HAL Id: hal-01570662
https://hal-lara.archives-ouvertes.fr/hal-01570662
Submitted on 31 Jul 2017HAL is a multi-disciplinary open access
archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
devenir des personnes atteintes
Jean-Pierre Bronowicki, Jean-Pierre Daurès, Sylvie Deuffic-Burban, Daniel
Dhumeaux, Jacques Izopet, Alain Leplège, Sandrine Loubière, Stanislas Pol,
André-Jean Rémy, Françoise Roudot-Thoraval, et al.
To cite this version:
Jean-Pierre Bronowicki, Jean-Pierre Daurès, Sylvie Deuffic-Burban, Daniel Dhumeaux, Jacques Izopet, et al.. Hépatite C : transmission nosocomiale, état de santé et devenir des personnes at-teintes. [Rapport de recherche] Institut national de la santé et de la recherche médicale(INSERM). 2003, 257 p., tableaux, graphiques. �hal-01570662�
Hépatite C
Transmission nosocomiale
Etat de santé et devenir
des personnes atteintes
Ce logo rappelle que le code de la propriété intellectuelle du 1erjuillet 1992 interdit la photocopie à usage collectif
sans autorisation des ayants-droits.
Le non-respect de cette disposition met en danger l’édition, notamment scientifique.
Toute reproduction, partielle ou totale, du présent ouvrage est interdite sans autorisation de l’éditeur ou du Centre français d’exploitation du droit de copie (CFC, 20 rue des Grands-Augustins, 75006 Paris).
Dans la même collection ¬Imagerie médicale en France dans les hôpitaux
publics.1996
¬Hépatites virales. Dépistage, prévention,
traitement.1997
¬Grande prématurité. Dépistage et prévention
du risque.1997
¬Effets sur la santé des principaux risques
d’exposition à l’amiante.1997
¬Ecstasy. Des données biologiques et cliniques
aux contextes d’usage.1998
¬Insuffisance rénale chronique. Etiologies,
moyens de diagnostic précoce, prévention.1998
¬La migraine. Connaissances descriptives,
traitements et prévention.1998
¬Risques héréditaires de cancers du sein
et de l’ovaire. Quelle prise en charge ? 1998
¬Effets sur la santé des fibres de substitution
à l’amiante.1999
¬Maladie parodontales. Thérapeutiques
et prévention.1999
¬Plomb dans l’environnement. Quels risques
pour la santé ? 1999
¬Carences nutritionnelles. Etiologies
et dépistage.1999
¬Vaccinations. Actualités et perspectives.1999
¬Éthers de glycol. Quels risques pour la santé ? 1999
¬Obésité. Dépistage et prévention chez l’enfant.2000
¬Asthme et rhinites d’origine professionnelle.2000
¬Lombalgies en milieu professionnel. Quels facteurs
de risques et quelle prévention ? 2000
¬Dioxines dans l’environnement. Quels risques pour
la santé ? 2000
¬Hormone replacement therapy. Influence on
cardiovascular risk ? 2000
¬Rythmes de l’enfant. De l’horloge biologique aux
rythmes scolaires.2001
¬Susceptibilités génétiques et expositions
professionnelles.2001
¬Éducation pour la santé des jeunes. Démarches et
méthodes.2001
¬Alcool. Effets sur la santé.2001
¬Cannabis. Quels effets sur le comportement et la
santé ? 2001
¬Asthme. Dépistage et prévention chez l’enfant.2002
¬Déficits visuels. Dépistage et prise en charge chez le
jeune enfant.2002
¬Troubles mentaux. Dépistage et prévention chez
l’enfant et l’adolescent.2002
¬Alcool. Dommages sociaux, abus et
dépendance.2003
Etat de santé et devenir des personnes atteintes ISBN 2-85598-827-6
© Les éditions Inserm, 2003 101 rue de Tolbiac, 75013 Paris
Couverture
Hépatite C
Transmission nosocomiale
Etat de santé et devenir
des personnes atteintes
Expertise collective
posées par la Direction générale de la santé (DGS) sur la transmission noso-comiale du virus de l’hépatite C (VHC), l’évolution de l’épidémie et l’état de santé, la qualité de vie et le devenir des personnes atteintes.
Il s’appuie sur les données scientifiques disponibles en date du premier semestre 2003. Environ 600 articles et documents ont constitué la base docu-mentaire de cette expertise.
Le Centre d’expertise collective de l’Inserm a assuré la coordination de cette expertise collective avec le Département animation et partenariat scientifique (Daps) pour l’instruction du dossier et avec le service de documentation du Département de l’information scientifique et de la communication (Disc) pour la recherche bibliographique.
Jean-Pierre BRONOWICKI, service d’hépato-gastro-entérologie, hôpital de Nancy, Vandœuvre Les Nancy
Jean-PierreDAURÈS, laboratoire d’épidémiologie et de biostatistique, institut universitaire de recherche clinique, Montpellier
SylvieDEUFFIC-BURBAN, épidémiologie et biostatistique, centre de recherches économiques, sociologiques et de gestion (CRESGE-LABORES),URA-CNRS362,
université catholique de Lille, Lille
Daniel DHUMEAUX, service d’hépatologie et de gastro-entérologie, hôpital
Henri Mondor, Creteil
Jacques IZOPET, variabilité virale, laboratoire de virologie, EA2046, IFR30,
hôpital de Purpan, Toulouse
AlainLEPLÈGE, qualité de vie et santé des populations,EA2494,UFR
Cochin-Port Royal, université Paris V, Paris
SandrineLOUBIÈRE, épidémiologie et sciences sociales appliquées à
l’innova-tion médicale, InsermU379, Marseille
Stanislas POL, carcinogenèse hépatique et virologie moléculaire, Inserm U370, unité d’hépatologie, hôpital Necker, Paris
André-JeanRÉMY, service d’hépato-gastro-entérologie, centre hospitalier de Perpignan, Perpignan
Françoise ROUDOT-THORAVAL, service de santé publique, hôpital Henri Mondor, Créteil
Louis-RachidSALMI, institut fédératif de recherche de santé publique,IFR99, université Victor Segalen, Bordeaux II, Bordeaux ; avec le concours de Stéphanie VANDENTORREN, laboratoire santé travail environnement, Bordeaux
Jean-Claude TRINCHET, service d’hépato-gastro-entérologie, hôpital Jean Verdier, Bondy
Yazdan YAZDANPANAH, service des maladies infectieuses et du voyageur, centre hospitalier, Tourcoing et laboratoire de recherche économique et sociale,CNRS362, Lille
A été auditionné
GillesRAGUIN, Germivic groupe, hôpital Croix Saint Simon, Paris
ÉlisabethALIMI, chargé d’expertise, Centre d’expertise collective de l’Inserm, faculté de médecine Xavier-Bichat, Paris
Catherine CHENU, attaché scientifique, Centre d’expertise collective de l’Inserm, faculté de médecine Xavier-Bichat, Paris
Jeanne ÉTIEMBLE, directeur du Centre d’expertise collective de l’Inserm, faculté de médecine Xavier-Bichat, Paris
Catherine POUZAT, attaché scientifique, Centre d’expertise collective de
l’Inserm, faculté de médecine Xavier-Bichat, Paris
Assistance bibliographique
ChantalRONDET-GRELLIER, documentaliste, Centre d’expertise collective de
l’Inserm, faculté de médecine Xavier-Bichat, Paris
Environ 170 millions de personnes sont infectées par le virus de l’hépatite C (VHC) à travers le monde, dont 500 000 à 650 000 en France. La gravité de l’infection par le VHC tient à la très haute fréquence de développement d’une infection chronique (55 à 90 % des patients), susceptible d’évoluer vers une cirrhose et éventuellement un cancer primitif du foie. Cela explique que l’hépatite C est devenue, en France comme en Europe, l’une des toutes premières causes de maladie chronique du foie et une indication majeure de transplantation.
Le virus de l’hépatite C a été identifié en 1989. Des techniques de détection sensibles ont été mises au point et ont en particulier permis la quasi-élimination des hépatites post-transfusionnelles, qui étaient très majoritaire-ment dues au VHC. La transmission du virus de l’hépatite C est en effet essentiellement due à une contamination par le sang. Après la transmission transfusionnelle, aujourd’hui maîtrisée, la transmission parmi les usagers de drogue reste un souci majeur. Par ailleurs, pour environ 10 à 30 % des personnes infectées, l’origine précise de la contamination ne peut être identi-fiée ; il est probable que pour une forte proportion d’entre elles, des pratiques de soins mal contrôlées sont responsables de la contamination. Cette situation est d’autant plus préoccupante qu’il n’existe pas, malgré des pistes promet-teuses, de vaccin disponible.
Un progrès majeur de ces dernières années a été l’obtention de guérisons de l’hépatite chronique C. Ce succès thérapeutique se traduit par un arrêt défi-nitif de la réplication virale, associé à la régression des lésions hépatiques. Globalement, environ 50 % des personnes chroniquement infectées par le virus de l’hépatite C peuvent être guéries par la combinaison interféron pégylé-ribavirine. Le taux de guérison dépend du génotype du VHC : il atteint 80 % chez les patients infectés par le génotype 2 ou 3, mais est seulement de 40 % chez ceux infectés par le génotype 1. Aujourd’hui encore, 50 % des personnes traitées restent donc en situation d’impasse thérapeutique. Dans ce contexte, les enjeux de la recherche de nouvelles cibles thérapeutiques, comme le développement d’anti-enzymes spécifiques, sont majeurs.
En 1999, le ministère de la Santé a lancé un programme national de lutte contre l’hépatite C : un effort considérable a été entrepris pour améliorer la prise en charge des malades atteints d’hépatite C au sein des hôpitaux et l’accès au dépistage a été renforcé. S’agissant de la recherche, des moyens importants ont été mis en œuvre. L’Agence nationale de la recherche sur le sida (ANRS) a vu ses missions s’élargir à tous les domaines de recherche sur les
tion entre toutes les équipes travaillant dans le domaine. Un programme, établi en concertation avec l’ANRS et le ministère de la Recherche assure ainsi le continuum entre recherche fondamentale, recherche clinique et thérapeutique et recherche en santé publique. De même, l’Inserm a développé plusieurs actions (programme Avenir, accueil de médecins, contrats d’inter-face, réseaux de recherche clinique{) pour assurer un rapprochement perma-nent entre la recherche fondamentale menée dans ses laboratoires et les acteurs des services hospitaliers impliqués dans la recherche clinique. J’ai souhaité en outre impliquer étroitement l’ensemble de nos partenaires – aca-démiques, médicaux et industriels – dans les programmes de recherche de l’Institut.
L’expertise collective présentée dans ce rapport répond pour la première fois à de nombreuses questions sur des aspects encore peu connus aujourd’hui de l’infection par le virus de l’hépatite C. Dans une première partie, elle rend compte des données les plus récentes sur les différents modes de contamina-tion par le VHC et sur leur importance respective, notamment pour les contaminations nosocomiales, sujet toujours très préoccupant pour les méde-cins, les décideurs et le public. Pour cette raison, la Direction générale de la santé (DGS), demandeur de l’expertise, a souhaité un point des connaissances sur ces questions. Les experts ont souligné la nécessité du respect des règles d’hygiène universelles, ainsi que d’une évaluation de l’application de ces règles, seule mesure susceptible de faire chuter l’incidence des contaminations résiduelles en milieu de soins.
Le devenir des personnes infectées par le VHC et les perspectives d’évolution de l’infection constituent le sujet de la deuxième partie de l’expertise. Les modélisations présentées montrent que, malgré une probable diminution de l’incidence de l’infection, les contaminations passées auront pour consé-quence dans les vingt prochaines années une augmentation de la complica-tion la plus sérieuse de l’infeccomplica-tion, le carcinome hépatocellulaire. L’effet des traitements récents, plus efficaces, pourrait toutefois limiter cette tendance. L’évaluation économique des stratégies de dépistage et de traitement qui est présentée dans ce rapport est un élément d’éclairage pour les décisions en santé publique. Enfin, les experts insistent sur l’intérêt de la prise en charge des patients en fonction du stade de leur maladie, du pronostic, mais aussi de leur qualité de vie, dimension encore trop peu présente dans la pratique médicale. Je remercie les scientifiques qui ont contribué à cet important travail, qui devrait être très utile, tant aux praticiens qu’aux décideurs des politiques de santé.
Professeur Christian Bréchot Directeur général de l’Inserm
L’expertise collective de l’Inserm consacrée à l’hépatite C est une initiative qui doit être saluée au moins à deux titres : la pertinence des objectifs et le moment choisi pour la mener à bien.
Les informations recueillies bénéficient en effet des acquis du premier Programme national de lutte contre l’hépatite C lancé par Bernard Kouchner et parviennent au tout début du nouveau plan, en temps utile pour en influencer les étapes futures.
Cette « commande » de la DGS à l’Inserm s’inscrit dans la continuité des récentes conférences de consensus française et américaine et, permet d’en combler certains manques, mais aussi, et c’est louable, de répondre aux préoc-cupations des patients eux-mêmes.
Les coïncidences du calendrier renforcent encore cette opportunité puisque des décisions politiques récentes viennent, à l’occasion du renouvellement de l’ANRS, d’élargir les missions de cette agence en lui confiant la responsabilité de toute la recherche sur les hépatites virales B et C. Or, il s’agit d’un moment historique puisqu’il survient, précisément, alors que l’on a désormais acquis la certitude que l’hépatite C peut être curable et que sa première complication, la cirrhose, est en partie réversible si traitée à temps. Ce qui, au moins indirectement, fait espérer réduire le risque de carcinome hépatocellulaire, puisque la survenue de celui-ci est elle-même générée par la cirrhose.
Enfin et surtout, c’est actuellement que les nouvelles molécules antivirales (antiprotéases, hélicases, polymérases) confirment leur efficacité, annonçant une révolution thérapeutique susceptible de guérir ou de stabiliser la plupart des malades en quelques années.
En ciblant la transmission nosocomiale, l’histoire naturelle de la maladie et le devenir des patients, cette mise au point cherche à répondre en fait à plusieurs problématiques de nature bien différente :
• Les unes ont une dimension juridique : imputabilité de l’hépatite C à une transfusion méconnue du malade, risque nosocomial, impliquant l’hôpital ou le chirurgien s’il est lui-même infecté.
• Les autres sont de nature médico-économique, telle que la difficulté extrême de modéliser la probabilité de progression et les conséquences pour le système de soins d’une maladie protéiforme, multifactorielle, de pathogénie mal comprise, et dont le traitement peut modifier radicalement le devenir en fonction du stade évolutif auquel il sera prescrit.
Les réponses à ces questions sont indispensables aux décideurs politiques et de santé, afin de pouvoir, dès maintenant, réorienter au besoin les stratégies XI
La méthodologie scientifique retenue a été à la hauteur des enjeux. Un groupe multidisciplinaire, sous l’égide de l’Inserm, s’est astreint à une étude critique des bases de données et de la littérature.
Ce travail aboutit à un précieux thésaurus, dont la synthèse, au-delà de la réserve et de la prudence scientifique, est très riche d’enseignement.
Quelques « morceaux choisis » suffiront à illustrer la pertinence de l’analyse et des recommandations : le risque nosocomial est omniprésent, sous-estimé, difficile à cerner et encore plus à contrôler. La situation de l’hémodialyse par son ampleur et la survenue d’épidémies récurrentes, en France et dans le monde, impose de toute urgence un programme spécifique en cours de mise en œuvre.
L’imputabilité de l’hépatite C à un acte de soins, y compris à une transfusion, est reconnue comme « généralement difficile » et nécessite une procédure adaptée. Très sobrement le rapport conclut que l’étude des données confirme que la morbidité et la mortalité liées aux complications de la cirrhose, en particulier au carcinome hépatocellulaire, vont continuer d’augmenter en France jusqu’en 2020 (de 50 % au moins). En effet il est admis que l’impact des pratiques actuelles – minorité de patients traités et potentiels de malades évolutifs non dépistés – n’est pas suffisant pour influencer cette évolution. Il serait nécessaire pour ce faire de traiter au moins 50 % des malades dont l’état s’aggrave. C’est reconnaître explicitement qu’on est encore loin des 80 % de malades traités que visait le premier programme de lutte contre l’hépatite C.
Et pourtant, le traitement est coût-efficace et se compare avantageusement à d’autres mesures prioritaires de santé publique, telles que la chimiothérapie anticancéreuse et antirétrovirale.
Les axes de recherche soulignent l’importance d’études de cohortes de patients évolués et/ou non répondeurs et le besoin d’indicateurs pertinents de progression vers la cirrhose et le cancer, car il faut impérativement permettre à plus de 100 000 malades concernés de bénéficier des progrès thérapeutiques imminents.
Il ne reste plus qu’à mettre en œuvre les priorités ainsi définies en précisant comment, dans le contexte actuel, on peut, de façon réaliste, atteindre quels objectifs, avec quels acteurs et quels moyens. C’est là bien sûr qu’est le défi, et le temps presse.
Professeur Christian Trépo Chef du service d’hépato-gastro-entérologie Hôpital de l’Hôtel Dieu, Lyon Responsable du pôle de référence Hépatite C de Lyon
L’infection par le virus de l’hépatite C (VHC) touche plus d’un pour cent de la population française. Source d’une morbidité et d’une mortalité importantes, cette maladie, probablement présente en France depuis plusieurs siècles, a fait l’objet de progrès scientifiques spectaculaires au cours des quinze dernières années : identification du virus responsable en 1989 ; mesures de prévention de la transmission transfusionnelle, constamment renforcées au fil des années, jusqu’à l’adoption récente du diagnostic génomique viral qui a virtuellement supprimé ce mode d’infection ; optimisation des traitements antiviraux, avec aujourd’hui des taux de guérison de l’infection de l’ordre de 40 % pour le VHC de génotype 1 et 80 % pour les VHC de génotypes 2 et 3, tout au moins dans les grandes études cliniques d’enregistrement.
Ces progrès sont à l’origine du discours optimiste en vogue : « L’hépatite C est une maladie curable, les traitements n’ont cessé de progresser et de très nombreuses molécules antivirales sont en cours de développement, dont certaines en développement clinique précoce ; l’hépatite C n’en a plus pour très longtemps, nous la vaincrons ! » Comme souvent, la réalité pourrait être moins favorable. Les mécanismes expliquant l’efficacité des traitements anti-viraux actuels ne sont pas connus. Le génotype viral le plus répandu en France (génotype 1) est associé aux taux de réponse les plus faibles. Les malades qui, aujourd’hui, n’éliminent pas l’infection virale au cours d’un traitement prolongé par l’interféron alpha pégylé et la ribavirine (traitement combinant un effet antiviral puissant et une stimulation de la clairance des cellules infectées par la réponse immune) pourraient, demain, se trouver à nouveau en situation d’échec thérapeutique avec un traitement purement antiviral. Et encore faudrait-il que quelques-unes des molécules actuellement en dévelop-pement parviennent au stade de la commercialisation{ Le contrôle de l’infec-tion et de la maladie reste donc un élément fondamental du combat contre l’hépatite C. L’hypothèse – vraisemblable – que ce combat durera encore de nombreuses années donne toute sa valeur à l’expertise collective de l’Inserm sur la transmission nosocomiale du VHC, l’histoire de l’infection et le devenir des personnes atteintes.
La transmission nosocomiale de l’hépatite C reste sans doute fréquente. À une transmission « médicalisée » s’ajoute la transmission lors de pratiques non médicales, telles que le piercing, les tatouages{ Les experts ont disséqué les différents aspects de la transmission nosocomiale de l’hépatite C, mais n’ont pu établir avec certitude son incidence actuelle. Faut-il s’en étonner ? Le propre de la transmission nosocomiale, dans un pays sensibilisé à ce problème depuis de nombreuses années et dans lequel des règles de prévention efficaces sont édictées et généralement suivies, est de survenir accidentellement et de XIII
soignant ou d’un groupe de soignants. Le résultat se traduit généralement par la survenue d’une épidémie localisée, telle que celles régulièrement rapportées au sein d’unités d’hémodialyse, où un malade source infecte un certain nombre de sujets pendant un temps donné, jusqu’à ce que l’épidémie soit découverte ou cesse spontanément. L’accumulation à l’échelle nationale de ce type d’accidents est sans doute responsable, chaque année, d’un grand nombre de nouveaux cas d’hépatite C, mais leur incidence globale reste très difficile à mesurer. On comprend la préoccupation des autorités sanitaires d’identifier le risque et d’améliorer la recherche d’imputabilité dans une société qui ne tolère plus la transmission d’une infection virale au cours des soins. La transmission nosocomiale de l’hépatite C ne doit cependant pas être l’arbre qui cache la forêt. Si elle doit être recherchée, prévenue, et à terme supprimée, la première cause d’hépatite C en France reste aujourd’hui l’usage de drogues par voie veineuse, et tous les efforts doivent être entrepris pour éviter la transmission dans cette population d’accès difficile, car c’est principalement là que réside la clé du contrôle de l’épidémie.
Connaître l’histoire naturelle de l’infection par le VHC est indispensable. C’est principalement sur la prédiction de l’évolution de l’infection chez une personne donnée que repose la décision thérapeutique. Améliorer la qualité de vie des malades est une préoccupation évidente : c’est l’objectif de la médecine depuis toujours. On peut d’ailleurs s’étonner qu’on ait dû attendre la fin du vingtième siècle pour affirmer cette évidence (ou lui trouver un nom{). Le groupe d’experts a fourni, à l’issue d’un travail considérable, une somme importante de connaissances et des recommandations larges, allant de la prise en charge individuelle aux recherches qui devraient être menées. Il est surpre-nant de constater à quel point on connaît mal encore l’histoire naturelle de la maladie virale C. Surprenante aussi notre incapacité à prévoir son évolution à l’échelon individuel. Qui a ou n’a pas besoin d’être traité ? Le traitement doit-il être administré rapidement ou peut-il être différé ? Les données objec-tives manquent pour répondre à ces questions, en dépit d’une abondante littérature. La simple évaluation de la gravité de la maladie est aujourd’hui insuffisante pour prendre une décision thérapeutique. L’évaluation doit être plus large et tenir compte à la fois du pronostic naturel de l’infection et du pronostic du traitement. La décision thérapeutique ne peut être la même chez deux malades ayant la même maladie hépatique, mais une probabilité de guérir après traitement de 80 % pour l’un (génotype 2 ou 3) et de 40 % pour l’autre (génotype 1).
Que retenir de cette expertise collective ? De nombreuses recommandations, justes, raisonnables, argumentées, qui devront être suivies d’effets si l’on veut réellement améliorer la qualité de vie de la population en lui évitant l’infec-tion ou en la prenant en charge avec un objectif qui dépasse la simple
tite C est une maladie fréquente, grave. C’est une priorité de santé publique. La France est un des trois pays de tête en matière de recherches sur l’hépa-tite C. L’effort national doit être poursuivi, amplifié, tant en recherche fonda-mentale qu’en recherche clinique, et ce, par tous les moyens. Cela passe par les attributions en moyens financiers et humains nécessaires aux organismes en charge de cette recherche, et par la volonté politique (à tous les niveaux) de la promouvoir. La France a un rôle à jouer en ce domaine et les premiers bénéficiaires en seront les malades. Deuxièmement, la France doit s’inscrire dans la lutte au niveau mondial. L’hépatite C touche environ 3 % de la population mondiale, soit 170 millions d’individus, dont une part importante vit dans les pays en développement. Si l’hépatite C n’apparaît pas en première ligne dans ces régions de forte mortalité liée au sida, au paludisme, à la tuberculose ou à l’hépatite B, elle n’en constitue pas moins une comorbidité importante, responsable de surmortalité. Nous pouvons croiser les bras et attendre que l’industrie pharmaceutique fournisse aux pays riches des médica-ments chers et efficaces qui guériront un nombre important de malades. Nous pouvons également retrousser nos manches et investir dans l’épidémiologie, la prévention, la connaissance de l’histoire naturelle de la maladie, le dévelop-pement vaccinal et celui d’alternatives thérapeutiques accessibles et bon marché, et espérer voir le jour où, enfin, cette maladie qui aura occupé une grande partie de notre vie professionnelle aura disparu de la planète. Cette perspective est enthousiasmante, elle demandera de la volonté et des moyens.
Professeur Jean-Michel Pawlotsky Chef du laboratoire de Virologie, Urgences et Qualification virologiques (EA 3489) Hôpital Henri Mondor, Université Paris XII, Créteil Co-coordonnateur du Réseau national hépatites
Avant-Propos
... XIXAnalyse
Transmission nosocomiale
... 11. Différents modes de transmission et leur évolution ... 3
2. Transmission nosocomiale en hémodialyse... 15
3. Transmission liée aux actes médicaux et chirurgicaux... 39
4. Modélisation des risques de transmission nosocomiale... 55
5. Approche du problème de l’imputabilité ... 71
Histoire de l’infection et devenir des personnes atteintes
... 836. Incidence, prévalence et leur évolution... 85
7. Histoire naturelle de l’infection ... 95
8. Facteurs associés à la progression de la fibrose ... 117
9. Manifestations extra-hépatiques ... 137
10. Évaluation de la qualité de vie ... 151
11. Modélisation prévisionnelle de l’épidémie ... 167
12. Aspects médico-économiques du dépistage et du traitement ... 191
Synthèse
... 217Recommandations
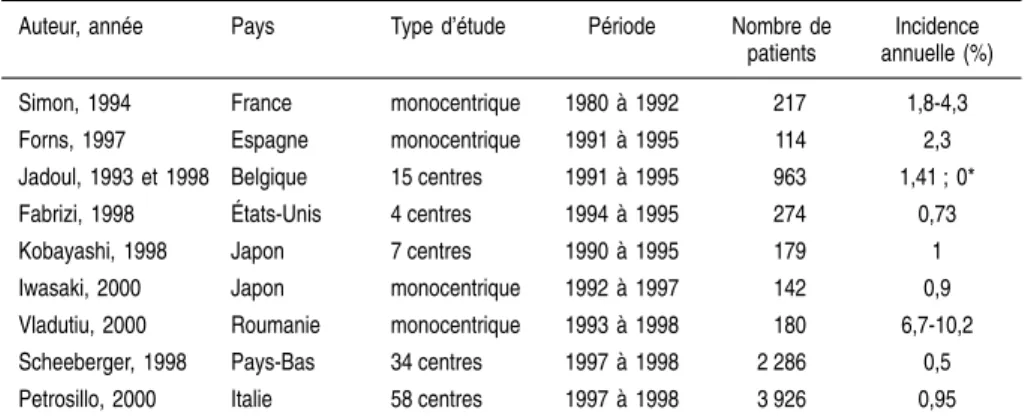
... 247Environ 1 % de la population adulte française (soit de 500 000 à 650 000 personnes) aurait des anticorps dirigés contre le virus de l’hépatite C (VHC) dans le sérum. Comparée aux pays de l’Union européenne, où la prévalence du VHC varie entre 0,5 et 2 %, la France occupe une position intermédiaire. L’infection par le VHC se caractérise par un passage à l’état chronique dans 55 à 90 % des cas. Les complications les plus sévères sont la cirrhose (0,5 à 30 % des hépatites chroniques selon les populations étudiées) et le cancer hépatocellulaire (5 à 15 % des cirrhoses à 5 ans). En France, l’hépatite C est devenue la première cause de transplantation du foie. En 2002, le nombre de décès liés au VHC est estimé entre 2 000 et 4 400. Déterminer l’incidence des nouvelles contaminations par le VHC et identifier les facteurs impliqués dans ces contaminations est indispensable afin d’améliorer les stratégies de prévention. Toutes les mesures prises successive-ment de 1985 à 2001 pour sécuriser le don du sang ont permis de réduire considérablement le risque résiduel en transfusion sanguine. En 2002, ce risque était estimé à une hépatite pour 6,65 millions de dons (données de l’Institut de veille sanitaire – InVS –). En revanche, un risque important de transmission persiste chez les usagers de drogue du fait du partage du matériel d’injection et de préparation. On estime de 2 700 à 4 400 le nombre annuel de nouveaux cas de contamination par le VHC chez les usagers de drogue injecteurs. Le plus souvent associée à un déficit d’application des règles d’hygiène, la transmission en milieu de soins constitue une préoccupation majeure des pouvoirs publics.
Les conséquences à long terme de l’infection par le VHC sont encore mal connues. Si certaines études ont montré que l’infection chronique peut évoluer dans 30 % des cas vers la cirrhose en moins de vingt ans, en l’absence de traitement, d’autres indiquent que l’impact clinique à long terme pourrait être moins sévère. Ces différences pourraient être liées à des facteurs connus pour influencer la vitesse de progression de la maladie, parmi lesquels l’âge (élevé) au moment de la contamination, le sexe masculin et la consommation excessive d’alcool.
Les modélisations qui permettent des projections pour les années à venir de l’incidence du VHC et de la morbidité et mortalité liées à l’évolution de l’hépatite C sont très utiles pour aider les décideurs dans les actions à mener. L’impact socio-économique de l’infection par le VHC en termes de qualité de vie des personnes atteintes est encore peu pris en considération.
La Direction générale de la santé (DGS), dans le cadre du plan national 1999-2002 de lutte contre l’hépatite C, a souhaité interroger l’Inserm à travers XIX
miale afin d’aider à la recherche d’imputabilité d’une infection à des produits sanguins ou à un acte médical invasif et (b) l’évolution de l’épidémie et l’état de santé, la qualité de vie et le devenir des personnes atteintes.
Pour répondre à la demande de la DGS, l’Inserm a réuni un groupe pluridisci-plinaire d’experts composé de médecins et de chercheurs en hépatologie, virologie, épidémiologie et biostatistique, économie et santé publique. Le groupe d’experts a travaillé à partir de la grille de questions suivante :
• Quelles sont les données sur les facteurs de contamination de l’infection par le VHC et la part de la contamination nosocomiale ? Quelles évolutions sont rapportées en fonction des mesures qui ont été prises ?
• Quelles sont les données d’estimation des risques de contamination au cours de différents actes invasifs médicaux et chirurgicaux (hémodialyse, endos-copie, anesthésie...) ?
• Quelles sont les données sur les transmissions patients-personnels soignants et inversement ? Quel est l’apport d’une modélisation ?
• Quelles sont les données nécessaires pour rapporter l’imputabilité d’une infection par le VHC à un acte médical ou chirurgical ?
• Quelles sont les évolutions constatées, en termes d’incidence et de préva-lence de l’infection, des maladies hépatiques et de la mortalité par carcinome hépatocellulaire ?
• Comment caractériser les différents stades de la maladie hépatique ? Quels sont les facteurs liés au virus, à l’hôte et à son comportement qui influencent l’évolution de la maladie ?
• Quelles manifestations extra-hépatiques apparaissent aux différents stades et avant, pendant et après le traitement ?
• Quelles sont les répercussions de la maladie et de son traitement sur la qualité de vie du patient ? Quels sont les outils disponibles pour mesurer la qualité de vie ?
• Quelles sont, d’après les modélisations, les prévisions épidémiologiques pour la France ?
• Quel est le coût social de la maladie et de sa prise en charge ? Quels sont les éléments d’évaluation économique disponibles ?
L’interrogation des bases bibliographiques a conduit à sélectionner environ 600 articles. Le groupe d’experts a également appuyé sa réflexion sur les travaux menés sous l’égide des agences et instituts tels que l’ANRS, l’Anaes, l’Afssaps et l’InVS.
Au cours de séances de travail organisées entre les mois de septembre 2002 et avril 2003, les experts ont présenté, selon leur champ de compétence, l’analyse critique et la synthèse des travaux sur les différents thèmes. Ont ensuite été élaborés un document de synthèse et des recommandations dont la validation a été collective.
I
1
Différents modes de transmission
et leur évolution
Depuis l’introduction des tests de dépistage du virus de l’hépatite C (VHC), la surveillance de l’infection a permis d’observer l’évolution des caractéristiques des nouveaux cas diagnostiqués et les modifications de l’épidémiologie liées notamment aux mesures prises pour combattre l’infection. Ainsi, les modes de contamination par le VHC jouent un rôle différent dans le développement et la persistance de l’épidémie, influant sur l’évolution des caractéristiques des patients diagnostiqués.
Modes de contamination par le VHC
La transmission du VHC est essentiellement parentérale et résulte de la mise en contact direct du sang d’un sujet indemne avec le sang d’un sujet infecté.
Transfusion de produits sanguins
Elle a été la première cause reconnue de contamination et a joué un rôle majeur dans la diffusion de l’infection jusqu’en 1990 (Alter et coll., 1989 ; Lefrère, 1997). Le nombre de sujets infectés par voie transfusionnelle en France au cours des dernières décennies a été estimé entre 100 000 et 400 000 ; les produits en cause étaient aussi bien des produits labiles (prove-nant le plus souvent d’un seul donneur) que des produits stables (médicaments dérivés du sang, préparés par fractionnement de pools plasmatiques provenant de donneurs multiples). Le risque de contamination transfusionnelle a été lié à plusieurs facteurs : la prévalence de l’infection virale C chez les donneurs de sang, la date de transfusion, le nombre et le type de produits transfusés, rendant compte de la fréquence de l’infection dans certains groupes comme les hémophiles ou les thalassémiques polytransfusés.
Ces quinze dernières années ont été marquées par une diminution progressive du risque d’hépatite post-transfusionnelle en rapport avec différentes mesu-res :
• l’introduction d’étapes d’inactivation virale (solvant-détergent) dans la préparation des fractions coagulantes (1987), puis dans la préparation des
poches de plasma frais congelé (1992) ; 3
• un ensemble de mesures prises pour l’éviction des donneurs de sang à risque : élimination des unités de sang provenant de sujets ayant une valeur d’alanine aminotransférase (ALAT) supérieure à deux fois la limite supérieure de la normale et contenant des anticorps anti-HBc (1988), élimination des unités de sang contenant des anticorps anti-VHC par les tests de première génération (mars 1990) puis de deuxième génération (mars 1991), éviction des donneurs dont la valeur d’ALAT est strictement supérieure à la limite supérieure de la normale (1992), utilisation des tests anti-VHC de troisième génération (1993) et sélection clinique stricte des donneurs, allant jusqu’à éliminer du don du sang tout sujet ayant des antécédents transfusionnels ou ayant eu une endoscopie dans les six mois précédant le don du sang (1997) (tableau 1.I).
Toutes ces mesures ont permis de considérablement réduire le risque. Ainsi, le taux de dons positifs est passé de 13,46/10 000 en 1991 à 1,52/10 000 en 2000. Pour les produits labiles, le risque résiduel est lié à la transfusion d’un sang qui aurait été prélevé pendant la période de silence sérologique précédant la séroconversion. Ce risque résiduel de transmission du VHC était estimé en France à la fin de 2000 à 1 pour 860 000 dons (IC 95 % = 1/430 000 à 1/3 300 000) (Pillonel et coll., 2001), correspondant à la survenue d’environ cinq hépatites post-transfusionnelles par an.
La mise en place, le 1erjuillet 2001, du dépistage génomique viral systéma-tique pour tout don du sang devrait encore réduire le risque résiduel de transmission par transfusion du VHC, en raison de la diminution de la durée
Tableau 1.I : Calendrier des mesures concernant l’hépatite
Années Mesures prises
1988 Élimination des unités de sang provenant de sujets ayant une valeur d’alanine
aminotransférase (ALAT) supérieure à deux fois la limite haute de la normale et contenant des anticorps anti-HBc
1990 Dépistage obligatoire des donneurs par recherche des anticorps anti-VHC ; tests de 1regénération
1991-1993 Utilisation de tests anti-VHC de 2epuis 3egénération
1992 Eviction des donneurs dont la valeur d’ALAT est strictement supérieure à la limite haute de la normale
1993 Renforcement de la sélection clinique des donneurs 1994 Utilisation de dispositifs médicaux à usage unique 1996 Recommandations pour la désinfection des endoscopes
1997 Recommandations pour la stérilisation des dispositifs médicaux dans les établissements de santé
1999 Circulaire relative à la prévention de la transmission des agents infectieux véhiculés par le sang ou d’autres liquides biologiques lors de soins
2001 Mise en place du dépistage génomique viral systématique chez les donneurs
de la fenêtre sérologique, qui passe de 66 jours en moyenne avec les tests Elisa de 3e génération à 13 jours avec la recherche d’ARN du VHC. Le risque résiduel attendu est d’une hépatite post-transfusionnelle pour cinq millions de dons, soit moins d’une hépatite par an. La recherche de l’antigène de capside du VHC, qui n’a pas été retenue dans le dépistage des donneurs à risque, permettait quant à elle de diminuer la fenêtre sérologique de 66 à 14 jours en moyenne, donnant ainsi une estimation similaire du risque résiduel.
Usage de drogue intraveineux
Ce mode de contamination s’est développé à la fin des années 1960 dans une population jeune à prédominance masculine. Le partage des seringues était très fréquent avant l’épidémie de VIH, expliquant la forte séroprévalence du VHC chez les anciens usagers de drogue intraveineux (UDIV), estimée entre 50 et 80 % (Lucidarme et coll., 1994). Malgré la prise de conscience du risque viral lié à l’épidémie de VIH et l’autorisation de vente libre des seringues en pharmacie dès 1987, le risque de contamination par le VHC du fait de la toxicomanie n’a pas diminué aussi vite que le risque d’infection par le VIH. Cette persistance pourrait être liée au partage de seringues lors des premières injections ou au cours d’une incarcération (Roudot-Thoraval, 1998), ou au partage du petit matériel nécessaire aux injections (filtre, cuillère) (Hagan et coll., 2001). La plus forte contagiosité du VHC que du VIH et sa résistance en dehors du milieu biologique peuvent expliquer cette importante contamina-tion résiduelle chez les toxicomanes. La mise à disposicontamina-tion récente de kits Stéribox comportant également un petit matériel de préparation stérile pour-rait permettre une diminution de la transmission entre utilisateurs, à condi-tion que les comportements à risque tendent véritablement à disparaître dans la population des UDIV. Différentes enquêtes montraient en 1998 une préva-lence variant de 40 à 60 % selon les régions (Emmanuelli, 2000). Les résultats préliminaires d’une étude effectuée dans des centres de prise en charge ambu-latoires de toxicomanes dans les régions Nord et Est montrent un taux de séroconversion de 10 % par an, et ce malgré l’information répétée sur les comportements à risque (Lucidarme et coll., 2001 ; Lucidarme, 2003). En 2002, une enquête de prévalence effectuée à Marseille (Emmanuelli, 2002) montre des taux élevés : 73 % chez les utilisateurs actuels, avec notamment chez les jeunes de 20 ans 43 % de séropositivité (anticorps anti-VHC). La mise sur le marché de produits de substitution depuis 1996 a fait diminuer progressivement la proportion d’usagers injecteurs, ce qui réduit le réservoir de sujets potentiellement contaminants. Ainsi, les estimations récentes chiffrent entre 170 000 et 190 000 les usagers de drogue et entre 80 000 à 100 000 le nombre d’injecteurs actifs, parmi lesquels 48 000 à 70 000 seraient positifs pour les anticorps anti-VHC. À côté de l’usage intraveineux, la diffusion du VHC semble également possible chez les usagers de drogue utilisant la voie intranasale. Le partage de la paille utilisée pour « sniffer », associé à des lésions 5
ANAL
de la muqueuse nasale, pourrait expliquer ce mode de contamination (Conry-Cantilena et coll., 1996). Suite à l’enquête pilote conduite sur Marseille (Emmanuelli, 2002), une enquête nationale de prévalence est prévue. On peut espérer qu’elle montrera une réduction de l’infection virale C chez les UDIV, grâce à la politique de réduction des risques développée depuis plusieurs années et à la diffusion des nouveaux Stéribox.
Contamination nosocomiale ou iatrogène
Le rôle joué par la contamination nosocomiale est difficile à évaluer. L’exis-tence d’antécédents d’actes chirurgicaux ou médicaux invasifs ne signifie pas obligatoirement qu’une infection virale C est d’origine nosocomiale. À l’inverse, la transfusion de sang ou autres produits sanguins peut être inconnue des malades, qu’il s’agisse de transfusions per-opératoires ou de perfusions de plasma en réanimation. La transplantation d’organe ou de tissu a pu être une source fréquente d’infection virale C avant 1996, date à laquelle la sélection de donneurs indemnes d’anticorps anti-VHC a été mise en place. En dehors des transfusions ou des transplantations d’organes et de tissus, la contamina-tion nosocomiale relève essentiellement de l’utilisacontamina-tion de matériel mal désin-fecté.
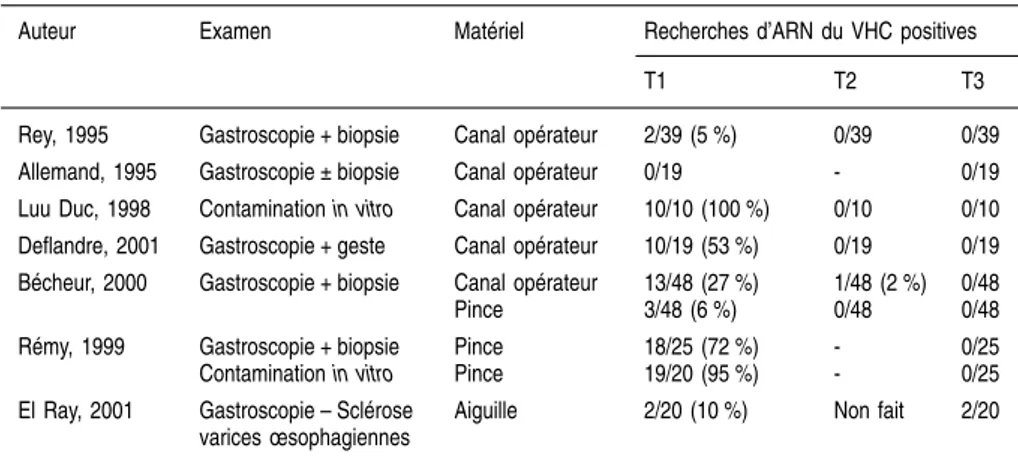
Le risque de transmission de malade à malade, par l’intermédiaire d’objets souillés ou par un mode manuporté, a été bien démontré dans les centres d’hémodialyse chez des malades non transfusés (Pol et coll., 1993 ; Simon et coll., 1994). Il a été évoqué (Andrieu et coll., 1995), puis démontré récem-ment (Bronowicki et coll., 1997), pour les endoscopies digestives avec biopsie. L’ARN du VHC a pu être détecté dans le canal opérateur d’endoscopes ou sur les pinces à biopsie avant désinfection, mais dans aucun cas après nettoyage et désinfection du matériel selon les recommandations (Bécheur et coll., 2000) ; cependant, il n’est pas exclu qu’une contamination constatée après un acte endoscopique ou chirurgical soit liée non à l’acte lui-même, mais au temps anesthésique, par exemple par utilisation abusive d’un même flacon d’anesthé-sique pour plusieurs malades. La fréquence de ce type de pratique est impos-sible à établir. Le risque nosocomial a aussi été démontré à l’occasion de l’utilisation inadéquate d’auto-piqueurs pour dosage de la glycémie (Desenclos et coll., 1998). Le mode de contamination nosocomial a pu être très fréquent entre 1950 et 1970, à une époque où les injections ou les actes chirurgicaux se faisaient avec du matériel non jetable et seulement stérilisé par chauffage et où les vaccinations pouvaient être faites « à la chaîne ». Une possible contami-nation après exposition nosocomiale est habituellement notée chez environ 20 % des malades pris en charge en milieu spécialisé (Roudot-Thoraval et coll., 1997). Il est intéressant de noter que les malades chez lesquels un risque nosocomial d’infection a été identifié ou dont le mode de contamination est inconnu ont des caractéristiques démographiques, cliniques et virologiques similaires à celles des malades contaminés à la même époque par transfusion (Pawlotsky et coll., 1995). Des études cas-témoins effectuées dans plusieurs
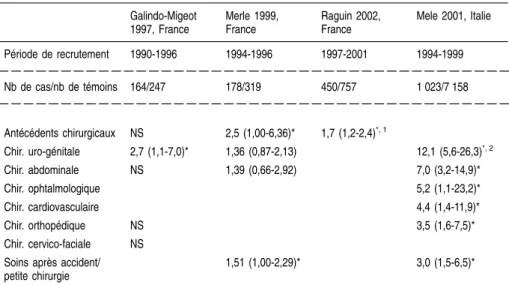
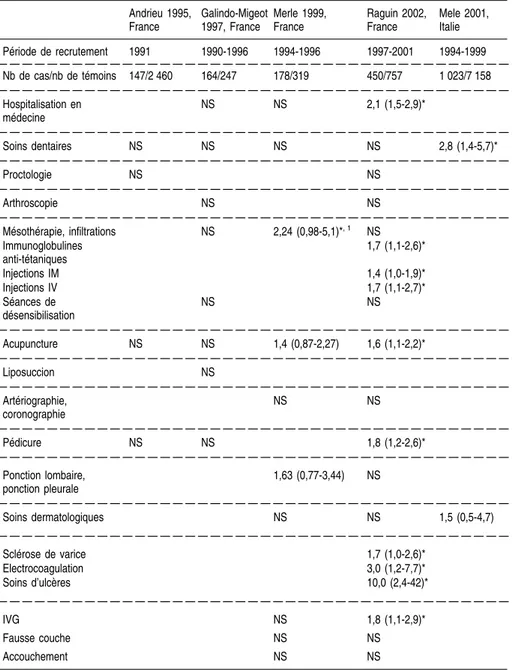
régions de France en population générale montrent le rôle possible des conta-minations nosocomiales. Elles rapportent ainsi une fréquence plus grande d’antécédents de certains actes médicaux ou chirurgicaux chez les sujets positifs pour le VHC que chez les témoins (Galindo-Migeot et coll., 1997 ; Merle et coll., 1999), tels que des endoscopies digestives, la chirurgie urolo-gique, des fausses couches spontanées et des interruptions volontaires de grossesse... Aujourd’hui, un meilleur respect des règles d’hygiène universelles et des recommandations de désinfection du matériel médical non jetable, ainsi que le développement du matériel à usage unique, devraient permettre à terme une quasi-disparition de ce type de risque nosocomial. Ainsi, le taux de séroconversion observé dans les centres d’hémodialyse dans lesquels la préva-lence pouvait atteindre en moyenne 30 % au début des années 1990 est estimé actuellement à 0,35 % par an selon une étude multicentrique française (Izopet et coll., 2001). À côté de la transmission de malade à malade, de rares cas de transmission de médecin à malade ont été rapportés, à l’occasion d’interven-tions chirurgicales sanglantes, cardio-thoraciques ou gynécologiques (Esteban et coll., 1996, Ross et coll., 2002). Ce risque reste exceptionnel, estimé à 0,04 % à partir de l’étude sérologique des 2 286 femmes opérées sur une période de 7 ans par un gynécologue qui avait contaminé une de ces patien-tes ; parmi les sept autres femmes dépistées positives, aucune ne s’est avérée contaminée par le gynécologue après séquençage des génomes viraux (Ross et coll., 2002).
À côté de la contamination nosocomiale, la contamination iatrogène, difficile à prouver, ne peut être éliminée. En France, des enquêtes menées dans les centres pratiquant le tatouage et/ou le piercing, rendent compte de nombreuses déviations aux règles de précaution universelles (Luminet et coll., 2002), potentiellement à l’origine de risques sanitaires non évalués dans cette étude.
Autres modes de transmission
Les personnels de santé sont exposés aux contaminations par le VHC lors d’accidents d’exposition au sang et liquides biologiques. De nombreuses règles ont été établies pour augmenter la qualité de leur protection. Il est plus difficile d’en établir au sein de la famille lorsqu’un des membres est contaminé.
Exposition professionnelle
Elle est liée à une blessure accidentelle avec du matériel souillé ; c’est un mode de transmission mineur du VHC. Estimé à 2,1 % selon les résultats d’une analyse regroupant neuf études, le risque de contamination après accident avec exposition au sang pourrait atteindre 10 % quand le sujet source a une virémie élevée. Cependant, la prévalence des anticorps anti-VHC chez les 7
ANAL
professionnels de santé n’est pas différente de celle de la population générale. La surveillance des accidents d’exposition au sang (AES) chez le personnel de santé en France a permis d’observer une diminution du nombre de contami-nations par le VHC dans les dix dernières années (Lot et coll., 2002).
Transmission familiale
La transmission familiale du VHC correspond à trois modes mineurs de contamination.
• La transmission entre partenaires sexuels a été initialement évoquée devant la constatation d’une séroprévalence plus élevée chez les partenaires de sujets séropositifs que dans la population des donneurs de sang. Cette transmission, très faible, est favorisée par une coinfection VIH (3 % versus 0 % chez les conjointes d’hémophiles co- et monoinfectés respectivement). Les études de séroprévalence transversales ne permettent pas d’affirmer que la transmission du VHC est réellement sexuelle, par l’intermédiaire des sécrétions biologi-ques. En effet, si l’ARN du VHC a été mis en évidence dans le sang menstruel des femmes infectées, il n’a pas été trouvé dans les sécrétions vaginales et sa présence dans le sperme est inconstante ; quand le virus y est retrouvé, c’est à des concentrations 10 à 100 fois plus faibles que dans le plasma. Au-delà de l’interrogation sur la contamination sexuelle ou survenant au cours d’actes sexuels, la séropositivité des partenaires pourrait être le fait d’un facteur de risque commun au couple ou du partage d’objets de toilette contaminés (Zylberberg et coll., 1999).
• La transmission entre sujets vivant sous le même toit pourrait être égale-ment liée au partage d’objets de toilette responsables de petites plaies. Elle pourrait être favorisée par une promiscuité forte et des conditions d’hygiène défectueuses.
• La transmission mère-enfant a été bien démontrée. Sur l’ensemble des séries européennes publiées, le risque de transmission est faible. Il a été estimé à 5 % en l’absence de coinfection par le VIH. Le risque est beaucoup plus élevé (15 à 20 %) quand les mères sont coinfectées par le VIH. La transmission du VHC dans ce cas est indépendante de celle du VIH. La contamination du nouveau-né semble survenir le plus souvent au moment de la naissance et son risque pourrait dépendre de l’importance de la charge virale chez la mère. Elle pourrait être favorisée par l’utilisation de forceps au cours des accouchements longs et difficiles ou par une rupture prolongée des membranes (Poiraud et coll., 2001) et diminuée en cas de césarienne programmée (Gibb et coll., 2000), mais les études sont encore insuffisantes pour recommander la pratique systématique d’une césarienne. L’allaitement n’apparaît pas comme un risque supplémentaire de transmission du VHC et n’est donc pas contre-indiqué. Le risque lié aux procédures d’assistance médicale à la procréation (AMP) chez les couples dont au moins un des membres est infecté par le VHC est en cours d’évaluation en France. Les résultats préliminaires ne paraissent pas montrer d’excès de risque de transmission mère-enfant du VHC après AMP.
Modes de transmission non identifiés
Dans 10 à 30 % des cas en France selon les séries, le mécanisme de la transmission du VHC demeure inconnu. Plusieurs hypothèses peuvent être émises :
• un facteur de risque dissimulé par le malade (usage de drogue) ;
• un facteur de risque méconnu ou oublié (transfusion) ;
• une transmission percutanée méconnue, qu’il s’agisse de soins médicaux ou dentaires anciens, de pratiques telles que les vaccinations de masse ou les scarifications rituelles dans les pays à forte prévalence du VHC, ou d’autres modes anecdotiques (barbier, rixe, dopage, tatouage et piercing). Ces modes de transmission inconnus posent problème pour l’élaboration d’un plan de dépistage de l’infection virale C.
Modes résiduels de transmission du VHC
Les modes de contamination ont fortement évolué depuis l’introduction des tests de dépistage du VHC (tableau 1.II).
Les hépatites post-transfusionnelles sont devenues exceptionnelles. Depuis longtemps, le développement du matériel à usage unique et une meilleure connaissance des modalités de stérilisation du matériel médicochirurgical ont contribué à fortement réduire le risque nosocomial, bien qu’on ne puisse exclure la persistance de fautes de désinfection. La transmission mère-enfant ne représente que quelques centaines de nouveaux cas par an. À l’inverse, la contamination en rapport avec l’utilisation intraveineuse de drogues a proba-blement peu diminué.
L’évolution progressive des modes de contamination a pu être observée sur les caractéristiques des malades nouvellement pris en charge avec, en 10 ans, une diminution des hépatites en rapport avec la transfusion (figure 1.1) et une augmentation des cas en rapport avec l’UDIV (tableau 1.III), cette évolution étant d’autant plus nette chez les hommes (figure 1.2).
L’étude de Pillonel et Laperche sur 112 donneurs de sang récemment infectés (séroconversion entre deux dons), sur la période 1994-2000, est indicatrice de
Tableau 1.II : Évolution des principaux modes de contamination
Avant 1970 Transfusion de produits sanguins Soins médicaux et chirurgicaux 1970-1990 Transfusion de produits sanguins ++
Actes invasifs Toxicomanie Après 1990 Toxicomanie +++ 9 ANAL YSE
certains facteurs de risque potentiels (Pillonel et Laperche, 2001). Cependant, les donneurs de sang, très sélectionnés, ne sont pas représentatifs de la popu-lation à risque et les facteurs de risque mentionnés mériteraient d’être authen-tifiés par l’étude d’un groupe témoin de donneurs de sang appariés et non infectés par le VHC (tableau 1.IV).
Relation entre la source présumée d’infection
et le génotype du VHC
Il est bien établi que les six principaux génotypes du VHC ont une répartition géographique qui leur est propre. Ainsi, en Europe de l’Ouest et notamment en France, le génotype le plus fréquent est le génotype 1 (1b et 1a), suivi du
2000 1995 1990 1985 1980 1975 1970 1965 0 2 4 6 8 10 Incidence des HPT (%) Ag HBs Sélection clinique Sérologie VIH Ac anti-HBc ALAT > 2N Ac anti-VHC (Elisa 1) Ac anti-VHC (Elisa 2) Acanti-VHC (Elisa 3) ALAT > N
Dépistage Génomique Viral
Figure 1.1 : Incidence des hépatites post-transfusionnelles (HPT) en fonction des mesures d’éviction des dons à risque
Tableau 1.III : Évolution des modes de contamination chez les malades pris en charge (d’après Roudot-Thoraval et coll., 1997 et Delarocque-Astagneau et coll., 2002 et 2003) Période 1991-1993 (%) Période 2000-2001 (%) Transfusion 37,0 31,9 Usage de drogues 24,7 48,0 Exposition nosocomiale 14,9 17,4 Partenaire sexuel 2,9 -Exposition professionnelle 3,3 3,4 Inconnue 20,4 12,7 10
Tableau 1.IV : Facteurs de risque chez des donneurs de sang ayant présenté une séroconversion VHC entre 1994 et 2000 (d’après Pillonel et Laperche, 2001 ; étude réalisée sur 112 donneurs ayant fait un don antérieur négatif)
Facteur de risque potentiel Pourcentage des séroconversions
UDIV 20 Actes invasifs 18 Chirurgie 15 Exposition professionnelle 5 Partenaire VHC (+) 10 Tatouage 1 Inconnu 30
génotype 3 et du génotype 2. Une forte relation entre le mode présumé de contamination et les génotypes a également été montrée (Pawlotsky et coll., 1995, Martinot-Peignoux et coll., 1999). Le génotype 3, et dans une moindre mesure le génotype 1a, sont plus fréquents chez les sujets contaminés par usage de drogues, tandis que le génotype 1b, et dans une moindre mesure les génotypes 1a et 2 sont observés chez les malades transfusés exposés à un risque nosocomial. L’étude des génotypes nous permet également de suivre l’épidémie virale C et la répartition des modes de contamination au cours du temps. On observe ainsi chez les malades contaminés plus récemment une diminution des génotypes 1b et 2, au profit des génotypes 3 et 1a et plus récemment encore du génotype 4, lié à l’immigration africaine et qui se diffuse
0 10 20 30 40 50 60 1991- 93 2000- 01 Transfusion Femme Transfusion Homme UD Femme UD Homme
Figure 1.2 : Évolution du mode de contamination selon le sexe (d’après Roudot-Thoraval et coll., 1997 et Delarocque-Astagneau et coll., 2002 et 2003)
UD : usager de drogue
11
ANAL
dans des groupes d’usagers de drogues. Parallèlement au mode de contamina-tion, il existe une forte relation entre l’âge des sujets infectés et la répartition des génotypes, montrant que 80 % des malades de plus de 60 ans sont de génotype 1 tandis que 40 % des malades de moins de 40 ans sont de génotype non 1. L’étude des génotypes constitue ainsi un moyen de surveillance des populations et aide à prévoir le type de malades qui seront à charge dans les années à venir ainsi que la probabilité de réponse au traitement antiviral dont nous disposons actuellement. En complément de certaines études épidémiolo-giques, l’étude plus précise des souches virales et de leurs liens phylogéniques permet d’établir des preuves moléculaires de transmission, notamment noso-comiale.
En conclusion, les différentes mesures prises depuis la reconnaissance de
l’infection virale C ont permis de réduire l’incidence de l’infection, et sont notamment efficaces pour éliminer les infections en rapport avec la transfu-sion de sang ou de produits dérivés du sang. Les recommandations existent pour éviter les contaminations nosocomiales de malade à malade, soit par l’intermédiaire du personnel de soins, soit à partir du matériel médical et chirurgical. Un effort permanent pour respecter les précautions universelles et une information répétée sont toutefois nécessaires. Une recherche doit égale-ment être effectuée pour améliorer les techniques de désinfection et les rendre plus compatibles avec l’exercice médical quotidien. L’obligation faite à tous les établissements de soins, depuis juillet 2001, de signaler à la Direction départementale des affaires sanitaires et sociales (DDASS) et au Centre de coordination de la lutte contre les infections nosocomiales (CCLIN) les infections nosocomiales à VHC devrait permettre d’estimer le risque nosoco-mial résiduel, d’analyser ses modalités de survenue et d’aider ainsi à cibler l’information pour le respect des règles d’hygiène.
BIBLIOGRAPHIE
ALTER HJ, PURCELL RH, SHIH JW. Detection of antibody to hepatitis C virus in prospec-tively followed transfusion recipients with acute and chronic non-A, non-B hepatitis. N Engl J Med 1989, 321 : 1494-1500
ANDRIEU J, BARNY S, COLARDELLE P, MAISONNEUVE P, GIRAUD Vet coll. Prévalence et facteurs de risque de l’infection par le virus de l’hépatite C dans une population hospitalière en gastro-entérologie. Gastroenterol Clin Biol 1995, 19 : 340-345 BÉCHEUR H, HARZIC M, COLARDELLE P, DENY P, COSTE Tet coll. Contamination des endoscopes et des pinces à biopsies par le virus de l’hépatite C. Gastroenterol Clin Biol 2000, 24 : 906-910
BRONOWICKI JP, VÉNARD V, BOTTÉ C, MONHOVEN N, GASTIN Iet coll. Patient-to-patient transmission of hepatitis C virus during colonoscopy. N Engl J Med 1997, 337 : 237-240
CONRY-CANTILENA C, VANRADEN M, GIBBLE J, MELPOLDER J, SHAKIL AOet coll. Route of infection, viremia, and liver disease in blood donors found to have hepatitis C virus infection. N Engl J Med 1996, 26 : 1691-1696
DELAROCQUE-ASTAGNEAU E, CAMPESE C, ROUDOT-THORAVAL F, MIGUET JP, HILLON P et coll. Mise en place du système de surveillance de l’hépatite C à partir des pôles de référence en 2000-2001. Gastroenterol Clin Biol 2002, 26 : 766
DELAROCQUE-ASTAGNEAU E, CAMPESE C, BRONOWICKI JP, COUZIGOU P, GORIA Oet coll. Surveillance de l’hépatite C à l’échelon national à partir des pôles de référence volontaires, 2000-2001. BEH 2003, 16-17 : 90-93
DESENCLOS JC, BOURDIOL RAZÈS M, ROLIN B, GARANDEAU P, CHAU Pet coll. Transmis-sion nosocomiale du VHC documentée lors de l’investigation d’une épidémie hospi-talière. BEH 1998, 7 : 25-27
EMMANUELLI J. Présentation des données et des indicateurs de mise en œuvre de la politique de RDR par le biais de SIAMOIS. In : Contribution à l’évaluation de la politique de réduction des risques SIAMOIS. Institut de veille sanitaire, Saint-Maurice 2000 : 15-36
EMMANUELLI J. Epidémiologie du VHC et des infections transmissibles associées chez les usagers de drogue. Dépistage et prise en charge globale des personnes atteintes d’hépatite C. Rencontre nationale des acteurs de santé du 10 octobre 2002
ESTEBAN JL, GOMEZ J, MARTELL M, CABOT B, QUER Jet coll. Transmission of hepatitis C by a cardiac surgeon. N Engl J Med 1996, 334 : 555-560
GALINDO-MIGEOT V, LAUWERS-CANCES V, PAYEN JL, PASCAL JP, POUS J. Facteurs de risques associés aux marqueurs sérologiques de l’hépatite C chez les sujets ne présen-tant pas de contamination connue : une étude cas-témoins en Midi-Pyrénées. Bull Info Epidemiol 1997, 47 : 1-3
GIBB DM, GOODALL RL, DUNN DT, HEALY M, NEAVE Pet coll. Mother-to-child transmis-sion of hepatitis C virus : evidence for preventable peripartum transmistransmis-sion. Lancet 2000, 356 : 904-907
HAGAN H, THIEDE H, WEISS NS, HOPKINS SG, DUCHIN Jet coll. Sharing of drug prepa-ration equipment as a risk factor for hepatitis C. Am J Public Health 2001, 91 : 42-46 IZOPET J, SAUNE K, SALAMA G, PASQUIER C, PUEL Jet coll. Infections nosocomiales à VHC en hémodialyse. Ann Biol Clin 2001, 59 : 7-8
LEFRÈRE JJ. Descriptive epidemiology of hepatitis C virus infection in France in 1996. Transfus Clin Biol 1997, 4 : 299-319
LOT F, MIGUERES B, YAZDANPANAH Y, TARANTOLA A, ABITEBOUL Det coll. Séro-conversions professionnelles par le VIH et le VHC chez le personnel de santé en France, le point au 30 juin 2001. BEH 2002, 12 : 49-51
LUCIDARME D, FOUTREIN P, CREUSY C, FOIZY G, FOUTREIN-COMES MCet coll. Preva-lence of hepatitis C, B and D markers and histopathological aspects in a group of intravenous drug addicts. Gastroenterol Clin Biol 1994, 18 : 964-968
LUCIDARME D, ILEF D, HARBONNIER J, JACOB C, DECOSTER Aet coll. Étude prospective multicentrique de l’incidence et des facteurs de risque de l’infection par le virus de l’hépatite C dans un groupe de toxicomanes du Nord-Est de la France : méthodologie, résultats intermédiaires (résumé). Gastroenterol Clin Biol 2001, 25 : 629 13
ANAL
LUCIDARME D. Étude de l’incidence et des facteurs de risque de l’infection par le virus de l’hépatite C chez les toxicomanes injecteurs du Nord et de l’Est de la France. Rapport de fin d’étude, janvier 2003
LUMINET B, GUYONNET JP. Sécurité sanitaire, tatouage et piercing, des pratiques professionnelles à risques. BEH 2002, 4 : 15-17
MARTINOT-PEIGNOUX M, ROUDOT-THORAVAL F, MENDEL I, COSTE J, IZOPET Jet coll. Hepatitis C virus genotypes in France : relationship with epidemiology, pathogenicity and response to interferon therapy. J Viral Hepatitis 1999, 6 : 435-443
MERLE V, GORIA O, GOURIER-FERY C, BENGUIGUI C, MICHEL Pet coll. Facteurs de risque de contamination par le virus de l’hépatite C. Étude cas-témoins en population générale. Gastroenterol Clin Biol 1999, 23 : 439-446
PAWLOTSKY JM, TSAKIRIS L, ROUDOT-THORAVAL F, PELLET C, STUYVER Let coll. Rela-tionship between hepatitis C virus genotypes and sources of infection in patients with chronic hepatitis C. J Infect Dis 1995, 171 : 1607-1610
PILLONEL J, LAPERCHE S. Surveillance des marqueurs d’une infection par le VIH, l’HTLV et les virus des hépatites B et C chez les donneurs de sang en France de 1991 à 2000. BEH 2001, 46 : 207-209
POIRAUD S, COHEN J, AMIOT X, BERKANE N, FLAHAULT Aet coll. Etude cas-témoin des facteurs de risque de transmission materno-infantile du virus de l’hépatite C (VHC) (résumé). Gastroenterol Clin Biol 2001, 25 : A96
POL S, ROMEO R, ZINS B, DRISS F, LEBKIRI Bet coll. Hepatitis C virus RNA in anti-HCV positive hemodialyzed patients : significance and therapeutic implications. Kidney Int 1993, 44 : 1097-1100
ROSS RS, VIAZOV S, THORMÄHLEN M, BARTZ L, TAMM Jet coll. Risk of hepatitis C virus transmission from an infected gynecologist to patients. Arch Intern Med 2002, 162 : 805-810
ROUDOT-THORAVAL F, BASTIE A, PAWLOTSKY JM, DHUMEAUX D. Epidemiological factors affecting the severity of hepatitis C virus-related liver disease : a French survey of 6,664 patients. The study group for the prevalence and the epidemiology of hepatitis C virus. Hepatology 1997, 26 : 485-490
ROUDOT-THORAVAL F. L’hépatite C en milieu carcéral : faut-il dépister ? Gastroenterol Clin Biol 1998, 22 : 41-42
SIMON N, COUROUCÉ AM, LEMARREC N, TRÉPO C, DUCAMP S. A twelve year natural history of hepatitis C virus infection in hemodialyzed patients. Kidney Int 1994, 46 : 504-511
ZYLBERBERG H, THIERS V, LAGORCE D, SQUADRITO G, LEONE Fet coll. Epidemiological and virological analysis of couples infected with hepatitis C virus. Gut 1999, 45 : 112-116
2
Transmission nosocomiale
en hémodialyse
Les patients hémodialysés constituent une population à haut risque d’infec-tion par le virus de l’hépatite C (VHC). Malgré une diminud’infec-tion globale des chiffres de prévalence et d’incidence au cours de ces dix dernières années, les infections de novo persistent. Ces infections sont d’origine nosocomiale non transfusionnelle. L’imputabilité, difficile à établir sur des études épidémiologi-ques à grande échelle, bénéficie aujourd’hui de la disponibilité d’outils virolo-giques permettant de tracer l’origine des infections et de préciser le mécanisme de transmission. Après avoir décrit l’intérêt mais aussi les limites de ces outils, seront abordés les tendances épidémiologiques de l’infection à VHC en hémo-dialyse, les mécanismes de transmission du virus, les conséquences de l’infec-tion chez les sujets infectés et les stratégies actuelles de prévenl’infec-tion.
Outils virologiques
Bien qu’ayant certaines limites, la détection et la caractérisation de l’ARN viral présentent un très grand intérêt diagnostique.
Virus de l’hépatite C
Le VHC est un virus à ARN monocaténaire linéaire à polarité positive, enveloppé, dont le diamètre est d’environ 50 nm. Six génotypes majeurs 1-6 ont été identifiés (Simmonds, 1999). La comparaison des séquences nucléoti-diques virales des individus infectés indique une variabilité génétique d’environ 30 % entre génotypes, 20 % entre sous-types au sein d’un même génotype et 10 % entre souches au sein d’un même sous-type. À l’échelle individuelle, le VHC existe sous la forme d’une population hétérogène de variants génétiquement proches constituant la quasi-espèce virale. 15
Tests de diagnostic
Les tests indirects permettent la mise en évidence des anticorps anti-VHC. Les tests utilisés pour le dépistage sont aujourd’hui des tests immunoenzyma-tiques de 3e génération (Pawlotsky, 2002 ; Richter, 2002). Certains tests sérologiques permettent également la détermination du génotype.
Les tests directs permettent la mise en évidence de l’ARN VHC ou de l’antigène de capside du virus (Pawlotsky, 2002 ; Richter, 2002). Si l’ARN VHC et l’antigène de capside sont des paramètres de détection et de quantification du virus, seul l’ARN permet la caractérisation virale. Celle-ci consiste à identifier le génotype par différentes techniques d’hybridation moléculaire ou à déterminer la séquence nucléotidique de différentes régions génomiques.
Intérêts
La recherche des anticorps anti-VHC est une méthode de dépistage, mais la mise en évidence de l’infection repose sur la recherche de l’ARN viral. La caractérisation génomique permet de tracer l’origine d’une infection.
Élaboration d’algorithmes diagnostiques performants
Les anticorps anti-VHC sont des marqueurs d’exposition au virus, et non des marqueurs d’infection. Les tests sérologiques de 3egénération présentent des performances excellentes en termes de sensibilité et de spécificité (Dalekos et coll., 1998). Cependant, en cas d’infection aiguë, la mise en évidence des anticorps s’effectue habituellement 1 à 12 semaines après l’élévation de l’acti-vité des alanine aminotransférases (ALAT). L’identification d’une infection à VHC repose sur la mise en évidence de l’ARN VHC ou de l’antigène de capside ; les tests vis-à-vis de ce dernier ont une sensibilité moindre que ceux ciblés sur l’ARN VHC. Les tests de mise en évidence de l’ARN sont aujourd’hui standardisés. La limite de détection des différents tests commer-cialisés est parfaitement établie grâce à des standards internationaux. Les contrôles de qualité réalisés dans les laboratoires au cours de ces trois dernières années ont montré leur fiabilité.
Chez un individu immunocompétent, une infection aiguë se caractérise par une élévation des ALAT, l’absence d’anticorps anti-VHC et la présence d’ARN VHC. Une infection chronique se caractérise par la présence d’anti-corps anti-VHC et d’ARN VHC, une infection ancienne et guérie par la présence d’anticorps anti-VHC et l’absence d’ARN VHC. Ces données s’appliquent aux patients hémodialysés pour lesquels l’immunodépression n’altère pas de manière significative la fréquence de détection des anticorps anti-VHC avec les tests actuels (Salama et coll., 2000).
Bien que les hémodialysés présentent des valeurs d’ALAT plus faibles que les sujets à fonction rénale normale (Guh et coll., 1995 ; Yasuda et coll., 1995 ;