HAL Id: halshs-00961336
https://halshs.archives-ouvertes.fr/halshs-00961336v2
Preprint submitted on 20 Nov 2014
HAL is a multi-disciplinary open access
archive for the deposit and dissemination of
sci-entific research documents, whether they are
pub-lished or not. The documents may come from
teaching and research institutions in France or
abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est
destinée au dépôt et à la diffusion de documents
scientifiques de niveau recherche, publiés ou non,
émanant des établissements d’enseignement et de
recherche français ou étrangers, des laboratoires
publics ou privés.
Zones refuges glaciaires et processus de recolonisation
tardiglaciaire et holocène du castor (Castor fiber L.) en
Europe : aperçu synthétique des données
archéozoologiques
Alexandra Liarsou
To cite this version:
Alexandra Liarsou. Zones refuges glaciaires et processus de recolonisation tardiglaciaire et holocène
du castor (Castor fiber L.) en Europe : aperçu synthétique des données archéozoologiques. 2014.
�halshs-00961336v2�
Zones refuges glaciaires et processus de recolonisation tardiglaciaire et holocène du castor (Castor fiber L.) en Europe : aperçu synthétique des données archéozoologiques
Alexandra Liarsou,
Docteur en Archéologie, Ethnologie, Préhistoire – Université Paris I UMR 7041 ArScAn - Archéologies et Sciences de l’Antiquité Membre associé, équipe Archéologies environnementales Maison de l’Archéologie et de l’Ethnologie,
21 allée de l’Université,
92023 Nanterre Cedex – France
Nota : figures en fin de document Introduction
Le castor (Castor fiber Linnaeus,
1758) est un grand rongeur aquatique.
L’animal était en voie de disparition au début du XXème siècle, avant d’être protégé puis réintroduit dans la plupart des pays européens.
Aujourd’hui, le castor d’Europe recolonise rapidement les hydrosystèmes (fleuves, rivières, lacs…). Ses populations se sont multipliées par 500 entre le début du XXème siècle et le début du XXIème siècle1. Sa réintroduction peut être considérée comme un grand succès écologique2, eu égard aux objectifs premiers de la démarche visant la sauvegarde des populations et la restauration de l’aire de répartition de l’animal.
Lorsqu’une espèce fait l’objet de plans de réintroduction, et, dès lors que les notions d’aire de répartition et de densité de population sont évoquées, il est inexorable de se demander quels sont, si l’on peut dire, les « états » à atteindre et
1 De moins de 1200 individus à presque 1 000 000 (Halley et
Rosell, 2002 : 153).
2 Succès qui a d’ailleurs surpris les écologues eux-mêmes
(Reichholf, 1999). Les gestionnaires et écologues se sont demandés si les nombreuses et récentes interventions techniques des hommes sur les cours d’eau européens (nettoyage des berges, canalisation, bétonnage, régularisations générales de l’écoulement avec construction de barrages) n’avaient pas modifié la physionomie des rivières à un degré tel que ces nouvelles conditions rendaient impossible l’adaptation du castor, accoutumé à vivre le long des cours d’eau « sauvages » et à régler à sa guise le niveau des eaux dans son aire d’habitat. Ayant massivement disparu avant le XIXème siècle alors même que les grands travaux
d’aménagement ont eu lieu à partir de cette époque, les écologues manquaient d’observations sur sa vie le long des écoulements anthropisés. Certains ont prétendu que sa « niche écologique » avait disparu, pourtant l’animal, qui n’est en réalité pas très dépendant de l’eau, s’est parfaitement adapté et a su profiter des opportunités créées par les hommes.
comment les définir… Quelle époque doit être considérée comme point de référence ? À partir de quelles données et de quels indices caractériser l’extension des populations et la densité à atteindre ? Ces questions sont particulièrement décisives concernant le castor qui modifie intensément son milieu de vie3 et a donc une emprise étendue sur les écosystèmes (à ce sujet Ulevicius et al., 2009 : 126-140).
Le propos de cet article est de déterminer les principales zones refuges du castor pendant la glaciation de Würm et de retracer les grandes étapes de sa colonisation des vallées européennes à partir de la fin du dernier épisode glaciaire. Pour y parvenir, nous avons principalement
analysé un corpus de données
archéozoologiques collectées de 2005 à 20084 et nous avons appuyé notre argumentation sur les connaissances éthologiques de l’animal ainsi que sur les études écologiques et démographiques conduites actuellement dans le cadre du suivi des plans de gestion des populations de castor.
1. Refuges glaciaires et formation des sous-espèces
Les sous-espèces de castors ont été essentiellement déterminées en fonction des zones où les populations dites
3 Comment décider des zones où implanter l’animal ?
Comment contrôler sa dispersion et ses effectifs ? Comment anticiper l’effet des réintroductions effectuées ? L’état démographique supposé des populations à un moment T doit-il être recherché ? In fine, comment déterminer ce qui est nécessaire et ce qui ne l’est pas en matière de réintroduction d’espèces presque disparues ?
4 La collecte des données est à actualiser au regard des
découvertes faites depuis 2009, notamment en Europe de l’Est et en Fédération de Russie.
relictuelles se trouvaient confinées – et donc déconnectées les unes des autres – au début du XXème siècle.
Vers 1930, il restait environ 30 individus sur le Rhône, 200 sur l’Elbe et 100 dans le Sud de la Norvège. D’autres populations dites natives se rencontraient également de la Sibérie au Turkestan, vers l’Oural et la Caspienne en Russie ; soit : ―900 le long du Niémen et des affluents du Dniepr (Bérézina, Sozh, Pripjat, Tetetrev) en Biélorussie et Ukraine,
―70 le long du Don (Voronej) en Russie, ―300 le long du Konda et du Sosva dans l’Ouest de la Sibérie,
―30-40 le long du cours supérieur de l’Ienisseï dans les montagnes du Touva en Sibérie centrale et enfin,
―moins de 150 dans l’Altaï mongol.
Les travaux concernant la
génétique de ces populations ont été multiples (Ellegren et al., 1993 : 8150-8153 ; Lavrov, 1983 : 87-90etc.). Pour le continent
européen, au sein de l’unique espèce C.
fiber, 9 sous-espèces ont été reconnues,
tout en faisant l’objet de controverses : ―C. fiber fiber Linné, 1758 (Scandinavie) ; ―C. fiber galliae Geoffroy, 1803 (Rhône) ; ―C. fiber albicus Matschie, 1907 (Elbe allemand) ;
―C. fiber vistulanus Matschie, 1907 (Europe de l’Est) ;
―C. fiber pohlei Serebrennikov, 1929 (Ouest sibérien, Oural : Konda, Sosva : bassin de l’Ob) ;
―C. fiber birulai Serebrennikov, 1929 (Mongolie) ;
―C. fiber tuvinicius Lavrov, 1969 (Ienisseï, Sibérie ; Touva, Chine) ;
―C. fiber belorussicus ou belarusicus Lavrov, 1981 (Biélorussie, Niémen, Dniepr) et,
―C. fiber orientoeuropaeus Lavrov, 1981 (Europe de l’Est, Voronej).
Certaines de ces variétés ont été remises en cause, leur origine étant
considérée comme « partiellement
naturelle » seulement (Heidecke et Neumann, 2000 : 20). La sous-espèce
Castor fiber galliae serait nettement
identifiable grâce à ses caractéristiques ostéologiques plus « robustes » (Frahnert et Heidecke, 1992 : 175-189). Elle est considérée comme l’unique espèce indigène de castor européen dans l’Ouest. En Allemagne, le Castor fiber albicus est également envisagé comme autochtone.
Toutefois, la séparation catégorique entre les deux populations ne fait toujours pas consensus à ce jour. Les populations de l’Est, autrement dit belorussicus, orientoeuropaeus et vistulanus pourraient
constituer un seul ou trois taxons différents. Dans le cas de figure où l’hypothèse d’une seule espèce est acceptée par les chercheurs, elle est appelée C. fiber
vistulanus (Gabrys et Wasna, 2003 :
433-439).
À l’issue de ce bref inventaire, nous pouvons nous poser plusieurs questions : quand et comment ces sous-espèces se sont formées ? Se sont-elles constituées dans les régions refuges lors la dernière glaciation ? Étaient-elles présentes antérieurement à l’Holocène ou se sont-elles développées durant cette période ? Quel degré de divergence existe-t-il entre les populations ? Comment se sont-elles rencontrées ou isolées ? Existait-il des zones dans lesquelles le rongeur aurait pu perdurer pendant le maximum glaciaire, dans les régions d’Europe centrale correspondant à l’Allemagne, la Pologne ou la Tchéquie actuelles, situées à la limite du glacier principal scandinave et du glacier alpin ? Durant quelles périodes le rongeur a-t-il recolonisé le Nord de l’Europe, autour de la Baltique et de la Scandinavie ?
Tenter de répondre à de telles interrogations revient essentiellement à essayer de concevoir, au moyen des données paléo-environnementales et à l’aide du matériel archéozoologique, quels ont pu être les refuges glaciaires de l’espèce et par quelles voies migratoires les castors ont pu coloniser les grands bassins fluviaux de plaines comme la Weser, l’Elbe, l’Oder et la Vistule.
Nous pouvons également tenter d’apporter des éléments de réponse plus particuliers concernant l’évolution du peuplement durant les fluctuations climatiques du Tardiglaciaire : par exemple, les populations ont-elles subi une régression pendant les derniers épisodes froids et notamment pendant le Dryas III, qui marque le retour à des conditions glaciaires ?
Pour certains auteurs, la distinction entre les populations s’est effectuée avec le morcellement holocène des groupes de
castors : « un morcellement des
notre ère en raison de l’expansion humaine et de défrichements, couplé à une baisse des effectifs, auraient fait baisser les échanges génétiques entre les populations et amorcé le début d’une différenciation entre elles » (Véron, 1992 :
87).
Examinons la recevabilité de cette supposition par le biais des données génétiques, des données archéologiques et palynologiques.
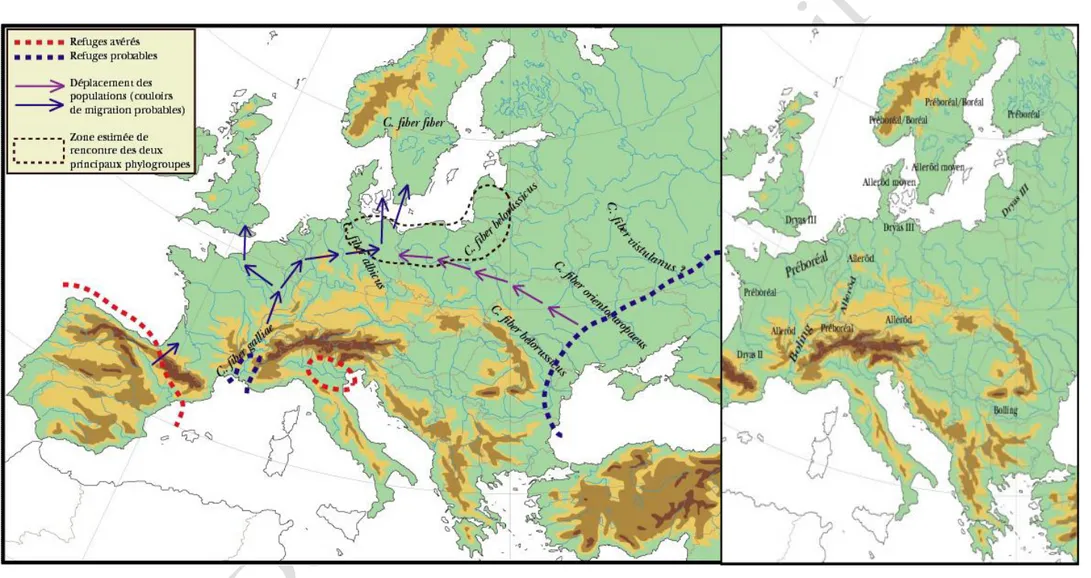
D’après les analyses génétiques effectuées à partir d’individus issus des différentes sous-espèces, les populations dites autochtones (résiduelles) de castors ont subi les effets d’un étranglement génétique en raison du taux de fragmentation des groupes, surimposé à l’héritage génétique des glaciations quaternaires successives et de la dernière expansion postglaciaire. L’analyse phylogénétique conduite par Durka et al. (2005 : 3843-3856) révèle deux lignages d’ADN mitochondrial : Est (Pologne, Lituanie, Russie, Mongolie) et Ouest (Allemagne, Norvège et France).
Ceci suggère une différenciation pendant le dernier épisode glaciaire et l’existence de plusieurs zones refuges. Pour les auteurs, les populations de castors ont vraisemblablement été séparées dès le début de la dernière période glaciaire vers 115 000 BP5.
Pour l’Est de l’Europe et la zone Nord-Ouest asiatique, C. fiber montre une structuration stable avec un degré très faible de divergence génétique. Les échantillons de populations autochtones de Mongolie ou Sibérie n’apparaissent pas significativement différentes des échantillons de la partie européenne de la Russie, en dépit de la grande distance géographique qui les sépare. L’examen des données suggère donc une unique et récente origine des populations actuelles de castors de l’Est de l’Europe et d’Asie.
C. fiber Birulai apparaît comme le
membre le plus divergent de l’espèce ; ce phénomène pourrait résulter de sa longue isolation génétique dans un bassin versant enclavé.
5 Il convient de rappeler que la rupture Est/Ouest entre les
lignages d’ADN mt dans le centre de l’Europe est similaire à celle de nombreuses autres espèces de mammifères. Elle indique au moins deux refuges glaciaires de part et d’autre du massif alpin.
D’après les données
archéologiques examinées, avant le maximum glaciaire, la présence du rongeur est attestée :
―en Europe centrale, au-dessus du glacier alpin, au niveau de l’actuelle Tchéquie et de la Slovaquie ainsi que sur le bassin de la Vistule ;
―en Méditerranée, en Italie, dans la péninsule ibérique (ex : Antunes, 1989 : 23-40 ; Povoas et al., 1992 : 23-40-47) et dans le Sud des Balkans ;
―en France, sur le bassin du Rhône et en Charente (ex : Porraz, 2005 p. 175-176 ; Poulain, 1976 : 29-41 ; Tournepiche et Couture, 1999 : 89-101).
Après 25 000 BP6, l’animal est toujours bien signalé dans ces zones (sites autrichiens, roumains ex : Borziac, Chirica et Valeanu, 2006 : 355, italiens, espagnols ex : Povoas et al., 1992 : 40-47) ainsi que sur le bassin rhodanien. Le rongeur est enfin sporadiquement attesté sur deux autres bassins : celui de la Loire et celui du Rhin. L’animal est autant représenté dans des spectres de faunes arctiques qu’avec des faunes de climats tempérés (Liarsou, 2012 : 94).
Il est à noter que plusieurs refuges glaciaires méditerranéens sont attestés derrière le verrou formé par les Pyrénées et le glacier alpin qui s’étendait du Jura aux Carpates lors du maximum glaciaire (Espagne du Nord, ex : Antunes, 1989 : 23-40 ; Povoas et al., 1992 : 23-40-47, Italie du Nord, où l’animal est représenté de manière continue dans les couches stratigraphiques de certains sites comme Riparo del Broion ex : Fiore, Gala et Tagliacozzo, 2004 : 273-286). Le refuge de la population de l’Est pourrait se situer autour de la zone ponto-caspienne et au Proche-Orient (présence sur l’altiplano anatolien/Syrie, Iraq/Crimée) voire encore plus à l’Est (Boessneck, 1974 : 83-88).
Dans les niveaux épi-gravettiens datés de 20 000 BP du site de Climente II (Boroneant, 2000), en zone aval du Danube, des dents percées de castor ont été identifiées. Cela peut suggérer la présence du rongeur et, corrélativement, celle d’une zone refuge à l’Ouest de l’actuelle Mer Noire ; à moins que les
6 Toutes les dates fournies dans le présent texte sont données
pièces n’aient été transportées par les groupes humains (échange, migration).
Les découvertes archéologiques restent le reflet de l’implantation humaine et, de surcroît, de l’exploitation de l’animal par l’homme dans la plupart des cas. Il est donc malaisé de restituer une répartition naturelle de l’espèce.
Nous pouvons faire appel aux indices palynologiques qui ont été mis au jour à partir des années 20007, suggérant l’existence possible d’une zone refuge (favorable du point de vue climatique à la survie des populations de castors) dans les plaines d’Ukraine et de Russie Centrale. La présence d’une végétation forestière sur les rives de la mer d’Azov et de la mer Noire, au Sud de l’Oural, dans le Sud de la Sibérie et de la Mongolie, durant le dernier maximum glaciaire, est attestée (Kuzmin et Orlova, 2004 : 133-169).
Toutefois, nous n’avons pas de données archéologiques suffisantes pour étayer cet argument dans l’état actuel de nos connaissances. Dans la partie Est de l’aire de répartition du castor, les populations ont aussi bien pu être morcelées entre – et au sein – de plusieurs refuges glaciaires ou bien dispersées sur une ceinture plus ou moins continue de biotopes favorables en Europe de l’Est ainsi qu’en Asie.
Revenons aux données
archéologiques. Il semble exister de potentiels refuges sur le Rhône aval où l’animal est signalé dans plusieurs séquences successives du Würm. Sa présence est attestée, avec une relative continuité par rapport aux durées envisagées8, dans les séquences chronologiques s’étendant sur les phases glaciaires et les interstades entre le Würm I et le Würm III, dont Ia et Ib, IIa et IIb (Lumley, 1969 : 162-165).
Selon Cordier-Goni (1947 : 101), les animaux formant la population de ce bassin se seraient légèrement différenciés au cours du quaternaire sous l’influence du climat méditerranéen et peut-être de conditions hydrologiques particulières, menant à la caractérisation de la
7 Les données doivent faire l’objet d’une actualisation. 8 Difficile de parler de continuité lorsque de telles durées sont
considérées…
espèce rhodanienne, de grande taille, d’après les mesures crâniométriques. La sous-espèce Castor fiber galliae aurait pu isoler ses caractéristiques dites « robustes » au cours de cette période. Il est toutefois à noter que si l’animal est représenté, parfois très abondamment, dans des niveaux humides à secs, froids à tempérés, il est absent de ceux qui sont reconnus comme ayant attesté des conditions climatiques les plus extrêmes, dont celles de froid très intense (à titre d’exemple, sur le site de la grotte aux Puces en Provence).
Du point de vue éco-éthologique, l’animal est à la fois est adapté :
―à un biotope de type forêt boréale de conifères ;
―à un environnement de « steppes-taïga-toundra » à faible recouvrement arbustif ; ―ainsi qu’à la forêt mixte ou caducifoliée.
Les sites archéologiques – où les indications climatiques sont suffisamment fines et où les taxons végétaux et animaux ont été étudiés sur plusieurs périodes consécutives –, mettent en évidence la présence du castor dans des zones à très faible recouvrement végétal. Le rongeur y est accompagné d’espèces froides et/ou de climat aride ; par exemple, au Dryas I de Riparo Tagliente (Fontana et al., 2009 : 49-57 ; Fiore et al., 2004 : 273-297). La proportion des restes osseux, issus de l’exploitation de l’animal par les groupes humains, est par ailleurs identique dans les niveaux froids et tempérés ; par exemple, à Galgenbühel/Dos de la Forca (Wierer et Boscato, 2006 : 85-98).
Ces données conduisent à
envisager l’existence de multiples refuges glaciaires et vraisemblablement l’amorce d’une distinction entre certaines sous-espèces depuis au moins la dernière période glaciaire.
Il demeure très difficile
d’appréhender les mouvements de
populations pendant la glaciation, non seulement à cause du biais humain d’implantation des zones d’habitats et d’exploitation9, mais aussi à cause du caractère disparate de l’état de la
recherche et de la temporalité
considérée.
9 y compris les possibles imports d’éléments du squelette de
Il est possible de proposer un scénario où l’animal aurait totalement disparu de la faune glaciaire pendant des périodes très froides et aurait recolonisé progressivement, à partir de refuges, les bassins qu’il occupait durant les interstades ou les périodes moins rudes. Cette hypothèse induit de multiples régressions et phases de recolonisations. Ces mouvements sont pour le moment impossibles à mettre en évidence ou à infirmer ; notamment car les sites sont trop peu nombreux et séparés par de trop longs intervalles de temps10. Des populations résiduelles plus ou moins isolées ont dû perdurer dans des zones aux conditions favorables (fonds de vallée), dépendantes du type d’exposition.
2. Hypothèses d’expansion tardiglaciaire et postglaciaire du castor en Europe
Le castor possède une grande plasticité écologique et dispose d’un
panel diversifié de réponses
comportementales. Cela lui permet de s’adapter à d’importantes variations de conditions climatiques. Il peut également stabiliser, par ses propres actions – endiguement et coupe des arbres –, les faciès hydriques et les strates végétales des espaces qu’il occupe. L’étude de la répartition des ossements de castor retrouvés en contexte archéologique, couplée à la prise en considération des données éthologiques et démographiques actuelles, permet de formuler des hypothèses générales et particulières sur le processus de recolonisation de l’Europe par le castor.
2.1 Écologie et voies migratoires actuelles : quelques pistes de réflexion sur les milieux fréquentés par le castor
Plusieurs données doivent être prises en compte par les archéologues lorsque des ossements de castor sont identifiés au sein du matériel faunique d’un site.
―La capacité du castor à générer un biotope favorable à son installation et à améliorer l’état des ressources ligneuses
10 Il ne semble pas impossible d’apporter des éléments de
réponse permettant d’invalider ou de valider cette hypothèse générale, notamment en focalisant les recherches sur des zones géographiquement restreintes.
exploitables – comme des conditions hydrologiques – est un facteur qui ne doit pas être négligé. Les moyens dont l’animal dispose pour transformer le paysage lui permettent de s’affranchir de conditions écologiques initialement défavorables ainsi que de fluctuations hydrologiques assez brutales.
―Le fait que le rongeur possède une
grande plasticité génétique doit
également être pris en considération. Il peut reconstruire une population viable avec un très petit nombre d’individus. Ceci explique sa forte tolérance à la consanguinité et sa survie dans des conditions qu’aucun autre mammifère ne pourrait supporter (Milishnikov, 2004 : 949-960).
―Le fait que le castor possède une alimentation à large spectre, comportant en moyenne plus de 150 espèces herbacées et plus de 60 variétés de ligneux, allant de plantes d’eau (potamots) et rhizomes (nénuphar) aux houppiers et à l’écorce des arbres, est également une indication importante à prendre en compte.
Le castor exerce une prédation sur chaque nouvelle espèce végétale entrant dans son biotope. En cela, il est capable de s’adapter à la structure végétale des différentes phases postglaciaires de réchauffement climatique. Le rongeur consomme des espèces dites sub-spontanées ou pionnières. Certaines de ses espèces de prédilection sont des arrivants des premiers stades du Tardiglaciaire. Par exemple :
―les herbacées telle l'armoise ainsi que les graminées, qui composent la végétation steppique à faiblement arborée ;
―le bouleau, premier arbre à se propager après une phase froide avec le pin (dès le Bölling, 13 000 BP) ;
―le pin peut être occasionnellement consommé par le rongeur en cas de manque de nourriture ;
―le saule, très apprécié du castor, est également une espèce de reconquête avec le noisetier.
En examinant les environnements occupés actuellement par le castor, plusieurs études ont mis en évidence que ces espaces comportaient fréquemment peu de zones forestières, à l’exception de la bande rivulaire. Par ailleurs, l’animal
peut vivre dans des zones très pauvres en salicacées. Au Danemark, le castor vit dans des régions composées à 90 % de conifères (cf. Hartman, 1994 ; Bevanger, 1995 ; Parker, 2001 : 77-95).
Les études sur la répartition et les principales voies de recolonisation empruntées par les populations de castor réintroduites en Europe fournissent une vue d’ensemble du processus. Dans une certaine mesure11, ces données peuvent être utilisées comme des indices pour
comprendre la recolonisation
postglaciaire de l’animal.
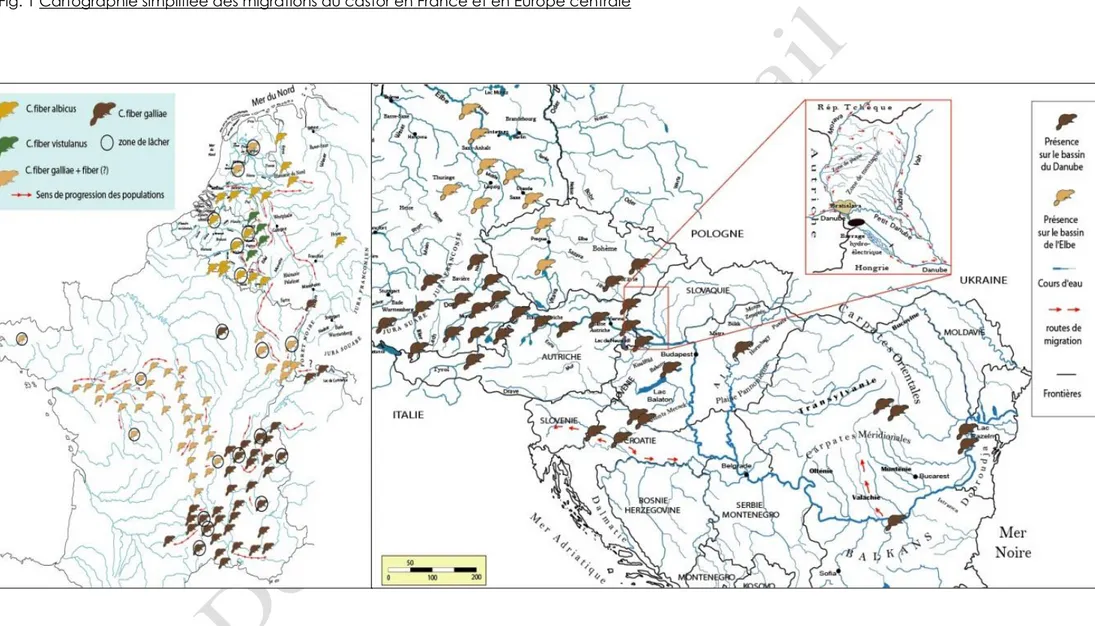
Les principaux « couloirs » de
migration sont matérialisés par
l’intercommunication entre les affluents du Danube moyen (Tisza amont) et l’Elbe amont (par le plateau de Bohème, Hongrie ; Szigetköz) ainsi qu’entre le Danube moyen et le Rhin moyen (par les affluents du Main, par le Rhon). Il est vraisemblable qu’il se dessine à court terme une communication entre les sources du Rhin et du Rhône par le plateau suisse.
Dans la région de l’Hesse (Allemagne), le contact avec le bassin de la Weser par les populations du cours aval
du Rhin est envisageable. Une
communication du Kallbach dans la région de l’Eifel allemand avec la Roer, la Vesdre, la Meuse et l’Ourthe en Belgique (par le plateau des Hautes-Fagnes) est avérée. Les castors ont également colonisé la Rurh, la Mohne et le Lenne.
En France, l’intercommunication entre le bassin du moyen du Rhône, le bassin amont de la Loire et de la Garonne peut être suggérée au niveau des Monts d’Auvergne. Il en est de même entre le haut bassin de la Saône et celui de la Moselle.
Le castor a colonisé en quelques dizaines d’années les affluents des grands fleuves sur lesquels il a été réintroduit (comme la Loire, la Meuse, la Moselle jusqu’à la Sure et l’Our, l’Ourthe jusqu’à la Vesdre, le Semois et le Viroin, le Rhône,
11 Il est impossible de faire une stricte comparaison entre les
modes actuels de colonisation et les potentialités offertes au Tardiglaciaire et au début de l’Holocène. Les conditions de peuplement sont différentes et, actuellement, fortement influencées par l’action de l’homme sur les castors et par la transformation des milieux aquatiques à très grande échelle.
jusqu’à la Versoix et au Léman, le Rhin, de l’Eifel au Biesbosh, la Hase jusqu’à l’Ems).
À partir de l’Elbe, le castor s’est dispersé sur le Schorfheide, le Peene (dans le Mecklenburg) puis sur l’Havel et le bassin de l’Oder (dans le Brandebourg) et jusqu’aux marais de Werbellin. Sa progression sur l’Elbe est de plus de 200 kilomètres. L’animal a également colonisé l’Ehle, la Saale, la Mulde et l’Elster.
Sur le Danube, le castor s’est dispersé du Biberach (en Bavière) vers le cours du Danube, l’Isaar, l’Inn (en Autriche) et le lac Ammer. A partir de l’Ettenau (Salzach), ses populations se sont étendues sur le Danube et les bras secondaires du fleuve. Du cours du Danube moyen, les animaux se sont répartis sur la Morava, la plaine de Zahorska, sur la Vah et la Dudvah (Hongrie et Slovaquie). L’animal a traversé le flanc Est des Carpates méridionales pour atteindre le Danube (en Tchéquie). Les groupes présents en Pologne ont gagné la Slovaquie par les montagnes de Beskydy.
Au Sud, les bassins de la Save et de la Drave (Croatie et Slovénie) ont été colonisés à partir des populations dispersées sur le Danube. En Roumanie, les animaux se dispersent progressivement sur les affluents du Danube aval, comme l’Olt (cf. travaux de Heidecke et Ibe, 1997 ; Czech et Schwab, 2001 : 5-7 ; Czech, 1999 ; Duha et Majzlan, 1997 : 7 ; Dzieciolowski et Gozdziewski, 1999 : 31-35 ; Halley et Rosell, 2002 : 153-178 ; Kostkan et Lehky, 1997 : 307-310 ; Pachinger, 2001 : 125-129 ; Schwab et Lutschinger, 2001 : 47-50).
Les données montrent que les limites de partage des eaux peuvent être franchies (par exemple, concernant la colonisation du fleuve Danube et de quelques-uns de ses affluents, Zahorska, Vah et Dudvah). Enfin, le castor peut parcourir des distances assez longues sans eau à proximité, jusqu’à plusieurs kilomètres. Certains castors ont été identifiés à plus de 11 km du plus proche point d’eau en Russie occidentale d’après (Saveljev et al., 2002 : 434-439).
Fig. 1. Cartographie simplifiée des migrations du castor en France et en Europe centrale
2.2 Synthèse archéologique concernant la répartition et les mouvements de populations en Europe méridionale et centrale
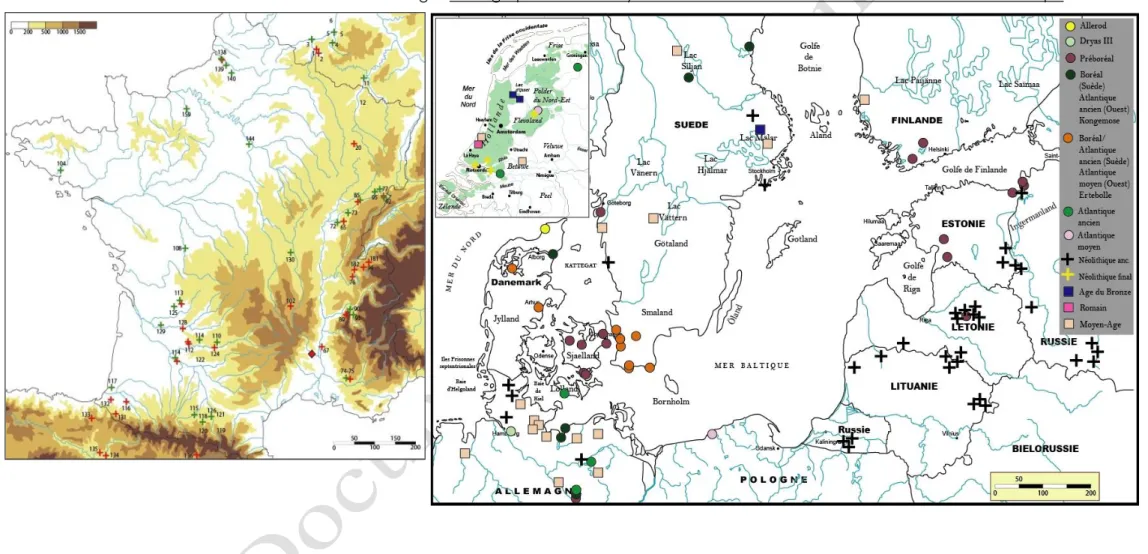
Les données archéologiques
(Liarsou, 2012 : 591-642) semblent indiquer une émigration des populations ibériques vers le Nord dès le Tardiglaciaire car les sites espagnols n’enregistrent quasiment plus la présence de l’animal, tandis que sa représentation augmente de manière très importante dans les archéofaunes des sites des bassins de la Garonne et du Rhône (soit respectivement 38 % et 36 % du nombre total de sites tardiglaciaires de notre corpus).
Il est également absent de la zone Sud de l’Italie malgré l’exploitation de nombreuses espèces à fourrure par les hommes ; il est signalé dans le Nord du pays (y compris durant le Dryas III comme à Riparo Dalmeri, voir Fiore et Tagliacozzo, 2009 : 79-93). Le taux d’exploitation du castor au sein des spectres fauniques oscille entre 0,03 % et 49 % du NMI12. Il est
possible que la conjugaison du
réchauffement Holocène et la diminution générale de l’humidité au Sud ait induit la raréfaction du castor dès la fin du Tardiglaciaire dans les zones les plus méridionales.
Le castor est attesté sur le Danube aval entre 12 600 BP et 10 120 BP13 sur un petit nombre de sites tardiglaciaires implantés dans les gorges du Sud-Ouest de la Roumanie (comme Cuina Turcului) puis à Veterani et Pestera Hotilor, au début du Mésolithique. L’animal y est fortement exploité. Il représente entre 10 % et 18 % du NMI de chaque site.
Sur le cours moyen du Danube, le rongeur n’est pas signalé au Tardiglaciaire, mais cela tient vraisemblablement davantage à l’état de la recherche qu’à une réalité paléozoologique14.
En amont du fleuve, dans les zones humides proches de sa source, les sites attestent sporadiquement de la présence du castor à partir de l’Alleröd (Peterfels, Zigeunerfels) mais ce sont essentiellement les sites mésolithiques qui enregistrent ce taxon. Au moins deux explications à ce
12 Nombre minimum d’individus 13 Rappel : les dates sont données n. C.
14 Là encore, les données sont à actualiser puisque notre
travail de collecte de données s’arrête à l’année 2008.
phénomène sont envisageables : soit le
castor constitue une ressource
nouvellement exploitée par les populations
humaines épipaléolithiques puis
mésolithiques dans cette zone (cf. Bridault, 1993 : 149-167 ; 1990 : 271-272), soit l’animal n’y développe que tardivement des populations en nombre important.
Le fait qu’il soit représenté à des latitudes plus élevées au Nord, sur le Rhin, à partir de cette même période (sites de culture federmesser de Gönnersdorf, Martinsberg/Andarnach : 11 400 BP n. C.) tend à invalider la seconde hypothèse15.
Concernant les voies de dispersion et de rencontre des populations, les faunes d’Europe et d’Asie pouvaient être en relation par la plaine germano-polonaise ou par le Sud de l’Ukraine. Le scénario théorique principalement envisageable est que la prise de contact entre les populations orientales (Balkans) et occidentales (Sud de la France) n’a pu s’effectuer que dans la plaine hollando-germano-polonaise. La possibilité que les
deux populations balkaniques et
françaises soient parvenues en même temps dans la plaine allemande est peu probable. Il est possible que le castor occidental ait été plus rapide dans sa progression, suivant la remontée de la végétation ligneuse jusqu’en Pologne.
Le castor colonisant au
Mésolithique les territoires du Nord de la France, de l’Angleterre et de la Belgique serait donc le castor occidental tandis qu’au même moment, le castor danubien aurait contourné le massif alpin en remontant vers l’Allemagne, utilisant notamment le couloir du Danube progressivement dégagé des conditions glaciaires.
Suite à une colonisation disjointe, se serait opérée la jonction entre les deux
populations dans les plaines
septentrionales, le castor de l’Elbe (albicus) étant le résultat du mélange
15 Par ailleurs, les datations de ces deux gisements
magdaléniens montrent que la réoccupation humaine de la région après la période pléniglaciaire était déjà effectuée avant l’amélioration climatique tardiglaciaire de Bölling (vers 13 000 BP). Inutile donc d’invoquer l’absence de présence humaine à des latitudes élevées – et en conséquence l’absence d’exploitation du castor qui est une ressource globalement exploitée par tous les groupes du Tardiglaiciaire – pour justifier de l’absence de l’animal dans des zones semblant similaires à celles de Gönnerdorf et Andarnach au plan de leurs conditions climatiques…
génétique de cette rencontre. La frontière
entre castors « orientaux » et
« occidentaux » coïnciderait avec la limite méridionale du glacier scandinave se retirant vers le Nord.
Ceci est plausible mais difficile à étayer ; d’autant plus que des travaux biométriques ont montré que le castor de
l’Elbe présente les caractères
morphologiques les plus distincts des autres sous-espèces tandis que le castor du Rhône (galliae) présenterait davantage d’affinités avec le castor Est-Européen. Ce schéma de peuplement peut donc être remis en cause d’après les analyses conduites par Frahnert et Heidecke, (1992 : 175-189).
La localisation exacte des zones de contact peut notablement varier, allant de l’Allemagne à la Lituanie, en fonction de facteurs multiples (localisation des refuges glaciaires, viabilité des corridors migratoires, vitesse de colonisation des plaines…).
Dans le phylogroupe de l’Est, l’Oural sépare géographiquement les populations de castors de l’Est de l’Europe de celles du centre de l’Asie. Dans le cas de C. fiber fiber, l’ouverture du Skagerrak-Skattegat entre le Danemark et la Norvège vers 7 500 BP peut avoir créé une barrière effective au brassage génétique. Par ailleurs, il est généralement admis que la variabilité très basse intra-populations serait due à l’isolement des populations cantonnées à chaque grand bassin versant.
L’inventaire archéologique ne présente aucun site antérieur à l’Alleröd. Ceci ne vient pas étayer l’hypothèse d’une présence plus ancienne du castor sur toute la zone couvrant le cours moyen du Rhin et la source du Danube, potentiels couloirs de migration pour les populations de castors, « connectés » au niveau du Neckar, du Main et de la source du Rhin.
Nous ne disposons pas de données suffisantes pour discuter la colonisation de la zone du Danube moyen. La population de l’Ouest peut être parvenue jusque dans cet espace à partir des zones humides engendrées par la déglaciation de l’Ouest de l’arc alpin ; le rongeur a peut-être eu également le temps de coloniser le cours du Danube et ses affluents par l’Est. Toutefois, il parait difficilement concevable
que l’animal n’ait pas réussi à coloniser l’Elbe au niveau du plateau de Bohème puisqu’il est capable de franchir de telles zones de partages des eaux, dont les sources sont peu éloignées et la topographie peu escarpée.
L’animal ne disparaît pas au Dryas III, période qui marque le retour à des conditions glaciaires sur environ un millénaire. Il est attesté dans la moitié Sud de la France (comme à Rochedane, voir Bridault, 1993), dans les zones d’Europe centrale et même dans le Sud de la Suède et au Danemark (voir 2.3 du présent texte). Il fait partie des faunes froides. Cependant, du côté Ouest du Rhin, à Mannlefelsen I (Bridault, 1993), il est absent durant cette oscillation. Parmi la petite faune sauvage à fourrure, le rongeur est le seul à être totalement absent de la séquence Epipaléolithique à Mésolithique, dont du niveau azilien (charnière Dryas III/ Préboréal).
Dans les zones humides situées plus au Nord (région du Holstein) en revanche, le castor pourrait être une espèce nouvellement exploitée à partir du début du Dryas III. Il est absent de Stellmoor au Dryas I mais présent dans le niveau couvrant la période du Dryas III, durant l’Ahrensbourgien (postérieurs à la culture Federmesser, charnière Alleröd/ Dryas III), aux côtés du lemming, du loup, du renard, du lynx et de l’élan. Les sites datés du Dryas I, du Bolling et du Dryas II n’ont pas livré de castor (Bridault, 1993).
Le castor représenté en Allemagne dès l’Alleröd n’est pas attesté avant le Mésolithique ancien sur le plateau suisse. En Suisse occidentale, sur les sites concernant le bassin amont du Rhône, il est par exemple absent du niveau Azilien
de Neufchâtel-Monruz ainsi que
d’Hauterive à la même période, des sites
magdaléniens moyen et final de
Mollendruz 5, Rislisberghöhle ou Champrèveyres (Bridault et al., 2000 : 47-57).
Plus tardivement, l’animal est représenté et exploité dans chaque grande zone du plateau suisse (lac de Zürich à l’Est, Léman et source du Rhône au Sud-Ouest, Birse (Stampfli, 1979 : 97-105) et Jura Souabe au Nord de la zone). Il est faiblement signalé au Mésolithique
mais très abondamment au Néolithique (Liarsou, 2012).
Il est difficile d’admettre, dans l’état actuel des recherches, que les populations de l’Ouest aient conquis les plaines du Rhin, de l’Elbe et de l’Oder ainsi que les sources du Danube de cette façon. Il est possible de suggérer que ce soient les populations de l’Est qui aient gagné ces territoires en premier, après le Dryas II. Dans le Brandebourg (Elbe moyen), le castor est représenté au Mésolithique à Friesack (Teichert, 1994 : 213-221) par 4 % du NR16 total composé de 4397 restes, ainsi que sur l’Oder.
Dans l’état actuel de notre corpus, aucun site de l’Ems ou de la Weser ne livre de castor au Tardiglaciaire ou au Mésolithique. L’animal est bien signalé sur le bassin moyen du Rhin, du côté allemand (Niederbieber, Kettig, site mésolithique de Kleinen-Kalmit ; site de Siebenlinden sur le Neckar, ex : Street et Baales, 1997 : 373-378 ; Wierer et Boscato, 2006 : 95-98). Son exploitation représente entre 1,4 et 2,4 % du NR total de faune.
En France, sur le bassin de la Garonne, l’animal est bien signalé dans la moitié Ouest. Il apparaît au Dryas II en Dordogne. Il est attesté à partir de la fin du Dryas III en Haute-Garonne, dans les Pyrénées Atlantiques et dans les Landes (Dufaure 3, Saint-Martory, Arancou : Fosse, 1999 : 98-113). Il est en revanche absent de plusieurs sites dont l’environnement est potentiellement favorable à la présence du castor ; par exemple, au Magdalénien VI de Faustin (Cessac, Gironde) où l’exploitation des taxons à fourrure est attestée ainsi que la présence du rat d’eau17 (Delpech, 1971 : 328-329). Il en est de même pour le site du Cantet à Espèche (Hautes-Pyrénées), daté de 13 370-10 920 BP. La faune qui y a été identifiée est composée de taxons de milieux arctiques et tempérés dont de nombreux mammifères à fourrure (Clot, 1984 : 33-50). Le castor est également absent des échantillons archéofauniques
de Lortet (Hautes-Pyrénées) au
Magdalénien V, VI et à l’Azilien (Boivin, Clot et Heim, 1986 : 171-197) ; le site
16 Nombre de restes
17 Le campagnol amphibie partage le même type de
biotope que le castor. Il est souvent associé à sa présence.
atteste la présence du chat sauvage, du loup, du renard, du blaireau, de la martre et du lièvre variable.
L’animal n’est pas attesté dans la moitié Est du bassin de la Garonne malgré le nombre de sites paraissant pouvoir l’accueillir et en dépit du fait que de nombreux taxons à fourrure et quelques taxons aquatiques sont exploités : à Alliat (Ariège) par exemple, l’animal est absent des couches magdaléniennes moyennes et finales (13 770-12 540 BP ; fin du Bolling, Dryas II). De nombreuses espèces à fourrure sont exploitées, espèces de climat froid et tempéré. Le castor n’est-il pas encore arrivé dans la région à cette période ? Il en est de même pour Belvis (Aude) qui enregistre durant le Magdalénien supérieur vers 12 300 BP n. C. la présence de taxons à fourrure et celle du rat taupier, qui indique la proximité de zones humides. A la grotte Gazel (Aude), au Magdalénien moyen, la faune à dominante froide comporte des taxons aquatiques, dont le rat taupier18 dans un niveau daté de 10 700 BP n. C. Pourtant, le castor n’est pas signalé. Cela plaide en faveur d’une arrivée tardive du castor dans la région (Pailhaugue, 1995 : 225-289 ; Crémadès, 1997 ; 455-469 ; Fontana, 1999 : 175-190 ; Sacchi, 1986 : 196). De plus, l’animal n’est toujours pas signalé dans les niveaux Épi-magdalénien et Azilien vers 10 700 BP.
Plus au Nord, nous remarquons l’absence du castor sur le site du Pech à Cavaniès (Lot) au Magdalénien final (Dryas II). Les archéofaunes de ce réseau karstique enregistrent la présence de rat d’eau. Le castor semble globalement absent des faunes à dominante très froide,
même ceux comprenant des
environnements marécageux.
Les Pyrénées basques ne
représentent pas une frontière par rapport aux faunes de la région cantabrique. Il est
possible que le castor ait
préférentiellement remonté d’Espagne vers le Nord par la zone de l’Adour ; cela est envisageable au vu de la répartition des sites archéologiques attestant sa présence : il est principalement identifié sur
18 Le Grand campagnol est très fréquemment associé à la
les sites tardiglaciaires de ce bassin19 et sur la zone Nord-Est située dans le prolongement de celui-ci. Le castor est absent des niveaux magdalénien final du site de Sordes-l’Abbaye et apparaît à l’Azilien vers 12 200 BP. Si cette présence traduit une migration, cette migration potentielle a correspondu aux phases de refroidissement du Dryas III (Delpech, 1978 : 108-116).
Si, par comparaison, le castor est plus fréquemment signalé sur les sites tardiglaciaires et épipaléolithiques que sur les sites mésolithiques, ces derniers sont en valeur absolue plus nombreux à attester sa présence. Notre corpus comporte 18 sites épipaléolithiques contre 32 sites mésolithiques. Sur les sites pléniglaciaires, il est en revanche totalement absent. Cette absence est significative puisque notre corpus comporte 109 sites.
Les proportions d’exploitation du castor sur chaque site sont peu importantes ; elles sont toutefois similaires à celles des autres taxons à fourrure. Exceptionnellement, le nombre de restes peut dépasser 20 (ex : à Bourouilla, Pyrénées-Atlantiques) voire 50 (ex : à Pont d’Ambon, Dordogne Gagnière, 1972 : 489 ; Combier, 1978 : 628). Dans le Lot, le castor n’est plus lisible au Sauveterrien moyen malgré la diversité des taxons à fourrure exploités. La présence du rongeur est globalement enregistrée de manière continue du Dryas II au Préboréal, en passant par l’Alleröd et le Dryas III. L’animal est faiblement exploité sur chaque site mais, là encore, il existe quelques exceptions puisque le castor représente 0,6 % des restes de Saint-Martory (Haute-Garonne), 5 % de la faune dans les niveaux sauveterriens de Fontfaurès (Lot) et jusqu’à 17,2 % (Martin, 1991 : 33-41).
Le castor est peu signalé dans le Sud-Ouest de la France en proportion des régions de l’Est (bassin du Rhône du Tardiglaciaire jusqu’au Néolithique). Ses populations ne semblent plus se développer ; du moins, pour ce que l’archéologie permet d’en connaître, le castor ne fait plus l’objet d’une exploitation autre que ponctuelle par les
19 Dans cette microrégion de l’Adour, il y a relativement peu
de sites. Le type de peuplement Magdalénien apparaît rarement en plein air. Les grottes sont plus nombreuses (Isturitz, Duruthy, Dufaure, Brassempouy, Aitzbitarte IV).
groupes humains dès la fin du Mésolithique. Malgré le nombre de sites néolithiques du corpus, le rongeur est faiblement représenté.
Actuellement, l’animal n’occupe que très peu cette zone du grand Sud-Ouest malgré le succès global des initiatives de réintroduction et son expansion sur l’ensemble des bassins de l’Ouest de l’Europe.
Sur le bassin moyen du Rhône, les
premières occupations humaines
postérieures au retrait glaciaire remontent au Magdalénien moyen, vers 17 900-16 900 BP. Elles se cantonnent à l’Ouest de l’arc jurassien. Ce n’est qu’au Magdalénien supérieur, entre 15 400 et 13 900 BP n. C. (Bolling-Dryas II) que l’ensemble de la région est occupé. Nous n’avons donc que peu de sites würmiens, dont certains mentionnent la présence du castor antérieurement au maximum glaciaire. Nous ne disposons d’aucun site du Dryas Ia mais le castor commence à être signalé à partir de la toute fin du Dryas Ib en Haute-Savoie dès 13 400 BP (Musièges) ; à Ranchot (Franche-Comté), vers 12 600 BP (Bolling/Dryas II), dans l’Isère vers 12 500 BP (Colomb, Méaudre), à Chinchon (Vaucluse) vers 12 000 BP, présentant un climat très froid et humide (Leduc, 2005 : 27 ; Crégut-Bonnoure, 1992 : 9-13 ; Crégut-Bonnoure et Paccard, 1997 : 391-407). L’animal reste présent au Dryas III dans le massif jurassien, même dans les niveaux à forêt très clairsemée dominée par le pin de Rochedane (Doubs, Azilien)20.Il est également présent au Dryas III en Savoie (Bridault, 1993).
À la transition entre le Tardiglaciaire et l’Holocène, les sites montagneux où l’animal est représenté ne sont pas les plus boisés. Il est fréquent dans les zones à faible couverture végétale (Ranchot, Rochedane B et C1, Grande-Rivoire D, Chataillon, Dufaure 3) voire en terrain steppique (Ranchot, Rochedane A3 et A4, Rond du Barry D). Les sites peuvent être froids à tempérés. L’animal est cependant absent des sites ou des niveaux stratigraphiques pour lesquels les conditions glaciaires sont les plus extrêmes.
20 Il est absent des niveaux les plus anciens (pelouses, climat
froid, débit très irrégulier du Doubs) mais présent par la suite (forêt froide et humide de conifères, apparition progressive des feuillus qui restent clairsemés jusqu’au Mésolithique).
Sur l’ensemble du bassin, il est attesté sur toute la séquence postérieure au Dryas I (Bolling, Dryas II, Alleröd, Dryas III pour le Jura méridional, Préboréal, Boréal) ; cela suggère une disparition ou quasi-disparition du castor sur le Rhône jusqu’au Dryas I, au moins dans le Nord du bassin, et une reconquête à partir du Nord-Est de la zone.
En Vaucluse, le castor constitue une ressource clef des populations du paléolithique supérieur ; il est associé au renne et à la marmotte pendant les phases froides. La zone du Valat a sans doute été favorable à l'installation du castor, puisque plusieurs sites attestent de sa présence (Crégut-Bonnoure, 1992 ; Crégut-Bonnoure et Paccard, 1997 : 391-407).
Du Magdalénien à l’Azilien, les conditions environnementales semblent favorables au castor. Par la suite, à partir du Magdalénien supérieur et surtout au Mésolithique, une lente raréfaction de la végétation se produit dans les vallées. Le paysage se déboise, le régime des cours d’eau devient intermittent et le climat devient sec et contrasté avec de longues périodes de sécheresse estivale. Le castor, qui était jusqu’alors associé à des espèces caractéristiques du Paléolithique supérieur comme le renne et la marmotte disparaît des occupations épipaléolithiques et mésolithiques.
Brochier (1982 : 23-27) émet l’hypothèse que l’extension de vastes espaces découverts dans les vallées et l’extrême irrégularité du régime des cours d’eau au cours de cette période est la cause d’une régression locale des populations de castors. Les forêts se
seraient peu développées au
Magdalénien à cause du froid et encore moins au Mésolithique à cause de la sécheresse, les zones boisées ayant été circonscrites aux hauteurs du plateau du Vaucluse et/ou de celui du Lubéron. L’espace forestier aurait ainsi été davantage freiné au Mésolithique par la sécheresse qu’au Magdalénien final par le froid21.
21 Il n’y a vraisemblablement pas de changement qualitatif
des principaux biotopes en Vaucluse entre le Tardiglaciaire et l’Holocène. Les forêts et les espaces découverts cohabitent mais leurs positions respectives subissent une inversion : au Magdalénien supérieur, les forêts occupent des zones-refuges au fond des vallées sur des surfaces limitées, tandis qu’au Paléolithique final et au Mésolithique, les forêts
L’hypothèse du maintien des grandes faunes forestières grâce au boisement des ripisylves, malgré un assèchement progressif durant le Préboréal et le Boréal semble être infirmée dans le Vaucluse. Du Sauveterrien au Castelnovien, une diminution des espèces forestières de 40 % à 28 % est estimée, notamment par les indices indirects que représentent la diminution/disparition des occurrences de certaines espèces comme le chevreuil et le castor. À l’inverse de la situation de la Garonne, le castor accuse une nette régression de ses populations au Mésolithique22. Il est présent sur 36 % des sites tardiglaciaires contre 23 % au Mésolithique, sachant que le nombre total de sites de notre corpus passe de 23 à 37. En remontant vers les marges jurassiennes, le castor semble apparaître au Dryas II/III (Bridault, 1993).
À Vallon-Pont-d’Arc, le castor est absent de 14 500 BP à 12 150 BP n. C. sur toute la séquence couvrant le Bölling et l’Alleröd. Il est représenté à l’Azilien sur ce site23. En revanche, l’animal est dessiné sur une des parois de la grotte d’Ebbou (la gravure a été attribuée au Magdalénien III). Ceci semble indiquer que le castor était présent dans l’univers mental de
certains groupes paléolithiques
tardiglaciaires du Dryas II (Chabredier, 1992 : 1-14) en Ardèche. Le rongeur est faiblement exploité sur chaque site, puisqu’il fournit entre 0,1 et 0,7 % du NMI (à l’exception du site de Ranchot, avec 2,5 %). L’exploitation est un peu plus importante au Mésolithique (Leduc, 2005).
Enfin, si l’animal est représenté précocement sur les sites jurassiens, il est totalement inexploité sur ceux du plateau occidental de la Suisse, comme déjà évoqué. Il est peu signalé au Mésolithique, côté Rhône comme côté Rhin.
Sur le bassin de la Loire, l’animal est très peu signalé. Il est possible que l’exploitation du castor soit relativement tardive dans la Haute-vallée de la Loire puisque le rongeur n’y apparaît qu’au Magdalénien final (Rond du Barry, absent
quittent le fond des vallées et colonisent les plateaux, ce qui implique une augmentation globale de la surface boisée.
22 Peut-être du fait de l’instabilité hydrologique qui est
susceptible de s’être étendue à l’ensemble du bassin du Rhône.
dans les couches antérieures). C’est le site le plus ancien attestant de l’exploitation du castor sur ce bassin (Poulain, 1972 : 58-68).
Le rongeur apparaît à l’Azilien pendant le Dryas III vers 10 900 BP n. C. Dans, semble surprenante. L’hypothèse qu’entre les plus hautes altitudes du Massif central et les plaines vendéo-aquitaines, existait un domaine refuge pendant la fin de la glaciation est envisageable. Cette zone pourrait avoir constitué une voie de colonisation préférentielle pour le castor entre la Garonne et le bassin de la Loire24. Pourtant, le castor semble effectuer sa remontée sur la Loire par le Massif Central entre Garonne, Rhône et Loire, en dépit du fait que la Charente ait pu constituer dès le Tardiglaciaire une région très favorable à une reconquête de l’espèce de par sa végétation et son climat plus clément. Le castor est en effet manifestement absent de cette région d’après le nombre de sites de notre corpus. Il n’est lisible qu’à partir du Néolithique.
Le castor aurait été identifié dès 12 500 BP (Bölling) sur la Meuse mais la datation est incertaine ; les autres sites attestant sa présence sont mésolithiques. Sur ce bassin, les taux d’exploitation présentent une forte variabilité, oscillant entre 1 et 4,3 %. Le corpus est peu fourni. La progression des populations sur les
bassins français par les zones
méditerranéennes semble indépendante de celle qui s’opère au Nord-Est sur le bassin Rhin-Meuse.
Sur le bassin de la Seine, le castor apparaît au Mésolithique. Le nombre de sites attestant sa présence est très peu élevé. Il est absent de l’ensemble des sites tardiglaciaires de notre corpus. Pour l’ensemble Seine/Somme, il est signalé sur 20 % des sites mésolithiques. Globalement, les spectres de faune mettent en évidence une diminution de la chasse dirigée vers la petite faune à fourrure. La proportion de sites paléolithiques comme
24 Les analyses polliniques attribuées au Tardiglaciaire dans la
région charentaise, attestent de la réapparition brusque d’un ensemble d’arbres dont certains ont des exigences thermiques importantes tels le pin maritime (Pinus pinaster), le chêne pubescent (Quercus pubescens) et le chêne vert (Quercus ilex).
mésolithiques présentant du castor est très faible, à l’inverse des régions plus au Sud25. Sur la Somme, le castor apparaît durant l’Epipaléolithique (Saleux, Les Baquets, au Federmesser, Crouy). Il est faiblement exploité. Le corpus est peu étoffé. L’animal est absent de plusieurs sites Federmesser dont Hangest III (12ème millénaire BP). A
Hangest, le rongeur constitue
vraisemblablement une ressource
nouvellement exploitée à partir de 10 000 BP n. C., puisqu’il est attesté dans les couches postérieures (Hangest II). Sur le bassin de la Moselle, le site mésolithique de Loschbour atteste de la présence du castor (Bridault, 1993).
D’après la synthèse des données archéologiques, l’hypothèse minimale formulable est qu’au moins deux foyers de reconquête existent, à l’Est et à l’Ouest (par la zone méditerranéenne).
Il reste difficile d’être certain de l’origine des populations situées dans les plaines bordant la Mer Baltique et la Mer du Nord. La progression semble moins rapide à l’Ouest qu’à l’Est.
Il est vraisemblable que le bassin de la Garonne ait été recolonisé par l’Espagne ; celui du Rhône par des populations résiduelles et celui de la Loire par des contacts probables au niveau du Massif Central, et non par l’espace des plaines bordant le golfe de Gascogne.
Il est difficile de détailler la reconquête du Nord de la France et de la Belgique, étant donné que le castor n’est exploité qu’à partir du Mésolithique sur le bassin de la Seine, alors qu’il est par ailleurs déjà représenté à l’Epipaléolithique sur la Somme et encore antérieurement à l’Est sur la Meuse, affluent du Rhin.
Sa lisibilité tardive sur le plateau Suisse, du côté du Rhin comme du Rhône empêche également de préciser la colonisation de cette zone potentielle de rencontre entre populations du Sud-Ouest et du Nord-Est. Le rongeur peut être un arrivant tardif dans ces zones humides périglaciaires/issues du retrait glaciaire.
Fig. 2. Cartographie des sites du Paléolithique final et du Mésolithique, France et marges
25 Peu d’espèces plaident en faveur de chasses dans des
environnements rivulaires par les groupes magdaléniens de la zone.
2.3 Synthèse des données archéologiques concernant la recolonisation de l’Europe du Nord
Le castor est souvent associé par les archéologues à la caractérisation d’un milieu humide et relativement tempéré. Pourtant, il n’est pas un bon indicateur du climat et de la végétation. Comme nous l’avons déjà évoqué, il crée lui-même les conditions favorables à l’occupation d’un territoire ; il est cavernicole en zone karstique lorsque les rivières sont périodiquement asséchées ; de plus, sa dépendance à l’eau est indirecte. L’élément lui sert principalement à transformer le paysage végétal et à refroidir son corps. La possibilité de faire des réserves (provisions d’hiver, même sous la glace) lui permet enfin de coloniser des zones très froides (cf. Vadrot, 2000 ; Erome, 1982).
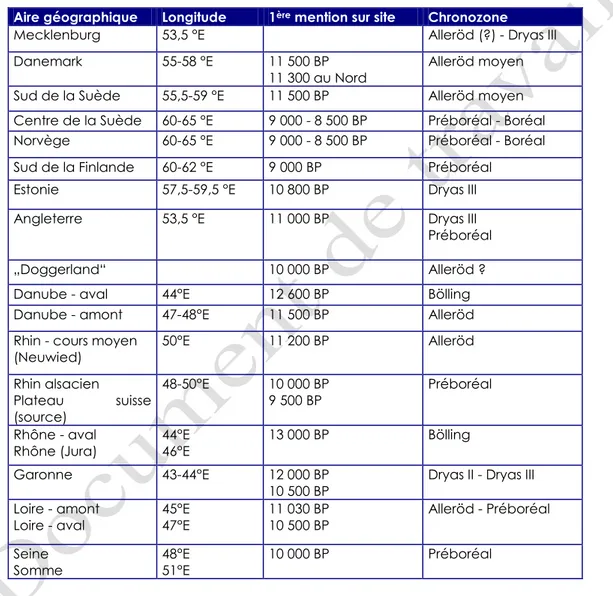
Au Danemark, le castor apparaît à l’Alleröd moyen (11 500 BP), à l’instar de l’ours, de l’élan et du glouton. Sa présence précoce est signalée par Aaris-Sorensen (2009 : 12) qui précise que la plus ancienne mention appartient au site de Bromme (Sjaelland). Le rongeur est représenté à Norre Lyngby entre 11 300 et 11 200 BP26. Le site couvre la période de l’Alleröd moyen et récent. Le paysage est composé de forêts boréales et de steppes. La latitude plus élevée de cette zone par rapport aux sites de l’Allemagne du Nord tend à suggérer que l’apparition du castor en Allemagne du Nord n’a pas été concomitante de sa chasse par les groupes humains27.
Dans le sud de la Scandinavie, en Suède, le castor apparaît en même temps que les taxons Megaloceros, Alces et Ursus vers 11 500 BP (c’est-à-dire 1 500 ans après la glaciation et à 350 km minimum du front de glace, durant la période de l'Alleröd
26 A titre indicatif, la loutre n’apparaît au Danemark que vers
9 500 BP (Boréal).
27 Le rongeur devait être présent en Allemagne
antérieurement aux premières mentions archéologiques attestant son exploitation. La représentation du castor plus tôt dans les assemblages de faune d’Europe du Nord pourrait vouloir dire que cette ressource a été plus rapidement et plus volontiers exploitée par les groupes humains y vivant. D’après les gisements situés plus au Sud, en Allemagne de l’Ouest et du Sud, le castor semble être une ressource tardivement exploitée, à partir du Dryas III. Le lynx et le loup semblent être exploités préférentiellement à partir du Dryas III également.
moyen). Le renne et le loup apparaissent vers 12 500 BP, 500 ans après la glaciation, à 200 km minimum du front de glace. Les conséquences de la détérioration climatique intervenant entre 11 000 et 10 500 BP dans la zone danoise et au sud de la Suède (latitude identique) ne semblent pas affecter la distribution de certaines espèces comme l’élan et le castor28. Hormis ces exceptions, la principale immigration d’espèces dans ces régions du Sud de la Scandinavie semble
se produire pendant la période
correspondant au début du Mésolithique. Le castor est signalé à Gough’s cave, au
Dryas III (Angleterre, latitude
correspondant aux sites du Sud de la Suède).
Au sud de l’Estonie vers 13 500 BP, le retrait du glacier ouvre un espace pour la toundra arctique et la diffusion de plusieurs espèces animales. Trois périodes29 de colonisation majeures semblent
attestées. L’augmentation des
températures et le développement de la transgression marine de Littorina favorisent le renouvellement de la diversité taxonomique. C’est vers 10 800 BP qu’apparaissent le castor, l’ours, la loutre, l’élan, le renard, le loup, le lynx et le lièvre variable. Le castor est ensuite attesté dans des niveaux archéologiques datés du Préboréal (9 500-9 300 BP) et de l’Atlantique (6 500-5 000 BP).
En Finlande, après la glaciation, les premières mentions de faune terrestre proviennent des sites mésolithiques d’Askola (au Sud) et Hydrynsalmi (au Nord-Est). Ces sites sont datés de 9 000 BP et comprennent des restes d'élan, de castor et de lièvre arctique (Ukkonen, 1993 : 253 ; 259). Les premières espèces à coloniser cette zone sont les taxons liés à une forêt pionnière. Elles sont suivies par des espèces
28 A titre indicatif, viennent ensuite le cheval et le bison vers
10 000 BP à 450 km du front de glace puis le cerf, le chevreuil et le sanglier, vers 9 700-9 600 BP (Préboréal), 3 700 ans après la glaciation et 300 ans après le Dryas récent, à 550 km du front de glace. Les premiers restes de ces espèces dans le Sud de la Scandinavie ont été découverts sur les sites maglemosiens correspondant à la période Boréale
(Aaris-Sorensen, 1992 : 143-149). La loutre apparaît vers 9 400 BP
(Aaris-Sorensen, 2000 : 36-44).
29 Le Dryas ancien et l’Alleröd constituent la première
période. Les animaux et la végétation de type périglaciaire (toundra ouverte) occupent l’espace libre des glaces.
associées aux forêts de conifères, comme l'ours, l'écureuil et la martre. Après des oscillations glaciaires puis la déglaciation finale, la faune boréale actuelle a pu coloniser le territoire par l’Est. Le castor est présent dans le pays sur toute la séquence allant de 9 000 à 3 000 BP. Le castor est la seule espèce à couvrir toute cette tranche chronologique parmi une dizaine d’autres (renard, ours, loutre, martre, sanglier, élan, chevreuil, renne, écureuil et lièvre variable).
Le castor est représenté à partir de 9 000-8 500 BP en Norvège et dans la moitié Nord de la Scandinavie (Aaris-Sorensen, 2000 : 36-44).
Fig. 3. Cartographie des sites ayant livré des restes de castor dans la zone Nord de l’Europe
Tabl. 1. Premières mentions archéozoologiques du castor sur les sites postérieurs au Pléniglaciaire en Europe et indications géographiques
Fig. 4. Aperçu cartographique synthétique des aspects de la colonisation tardiglaciaire de l’Europe par le castor
Conclusion
À l’aide des données
archéozoologiques et de la confrontation aux autres sources d’information à disposition (e.g. génétiques,
archéo-botaniques, climatologiques,
éco-éthologiques, démographiques…), les refuges glaciaires et les processus de colonisation de l’Europe tardiglaciaire par le castor peuvent être partiellement appréhendés. Le mammifère semble avoir été l’un des premiers à recoloniser l’Europe après le dernier épisode glaciaire. Ceci serait notamment dû au fait que son régime alimentaire lui a permis de survivre dans de multiples refuges et de s’adapter rapidement aux conditions écoclimatiques du Tardiglaciaire. En l’état actuel de nos connaissances, les données plaident en faveur d’une colonisation rapide de l’Europe Tardiglaciaire, avec des phases d’extension et de régression des populations de castor à partir de refuges glaciaires variés. Cette recolonisation
semble complexe. Il s’agit
vraisemblablement d’un processus
diachronique, aux échelles spatiales multiples, qui ne s’est pas exercé à partir d’un foyer unique ou de quelques foyers « classiques » de dispersion. Nous postulons
l’existence de plusieurs souches déjà formées dans les différents bassins, antérieurement ou pendant l’isolement glaciaire, où il n’y aurait pas eu complète disparition des groupes et suffisamment
d’individus pour recomposer une
population. De nouvelles analyses archéozoologiques apporteront des réponses de plus en plus fines concernant la localisation des zones refuges ainsi que les voies de migration empruntées par l’animal. Le fait que le castor influence l’évolution de la physionomie des cours d’eau et des ripisylves est bien connu (Gurnell, 1998: 167-189 ; Medwecka-Kornas et Hawro, 1993: 611-618 ; Parker, 2001: 77-95). Il est certain que ses capacités éthologiques en ont fait l’une des espèces clefs du Tardiglaciaire et de l’Holocène ; c’est une des raisons pour lesquelles il apparaît pertinent de rechercher à mieux caractériser la répartition de l’animal durant le Tardiglaciaire et tout au long de l’Holocène mais aussi de tenter d’estimer la densité de ses populations durant la Préhistoire.
Bibliographie
Aaris-Sorensen, 1992
Aaris-Sorensen K. – “Deglaciation chronology and re-immigration of large mammals, a south scandinavian example from Late Weichselian – early Flandrian”, Courier Forsch. Inst.
Senckenberg, Frankfurt, 153, 1992 : 143-149.
Aaris-Sorensen, 2000
Aaris-Sorensen K. – “Development of the terrestrial mammal fauna in Fennoscandia after the last glaciation”, in : P. Sandgren (ed.), Environmental changes in Fennoscandia during the