LE MÉTABOLISME DES ACIDES GRAS ET DES
GLYCÉROPHOSPHOLIPIDES CHEZ LES
LYMPHOCYTES T HUMAINS
Thèse
Philippe-Pierre Robichaud
Doctorat en Microbiologie-Immunologie
Philosophiae Doctor (Ph.D.)
Québec, Canada
© Philippe-Pierre Robichaud, 2018
LE MÉTABOLISME DES ACIDES GRAS ET DES
GLYCÉROPHOSPHOLIPIDES CHEZ LES
LYMPHOCYTES T HUMAINS
Thèse
Philippe-Pierre Robichaud
Sous la direction de :
Eric Boilard, directeur de recherche
Marc E. Surette, codirecteur de recherche
iii
Résumé
Les acides gras (AG) polyinsaturés, tels que l’acide arachidonique (AA), sont précurseurs de médiateurs lipidiques impliqués dans nombreux processus biologiques, mais aussi dans la progression de certaines maladies inflammatoires et cancers. La biodisponibilité de ces AG dépend des mécanismes de remodelage qui contrôlent leur incorporation et redistribution dans les glycérophospholipides (GPL) ainsi que leur libération. L’inhibition de la transacylase CoA-indépendante (CoA-IT) a démontré le potentiel du remodelage de l’AA comme cible thérapeutique contre les maladies inflammatoires et prolifératives. Boilard et Surette ont démontré que l’activité de la CoA-IT est induite chez les lymphocytes T humains en prolifération et que son inhibition induit l’apoptose chez ces cellules, mais pas chez celles au repos. Par contre, peu était connu sur les changements dans la composition en AG des GPL suite à l’induction de la prolifération des lymphocytes T et encore moins sur l’identité des enzymes impliquées.
Lors de cette thèse, nous avons premièrement mesuré la composition en AG des GPL chez les lymphocytes T primaires humains au repos et en prolifération, ainsi que chez la lignée lymphocytaire Jurkat. La prolifération des lymphocytes T induit des modifications majeures dans la distribution des AG contenus dans les GPL et les Jurkat ressemble beaucoup plus aux lymphocytes T en prolifération que ceux au repos. Au niveau du contenu en AG des GPL, la plupart des AG ont subi une augmentation significative suite à l’induction de la prolifération, mais ce sont les AG mono-insaturés qui ont subi l’augmentation la plus significative. Contrairement aux autres AG, la masse de l’AA dans les GPL n’a pas été affectée suite à l’induction de la prolifération, mais l’AA a subi une importante redistribution dans les différents GPL. Cette redistribution est non seulement associée à l’induction de l’activité CoA-IT, mais aussi à une importante induction de l’incorporation de l’AA. Nous avons aussi démontré que les cellules T en prolifération et les cellules Jurkat ont une grande capacité d’élongation et de désaturation des AG polyinsaturés de 18 et 20 carbones comparativement aux cellules T au repos.
Afin d’expliquer ces changements, nous avons mesuré l’expression de plusieurs enzymes potentiellement impliquées dans la biosynthèse des AG ainsi que dans le remodelage des AG
iv
polyinsaturés dans les GPL chez les cellules T au repos et en prolifération. Nous avons démontré une induction de l’expression de l’acide gras synthase (FASN), de la stéaroyl-CoA desaturase-1 (SCD1), des désaturases 1 et 2 (FADS1 et FADS2), de l’élongase 5 (ELOVL5) ainsi que plusieurs acyl-CoA-synthétases (ACS), lysophospholipid acyltransférases (LPLAT) et phospholipases A2 (PLA2) chez les cellules T en prolifération comparativement au cellules T au repos. Il est connu que la SCD1 est nécessaire pour la prolifération de plusieurs carcinomes. L’atténuation de la SCD1 chez la lignée Jurkat affecte la désaturation de l’acide palmitique (16:0 vers 16:1 n-7), mais ne semble pas affecter la désaturation de l’acide stéarique (18:0 vers 18:1 n-9) ni la prolifération cellulaire. La stéaroyl-CoA désaturase-5 (SCD5) pourrait être un élément compensateur responsable du maintien de l’acide oléique (18:1n-9) cellulaire et de la prolifération. Nous avons aussi démontré que l’atténuation de l’ELOVL5 chez les cellules T en prolifération et les cellules Jurkat modifie significativement le profil des AG mono-insaturés et polyinsaturés, et bloque efficacement l’élongation des AG polyinsaturés de 18 et 20 carbones, mais n’a eu aucun effet sur la survie et la prolifération. Pour ce qui est des enzymes potentiellement impliquées dans le remodelage de l’AA, leur implication reste à être élucidée et l’identité de la CoA-IT n’est pas encore connue.
Nous avons aussi démontré que l’utilisation d’un analogue de l’AA, l’AA-alcyne, comme outil pour étudier le remodelage de l’AA et la production de médiateurs lipidiques nécessite la prise de certaines précautions, car les enzymes cellulaires ne l’utilisent pas exactement comme l’AA. Nous avons aussi publié une revue discutant des études récentes sur le contrôle de la biodisponibilité des AG polyinsaturés pour la production de médiateurs lipidiques ainsi que les aspects de ce métabolisme qui sont encore inconnus. Une meilleure compréhension du contrôle de la distribution des AG polyinsaturés dans les GPL et de leurs biodisponibilités pourrait mener à la découverte de nouvelles cibles thérapeutiques contre les maladies inflammatoires et prolifératives.
v
Abstract
Polyunsaturated fatty acids (PUFA), such as arachidonic acid (AA), are precursors of bioactive lipid mediators involved in several biological processes, but also in the progression of certain inflammatory diseases and cancers. The availability of these fatty acids (FA) depends on the remodeling mechanisms that control their incorporation and redistribution in glycerophospholipids (GPL) as well as their release. Inhibition of CoA-independent transacylase activity (CoA-IT) has demonstrated the potential for the remodeling of AA as a therapeutic target against inflammatory and proliferative diseases. Boilard and Surette demonstrated that CoA-IT activity is induced in proliferating human T lymphocytes and that its inhibition only induces apoptosis in proliferating T cells and not in resting cells. On the other hand, little was known about the changes in the FA composition of the GPL following the induction of the proliferation of the T lymphocytes and still less on the identity of the enzymes involved.
In this thesis, we first measured GPL FA composition in resting and proliferating human primary T lymphocytes as well as in the Jurkat lymphocyte cell line. The activation of the T cells proliferation induces major changes in the FA profile contained in the GPL and the Jurkat line resembles much more proliferating T lymphocytes than resting T cells. At the level of the FA content of the GPL, the mass of most FA has increased significantly following the induction of proliferation, but the monounsaturated FA has the most significant increase. Unlike other FA, the total mass of AA in cellular GPL was not affected by T-cell proliferation induction, but the AA was significantly redistributed in the different classes and subclasses of GPL. This redistribution is not only associated with the induction of CoA-IT activity, but also a significant induction of the incorporation of AA in GPL. We have also demonstrated that proliferating T cells and Jurkat cells have a very high capacity for elongation and desaturation of PUFA omega-3 and omega-6 of 18 and 20 carbons compared to resting cells.
To explain these observations, we measured the expression of several enzymes potentially involved in the biosynthesis of FA and in the GPL remodeling in resting and proliferating T cells. We have demonstrated an induction of the fatty acid synthase (FASN), the stearoyl-CoA desaturase-1 (SCD1), the fatty acid desaturases 1 and 2 (FADS1 and FADS2), the fatty
vi
acid elongase 5 (ELOVL5) as well as several acyl-CoA synthetases (ACS), lysophospholipid acyltransferases (LPLAT) and phospholipases A2 (PLA2) expression in proliferating T cells compared to resting T cells. Many carcinoma cells require the stearoyl-CoA desaturase-1 (SCD1) to proliferate. The knockdown of SCD1 in Jurkat cell line affects the desaturation of palmitic acid (16:0 to 16:1 n-7), but does not appear to affect the desaturation of stearic acid (18:0 to 18:1 n-9) and cell proliferation. The stearoyl-CoA desaturase-5 (SCD5) could be a compensating element responsible for maintaining cellular oleic acid (18:1 n-9) and proliferation capacity. We also demonstrated that the ELVOL5 knockdown in proliferating T cells and Jurkat cells significantly altered the profile of monounsaturated and polyunsaturated FA and effectively blocks the elongation of 18 and 20 carbon PUFA, but had no effect on survival and proliferation. For the enzymes potentially involved in the remodeling of AA, their involvement remains to be elucidated and the identity of the CoA-IT is not yet known.
We have also demonstrated that the use of an AA analogue, AA-alkyne, as a research tools to study the remodeling of AA and the production of lipid mediators requires certain precautions because it is not used by cellular enzymes exactly like AA. We also published a review discussing recent studies on the control of the availability of PUFA to produce lipid mediators in inflammatory cells as well as aspects that remain unknown. A better understanding of the control of the distribution of PUFA in GPL and their availabilities could lead to the discovery of new therapeutic targets for the treatment of inflammatory and proliferative diseases.
vii
Table des matières
Pages
Résumé ... iii
Abstract ... v
Liste des Tableaux ... ix
Liste des Figures ... x
Liste des abréviations ... xiii
Dédicace ... xiv
Remerciements ... xv
Avant-propos ... xvi
1. CHAPITRE I: Introduction ... 1
1.1. Introduction générale ... 1
1.2. Les acides gras et leurs biosynthèses ... 1
1.3. Les médiateurs lipidiques bioactifs et l’inflammation ... 4
1.4. Les glycérophospholipides membranaires et leur métabolisme ... 7
1.4.1. Les glycérophospholipides membranaires ... 7
1.4.2. La biosynthèse et le remodelage CoA-dépendent des glycérophospholipides ... 8
1.4.3. Le remodelage CoA-indépendant des glycérophospholipides ... 10
1.4.4. L’inhibition de la transacylase CoA-indépendante ... 11
1.4.5. Les enzymes potentiellement impliquées dans le remodelage des glycérophospholipides ... 13
1.5. La synthèse des acides gras, le remodelage des glycérophospholipides et la prolifération cellulaire ... 18
1.6. La synthèse des acides gras et le remodelage des glycérophospholipides chez les lymphocytes T ... 18
2. CHAPITRE II: Hypothèses et objectifs de recherche ... 21
3. CHAPITRE III: Fatty acid remodeling in cellular glycerophospholipids following the activation of human T cells ... 22
3.1. Résumé ... 23 3.2. Abstract ... 24 3.3. Introduction ... 25 3.4. Experimental procedures ... 27 3.5. Results ... 32 3.6. Discussion ... 50 3.7. Supplemental data ... 55 3.8. Abbreviations ... 58 3.9. Acknowledgements ... 59 3.10. References ... 59
4. CHAPITRE IV: The role of Stearoyl-CoA desaturase in proliferation maintenance of human leukemic Jurkat T cells ... 65
4.1. Résumé ... 66
4.2. Abstract ... 67
4.3. Introduction ... 68
4.4. Materials and methods ... 69
4.5. Results ... 71
viii
4.7. Abbreviations ... 77
4.8. Aknowledgements ... 77
4.9. References ... 78
5. CHAPITRE V: Polyunsaturated fatty acid elongation and desaturation following activation of human T cells: ELOVL5 is responsible for fatty acid elongation ... 81
5.1. Résumé ... 82
5.2. Abstract ... 83
5.3. Introduction ... 84
5.4. Materials and methods ... 86
5.5. Results ... 90
5.6. Discussion ... 105
5.7. Supplemental data ... 110
5.8. Aknowledgements ... 113
5.9. References ... 114
6. CHAPITRE VI: On the cellular metabolism of the click chemistry probe 19-alkyne arachidonic acid ... 117
6.1. Résumé ... 118
6.2. Abstract ... 119
6.3. Introduction ... 120
6.4. Materials and methods ... 123
6.5. Results ... 127 6.6. Discussion ... 135 6.7. Supplemental data ... 141 6.8. Abbreviations ... 148 6.9. Acknowledgements ... 148 6.10. References ... 148
7. CHAPITRE VII: Polyunsaturated fatty acid–phospholipid remodeling and inflammation ... 153
7.1. Résumé ... 154
7.2. Abstract ... 155
7.3. Introduction ... 156
7.4. Turnover of polyunsatured fatty acids ... 157
7.5. Acyl-CoA synthetases ... 160 7.6. Lysophospholipid acyltransferases ... 162 7.7. Phospholipases A2 ... 164 7.8. Conclusion ... 165 7.9. Key Points ... 165 7.10. Abbreviations ... 166 7.11. Acknowledgements ... 166
7.12. Financial support and sponsorship ... 166
7.13. Conflicts of interest ... 166
7.14. References ... 166
8. CHAPITRE VIII: Discussion ... 169
9. CHAPITRE IX: Conclusion et perspectives ... 179
ix
Liste des Tableaux
Page Table 1.1. Les phospholipases A2 et leur dépendance en calcium ... 14
Table 1.2. La diversité des lysophospholipides acyltransférases ... 16
Table 3.1. List of primer sequences used in qPCR experiments for each
transcript ... 31
Table 3.2. Gene expression of selected enzymes in resting and proliferating T cells ... 34
Table 3.3. Supplemental Table SI. Fatty acid composition glycerophospholipid sub-classes of resting and proliferating T cells ... 58
Table 4.1. Fatty acid composition of Jurkat cells with induced SCD1
knockdown ... 73
Table 5.1. List of primer sequences used in qPCR experiments and product size in base pairs (bp) for each of the indicated transcripts ... 87
Table 5.2. Gene expression of selected enzymes in resting and proliferating T cells ... 95
x
Liste des Figures
Pages Figure 1.1. Les voies métaboliques de la biosynthèse des acides gras saturés et
mono-insaturés ... 2
Figure 1.2. Les voies métaboliques de la biosynthèse des acides gras
polyinsaturés ... 3
Figure 1.3. Structures moléculaires de l’acide arachidonique (AA), l’acide
éicosapentaénoïque (EPA) et de l’acide docosahexaénoïque (DHA) ... 4
Figure 1.4. Les phases de l’inflammation et les voies métaboliques de la
biosynthèse des médiateurs lipidiques impliqués dans l’inflammation. ... 5
Figure 1.5. La structure générale des glycérophospholipides ... 7
Figure 1.6. Les voies métaboliques de la biosynthèse des glycérophospholipides ... 8
Figure 1.7. Schéma illustrant la biosynthèse et le remodelage CoA-dépendant des
glycérophospholipides ... 9
Figure 1.8. Schéma illustrant la biosynthèse et les remodelages CoA-dépendant
et CoA-indépendant des glycérophospholipides ... 10
Figure 3.1. Schematic representation of fatty acid (FA) and glycerophospholipid
(GPL) biosynthesis and remodeling. ... 26
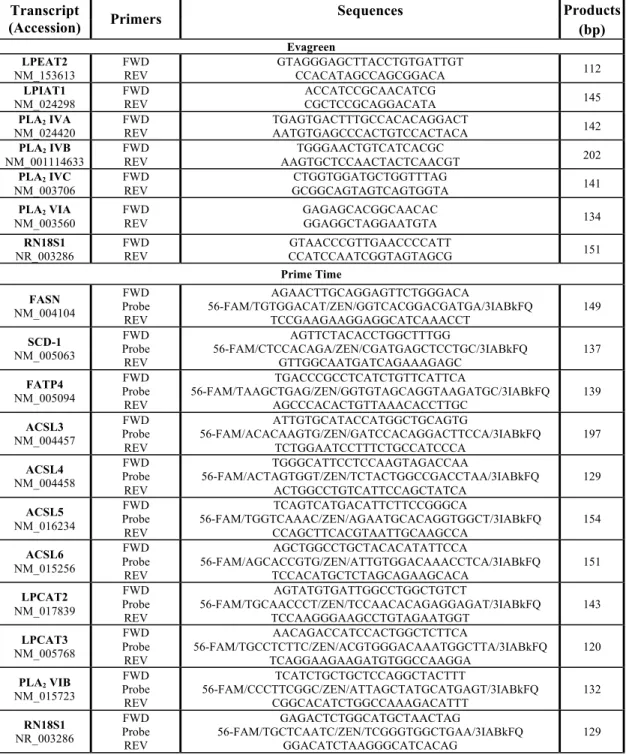
Figure 3.2. The mass content of fatty acids (A) and the fatty acid distribution (B)
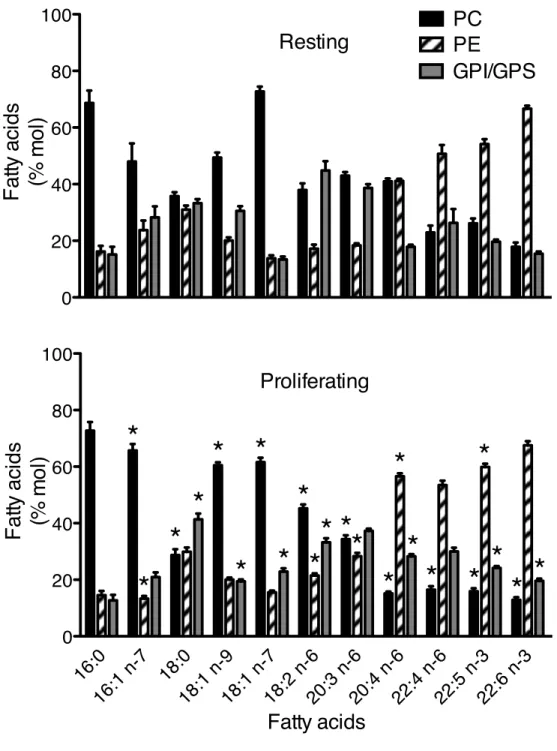
in total glycerophospholipid from resting and proliferating T cells. ... 33
Figure 3.3. Fatty acid synthase (FASN) and stearoyl-CoA desaturase 1 (SCD1)
expression in resting and proliferating T cells. ... 35
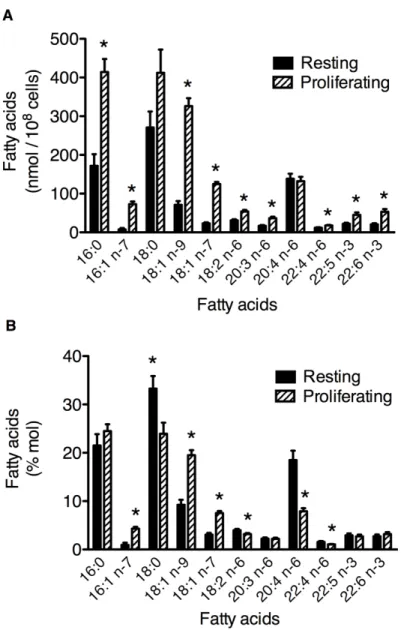
Figure 3.4. Total fatty acid content (A) and the fatty acid distribution (B) of
glycerophospholipid (GPL) classes from different cell populations. ... 36
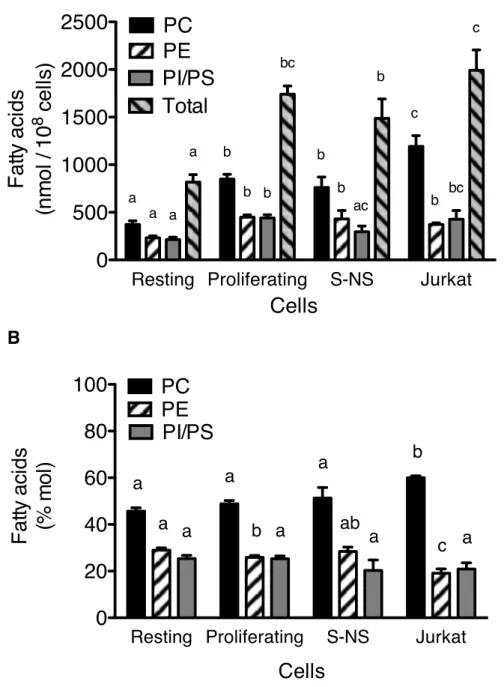
Figure 3.5. The distribution of fatty acids within glycerophospholipid (GPL)
classes from different cell populations. ... 38
Figure 3.6. The mass content of fatty acids within glycerophospholipid (GPL)
classes of resting and proliferating T cells. ... 40
Figure 3.7. The distribution of fatty acids between glycerophospholipid (GPL)
classes of resting and proliferating T cells. ... 42
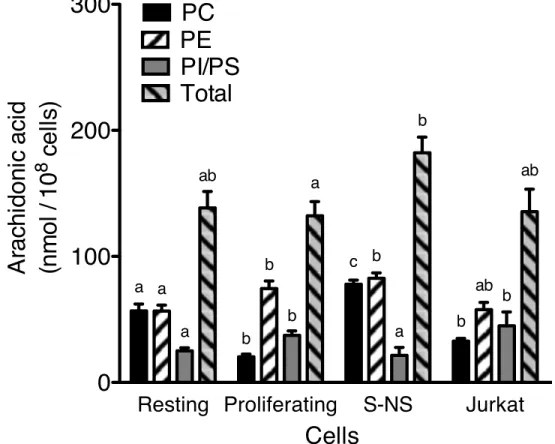
Figure 3.8. Arachidonic acid mass content in glycerophospholipid (GPL) classes
from different cell populations. ... 43
Figure 3.9. Arachidonic acid composition of glycerophospholipid (GPL)
sub-classes from resting and proliferating T cells. ... 44
Figure 3.10. Arachidonate-phospholipid remodeling in resting and proliferating
T cells. ... 46
Figure 3.11. Arachidonoyl-CoA synthetase (A), lysophosphatidylcholine
acyltransferase (B), lysophosphatidylinositol acyltransferase (C) and lysophosphatidylethanolamine (D) activities in resting and
proliferating human T cells. ... 48
Figure 3.12. Lysophospatidylcholine acyltransferase 3 (LPCAT3),
lysophospatidylinositol acyltransferase 1 (LPIAT1) and phospholipase A2 IVC (PLA2) expression in resting and
proliferating T cells. ... 49
Figure 3.13. Supplemental Figure SI. Cell cycle analysis of proliferating and
xi
Figure 3.14. Supplemental Figure SII. Lipid phosphorus composition (A) and
lipid phosphorus distribution (B) of glycerophospholipid (GPL) classes from resting and proliferating T cells. ... 56
Figure 3.15. Supplemental Figure SIII. Arachidonic acid distribution between
glycerophospholipid (GPL) classes for resting, proliferating and S-NS T cells and for Jurkat cells. ... 57
Figure 4.1. Activation of knockdown in Jurkat cell clones induces diminution in
SCD1 protein expression. ... 72
Figure 4.2. SCD1 knockdown and cell proliferation in Jurkat cell clones. ... 74 Figure 5.1. The metabolic pathway of the n-6 and n-3 families of PUFA. ... 85
Figure 5.2. The percent distribution of n-6 and n-3 fatty acids in resting T cells,
proliferating T cells and Jurkat cells following supplementation with different PUFA. ... 91
Figure 5.3. Protein expression of indicated enzymes. ... 96
Figure 5.4. Jurkat cell fatty acid distribution following ELOVL5 knockdown
and supplementations with or without different PUFA. ... 97
Figure 5.5. Primary proliferating T cell fatty acid distribution following
ELOVL5 knockdown with and without supplementation with
different PUFA. ... 99
Figure 5.6. HepG2 cell fatty acid distribution following ELOVL5 knockdown
with and without supplementation with different PUFA. ... 101
Figure 5.7. The elongation of AA-d8 and EPA-d5 following ELOVL5 knockdown
in Jurkat cells, proliferating primary T cells and HepG2 cells. ... 103
Figure 5.8. Supplemental Figure SI. The mass content of n-6 and n-3 fatty acids
in resting T cells, proliferating T cells and Jurkat cells following
supplementation with different n-6 PUFA. ... 110
Figure 5.9. Supplemental Figure SII. Proliferation of Jurkat cells measured
by the CellTrace™ CFSE flow cytometry cell proliferation assay
following ELOVL5 knockdown. ... 111
Figure 5.10. Supplemental Figure SIII. Proliferation of Jurkat cells measured
by the Click-iT® EdU Alexa Fluor® 488 and FxCycle flow
cytometry cell proliferation assay following ELOVL5 knockdown. .... 112
Figure 5.11. Supplemental Figure SIV. Annexin V / propidium iodide (PI) flow
cytometry apoptosis assay. ... 113
Figure 6.1. The structures of arachidonic acid and its clickable analogue
19-alkyne arachidonic acid. ... 120
Figure 6.2. Schematic representation of cellular arachidonic acid
incorporation and metabolism. ... 121
Figure 6.3. The incorporation and elongation of exogenous AA and AA-alk
into Jurkat cells. ... 128
Figure 6.4. Arachidonate-phospholipid remodeling in Jurkat cells. ... 129
Figure 6.5. Eicosanoid biosynthesis by human platelets, neutrophils and
5-LO-transfected HEK293 cells stimulated in the presence of
exogenous AA or AA-alk. ... 131
Figure 6.6. (A) Autocrine stimulation of neutrophils with exogenous AA and
AA-alk and (B) neutrophil chemoattractant activity of LTB4 and
xii
Figure 6.7. Supplemental Figure SI. Gas chromatograms of FAMEs prepared
from Jurkat cells incubated for 2 hours in the absence (A) or
presence (B) of 20 µM AA-alk. ... 141
Figure 6.8. Supplemental Figure SII. HPLC chromatograms of eicosanoids
from human platelets stimulated with calcium ionophore A23187 in the presence of 10 µM AA (A) 10 µM AA-alk (B). ... 142
Figure 6.9. Supplemental Figure SIII. LC-MS/MS analysis of product
identified as 12-HETE-alk. ... 143
Figure 6.10. Supplemental Figure SIV. HPLC chromatograms of eicosanoids
from human neutrophils stimulated with calcium ionophore A23187 in the presence of 10 µM AA (A and C) or 10 µM AA-alk (B and D). . 144
Figure 6.11. Supplemental Figure SV. MS/MS analysis of authentic LTB4. ... 145
Figure 6.12. Supplemental Figure SVI. LC-MS/MS analysis of product
identified as LTB4-alk. ... 146
Figure 6.13. Supplemental Figure SVII. LC-MS/MS analysis of product
identified as 5-HETE-alk. ... 147
Figure 7.1. Schematic representation of glycerophospholipid (PL) biosynthesis,
xiii
Liste des abréviations
GPL Glycérophospholipides
sn- Numérotation stéréospécifique (Stereospecific Numbering)
AG Acide gras
ACC Acétyl-CoA carboxylase
FAS / FASN Acide gras synthase (“Fatty Acid Synthase”)
SCD1 Stéaroyl-CoA desaturase 1 (Delta-9-désaturase)
SCD5 Stéaroyl-CoA desaturase 5 (Delta-9-désaturase)
FADS1 Delta-5-désaturase
FADS2 Delta-6-désaturase
ELOVL5 Élongase 5 (“Elongation of very long chain fatty acid protein 5”)
ELOVL2 Élongase 2 (“Elongation of very long chain fatty acid protein 2”)
16:0 Acide palmitique 18:0 Acide stéarique 16:1 n-7 Acide palmitoléique 18:1 n-9 Acide oléique 18:1 n-7 Acide vaccénique 18:2 n-6 Acide linoléique 18:3 n-3 Acide alpha-linolénique 20:3 n-6 Acide dihomo-gamma-linolénique 20:4 n-3 Acide éicosatétraénoïque
AA Acide arachidonique; acide éicosatétraénoïque; (20:4 n-6)
EPA Acide éicosapentaénoïque (20:5 n-3)
DHA Acide docosahexaénoïque (22:6 n-3)
5-LO 5-Lipoxygénase COX-1 Cyclooxygénase-1 COX-2 Cyclooxygénase-2 LTB4 Leucotriène B4 GPC / PC Phosphatidylcholine GPE / PE Phosphatidyléthanolamine GPI / PI Phosphatidylinositol GPS / PS Phosphatidylsérine Lyso-GPL Lyso-glycérophospholipides
PAF Facteurs activant les plaquettes (Platelet-activating factor, PAF)
GPAT 1-glycérol-3-phosphate acyltransférase
LPAAT Acide lysophosphatidique acytransférase
LPLAT Lysophospholipide acyltransférase
LPLAT Lysophospholipides acyltransférase
LPCAT Lysophosphatidylcholine acyltransférase
LPEAT Lysophosphatidyléthanolamine acyltransférase
LPIAT Lysophosphatidylinositol acyltransférase
LPSAT Lysophosphatidylsérine acyltransférase
ACS Acyl-CoA synthétase
CoA-IT Coenzyme A-indépendante transacylase
PLA2 Phospholipase A2
cPLA2 Phospholipase A2 calcium-dépendante du groupe IV
xiv
À la mémoire de mon père, Jean-Pierre
xv
Remerciements
La présente thèse est le résultat de plusieurs années consacrées à cette recherche. Bien qu’il y ait eu des défis à relever tout au long de ces années, le sujet de cette recherche m’a passionné dès le début et m’a motivé à mettre tous les efforts et le temps nécessaires pour accomplir ce projet.
La réalisation de cette thèse fut possible grâce à l’apport de plusieurs personnes à qui je voudrais témoigner ma reconnaissance. Dans un premier temps, je tiens particulièrement à remercier mon directeur de thèse, Dr. Éric Boilard et mon co-directeur de thèse, Dr. Marc Surette, pour leur disponibilité, leur engagement, leurs judicieux conseils et leur passion qui m’ont permis d’avancer dans ma recherche et de perfectionner mon travail.
Mes remerciements vont également au comité d’évaluation, l’évaluateur externe Dr. Richard Bazinet ainsi que les évaluateurs interne Dr. Sylvain G Bourgoin et Dr. Nicolas Flamand pour avoir accepté d’évaluer cette thèse.
Je désire aussi remercier les assistants de recherche du Dr. Surette, Nathalie Lévesque et Jérémie Doiron, pour leur soutien technique au laboratoire. Je voudrais exprimer ma reconnaissance à mes collègues, co-auteurs et amis, Katherine Boulay, Luc Boudreau, Samuel Poirier, Anissa Belkaid, Eric Allain, Jean-Luc Jougleux, Jean Éric Munganyiki, Maroua Mbarik, Natalie Lefort et Yasmina Néchadi pour leur soutien et leur contribution essentielle à ce projet. Aussi, j’exprime ma reconnaissance envers tous ceux et celles qui ont participé de près ou de loin à l’élaboration de cette recherche.
Enfin, je tiens à témoigner toute ma gratitude à ma conjointe, Mylène, ainsi qu’aux membres de ma famille et à tous mes amis pour leur amour, leur compréhension et leur appui inestimable. Je tiens aussi à saluer mon garçon, Charles-Émile, qui été une importante source de motivation lors de l’écriture de cette thèse.
xvi
Avant-propos
CHAPITRE III: Fatty acid remodeling in cellular glycerophospholipids following the activation of human T cells
Philippe Pierre Robichaud, Katherine Boulay, Jean Éric Munganyiki and Marc E Surette • Cet article fut publié dans le journal J Lipid Res. 2013 Oct;54(10):2665-77.
• Les modifications apportées sont l’insertion des figures et des légendes directement dans le texte des résultats et quelques modifications au niveau du formatage.
• Contribution des auteurs : P.P.R., K.B., et J.E.M. ont contribués aux travaux expérimentaux. P.P.R., K.B., et M.E.S. ont contribués au développement du plan expérimental. P.P.R. et M.E.S. ont écrit le manuscrit.
CHAPITRE IV: The role of Stearoyl-CoA desaturase in proliferation maintenance of human leukemic Jurkat T cells
*Yasmina Néchadi, *Philippe Pierre Robichaud, Eric Boilard and Marc E Surette * Co-premiers auteurs
• Cet article est en préparation et sera soumis sous peu.
• Les modifications apportées sont l’insertion des figures et des légendes directement dans le texte des résultats et quelques modifications au niveau du formatage.
• Contribution des auteurs : P.P.R. et Y.N. ont contribués aux travaux expérimentaux. P.P.R., Y.N., E.B. et M.E.S. ont contribués au développement du plan expérimental et ont écrit le manuscrit.
CHAPITRE V: Polyunsaturated fatty acid elongation and desaturation following activation of human T cells: ELOVL5 is responsible for fatty acid elongation
*Philippe Pierre Robichaud, *Jean Éric Munganyiki, Eric Boilard and Marc E Surette *Co-premiers auteurs
• Cet article a été soumis chez BBA Molecular and Cell Biology of Lipids le 26 Mai 2017, Manuscript Number : BBALIP-17-143.
• Les modifications apportées sont l’insertion des figures et des légendes directement dans le texte des résultats et quelques modifications au niveau du formatage.
xvii
• Contribution des auteurs : P.P.R. et J.E.M. ont contribués aux travaux expérimentaux. P.P.R., J.E.M., E.B. et M.E.S. ont contribués au développement du plan expérimental et ont écrit le manuscrit.
CHAPITRE VI: On the cellular metabolism of the click chemistry probe 19-alkyne arachidonic acid
Philippe Pierre Robichaud, Samuel J Poirier, Luc H Boudreau, Jeremie A Doiron, David A Barnett, Eric Boilard and Marc E Surette
• Cet article fut publié dans le journal J Lipid Res. 2016 Oct;57(10):1821-1830. • Les modifications apportées sont l’insertion des figures et des légendes directement dans le texte des résultats et quelques modifications au niveau du formatage.
• Contribution des auteurs : P.P.R., S.J.P., L.H.B., J.A.D., D.A.B. ont contribués aux travaux expérimentaux. P.P.R., E.B. et M.E.S. ont contribués au développement du plan expérimental et ont écrit le manuscrit.
CHAPITRE VII: Polyunsaturated fatty acid–phospholipid remodeling and inflammation
Philippe Pierre Robichaud and Marc E Surette
• Cet article fut publié dans le journal Current Opinion in Endocrinology, Diabetes & Obesity. 22(2):112-118, April 2015.
• Les modifications apportées sont l’insertion de la figure et de sa légende directement dans le texte et quelques modifications au niveau du formatage.
1
1.
CHAPITRE I: Introduction
1.1. Introduction générale
La prolifération cellulaire nécessite la biosynthèse de glycérophospholipides (GPL), qui sont des composantes majeures des membranes et une importante réserve d’acides gras (AG) polyinsaturés. Les AG polyinsaturés sont précurseurs de médiateurs lipidiques bioactifs impliqués dans plusieurs processus biologiques, mais leurs implications dans l’inflammation ne cessent d’être élucidés. L’inflammation est une importante réponse du système immunitaire contre les pathogènes et pour la réparation des tissus endommagés lors de blessures et d’infections. La progression de l’inflammation est grandement contrôlée par les médiateurs lipidiques bioactifs produits à partir d’AG polyinsaturés, car certains sont de puissantes molécules pro-inflammatoires tandis que d’autres sont anti-inflammatoires [1-6]. Cependant, l’inflammation cause une sensation de chaleur et de douleur qui est associée avec une rougeur et un gonflement de la région atteinte qui peut même aboutir à la destruction et à la perte de fonctions des tissus atteints lors d’inflammation excessive ou chronique. De plus, les médiateurs lipidiques pro-inflammatoires sont généralement impliqués dans la progression de certains cancers, réactions allergiques et maladies inflammatoires chroniques comme l’asthme, l’arthrite rhumatoïde et l’athérosclérose [4-9]. C’est pourquoi vient l’importance d’étudier comment les cellules régulent la biodisponibilité des AG polyinsaturés pour ainsi contrôler la production de médiateurs lipidiques bioactifs. Certaines enzymes qui contrôlent l’incorporation, le stockage et la libération des AG polyinsaturés semblent aussi être des cibles intéressantes contre les maladies prolifératives.
1.2. Les acides gras et leurs biosynthèses
Les AG sont des acides carboxyliques à chaine aliphatique qui diffèrent par leur nombre de carbones et d’insaturations ainsi que par la position de ces dernières. Basé sur le nombre d’insaturation, les AG peuvent être classés en trois grandes familles; les AG saturés qui ne contiennent aucune insaturation, les AG mono-insaturés qui contiennent une seule insaturation et les AG polyinsaturés qui contiennent plusieurs insaturations [10]. La biosynthèse de novo des AG saturés débute par la synthèse de l’acide palmitique (16:0) qui est catalysé par l’acétyl-CoA carboxylase (ACC) et l’acide gras synthase (FAS, Fatty Acid
2
Synthase) tandis que l’acide stéarique (18:0) est produit par l’élongation de 2 carbones à l’acide palmitique (16:0) catalysée par une élongase (Figure 1.1.) [11, 12].
Figure 1.1. Les voies métaboliques de la biosynthèse des acides gras saturés et mono-insaturés.
Les AG mono-insaturés, tels que l’acide palmitoléique (16:1 7) et l’acide oléique (18:1 n-9), sont produits par la désaturation de l’acide palmitique (16:0) et de l’acide stéarique (18:0), respectivement, tandis que l’acide vaccénique (18:1 n-7) est produit par l’élongation de l’acide palmitoléique (16:1 n-7) [11-13] (Figure 1.1). Ces AG saturés et mono-insaturés représentent les AG majoritairement retrouvés chez les cellules animales, mais ces AG peuvent encore subir des élongations. Chez l’humain, on connait maintenant sept élongases (ELOVL1-7) et deux delta-9-désaturases, la CoA désaturase 1 (SCD1) et la stéaroyl-CoA désaturase 5 (SCD5), qui sont responsables de la synthèse des AG saturés et mono-insaturés à partir de l’acide palmitique [11, 14-16]. Plusieurs études ont démontré que les élongases et les delta-9-désaturases ont des préférences envers les différents AG, mais la plupart des études ayant vérifié la spécificité enzymatique de ces enzymes ont procédé à leur surexpression dans des cellules d’origines non humaines.
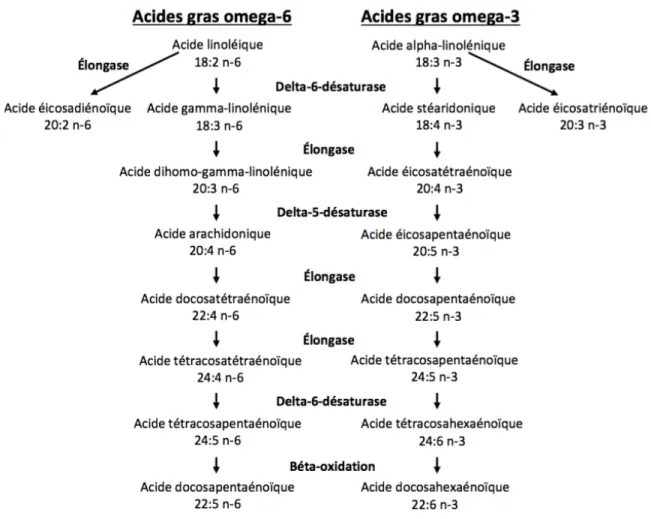
Contrairement aux AG saturés et mono-insaturés, certains AG polyinsaturés sont essentiels car ils ne peuvent pas être entièrement synthétisés par l’organisme et doivent être obtenus par l’alimentation. La majorité des AG polyinsaturés peuvent être divisée en deux familles, les omega-3 et les omega-6, selon la position de leur première liaison double à partir du bout méthyle [10]. Par contre, il est important de noter que l’organisme peut quand même faire certaines conversions en procédant à l’élongation, à la désaturation et à la béta-oxydation des AG polyinsaturés omega-3 et omega-6 [17] (Figure 1.2).
3
Figure 1.2. Les voies métaboliques de la biosynthèse des acides gras polyinsaturés.
Les gènes de la delta-5-désaturase qui catalyse de désaturation de l’acide linoléique (18:2 n-6) et de l’acide alpha-linolénique (18:3 n-3) et de la delta-6-désaturase qui catalyse de désaturation de l’acide dihomo-gamma-linolénique (20:3 n-6) et de l’acide éicosatétraénoïque (20:4 n-3) (Figure 1.2.), FADS1 et FADS2 respectivement, sont les seules enzymes connues pour catalyser ces activités enzymatiques [16, 17]. Pour ce qui est des élongases impliquées dans la synthèse des AG polyinsaturés, plusieurs études ont démontré que l’élongase 5 (ELOVL5) est impliquée dans l’élongation des AG polyinsaturés oméga-3 et oméga-6 de 18 et 20 carbones tandis que l’élongase 2 (ELOVL2) est plutôt impliquée dans l’élongation des AG polyinsaturés oméga 3 et oméga-6 de 20 et 22 carbones [11, 16-21]. Cependant, encore une fois, les études qui ont vérifié la spécificité enzymatique des élongases ont procédé à leur surexpression chez différents types cellulaires d’origine non humaines.
4
Les AG polyinsaturés les plus étudiés sont l’acide arachidonique (AA, 20:4 n-6), l’acide éicosapentaénoïque (EPA, 20:5 n-3) et l’acide docosahexaénoïque (DHA, 22:6 n-3) (Figure 1.3), car ils sont d’importants précurseurs de médiateurs lipidiques bioactifs.
Figure 1.3. Structures moléculaires de l’acide arachidonique (AA), l’acide éicosapentaénoïque (EPA) et de l’acide docosahexaénoïque (DHA).
L’AA est un AG polyinsaturé oméga-6 composé de vingt carbones et de quatre liaisons doubles tandis que l’EPA et le DHA sont des AG polyinsaturés oméga-3 composés de vingt et vingt-deux carbones et de cinq et six liaisons doubles, respectivement (Figure 1.3). Les liaisons doubles de ces AG sont sujettes à l’oxydation enzymatique et non-enzymatique pouvant ainsi produire des centaines de molécules lipidiques différentes. Certaines de ces molécules sont très bien connues due aux diverses réponses biologiques qu’elles engendrent, car ces molécules agissent généralement comme molécules de signalisation cellulaire.
1.3. Les médiateurs lipidiques bioactifs et l’inflammation
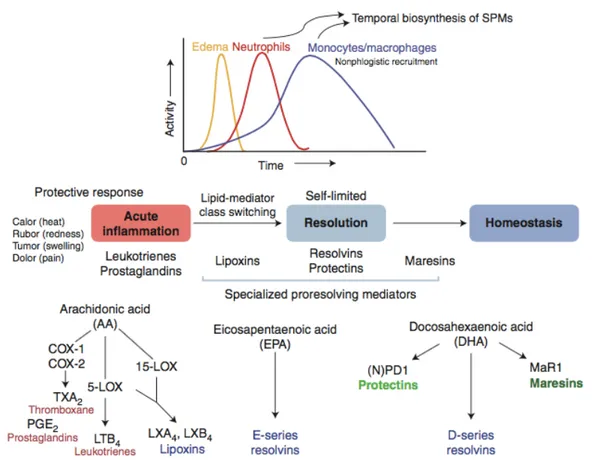
Le processus d’une réaction inflammatoire aïgue normale est caractérisé par la succession de trois phases qui mènent à une guérison spontanée en nécessitant aucun traitement. La phase d’initiation et la phase aigüe de l’inflammation, qui sont caractérisées par la formation d’un œdème et par le recrutement et l’activation de neutrophiles afin de tuer les pathogènes, est suivie par une phase de résolution où d’autres types de cellules immunitaires, telles que les monocytes et les macrophages, sont recrutés et activés afin d’éliminer les débris par phagocytose et de réparer les tissus endommagés [1, 2, 22] (Figure 1.4).
5
Figure 1.4. Les phases de l’inflammation et les voies métaboliques de la biosynthèse des médiateurs lipidiques impliqués dans l’inflammation.
(Tirée de Serhan et al 2014 [3]).
Les médiateurs lipidiques produits à partir de l’AA, à l’exception des lipoxines et de certaines prostaglandines, sont généralement pro-inflammatoires, tandis que ceux produits à partir des AG polyinsaturés oméga-3 sont généralement anti-inflammatoires et plutôt impliqués dans la résolution de l’inflammation (Figure 1.4.). Les effets bénéfiques sur la santé et la progression de maladies inflammatoires chroniques associés à la consommation de poissons ou d’huiles de poisson riches en AG polyinsaturés oméga-3 semblent dues à un ratio d’AG omega-3 par rapport aux AG oméga-6 qui pousse la production de médiateurs lipidiques vers des médiateurs anti-inflammatoires [23, 24].
En général, l’AA et le EPA sont précurseurs d’éicosanoïdes, un groupe de molécules lipidiques bioactives produites par l’oxygénation d’AG polyinsaturés de 20 carbones. Plus précisément, l’AA (20:4 n-6) peut être converti en leucotriènes, prostaglandines,
6
thromboxanes et lipoxines tandis que l’EPA (20:5 n-3) peut être converti en médiateurs tel que les résolvines de la série E. Pour sa part, le DHA (22:6 n-3) est le précurseur de docosanoïdes incluant les résolvines de la série D, les protectines et les marésines (Figure 1.4.). Ces médiateurs lipidiques bioactifs ont des récepteurs présents à la surface de différents types cellulaires et induisent diverses réponses physiologiques grandement impliquées dans l’inflammation telles que la migration cellulaire (chimiotactisme), la vasodilatation, la bronchoconstriction, la perméabilisation vasculaire, la phagocytose et bien d’autres [1, 3-5, 25, 26].
Plusieurs voies métaboliques complexes sont impliquées dans la production de médiateurs lipidiques à partir des AG polyinsaturés et ces modifications moléculaires sont catalysées par de nombreuses enzymes notamment des lipoxygénases, des cyclooxygénases, des hydrolases et des synthétases [4, 25, 27-29]. Les voies les plus connues sont celles de la 5-lipoxygénase (5-LO) et des cyclooxygénases (COX-1 et 2) qui catalysent la bioconversion de l’AA en leucotriènes et en prostaglandines, respectivement. Puisque ces médiateurs lipidiques sont impliqués dans la douleur et dans plusieurs maladies inflammatoires, de nombreux groupes de recherche ciblent ces voies métaboliques depuis plusieurs années et quelques médicaments contre la douleur et les maladies inflammatoires telles que l’arthrite rhumatoïde et l’asthme ont été développés. Par exemple, l’Aspirine® (acide acétylsalicylique), le Celebrex® (célécoxib) et le Vioxx® (rofécoxib) sont des inhibiteurs des cyclooxygenases utilisés contre la douleur et l’arthrite rhumatoïde [30]. Le Zyflo® (zileuton) est un inhibiteur de la 5-lipoxygénase tandis que l’Accolate® (zafirlukast) et le Singulair® (montelukast) sont des antagonistes du récepteur de peptidoleucotriènes (Cyst-LTR1) utilisés contre les allergies et l’asthme [8]. Les plus récentes découvertes ont démontré l’importance des lipoxines, des résolvines, des protectines et des marésines, qui sont aussi produites par les lipoxygénases et la cyclooxygénase-2 (COX-2) acétylée, dans la résolution de l’inflammation pour un retour éventuel de l’homéostasie [1-3, 26].
La biosynthèse des médiateurs lipidiques dérivés d’AG polyinsaturés est grandement contrôlée par l’expression et l’activation des lipoxygénases et cyclooxygénases suite à une stimulation cellulaire adéquate, mais aussi par la biodisponibilité des différents AG
7
polyinsaturés [25, 27-29, 31, 32]. Au niveau cellulaire, les AG polyinsaturés sont généralement entreposés dans les GPL membranaires et doivent être libérés avant d’être converti en médiateurs lipidiques, ce qui contrôle grandement leur biodisponibilité cellulaire. Lorsque certaines cellules immunitaires sont stimulées adéquatement, les AG polyinsaturés sont libérés des GPL pour ensuite être convertis en différents médiateurs lipidiques dépendamment des enzymes qui sont exprimées dans ces cellules [25, 27, 31]. Par exemple, lorsque les neutrophiles sont activés et que le calcium intracellulaire augmente, une phospholipase A2 (PLA2) et la 5-LO sont activés et transloquent du cytosol vers les membranes péri-nucléaires afin de libérer et convertir l’AA en leucotriène B4 (LTB4) et autres dérivés de l’AA. Le LTB4 est un chimio-attractant puissant causant le recrutement supplémentaire de neutrophiles et d’autres types de cellules au site inflammatoire [31, 33]. En fait, la biodisponibilité des AG polyinsaturés dépend de l’équilibre entre l’activité de l’incorporation et de la libération des AG polyinsaturés des GPL qui est régulée par plusieurs enzymes impliquées dans le métabolisme des GPL. Cependant, on connait encore très peu sur les mécanismes qui permettent le changement des classes de médiateurs lipidiques lors de la résolution de l’inflammation.
1.4. Les glycérophospholipides membranaires et leur métabolisme
1.4.1. Les glycérophospholipides membranaires
Les GPL sont des composantes majeures de la bicouche lipidique des membranes cellulaires, mais aussi une importante réserve de molécules lipidiques bioactives. La structure générale des GPL est constituée d’une molécule centrale de glycérol liée à deux AG en position sn-1 et sn-2 et à un groupement phosphate lié à une tête polaire en position sn-3 (Figure 1.5) [34].
8
On retrouve généralement une grande diversité de GPL au niveau des membranes cellulaires, incluant des classes et des sous-classes selon la nature moléculaire de la tête polaire présente en sn-3 et du type de liaison entre l’AG et le glycérol en position sn-1, respectivement. Les quatre principales classes de GPL contenant des AG polyinsaturés sont les phosphatidyléthanolamines (PE), les phosphatidylcholines (PC), les phosphatidylinositols (PI) et les phosphatidylsérines (PS) ayant respectivement des molécules d’éthanolamine, de choline, d’inositol et de sérine comme têtes polaires. La présence d’une liaison ester en sn-1 correspond à la sous-classe des diacyl-GPL (1-acyl-2-acyl-GPL), la présence d’une liaison éther correspond aux alkyl-GPL (1-alkyl-2-acyl-GPL) et la présence d’une liaison vinyl éther correspond aux alk-enyl-GPL (1-alk-1-enyl-2-acyl-GPL) qui sont couramment appelés les plasmalogènes [34]. De plus, l’identité des AG présents en position sn-1 et sn-2 augmente encore plus la diversité des espèces moléculaires de GPL présents dans les membranes biologiques, car on retrouve une vingtaine d’AG associés aux GPL membranaires.
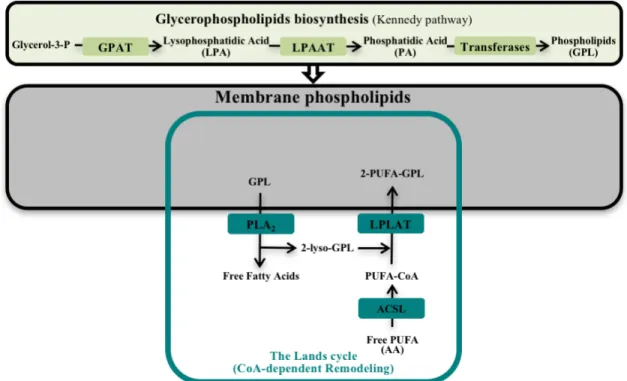
1.4.2. La biosynthèse et le remodelage CoA-dépendent des glycérophospholipides
Les GPL sont tous synthétisés de novo à partir de l’acide phosphatidique, un GPL ayant un atome d’hydrogène comme tête polaire, mais les différentes classes et sous-classes de GPL n’ont pas la même composition en AG. L’acide phosphatidique est synthétisé à partir du glycérol-3-phosphate par la voie de Kennedy. (Figure 1.6).
Figure 1.6. Les voies métaboliques de la biosynthèse des glycérophospholipides.
Les enzymes responsables de l’acylation du glycérol-3-phosphate (GPAT, glycerol-3-phosphate acyltransferase) et les enzymes responsables de l’acylation des acides lysophosphatidiques (LPAAT, lysophosphatidic acid acyltransferase) incorporent majoritairement des AG saturés et mono-insaturés. Cependant, il est très bien connu que les GPL représentent une importante réserve d’AG polyinsaturés contrairement à l’acide phosphatidique. En fait, les GPL synthétisés de novo à partir de l’acide phosphatidique
9
subissent une maturation (un remodelage) par l’action de plusieurs enzymes telles que des phospholipases, des acyltransférases et des transacylases afin d’atteindre un certain équilibre et une certaine diversité moléculaire [35, 36]. Depuis la fin des années 1950, Lands a publié une série d’articles sur la caractérisation du remodelage CoA-dépendant des AG en position sn-2 des GPL. Cette voie consiste premièrement à l’hydrolyse d’un GPL par une phospholipase A2 produisant ainsi un 2-lyso-GPL et un AG libre. Ensuite, un autre AG libre, préalablement activé par une acyl-CoA synthétase (ACS), peut être transféré à ce lyso-GPL par une CoA-dépendante 2-lyso-GPL acyltransférase (LPLAT) (Figure 1.7).
Figure 1.7. Schéma illustrant la biosynthèse et le remodelage CoA-dépendant des glycérophospholipides.
Ce mécanisme, couramment appelé le cycle de Lands, est responsable de l’incorporation d’AG polyinsaturés à longues chaines en position sn-2 des GPL et donc, de l’asymétrie des AG en position sn-1 par rapport à la position sn-2 des GPL [35, 37-42]. Plusieurs PLA2, ACS et LPLAT ayant différentes caractéristiques et spécificités enzymatiques sont maintenant connues, mais d’autres activités enzymatiques sont responsables du contrôle de la distribution des AG dans les différentes classes et sous-classes de GPL.
10
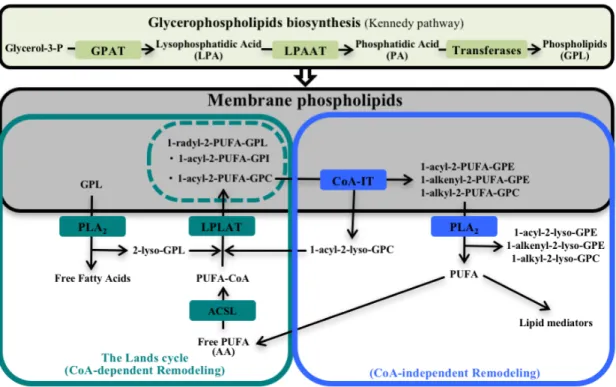
1.4.3. Le remodelage CoA-indépendant des glycérophospholipides
Plusieurs études ont démontré la spécificité de l’incorporation et du remodelage de l’AA dans les différentes classes et sous-classes de GPL chez plusieurs types cellulaires humains et animales. Kramer et Deykin ont été les premiers à caractériser le remodelage de l’AA en étudiant l’incorporation et la redistribution (remodelage) de l’AA marqué ([3H]AA) chez des plaquettes humaines en 1983 [43]. Il était connu qu’une grande proportion de l’AA cellulaire était associée avec la sous-classe des plasmalogènes (1-alk-1-enyl-GPE), mais que l’[3H]AA était initialement majoritairement incorporé dans le GPC et très peu dans la sous-classe des plasmalogènes chez ces cellules. En effet, ils ont démontré que des préparations membranaires de plaquettes, préalablement marquées à l’[3H]AA, étaient capable de transférer l’[3H]AA à des lyso-plasmalogènes exogènes en absence de CoA, d’ATP, de Ca2+ et de Mg2+ et que le 1-acyl-2-lyso-GPE et le 1-alky-2-lyso-GPC pouvaient aussi être utilisés comme substrats accepteurs contrairement aux lyso-GPS, lyso-GPI [43, 44]. (Figure 1.8)
Figure 1.8. Schéma illustrant la biosynthèse et les remodelages CoA-dépendant et CoA-indépendant des glycérophospholipides.
11
Il fut ensuite démontré que lorsque des macrophages alvéolaires de lapin sont marqués à l’[3H]AA, l’AA est rapidement incorporé dans la classe des GPC suivit d’un transfert vers la classe des GPE jusqu'à l’obtention d’un certain équilibre. Suite à la séparation et l’analyse de la radioactivité associée aux différentes sous-classes des GPC et des GPE, ils ont démontré que l’incorporation de l’AA est spécifique aux diacyl-GPC et le remodelage est caractérisée par le transfert spécifique de l’AA vers les sous-classes acyl-GPE, alk-enyl-GPE et 1-alkyl-GPC. Ces expériences ont aussi été réalisées avec l’acide linoléique (18:2, n-6), mais aucun remodelage ne fut décelé [45]. De plus, des préparations microsomales de macrophages alvéolaires de lapin sont capables de transférer le 20:5 n-3, le 20:3 n-6, le 22:4 n-6 et le 22:6 n-3 à partir de diacyl-GPC vers les 1-alkyl-GPC de façon CoA-indépendante contrairement à l’acide palmitique (16:0), l’acide stéarique (18:0) et l’acide oléique (18:1n-9) [46, 47].
Ces études ont mené à la description d’une voie de remodelage des AG polyinsaturés caractérisée par la présence d’une transacylase CoA-indépendante (CoA-IT) (Figure 1.6). Il a été proposé que le remodelage de l’AA pourrait être impliqué dans le contrôle de la biodisponibilité de l’AA et de lyso-PAF (1-alkyl-2-lyso-GPC) lorsque certaines cellules inflammatoires sont stimulées [47-51]. Par contre, la CoA-IT n’a jamais été isolée et identifiée due à une très grande sensibilité aux détergents, mais des inhibiteurs ont été développés afin d’évaluer l’implication du remodelage de l’AA sur la distribution de l’AA et la synthèse de médiateurs lipidiques comme les leucotriènes, les prostaglandines et de facteurs activant les plaquettes (Platelet-activating factor, PAF).
1.4.4. L’inhibition de la transacylase CoA-indépendante
Depuis les années 1990, plusieurs études ont porté sur l’inhibition de l’activité CoA-IT. Premièrement, deux inhibiteurs, le SK&F98625 et le SK&F45905, qui agissent selon un mécanisme de compétition de substrat sans inhiber l’incorporation initiale de l’AA, ont été développés et testés avec succès chez des neutrophiles humains [52]. Ensuite, un composé préalablement utilisé comme agent antinéoplasique, l’édelfosine (ET-18-O-CH3), qui est structuralement très similaire aux 1-alkyl-2-lyso-PC ayant un groupement o-méthyl non-hydrolysable en position sn-2, inhibe l’activité CoA-IT chez la lignée leucocytaire HL-60 par
12
compétition de substrats [53]. En analysant l’effet de ces trois inhibiteurs sur la distribution de la masse de l’AA dans les GPL des cellules HL-60 par GC/MS, il a été démontré que l’inhibition de la CoA-IT est non seulement associée à un ralentissement du remodelage de l’AA marqué ([3H]AA), mais cause aussi une redistribution de la masse de l’AA dans les classes et sous-classes de GPL. Cette redistribution de masse semble être spécifique à l’AA, car la distribution de l’acide linoléique (18:2 n-6) et la distribution relative des classes de GPL n’ont pas été altérées par l’inhibition de la CoA-IT [54]. L’aspect le plus intéressant est que l’inhibition de la CoA-IT diminue la capacité de production d’éicosanoïdes et de PAF suite à la stimulation de certaines cellules inflammatoires [55]. Par contre, l’incubation prolongée de lignées cellulaires avec ces trois inhibiteurs, contrairement à des analogues inactifs, causent une diminution de la prolifération et de la survie cellulaire due à l’induction de l’apoptose [53] [54] [56] [57].
Il a été proposé que la perturbation du contrôle de la distribution cellulaire de l’AA soit à l’origine de l’influence qu’a l’inhibition de la CoA-IT sur la prolifération et la mort cellulaire induite par l’apoptose. Cette hypothèse fut apportée car l’inhibition de la CoA-IT est associée avec une augmentation de la quantité d’AA libre dans le milieu extracellulaire et la sensibilité à l’induction de l’apoptose par l’inhibition de la CoA-IT est significativement diminuée lorsque les cellules HL-60 sont déplétées en AA [56]. De plus, lors de l’incubation de ces cellules en présence de différents AG libres, seulement les AG de 20 carbones ont induit une diminution significative de la prolifération de façon dose dépendante (10-100 µM). Cette induction de l’apoptose ne semble pas être causée par le métabolisme de l’AA en éicosanoïdes car l’inhibition de la 5-lipoxygénase et des cyclooxygénases fut sans effet sur la diminution de la prolifération induite par l’AA et les inhibiteurs de la CoA-IT. Cette induction de l’apoptose fut plutôt associée à la synthèse de céramides qui sont connus pour induire l’apoptose [56].
Une diminution du remodelage de l’AA a été démontré lorsque l’apoptose de cellules BMMC “Bone Marrow-Derived Mast Cells” de souris est induite par la déplétion de cytokines (“stem cell factor” (SCF) et IL-3). La quantité d’AA libre, contrairement aux autres AG, corrèle avec le pourcentage de cellules apoptotiques et pourtant les activités arachidonoyl-CoA
13
synthétases et LPLAT n’étaient pas altérées. Cependant, l’induction de l’apoptose chez ces cellules fut associée avec une diminution de l’activité CoA-IT résultant en une diminution de la quantité d’AA dans les GPE et une augmentation de la quantité d’AA dans les GPC, dans les lipides neutres et libres [58].
Il fut ensuite proposé que le mécanisme d’action la CoA-IT pouvait être similaire à celui de la lécithine-cholestérol acyltransférase, ce mécanisme consisterait à la formation d’un intermédiaire IT et AA par la formation d’une liaison covalente entre l’AA et la CoA-IT et d’une libération d’un lyso-GPL. Ensuite, l’AA lié de façon covalente à la CoA-CoA-IT pourrait être transféré à un GPL accepteur [59]. En se basant sur ce mécanisme, deux inhibiteurs irréversibles de la CoA-IT, le ß-Lactam SB 212047 et SB 216754, ont été développés. En plus d’inhiber la production d’éicosanoïdes et de PAF suite à des stimulations cellulaires in vitro, ces inhibiteurs bloquent aussi des phénomènes inflammatoires comme l’œdème et l’infiltration cellulaire in vivo [59].
1.4.5. Les enzymes potentiellement impliquées dans le remodelage des glycérophospholipides
L’incorporation des AG polyinsaturés dans les GPL ainsi que leur remodelage, qui nécessitent les activités PLA2, ACS, LPLAT et CoA-IT (Figure 1.8.), contrôlent grandement la biodisponibilité des AG polyinsaturés pour la production de médiateurs lipidiques bioactifs. Les expériences d’inhibition de la CoA-IT ont démontré que le remodelage des AG polyinsaturés est une cible thérapeutique potentiellement intéressante contre les maladies inflammatoires et prolifératives. Cependant la CoA-IT n’a jamais été isolée ni identifiée étant donné sa sensibilité aux détergents, mais plusieurs PLA2, ACS et LPLAT ayant différentes spécificités enzymatiques et caractéristiques sont maintenant connues. Certaines PLA2 membranaires ont des caractéristiques et des spécificités enzymatiques intéressantes qui nous laissent penser que la CoA-IT pourrait bien être une PLA2 [60].
Les phospholipases A2
L’activité PLA2, qui catalyse l’hydrolyse des AG en position sn-2 des GPL, est nécessaire à la production des 1-acyl-2-lyso-GPC et 1-acyl-2-lyso-GPI qui sont requis pour
14
l’incorporation des AG polyinsaturés dans les GPL. De plus, l’activité PLA2 est aussi nécessaire pour la production des 1-alkyl-2-lyso-GPC, 1-acyl-2-lyso-GPE et des 1-alkenyl-2-lyso-GPE qui sont les accepteurs des AG polyinsaturés lors de la transacylation CoA-indépendante, ainsi que pour la libération des AG polyinsaturés pour la production de médiateurs lipidiques bioactifs (Figure 1.3) [31, 61, 62]. Les gènes de près d’une trentaine de PLA2, ayant différentes caractéristiques et spécificités enzymatiques, sont maintenant connus et ces enzymes peuvent être classifiées selon l’homologie de leurs séquences (groupes), leurs localisations cellulaires, leur poids moléculaire et leurs dépendances pour le calcium [63]. Les PLA2 les plus connues sont les PLA2 sécrétées, qui sont caractérisées par leur faible poids moléculaire, leur sécrétion dans le milieu extracellulaire et leur dépendance envers le calcium qui est de l’ordre des mM, et les PLA2 intracellulaires qui sont soit calcium-dépendantes dans l’ordre du µM ou calcium-incalcium-dépendantes [64] [63, 65, 66]. (Tableau 1)
Table 1.1. Les phospholipases A2 et leur dépendance en calcium
Phospholipases A2 Groupes Synonymes Dépendance en calcium
Sécrétées IB, IIA, IIC-F, III, V, X XII sPLA2 mM Cytosoliques IVA IVB IVC IVD-F cPLA2 α cPLA2 β cPLA2 γ cPLA2 δ, ε et ζ µM µM - µM Calcium-indépendantes VIA VIB iPLA2 β, PNPLA9 iPLA2 γ, PNPLA8 - -
Les PLA2 cytosoliques (groupe IV) contiennent six membres, mais la cPLA2α (IVA) est la plus étudiée due à sa grande spécificité envers les GPL contenant l’AA et par son implication dans la libération de l’AA pour la production de médiateurs lipidiques bioactifs [31, 33, 67]. La PLA2 IVA, ainsi que les PLA2 IVB, IVD, IVE et IVF qui sont moins connues, contiennent un domaine C2 permettant leur translocation du cytosol vers les membranes lors de stimulation cellulaire adéquate qui augmente la concentration du calcium intracellulaire [68-70]. Les PLA2 IVB, IVD, IVE et IVF ont beaucoup moins d’activité lysophospholipase et phospholipase A2 et elles n’ont pas de spécificité envers les GPL contenant l’AA [68-70]. La cPLA2γ (IVC) est classée dans la catégorie des PLA2 cytosoliques par rapport à l’homologie de sa séquence avec celle de la PLA2 IVA, mais elle est membranaire et calcium-indépendante. La cPLA2 IVC catalyse plusieurs activités différentes, car en plus de catalyser
15
la libération de l’AA des GPL, elle catalyse aussi les activités lysophospholipase, lysophospholipide dismutase (LPLase/transacylase) et une faible activité CoA-IT [71, 72]. Les PLA2 calcium-indépendantes (iPLA2β VIA et iPLA2γ VIB) font partie de la famille des ‘Patatin-like phospholipase domain-containing protein’ (PNPLA) composée de neuf gènes [73]. La PLA2 VIA contient des séquences ankyrines qui sont généralement impliquées dans l’interaction protéine-protéine et cette enzyme semble être active sous forme de tétramère. Plusieurs isoformes produits par l’épissage alternatif de la PLA2 VIA ont été découverts et les isoformes ankyrines non-actifs semblent être responsables d’une modulation négative de l’activité de la iPLA2 VIA en formant des tétramères avec les formes actives [74, 75]. Pour ce qui est de la iPLA2 VIB, elle est calcium-indépendante, elle contient une séquence de localisation peroxysomale en C-terminal et elle est généralement associée aux membranes des peroxysomes [76]. Ces enzymes ne semblent pas avoir de spécificité de substrat envers les GPL contenant l’AA et semble surtout responsable du remodelage général des GPL. De plus, l’inhibition de la PLA2 VIA par le bromoenol lactone (BEL) diminue l’incorporation de l’AA dans les GPL en inhibant probablement la production des lyso-GPL accepteurs de l’AA [61, 77, 78].
Cependant, les autres membres de la famille des PNPLA, qui ne semblent pas avoir d’activité phospholipase A2, ont des activités transacylases en utilisant différents substrats donneurs et accepteurs que ceux utilisés par la CoA-IT [79]. De plus, plusieurs autres PLA2 beaucoup moins connues, incluant quatre acétylhydrolases de facteurs activateurs de plaquettes (PAF-AH VIIA, VIIB, VIIIA et VIIIB), une PLA2 lysosomale (LPLA2 XV), une famille de PLA/AT (PLA2 XVI) et la peroxyredoxin-6 (PRDX6) pourraient bien être impliquées, mais la caractérisation de leur activité enzymatique est beaucoup moins complète [60, 65, 66, 80]. Plusieurs études ont démontré l’implication des PLA2 dans la progression des maladies inflammatoires et prolifératives [31, 33, 62, 81-85]
Les acyl-CoA synthétases
L’activité acyl-CoA synthétase (ACS), qui catalyse la formation d’une liaison thioester entre une molécule de Coenzyme A et le groupement carboxylique des AG, est indispensable pour l’incorporation des AG dans les GPL ainsi qu’aux réactions d’élongation et de désaturation
16
des AG qui sont catalysées sur des acyl-CoA. Environ 26 ACS, ayant différentes spécificités enzymatiques, distributions tissulaires et localisations subcellulaires, sont maintenant connues [86]. Cependant, ce sont les ACSL (long-chain acyl-CoA synthases) qui sont connues pour agir sur les AG d’intérêts pour cette étude (12-22 carbones). Il y a cinq ACSL (ACSL1, 3, 4, 5, 6) qui sont exprimées chez les humains, mais l’ACSL4 est l’ACS la plus étudiée et semble être la seule ACS à avoir une très grande préférence pour l’AA [87]. Plusieurs études récentes démontrent que l’ACSL4 est impliquée dans le contrôle de la biodisponibilité de l’AA pour la production de médiateurs lipidiques bioactifs et que son expression est importante pour la prolifération et la survie de plusieurs types de cellules cancéreuses [86-96]. Très peu est connu sur l’implication des autres ACS sur l’incorporation de l’AA, la biodisponibilité de l’AA et la prolifération cellulaire. Sauf qu’il fut démontré que l’ACSL1 est induite lorsque les monocytes humains sont différentiés en macrophages de type inflammatoire (M1) et joue un rôle important dans la disponibilité de l’AA pour la synthèse de médiateurs lipidiques bioactifs produit à partir de l’AA [97]. Dans cette étude, ils ont aussi démontré que la suppression sélective myéloïde de l'ACSL1 chez les souris diabétiques de type 1 atténue le phénotype inflammatoire des monocytes et des macrophages diabétiques et prévient l'athérosclérose accélérée par le diabète [97].
Les lysophospholipides acyltransférases
Les lysophospholipides acyltransférases (LPLAT) sont les enzymes qui incorporent les acyl-CoA en position sn-2 des 2-lyso-GPL en catalysant la formation d’une liaison ester. Deux familles de LPLAT, ayant différentes spécificités enzymatiques envers les AG et les lyso-GPL, sont maintenant connues (Tableau 2) [98, 99].
Table 1.2. La diversité des lysophospholipides acyltransférases
Lysophospholipides acyltransférases Familles et synonymes
LPCAT1 AGPAT9 / AYTL2
LPCAT2 LysoPAF-AT / AYTL1
LPCAT3 MBOAT5
LPCAT4 MBOAT2 / LPEAT2
LPEAT1 MBOAT1
LPEAT2 AGPAT7 / AYTL3
17
La famille des 1-acylglycérol-3-phosphate acyltransférase (AGPAT) comprend trois membres ayant une activité LPLAT (LPCAT1/AGPAT9, LPCAT2/ LysoPAFAT/AYTL1 et LPEAT2/AGPAT7). La LPCAT1 est une enzyme calcium-indépendante qui préfère le 18:2-CoA et le 18:3-18:2-CoA comme AG et les lyso-GPC comme GPL accepteur, mais elle a aussi une activité lyso-PAF acétyltransférase pour produire le PAF. Cette enzyme semble être majoritairement impliquée dans la production des GPL contenus dans le surfactant pulmonaire [100]. La LPCAT2 préfère l’AA-CoA et les 1-alkyl-2-lyso-GPC et elle a aussi une activité lyso-PAF acétyltransférase chez certaines cellules inflammatoires. Contrairement à la LPCAT1, son activité est calcium-dépendante et elle peut être induite par les lipopolysaccharides (LPS) chez les macrophages [101]. La LPEAT2 est majoritairement exprimée au niveau du cerveau et elle a été démontrée pour avoir des activités LPEAT, LPCAT et LPSAT en utilisant préférentiellement le 16:0-CoA, le 18:0-CoA et le 18:1-CoA, mais elle peut aussi utiliser l’AA-CoA. L’atténuation de l’expression de la LPEAT2 par des ARN interférents chez les cellules HEK293T a diminué l’activité d’acylation des 1-acyl-GPE et 1-alk-1-enyl-GPE [102].
La famille des “membrane-bound O-acyltransferases” (MBOAT) comprend quatre membres ayant une activité LPLAT (LPEAT1/MBOAT1, LPCAT3/MBOAT5, LPCAT4/MBOAT2 et LPIAT1/MBOAT7). La LPCAT3 a une activité LPCAT, LPEAT et LPSAT et utilise préférentiellement des AG polyinsaturés comme l’AA-CoA et le 18:2-CoA [103]. Des expériences d’ARN interférents chez la lignée de cellules mélanomes B16 ont démontré une diminution de l’activité endogène LPCAT, LPEAT et LPSAT avec l’AA-CoA et une diminution de la masse de l’AA en position sn-2 des GPC, GPE et GPS [104]. La LPEAT1 et la LPCAT4 ont une activité LPEAT, LPCAT et LPSAT avec une très grande préférence pour le 18:1-CoA [98, 99, 103]. La LPIAT1 est pour sa part la seule enzyme ayant une très grande spécificité envers les lyso-GPI et l’AA-CoA [103].
Cependant, l’implication des différentes LPLAT dans le contrôle de la biodisponibilité de l’AA et des autres AG polyinsaturés pour la production de médiateurs lipidiques ainsi que l’effet de l’atténuation de ces gènes sur la prolifération et la survie cellulaire sont encore très peu connus.
18
1.5. La synthèse des acides gras, le remodelage des glycérophospholipides
et la prolifération cellulaire
La prolifération cellulaire est un processus de base, mais la prolifération non contrôlée ou non voulue est impliquée dans les cancers et dans plusieurs maladies auto-immunes et inflammatoires chroniques. Il est très bien connu que la biosynthèse de novo des AG saturés et mono-insaturés est induite chez les cellules cancéreuses pour supporter la biosynthèse accrue de GPL membranaires et de nouvelles membranes [105-111]. L’acétyl-CoA carboxylase (ACC), l’acide gras synthase (FAS), la stéaroyl-CoA désaturase 1 (SCD1) et la stéaroyl-CoA désaturase 5 (SCD5) semblent tous être des cibles thérapeutiques intéressantes, car l’inhibition de ces enzymes affectent la prolifération cellulaire et induisent l’apoptose chez plusieurs types de cancers [107, 108, 110-121]. Au niveau de l’intégrité membranaire, les propriétés physiques des AG insaturés influence grandement la fluidité, ce qui affecte l’organisation moléculaire des membranes et les fonctions membranaires [122-125]. Le remodelage des GPL, qui est responsable de l’incorporation et de la redistribution des AG polyinsaturés dans les GPL, contribue aussi au maintien de l’intégrité et de l’homéostasie des membranes [123-125]. Plusieurs PLA2 ont été démontrées être impliquées dans la progression de différents types de cancers et maladies inflammatoires [126-128], mais très peu est connu sur l’expression et l’implication des ACS, LPLAT, FADS et ELOVL dans la prolifération cellulaire et encore moins dans la production de médiateurs lipidiques.
1.6. La synthèse des acides gras et le remodelage des
glycérophospholipides chez les lymphocytes T
Les lymphocytes T sont responsables de la reconnaissance spécifique des antigènes et coordonnent la réponse immunitaire cellulaire adaptative par des interactions intercellulaires et la libération de cytokines. En fait, il y a deux types majeurs de lymphocytes T, les lymphocytes T auxiliaires (CD4) et les lymphocytes T cytotoxiques (CD8), qui jouent des rôles très différents. Les lymphocytes T auxiliaires CD4 (Th1 et Th2) ont des récepteurs qui reconnaissent des antigènes présentés par des cellules présentatrice d’antigènes, telles que les cellules dendritiques et macrophages, qui ont ingéré des pathogènes. Une fois activées, les lymphocytes T auxiliaires Th1 aident les phagocytes à détruire les pathogènes, les lymphocytes T auxiliaires Th2 induisent la production d’anticorps par les lymphocytes B et