Université d’Aix-Marseille – Faculté de Pharmacie – 27 bd Jean Moulin – CS 30064 - 13385 Marseille cedex 05 - France Tél. : +33 (0)4 91 83 55 00 - Fax : +33 (0)4 91 80 26 12
MÉMOIRE
DU DIPLÔME D’ÉTUDES SPECIALISÉES
DE BIOLOGIE MÉDICALE
Soutenu le lundi 8 OCTOBRE 2018
Par M. ABOUBAKR Tarek Né(e) le 7 décembre 1988 à Marseille
Conformément aux dispositions du décret n°2003-76 du 23 janvier 2003, tenant lieu de
THÈSE
POUR LE DIPLÔME D’ÉTAT DE DOCTEUR EN
PHARMACIE
----oOo---- TITRE :
Intérêt des Immunoglobulines IgA dans le diagnostic de la toxoplasmose : chez la femme enceinte, chez le nouveau-né suspect d’infection congénitale et chez les patients immunodéprimés suspects de réactivation
----oOo---- JURY : Président : Pr Nadine AZAS
Membres : Pr Stéphane RANQUE
Dr Coralie L’OLLIVIER (Directrice de thèse) Dr Fabrice USSEGLIO
2
LISTE DES ENSEIGNANTS DE L’UFR
ADMINISTRATION :
Doyen : Mme Françoise DIGNAT-GEORGE
Vice-Doyens : M. Jean-Paul BORG M. François DEVRED M. Pascal RATHELOT
Chargés de Mission : Mme Pascale BARBIER M. David BERGE-LEFRANC Mme Manon CARRE
Mme Caroline DUCROS Mme Frédérique GRIMALDI
Conseiller du Doyen : M. Patrice VANELLE
Doyens honoraires : M. Jacques REYNAUD M. Pierre TIMON-DAVID M. Patrice VANELLE
Professeurs émérites : M. José SAMPOL M. Athanassios ILIADIS M. Jean-Pierre REYNIER M. Henri PORTUGAL
Professeurs honoraires : M. Guy BALANSARD M. Yves BARRA
Mme Claudette BRIAND M. Jacques CATALIN Mme Andrée CREMIEUX M. Aimé CREVAT
M. Bernard CRISTAU M. Gérard DUMENIL M. Alain DURAND Mme Danielle GARÇON M. Maurice JALFRE M. Joseph JOACHIM
3 M. Maurice LANZA
M. José MALDONADO M. Patrick REGLI M. Jean-Claude SARI
Chef des Services Administratifs : Mme Florence GAUREL
Chef de Cabinet : Mme Aurélie BELENGUER
Responsable de la Scolarité : Mme Nathalie BESNARD
DEPARTEMENT BIO-INGENIERIE PHARMACEUTIQUE
Responsable : Professeur Philippe PICCERELLE
PROFESSEURS
BIOPHYSIQUE M. Vincent PEYROT
M. Hervé KOVACIC GENIE GENETIQUE ET BIOINGENIERIE M. Christophe DUBOIS PHARMACIE GALENIQUE,
PHARMACOTECHNIE INDUSTRIELLE, BIOPHARMACIE ET COSMETIQUE
M. Philippe PICCERELLE
MAITRES DE CONFERENCES
BIOPHYSIQUE M. Robert GILLI
Mme Odile RIMET-GASPARINI Mme Pascale BARBIER
M. François DEVRED Mme Manon CARRE M. Gilles BREUZARD Mme Alessandra PAGANO
GENIE GENETIQUE ET BIOTECHNOLOGIE M. Eric SEREE-PACHA
Mme Véronique REY-BOURGAREL PHARMACIE GALENIQUE,
PHARMACOTECHNIE INDUSTRIELLE, BIOPHARMACIE ET COSMETOLOGIE
M. Pascal PRINDERRE M. Emmanuel CAUTURE Mme Véronique ANDRIEU Mme Marie-Pierre SAVELLI
4
NUTRITION ET DIETETIQUE M. Léopold TCHIAKPE
A.H.U.
THERAPIE CELLULAIRE M. Jérémy MAGALON
ENSEIGNANTS CONTRACTUELS
ANGLAIS Mme Angélique GOODWIN
DEPARTEMENT BIOLOGIE PHARMACEUTIQUE
Responsable : Professeur Philippe CHARPIOT
PROFESSEURS
BIOCHIMIE FONDAMENTALE, MOLECULAIRE ET CLINIQUE
M. Philippe CHARPIOT
BIOLOGIE CELLULAIRE M. Jean-Paul BORG
HEMATOLOGIE ET IMMUNOLOGIE Mme Françoise DIGNAT-GEORGE
Mme Laurence CAMOIN-JAU
Mme Florence SABATIER-MALATERRE Mme Nathalie BARDIN
MICROBIOLOGIE M. Jean-Marc ROLAIN
M. Philippe COLSON PARASITOLOGIE ET MYCOLOGIE
MEDICALE, HYGIENE ET ZOOLOGIE
Mme Nadine AZAS-KREDER
MAITRES DE CONFERENCES
BIOCHIMIE FONDAMENTALE, MOLECULAIRE ET CLINIQUE
Mme Dominique JOURDHEUIL-RAHMANI M. Thierry AUGIER
M. Edouard LAMY
Mme Alexandrine BERTAUD Mme Claire CERINI
Mme Edwige TELLIER M. Stéphane POITEVIN
HEMATOLOGIE ET IMMUNOLOGIE Mme Aurélie LEROYER
5 Mme Sylvie COINTE
MICROBIOLOGIE Mme Michèle LAGET
M. Michel DE MEO
Mme Anne DAVIN-REGLI Mme Véronique ROUX M. Fadi BITTAR
Mme Isabelle PAGNIER Mme Sophie EDOUARD
M. Seydina Mouhamadou DIENE PARASITOLOGIE ET MYCOLOGIE
MEDICALE, HYGIENE ET ZOOLOGIE
Mme Carole DI GIORGIO M. Aurélien DUMETRE Mme Magali CASANOVA Mme Anita COHEN
BIOLOGIE CELLULAIRE Mme Anne-Catherine LOUHMEAU
A.H.U.
HEMATOLOGIE ET IMMUNOLOGIE M. Maxime LOYENS
DEPARTEMENT CHIMIE PHARMACEUTIQUE
Responsable : Professeur Patrice VANELLE
PROFESSEURS
CHIMIE ANALYTIQUE, QUALITOLOGIE ET NUTRITION
Mme Catherine BADENS
CHIMIE PHYSIQUE – PREVENTION DES RISQUES ET NUISANCES
TECHNOLOGIQUES
M. Philippe GALLICE
CHIMIE MINERALE ET STRUCTURALE – CHIMIE THERAPEUTIQUE
M. Pascal RATHELOT M. Maxime CROZET
CHIMIE ORGANIQUE PHARMACEUTIQUE M. Patrice VANELLE
6 PHARMACOGNOSIE,
ETHNOPHARMACOLOGIE, HOMEOPATHIE
Mme Evelyne OLLIVIER
MAITRES DE CONFERENCES
BOTANIQUE ET CRYPTOGAMIE, BIOLOGIE CELLULAIRE
Mme Anne FAVEL
Mme Joëlle MOULIN-TRAFFORT CHIMIE ANALYTIQUE, QUALITOLOGIE ET
NUTRITION
Mme Catherine DEFOORT M. Alain NICOLAY Mme Estelle WOLFF Mme Elise LOMBARD Mme Camille DESGROUAS CHIMIE PHYSIQUE – PREVENTION DES
RISQUES ET NUISANCES TECHNOLOGIQUES
M. David BERGE-LEFRANC M. Pierre REBOUILLON
CHIMIE THERAPEUTIQUE Mme Sandrine FRANCO-ALIBERT
Mme Caroline DUCROS M. Marc MONTANA Mme Manon ROCHE CHIMIE ORGANIQUE PHARMACEUTIQUE
HYDROLOGIE
M. Armand GELLIS M. Christophe CURTI Mme Julie BROGGI M. Nicolas PRIMAS M. Cédric SPITZ M. Sébastien REDON PHARMACOGNOSIE, ETHNOPHARMACOLOGIE, HOMEOPATHIE M. Riad ELIAS
Mme Valérie MAHIOU-LEDDET Mme Sok Siya BUN
Mme Béatrice BAGHDIKIAN
MAITRES DE CONFERENCE ASSOCIES A TEMPS PARTIEL (M.A.S.T.)
7 NUTRITION
CHIMIE PHYSIQUE – PREVENTION DES RISQUES ET NUISANCES
TECHNOLOGIQUES
M. Cyril PUJOL
DROIT ET ECONOMIE DE LA PHARMACIE M. Marc LAMBERT
GESTION PHARMACEUTIQUE, PHARMACOECONOMIE
ET ETHIQUE PHARMACEUTIQUE
OFFICINALE, DROIT ET COMMUNICATION PHARMACEUTIQUES A L’OFFICINE ET GESTION DE LA PHARMAFAC
Mme Félicia FERRERA
A.H.U.
CHIMIE ANALYTIQUE, QUALITOLOGIE ET NUTRITION
M. Mathieu CERINO
ATER
CHIMIE ANALYTIQUE M. Charles DESMARCHELIER
CHIMIE THERAPEUTIQUE Mme Fanny MATHIAS
DEPARTEMENT MEDICAMENT ET SECURITE SANITAIRE
Responsable : Professeur Benjamin GUILLET
PROFESSEURS
PHARMACIE CLINIQUE Mme Diane BRAGUER
M. Stéphane HONORÉ
PHARMACODYNAMIE M. Benjamin GUILLET
TOXICOLOGIE GENERALE M. Bruno LACARELLE
TOXICOLOGIE DE L’ENVIRONNEMENT Mme Frédérique GRIMALDI
MAITRES DE CONFERENCES
8 Mme Ahlem BOUHLEL
M. Philippe GARRIGUE
PHYSIOLOGIE Mme Sylviane LORTET
Mme Emmanuelle MANOS-SAMPOL TOXICOCINETIQUE ET
PHARMACOCINETIQUE
M. Joseph CICCOLINI
Mme Raphaëlle FANCIULLINO Mme Florence GATTACECCA TOXICOLOGIE GENERALE ET PHARMACIE
CLINIQUE
M. Pierre-Henri VILLARD
Mme Caroline SOLAS-CHESNEAU Mme Marie-Anne ESTEVE
9
REMERCIEMENTS
À mon jury de thèse :
Madame le Professeur Nadine AZAS,
Vous avez été mon professeur à la faculté de pharmacie. Vous me faites aujourd’hui l’honneur de présider ce jury de thèse et de juger ce travail, je vous en remercie.
Permettez-moi de vous exprimer ma sincère reconnaissance et mon profond respect.
Madame le Docteur Coralie L’OLLIVIER, ma directrice de thèse,
Merci pour m’avoir proposé ce sujet et pour avoir dirigé l’ensemble de ce travail. J'ai trouvé auprès de toi conseils avisés, aides précieuses, orientation précise et rigoureuse.
Je te remercie pour ta considération et ton implication dans ma formation lors de mon passage dans ton stage qui m’ont permis d’élargir le cadre de ma formation de base.
Enfin merci pour ton énergie, ton enthouthiasme communicatif, pour tes encouragements, pour ta discipline qui ont rendu ce travail aussi intéressant qu’interactif.
Monsieur le Professeur Stéphane RANQUE,
Je te remercie de m’avoir fait l’honneur d’accepter de participer à ce jury de thèse. Merci également pour ton encadrement et pour ta formation éclairée en mycologie lors de mon passage en parasitologie.
Monsieur le Docteur Fabrice USSEGLIO,
Tu m’as accompagné lors de mes premiers pas en tant qu’interne et aujourd’hui tu participe à ce jury de thèse, et pour cela je t’en remercie. Tu as su me former, m’encadrer toujours avec un regard bienveillant. Tes qualités, aussi bien humaines que professionnelles, font que c’est un vrai plaisir d’avoir travaillé avec toi.
10
« L’Université n’entend donner aucune approbation, ni improbation aux opinions émises dans les thèses. Ces opinions doivent être considérées comme propres à leurs auteurs. »
11
TABLE DES MATIERES
REMERCIEMENTS ... 9
TABLE DES MATIERES ... 11
LISTE DES ABREVIATIONS ... 14
LISTES DES FIGURES ... 16
LISTES DES TABLEAUX ... 17
INTRODUCTION ... 18
1 GENERALITES SUR TOXOPLASMA GONDII ... 20
1.1 AGENT PATHOGENE ... 20
1.1.1 Forme de dissémination ... 20
1.1.2 Forme trophozoïte ... 20
1.1.3 Forme latente ... 21
1.2 CYCLE EVOLUTIF ... 21
1.2.1 - Cycle complet sexué ... 21
1.2.2 - Cycle incomplet asexué ... 22
1.2.3 Mode de contamination chez l’Homme ... 22
2 POUVOIR PATHOGENE ET POPULATIONS A RISQUES ... 23
2.1 POUVOIR PATHOGENE DE TOXOPLASMA GONDII ... 23
2.2 POPULATIONS A RISQUE ... 25
2.2.1 La femme enceinte non immunisée ... 25
2.3 SUJETS IMMUNODEPRIMES ... 27
2.3.1 Les situations à risques ... 27
2.3.2 Présentation clinique chez l’immunodéprimé ... 28
2.4 EPIDEMIOLOGIE ... 29
2.4.1 Sujet immunocompétent ... 29
2.4.2 Sujet Immunodéprimé ... 29
2.4.3 Toxoplasmose Congénitale ... 30
3 OUTILS DIAGNOSTICS DE LA TOXOPLASMOSE ... 32
3.1 TESTS SEROLOGIQUES... 32
12
3.2 BIOLOGIE MOLECULAIRE ... 35
4 STRATEGIES DE DEPISTAGE DES POPULATIONS A RISQUES ... 35
4.1 DIAGNOSTIC DE LA TOXOPLASMOSE CHEZ L’IMMUNOCOMPETENT ... 35
4.2 4.2DIAGNOSTIC DE LA TOXOPLASMOSE CHEZ LA FEMME ENCEINTE NON IMMUNISEE ... 35
4.2.1 Dépistage initial... 36
4.2.2 Datation de l’infection ... 38
4.2.3 Diagnostic prénatal (DPN) ... 39
4.2.4 Diagnostic post-natal ... 41
4.3 DIAGNOSTIC DE LA TOXOPLASMOSE CHEZ L’IMMUNODEPRIME ... 43
4.3.1 Diagnostic chez le patient VIH ... 43
4.3.2 Diagnostic chez le patient transplanté d’organe ... 44
4.4 PLACE DES IGA DANS LA DEMARCHE DIAGNOSTIQUE D’UNE INFECTION A TOXOPLASMA GONDII ... 45
MATERIEL ET METHODES ... 46
5 OBJECTIFS DE L’ETUDE ... 46
6 DESCRIPTION DES GROUPES ... 46
6.1 GROUPE SEROCONVERSION CHEZ LA FEMME ENCEINTE IMMUNOCOMPETENTE ... 46
6.2 GROUPE TOXOPLASMOSE CONGENITALE : GROUPE TC ... 46
6.3 GROUPE REACTIVATION ... 47
7 METHODES ... 48
7.1 GROUPE SEROCONVERSION CHEZ LA FEMME ENCEINTE IMMUNOCOMPETENTE ... 48
7.2 GROUPE TOXOPLASMOSE CONGENITALE (TC)... 48
7.3 GROUPE REACTIVATION ... 49
7.4 METHODES DE DOSAGES UTILISEES ... 50
RESULTATS ... 51
8 GROUPE TOXOPLASMOSE CONGENITALE (TC) ... 51
8.1 EXPLORATIONS BIOLOGIQUES SUR SANG DE CORDON (A J0) CHEZ LES SUJETS ATTEINTS DE TC(N=96) ... 51
8.2 EXPLORATIONS BIOLOGIQUES SUR SANG DE CORDON (A J0) CHEZ LES SUJETS INDEMNES DE TC(N=467) ... 52
8.3 EXPLORATIONS BIOLOGIQUES POST-J0 DES SUJETS ATTEINTS DE TC(N=25) ... 53
8.4 EXPLORATIONS BIOLOGIQUES POST-J0 DES SUJETS INDEMNES DE TC(N=467) ... 54
8.5 INFLUENCE DU TRAITEMENT ANTENATAL SUR LA DETECTION DES IGA SUR SANG DE CORDON (J0) ... 55
9 GROUPE SEROCONVERSION ... 55
13
10.1 GROUPE REACTIVATION SEROLOGIQUE AVEC PRESENCE D’IGA(N=47) ... 58
10.2 GROUPE PROBABLE REACTIVATION SEROLOGIQUE AVEC ABSENCE D’IGA(N=70) ... 60
10.3 GROUPE REACTIVATION CLINIQUE (N=15) ... 61
DISCUSSION... 64
11 GROUPE TOXOPLASMOSE CONGENITALE (TC) ... 64
12 GROUPE SEROCONVERSION ... 71
13 GROUPE REACTIVATION ... 73
CONCLUSION ... 79
14
LISTE DES ABREVIATIONS
Ac : Anticorps
ADN : Acide Désoxyribonucléique ADP : Adénopathies
AEG : Altération de l’Etat Général BFP : Barriere Foeto-Placentaire BHE : Barriere Hémato-Encéphalique CD4 : Lymphocyte T CD4
CNR : Centre National de référence CRP : Protéine C Réactive
CSH : Cellules Souches Hématopoïétiques D+ : Donneur immunisé contre la toxoplasmose DPN : Diagnostic Prénatal
ECLIA : Electrochemiluminescence Immunoassay ELISA : Enzyme Linked Immunosorbent Assay GB : Globule Blanc
HA : Humeur Aqueuse HAS : Haute Autorité de Santé IC : Immunocompetent ID : Immunodéprimé
IFI : Immunofluorescence Indirecte IgA : Immunoglobuline A
IgG : Immunoglobuline G IgM : Immunoglobuline M
IMG : Interruption Médicale de la Grossesse IRM : Imagerie par Résonnance Magnétique IS : Immunosupresseur
ISAGA : Immunosorbent Agglutination Assay
J0 : Exploration à l’accouchement
LA : Liquide Amniotique
15 LCR : Liquide Céphalo-Rachidien
LDH : Lactate Déshydrogénase
LED : Lupus Erythémateux Disséminé Ly : Lymphocyte
MIU : Mort in utero NN : Nouveau-Né
PCR : Polymerase Chain Reaction PCT : Procalcitonine
R- : Receveur non immunisé contre la toxoplasmose SA : Semaine d’aménorrhée
Se : Sensibilité
SEP : Sclérose en plaque SNC : Système Nerveux Central Sp : Spécificité
T.gondii : Toxoplasma gondii TC : Toxoplasmose Congénitale UI : Unité Internationale
VIH : Virus de l’Immunodéficience Humaine VN : Valeurs Normales
VPN : Valeur Prédictive Négative VPP : Valeur Prédictive Positive VS : Vitesse de Sédimentation WB : Western Blot
16
LISTES DES FIGURES
Figure 1 : Oocystes de T.gondii : autofluorescence en microscopie sous UV (330-385 nm) (4) ... 20
Figure 2 : Tachyzoïtes colorés au May-Grunwald-Giemsa, culture cellulaire sur fibroblastes MRC5(2) ... 20
Figure 3 : Kyste de T.gondii dans la viande(2) ... 21
Figure 4 : Cycle reproductif de Toxoplasma gondii (9) ... 23
Figure 5 : Pathogénicité de T.gondii (13) ... 24
Figure 6 : Répartition des différents génotypes en France en 2016 (9) ... 25
Figure 7 : Rétinochoroïdite consécutive à une toxoplasmose congénitale (13) ... 26
Figure 8 : Toxoplasmose cérébrale (IRM) (13)... 28
Figure 9 : Évolution de la séroprévalence de la toxoplasmose en France (en %) chez les femmes enceintes entre 1995 et 2010.(34) ... 29
Figure 10 : Incidence de la toxoplasmose congénitale entre 2007-2016 en France (33) ... 31
Figure 11 : Fréquence des formes symptomatiques chez les nouveaux nés atteints de TC entre 2007-2016 (33) ... 31
Figure 12 : Interprétation et conduite à tenir devant un profil IgG-/IgM- (48)... 36
Figure 13 : Interprétation et conduite à tenir devant un profil IgG+/IgM- (48) ... 37
Figure 14 : Interprétation et conduite à tenir devant un profil IgG-/IgM+ (48) ... 37
Figure 15 : Interprétation et conduite à tenir devant un profil IgG équivoque/IgM-(48) ... 38
Figure 16 : Interprétation et conduite à tenir devant un profil IgG+/IgM+(48) ... 39
Figure 17 : Diagnostic prénatal dans les cas de suspicions de toxoplasmose congénitale.(49) ... 40
Figure 18 : Conduite à tenir devant une séroconversion chez la femme enceinte.(49) ... 40
Figure 19 : Explorations chez le nouveau-né suspect de toxoplasmose congénitale(33) ... 42
Figure 20 : Performances diagnostiques néonatal et postnatal des IgA et IgM(56) ... 67
Figure 21 : Etude des performances de l’ISAGA-A lors du diagnostic néonatal et durant le suivi post-natal.(57) ... 68
Figure 22 : Influence du traitement prénatal maternel sur la détection néonatale des IgA sur sang de cordon ... 70
17
LISTES DES TABLEAUX
Tableau 1 : Présentation clinique de la toxoplasmose congénitale en fonction du moment de
l’infection(20,21,26) ... 27
Tableau 2 : Nombres de cas recensés par le CNR Toxoplasmose entre 2007-2016 (33) ... 30
Tableau 3 : Enfants diagnostiqués TC par méthodes sérologiques IgA/IgM sur sang de cordon ... 52
Tableau 4 : Sensibilités des IgA / IgM au cours du suivi postnatal chez l’enfant TC (+) ... 54
Tableau 5 : Résultats des séroconversions chez la femme en enceinte (n=25) ... 58
Tableau 6 : Caractéristiques clinico- biologiques de patients avec réactivations sérologiques ... 60
Tableau 7 : Caractéristiques clinico- biologiques de 15 cas de réactivations toxoplasmiques ... 63
Tableau 8 : Moyenne des différents marqueurs biologiques explorés dans le groupe avec réactivation sérologique ... 74
Tableau 9 : Moyenne des différents marqueurs biologiques explorés dans le groupe avec probable réactivation sérologique ... 75
18
INTRODUCTION
La toxoplasmose est une anthropozoonose parasitaire cosmopolite, due à un protozoaire intracellulaire obligatoire : Toxoplasma gondii décrit pour la 1ère fois en 1908.
Si la toxoplasmose acquise est bénigne chez l’immunocompétent dans la majorité des cas, elle présente un risque sérieux chez les personnes présentant un système immunitaire affaibli (immunodéprimés, greffés) et la femme enceinte. Une primo-infection en cours de grossesse peut avoir en effet des conséquences graves sur le fœtus : mort in utero, fœtopathie associant hydrocéphalie, choriorétinite et calcifications intracrâniennes.
Ceci a justifié en France la mise en place d’un programme de dépistage chez les femmes enceintes non immunisées. Ce programme comprend un dépistage sérologique, des conseils de préventions et un diagnostic prénatal. En ce qui concerne les patients immunodéprimés tels que les patients atteint par le virus du sida ou les patients sous traitement immunosuppresseurs, le risque à craindre est une réactivation d’une infection toxoplasmique ancienne avec comme manifestations principale une toxoplasmose cérébrale ou disséminée dont le pronostic est sévère.
Le diagnostic biologique de la toxoplasmose repose sur la mise en évidence directe du parasite par biologie moléculaire essentiellement et sur l’exploration de la réponse humorale. Depuis la mise en place du programme de dépistage de femmes enceintes, un Centre National de Référence a été créé.
Les données de la littérature confirmées et complétées par les précisions et préconisations du CNR ont permis de codifier et de mettre à jour la nomenclature des actes de biologie médicale dans le diagnostic de la toxoplasmose congénitale (période pré et post natale) ainsi que chez l’immunodéprimé. Ainsi le dosage des immunoglobulines A est conseillé dans ces deux situations. Les Immunoglobulines A sont souvent rapportées à travers la littérature dans le dépistage de la toxoplasmose congénitale ou de réactivation toxoplasmique, mais très peu d’études récentes ont évalué sa sensibilité dans un contexte d’infection évolutive.
Dans ce travail, après un rappel sur la physiopathologie, l’épidémiologie, ainsi que les conséquences cliniques dans les différentes populations à risques, nous avons évalué les performances du dosage des IgA dans le diagnostic de la toxoplasmose.
19 Nous évaluerons son intérêt à travers une étude rétrospective menée dans 3 types de populations à risques : les femmes présentant une séroconversion durant la grossesse, les nouveau-nés avec suspicion de toxoplasmose congénitale, et chez les immunodéprimés suspects de réactivations toxoplasmiques.
20
1 GENERALITES SUR TOXOPLASMA GONDII
1.1 Agent pathogène
Toxoplasma gondii, est un protozoaire à développement intracellulaire obligatoire
appartenant au Phylum des Apicomplexa, dans l’ordre des Coccidies Il est responsable de la toxoplasmose qui est une anthropozoonose cosmopolite. T.gondii est capable de parasiter toutes les cellules nucléés de l’organisme, et se présente sous 3 différentes formes infestantes (1–3).
1.1.1 Forme de dissémination
Le sporozoïte, contenu dans l’oocyste qui est la forme de résistance dans le milieu extérieur infectant l’hôte intermédiaire
Figure 1 : Oocystes de T.gondii : autofluorescence en microscopie sous UV (330-385 nm) (4)
1.1.2 Forme trophozoïte
Le tachyzoïte, forme de multiplication rapide lors des phases actives de l’infection, capable de pénétrer tout type cellulaire : placenta, barrière hémato-encéphalique (BHE).
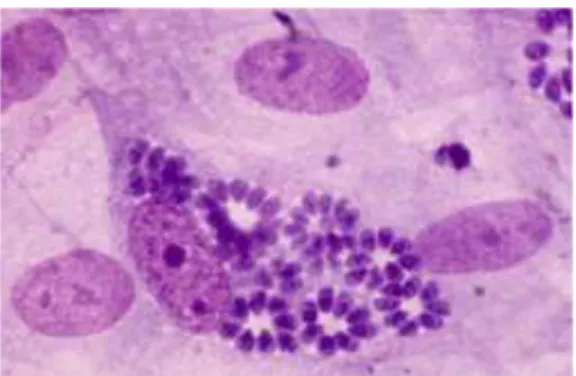
Figure 2 : Tachyzoïtes colorés au May-Grunwald-Giemsa, culture cellulaire sur fibroblastes MRC5(2)
21 1.1.3 Forme latente
Le bradyzoïte, au sein de kystes persistant à l’état latent durant toute la vie de l’hôte
(préférentiellement dans les neurones, astrocytes, les cellules musculaires et
rétiniennes)(1,5,6).
Figure 3 : Kyste de T.gondii dans la viande(2)
1.2 Cycle évolutif
Le cycle parasitaire comporte un cycle sexué chez les hôtes définitifs (chats et autres félidés) et une multiplication asexuée chez les hôtes intermédiaires (l’Homme, et autres animaux à sang chaud : oiseaux ou mammifères).
1.2.1 - Cycle complet sexué
Les félidés s'infectent par ingestion des hôtes intermédiaires infectés qui hébergent des kystes dans leurs tissus. Les bradyzoïtes libérés des kystes dans le tube digestif du chat pénètrent dans les cellules épithéliales intestinales. Après une phase de multiplication asexuée par schizogonie, certains parasites peuvent se transformer dans les cellules épithéliales en gamétocytes, puis en gamètes soit mâles soit femelles (phase de gamétogonie). L'union d'un gamète mâle et d'un gamète femelle aboutit à la formation d'un oocyste non sporulé qui est émis dans les fèces du chat. En quelques jours, dans le milieu extérieur, se produit une sporulation au sein de l'oocyste qui donne naissance aux sporozoïtes contenus dans des oocystes matures ou sporulés. Ces oocystes sporulés qui souillent le sol, les végétaux et l'eau sont à l'origine de la contamination des hôtes intermédiaires. Après ingestion des oocystes par l'hôte intermédiaire, les sporozoïtes libérés des oocystes envahissent les cellules intestinales et se transforment en tachyzoïtes. Les tachyzoïtes se multiplient dans n'importe quelle cellule nucléée et se disséminent dans l'organisme. Après quelques jours d'évolution, les tachyzoïtes ralentissent leur multiplication et se transforment en bradyzoïtes au sein de structures
22 kystiques intratissulaires. Les kystes prédominent dans les muscles et le système nerveux des animaux infectés. Ils sont à l'origine de l'infection des félidés par carnivorisme.(3,5,6)
1.2.2 - Cycle incomplet asexué
La particularité du toxoplasme est la possibilité de transmission du parasite entre hôtes intermédiaires : les bradyzoïtes contenus dans les kystes sont également infectants pour d'autres hôtes intermédiaires. Le toxoplasme pourra donc se propager par carnivorisme, entre hôtes intermédiaires, dans un cycle totalement asexué ne faisant pas intervenir l'hôte définitif (3,5,6).
1.2.3 Mode de contamination chez l’Homme
L’Homme se contamine par ingestion de kystes tissulaires présents dans la viande infectée crue ou insuffisamment cuite (représentant la majorité des cas), ou en ingérant des oocystes présents sur des végétaux ou dans de l’eau contaminés. (3,5,6)
Outre la contamination par ingestion d’aliments ou d’eau contaminés, il existe d’autres voies de contamination moins fréquentes chez l’Homme mais cliniquement redoutables faisant l’objet d’une attention particulière : la transmission verticale mère-enfant au cours de la grossesse et la transmission par transplantation d’organe provenant d’une personne infectée (transmission de kystes d’un donneur séropositif pour la toxoplasmose vers un receveur négatif avant la greffe(7,8). La transfusion sanguine d’un donneur en phase parasitémique d’une toxoplasmose (contamination directe par les tachyzoïtes) est également une source potentielle de contamination, mais très peu de cas sont décrits.
23
Figure 4 : Cycle reproductif de Toxoplasma gondii (9)
2 POUVOIR PATHOGENE ET POPULATIONS A RISQUES
2.1 Pouvoir pathogène de Toxoplasma gondii
La toxoplasmose est l’infection parasitaire la plus répandue dans le monde et aucun signe clinique n’est observé dans 80% des cas(10). Lors de la primo-infection par le toxoplasme, les cellules de l’immunité innée, monocytes/macrophages, polynucléaires neutrophiles et cellules Natural Killers, sont les premières à intervenir au niveau du site de pénétration du parasite et secrètent des cytokines participant au recrutement des cellules de l’immunité adaptative. L’immunité adaptative humorale permet de limiter la dissémination du parasite dans l’organisme en assurant une lyse du parasite extracellulaire, suivie par l’immunité cellulaire médiée par les lymphocytes T CD4(Th1) et CD8+. Dans certains organes peu accessibles aux cellules du système immunitaire, tels que les muscles cardiaques et squelettiques, le cerveau et la rétine, le parasite persiste sous la forme de bradyzoïtes
24 contenus dans des kystes pour le reste de la vie. Une immunodépression qu’elle que soit sa cause (d’origine pathogène, oncogène ou iatrogène) peut entraîner une réactivation, pouvant se traduire par une atteinte symptomatique d’un organe [(œil, poumon, système nerveux central (SNC)] ou par une toxoplasmose disséminée avec un taux élevé de mortalité en l’absence de traitement spécifique(1,3,5,6,11).Toutefois une réactivation clinique est possible chez un immunocompétent cela conduisant le plus souvent à des choriorétinites (12).
Figure 5 : Pathogénicité de T.gondii (13)
Il existe 3 génotypes connus de T.gondii à travers le monde, le génotype 2 représente la majorité des cas recensés en France (80% des cas) le plus souvent associés à des toxoplasmoses asymptomatiques ou infracliniques, tandis que les souches atypiques ou les souches dites recombinantes sont à l’origine d’atteintes sévères chez des patients immunocompétents.(3,14). C’est le cas des souches celles isolées en lien avec un cycle sauvage du toxoplasme en Amazonie, chez ces patients immunocompétents, des formes graves avec détresse respiratoire aiguë, voire des formes mortelles ont été décrites notamment en Guyane Française(15). Quelques rares cas avec formes graves ont aussi été décrites en France métropolitaine, les souches à l’origine de ces cas sévères sont génétiquement différentes de celles circulant habituellement. Voyages, transport d’aliments contribuent à la dissémination de ces souches hautement pathogènes. Un moyen d’évaluer cette diversité des souches responsables des toxoplasmoses symptomatiques pourrait venir du sérotypage que le CNR tente de développer depuis 2017.(9)
25
Figure 6 : Répartition des différents génotypes en France en 2016 (9)
2.2 Populations à risque
2.2.1 La femme enceinte non immunisée
Une partie de la population particulièrement à risque vis-à-vis de l’infection toxoplasmique concerne les femmes enceintes : la préoccupation étant le risque de transmission au fœtus. La mère immunocompétente est le plus souvent asymptomatique lors de la primo-infection, mais la capacité du toxoplasme à franchir les barrières biologiques, et notamment le placenta, entraîne un risque de contamination fœtale et plus particulièrement lors de la phase initiale de parasitémie qui suit généralement une primo-infection toxoplasmique et dont la durée est mal connue à ce jour.
Chez le fœtus et/ou le nouveau-né (=NN), l’infection toxoplasmique est favorisée par l’immaturité du système immunitaire. L’absence de complément (empêchant la lyse du parasite) et des lymphocytes T avec une capacité limitée de reconnaissance des antigènes, sont à l’origine d’un état de tolérance vis à vis de l’antigène toxoplasmique. Ce phénomène de tolérance expliquerait les réactivations chez le sujet atteint de toxoplasmose congénitale à l’origine des épisodes de rétinochoroïdite observées durant le suivi post-natal(16). La toxoplasmose congénitale (TC) est définie comme la contamination in utéro du fœtus par
Toxoplasma gondii. L'infection congénitale entraîne une maladie récurrente (persistance à vie
des kystes) chez les enfants infectés pouvant se présenter sous différents tableaux cliniques comprenant des atteintes asymptomatiques, modérées (choriorétinite) et sévères (mort in utero)(17,18).
26
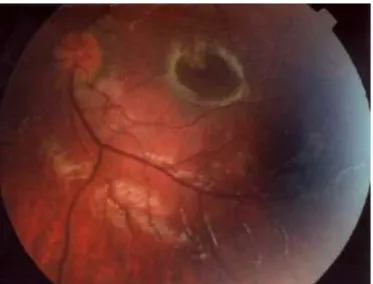
Figure 7 : Rétinochoroïdite consécutive à une toxoplasmose congénitale (13)
d’après Derouin et Al. 2005
Depuis 1978, les autorités de santé publique françaises ont mis en place un programme de prévention et de dépistage de la toxoplasmose congénitale, comprenant un dépistage sérologique mensuel de toutes les femmes enceintes séronégatives ,un traitement en cas de séroconversion, et une mise à disposition d’un dépistage prénatal(19).
La sévérité de la TC dépend de différents paramètres notamment l’âge gestationnelle au moment de la primo-infection. Le risque de transmission fœto-placentaire du parasite augmente avec l’âge gestationnelle. A l’inverse, la gravité de l’infection fœtale évolue de façon opposée. Ainsi au cours du 1er trimestre de la grossesse, l’infection fœtale survient dans 4 à 14 % des cas mais se traduit dans la majorité des cas par une forme sévère ou une perte fœtale. A l’inverse, lors du 3ème trimestre de la grossesse, le passage transplacentaire se produit dans plus de 50 % (et proche de 90% au dernier mois de grossesse) des cas mais n’est à l’origine, le plus souvent, que d’une forme infraclinique. Dans une étude plus récente le risque de transmission durant le 1er, 2eme, et 3eme trimestre sont estimés respectivement à 7%, 24% et 59%(20). Au total, le risque de transmission materno-fœtale au cours de la grossesse est estimé autour de 30 %(21). Dans un contexte d’immunodépression, des cas de TC survenant chez une femme enceinte déjà immunisée contre la toxoplasmose ont été décrits suite à une réactivation toxoplasmique(22,23). De très rares cas de TC ont été décrits suite à une primo-infection survenant en période anté-conceptionnelle (définie comme survenant 2 mois avant la conception)(24,25).
27 Chez le NN les retentissements cliniques dépendent donc de plusieurs facteurs, tel que l’âge gestationnel (corrélé au stade de développement placentaire), la précocité d’un traitement maternel, le passage placentaire d’anticorps maternels ou le type de souche
T.gondii.(21,26). Schématiquement la TC peut se révéler sous 3 grands tableaux cliniques :
Tableaux cliniques TC sévère TC bénigne TC asymptomatique
Terme grossesse Début de grossesse 2ème ou 3ème mois de grossesse Fin de grossesse
Fréquences symptômes 3% 7% 90% Fréquences transmissions 7% 24% 59% Symptômes Encéphalo-méningo-myélite,macrocéphalie avec hydrocéphalie, calcifications intracrâniennes rétinochoroïdite, infection
néonatale grave possible (fièvre, ictère, hépatosplénomégalie) Rétinochoroïdite, Retard psychomoteur, hydrocéphalie et convulsions pigmentaire, calcifications intracrâniennes Asymptomatique à la naissance, Séquelles possible de type altération visuelle et
auditive, voire troubles psychomoteur Tableau 1 : Présentation clinique de la toxoplasmose congénitale en fonction du moment de
l’infection(20,21,26)
2.3 Sujets Immunodéprimés 2.3.1 Les situations à risques
Chez des sujets déjà immunisés, la rupture des kystes tissulaires latents peut aboutir à une réactivation d’une toxoplasmose contractée par le passé, lorsque le terrain est favorable. Un déficit de l’immunité à médiation cellulaire faisant intervenir les lymphocytes T, permet une reprise de la réplication du parasite et donc un risque de dissémination dans l’organisme. Ce sont des situations souvent observées chez les patients immunodéprimés contaminé par le VIH ayant un taux de CD4 <100/mm3 ou chez les patients transplantés pour lesquels des immunosuppresseurs sont souvent instauré en prévention d’un rejet de greffe, mais aussi chez les patients atteints d’hémopathie maligne, sous chimiothérapie anticancéreuse ou sous corticostéroïdes au long cours(27,28). Lors de transplantation d’organe provenant d’un donneur séropositif pour la toxoplasmose (D+) et un receveur séronégatif (R-), en l’absence de prophylaxie spécifique anti-T.gondii, une primo-infection peut survenir par la rupture des kystes latents contenus dans le greffon (les greffe cardiaques sont particulièrement à risques dû au tropisme du parasite pour le cœur)(3,5,29). Chez un patient séropositif pour le VIH avec
un taux de CD4 <100/mm3 une prophylaxie primaire anti-toxoplasmique est indiquée. Pour un
28 par cotrimoxazole anti-Pneumocystis jirovecii instauré habituellement pour des taux de CD4 en dessous de ce seuil, est également actif sur T.gondii.
2.3.2 Présentation clinique chez l’immunodéprimé
Le tableau est celui d’une maladie opportuniste qui peut être potentiellement grave, très souvent mortelle en l’absence de traitement. Schématiquement on peut classer les atteintes en 2 catégories : les atteintes localisées et disséminées. Parmi les atteintes localisées, l’atteinte la plus fréquente est celle du SNC se traduisant le plus souvent par une toxoplasmose cérébrale, elle représente la pathologie opportuniste la plus fréquente chez le patient VIH (30).
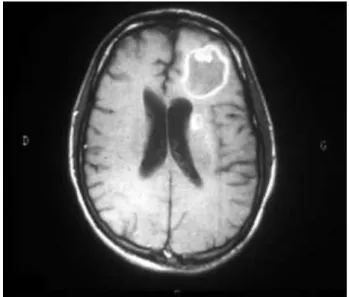
Figure 8 : Toxoplasmose cérébrale (IRM) (13)
d’après Derouin et Al. 2005
D’autres formes de reactivations sont également observées telles que l’atteinte oculaire (choriorétinite le plus souvent), et l’atteinte pulmonaire avec un tableau de pneumopathie interstitielle fébrile hypoxemiante.
Mais tous les organes peuvent être atteints lors de la dissémination hématogène qui suit une primo-infection ou une réactivation chez un patient immunodéprimé cela pouvant aboutir à une toxoplasmose disséminée souvent fatale sans traitement spécifique(27).
29 2.4 Epidémiologie
2.4.1 Sujet immunocompétent
Les enquêtes nationales de prévalence de la toxoplasmose au sein de la population générale sont essentiellement celles ciblant les femmes enceintes, les seules à bénéficier d’un programme de dépistage systématique. La séroprévalence de la toxoplasmose a considérablement diminué ces dernières décennies avec une baisse de la prévalence régulière au cours du temps. Les 3 enquêtes nationales périnatales de 1995, 2003 et 2010 ont permis de combiner les données de 42 208 femmes âgées de 15 à 45 ans. Ainsi la séroprévalence moyenne chez les femmes enceintes estimée à 54,3% en 1995 (31), et à 43,8% en 2003 (32) a encore chuté ces dernières années, estimée en 2010 à 37,8%.(33)
Figure 9 : Évolution de la séroprévalence de la toxoplasmose en France (en %) chez les femmes enceintes entre 1995 et 2010.(34)
Le nombre de nouveaux cas diagnostiqués suivent la même tendance avec une incidence qui passe de 7,5/ 1000 femmes en 1980 à 3,5/ 1000 femmes en 2000 et à 1,9 /1000 femmes en 2012.(19,35,36)
2.4.2 Sujet Immunodéprimé
Lors des transplantations d’organes, notamment cardiaques, en cas de discordance entre le statut sérologique du Donneur déjà immunisé contre le parasite (D+) et du Receveur séronégatif pour la toxoplasme (R-) (mismatch), l’incidence de la toxoplasmose en l’absence de prophylaxie a été rapportée entre 30 et 75 %(5,37,38). Le risque est plus important que
30 chez les greffés de cellules souches hématopoïétiques (CSH), chez ces derniers, une toxoplasmose symptomatique est liée à un phénomène de réactivation à la suite de rupture de kystes latents sous l’effet du traitement immunosuppresseur. Ce phénomène est très peu décrit dans la littérature et l’incidence moyenne chez les greffés de CSH est de 0,8% (39,40). Les cas de transmission de l’infection par des organes autres que cœur et poumon sont beaucoup moins fréquents.(5,37) On estime que le risque d’un patient VIH+ immunisé contre T. gondii de développer une encéphalite toxoplasmique est de l’ordre de 25 %(30).
Très peu de données sur l’incidence de réactivations sont disponibles et les rares résultats sont variables selon les études. L’incidence des cas de toxoplasmose chez les sujets transplantés est liée à la séroprévalence de l’infection dans la population générale, très variable d’une région à l’autre. Les différences d’incidence observées dans la littérature expliqueraient en partie l’hétérogénéité des pratiques entre les pays, en matière de suivi biologique et de chimioprophylaxie anti-toxoplasmique post-transplantation(41,42).
2.4.3 Toxoplasmose Congénitale
Les données récentes permettent une estimation de la prévalence globale de la toxoplasmose congénitale observée en France est de 3,1/10 000 naissances, la prévalence des cas de toxoplasmose congénitale diagnostiqués à la naissance est de 2/10 000 naissances. La létalité liée à la toxoplasmose congénitale est de 2 % (stabilité depuis 2007) et la morbidité globale représente 8% (taux assez stable au cours du temps, entre 8 et 10% depuis 2007).(33) D’après les cas recensés par le réseau TOXOSURV mis en place par le CNR toxoplasmose, entre 2007 et 2016, 2273 cas de TC ont été recensés. Dans 2024 cas (89,0%) la poursuite de la grossesse fut possible, 105 (4,6%) interruptions de grossesse ont eu lieu (IMG ou pertes fœtales) et 144 cas perdus de vue.
2007 2008 2009 2010 2011 2012 2013 2014 2015 2016 Cas TC(+) 272 268 266 244 186 204 179 216 246 192 Naissances 234 233 228 207 173 176 165 205 231 172 Asymptomatiques 206 206 203 189 147 161 148 191 211 157 IMG/MIU 11 16 23 12 5 12 9 7 5 5 Formes sévères 7 8 8 5 9 7 5 4 5 2 Formes modérées 21 19 17 13 17 8 12 10 15 13
Tableau 2 : Nombres de cas recensés par le CNR Toxoplasmose entre 2007-2016 (33) TC : Toxoplasmose congénitale ; IMG : Interruption médicale de grossesse ; MIU : Mort in utero
31 Sur les 2024 naissances diagnostiqué TC, 1819 cas (90,0%) sont asymptomatiques, 145 cas (7,2% ) atteints de forme modérées, et 60 cas (3,0%) ont contractés une forme sévères.(33).Le taux d’incidence estimé en 2007 et en 2012 de la TC en France étaient respectivement de 2,9/10 000 naissances et de 2,58/10 000 naissances. Le taux d'incidence estimé de la toxoplasmose congénitale symptomatique était de 0,34/1000 naissances. Depuis ces dernières données l’incidence suit une tendance plutôt stable (35,36,43).
Figure 10 : Incidence de la toxoplasmose congénitale entre 2007-2016 en France (33)
Figure 11 : Fréquence des formes symptomatiques chez les nouveaux nés atteints de TC entre 2007-2016 (33)
32 La mise sous traitement de la mère lors de toute séroconversion au cours de la grossesse semble réduire considérablement le nombre de cas de TC symptomatiques. Une étude réalisée aux Etats Unis sur une cohorte de 164 femmes enceintes avec séroconversion durant la grossesse mais n’ayant pas bénéficiées de traitement spécifique anti-T.gondii en prénatal ont monté une proportion de cas de TC symptomatique s’élevant à 84% (choriorétinite 92,2% des cas, des calcifications intracrâniennes 79,6% des cas, et hydrocéphalie 67,7% des cas)(44).
3 OUTILS DIAGNOSTICS DE LA TOXOPLASMOSE
Plusieurs méthodes diagnostiques permettent de détecter une contamination par le toxoplasme. Soit par des méthodes indirectes explorant l’immunité humorale (sérologies), soit par des méthodes directes (mis en évidence directement de l’agent pathogène).
Les tests sérologiques évoqués dans le cadre de cette évaluation portent tous sur la recherche des anticorps spécifiques anti-Toxoplasma gondii, la spécificité des anticorps n’est pas systématiquement rappelée.
3.1 Tests sérologiques
La méthode sérologique représente la technique de 1ère intention, adaptée pour le dépistage en routine. Le diagnostic de l'infection repose principalement sur des tests sérologiques visant à détecter les anticorps IgM et IgG dirigés contre T.gondii.
La recherche de toxoplasme sur sérum comprend plusieurs techniques dont certaines sont réservés à des laboratoires dits « experts » pour diverses raisons : technique manuelle, interprétation difficile, technique onéreuse.
Cinétique des anticorps
Les cinétiques obtenues varient en fonction des individus et de la sensibilité des techniques utilisées. Les IgM anti-Toxoplasma apparaissent habituellement pendant la semaine suivant l’infection aiguë. Leur niveau augmente jusqu’à un pic atteint vers 1 à 2 mois. La cinétique d’apparition des IgA décrite dans la littérature suit quasiment le même
33 schéma que les IgM. Une lente diminution du taux des IgM se produit entre un à six mois suivants lac contamination jusqu’à négativation, mais ces anticorps restent le plus souvent détectables un an ou plus. Les IgA disparaissent généralement plus rapidement mais peuvent être détectées jusqu’à neuf mois après l’infection. Les IgG sont détectées environ 2 à 3 semaines après l’infection aiguë et sont maximales après environ 2 à 3 mois. Leur taux diminue alors globalement au cours des deux années suivantes jusqu’à des niveaux résiduels qui persistent toute la vie de l’individu(5,7,29,45).
Il est essentiel de choisir les bonnes méthodes au bon coût. Cependant, le choix de la méthode peut être fonction de la prévalence de l'infection dans le pays en question, des recommandations locales ou nationales pour le suivi, et peut également dépendre de la situation clinique observée, par exemple les femmes enceintes, les NN et les patients immunodéprimés.
Les performances des méthodes sont très variables et il peut être difficile de choisir parmi les méthodes de dosages historiques, tels que le Dye Test, l’hémagglutination, l’agglutination après immunocapture pour le dosage des IgM (ISAGA), les tests d'immunofluorescence indirecte (IFI) ou les méthodes diagnostics plus récentes qui sont automatisées : ELISA, ECLIA, voir les méthodes les plus spécialisées telles que le Western Blot.(5,29)
Néanmoins, ces méthodes doivent être séparées en deux groupes afin d'optimiser l'interprétation des données sérologiques, l'une étant destinée à un dépistage rapide ou automatisé et l'autre à des tests de confirmation. Les méthodes de criblage sont soit peu onéreuses, soit limitées à une petite quantité de sérum, comme c'est le cas, par exemple pour l'hémagglutination, ou sont automatisés dans le cas d'un processus de dépistage plus important comme ELISA ou ECLIA. Les méthodes de confirmation sont principalement des méthodes internes, complexes ou coûteuses, telles que le Dye Test, l’IFI, le Western Blot, le test de mesure de l’avidité des IgG, l’ISAGA IgM ou la détection quantitative des IgA (par ISAGA
ou PlateliaTM Toxo-IgA (Bio-rad®). Ces dernières méthodes doivent être traitées
exclusivement dans des centres de référence.
Le diagnostic de l'infection repose sur des tests sérologiques visant à détecter les anticorps IgM et IgG dirigés contre T.gondii. Cependant, la présence d’IgM spécifique ne suffit pas pour conclure à une infection récente, en effet la détection d'IgM peut parfois persister des mois après la primo-infection. Lorsqu’on retrouve des IgG et des IgM, le test
34 d’avidité IgG est un moyen rapide de distinguer une infection récente d’une infection ancienne.(46).
La cinétique des IgG peut également apporter des informations de datation de l’infection, sur la base de l’analyse de deux échantillons séparés de trois semaines et traités en même temps par la même technique, la stabilisation du titre en IgG traduit une infection toxoplasmique datant de plus de 2 à 3 mois à la date du premier sérum.(5,45).
La mesure de la force de liaison de l’anticorps, qui augmente au fil du temps, est évaluée par une technique de type ELISA modifiée par l’introduction d’un agent dissociant (tel que l’urée) permettant de décrocher les anticorps de faible avidité. Les titre d’IgG entre les échantillons traités et non traités permettent de calculer un ratio appelé indice d’avidité. Un
indice d’avidité élevé indique une infection acquise plus de 4 mois à la date du 1er sérum. Un
indice élevé après l’ajout de 2-mercaptoethanol (destruction des IgM) permet de préciser la
datation à plus de 2 mois à la date du 1er sérum. En revanche une avidité faible ne permet pas
d’affirmer une infection récente et d’autres explorations biologiques sont nécessaires. (5,29,47)
Enfin, le dernier degré de complexité du diagnostic sérologique de la toxoplasmose réside dans l'interprétation des données acquises par ces différentes méthodes. Les conclusions de la sérologie peuvent conduire à une prophylaxie primaire, à un traitement spécifique, à un suivi sérologique et à une investigation plus invasive des formes de toxoplasmoses, telles que l'amniocentèse, le lavage broncho-alvéolaire (LBA), le prélèvement de liquide céphalorachidien, etc.(29)
3.1.1 ISAGA (Immunosorbent Agglutination Assay) ou PLATELIA
La technique ISAGA (BioMérieux®) peut être utilisée pour la recherche d’IgM ou
d’IgA. Elle est basée sur le principe d’immunocapture, le fond des puits de plaques est sensibilisé par des anticorps recombinants dirigés contre les IgM ou IgA humaines. L’incubation du sérum humain dans ces cupules permet une capture des IgM ou IgA. Après lavage, une suspension de toxoplasmes formolés est ajoutée dans les cupules, révélant ainsi seulement les Ac spécifiques de T. gondii. Il s’agit d’une technique très sensible permettant une détection précoce, et très spécifique pour la recherche des IgM et IgA car non influencé par la présence de facteur rhumatoïde et d’un titre élevé d’IgG par comparaison aux autres techniques de détection des IgM utilisés en première ligne. L’ISAGA représente la méthode
35 de choix pour confirmer un résultat positif en IgM retrouvé lors d’un dépistage. La réalisation du test est facile, il existe un test commercial mais la lecture demande un certain degré d’expertise.
Les IgM et IgA peuvent être également recherchés par la technique PlateliaTM Toxo-
(Bio-rad®) qui est basé sur le principe d’immunocapture similaire à la technique ISAGA. Les
sensibilités et spécificités des deux tests sont comparables.
3.2 Biologie moléculaire
La PCR (Polymerase Chain Reaction) permet de mettre en évidence directement l’ADN du parasite dans quasiment tous les liquides biologiques (sang total, sang de cordon, LCR, Liquide Amniotique (LA), Humeur Aqueuse (HA), Placenta, biopsie). Les techniques de biologie moléculaire utilisé dans le diagnostic médical ciblent principalement des séquences spécifiques d’ADN, due gène B1 ou d’une une séquence de 529 paires de bases (REP-529), présente de manière répétitive dans le génome du parasite et absente chez l’Homme. Du fait de sa sensibilité élevée et de son champ d’application, la PCR est la méthode de référence pour la mise en évidence directe du parasite. Sur la base des données collectées annuellement entre 2007 et 2012 par le CNR de la toxoplasmose, la sensibilité estimée du DPN par PCR en temps réel de l’ordre de 90 %. Les résultats faussement négatifs sont probablement le résultat de très faibles concentrations de parasites dans le LA ou d’une transmission du parasite de la mère au fœtus postérieure à la date de l’amniocentèse en raison du délai de transfert placentaire.(45).
4 STRATEGIES DE DEPISTAGE DES POPULATIONS A RISQUES
4.1 Diagnostic de la toxoplasmose chez l’immunocompétent
Lors d’une suspicion d’infection toxoplasmique chez le patient immunocompétent non gravide, le diagnostic repose essentiellement sur des tests sérologiques objectivant une séroconversion. Le résultat est mis en balance avec la clinique : présence de fièvre, adénopathies et/ou asthénie profonde.
36 4.2.1 Dépistage initial
Le diagnostic sérologique de la toxoplasmose chez l’immunocompétent, essentiellement réalisé chez la femme enceinte, consiste à rechercher des IgM et IgG
anti-T.gondii dans le sérum.
Un résultat IgM positif devra être confirmé par une seconde technique (ISAGA IgM le plus souvent). Une présence associée d’IgG et d’IgM donnera lieu à un test de mesure de l’avidité des IgG afin de dater l’infection. Une présence isolée d’IgG se traduit par un profil sérologique d’immunité ancienne qui devra être confirmé par un second prélèvement à 3 semaines d’intervalle pour écarter toute ascension du titre en IgG, qui serait synonyme d’infection évolutive.
Le logigramme décisionnel varie en fonction du profil sérologique, les situations les plus fréquemment observées lors d’un dépistage sont soit un patient présentant un profil
positif en IgG, soit un patient naïf de toxoplasmose.
37
Figure 13 : Interprétation et conduite à tenir devant un profil IgG+/IgM- (48)
Un résultat IgM positif devra être confirmé par une seconde technique (ISAGA M le plus souvent), afin de confirmer avec certitude le caractère aigu de l’infection car des interférences analytiques sont possibles avec des IgM naturelles ou le facteur rhumatoïde produisant une réaction faussement positive.
38 Lors du dépistage, un résultat douteux en IgG avec absence d’IgM doit être confirmé par une seconde technique avec une sensibilité élevé pour la détection les IgG (Western Blot) pour pouvoir évaluer le risque potentiel selon les situations clinques et mettre en place un suivi et des conseils adaptés :
Figure 15 : Interprétation et conduite à tenir devant un profil IgG équivoque/IgM-(48)
4.2.2 Datation de l’infection
Chez la femme enceinte, la principale préoccupation est le risque de transmission du parasite au fœtus dont l’incidence est la plus élevée en début de grossesse. Dater l’infection permet de situer la contamination comme pergravidique, périconceptionnelle (période allant de 1 mois avant la conception et 1 mois après la conception) ou antéconceptionnelle (1 mois avant l’accouchement).
Une infection pergravidique entre 6 Semaines d’aménorrhée (SA) et 36 SA chez une femme non immune pour le toxoplasme pose l’indication d’une amniocentèse. La patiente est alors dirigée vers un centre de diagnostic prénatal (CDPN). A l’inverse la datation peut aussi éviter de pratiquer ce geste invasif en cas d’infection datée à plus de 1 mois avant le début de la grossesse, écartant tout risque de transmission verticale de l’infection.
39
Figure 16 : Interprétation et conduite à tenir devant un profil IgG+/IgM+(48)
4.2.3 Diagnostic prénatal (DPN)
L’amniocentèse ne doit pas être réalisée avant la 18ème semaine d’aménorrhée, et nécessite un délai minimum de 4 semaines à compter de la date d’infection maternelle afin d’éviter un résultat faussement négatif dû au délai de transfert transplacentaire. La collecte du LA permettra de mettre en évidence directement le parasite par PCR.
La PCR toxoplasmose dans le LA est aujourd’hui la méthode de choix pour le DPN d’infection toxoplasmique. La sensibilité de la PCR toxoplasmose sur LA semble varier en fonction du trimestre pendant lequel la mère a acquis l’infection. Pour le 1er trimestre : 75 % ; 2nd trimestre : 97 % ; 3ème trimestre : 88 %. La spécificité est estimée de l’ordre de 100 %. La VPN dans le LA est excellente estimée à 99% au 1er et 2nd trimestre et serait moins bonne au 3ème trimestre à 82 %. La VPP quant à elle est de 100% tout au long de la grossesse. Un résultat négatif dans le LA ne peut donc pas exclure une infection fœtale.
40
Figure 17 : Diagnostic prénatal dans les cas de suspicions de toxoplasmose congénitale.(49)
Un suivi échographique mensuel et un examen clinique néonatale poussé sont indispensables pour toute les séroconversions y compris celles pour lesquelles la PCR sur LA est négative (45).
41 Devant toute séroconversion survenant durant la grossesse la patiente est mise sous
traitement prophylactique par Rovamycine (Spiramycine®) jusqu’à l’accouchement afin
d’éviter la colonisation placentaire par le parasite et réduire le risque de contamination fœtal. Une PCR positive sur LA signe une atteinte du fœtus et dès lors le traitement par Rovamycine est remplacé par le Fansidar® (Sulfadoxine /Pyriméthamine) ou Malocide/Adiazine jusqu’à la fin de la grossesse (5,50).
4.2.4 Diagnostic post-natal
4.2.4.1 Diagnostic sur sang de cordon (= à J0)
En cas de DPN non réalisé ou négatif, un dépistage sérologique et parasitologique doit être réalisé à la naissance et comprend une PCR sur placenta, sur un éventuel LA de délivrance et/ou sang de cordon, associé à une recherche sérologique d’IgM, IgG, et/ou IgA dans le sang de cordon et le sang maternelle (communément appelé « Bilan mère-enfant »).
En cas de positivité des IgM et IGA chez le NN, une répétition du test sérologique à environ 10 jours de vie permet de confirmer un résultat positif obtenu à la naissance: en effet le placenta peut laisser passer une partie des IgG, et parfois des IgM et IgA d’origine maternelles.(29) Pour mettre en évidence une néosynthèse d’anticorps par le NN en cas de contamination in utero, une technique de Western Blot comparé (Profil immunologique comparé) est utilisé pour comparer des profils sériques appariés IgG et IgM entre la mère et le NN. Il permet de mettre en évidence une spécificité antigénique différente des anticorps du NN par rapport à ceux de la mère.
4.2.4.2 Diagnostic après J0
Après la recherche à J0, un suivi sérologique est débuté pendant 1 an en suivant la décroissance du titre d’IgG maternelle jusqu’à négativation complète, une persistance des IgG au-delà de 12 mois de vie traduit une TC. Toute modification de cette décroissance, soit par une stabilisation, soit par une augmentation du titre d’IgG signe également une TC. Les recherches après J0 chez le NN sont réalisées à J10, à 1 mois, 2 mois, 3 mois, 6 mois, 9 et 12 mois de vie. Une recherche d’IgM ou d’IgA positive à J10 ,ou au-delà permet de poser le diagnostic de TC (38).
42
43 4.3 Diagnostic de la toxoplasmose chez l’immunodéprimé
4.3.1 Diagnostic chez le patient VIH
La toxoplasmose cérébrale est la manifestation clinique la plus fréquente d’une réactivation toxoplasmique. Son diagnostic est avant tout présomptif et repose sur un faisceau d’argument clinico- biologique associés à des anomalies caractéristiques à l’imagerie (prise de contraste annulaire associé à un œdème péri-lésionnel). La présence d’une immunisation ancienne représenté par une sérologie positive avec la présence d’IgG anti-Toxoplasma,
troubles neurologiques, taux de CD4< 200/mm3, et une réponse favorable clinico-
radiologique sous traitement adapté intervenant dans les 2 premières semaines sont des arguments en faveur d’une toxoplasmose cérébrale.
Les recommandations actuelles préconisent un dépistage sérologique de la toxoplasmose lors du bilan biologique initial à la suite de la découverte d’une séropositivité pour le VIH. Un patient présentant une sérologie positive en IgG pour la toxoplasmose traduisant une immunité ancienne est sujet à risque de réactivation dû à la présence de kyste latents au sein de l’organisme.il est recommandé de suivre régulièrement cette sérologie pour déceler toute variation. Lorsque le dépistage de la toxoplasmose est négatif lors du bilan initial, un contrôle annuel est recommandé et des conseils hygiéno-diététiques, similaires à ceux prodigués aux femmes enceintes séronégatives, sont rappelés au patient afin de prévenir toute séroconversion toxoplasmique (5). Lors d’une suspicion de toxoplasmose cérébrale, une sérologie positive en IgG indique seulement les patients à risques de réactivation sans pour autant pouvoir affirmer le diagnostic, seule une augmentation du titre des IgG pourrait être indicatrice de réactivation mais selon les études des augmentations de taux IgG associé ou pas à l’apparition d’autres isotypes M ou A sont souvent observés sans répercussions aux niveau clinique.(38)
La majorité des cas d’encéphalite toxoplasmique font suite à une réactivation sérologique plutôt qu’une primo-infection toxoplasmique. De rares cas d’encéphalite toxoplasmique ont été décrits chez des patients ayant des sérologies négatives pour la toxoplasmose, la fréquence varient selon les études allant de 6 à 16 %, le diagnostic étant posé par l’imagerie ou par l’amélioration sous traitement spécifique anti-T.gondii, les hypothèses
44 avancés par les auteurs sont une primo infection récente, ou une altération de l’immunité humorale rendant impossible la production d’anticorps spécifiques contre la toxoplasmose (5,51). La mise en évidence directe de l’ADN du parasite par PCR sur biopsie cérébrale est la seule méthode pour affirmer le diagnostic de toxoplasmose cérébrale mais, du fait du risque qu’entraine un tel geste invasif, elle est très peu réalisée et ses indications sont limitées aux cas d’échecs thérapeutiques face aux traitements spécifiques.
En cas de suspicion de réactivation d’autres explorations sont possibles apportant un argument diagnostic supplémentaire. Une PCR (+) sur LCR ou sur LBA permet de confirmer un diagnostic, respectivement, de toxoplasmose cérébrale ou pulmonaire. Les études portant sur les performances diagnostics de la PCR sur LCR avant début du traitement spécifiques anti-T.gondii rapportent une sensibilité assez médiocre de l’ordre de 50% ce qui implique qu’une PCR négative ne permet pas d’écarter une atteinte cérébrale. En revanche la spécificité proche de 100% (pas de circulation du parasite retrouvée en dehors des cas de réactivation) dans l’ensemble des études nous montrent que lorsque le génome parasitaire est retrouvé dans le LCR la toxoplasmose cérébrale est confirmée, et tend à devenir la technique de 1ère ligne pour la recherche directe du parasite (51,52). La PCR sur sang total est très rarement contributive sauf en cas de toxoplasmose disséminé, une atteinte généralisée assez rarement observée.(5)
4.3.2 Diagnostic chez le patient transplanté d’organe
Un dépistage sérologique de la toxoplasmose doit être réalisé systématiquement en pré-greffe afin d’identifier les patients à risques, notamment transplantés cardiaques et greffées de cellules souches hématopoïétiques.
Le risque de toxoplasmose sévère chez le patient transplanté d’organe est causé par une discordance (mismatch) entre les statuts sérologiques d’un donneur chroniquement infecté (D+) et d’un receveur séronégatif (R-) qui reçoit un greffon contenant des toxoplasmes enkystés. Sous l’influence du traitement immunosuppresseur, favorisant la rupture des kystes présents dans le greffon (D+) et la diffusion des tachyzoïtes, un risque élevé de primo-infection sévère chez le receveur R- impose une surveillance régulière en post-greffe par des méthodes sérologiques similaires à ceux mis en œuvre chez l’immunocompétent.(5)
Lors du suivi post-greffe les receveurs initialement immunisés en pré-greffe (R+) peuvent bénéficier d’un traitement prophylactique anti-toxoplasmique afin de prévenir une réactivation suite aux traitements immunosuppresseurs, le cas échéant un suivi hebdomadaire
45 par PCR sur sang total permet de dépister précocement une infection évolutive. La sérologie n’a que peu d’intérêt diagnostic au sein de cette population car des réactivation sérologique avec des augmentation de titre d’un facteur 4 sont observés sans signes cliniques d’infection évolutive.(39)
Par ailleurs, chez les patients non immunisés en pré-greffe (R-), un suivi sérologique identique à celui réalisé chez l’immunocompétent doit être mis en place pour déceler une séroconversion en post-greffe. Toutefois le traitement immunosuppresseur peut retarder ou
annihiler la production d’ Ac spécifiques, et une recherche directe, du parasite ou de son génome doit être réalisée( sang total, LCR ou LBA) pour mettre en
évidence une infection évolutive.(5,52)
4.4 Place des IgA dans la démarche diagnostique d’une infection à Toxoplasma gondii
Il existe peu d’études dans la littérature concernant les performances diagnostiques des IgA pour détecter une infection évolutive, que ce soit dans un contexte de suspicion réactivation chez l’immunodéprimé, ou dans le cadre d’une suspicion de toxoplasmose congénitale. Nous retrouvons souvent dans ces études, parmi les explorations biologiques, une recherche des IgA systématique chez les NN suspects de TC (diagnostic néonatal et screening post natal de la TC), les suspicions de séroconversion (présence d’IgM sans IgG sur un premier prélèvement) ainsi que dans les suspicions de réactivation chez un patient immunodéprimé. Les IgA pourraient être un argument supplémentaire au diagnostic précoce des différentes infections à T.gondii, cependant très peu d’études traitent de la pertinence de cette immunoglobuline.
46
MATERIEL ET METHODES
5 Objectifs de l’étude
Nous avons réalisé une étude rétrospective monocentrique sur des patients que l’on peut repartir en trois grands groupes cliniques. Parmi ces patients, certains entrent dans le cadre d’une stratégie globale de prévention, c’est le cas de la femme enceinte pour laquelle un suivi mensuel est préconisé lorsqu’il existe une absence d’immunisation lors du dépistage prénatal. C’est le cas également du NN de mère ayant fait une séroconversion durant sa grossesse ou dans les semaines précédant le début de la grossesse. Le dernier groupe est composé de patients suspects de réactivation toxoplasmique, symptomatiques ou pas, avec des motifs de consultations assez disparates. L’objectif principal de l’étude est d’évaluer l’intérêt des IgA lors du diagnostic de la primo-infection toxoplasmique, la toxoplasmose congénitale ou la réactivation toxoplasmique.
La sélection des patients a été réalisée sur la base de différents critères spécifiques à chaque groupe d’étude.
6 Description des groupes
6.1 Groupe séroconversion chez la femme enceinte immunocompétente
Ce groupe comprend des femmes enceintes non immunisées, suivis dans le cadre du programme français de prévention et de dépistage de la toxoplasmose congénitale. Ce suivi comprend entre autres une sérologie mensuelle jusqu’à l’accouchement. Nous avons pu sélectionner un groupe de 25 patientes enceintes, pour lesquelles une séroconversion a été observée durant leur grossesse : antériorité négative avec détection d’IgM, et apparition secondaire des IgG Nous avons observé la cinétique d’apparition des IgA ainsi que la durée après la séroconversion durant laquelle elles restent détectables.
6.2 Groupe Toxoplasmose Congénitale : groupe TC
Une base de données sur fichier Excel® répertorie les résultats des explorations cliniques et paracliniques réalisés chez des NN suspects de toxoplasmose congénitale entre 2007-2013 au sein du service de parasitologie du CHU Timone. La cohorte regroupe 563
47 couples mères-enfants. Les mères ont fait une séroconversion pendant leur grossesse : le bilan néonatal ainsi que le suivie de l’enfant a été réalisé au laboratoire de parasitologie du CHU Timone.
6.3 Groupe Réactivation
Une réactivation sérologique est définie, selon Martino et Al., par une augmentation significative du titre en IgG par un facteur 4 ou un titre élevé en IgG : la définition du titre élevé dépend de l’automate ou de la technique de dosage utilisée(39). Pour cette étude nous avons défini un seuil ≥ 150 UI/ml sur ARCHITECT(Abbott). Une réactivation sérologique s’accompagne parfois de la présence d’IgA. Dans notre laboratoire Lorsqu’un taux élevé d’IgG > 150UI/mL en technique ARCHITECT sur une première sérologie est observée, une recherche des IgA est systématiquement réalisée. Nous avons également récoltés à partir des bases de données disponibles sur le serveur du CHU Timone (AP-HM,Marseille) entre mai 2016 et mars 2018, les résultats des bilans des patients suspects de réactivation toxoplasmique clinique, et les résultats des bilans patients présentant une réactivation sérologique,. Le sous-groupe réactivation clinique comprend des cas de toxoplasmose cérébrale ou toxoplasmose disséminée. Le sous-groupe réactivation sérologique comprends des patients pour lesquels il a été mis en évidence un titre élevé ou en augmentation des IgG avec la présence d’IgA. Il est sous divisé en trois sous-groupes :
1) Groupe réactivation avec IgG ≥ 150 UI/mL sur ARCHITECT avec présence d’IgA 2) Groupe probable réactivation IgG ≥ 150 UI/mL sur ARCHITECT sans IgA
3) Groupe réactivation cliniquement prouvée. L’objectif étant de mettre en évidence une corrélation entre la réactivation sérologique, avec notamment la détection d’IgA dans le sérum, et des arguments cliniques, biologiques et radiologiques en faveur d’une réactivation clinique.