Pro-drogues agonistes du récepteur B2 de la
bradykinine activées par des peptidases
vasculaires
Mémoire
Melissa Jean
Maîtrise en médecine expérimentale
Maître ès sciences (M.sc.)
Québec, Canada
Pro-drogues agonistes du récepteur B2 de la
bradykinine activées par des peptidases
vasculaires
Mémoire
Melissa Jean
Sous la direction de :
Hélène Bachelard, codirectrice de recherche
François Marceau, directeur de recherche
iii
RÉSUMÉ
La bradykinine (BK) est une hormone peptidique libérée dans la circulation à partir des kininogènes. La BK est reconnue dans la littérature scientifique pour sa multitude d’effets pathologiques, mais elle exerce aussi un rôle protecteur dans diverses complications liées à l’ischémie cardiaque et des effets bénéfiques sur la circulation. Les effets potentiellement salutaires de la BK, soit le relâchement de monoxyde d’azote et de plasminogène de type tissulaire entrainant une vasodilatation, semblent être causés par une activation sélective des récepteurs B2 (B2R) endothéliaux. Nous avons
émis comme hypothèse qu’il était faisable de stimuler sélectivement et durablement le récepteur B2R pour ses effets bénéfiques en utilisant une variété de ligands (résistants
à des peptidases ou types pro-drogues prolongés à partir de la séquence originale de la BK). Nos objectifs spécifiques sont de vérifier l’effet de ceux-ci in vivo en mesurant des paramètres hémodynamiques et leur intensité (fréquence cardiaque, pression artérielle, signal Doppler). Des rats mâles de souche Sprague-Dawley ont été anesthésiés et deux cathéters (un dans la veine jugulaire pour l’administration des drogues en bolus (courbes doses-réponses), et l’autre dans l’artère fémorale pour la mesure des paramètres) ont été implantés. L’injection de BK provoque des épisodes hypotenseurs transitoires de courte durée. La convertase de l’angiotensine (ECA) domine dans le milieu extracellulaire du système vasculaire comme voie de dégradation principale de la BK. En présence d’énalaprilate (inhibiteur de l’ECA), la puissance de l’effet hypotenseur de la BK est augmentée de 15X. Les séquences prolongées en C-terminal régénèrent de la BK via l’action de peptidases spécifiques (clivage). Les pro-drogues libérant BK progressivement via l’activité de peptidases vasculaires ont un profil intéressant comme potentiel traitement de l’hypertension. Le fardeau des effets indésirables de ces stratégies reste à clarifier pour le développement des agonistes du B2R comme
iv
TABLE DES MATIÈRES
RÉSUMÉ ... iii
TABLE DES MATIÈRES ... iv
LISTE DES FIGURES ... vi
LISTE DES TABLEAUX ... vii
LEXIQUE ... viii
AVANT-PROPOS ... x
Chapitre 1. Introduction ... 1
1.1 Système Kallikréines-Kinines ... 1
1.1.1 Bref historique ... 1
1.1.2 Présentation du système Kallikréine-Kinine ... 2
1.1.3 Les kallikréines ... 3
1.1.4 Les kininogènes ... 5
1.1.5 Les kinines ... 5
1.2 Protéases (peptidases) ... 8
1.2.1 Métabolisme des kinines ... 9
1.2.1.1 Enzyme de conversion de l’angiotensine I ... 10
1.2.1.2 Endopeptidase neutre 24.11 ... 12
1.2.1.3 Aminopeptidase P (APP) ... 13
1.2.1.4 Aminopeptidase N (APN) ... 14
1.2.1.5 Carboxypeptidases M & N ... 14
1.3 Prostaglandines ... 15
1.4 Pro-drogues activables par des peptidases ... 16
1.5 Récepteurs des kinines ... 16
1.5.1 Le récepteur B1 ... 17
1.5.1.1 Les ligands du récepteur B1 ... 17
1.5.1.2 La régulation et la signalisation du récepteur B1 ... 18
1.5.2 Le récepteur B2 ... 19
1.5.2.1 Les ligands du récepteur B2 ... 20
1.5.2.2 La régulation et signalisation du récepteur B2 ... 21
1.5.3 Les interactions entre les deux récepteurs ... 22
1.6 Interactions entre le SRA et le SKK ... 22
v
1.7.2 L’angiotensinogène ... 25
1.7.3 L’angiotensine I ... 26
1.7.4 L’angiotensine II ... 26
1.8 Les récepteurs de l’angiotensine II ... 27
1.8.1 Le récepteur AT1 ... 28
1.8.2 Le récepteur AT2 ... 29
1.9 L’ECA 2 et l’Ang (1-7) ... 30
1.10 L’ECA et les inhibiteurs de l’ECA ... 31
1.11 Problématique ... 32 1.11.1 L’hypertension artérielle ... 32 1.11.2 L’angio-oedème ... 33 Chapitre 2 : Méthodologie ... 37 2.1 Rongeurs ... 37 2.2 Agents pharmacologiques ... 37
2.3 Préparation chirurgicale (chirurgie aseptique) ... 39
2.4 Mesures des paramètres hémodynamiques ... 40
2.5 Méthode et théorie du Doppler ... 41
2.6 Essais de liaison ... 42
2.7 Analyses statistiques ... 43
Chapitre 3. Résultats ... 44
3.1 Effets de la bradykinine sur la pression artérielle moyenne (PAM) et la fréquence cardiaque (FC). ... 44
3.1 Effets des agonistes du récepteur des kinines sur la pression artérielle moyenne (PAM) 49 3.4 Effets hémodynamiques d’injections intraveineuses de BK et autres kinines agonistes du récepteur B2 chez les rats. ... 63
Chapitre 4. Discussion ... 68
Chapitre 5. Conclusion et perspectives ... 73
vi LISTE DES FIGURES
Figure 1. Schéma du système kallikréines-kinines ... 3
Figure 2. Structure peptidique de BK et les principales enzymes la dégradant ... 15
Figure 3. Schéma du système rénine-angiotensine ... 24
Figure 4. Structures des principaux ligands et hypothèses sur leurs règles de clivages ... 36
Figure 5. Réponses hypotensives aux injections en bolus intraveineux de doses croissantes de bradykinine (BK) et de des-Arg9-BK chez les rats anesthésiés (A,B). ... 48
Figure 6. Réponses hypotensives aux injections i.v. en bolus de doses croissantes de B-9972 chez le rat anesthésié ... 51
Figure 7. Réponses hypotensives aux injections i.v. en bolus de doses croissantes de BK-Arg chez le rat anesthésié ... 54
Figure 8. Réponses hypotensives aux injections i.v. en bolus de doses croissantes de BK-His-Leu chez le rat anesthésié ... 57
Figure 9. Réponses hypotensives aux injections i.v. en bolus de doses croissantes de BK-Ala-Pro chez le rat anesthésié ... 60
Figure 10. Réponses hémodynamiques aux injections i.v. en bolus de doses croissantes de MK chez le rat anesthésié ... 62
Figure 11. Diagramme à bandes démontrant les changements maximaux de C) causés par des injections i.v. de véhicule saline-BSA 0.1%, et de doses croissantes de (A) BK (n=10), (B) B-9972 (n=7), (C) BK-Arg (n=11), et (D) BK-His-Leu (n=10) ... 65
Figure 12. Changements cardiovasculaires provoqués par des injections i.v. en bolus de BK et de trois autres analogues agonistes du récepteur B2 chez le rat anesthésié ... 67
vii LISTE DES TABLEAUX
Tableau 1.Structure primaire des kinines ... 6 Tableau 2. Affinité des ligands pour le récepteur B1 ... 18 Tableau 3. Affinité des ligands pour le récepteur B2 ... 21 Tableau 4. Comparaison des effets biologiques résultant de l’activation des 2 récepteurs de l’Ang II ... 30
Tableau 5. Paramètres In vitro des agonistes du récepteur B2R ou homologues de la BK
prolongés en C-terminal sélectionnés établi par essais de liaison avec un radioligand ... 38
Tableau 6.Valeurs basales de la pression artérielle moyenne (PAM) et de la fréquence cardiaque (FC) chez des rats anesthésiés non traités ou prétraités avec des inhibiteurs ou antagonistes spécifiques ... 46
viii LEXIQUE
ECA : enzyme de conversion de l’angiotensine APP : Aminopeptidase P
Arg : Arginine
B1R : Récepteur B1 de la bradykinine
B2R : Récepteur B2 de la bradykinine
BK : Bradykinine
BSA : albumine bovine sérique DMSO : diméthylsulfoxyde FC : fréquence cardiaque
GPCR : G-protein coupled receptor, Recepteur couple aux protéines G HAE : hereditary angioedema Angioèdeme hériditaire
I.P. : intra-péritonéal I.V.: intra-veineux
PAM : pression artérielle moyenne Cm : Centimètre
C-terminale : Carboxy terminale des-Arg9-BK : des-Arg9-bradykinine
HBSS : Hank's buffered salt solution HK : Kininogène de haut poids moléculaire SKK : Système kalikréines-kinines Leu: leucine mg : Milligramme min : Minute ml : Millilitre mM : Millimolaire mmol : Millimole µg: Microgramme µl : Microlitre µM : Micromolaire MK : maximakinin NO : monoxyde d’azote NOS : NO synthase
N-terminal : amino terminale PKC : protéine kinase C PKK : prékalikréine Pro : proline
Ser : serine
RAS : renin-angiotensin system / système rénine-angiotensine t1/2 : demi-vie
ix Tissue plasminogen activator
Val : valine µCi : Microcurie
x
AVANT-PROPOS
Tout d’abord, je tiens à remercier le Dr. François Marceau pour l’opportunité de faire ma maîtrise au sein de son équipe au CRCHUL. Ses connaissances, son expertise, et sa rigueur professionnelle font de lui un chercheur hors pair avec une éthique de travail remarquable et se fût un privilège de pouvoir faire partie de son équipe.
Je remercie aussi le Dre. Bachelard qui m’a mentoré, judicieusement conseiller et encourager tout au long de ma maîtrise. Son expertise pour les expériences in vivo et dans le domaine cardiovasculaire m’ont beaucoup apporté et les compétences acquises auprès d’elle me seront sans doute très utile dans ma future carrière. J’aimerais également la remercier de la confiance dont elle m’a témoignée et de son soutient lorsqu’il fut temps de rédiger mon mémoire.
Il va de soi de remercier Mme Johanne Bouthiller pour son support autant technique que moral. Ses précieux conseils, son organisation, sa patience et son expérience m’ont permis d’acquérir une méthode de travail qui restera toujours avec moi. Dans l’équipe du laboratoire Marceau, Francois est l’incroyable cerveau mais toi tu en es le cœur.
Je tiens à remercier mes collègues étudiants. Xavier pour ses précieux conseils qui m’ont permis d’éviter bien des erreurs et Alexandre d’avoir toujours été là pour me remonter le moral et me faire rire dans les moments plus sombres.
Mon conjoint Frédéric qui a endurer la boule de stress que j’ai été au cours de la dernière année, merci de toujours me faire sourire et me permettre d’être moi-même. Merci aussi à mes parents, surtout à ma mère qui m’a toujours épaulé mais particulièrement ses deux dernières années alors que je fus confronté à ma plus grande épreuve académique jusqu’à présent.
Merci maman de ne jamais remettre en question mes décisions, de me soutenir et de m’encourager lorsqu’une tâche ou situation semble insurmontable.
1
Chapitre 1. Introduction
Dans le corps humain, les processus biologiques et les états pathologiques sont régulés par plusieurs systèmes différents qui interagissent ensemble. Le système des kallikréines-kinines et le système rénine-angiotensine jouent un rôle important dans le maintien de l’homéostasie circulatoire en exerçant un contrôle sur les concentrations des vasoconstricteurs et des vasodilatateurs.
1.1 Système Kallikréines-Kinines
1.1.1 Bref historique
La découverte du système kallikréine-kinine (SKK) remonte au début du XXe siècle. En
1909, Abelous et Bardier, ont observé que l'injection intraveineuse d'une préparation d'urine humaine entraînait, chez le chien, une importante chute de pression artérielle (Abelous and Bardier 1909). Plus tard, en 1930, le groupe de E. Werle isola cette substance hypotensive et la nomma «kallikréine» (dérivée du grec kallikreas pour pancréas, qu'ils croyaient en être la source) (Kraut, Frey et al. 1930). Deux décennies après la découverte de la kallikréine, le groupe de Rocha e Silva décelait une autre molécule aux propriétés hypotensives, la bradykinine (BK) (Rocha e Silva, Beraldo et al. 1949). Ces auteurs montrèrent que la BK était libérée à partir d’un précurseur, qu'ils nommèrent "bradykininogène", via l'action de certaines enzymes, qui plus tard furent identifiées comme étant des sérines protéases, parmi lesquelles on distingue la kallikréine plasmatique (KP) et les kallikréines tissulaires (KT) (Bhoola, Figueroa et al. 1992). Ce n'est qu'en 1960 que la BK fut isolée à l'état pur (Boissonnas, Guttmann et al. 1960, Elliott, Horton et al. 1960, Elliott, Horton et al. 1961). C’est à partir de ce moment, la structure primaire enfin déterminée, que les travaux de recherche sur la BK se multiplièrent. Plusieurs enzymes métaboliques qui participent activement à la dégradation de la BK via la soustraction en C-terminal d'acides aminés, notamment la kininase I et la kininase II furent découvertes (Erdos 1961, Yang and Erdos 1967). Il fut d’ailleurs démontré que la kininase II était identique à l'enzyme de conversion de l'angiotensine (ECA) (Yang, Erdos et al. 1970). La notion que cette même enzyme était
2
capable d’agir à la fois sur le système rénine angiotensine (SRA), conduisant à la synthèse d'angiotensine II (un peptide vasoconstricteur) et sur le SKK, induisant la dégradation de la BK (un peptide vasodilatateur), ouvrit une importante voie de recherche pour l’industrie pharmaceutique dans le domaine de l’hypertension artérielle avec le développement des inhibiteurs de l'ECA.
1.1.2 Présentation du système Kallikréine-Kinine
Le SKK est un système peptidique vasoactif qui comprend les kallikréines (tissulaire et plasmatique), les kininogènes (haut et bas poids moléculaire), les kininases et les kinines notamment la BK. Il est principalement défini comme étant un système tissulaire, c’est-à-dire que celui-ci présente un taux de kinines beaucoup plus élevé au niveau de la microcirculation périphérique que dans la circulation générale. Il agit de concert avec plusieurs autres systèmes peptidiques et voies de signalisation (la cascade de coagulation, les voies de la fibrinolyse ainsi que le SRA) et est de ce fait impliqué dans nombreuses fonctions physiologiques telles que la régulation locale et systémique de la pression artérielle (Schmaier 2003).
En plus de jouer un rôle critique au niveau du système rénal (natriurèse) , il semble améliorer le transport ainsi que le métabolisme du glucose (Campbell 2003) et, selon plusieurs données, il serait impliqué dans un grand nombre de processus physiopathologiques cardiovasculaires dont l’hypertension artérielle, l’insuffisance cardiaque et l’angiogenèse (Griffon, Miternique-Grosse et al. 2005, Hillmeister and Persson 2012).
3 Figure 1. Schéma du système kallikréines-kinines
1.1.3 Les kallikréines
Les kallikréines sont des sérines protéases synthétisées sous forme de zymogènes (Goettig, Magdolen et al. 2010). Ces enzymes catalysent le relâchement des kinines à artir des kininogènes. Chez l’être l’humain, on en distingue deux formes principales soit la kallikréine plasmatique (KP) et la kallikréine tissulaire (KT). Les deux types de kallikréines diffèrent selon leur spécificité de substrats, de leurs propriétés physicochimiques, immunologiques et de leurs localisations (Bhoola, Figueroa et al. 1992). En fait, elles ne partagent que 38% d’homologie de séquence (Goettig, Magdolen et al. 2010). Elles sont synthétisées sous forme de précurseurs inactifs qui, une fois activées, hydrolysent avec des efficacités différentes leurs substrats respectifs (kininogène de haut et bas poids moléculaire), et libèrent des kinines.
4
La KP, une glycoprotéine de 60 kDa, est synthétisée par le foie et sécrétée dans la circulation en tant que la proenzyme prékallikréine. Elle est codée par un seul gène et ne comprend qu’une seule chaine γ-globuline (Blais, Marceau et al. 2000). La prékallikréine est l’une des sérines protéases les plus abondantes dans le plasma. On estime que près de 80 à 90% de cette enzyme circulant dans le corps est complexée avec le kininogène de haut poids moléculaire (KHPM) (Mandle, Colman et al. 1976, Reddigari and Kaplan 1989).
En utilisant le système de contact où le plasma rencontre une surface chargée négativement (ex : des lipopolysaccharides, la prékallikréine peut être activée par le facteur de coagulation XIIa (facteur de Hageman) (Zhao, Qiu et al. 2001). Elle peut aussi être activée par des protéases endothéliales lorsqu’il y a présence de zinc. Parallèlement, il y a libération de la BK à partir du KHPM en hydrolysant les liaisons Arg389-Ser390 et Lys380-Arg381 et la cascade de coagulation est initiée (Kazumine and
Nagasawa 1981, Moreau, Garbacki et al. 2005) (Mori, Sakamoto et al. 1981). La libération de la BK provoque ainsi une boucle de rétroaction positive via le système de contact (Feener 2010, Hillmeister and Persson 2012) .
Quant à la KT, elle est synthétisée dans de nombreux tissus mais majoritairement dans le pancréas, les glandes salivaires et les reins. Il existe actuellement une quinzaine de formes moléculaires fortement apparentées dans le génome humain (Chao, Chao et al. 1987, Bhoola, Figueroa et al. 1992, Mahabeer and Bhoola 2000). La KT libère la kallidine à partir de son substrat préférentiel le kininogène de bas poids moléculaire (KBPM) en clivant les liens entre les acides aminés Met379-Lys380 et Arg389
-Ser390(Mahabeer and Bhoola 2000, Fogaça, Melo et al. 2004). Les KT sont codées par
de nombreux gènes, cependant, seule la KT produite à partir de gène KLK1 chez l’homme et klk1 chez la souris produisent une enzyme ayant la capacité de générer efficacement des kinines in vivo à partir des kininogènes (Clements1989, Fogaça, Pimenta et al. 2004, Oikonomopoulou, Diamandis et al. 2010). D’autres protéases telles que la trypsine, la plasmine, les cathépsines, et calpaïnes qui sont encodées par des gènes apparentés à KT ont la capacité de produire des kinines in vitro (Meneton,
Bloch-5
Faure et al. 2001). Il est aussi important de noter que lorsque le système est atteint d’une maladie ou d’une pathologie, le corps peut activer d’autres voies pour produire des kinines en utilisant des enzymes alternatives aux kallikréines (Campbell 2003).
1.1.4 Les kininogènes
Les kininogènes sont considérés comme les précurseurs des kinines. Il existe le KBPM et le KHPM qui sont des précurseurs respectifs des peptides KD ou Lys-BK et BK (Adam, Albert et al. 1985, Moreau, Garbacki et al. 2005). Tous deux sont des glycoprotéines produites à partir du même gène structural situé sur le chromosome 3q26 par épissage alternatif produisant deux mRNA de taille différente (Kitamura, Kitagawa et al. 1985). Les deux kininogènes sont constitués d'une simple chaîne glycoprotéique ; le KHPM est une α-globuline tandis que le KBPM est une β-globuline. Ils possèdent la même séquence en acides aminés dans leurs portions N-terminale de la chaine mais diffèrent dans leur portion en C terminale. C’est cette portion C-terminale qui confère une différence fonctionnelle entre les deux kininogènes, puisque le KBPM ne possède pas de site de liaison à la prékallikréine (Müller-Esterl, Vohle-Timmermann et al. 1982, Takagaki, Kitamura et al. 1985). Les kininogènes sont principalement synthétisés dans le foie (Campbell 2003), mais sont également présents en grande quantité dans le plasma (Nakanishi 1987, Chao, Chao et al. 1987, Iwai, Matsunaga et al. 1988, Poblete, Reynolds et al. 1991, Figueroa, Henderson et al. 1992, Chao, Simson et al. 1993). Une troisième forme de kininogène existe : le T-Kininogène, retrouvé uniquement chez le rat et la souri, libère une kinine spécifique à ces espèces : la T-kinine (ou Ile-Ser-BK) (Okamoto and Greenbaum 1983, Okamoto and Greenbaum 1983, Blais, Marceau et al. 2000).
1.1.5 Les kinines
Les kinines sont des hormones autacoïdes actives seulement près de leur site de formation. Elles agissent localement de façon paracrine puisqu’elles sont dégradées
6
rapidement une fois relâchées dans la circulation in vivo (Marceau and Regoli 2004). Cette caractéristique des kinines reflète l’importance d’avoir une régulation locale par les enzymes présentes à la surface cellulaire. Les kinines semblent conserver une grande homologie de séquence puisqu’elles sont semblables chez plusieurs espèces (reptiles, insectes, oiseaux etc.) (Bhoola, Figueroa et al. 1992).
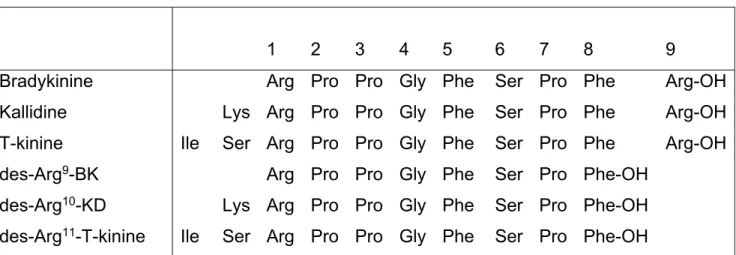
La famille des kinines comprend la BK, la kallidine (KD; Lys-BK), la T-kinine (Ile-Ser-BK, retrouvée uniquement chez le rat et les rongeurs apparentés) et leurs métabolites actifs dépourvus de l’arginine en position carboxy-terminal : des-Arg9-BK et Lys-des-Arg9-BK.
(Tableau 1). La BK et la KD, des kinines dites natives, sont issues de deux voies métaboliques différentes, l'une plasmatique et l'autre tissulaire, tel que vu à la section 1.3 sur les kallikréines.
Tableau 1.Structure primaire des kinines1
1 2 3 4 5 6 7 8 9 Bradykinine Kallidine T-kinine des-Arg9-BK des-Arg10-KD des-Arg11-T-kinine Ile Ile Lys Ser Lys Ser Arg Arg Arg Arg Arg Arg Pro Pro Pro Pro Pro Pro Pro Pro Pro Pro Pro Pro Gly Gly Gly Gly Gly Gly Phe Phe Phe Phe Phe Phe Ser Ser Ser Ser Ser Ser Pro Pro Pro Pro Pro Pro Phe Phe Phe Phe-OH Phe-OH Phe-OH Arg-OH Arg-OH Arg-OH
Malgré le fait que les kinines sont généralement de petites molécules possédant entre neuf et onze acides aminés, elles sont tout de même très puissantes puisqu’une concentration de l’ordre de nanomoles est suffisante pour activer leurs récepteurs et produire un effet biologique. Les multiples effets des kinines sont médiés par deux récepteurs couplés aux protéines G, soit le récepteur B1R et le B2R. La BK, la KD et la
T-kinine se lient préférentiellement au récepteur B2R tandis que la des-Arg9-BK et
7
Arg10-KD sont les agonistes préférentiels du B1R (Regoli and Barabe 1980, Marceau,
Hess et al. 1998).
Les kinines sont des médiateurs importants impliqués dans une variété d'effets biologiques, incluant l'homéostasie cardiovasculaire, l'inflammation et la nociception (Marceau and Bachvarov 1998, Couture, Harrisson et al. 2001).
La BK est l’une des kinines les plus importantes. C’est une hormone peptidique de 9 acides aminés libérée dans la circulation par l’action enzymatique des kallikréines (Leeb-Lundberg, Marceau et al. 2005). Ce petit peptide a d’abord été reconnu pour son effet vasodépresseur sur le système cardiovasculaire. La BK agit directement sur les cellules du muscle lisse, mais peut également recruter l’intervention de médiateurs tels que la prostacycline, le monoxyde d’azote (NO) et d’autres prostaglandines (Barrow, Dollery et al. 1986) (O'Kane, Webb et al. 1995). Chez le chien et le rat, l’injection de BK in vivo chez provoque une augmentation du débit sanguin rénal (associée à une diminution des résistances vasculaires) et une augmentation de l’excrétion hydrosodée (Willis, Ludens et al. 1969, Thomas, Bell et al. 1982, Granger and Hall 1985, Hillmeister and Persson 2012). La BK participe aussi au maintien de la balance entre les vasodilatateurs et les vasoconstricteurs du système circulatoire assurant ainsi une constance du flux sanguin aux organes vitaux. D’une manière, elle régule la pression artérielle et les fonctions rénales et cardiaques par l’activation de cellules endothéliales vasculaires causant une vasodilatation, en relâchant du plasminogène de type tissulaire (tPA), par la production de NO et la mobilisation d’acide arachidonique (Brown, Gainer et al. 2000, Manolis, Marketou et al. 2010). La BK est également reconnue dans la littérature pour avoir un rôle clé dans les réactions inflammatoires. En effet, lorsque la BK exogène est injectée dans des tissus humains ou d’autres espèces animales, elle déclenche rapidement les quatre signes classiques de l’inflammation soit une rougeur, de la douleur, de la chaleur et un gonflement (œdème). L’œdème est en partie le résultat d’une vasodilatation des artérioles précapillaires et d’une contraction des veinules post-capillaires stimulée par la BK et qui provoque une augmentation de la pression hydrostatique intracapillaire. Ceci, combiné avec une stimulation des cellules endothéliales vasculaires, augmente la perméabilité microvasculaire et favorise ainsi
8
l’extravasation plasmatique de fluides et de protéines. Quant à la douleur, elle est le résultat d’une contraction directe des fibres afférentes sensorielles. La BK participe donc dans le processus inflammatoire grâce à son habileté à causer de la vasodilatation, de l’hyperémie, des fuites vasculaires et de la sensation de douleur (Leeb-Lundberg, Marceau et al. 2005, Moreau, Garbacki et al. 2005, Elliott, Horton 1960).
La BK est reconnue pour ses effets bénéfiques et protecteurs dans l’hypertension artérielle et semble aussi conférer une protection aux organes ciblés par la maladie en augmentant la circulation et favorisant le développement d’un réseau capillaire dans le myocarde (Marketou and Vardas 2012). Certaines données indiquent qu’elle réduit le stress oxydatif et, conséquemment, la sénescence des cellules endothéliales. Il est intéressant de constater que la sénescence vasculaire est associée à un nombre réduit de récepteurs B2 de la BK et d’une réduction de la réponse au NO en présence de BK
(Vasa, Breitschopf et al. 2000, Kintsurashvili, Duka et al. 2005). La BK suscite de plus en plus d’intérêt grâce aux multiples démonstrations de ses effets salutaires et protecteurs. Dans les dernières années, ce peptide d’intérêt a fait l'objet de nombreux travaux de recherche dans le domaine de la pharmacologie en utilisant différents analogues agonistes et antagonistes spécifiques et sélectifs, et également via l’utilisation de modèles animaux transgéniques ou de type knockout, utilisés in vivo. Ces études ont permis de confirmer les hypothèses le rôle protecteur cardiovasculaire et rénal de la BK. (Yang, Liu et al. 1997, Bascands, Schanstra et al. 2003, Griol-Charhbili, Messadi-Laribi et al. 2005, Kakoki, McGarrah et al. 2007, Xi, Das et al. 2008).
1.2 Protéases (peptidases)
Les protéases ou peptidases sont des enzymes impliquées dans plusieurs processus tant biologiques que pathologiques. Grâce à un mécanisme appelé la protéolyse, les protéases coupent différents substrats à des endroits spécifiques de manière irréversible leur fonction essentielle résidant dans l'inactivation de leur substrat peptidique. (Choi, Swierczewska et al. 2012). Bien qu’elles soient présentes dans de
9
nombreux tissus et organes, chacune possède sa propre spécificité tissulaire ou cellulaire. De plus, les protéases sont très nombreuses : on en dénombre plus de 569 produites par les cellules humaines. Les protéases peuvent être subdivisées en deux grandes catégories : les endopeptidases et les exopeptidases. Les exopeptidases libèrent un ou deux acides aminés de la portion N- ou C- terminale de leur substrat, tandis que les endopeptidases clivent un lien peptidique à l’intérieur même de la chaîne polypeptidique du substrat (Skidgel 1992). Il est possible de catégoriser les protéases en 5 sous-classes selon la nature de leur site catalytique : les protéases à site actif sérine, à thréonine, à cystéine, les protéases aspartiques et les métallopeptidases (López-Otín and Matrisian 2007).
Les protéases jouent une multitude de rôles importants dans divers processus et systèmes comme dans la prolifération cellulaire, la fertilisation, le système immunitaire, les réactions inflammatoires, la sénescence, la nécrose et l’apoptose cellulaire. Plusieurs études ont d’ailleurs démontré l’implication des protéases dans plusieurs pathologies telles que le cancer.
1.2.1 Métabolisme des kinines
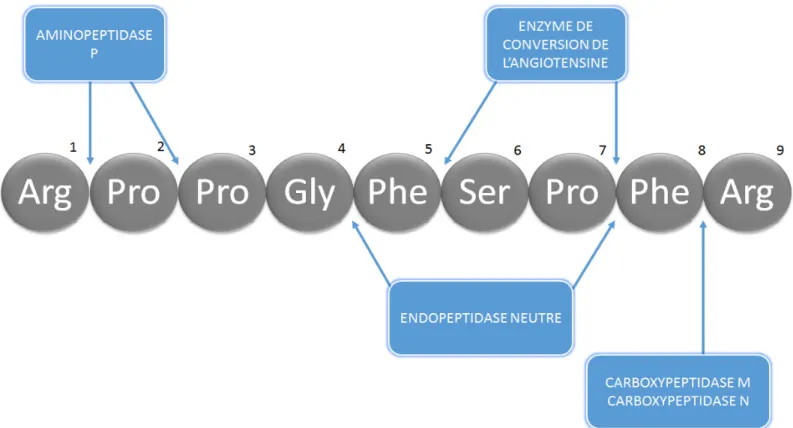
Le métabolisme des kinines est régulé par de nombreuses peptidases. Dans le corps humain, 4 métallopeptidases à zinc ont été identifiées comme étant les principaux acteurs dans le métabolisme de la BK (Leeb-Lundberg, Marceau et al. 2005). Étant largement distribuées, ces enzymes permettent le contrôle des concentrations locales et circulantes de kinines. Leur ordre d’importance varie selon plusieurs facteurs tels que l’espèce et le contexte pathophysiologie (Campbell 2003). La plus importante chez l’homme est l’enzyme de conversion de l’angiotensine I (ECA), aussi connue sous le nom de kininase II. Par la suite, il y a l’aminopeptidase P (APP) et N (APN), l’endopeptidase neutre 24.11 (NEP ou néprilysine) et finalement les carboxypeptidases M et N (CPM et CPN) collectivement appelées kininases I (Moreau, Garbacki et al. 2005). Ce sont toutes des glycoprotéines membranaires, sauf la CPN qui elle est présente sous forme de glycoprotéine tétramérique soluble. Par contre, il est important
10
de souligner qu’elles sont toutes présentes sous forme soluble, notamment dans le plasma et dans les fluides biologiques, puisqu’une certaine proportion de ces ectopeptidases est clivée à la surface endothéliale. Comme ce sont des métallopeptidases à zinc, la présence de zinc dans leur site catalytique est indispensable pour permettre l’hydrolyse de ses substrats ; sans ce groupe métallique, toute l’activité catalytique est perdue.
1.2.1.1 Enzyme de conversion de l’angiotensine I
L'enzyme de conversion de l’angiotensine I (ECA) est connue dans la littérature scientifique sous plusieurs noms tels que la kininase II et EC 3.4.15.1. Il s’agit d’une dipeptidyl carboxypeptidase de type 1, laquelle est liée à la membrane cellulaire par une séquence d’ancrage canonique retrouvée en position C-terminale et dont le domaine catalytique extracellulaire est orienté en N-terminale et se retrouvent exposés sur la surface cellulaire (Moreau, Garbacki et al. 2005). L’ECA est distribuée de façon ubiquitaire, mais se retrouve particulièrement en abondance dans l’endothélium vasculaire. On en retrouve aussi dans plusieurs liquides biologiques comme le plasma. L’ECA retrouvée dans les fluides biologiques provient de cellules endothéliales, épithéliales et germinales. Il en existe 3 formes, mais seulement deux de ces formes sont exprimées chez l’humain (Blais, Marceau et al. 2000). La forme dite somatique est la plus large (150-180 kDa). Elle est composée d’approximativement 1300 acides aminés et est présente dans la plupart des tissus (endothélium vasculaire, poumon, rein). La forme plus petite (100-110 kDa), composée de 730 acides aminés, est souvent appelée l’ECA germinale ou testiculaire puisque celle-ci est uniquement retrouvée dans les testicules (Hagaman, Moyer et al. 1988, Turner and Hooper 2002). Elle jouerait d’ailleurs un rôle dans la fertilité masculine et serait impliquée dans le cancer testiculaire (Bernstein, Howard et al. 1992, Franke, Pauls et al. 2003). La forme somatique est composée de deux sites catalytiques identifiés comme étant le domaine amino et le domaine carboxy (Moreau, Garbacki et al. 2005). Ces deux domaines partagent une homologie de plus de 60% tant au niveau de leurs séquences nucléotidiques que de leurs séquences en acides aminés (Blais, Marceau et al. 2000).
11
Chacun comporte un site actif capable de lier un ligand, et il est postulé que le gène de l’ECA serait en fait le produit d’une duplication puis d’une fusion d’un gène plus ancien (Blais, Marceau et al. 2000). Malgré le fait que cette enzyme contienne deux sites actifs, lesquels présentent une même cinétique de dégradation de la BK, ils différent dans leurs paramètres cinétiques de l’hydrolyse d’autres substrats et également dans leur sensibilité à l’activation par le chlore (Costerousse, Jaspard et al. 1992 Blais, Marceau et al. 2000). La forme germinale de l’ECA ne contient qu’un seul domaine, lequel correspond au domaine carboxy de l’ECA somatique. De même, la régulation de leur activité est sous des contrôles hormonaux différents. L’activité de l’ECA somatique est sous le contrôle des glucocorticoïdes, tandis que la forme testiculaire est stimulée par les androgènes. Malgré ces différences, les deux enzymes sont toutes deux transcrites à partir du même gène (17q23), mais par des promoteurs différents.
Bien que l’ECA fut d'abord connue pour son rôle dans la conversion de l'angiotensine I, un peptide inactif, en angiotensine II (un puissant agent vasoconstricteur), elle est également présente dans le SKK. La BK possède une affinité pour l'ECA vingt fois supérieure à celle de l’angiotensine I (Km de 16 µM pour l'angiotensine I versus un Km
de 0.18 µM pour la BK) (Blais, Marceau et al. 2000). Cette enzyme est au centre de deux systèmes importants et relie le SKK et le SRA.
L’ECA inactive la BK en hydrolysant 2 liens peptidiques du côté C-terminal. Tout d’abord, elle hydrolyse le lien Pro7-Phe8 créant ainsi le peptide inactif BK (1-7). À partir
de BK (1-7), elle peut ensuite générer BK (1-5) en clivant le lien Phe5-Ser6. Plus
précisément dans le système SRA, l’ECA catalyse également la conversion de l’angiotensine I en l’agent vasopresseur angiotensine II en enlevant le dipeptide His9
-Leu10 de la portion C-terminale (Kuoppala, Lindstedt et al. 2000).
En ayant un rôle si important dans deux systèmes qui assurent l’homéostasie cardiovasculaire, l’industrie pharmaceutique a ouvert une importante voie de recherche dans le développement des inhibiteurs de l’ECA. Ces inhibiteurs constituent une importante famille de médicaments pour le traitement de l’hypertension artérielle et de
12
plusieurs maladies cardiovasculaires, dont l’insuffisance cardiaque, l’infarctus du myocarde et la néphropathie diabétique (Izzo Jr and Weir 2011). En dépit du fait que les effets cardioprotecteurs de l’inhibition d’ECA ont été majoritairement attribués à l’inhibition de la formation de la substance hypertensive, angiotensine II du SRA, de nombreux résultats d’études scientifiques obtenus chez l’humain et la souris indiquent qu’une fraction des effets thérapeutiques de l’inhibition de l’ECA serait aussi médiée par des kinines endogènes du SKK, en prévenant leur dégradation et conservant de cette façon leurs effets vasodilatateurs, natriuétiques et diurétiques. (Linz, Wiemer et al. 1995, Liu, Yang et al. 1997, Gainer, Morrow et al. 1998, Squire, O’Kane et al. 2000, Pretorius, Rosenbaum et al. 2003, Leeb-Lundberg, Marceau et al. 2005, Marketou and Vardas 2012) . Les inhibiteurs d’ECA sont couramment utilisés comme thérapies dans les maladies cardiovasculaires et rénales (Izzo Jr and Weir 2011). Cependant, ces inhibiteurs présentent parfois des effets secondaires chez certains individus, dont un risque accru d'angio-oedème (Nussberger et coll., 1998; 2002) qui résulterait d'une accumulation de BK et de ses effets sur la perméabilité vasculaire (Charignon, Späth et al. 2012). Un médicament nommé icatibant ou plus souvent retrouvé sous le nom Firazyr (antagoniste sélectif et compétitif du récepteur B2) a récemment fait son entrée
sur le marché pharmaceutique. Il est rapidement devenu le traitement de choix pour traiter les crises d’angio-oedème héréditaire ou HAE (Charignon, Späth et al. 2012).
1.2.1.2 Endopeptidase neutre 24.11
L’endopeptidase neutre ou neprilysine est une protéine de surface liée à la membrane. Cette enzyme possède un seul domaine transmembranaire de 24 acides aminés, alors que les 700 acides aminés situés du côté C-terminal composent la partie extracellulaire et permettent l’ancrage de la peptidase à la surface membranaire. Celle-ci est résistante à l’action protéolytique des protéases extracellulaires. La séquence de l’enzyme humaine est très bien conservée et possède un grand degré d’homologie avec celles des espèces de rat et de lapin (Blais, Marceau et al. 2000). La NEP a été identifiée pour la toute première fois au niveau des reins, mais est également exprimée dans de multiples tissus comme les poumons, la moelle osseuse, ainsi que dans
13
différentes cellules et tissus du système nerveux central (Sales, Dutriez et al. 1991). Le rôle de l’endopeptidase varie selon sa distribution et la présence des substrats disponibles. Par exemple, dans les reins, elle est l’enzyme préférentiellement responsable du métabolisme des kinines, tandis que dans l’endothélium, NEP a une influence fondamentale dans le métabolisme de la BK. Elle n’a toutefois pas d’importance majeure dans le plasma en ce qui a trait au métabolisme des kinines (Moreau, Garbacki et al. 2005). Ses cibles préférentielles sont les liens hydrophobiques retrouvés en position N-terminale. Lorsque qu’en présence de BK, tout comme l’ECA, elle hydrolyse d'abord les deux acides aminés (Phe8-Arg9) situés à l'extrémité
C-terminale, suivi du retrait de trois autres acides aminés (Phe5-Ser6-Pro7) produisant
ainsi le peptide inactif BK(1-4). L’endopeptidase peut toutefois cliver d’autres peptides et
hormones tels que le facteur natriurétique auriculaire, ocytocine et des peptides opioïdes.
1.2.1.3 Aminopeptidase P (APP)
L'APP est une métallopeptidase présente sous deux formes soit la cAPP qui est une forme cytosolique et la mAPP qui est liée à la membrane. Les deux formes d’exopeptidases agissent spécifiquement à l’extrémité N-terminale de leur substrat en leur retranchant l’acide aminé terminal lié à une proline. La forme membranaire de l’APP agit sur la portion N-terminale des kinines BK et des-Arg9-BK qui contiennent une
proline comme deuxième acide aminé. Ce clivage de l’acide aminé terminal transforme ainsi les kinines en deux métabolites inactifs BK(2-9) et des-Arg9-BK(2-8) (Moreau,
Garbacki et al. 2005). Puisque la séquence naturelle de la BK contient une proline comme deuxième acide aminé en partant du N-terminal, l’aminopeptidase P est capable de cliver le lien entre la proline et l’arginine en position 1, rendant ainsi la BK inactive (Skidgel 1992, Décarie, Raymond et al. 1996, Blais, Marceau et al. 2000).
14 1.2.1.4 Aminopeptidase N (APN)
L'APN est une métallopeptidase distribuée de façon ubiquitaire possédant un large registre de substrats. Son activité est très importante dans le SKK, puisqu'elle retire en N-terminale l'acide aminé Lys des kinines Lys-BK et Lys-des-Arg9-BK, créant ainsi des
métabolites inactifs.
1.2.1.5 Carboxypeptidases M & N
Les carboxypeptidases M et N, aussi connues sous le nom de kininases 1, sont des carboxypeptidases de type B qui présentent 41% d’homologie de séquence entre elles. Ces enzymes se distinguent par leur distribution : la carboxypeptidase N est synthétisée dans le foie et relâchée dans le sang, tandis que la carboxypeptidase M est retrouvée au niveau de l'épithélium rénal et pulmonaire (Moreau, Dubreuil et al. 2005). La fonction principale des carboxypeptidases M et N est de cliver spécifiquement des résidus arginines en terminal. Puisque les kinines BK et Lys-BK possède une arginine en C-terminal, elles sont donc clivables par ces deux carboxypeptidases (Skidgel 1992), produisant ainsi les seuls métabolites de la BK ou de la KD ayant une activité biologique significative, la des-Arg9-BK et la des-Arg10KD respectivement. Elles sont
toutes deux des agonistes du récepteur B1. Il est à noter que leur rôle dans l’inactivation
des kinines est mineur, à moins que l’ECA ne soit inhibée, ce qui a pour effet d'accroître l'importance de leur implication dans le métabolisme des kinines (Cyr, Lepage et al. 2001).
15
Figure 2 Structure peptidique de la BK et les principales enzymes la dégradant
1.3 Prostaglandines
La production de prostaglandines dans le corps peut être augmentée de plusieurs façons par l’action de la BK. Premièrement, l’action de la bradykinine sur les B2Rs
contribue à la phosphorylation Ca2+ dépendante et la translocation à l’intérieur de la
membrane cellulaire des phospholipases cytosoliques. Deuxièmement, par une stimulation de la phospholipase A2, il y a libération d’acide arachidonique à partir des phospholipides membranaires et donc une augmentation de ses métabolites. Troisièmement, la BK mène à la stimulation de la cyclooxygenase 2, qui converti l’acide arachidonique en prostaglandines (Kakoki and Smithies 2009). Certaines prostaglandines peuvent causer des effets bénéfiques antithrombotiques et antihypertenseurs, tandis que les autres, à l’opposé, causent une vasoconstriction menant à une augmentation de la pression artérielle et à des agrégations plaquettaires. La prostacycline est une des prostaglandines stimulée par la BK; elle a la propriété d’agir sur les muscles lisses (dilatation) et contribue à une diminution de la pression artérielle via une inhibition de la vasoconstriction de la microcirculation. De plus, deux
16
catégories de prostaglandines, les prostacyclines et les thromboxanes ont la capacité de s’antagoniser mutuellement puisqu’un mécanisme d’équilibre homéostatique existe entre elles.
1.4 Pro-drogues activables par des peptidases
Les pro-drogues sont des molécules qui doivent subir une biotransformation par une enzyme ou par un stimulus externe (de nature chimique ou environnementale) pour relâcher la portion active de la drogue. Les pro-drogues en tant que telles sont inactives et doivent être transformées afin de produire un effet biologique. Un avantage majeur des pro-drogues est que ces molécules peuvent être conjuguées chimiquement pour améliorer les propriétés pharmacologiques et pharmacocinétiques de la drogue originale dont elles sont dérivées. La conjugaison peut, entre autres, améliorer la solubilité, la perméabilité, la stabilité et la distribution de la drogue in vivo. Les pro-drogues activables par des peptidases peuvent donc être utilisées pour améliorer l’acheminement de la drogue à des sites où l’expression de protéases spécifiques est plus élevée que dans les autres tissus (Rautio, Kumpulainen et al. 2008).
Les attributs bénéfiques des pro-drogues font d’elles des molécules de choix pour le développement de nouveaux médicaments et thérapies. Au début des années 2000, il était estimé que 5 à 7 % de toutes les nouvelles molécules sur le marché mondial étaient des pro-drogues (Stella 2004).
1.5 Récepteurs des kinines
Il y a deux récepteurs responsables de l’activité biologique des kinines dans le corps humain : le B1R et le B2R qui sont codés par un même gène localisé sur le chromosome
14q32 (Leeb-Lundberg, Marceau et al. 2005). Les récepteurs des kinines appartiennent à la famille des récepteurs couplés aux protéines G (GPCR) et contiennent 7 domaines transmembranaires. L'extrémité N-terminale extracellulaire de ces deux récepteurs est hautement glycosylée, alors que leur extrémité C-terminale intracellulaire possède des sites d'acylation, de phosphorylation et de recrutement pour les protéines Gαq et GαI .
17
expressions et ne comporte que 36% d’homologie de séquence (Menke, Borkowski et al. 1994, Marceau et al. 2013). On peut classer les récepteurs des kinines selon 7 catégories pharmacologiques différentes, dont les plus décisifs ont trait à leurs ligands privilégiés, à l’ordre de puissance des agonistes et à l’affinité que possèdent leurs antagonistes.
1.5.1 Le récepteur B1
Le récepteur B1 fut identifié au début des années 1970 par le groupe de Régoli et
Barabé (Regoli and Barabe 1980). Ce récepteur est généralement absent ou exprimé à des niveaux très faibles dans les tissus sains, mais est inductible dans plusieurs conditions physiopathologiques de type inflammatoire, lors de traumatisme ou de dommages tissulaires, ou lors de l'exposition à des endotoxines bactériennes (Marceau, Hess et al. 1998, Leeb-Lundberg, Marceau et al. 2005). Dans ces conditions, la présence du B1R a été mise en évidence dans l'endothélium vasculaire et du muscle
lisse de différentes artères ou veines, de même que dans des cellules non vasculaires comme les macrophages, des neurones du système nerveux central (Couture, Mizrahi et al. 1981, Raidoo and Bhoola 1997, Raidoo, Ramsaroop et al. 1997, Bhoola, Ramsaroop et al. 2001, Tirapelli, Bonaventura et al. 2007). Dans les années 1980, Marceau et al. ont démontré, dans la vessie d’un modèle basé sur le rat, une expression locale du récepteur B1 à la suite d’une lésion tissulaire ; cette induction
expérimentale de l’expression des B1Rs a révélé leur rôle dans un contexte
inflammatoire (Marceau, Barabe et al. 1980). D’ailleurs, ce sont les B1Rs qui sont le
plus souvent associés aux effets secondaires non désirables qui font partie du SKK. 1.5.1.1 Les ligands du récepteur B1
Des essais de liaisons ont permis d’obtenir l’ordre de puissance des agonistes pour le récepteur de type B1. Ces tests ont démontré que, pour avoir une bonne affinité au
récepteur, les ligands sont préférablement dépourvus du résidu arginine en position C-terminal comme les kinines des-Arg9-BK et Lys-des-Arg9-BK (Blais, Marceau et al.
N-18
terminale est également cruciale pour conférer une bonne affinité ligand-récepteur (Marceau et al. 2013). Une autre caractéristique observée est que les ligands qui ne possèdent pas d’arginine en N-terminal semblent avoir une affinité augmentée d’environ 10 fois comparativement à ceux qui en possèdent. La seule séquence de kinine naturelle possédant une affinité subnanomolaire pour le récepteur B1 humain est
Lys-des-Arg9–BK. Le tableau 2 présente les différentes kinines et leur affinité pour le
récepteur B1.
Tableau 2. Affinité des ligands pour le récepteur B1 2
Ligands Affinité (nM)
B1R humain B1R Souris B1R lapin
Bradykinine >10 000 200 >5000
Lys-BK 2.54 510 19
des-Arg9-BK 1930 0.7 32
Lys-des-arg9-BK 0.12 1.7 0.23
1.5.1.2 La régulation et la signalisation du récepteur B1
Les voies de signalisation recrutées par le récepteur B1 sont les mêmes que celles
stimulées par le récepteur B2, ces récepteurs étant tout deux couplés à la protéine Gq.
L’activation du récepteur est liée à la voie métabolique phospholipase C (PLC) et à la voie des phosphoinositols. Cette stimulation provoque le relâchement ainsi que la mobilisation de calcium à partir du réticulum endoplasmique, lequel à son tour activera plusieurs autres voies intracellulaires (Marceau and Regoli 2004). Comme mentionné plus haut, les B1Rs sont généralement absents dans des tissus normaux, mais
rapidement induits dans des conditions comme le dommage tissulaire, la septicémie et plusieurs autres conditions immunopathologiques entraînant la formation de cytokines (Leeb-Lundberg, Marceau et al. 2005). L’induction de l’expression du gène des cytokines est régulée par la voie métabolique des « mitogen-activated protein kinases »
19
(MAPK) reliées au stress cellulaire et plusieurs autres facteurs de transcriptions (Larrivée, Bachvarov et al. 1998, Campos, Souza et al. 1999). On peut d’ailleurs remarquer une surexpression des récepteurs B1Rs lors de situations inflammatoires
(Marceau and Regoli 2004). La présence des récepteurs à la surface de la membrane cellulaire est éphémère puisque sa demi-vie n’est que d’environ 2-4 heures. Après cette période, il est dégradé de la surface cellulaire d’une façon que l’on croit être ligand indépendant (Fortin, Bouthillier et al. 2003). Contrairement au récepteur B2, le récepteur
B1 n’est pas phosphorylé lors de stimulation par un agoniste ; il n’est pas affecté par les
GRKs (récepteurs kinases couplés aux protéines G) et ne recrute pas non plus les arrestines au niveau endosomal ou de la membrane plasmatique (Sabourin, Bastien et al. 2002). Il ne possède pas de mécanisme de désensibilisation, donc la durée de signalisation dépend de la durée de vie du ligand. Par exemple, des-Arg9-BK (le ligand
préférentiel des B1Rs) possède une demi-vie considérablement plus longue que la BK
(environ 8-10 minutes) et sa liaison au récepteur B1 est importante pour obtenir une
perméabilité lors de situations inflammatoires. Il est postulé que cette différence entre les mécanismes de désensibilisation de ces deux récepteurs et la demi-vie des récepteurs lors de conditions inflammatoires expliquerait la contribution des B1Rs dans
l’accélération des crises d’angio-œdème (Bossi, Fischetti et al. 2009). Finalement, les neurones afférents qui sont non myélinisés possèdent également des récepteurs B1 et
les kinines peuvent donc stimuler les nerfs qui sont responsable de la nociception et créer une sensation de douleur (Couture et al. 2001).
1.5.2 Le récepteur B2
Tout comme le récepteur B1, le récepteur B2 fut découvert en 1970 par Régoli et Barabé
(Régoli et Barabé 1980). C’est au début des années 1980, avec le développement et la purification d’analogues de la BK possédant une activité agoniste pour le récepteur B2,
que les chercheurs ont pu déclarer que ce récepteur était en fait un récepteur couplé aux protéines G (GPCR) formé de 364 acides aminés. L’expression du récepteur est constitutive et retrouvée dans plusieurs tissus incluant les cellules endothéliales, les
20
cellules du muscle lisse et les cellules épithéliales (Leeb-Lundberg, Marceau et al. 2005).
1.5.2.1 Les ligands du récepteur B2
Les agonistes naturels du récepteur B2R sont ceux qui comprennent la séquence
complète de la bradykinine, soit la BK et la KD, lesquels ont une affinité supérieure à la Lys-des-Arg9-BK et à la des-Arg9-BK (Blais, Marceau et al. 2000). Contrairement au
B1R, l’arginine en C-terminal est cruciale pour que les ligands des B2Rs aient une
bonne affinité. Les antagonistes du B2R possèdent normalement un squelette
peptidique rigide dû à l’ajout de gros acides aminés synthétiques. Ces acides aminés non naturels donnent aux antagonistes une résistance au clivage par de nombreuses peptidases. C’est également le cas de l’agoniste B9972 utilisé dans nos expériences, qui possède un acide aminé synthétique en C et N terminal, de même qu’au milieu de sa chaîne.
21 Tableau 3. Affinité des ligands pour le récepteur B23
Ligands Affinité (nM)
B2R humain B2R Souris B2R lapin
Bradykinine 0.54 0.48 4.5
Lys-BK 0.63 0.52 2
des-Arg9-BK 8100 6400 >1000
Lys-des-arg9-BK >30 000 25 000 >1000
1.5.2.2 La régulation et signalisation du récepteur B2
Le récepteur B2 est également un récepteur couplé à la protéine Gq, qui active une
phospholipase C-β pour induire plusieurs cascades d’effets intracellulaires. Les travaux subséquents sur le récepteur ont permis de découvrir que le B2R active au moins 2
voies métaboliques : 1) la voie métabolique de la phospholipase C qui mène à la formation de l’inositol 3-phosphate (IP3) ainsi que la mobilisation intracellulaire de calcium (Ca2+), et 2) la voie de la phospholipase A2 qui conduit au relâchement de
l’acide arachidonique (Higashida, Streaty et al. 1986, Axelrod, Burch et al. 1988). Les seconds messagers produits, tels que le NO et les prostaglandines, permettent la relaxation des cellules du muscle lisse des artérioles, contribuant ainsi à une vasodilatation (Marceau et al. 2013). De plus, la production de NO serait causée par la stimulation des eNOS suite à l’activation des B2Rs par la BK. On croit que l’activation
de ce récepteur aurait un rôle crucial dans les effets cardioprotecteurs reconnus de la BK, dans l’hypertension et autres conditions expérimentales et cliniques telles que l’hypertension artérielle pulmonaire, l’insuffisance cardiaque, l'ischémie, et lors d’infarctus du myocarde (Heitsch 2003, Veeravalli and Akula 2004, Xi, Das et al. 2008, Sharma 2012, Potier, Waeckel et al. 2013). La vasodilatation et la production endothéliale de NO et de tPA sont des exemples d’effets potentiellement salutaires
22
médiés par les kinines et la stimulation des B2Rs endothéliaux (Pretorius, Rosenbaum
et al. 2003, Leeb-Lundberg, Marceau et al. 2005).
La modélisation du récepteur prédit que le côté C-terminal des ligands du B2R plonge
vers le centre du récepteur, tandis que le N-terminal reste plus près du fluide extracellulaire. Le récepteur B2 possède une fonction d’adaptation commune à la
grande famille des GPCRs ; c’est-à-dire que le domaine intracellulaire ser/thr en C-terminal du récepteur est phosphorylé par des GPCR kinases. Par la suite, des arrestines se lient au récepteur maintenant phosphorylé et entrent en compétition avec la protéine G, ce qui ultimement entraîne la désensibilisation du récepteur. Le récepteur B2 ne semblerait pas être régulé au niveau de la transcription. Ceci est peut-être dû au
fait que la protéine du récepteur est constitutive et est recyclée. De plus, le récepteur B2
est recyclé ce qui lui confère une longue durée de vie à la surface cellulaire.
1.5.3 Les interactions entre les deux récepteurs
L’activation du B1R pourrait amplifier les effets du récepteur B2 en fonction du temps
particulièrement lors de conditions inflammatoires et de dommages tissulaires (Marceau, Hess et al. 1998). De plus, l’induction sur une plus longue période de temps du B1R compenserait pour la désensibilisation rapide du récepteur B2 (Bhoola,
Ramsaroop et al. 2001). Finalement, lors de pathologie ou d’une réponse inflammatoire, la concentration cellulaire de mRNA codant pour le B2R varie souvent en parallèle avec
celle qui code pour le B1R (Marceau et al. 2013).
1.6 Interactions entre le SRA et le SKK
La principale enzyme reliant les systèmes kallikréines-kinines et rénine-angiotensine est l'ECA. D’un côté, cette enzyme dégrade la BK et de l’autre, elle facilite la production d’Ang II (Wang et al 2001). L’Ang II, issu du système rénine-angiotensine, est généralement reconnu pour ses effets néfastes sur le système cardiovasculaire, tandis que le système kallikréine-kinine, est plus souvent associé à des effets
23
cardioprotecteurs. Malgré leurs activités antagonistes, en condition physiologique normale, l'activité de ces deux systèmes est largement complémentaire et indispensable à l’équilibre hémodynamique. Le SRA classique est un système autacoide circulatoire endocrinien. Toutefois, les avancées dans le domaine ont permis de déterminer aussi la présence de systèmes rénine-angiotensine tissulaires (nécessitant entre autres que les produits actifs doivent être synthétisés, présents et également régulés à même les tissus) dans le cerveau, le cœur et les reins (Dell'Italia, Meng et al. 1997, Navar, Harrison-Bernard et al. 2002, Carey and Siragy 2003). Nous allons nous concentrer dans les prochaines sections sur le SRA classique, ses composantes et ses interactions avec le SKK.
1.7. Système rénine-angiotensine (SRA) « classique »
Il s’agit là d’un système hormonal ayant une grande importance, puisque celui-ci est reconnu pour exercer un contrôle sur la pression artérielle, la résistance vasculaire périphérique, le volume sanguin et des autres fluides de l'organisme et le maintien de la balance d’électrolytes (Peach 1977, Rosendorff 1996). Le SRA est en fait une cascade protéolytique qui a pour but ultime la formation d’un peptide hypertenseur, l’angiotensine (Ang II). Dans cette cascade, le précurseur l’angiotensinogène, produit et libéré dans la circulation par le foie, est transformée en angiotensine I sous l'action enzymatique de la rénine circulante produite par les reins. L'angiotensine I est à son tour clivée par l'ECA pour produire l'angiotensine II, un puissant vasoconstricteur (Carey and Siragy 2003).
L’Ang II agit sur deux récepteurs couplés aux protéines G, le récepteur AT1, lequel est le médiateur des principaux effets cardiovasculaires de l'angiotensine II. Le peptide agit également sur le récepteur AT2 ; son activation entraîne des effets anti-prolifératifs, anti-hypertrophiques, pro-apoptotiques et vasodilatateurs (Bumpus, Catt et al. 1991, Ardaillou 1999, Horiuchi, Akishita et al. 1999, Horiuchi, Lehtonen et al. 1999, Inagami 1999).
24
25 1.7.1 La rénine
En 1898, l’enzyme rénine fut identifiée pour la première fois à partir d’homogénat de reins par les chercheurs Tigerstedt et Bergman comme étant une substance vasoconstrictrice (Tigerstedt and Bergman 1898). La rénine est une protéase acide de type aspartyl qui clive la liaison leucine-valine qui se retrouve à l'extrémité N-terminale de l'angiotensinogène, libérant ainsi l'angiotensine I (Peach 1977, Rosendorff 1996). La rénine est sécrétée par les cellules granuleuses de l’appareil juxtaglomérulaire des reins. Sa production est stimulée principalement en réponse à une réduction de la pression artérielle, à une diminution de la quantité de NaCl dans la macula densa, et s’ajuste selon le niveau plasmatique d’Ang II (Corvol, Pinet et al. 1994, Amar, Gimenez-Roqueplo et al. 2005). La rénine est d'abord synthétisée sous forme de pro-enzyme, la prorénine, un précurseur inactif. C’est d’ailleurs cette forme qui est la plus abondante (90%). Par une action protéolytique, la pro-rénine se voit retrancher de 43 de ses acides aminés N-terminaux, permettant ainsi la libération de la rénine active (Reudelhuber, Ramla et al. 1994). Celle-ci clive le lien leucine-valine en N-terminale de l’angiotensinogène humaine pour produire l’angiotensine I (Peach 1977, Rosendorff 1996).
Concernant les interactions avec le SKK, des études ont rapporté que la prorénine peut également être activée dans la circulation par la kallikréine plasmatique suite à l'activation du plasma par le facteur XII. Il est possible qu'il s'agisse là d'un phénomène de rétro-contrôle, afin d'assurer l'activité des deux systèmes, SKK et SRA, et obtenir un équilibre hémodynamique (Schmaier, 2003 ; Sealey, Atlas et al. 1978 ; Schalekamp and Derkx 1981).
1.7.2 L’angiotensinogène
L’angiotensinogène est une large glycoprotéine (452 acides aminés) qui appartient à la superfamille des inhibiteurs des protéases à sérine (serpines) (Griendling, Murphy et al. 1993). Sécrétée par les lobules hépatiques, la production de l’angiotensinogène est
26
sous la régulation positive de l’estrogène, des glucocorticoïdes, des hormones thyroïdiennes et de l’angiotensine II (Clauser, Gaillard et al. 1989). Sous l’action de la rénine, la portion N-terminale de l’angiotensinogène est clivée pour produire le décapeptide inactif Ang I (Jeunemaitre, Soubrier et al. 1992). Cette étape est importante puisqu’elle est limitante dans l’activation du système rénine-angiotensine (Laragh and Sealey 1990).
1.7.3 L’angiotensine I
L’angiotensine I est une prohormone produite par l’action de la rénine sur l’angiotensinogène. Elle n’a aucun rôle physiologique en tant que telle, mais le décapeptide est clivé en un octapeptide actif : l’Ang II (Guang, Phillips et al. 2012).
1.7.4 L’angiotensine II
La biosynthèse d'Ang II mettant en jeu la rénine circulante et l’ECA pulmonaire, constitue la voie classique connue depuis longtemps. Cependant, plus récemment, de nouvelles voies biosynthétiques mettant en jeu des enzymes autres que l'ECA et capables de produire localement de l’Ang II à partir de l'angiotensinogène ou de l'Ang I, ont été identifiées. Par exemple, Ang II peut être synthétisé directement à partir de l’angiotensinogène, par la cathepsine G et l’élastase dans les neutrophiles et par le « tissue plasminogen activator » (tPa) dans les tissus vasculaires. Comme mentionné auparavant, Ang II est l’effecteur principal du système RAS. L’angiotensine II exerce un large éventail d’effets biologiques en stimulant le récepteur AT1. Sa liaison au récepteur engendre un changement de conformation de celui-ci, ce qui rend les interactions avec la protéine G plus efficaces. Parmi les effets reconnus de l’Ang II, il y a la stimulation de la croissance et la réplication cellulaire au niveau cardiovasculaire. Ses effets peuvent avoir un côté néfaste en favorisant l’hypertrophie du myocarde et l’hyperplasie des cellules du muscle lisse vasculaire. Puisque Ang II est un puissant vasoconstricteur, son action peut augmenter la résistance périphérique vasculaire, augmentant ainsi la
27
tension de la paroi à l’intérieure du myocarde (pression artérielle). Ang II stimule également le relâchement d’aldostérone du cortex surrénalien. L’aldostérone, une hormone stéroïdienne possédant une activité minéralocorticoïde. Elle contrôle la régulation de la balance hydro-sodée dans les reins en activant le récepteur spécifique MR. Les récepteurs MRs sont également présent dans les cellules du muscle lisse des vaisseaux sanguins et pourraient contribuer à la régulation de la pression artérielle (augmentation des résistances vasculaires et une augmentation de la tension artérielle). Plusieurs études ont d’ailleurs démontré une communication entre l’aldostérone et l’Ang II dans les cellules du muscle lisse vasculaire (Briet and Schiffrin 2010, Aroor, DeMarco et al. 2014). En plus de favoriser des effets athérogènes, on croit que Ang II pourrait également stimuler la thrombose par une augmentation de l'inhibiteur des activateurs du plasminogène de type 1 (PAI-1) et ultimement à une accélération de la pathologie d’athérosclérose (Ridker, Gaboury et al. 1993, Rosendorff 1996, Fandrick, Saha et al. 2011). Il a également été observé dans des études in vitro et in vivo que Ang II stimule la surexpression de plusieurs gènes dont le B1R et B2R du SKK (Manolis, Marketou et al. 2010).
1.8 Les récepteurs de l’angiotensine II
Dans les années 1980, le développement d’antagonistes non peptidiques de l’angiotensine II a permis l’identification de deux sous types de récepteurs couplés aux protéines Gq soit AT1 et AT2. Les deux peuvent lier Ang II, mais présentent des
différences au niveau de leur structure, leur localisation et de leur expression et régulation dans certains tissus (Paul, Mehr et al. 2006). Ces deux récepteurs ne possèdent en fait que 34 % d’homologie de séquence (Carey, Wang et al. 2000). On peut observer des différences dans la structure des récepteurs, particulièrement dans la 3ième boucle intracellulaire et dans le domaine C-terminal intracellulaire. Ces différences
pourraient expliquer en partie les différences fonctionnelles entre les récepteurs AT1 et
AT2 (Inagami, Kambayashi et al. 1999). Contrairement à AT1, la séquence d’acides
aminés de AT2 conserve un résidu Lys qui semble être particulièrement important dans
28
l’existence d’un récepteur additionnel AT4 qui semble interagir avec des peptides
tronqués dérivés d’Ang I et Ang II (Ang IV et Ang 3-8) (Paul, Mehr et al. 2006).
1.8.1 Le récepteur AT1
Le récepteur AT1 humain contient 359 acides aminés et sa séquence est identique à
95% à celle du récepteur du rat et du bovin (Curnow, Pascoe et al. 1992). Le gène entier comporte 47 Kb (Curnow 1996) et est localisé sur le chromosome 3. Contrairement à tous les autres mammifères, le récepteur AT1 est dupliqué uniquement
chez les petits rongeurs comme le rat (AT1 a et AT1b).
Dans le muscle lisse vasculaire, la signalisation du récepteur par l’angiotensine II s’effectue par la protéine Gq laquelle déclenche une cascade de signalisation
intracellulaire faisant appel à l’activation de la phospholipase C. Il y a alors accumulation d’inositol triphosphate qui provoque une augmentation du calcium intracellulaire qui est à l’origine de la vasoconstriction. Cette mobilisation du calcium intracellulaire favorise également la libération d’aldostérone par la surrénale. Parallèlement, la stimulation de la voie de signalisation de la protéine-kinase C est à l’origine des effets à long terme de l’angiotensine II. Ces voies de signalisation sont responsables de la régulation de la transcription génique (augmente l’expression de certains proto-oncogènes) ainsi que l’expression des protéines qui contrôle, entre autres, la prolifération cellulaire dans plusieurs tissus cibles (De Gasparo, Catt et al. 2000).
C’est à l’activation de ce récepteur que nous devons la plupart des effets cardiovasculaires médiés par l’Ang II, qui de manière générale entraînent une augmentation rapide de la pression artérielle. Parmi les effets les plus reconnus, on pense entre autres à une vasoconstriction périphérique, une réabsorption rénale de sodium, la sécrétion d’aldostérone, la libération de vasopressine et une diminution du débit sanguin (Paul, Mehr et al. 2006). Une stimulation prolongée de se récepteur peut éventuellement conduire à une hypertrophie des cellules rénales, une hypertrophie cardiaque et à un remodelage vasculaire se traduisant par une hypertrophie vasculaire
29
et ultimement une augmentation de la rigidité des vaisseaux (Inagami, Kambayasi et al. 1999, Lavoie and Sigmund 2003). Le récepteur AT1 et son ligand Ang II ont été
impliqués dans le développement de pathologies cardiovasculaires incluant l’hypertension artérielle ainsi que l’insuffisance cardiaque et rénale (Kim and Iwao 2000).
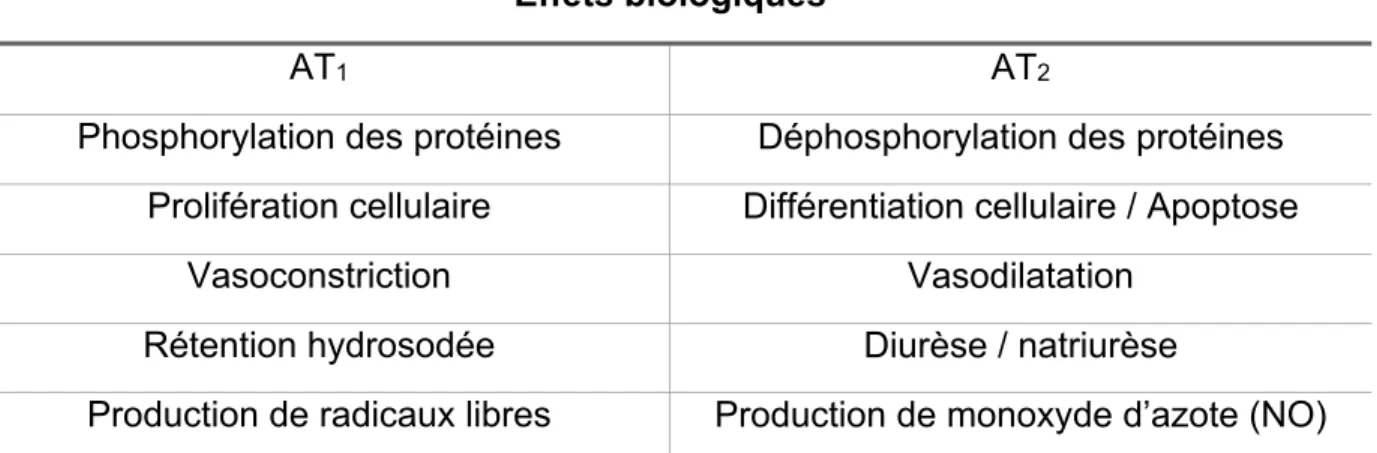
1.8.2 Le récepteur AT2
Le récepteur AT2 est également un récepteur couplé aux protéines G qui contient 363
acides aminés dont le gène est situé sur le chromosome X. Le récepteur AT2 est exprimé en grande quantité dans les tissus fœtaux lors du développement du fœtus (Grady, Sechi et al. 1991, Shanmugam, Llorens-Cortes et al. 1995). Par contre, l’expression de ce récepteur est rapidement réduite à des niveaux très bas dans la période postnatale (Ozono, Wang et al. 1997), ce qui suggère un rôle fonctionnel des AT2 dans le développement fœtal (Rosendorff 1996). Cependant, une réexpression de
ce récepteur chez l’adulte a été observée en réponse à certaines maladies cardiovasculaires comme l’insuffisance cardiaque et l’infarctus du myocarde (Wang, Moore et al. 1998, Carey, Wang et al. 2000). Pendant des années, son rôle est resté incertain et a fait l’objet de plusieurs recherches. Par l’activation d’une cascade autocrine qui implique la BK, le NO de même que le second messager GMP cyclique, la stimulation des récepteurs AT2 favorise entre autres la vasodilatation et la natriurèse.
La stimulation des AT2 semble dans la majorité des cas avoir les effets inverses de la
stimulation des AT1. Le tableau 4 résume quelques-uns des effets de l’activation des
30
Tableau 4. Comparaison des effets biologiques résultant de l’activation des 2 récepteurs de l’Ang II 4
Effets biologiques
AT1 AT2
Phosphorylation des protéines Déphosphorylation des protéines Prolifération cellulaire Différentiation cellulaire / Apoptose
Vasoconstriction Vasodilatation
Rétention hydrosodée Diurèse / natriurèse
Production de radicaux libres Production de monoxyde d’azote (NO) 1.9 L’ECA 2 et l’Ang (1-7)
Au début des années 2000, un analogue de l’ECA nommé ECA 2 fut identifié au niveau de l’endothélium vasculaire et cardiaque (Clarke and Turner 2011). L’ECA2 est une
mono carboxypeptidase de type métalloprotéase qui métabolise plusieurs peptides vasoactifs dont l’angiotensine I, qu’elle converti en angiotensine (1-9) et l’angiotensine II en angiotensine (1-7). Ce peptide peut également être formé par la NEP, une enzyme active dans le métabolisme de la BK. L'Ang (1-7) pourrait potentialiser l’action de la BK sur le récepteur B2 en se liant au site actif de l’ECA, par conséquent bloquant la
dégradation de la BK par ECA (Paula, Lima et al. 1995). Contrairement à l’ECA, l’ ECA2
n’a pas la capacité de convertir l'Ang I en Ang II, et les inhibiteurs de l’ECA n’ont aucun effet sur l’ECA2 (Donoghue, Hsieh et al. 2000). D'autre part, l'Ang I peut également être
transformée en Ang-(1-7) par des endopeptidases neutres, dont la néprilysine, une enzyme également active dans le métabolisme des kinines (Santos, Campagnole-Santos et al. 2000). L’Ang 1-7 est une substance vasodilatatrice dont les actions semblent contrebalancer celles de Ang II, et potentialiser celles de la BK, par entre autres une augmentation de la synthèse et de la sécrétion de prostaglandines aux propriétés vasorelaxantes (Ferrario, Chappell et al. 1998, Santos, Campagnole-Santos
31
et al. 2000, Paul, Mehr et al. 2006, Campell 2009). Finalement, l’homologue ECA2 peut également cliver des-Arg9-BK (Vickers, Hales et al. 2002)
1.10 L’ECA et les inhibiteurs de l’ECA
Étant donné les rôles critiques de l’ECA et Ang II dans le SRA et le SKK, ils sont la cible idéale pour l’élaboration d’un traitement pharmacologique l’hypertension artérielle et de plusieurs autres maladies cardiovasculaires, dont l’insuffisance cardiaque, l’infarctus du myocarde et la néphropathie diabétique (Izzo Jr and Weir 2011).Dans une tentative de bloquer la cascade du SRA, des antagonistes du récepteur AT1 ont été
développés. Communément appelés les sartans, les médicaments tels que l’irbésartan, l’éprosartan et le losartan sont sécuritaires et sont utilisés couramment dans le traitement de l’hypertension artérielle. Tandis que les sartans bloquent l’interaction entre l’Ang II et le récepteur AT1, les inhibiteurs de l'ECA, tels que le captopril (le premier de sa classe) et de l’enalapril bloquent la conversion de l’Ang I en Ang II. Ils sont également utilisés dans le traitement de l’hypertension. Les effets bénéfiques de l'inhibition de l'ECA proviennent autant du blocage de la production de l'angiotensine II que de l'accumulation des kinines et d'une potentialisation de leurs propriétés cardioprotectrices. Bien que ses deux classes de médicaments soient utilisées pour traiter la même pathologie, ceux-ci ne sont pas dépourvus d’effets secondaires. On rapporte notamment pour les inhibiteurs de l’ECA de la toux et un risque accru d’angio-œdème découlant en partie de l’accumulation de BK (libération de médiateurs inflammatoires et augmentation de la perméabilité vasculaire qui engendre une extravasation des fluides) (Nussberger, Cugno et al. 2002, Cugno, Nussberger et al. 2003).