L’embryon porcin : un modèle toxicogénomique
pour les sous-produits de la chloration et l’alcool
Thèse
Florence Pagé-Larivière
Doctorat en sciences animales
Philosophiæ doctor (Ph. D.)
Québec, Canada
L’embryon porcin : un modèle toxicogénomique
pour les sous-produits de la chloration et l’alcool
Thèse
Florence Pagé-Larivière
Sous la direction de :
Marc-André Sirard, directeur de recherche
Céline Campagna, codirectrice de recherche
III
RÉSUMÉ
L'approche présentement utilisée en évaluation du risque toxicologique est basée sur les tests de toxicité classiques tels que l'observation de signes cliniques visibles ou de pathologies évidentes. Cette approche est efficace pour déterminer les principaux symptômes associés à une exposition au produit de même que pour évaluer les concentrations auxquelles les animaux peuvent être exposés sans présenter d'effets secondaires apparents. Toutefois, elle ne fournit aucune information précise sur le où, le quand et le comment la toxicité apparaît, ni sur les éventuels effets à long terme pour l'individu ou pour sa descendance. Pour pallier ces lacunes, une nouvelle branche de la toxicologie s’est développée, favorisée par l’avancement des technologies : la toxicogénomique. Cette discipline s’intéresse aux impacts globaux d’un produit sur le génome et permet d’obtenir des informations sur les processus moléculaires affectés. La toxicogénomique s’inscrit donc comme une méthode complémentaire aux méthodes de toxicologie classique.
L’objectif de cette thèse est de déterminer si l’embryon préimplantatoire porcin est un bon modèle toxicogénomique pour évaluer les sous-produits de la chloration et l’éthanol aux concentrations auxquelles l’humain est exposé quotidiennement. Pour ce faire, nous avons exploré différentes facettes de la toxicogénomique en intégrant la sensibilité de l'embryon préimplantatoire porcin à la puissance des biopuces transcriptomiques et épigénétiques développées dans notre laboratoire. L'avantage du jeune embryon est qu'il a le potentiel d'exprimer l'ensemble des voies de signalisation permettant ainsi de l'utiliser comme modèle pour identifier les modes d'action de produits toxiques chez des individus adultes et dans l'ensemble de ses organes. Le modèle que nous avons développé est donc un système de dépistage toxicogénomique permettant d'identifier les modes d'action de molécules toxiques et de mieux comprendre la façon dont elles induisent leurs effets néfastes sur la santé.
Pour confirmer l'efficacité du modèle, nous avons exposé des embryons à de faibles concentrations de sous-produits de la chloration (bromodichlorométhane et acide
IV
dichloroacétique) et à de l’éthanol. Les concentrations utilisées correspondent à une exposition réaliste pour l'humain.
Les résultats obtenus suggèrent que l’embryon préimplantatoire est vulnérable aux contaminants de son environnement et que les mécanismes adaptatifs qu’il active afin d’assurer sa survie sont compatibles avec les effets secondaires de ces produits chez l’humain exposé in utero. Tous les produits testés ont réduit le taux de survie des embryons et ont modifié leur profil transcriptomique. Toutefois, chaque produit a induit des voies de signalisation différentes, suggérant des modes d’action spécifique pour chaque produit et montrant la plasticité de la réponse embryonnaire.
En somme, les résultats présentés dans cette thèse montrent que les mécanismes activés par l'embryon afin de survivre aux assauts des produits toxiques de son environnement nous fournissent des pistes d'explication quant aux modes d'action des molécules. Ces résultats supportent l'idée que les outils de toxicogénomiques combinés à l'utilisation d'un modèle hautement sensible à son environnement devraient être utilisés en évaluation du risque.
V
ABSTRACT
The current approach in toxicological risk assessment relies on traditional toxicity testing such as evaluation of clinical signs or pathological changes. This approach effectively provides concentrations to which an animal can be exposed without expecting any adverse outcome. However, it does not provide precise information on where, how and when toxicity occurs, as well as whether any long-term and trans-generational effects that may occur.
To address this shortcoming, a new branch of toxicology recently appeared, helped by the development of technology: toxicogenomic. This field of research focuses on the global genome impact of a toxicant and provides information regarding the molecular pathways affected. Thus, toxicogenomic is complementary to classical methods.
The objective of this thesis was to demonstrate that the preimplantation porcine embryo is an effective toxicogenomic model to evaluate the chlorination by-products and ethanol at environmentally-relevant concentrations. To conduct our experiments, we integrated the sensitivity of the preimplantation porcine embryo to powerful transcriptomic and epigenomic microarrays developed in our laboratory. The advantage of the early embryo is its capacity to express a plethora of pathways whilst serving as a relevant model for human. The result is a toxicogenomic screening system that better identifies the mode of action of toxicants that induce adverse health outcomes.
We exposed embryos to either 0.2% ethanol or chlorination by-products found in drinking water, bromodichloromethane (BDCM) and dichloroacetic acid (DCAA). The concentrations used were similar to human exposure. Our results suggest that the preimplantation embryo is vulnerable to the toxicants present in its environment and that the adaptive mechanisms it activates are compatible with the adverse outcomes observed in human exposed in utero. All tested products induced a decreased in embryonic survival and significant modification in the transcriptomic profile. However, each product induced specific pathways, suggesting a different mode of action and demonstrating the plasticity of the embryonic response.
VI
In summary, the results presented in this thesis provide information on the mechanisms activated by the embryo in order to survive following exposure to toxicants and give insight on the mode of action of these molecules. These results support the use of toxicogenomic tools combined to sensitive animal model in risk assessment.
VII
TABLE DES MATIÈRES
RÉSUMÉ ... III ABSTRACT ...V LISTE DES TABLEAUX ...XIII LISTE DES FIGURES ... XIV LISTE DES ABRÉVIATIONS ... XVI REMERCIEMENTS ... XX AVANT PROPOS ... XXIII
CHAPITRE 1 - Embryons préimplantatoires porcins et toxicogénomique ... 1
1. Revue de littérature ... 1
1.1. Le parcours de l’ovogonie vers l’embryon ... 1
1.1.1. Résumé ... 1
1.1.2. De cellules germinales primordiales à ovocyte de premier ordre ... 2
1.1.3. Développement folliculaire ... 3
1.1.4. Jonctions communicantes ... 4
1.1.5. Maturation ovocytaire ... 5
1.1.5.1. Maturation nucléaire et reprise de la méiose ... 5
1.1.5.2. Maturation cytoplasmique ... 7
1.1.5.3. Maturation du cumulus ... 8
1.1.6. Fécondation ... 9
1.1.7. Protocoles in vitro ... 10
1.1.7.1. Maturation ovocytaire in vitro ... 10
1.1.7.2. Fécondation in vitro ... 11
1.1.8. Développement embryonnaire ... 13
1.1.8.1. Premières divisions cellulaires ... 13
1.1.8.2. Premières différenciations cellulaires ... 14
1.1.8.3. Les cellules germinales primordiales ... 15
1.2. Épigénétique, reprogrammation de l’épigénome et impacts sur la santé ... 15
1.2.1. Qu’est-ce que l’épigénétique? ... 15
1.2.2. La méthylation des cytosines ... 16
1.2.3. Répartition des méthylations ... 16
VIII
1.2.5. Stabilité du profil de méthylation ... 18
1.2.6. Profil de méthylation dans les cellules somatiques ... 20
1.2.7. Profil de méthylation dans les gamètes ... 20
1.2.8. Reprogrammation lors de la fécondation et établissement d’un épigénome embryonnaire ... 21
1.2.9. Impact de l’environnement sur l’épigénome ... 22
1.2.10. Vulnérabilité de l’embryon à son environnement ... 23
1.3. Les sous-produits de la chloration et leurs impacts sur la santé ... 24
1.3.1. Nécessité de désinfecter l’eau ... 24
1.3.2. Les normes en vigueur ... 25
1.3.3. Méthode d’assainissement de l’eau ... 26
1.3.3.1. Méthodes physiques ... 27
1.3.3.2. Méthodes chimiques ... 27
1.3.3.3. Chloration ... 27
1.3.4. L’envers de la médaille : les sous-produits de désinfection ... 28
1.3.5. Analyse des sous-produits de désinfection ... 30
1.3.6. Familles de SPD ... 30
1.3.7. Formation des sous-produits de chloration ... 32
1.3.7.1. Généralité ... 32
1.3.7.2. Formation des SPD lors de la désinfection par le chlore ... 33
1.3.8. Exposition de l’humain aux SPD ... 34
1.3.9. Impacts sur la santé ... 34
1.3.10. Les trihalométhanes ... 35 1.3.10.1. Absorption ... 35 1.3.10.2. Distribution ... 37 1.3.10.3. Métabolisation ... 38 1.3.10.4. Toxicité ... 40 1.3.11. Acides haloacétiques ... 44 1.3.11.1. Exposition ... 44 1.3.11.2. Distribution et métabolisation ... 45 1.3.11.3. Toxicité ... 46
1.4. SPD étudiés dans le cadre du projet de recherche ... 48
IX
1.7. La toxicogénomique ... 52
1.8. Objectifs et hypothèses de la thèse ... 54
CHAPITRE 2 ... 56
De faibles concentrations de bromodichlorométhane induisent une réponse toxicogénomique chez l’embryon porcin in vitro. ... 56
2. Low concentrations of bromodichloromethane induce a toxicogenomic response in porcine embryos in vitro. ... 57
2.1 Résumé ... 58
2.2 Abstract ... 59
2.3 Introduction ... 60
2.4 Material and methods ... 62
2.4.1 Measures of BDCM in tap water and determination of exposure concentration ... 62
2.4.2 BDCM preparation ... 63
2.4.3 Oocytes recovery and maturation ... 63
2.4.4 Matured oocytes fertilization ... 64
2.4.5 Embryo development and exposure to BDCM ... 64
2.4.6 Simultaneous DNA/RNA extraction ... 65
2.4.7 RNA amplification for RNA microarrays ... 65
2.4.8 Analysis of gene expression profile ... 66
2.4.9 Replication study of selected genes by RT-qPCR ... 66
2.4.10 DNA microarrays ... 67
2.4.11 DNA microarray analysis ... 68
2.5 Results ... 68
2.5.1 BDCM concentrations in Quebec City tap water ... 68
2.5.2 Embryo development ... 69
2.5.3 Gene expression variations on the RNA microarray ... 69
2.5.4 Validation of transcriptomic results ... 69
2.5.5 Analysis of DNA microarray results ... 70
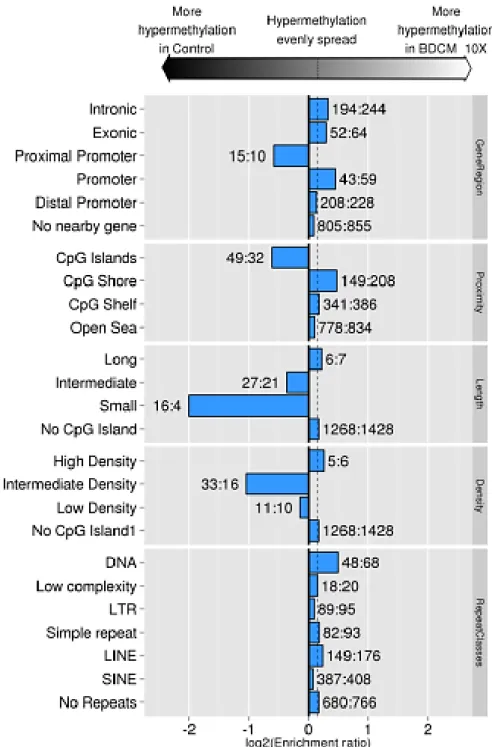
2.5.6 DNA methylation analysis with IPA ... 71
2.6 Discussion ... 72
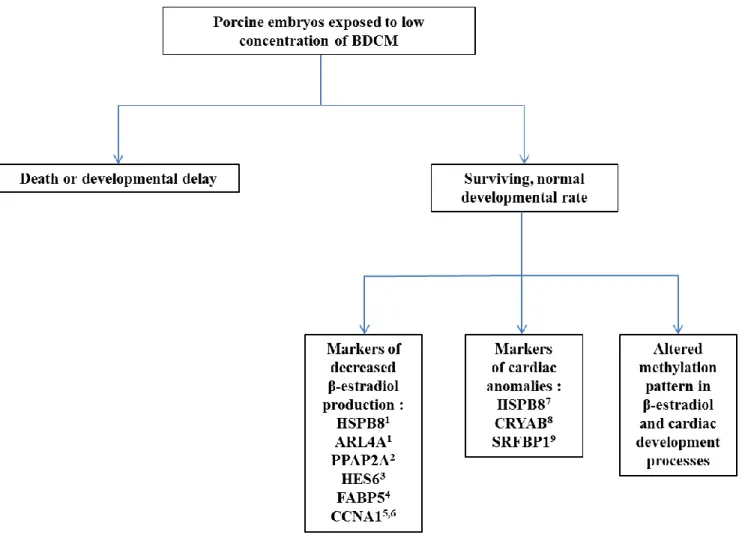
2.6.1 BDCM affects genes related to hormonal response and heart development ... 72
2.6.2 Specific genes affected by BDCM ... 73
2.6.3 Methylation profile of embryos following BDCM exposure ... 73
X 2.7 Conclusion ... 75 2.8 Acknowledgements ... 75 2.9 References ... 75 2.10 Figures ... 80 2.11 Tables ... 88 CHAPITRE 3 ... 92
Mécanismes impliqués dans la survie de l’embryon porcin suite à une exposition à l’éthanol ... 92
3. Mechanisms involved in porcine early embryo survival following ethanol exposure ... 93
3.1 Résumé ... 94
3.2 Abstract ... 95
3.3 Introduction ... 96
3.4 Materials and Methods ... 98
3.4.1 Oocyte Recovery and Maturation ... 98
3.4.2 Fertilization of Matured Oocytes ... 98
3.4.3 Embryo Development and Exposure to Ethanol ... 99
3.4.4 Simultaneous DNA/RNA Extraction ... 100
3.4.5 RNA Amplification for Microarrays ... 100
3.4.6 Analysis of Gene Expression Profile ... 101
3.4.7 Replication Study of Selected Genes by RT-qPCR ... 102
3.4.8 Mitochondrial Membrane Potential Measurement ... 102
3.5 Results ... 103
3.5.1 Ethanol Decreased Blastocyst and Expansion Rates ... 103
3.5.2 Gene Expression Variations on the RNA Microarray ... 103
3.5.3 Confirmation of Candidate Genes by RT-qPCR ... 104
3.5.4 Decreased Mitochondrial Membrane Potential ... 104
3.6 Discussion ... 105 3.7 Conclusion ... 110 3.8 References ... 110 3.9 Figures ... 115 3.10 Tables ... 119 CHAPITRE 4 ... 123
Le glucuronate pour lutter contre les effets néfastes de l’éthanol chez l’embryon porcin ... 123
XI
4.1 Résumé ... 125
4.2 Abstract ... 126
4.3 Introduction ... 127
4.4 Material and Methods ... 129
4.4.1 Oocyte Recovery and Maturation ... 129
4.4.2 Fertilization of Matured Oocytes ... 130
4.4.3 Embryo Development and Exposure to Ethanol ... 130
4.4.4 qPCR analysis ... 131
4.4.5 Mitochondrial membrane potential measurement ... 132
4.5 Results ... 133
4.5.1 Supplementation with myo-inositol has no effect on blastocyst development at the concentration tested ... 133
4.5.2 Supplementation with glucuronate increases blastocyst resistance to ethanol ... 133
4.5.3 qPCR analysis ... 133
4.5.4 Glucuronate improves mitochondrial function of ethanol-treated embryos ... 134
4.6 Discussion ... 134
4.7 References ... 138
4.8 Figures ... 140
4.9 Table... 143
CHAPITRE 5 ... 144
L’embryon porcin comme modèle pour déterminer les effets toxicogénomiques de l’acide dichloroacétique ... 144
5. The porcine preimplantation embryo as a model to determine the toxicogenomic impact of low concentrations of dichloroacetic acid ... 145
5.1 Résumé ... 146
5.2 Abstract ... 147
5.3 Introduction ... 148
5.4 Material and Methods ... 150
5.4.1 Measures of DCAA in tap water and determination of exposure concentration ... 150
5.4.2 Oocyte Maturation and Fertilization ... 151
5.4.3 Embryo Development and Exposure to Toxicant ... 151
5.4.4 Simultaneous DNA/RNA Extraction ... 153
5.4.5 RNA Amplification for Microarrays ... 153
XII
5.4.7 Replication Study of Selected Genes by RT-qPCR ... 154
5.4.8 Cell Count of Blastocysts ... 154
5.5 Results ... 155
5.5.1 DCAA Concentrations in Quebec City Tap Water ... 155
5.5.2 DCAA Decreased Blastocyst- But Not Expansion-Rate ... 155
5.5.3 Gene Expression Variations on the RNA Microarray ... 156
5.5.4 Confirmation of Candidate Genes by RT-qPCR ... 156
5.5.5 DCAA Induced a Decreased in Cell Number ... 157
5.6 Discussion ... 157 5.7 Conclusion ... 160 5.8 References ... 161 5.9 Figures ... 165 5.10 Tables ... 171 CHAPITRE 6 ... 175 6. Conclusion générale ... 175 BIBLIOGRAPHIE ... 181
XIII
LISTE DES TABLEAUX
Table 2.11-1 Primer sequences used for RT-qPCR experiments. Annealing
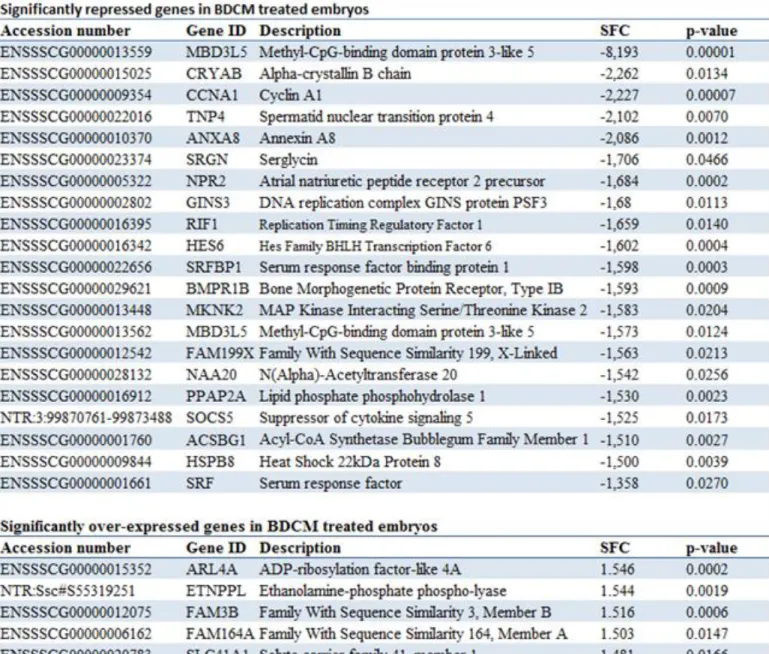
temperature for all the sets of primers was 57°C. ... 88 Table 2.11-2 Genes significantly affected by BDCM 10X as revealed by
transcriptomic microarray. ... 89 Table 2.11-3 Summary of Ingenuity pathway analysis top upstream regulators and top
toxicity list among transcriptomic and epigenetic selected genes. ... 90 Table 2.11-4 Proposed molecular targets of BDCM in porcine embryos and summary
of their functions. ... 91 Table 3.10-1 Primers sequences used for RT-qPCR experiments. ... 119 Table 3.10-2 Genes significantly downregulated by ethanol as revealed by
transcriptomic microarray. ... 120 Table 3.10-3 Genes significantly overexpressed by ethanol as revealed by
transcriptomic microarray. ... 121 Table 3.10-4 Summary of Ingenuity analysis pathway top upstream regulators and top
toxicity list among transcriptomic selected genes. ... 122 Table 4.9-1 Primers sequences used for RT-qPCR experiments. Annealing
temperature for all the sets of primers was 57°C. ... 143 Table 5.10-1 Primers sequences used for RT-qPCR experiments. Annealing
temperature for all the sets of primers was 57°C. ... 171 Table 5.10-2 Genes significantly overexpressed by 150 ppb DCAA as revealed by
transcriptomic microarray. ... 172 Table 5.10-3 Genes significantly repressed by 150 ppb DCAA as revealed by
transcriptomic microarray. ... 173 Table 5.10-4 Summary of Ingenuity analysis pathway top upstream regulators and top
XIV
LISTE DES FIGURES
Figure 1.1 Croissance du follicule et maturation ovocytaire chez le porc. La paroi du
follicule est représentée en bleu. Elle entoure l’ovocyte (vert). ... 2
Figure 1.2 La maturation nucléaire de l’ovocyte implique l’expulsion d’un premier globule polaire suite à l’ovulation puis d’un deuxième au moment de la fécondation (Wang et al., 2011). © 2011, Int. Union Physiol. Sci./Am. Physiol. Soc. ... 6
Figure 1.3 Représentation temporelle (en heures) des différentes divisions cellulaires chez l'embryon préimplantatoire porcin in vivo selon les données de Mateusen et al., 2005 (image par Pagé-Larivière F.) ... 14
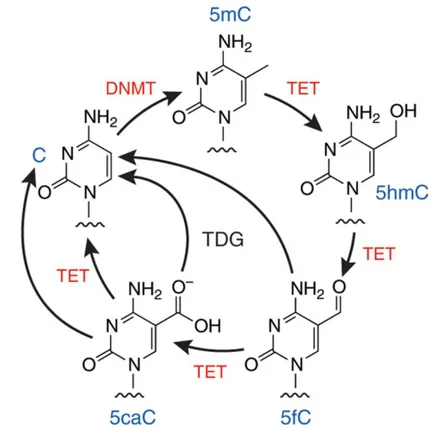
Figure 1.4 Le cycle de méthylation et de déméthylation de l'ADN par les enzymes DNMT et TET. Adaptée de (Huang and Rao, 2012). © 2012, Nature Publishing Group. ... 19
Figure 1.5 Structure moléculaire possible de la matière organique contenue dans l’eau potable qui présente bien la complexité de la molécule (Schulten and Schnitzer, 1993). ... 30
Figure 1.6 Importance relative (%) de chacune des familles de SPD. ... 32
Figure 2.10.1 Concentration of BDCM in Quebec City tap water according to season in µg/L (Mean ± SEM). The whiskers correspond to the 5th and 95th percentile. ... 80
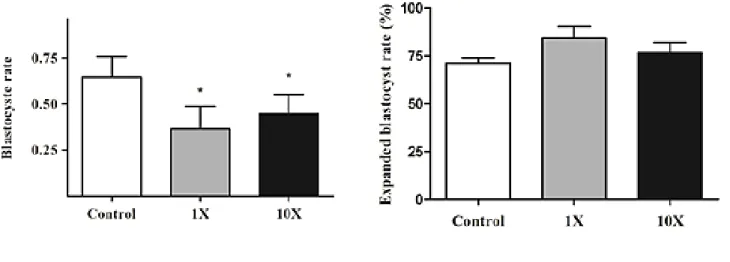
Figure 2.10.2 Blastocyst and expanded blastocyst rate of embryos exposed to 1X or 10X of BDCM during preimplantation period. ... 81
Figure 2.10.3 Volcano plot of transcriptomic and methylation microarray. Fold-change is expressed as a log2 and p-value is expressed as a –log10. ... 82
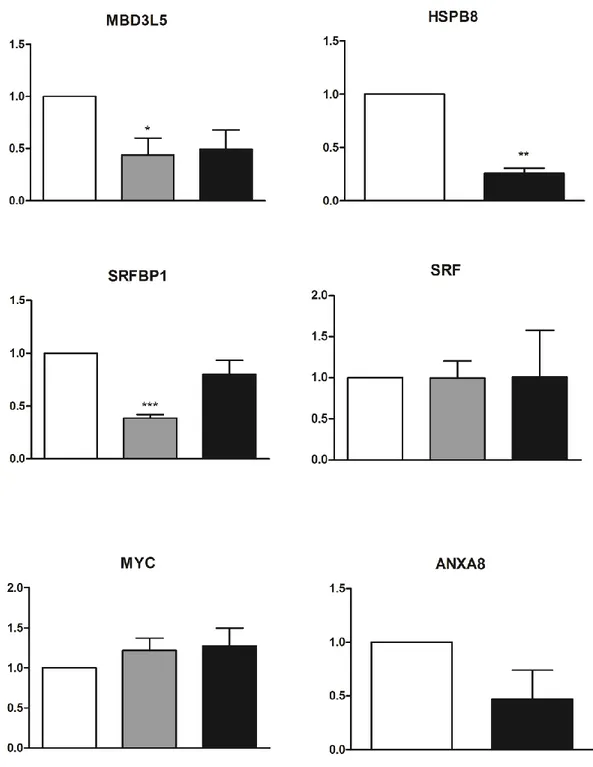
Figure 2.10.4 Expression level of selected genes as measured in RT-qPCR. ... 83
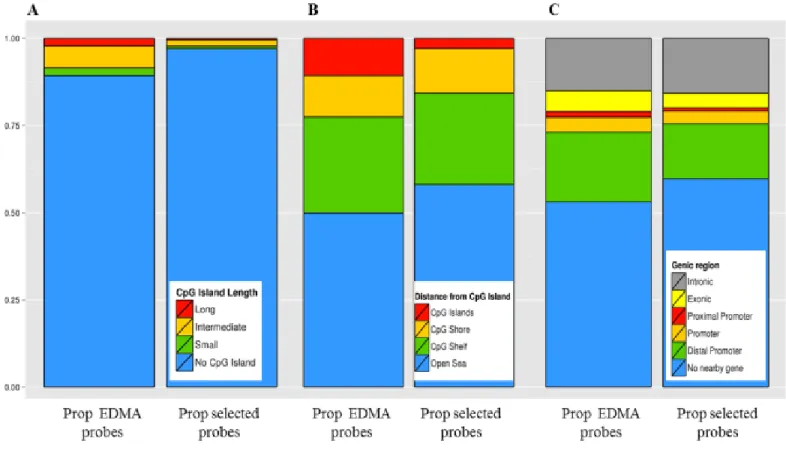
Figure 2.10.5 Proportion of probes on the array and within selected probes according to their type of CpG region. ... 84
Figure 2.10.6 Enrichment ratios of hypermethylated elements within selected probes. ... 85
Figure 2.10.7 Enrichment ratio of selected probes among repeated elements. ... 86
Figure 2.10.8 Schematic summary of the main BDCM impact on porcine embryos. ... 87
Figure 3.9.1 Blastocyst rates (A) and blastocyst rates per type (B) obtained following exposure of embryos to 0 or 0.2% ethanol. ... 115
Figure 3.9.2 Volcano plot of transcriptomic microarray. ... 116
XV
Figure 3.9.4 Mean fluorescence intensity of Mitotracker Red CMXROS staining in control and ethanol-treated (EtOH) (A) 4-cell embryos and (B) blastocysts as detected
by epifluorescence. ... 118 Figure 4.8.1 Blastocyst rate and expanded blastocyst rate of embryos exposed to
ethanol (0.2% w/v) (EtOH) with or without (A, C) myo-inositol (2.27 mM)
(MI-EtOH) or (B, D) glucuronate (2mM) (G-(MI-EtOH) during the preimplantation period... 140 Figure 4.8.2 Expression levels of (A) MIOX in 4-cell embryos and (B) in blastocysts
and (C) expression level of CLU in blastocysts as measured by RT-qPCR. ... 141 Figure 4.8.3 Fluorescence intensity of Mitotracker Red CMXROS staining as
measured in blastocysts with epifluorescence (A). ... 142 Figure 5.9.1 Concentration of DCAA in Quebec City tap water according to season in
µg/L (Mean ± SEM). ... 165 Figure 5.9.2 Blastocyst rate of embryos exposed to DCAA (15 or 150 ppb) with or
without β-ME during the preimplantation period. ... 166 Figure 5.9.3 Blastocyst expansion rate of embryos exposed to DCAA (0, 15 or 150
ppb) during the preimplantation period. (Mean ± SEM)... 167 Figure 5.9.4 Expression levels of selected genes as measured by RT-qPCR following
blastocysts exposure to 0 or 150 ppb DCAA. ... 168 Figure 5.9.5 Number of cell per expanded blastocyst exposed to 0 or 150 ppb of
DCAA, with or without β-ME. ... 169 Figure 5.9.6 Summary of the toxic mechanism induced by DCAA in preimplantation
XVI
LISTE DES ABRÉVIATIONS
ΔΔCt: delta delta cycle threshold5hmC : 5 hydroxymethylcytosine 5mC : 5 methylcytosine
5-MTHF : 5-Methyltetrahydrofolate
ACADL : Acyl-CoA Dehydrogenase, Long Chain AD : Alzheimer disease
ADN : acide désoxyribonucléique AH : acide hyaluronique
AHA : acide haloacétique
ALDH9A1: Aldehyde dehydrogenase 9 Family Member A1 AMPc (ou cAMP): adénosine monophosphate cyclique ANOVA: analysis of variance
ANXA8 : annexine A8
APC/C : anaphase promoting complex APP : amyloid bêta A4
ARN : acide ribonucléique
ARNm : acide ribonucléique messager ATP : adénosine triphosphate
BSA: bovine serum albumin BDCM : bromodichlorométhane β-ME : bêta-mercaptoéthanol CDK1 : cycline 1
cDNA: complementary desoxyribonucleic acid CLU : clusterin
CMX-rosamine : chloromethyl-X-rosamine COC : complexe ovocyte-cumulus
CpG : cytosine – phosphate – guanine CPK : chloropicrine CSF : facteur cytostatique CV : coefficient de variation CYP : cytochrome P450 DAG : diacylglycérol DBCM : dibromochlorométhane
DCA (ou DCAA) : dichloroacétique acide dL : décilitre
DNMT : DNA methyltransférase
DOHaD : developmental origine of health and disease EGF : facteur de croissance de l’épiderme
EtOH : ethanol
FASD : fetal alcohol spectrum disorder fg : femtogramme
FIV : fécondation in vitro
FSH : hormone folliculostimulante
XVII G-EtOH : glucuronate + éthanol
GP : globule polaire
GPR : protéine G couplée à un récepteur GPX5 : glutathione peroxydase
GSH : glutathione
GSS : glutathione synthetase
GSTA4 : Glutathione S-Transferase Alpha 4 HAA : haloacétique acide
HAN : haloacétonitrile HNM : halonitrométhane
IARC : International Agency for Research on Cancer IGF2 : insulin growth factor 2
IL-6 : interleukine-6 IP3 : inositol triphosphate
IP3R : récepteur de l’inositol triphosphate IPA : Ingenuity Pathway Analysis
kg : kilogramme L : litre
LH : hormone lutéinisante
LHR : récepteur de l’hormone lutéinisante MAPK : Mitogen-activated protein kinase MBD : methyl-binding domain
MCA : acide monochloroacétique MCI : masse cellulaire interne mg : milligramme
MII : métaphase 2
MIOX : myoinositol oxygénase ml : millilitre
mM : millimolaire
MOD : matière organique dissoute
MPF : facteur de promotion de la phase mitotique MYL7 : myosin light chain 7
NCSU23: North Carolina State University -23 NPPC : natriuretic peptides
NPR2 : natriuretic peptide receptor B
Oligo dT : courte séquence de nucléotides désoxythymidine PBS : phosphate-buffered saline
PDE3A : phosphodiestérase 3A PD : pyruvate deshydrogénase
PDK : pyruvate déshydrogénase kinase PFA: paraformaldehyde
pFF : liqueur folliculaire purifiée pg : picogramme
PLCz : phospholipase C zêta ppb : partie par milliard PVA : polyvinyl alcool
XVIII
PVA-TL-HEPES: polyvinylalcohol Tyrode’s lactate HEPES PZM3: porcine zygote medium 3
RA : réaction acrosomale
ROS : reactive oxygen species (radicaux libres) RPN1: ribophorin 1
RT-qPCR: quantitative reverse transcription polymerase chain reaction SAM : S-Adenosyl methionine
SEM : standard error of the mean SFC : symetrical fold-change
SPD : sous-produits de la désinfection
TAF11: TATA-Box binding protein associated factor 11 TCA : tricarboxylic acid cycle (cycle de Krebs)
TCAA : trichloroacétique acide TET : Ten-eleven translocation TGF : Transforming Growth Factor TGFβ1 : Transforming Growth Factor β1 THM : trihalométhane
TP53 : tumor protein 53 UDP: uridine diphosphate µg : microgramme
VG : vésicule gemrinale VIM : vimentine
XIX
XX
REMERCIEMENTS
Je suis fière du travail que j’ai accompli, mais je n’aurais pu me rendre à ce point sans l’aide précieuse des gens qui m’entourent.
Merci Marc-André de m’avoir laissé la liberté dont j’avais besoin pour expérimenter et grandir. Tu as su baliser mon parcours et contrôler mes dérapages tout en me laissant l’espace, le budget et le temps nécessaire pour tester mes idées. J’ai senti que tu me comprenais, que mes motivations et mes valeurs t’étaient familières, qu’on se faisait confiance mutuellement. Tu es l’une des figures les plus marquantes dans ma vie. Je suis fière de compter parmi tes étudiants.
Merci Céline d’avoir été ce parfait complément. Tu as été une co-directrice impliquée, disponible, rassurante, et plus que tout, compétente. Par tes commentaires et tes corrections, tu m’as fait voir de nouvelles perspectives et m’as amenée à présenter mes idées différemment. J’ai appris beaucoup à tes côtés.
Merci famille adorée. Diane, Paul, Jeanne, Luc et bébé Hubert, vous êtes ce qui m’est le plus cher au monde. Je suis chanceuse de vous avoir dans ma vie et d’entretenir avec chacun de vous ce lien si proche.
Angus, mon bel amour, je te remercie pour ton support constant, ton calme rassurant et ta grande sagesse. On se ressemble et se complète. Merci de faire partie de ma famille.
Merci amis et amies, particulièrement Francis, Simon, Gabriel et Audrey. Je vous suis reconnaissante d’être dans ma vie depuis toutes ces années et de m’avoir supportée pendant mes études. Votre amour m’est précieux et je resterai votre amie inconditionnelle.
Merci Maxouminet, Véronique et Stéphanie pour votre amitié et pour les (trop) nombreuses heures investies dans l’organisation des différentes activités de l’ACCESA. Ce qui ne devait être qu’un regroupement de quelques étudiants pour gérer une machine à café s’est soldé en une belle amitié, de grands fous rires et une association étudiante ressuscitée.
XXI
Merci Isabelle Laflamme pour toutes ces heures de ponction, de sélection, mais surtout de discussion. Tu es une des raisons pour lesquelles j’ai aimé mon doctorat. Sans ton support, sans tes histoires, sans ton écoute, ces 4 dernières années auraient été bien plus pénibles. Isabelle Dufort, Isabelle Gilbert, je vous dois une fière chandelle. Votre expérience, votre patience, votre rire et vos bons conseils ont grandement contribué à cette thèse. Merci. Merci Amélie Tremblay pour le support moral et technique offert au moment où j’en avais le plus besoin. Merci Julien Vachon pour ta maturité et ton efficacité. Tous les deux, vous m’épatez.
Merci Manuel Rodriguez, Sabrina Simard, Patricia Tremblay et Patrick Levallois pour votre grand apport dans cette thèse. Chacun à votre manière, vous avez ajouté un morceau à mon doctorat et l’avez fait progresser.
Merci aux étudiants passés et présents des laboratoires Sirard, Robert, Richard et Bailey. Vos conseils, vos services rendus et votre support ont souvent été d’un grand secours. Un merci général à tous les membres du département, tant étudiants que chercheurs et employés. Vous m’avez tous aidée d’une façon différente à me rendre où je suis et je vous en suis reconnaissante. Janny Bérubé, mère du département, tu vas me manquer.
Merci Drs Prather (University of Missouri, Columbia, MO), Ankley et Villeneuve (U.S. EPA, Duluth, MN) ainsi qu’à leur équipe respective (notamment Lee Spate et Kellie Fay) de m’avoir accueillie dans votre laboratoire. Ces séjours ont étés formateurs tant d’un point de vue scientifique que culturel.
Un merci bien musclé à Andy, Nico, Mélissa, Simon-Pierre, Marie-Noëlle, Charles, Stéphanie et à tous les autres avec qui j’ai sué au PEPS ces dernières années. Lâchez pas gang, ça va être payant!
Depuis le tout début de mes études graduées, le FRQNT m’a soutenue financièrement. En m’accordant d’abord une bourse de maîtrise, puis de doctorat, et enfin une bourse pour effectuer un stage à l’international, le FRQNT m’a permis de poursuivre mes études et d’obtenir le grade de Ph. D. Je tiens donc à les remercier pour leur confiance répétée.
XXII
Je me mordrai sans doute les doigts prochainement en réalisant qu’il manque des noms importants dans cette liste de remerciements. À toutes ces personnes qui m’ont aidée à un moment ou à un autre, je vous dis merci.
XXIII
AVANT PROPOS
Les chapitres 2 et 3 sont des articles publiés. Le chapitre 4 est accepté avec modifications majeures dans le journal Molecular Reproduction and Development alors que le chapitre 5 sera bientôt prêt à être soumis.
Chapitre 2 :
Pagé-Larivière, F., Tremblay, A., Campagna, C., Rodriguez, M. J., & Sirard, M. A. (2016). Low concentrations of bromodichloromethane induce a toxicogenomic response in porcine embryos in vitro. Reproductive Toxicology, 66, 44-55. Soumis le 28 février 2016. Accepté le 21 septembre 2016.
Florence Pagé-Larivière1, Amélie Tremblay1, Céline Campagna2, Manuel J. Rodriguez3, Marc-André Sirard1
1
Centre de recherche en reproduction, développement et santé intergénérationnelle, Québec, Canada
2
Institut national de santé publique du Québec, Québec and Département de médecine sociale et préventive, Université Laval, Québec
3
Centre de recherche en aménagement et développement, Université Laval, Québec
J’ai réalisé la majorité des expériences et j’ai écrit l’entièreté de cet article. Amélie Tremblay a contribué tant techniquement qu’intellectuellement à cet article en participant à la production d’embryons et en nourrissant le projet de ses suggestions. Manuel J. Rodriguez s’est impliqué dans l’élaboration du projet et a permis l’analyse des échantillons d’eau. Céline Campagna et Marc-André Sirard ont tous deux participé à l’élaboration du projet, à l’analyse des résultats et à la révision de l’article.
Chapitre 3 et 4:
Pagé-Larivière, F., Campagna, C., & Sirard, M. A. (2017). Mechanisms involved in porcine early embryo survival following ethanol exposure. Toxicological Sciences, kfw256. Soumis le 29 septembre 2016. Accepté le 28 novembre 2016.
XXIV
Pagé-Larivière, F., Campagna, C., & Sirard, M. A. Glucuronate Rescue of Porcine Embryos from Ethanol-Induced Death. Soumis le 25 février 2017 à Molecular
Reproduction and Development.
Florence Pagé-Larivière1, Céline Campagna2, Marc-André Sirard1 1
Centre de recherche en reproduction, développement et santé intergénérationnelle, Québec, Canada
2
Institut national de santé publique du Québec, Québec and Département de médecine sociale et préventive, Université Laval, Québec;
J’ai réalisé toutes les expériences et j’ai écrit l’entièreté des articles contenus dans les chapitres 3 et 4. Céline Campagna et Marc-André Sirard ont tous deux participé à l’élaboration du projet, à l’analyse des résultats et à la révision de l’article.
Chapitre 5 :
The toxicogenomic impact of dichloroacetic acid on porcine preimplantation embryo: from adverse effect to rescue. Pagé-Larivière, F., Tremblay, A., Campagna, C., Rodriguez, M. J., & Sirard, M. A.
Florence Pagé-Larivière1, Céline Campagna2, Manuel J. Rodriguez3, Marc-André Sirard1
1
Centre de recherche en reproduction, développement et santé intergénérationnelle, Québec, Canada
2
Institut national de santé publique du Québec, Québec and Département de médecine sociale et préventive, Université Laval, Québec
3
XXV
J’ai réalisé la majorité des expériences et j’ai écrit l’entièreté de cet article. Manuel J. Rodriguez s’est impliqué dans l’élaboration du projet et a permis l’analyse des échantillons d’eau. Céline Campagna et Marc-André Sirard ont tous deux participé à l’élaboration du projet, à l’analyse des résultats et à la révision de l’article.
1
CHAPITRE 1 - Embryons préimplantatoires porcins et
toxicogénomique
1. Revue de littérature
Cette revue de littérature vise à décrire le contexte entourant mes recherches doctorales. La première section (1.1) est donc focalisée sur le cheminement de l’ovogonie vers l’embryon préimplantatoire et décrit les changements majeurs en matière de physiologie chez les cellules impliquées. Un accent particulier est porté sur le porc puisqu’il s’agit du modèle animal choisi dans le cadre de cette thèse. La section 1.2 s’intéresse à la méthylation de l’ADN. Elle détaille sa signification au sein du génome de même que les changements qu’elle connait lors de la fécondation et du développement embryonnaire. La section 1.3 décrit quant à elle les revers de la chloration de l’eau et illustre la manière dont les sous-produits de la chloration peuvent avoir un effet néfaste sur la santé. Une justification du choix des sous-produits de chloration étudiés de même que du modèle animal utilisé est présentée aux sections 1.4 et 1.5, respectivement. Finalement, une description de la toxicogénomique et les objectifs et hypothèses de cette thèse sont décrits aux sections 1.6 et 1.7.
1.1. Le parcours de l’ovogonie vers l’embryon 1.1.1. Résumé
Les ovocytes sont entreposés en très grand nombre dans les ovaires pendant le développement fœtal et y restent inchangés jusqu’au commencement de la puberté. Contenus dans l’organe reproducteur, les ovocytes sont maintenus latents au stade prophase de la méiose I, du stade fœtal au recrutement du follicule. Chez la plupart des mammifères, une stimulation hormonale par la FSH a lieu – une fois par cycle œstral chez le porc – et amène plusieurs follicules à poursuivre dans la voie du développement. Cette maturation transforme le follicule qui prend alors de l’expansion et se gonfle de liquide folliculaire (Figure 1.1). L’ovocyte baigne dans ce liquide, entouré par ses cellules nourricières et protectrices nommées cumulus, et entreprend lui aussi une phase de maturation durant laquelle il entrepose une grande quantité d’ARNm. Cette réserve servira à combler les besoins protéiques du jeune embryon pendant les premiers stades de développement alors
2
que la transcription embryonnaire ne sera pas encore activée. Chez le porc, l’activation du génome embryonnaire se produit entre les stades 4- et 8-cellules, moment à partir duquel l’embryon s’affranchit de la contribution maternelle. La fin de la maturation ovocytaire s’accompagne de l’expulsion d’un premier globule polaire (GP). La méiose est ensuite à nouveau arrêtée, cette fois au stade métaphase II, et ne s’achève que suite au signal induit par la fécondation. L’embryon se développera pendant 7 jours jusqu’à l’atteinte du stade de blastocyste, puis éclora pour initier son développement intra-utérin.
Figure 1.1 Croissance du follicule et maturation ovocytaire chez le porc. La paroi du follicule est représentée en bleu. Elle entoure l’ovocyte (vert).
Après plusieurs jours de développement, un antre gorgé de liquide se forme et gonfle le follicule (rose). L’ovocyte est alors entouré des cellules du cumulus (mauve). (Image par Pagé-Larivière F.)
1.1.2. De cellules germinales primordiales à ovocyte de premier ordre
Les cellules germinales primordiales (CGP) sont les précurseurs des gamètes mâles et femelles. Elles prolifèrent par cycles mitotiques successifs pendant les premières semaines de développement embryonnaire pour atteindre un nombre de 2,7 millions de cellules diploïdes (2N), puis débutent la première étape du processus méiotique : la prophase (Black and Erickson, 1968)). Cette étape est elle-même subdivisée en 5 phases successives : leptotène, zygotène, pachytène, diplotène et diacinèse. Les ovocytes poursuivent la méiose jusqu’à la phase diplotène de la prophase 1, phase à laquelle ils resteront jusqu’à la puberté. À ce stade, ces cellules se nomment ovocytes de premier ordre et sont entourées de cellules épithéliales plates dans une structure nommée follicule primordial (Black and Erickson, 1968) .
3 1.1.3. Développement folliculaire
Les follicules primordiaux chez les mammifères se forment au cours de la vie fœtale, et plus précisément chez le fœtus porcin femelle entre les jours 48 et 56 post-fécondation (Oxender et al., 1979). De 1 100 000 pendant la croissance fœtale, le nombre de follicules passe à environ 500 000 à la naissance suite à une vague de nécrose (Black and Erickson, 1968), puis à 420 000 à la puberté (Gosden and Telfer, 1987). Lors de la venue de la puberté et au cours de tous les cycles ovulatoires subséquents, un certain nombre de follicules primordiaux empruntent la voie de la maturation, un processus s’étirant sur plus de trois mois et dont l’objectif est de mener les follicules à l’ovulation (Morbeck et al., 1992). La première phase de la maturation est plutôt lente et se caractérise par la multiplication des cellules de granulosa qui entraîne l’expansion du follicule. On voit également dériver de la granulosa une nouvelle couche cellulaire sécrétrice d’androgènes au pourtour du follicule, la thèque. Parallèlement, l’ovocyte croît au même rythme que les cellules l’entourant se multiplient et passe de 30 à 115 µm. Aidé des cellules de granulosa, l’ovocyte s’entoure d’une enveloppe constituée de glycoprotéines sulfatées nommée zone pellucide (ZP) qui abrite l’embryon jusqu’à son éclosion au stade blastocyste (Parillo et al., 2003).
La croissance linéaire du follicule perdure jusqu’à l’atteinte d’un plateau à partir duquel le follicule grossit sans que l’ovocyte ne prenne d’expansion, marquant alors le début de la deuxième phase de croissance, celle de l’expansion rapide dépendante des hormones gonadotropes. En effet, malgré la présence de récepteurs à la FSH sur les cellules de la granulosa des follicules primaires, la maturation folliculaire demeure largement indépendante des conditions hormonales et répond plutôt aux signaux de l’environnement ovarien tels les facteurs de croissance (Oxender et al., 1979). Au stade tertiaire toutefois, lorsqu’un antre est formé et que le follicule atteint un diamètre de 2 mm, la croissance et la maturation folliculaire sont guidées par des signaux gonadotropes (Brussow et al., 1996; Driancourt et al., 1995). À partir de ce point, la phase de recrutement folliculaire s’amorce et permet au follicule de répondre aux stimulations gonadotropes provenant de l’hypophyse (Christenson et al., 1985). La nouvelle sensibilité à ces hormones acquise par le follicule est permise par l’apparition de récepteurs fonctionnels à la FSH sur les cellules de
4
granulosa et de récepteurs à la LH sur les cellules de la thèque. De plus, une activité aromatase apparaît dans la granulosa et permet dès lors la synthèse d’œstradiol à partir des androgènes sécrétés par la thèque (Foxcroft and Hunter, 1985).
Environ 50 follicules de 2 à 6 mm de diamètre forment la cohorte de follicules tertiaires. Ceux-ci sont gonflés par du liquide folliculaire qui forme un antre au centre du follicule. L’ovocyte se trouve à ce moment entouré de quelques couches de cellules de granulosa différenciées, les cellules du cumulus (Grant et al., 1989). Entre les jours 14 et 16 de l’œstrus, de 15 à 20 follicules sont menés jusqu’au stade préovulatoire et sont alors dits dominants. Ces follicules mesurent plus de 5 mm de diamètre et les cellules de granulosa possèdent une forte activité aromatase assurant une synthèse d’œstradiol élevée. L’élévation du niveau d’œstradiol dans le follicule contribue à accroître chez les cellules de granulosa l’expression des récepteurs à la LH (Foxcroft and Hunter, 1985). Les cellules de la thèque acquièrent elles aussi une activité aromatase ce qui augmente de surcroit la concentration d’œstradiol dans l’environnement folliculaire (Evans et al., 1981).
L’ovulation (au jour 21 chez la truie) est précédée d’une augmentation marquée des niveaux d’œstrogène et de testostérone (converti en œstradiol) (Grant et al., 1989). Parallèlement et sous l’influence de l’inhibine et de l’œstradiol produites par les cellules folliculaires, le taux de FSH sanguin est abaissé, laissant les follicules dominants sous la gouverne unique de la LH. Environ 15 à 20 ovocytes seront ovulés, les autres follicules étant conduits vers l’atrésie (Foxcroft and Hunter, 1985).
1.1.4. Jonctions communicantes
Du follicule primordial au follicule préovulatoire, les cellules de granulosa supportent l’ovocyte via un réseau étendu de prolongements cytoplasmiques dont les extrémités forment des jonctions communicantes (jonctions gap). Elles assurent ainsi son approvisionnement en nucléosides, en acides aminés et en métabolites du glucose en plus de maintenir son équilibre ionique et d’assurer la stabilité de ses ARNm (Eppig, 1991; Herlands and Schultz, 1984). De plus, on voit traverser par ces canaux des signaux régulant
5
la maturation méiotique afin que règne une cohésion au sein du follicule (Coskun and Lin, 1994).
1.1.5. Maturation ovocytaire
Pendant tout le processus de maturation folliculaire et jusqu’à la reprise de la méiose suivant le pic de LH, l’ovocyte demeure au stade de vésicule germinative (VG) (Cran, 1985). Son cytoplasme est toutefois très actif et de nombreux événements cruciaux à la reprise de la méiose, à la fécondation et au développement embryonnaire y ont cours. En effet, tout au long des premiers stades embryonnaires, la transcription est arrêtée (Tomanek, 1989). L’ovule pallie alors à ce manque en formant pendant sa croissance et jusqu’à la fin de son stade VG une réserve d’ARNm devant répondre aux besoins de l’embryon. Cette réserve s’épuise graduellement jusqu’à ce que le génome embryonnaire soit activé et que l’embryon puisse à son tour produire ses propres ARNm (Schier, 2007). La dépendance de l’embryon est donc absolue face à la réserve d’ARNm ovocytaire et implique que la maturation ovocytaire se produise de façon adéquate pour assurer le développement normal de l’embryon. Cette maturation comporte un volet cytoplasmique qui s’initie dans les instants suivant le pic de LH et un volet nucléaire dont les premiers changements visibles s’enclenchent environ 20h post-LH (Cran, 1985).
1.1.5.1. Maturation nucléaire et reprise de la méiose
Tout près d’atteindre sa taille finale de 120 µm, l’ovocyte porcin au stade prophase de la méiose I entame le processus de maturation nucléaire qui le fera passer de cellule diploïde (2N, 4C) à cellule haploïde (1N, 2C) (Figure 1.2). Les chromosomes se distribuent en plaque métaphasique (métaphase 1) et, rapidement, migrent à leur pôle respectif (anaphase I). Le pôle le plus excentré sera enveloppé par la membrane plasmique et expulsé hors de la cellule (télophase I), on le qualifiera alors de premier globule polaire (Odor and Blandau, 1951). Cette dernière étape se conclut 40 à 50 heures post-LH (Cran, 1985) et met fin à la première division méiotique. La méiose s’arrête ensuite à nouveau au stade métaphase II (MII) jusqu’à la fécondation.
6
Figure 1.2 La maturation nucléaire de l’ovocyte implique l’expulsion d’un premier globule polaire suite à l’ovulation puis d’un deuxième au moment de la fécondation (Wang et al., 2011). © 2011, Int. Union Physiol. Sci./Am. Physiol. Soc.
D’un point de vue moléculaire, le maintien des ovocytes au stade diplotène de la métaphase II est imposé par un niveau élevé d’adénosine monophosphate cyclique (AMPc) dans l’ovocyte entretenu par les cellules du cumulus via leurs jonctions gap (Dekel and Beers, 1978). La concentration élevée d’AMPc dans le cytoplasme des ovocytes a pour effet d’activer la protéine kinase dépendante de l’AMPc (PKA) qui à son tour agit en contrecarrant l’activité de M-phase promoting factor (MPF) via la phosphorylation inactivatrice de la sérine 287 de cdc25, une protéine activatrice de MPF (Duckworth et al., 2002). MPF est un hétérodimère formé d’une sous-unité catalytique, la kinase dépendante de la cycline 1 (CDK1) et d’une sous-unité régulatrice, la cycline B (Fulka et al., 1985). Dans toute division cellulaire et sans faire exception de la complétion de la métaphase I chez l’ovocyte, MPF intervient afin de permettre la transition de G2 à M.
Tel que mentionné précédemment, les jonctions gap unissant le cumulus et l’ovocyte assurent une concentration élevée d’AMPc dans l’ovocyte, permettant ainsi un arrêt de la méiose. L’hypothèse la plus plausible voulait auparavant que le cumulus transfère à l’ovocyte l’AMPc dont il a besoin. Il a toutefois été récemment démontré que ce n’était pas l’AMPc mais bien la guanosine monophosphate cyclique, GMPc, qui traversait ces pores
7
cellulaires (Norris et al., 2009). En effet, l’adénylate cyclase ovocytaire est maintenue active par l’action constitutive de la protéine G couplée au récepteur 3 (GPR3) et de la GPR12, deux régulateurs de la protéine Gs du récepteur à la LH. Cette activation de l’adénylate cyclase assure une production continue d’AMPc dans l’ovocyte. Toutefois, afin de maintenir ce niveau élevé d’AMPc, il importe d’inhiber l’activité de la phosphodiestérase 3A (PDE3A) responsable d’hydrolyser le nucléotide cyclique. Cette inhibition est permise par la GMPc qui, en diffusant du cumulus vers l’ovocyte, bloque l’action de PDE3A et stabilise l’AMPc (Norris et al., 2009).
La production de GMPc s’amorce dans les cellules de la granulosa, sans avoir une activité guanylyl cyclase forte, sécrètent vers le cumulus le peptide Natriuretic peptide C (NPPC). Lorsque celui-ci se lie à son récepteur Natriuretic peptide receptor 2 (NPR2) à la surface des cellules du cumulus, il active la guanylyl cyclase et stimule la production de GMPc qui diffuse alors vers l’ovocyte (Zhang et al., 2010).
Pendant la maturation ovocytaire, la concentration d’AMPc dans les cellules de la granulosa murale est relativement faible due à l’inactivité du système récepteur à la LH (LHR)/Gs /adénylyl cyclase. Toutefois, suite au pic de LH, la liaison de cette hormone à son récepteur sur les cellules de la granulosa a pour effet d’activer la protéine Gs qui y est couplée, entraînant une production accrue d’AMPc qui active alors une cascade de réaction conduisant à la fermeture des jonctions gap reliant l’ovocyte aux cellules somatiques (Gilula et al., 1978). Ceci est causé par la phosphorylation et de l’inactivation subséquente du principal constituant de ces jonctions communicantes, les connexines 43 (Granot and Dekel, 1994). Parallèlement, la concentration de GMPc dans le cumulus décroît soit par une réduction de l’activité guanylyl cyclase ou par une activité accrue de la GMPc phosphodiestérase, causant une chute du niveau d’AMPc dans l’ovocyte, une levée de l’inhibition du MPF et une reprise de la méiose.
1.1.5.2. Maturation cytoplasmique
Le cytoplasme de l’ovocyte n’est pas en reste lors de la maturation finale. On note ainsi une migration des granules corticaux de la zone sous-corticale vers leur position finale, soit
8
quelques nanomètres sous la membrane plasmique, en association avec le cytosquelette (Cran, 1985). L’ovocyte acquiert alors la compétence pour expulser les granules corticaux et ainsi permettre la prévention de la polyspermie via le durcissement de la zone pellucide (Ducibella et al., 1994).
Les autres organites font également l’objet d’un réaménagement. Les mitochondries jusqu’alors petites et abondantes voient leur nombre chuter du tiers suite à la méiose, mais leur volume augmenter de 300 % chez le porc suite à des fusions (Cran, 1985). Aidées des microtubules, elles migrent de la périphérie vers la zone plus centrale de l’ovocyte, adoptant une conformation diffuse (Brevini et al., 2007). À l’inverse des mitochondries, les gouttelettes lipidiques contenues dans le cytoplasme de l’ovocyte porcin augmentent en nombre en adoptant toutefois une taille réduite (Cran, 1985). Entre la zone pellucide et la membrane plasmique, l’espace périvitellin apparaît (Flechon et al., 2003). La zone pellucide elle-même subit des altérations fonctionnelles et structurelles la rendant apte à la liaison des spermatozoïdes et à l’induction de leur réaction acrosomale (Parillo et al., 2001; Rath et al., 2005).
Suite à la fécondation, l’ADN condensé du spermatozoïde doit être décondensé afin de remplacer les protamines par des histones. Cette action est permise par l’importante quantité de glutathion (GSH) entreposée dans l’ovocyte pendant sa maturation (Maedomari et al., 2007).
1.1.5.3. Maturation du cumulus
Suite à la décharge de LH et avant l’ovulation, les cellules de cumulus modifient leur arrangement en sécrétant une matrice extracellulaire viscoélastique. Cette matrice est constituée d’acide hyaluronique, un glycosaminoglycan formé de chaînes répétées d’acide glucuronique et de N-acétyl-glucosamine (Salustri et al., 1992). Les cellules sont alors séparées les unes des autres tout en étant toujours unies entre elles par la matrice extracellulaire qui les entoure.
9
L’expansion du cumulus est chapeautée par la FSH qui traduit son action par une augmentation de la concentration d’AMPc dans les cellules du cumulus (Dekel and Kraicer, 1978; Salustri et al., 1985). Chez le porc, contrairement à la souris et au rat, ce processus est préalable à la rupture de la vésicule germinale (Motlik et al., 1986).
1.1.6. Fécondation
Chez toutes les espèces animales étudiées à ce jour, l’entrée d’un spermatozoïde dans l’ovoplasme enclenche une foule de mécanismes au sein de l’ovule, tous regroupés sous le titre d’ « activation ovocytaire » et tous initiés par le même facteur : un accroissement de la concentration de calcium intracellulaire (Stricker, 1999). Parmi les mécanismes mis en branle se trouvent l’exocytose des granules corticaux, la seconde reprise de la méiose aboutissant à l’extrusion du 2e
globule polaire et la formation des pronoyaux (Schultz & Kopf 1995; Ducibella et al. 2002; Ducibella & Fissore 2008; Ito et al. 2011).
La fécondation chez la plupart des mammifères (à l’exception du cochon d’Inde) implique la reconnaissance par la protéine Zone pellicude 3 (ZP3) du spermatozoïde, celui-ci déclenchant alors sa réaction acrosomique (Bleil, 1990; Wassarman, 1999). Celle-ci est caractérisée par la rupture de l’acrosome et la libération de l’hyaluronidase qu’il renferme. L’enzyme dégrade la matrice de la ZP et permet au gamète mâle de cheminer jusqu’à la membrane plasmique ovocytaire. À ce moment se produit une fusion des membranes plasmiques permettant d’une part l’expulsion du matériel génétique mâle dans l’ovoplasme et, d’autre part, le transfert vers l’ovoplasme de la phospholipase C type zêta (PLCz). Cette phospholipase est critique pour l’activation de l’ovocyte et l’enclenchement de ses mécanismes post-fécondation car c’est elle qui initie l’augmentation de la concentration de calcium intracellulaire, qu’on qualifie plutôt d’oscillations puisque la concentration varie sur une base cyclique, avec des hausses massives suivies de retours à la normale (Gilkey et al., 1978). La PLCz, en entrant dans l’ovule, hydrolyse les phosphatidylinositol (4,5)-biphosphate (PIP2) de la membrane plasmique pour former du diacylglycérol (DAG) et de l’inositol 1,4,5-triphosphate (IP3) (Saunders et al., 2002). L’IP3 nouvellement formé diffuse alors jusqu’à son récepteur (IP3R) situé sur la membrane du réticulum
10
endoplasmique (Keizer et al., 1995). Une fois lié à son ligand, le canal calcique IP3R s’ouvre et permet un afflux de calcium dans l’ovoplasme. Ce calcium libéré dans l’ovoplasme active la kinase calcium calmoduline-dépendante (CaMKII) qui à son tour inhibe l’activité du facteur cytostatique (CSF) (Lorca et al., 1993). Ce facteur joue un rôle prédominant dans le maintien de la phase MII car il prévient l’activité ubiquitine ligase du complexe promoteur de l’anaphase/cyclosome (APC/C) qui, s’il était actif, polyubiquitinerait la cycline B, monomère de MPF, et la conduirait au protéasome (Peters, 2006). Ainsi, en inhibant APC/C, CSF permet la stabilisation de MPF et le maintien en MII. Conséquemment, l’activation de CaMKII entraîne la dégradation de MPF et la seconde reprise de la méiose.
1.1.7. Protocoles in vitro
La maturation ovocytaire et la fécondation in vitro (FIV) sont largement utilisées à travers le monde, tant chez les animaux d’élevage que chez l’humain. Peu fructueuses initialement, les techniques de FIV se sont raffinées au fil des ans et permettent aujourd’hui d’obtenir de bons taux d’embryons chez plusieurs espèces (Coy and Yanagimachi, 2015; Mantikou et al., 2013). Toutefois, un plat de pétri n’est pas un utérus et, dans ces circonstances, les perturbations environnementales sont nettement supérieures dans les protocoles in vitro que dans les in vivo. Ces perturbations ont le potentiel de nuire au bon développement d’un embryon en en modifiant le métabolisme, l’épigénome et le profil d’expression des gènes (Pinborg et al., 2016; Talaulikar and Arulkumaran, 2013).
1.1.7.1. Maturation ovocytaire in vitro
Chez le porc, les follicules de plus de 0,77 mm de diamètre renferment un ovocyte apte à reprendre la méiose. Ce n’est toutefois qu’à partir de 3 mm de diamètre que l’ovocyte devient suffisamment mature pour finaliser sa maturation in vitro et poursuivre son développement au-delà de la métaphase I (Sun et al., 2004). Il importe donc de sélectionner avec soin les follicules ponctionnés afin d’éviter l’obtention de faibles taux de développement.
11
Lorsque retiré de son environnement folliculaire, l’ovocyte jusqu’alors tributaire des facteurs inhibiteurs sécrétés par la granulosa murale enclenche la reprise de la méiose. Certains protocoles de maturation in vitro recommandent l’ajout d’AMPc au milieu afin de retarder ce processus et d’assurer une maturation adéquate préalablement à la rupture de la VG (Campagna et al., 2008). Le protocole développé pour la présente étude fait usage d’un tel nucléotide.
L’expansion du cumulus est compromise dans la majorité des protocoles de maturation in
vitro, principalement ceux préconisant l’usage de milieux définis (Naito, 1989, 1988). La
maturation en présence de liquide folliculaire porcin purifié (pFF) ou de sérum recrée l’expansion du cumulus in vivo, c’est-à-dire qu’une expansion normale est observée à la fin du processus de maturation. L’utilisation d’un milieu défini où l’alcool polyvinylique (PVA) remplace le pFF et le sérum ne permet pas quant à lui une telle expansion du cumulus (Abeydeera, 2000). Considérant que cette expansion constitue normalement l’un des critères permettant de mesurer la qualité de la maturation ovocytaire, comment alors expliquer que des ovocytes de qualité puissent émerger de tels protocoles? Des études se sont penchées sur la question et ont montré que ces milieux définis, s’ils assurent la même production d’acide hyaluronique (AH) par le cumulus (AH), ne confèrent pas à ces cellules somatiques la capacité de le retenir (Nagyova, 2012). L’AH est le composant principal de la matrice extracellulaire. Il advient donc que le milieu de maturation reçoit l’AH qui aurait normalement dû être concentré au pourtour de chacune des cellules du COC. Le protocole utilisé dans cette étude inclut l’usage du pFF.
1.1.7.2. Fécondation in vitro
La fécondation in vitro chez le porc présente de nombreux obstacles, que ce soit par les taux de polyspermie très élevés (Wang et al., 2003), le faible taux de blastocystes ou la qualité souvent mauvaise de ceux obtenus. La polyspermie chez le porc est entre autres causée par une trop grande synchronie dans la réaction acrosomale (RA) des spermatozoïdes. Ceux-ci étant tous capacités en même temps lors de la décongélation (capacitation induite par le froid) et ayant tous la RA simultanément, le durcissement de la
12
zone pellucide provoqué par l’extrusion des granules corticaux ne survient pas suffisamment rapidement et ne parvient donc pas à bloquer l’entrée d’autres spermatozoïdes une fois le premier pénétré.
Différentes techniques de fécondation ont été testées à travers le monde avec des succès mitigés (Romar, 2016). Certains ont opté pour une réduction drastique du nombre total de spermatozoïdes mis en contact avec l’ovocyte ce qui conduisait inévitablement à une réduction du nombre d’ovocytes fécondés (Abeydeera et al., 1997). D’autres ont plutôt développé une méthode élaborée permettant de mimer la fécondation in vivo, c’est-à-dire que les spermatozoïdes devaient cheminer le long d’un canal pour arriver à l’ovocyte. Cette méthode nommée « fécondation dans une paille », ou Straw-IVF a montré qu’il était possible d’obtenir de meilleurs taux de blastocystes tout en réduisant le taux de polyspermie (Li et al., 2003). Une autre équipe a obtenu de bons taux de monospermie et de blastocystes en combinant la méthode Straw-IVF à une réduction de l’incubation des deux gamètes à 10 minutes (Alminana et al., 2008). D’autres méthodes ont tenté de modifier les milieux de fécondation. Par exemple, Kim et al. a montré que la monospermie était accrue dans ses protocoles lorsque 1% du milieu de fécondation était constitué de fluide de l’oviducte (Kim et al., 1996). Une autre équipe a montré que l’incubation des ovocytes pendant 30 minutes dans du liquide de l’oviducte non dilué réduisait la polyspermie (Coy et al., 2008). Nagai a aussi montré que la co-culture des spermatozoïdes et des cellules de l’oviducte pendant 2,5h avait un effet significatif sur la réduction de la polyspermie (Nagai and Moor, 1990). Dans le cadre des présentes recherches, l’emphase a été mise sur la méthode de cryoconservation et de décongélation de la semence.
La semence porcine résiste difficilement à la cryoconservation (Pursel and Johnson, 1976). Les critères de qualité tels que la survie et la motilité sont fortement réduits suite à la décongélation et la capacité des spermatozoïdes à féconder est souvent nulle. Cette baisse de qualité peut être exploitée pour limiter le taux de fécondation polyspermique, à condition de trouver une semence qui conserve un certain potentiel à féconder. La résistance à la cryoconservation de la semence est variable d’un verrat à l’autre et même d’un éjaculat à l’autre pour un même verrat (Johnson et al., 1981; Thurston et al., 2002).
13
Pour réaliser des expériences de fécondation in vitro avec de la semence congelée, il importe donc de tester plusieurs éjaculats avec différents paramètres de congélation, de décongélation et de fécondation.
1.1.8. Développement embryonnaire
1.1.8.1. Premières divisions cellulaires
Suite à la fécondation, les ADN mâle et femelle se décondensent et forment deux pronoyaux bordés d’une enveloppe nucléaire distincte. Une phase de réplication de l’ADN en vue de la première division méiotique a alors lieu sans toutefois que les pronoyaux ne fusionnent. Ceux-ci effectuent plutôt une migration vers le centre de l’ovocyte aidés des microtubules puis, suite à la dégradation de leur enveloppe, alignent leurs chromosomes en 2 fuseaux mitotiques (Kim et al., 1997). La première division cellulaire a lieu 12 heures après la fécondation in vitro et permet alors la formation de deux cellules identiques dont la taille respective correspond à la moitié de la taille de la cellule initiale (Schoenbeck et al., 1992). L’embryon demeure au stade 2-cellules pendant environ 14 heures, puis se divise à nouveau (4-cellules) après 50 heures (Prather, 1993; Schoenbeck et al., 1992). Au 4e jour, l’embryon a entre 8 et 16 cellules (stade morula) et entame sa compaction (Hunter, 1974). Toutes ces divisions se font elles aussi de manière à respecter les dimensions originales de l’ovule, et ce, jusqu’à l’atteinte du stade de blastocyste, stade à partir duquel un antre empli de liquide se forme au centre de l’embryon, le blastocèle. L’embryon prend alors de l’expansion jusqu’à la rupture de la zone pellucide. On qualifiera alors l’embryon d’éclos (Figure 1.3). À ce moment, l’embryon compte entre 65 et 120 cellules (Papaioannou and Ebert, 1988).
14
Figure 1.3 Représentation temporelle (en heures) des différentes divisions cellulaires chez l'embryon préimplantatoire porcin in vivo selon les données de Mateusen et al., 2005 (image par Pagé-Larivière F.)
Les cellules totipotentes de l’embryon sont en orange. Une première division cellulaire apparaît après 140-150 heures et forme le trophectoderme (bleu) et la masse cellulaire interne (rose). Suite à l’éclosion, la masse cellulaire interne se subdivise en épiblaste (rose) et en hypoblaste (vert). (Mateusen et al., 2005)
1.1.8.2. Premières différenciations cellulaires
Le stade de blastocyste marque le premier pas vers la différenciation cellulaire. Jusque-là, toutes les cellules de l’embryon étaient totipotentes, c’est-à-dire que chacune d’elles avait le potentiel de former un nouvel individu à part entière. À partir du blastocyste toutefois, les cellules deviennent pluripotentes et se trouvent divisées en deux groupes : les cellules du trophoblaste qui se situent en périphérie de l’embryon et qui formeront le placenta, et la masse cellulaire interne (MCI), embryon en développement (Stroband and Van der Lende, 1990).
Peu après l’éclosion, le blastocyste migre jusqu’à la paroi utérine où il se fixe grâce aux microvillosités des cellules du trophectoderme. De nouvelles différenciations cellulaires ont alors lieu. D’abord, le trophoblaste se subdivise en deux parties : la plus externe formant un syncytium qui érode la muqueuse utérine pour permettre l’ancrage, et la plus interne, le cytotrophoblaste, qui borde l’embryon (Stroband and Van der Lende, 1990).
Du côté de la MCI, une subdivision fait apparaître un feuillet cellulaire nommé hypoblaste de même qu’un second, l’épiblaste. L’hypoblaste n’est pas destiné à former l’embryon. Sa contribution est plutôt dans la formation de l’entoblaste extra-embryonnaire de la vésicule
15
vitelline et de l’allantoïde. Quant à l’épiblaste, il se subdivise à son tour en trois feuillets, soit l’ectoblaste, le mésoblaste et l’entoblaste. C’est de ces trois feuillets que l’embryon à proprement parlé sera issu.
1.1.8.3. Les cellules germinales primordiales
Les cellules germinales primordiales sont à l’origine des futures gamètes. Issues de l’épiblaste proximal, elles apparaissent au tout début de la première phase de gastrulation, avant même la division en feuillets embryonnaires. Elles se regroupent ensuite dans une région extra-embryonnaire du mésoderme (Kozhukhar, 2011) puis migrent vers les crêtes génitales via l’endoderme de l’intestin postérieur et le mésentère dorsal (Hyldig et al., 2011).
1.2. Épigénétique, reprogrammation de l’épigénome et impacts sur la santé
L’ovule et le spermatozoïde sont deux cellules hautement spécialisées. À l’inverse, l’embryon préimplantatoire est constitué de cellules ayant le potentiel de devenir n’importe lequel des quelques 200 types cellulaires qui constituent l’individu adulte. Le passage de cellules différenciées à totipotentes est permis notamment par les changements épigénétiques que subissent les cellules à ce stade.
1.2.1. Qu’est-ce que l’épigénétique?
L’épigénétique permet la modulation de l’expression des gènes. C’est par elle que la différenciation cellulaire s’établit, reflétant les fonctions variées et l’expression différentielle des gènes selon le tissu et permettant un profil d’expression génique différent d’un type cellulaire à l’autre (Cantone and Fisher, 2013; Ji et al., 2010). L’épigénome, qui regroupe l’ensemble des marques épigénétiques d’un génome, est partiellement malléable et participe à l’adaptation de la réponse cellulaire lors de perturbations environnementales (Barres et al., 2012; Fraga et al., 2005). L’épigénétique s’inscrit en quatre volets principaux, soit la méthylation de l’ADN, la modification post-traductionnelle des histones,
16
l’expression d’ARN non-codants et la reconfiguration de la chromatine (Berger, 2009). Nous nous intéresserons uniquement à l’aspect méthylation des cytosines.
1.2.2. La méthylation des cytosines
Les méthylations de l’ADN sont majoritairement situées sur le 5e
carbone de cytosines (5mC) adjacentes à une guanine dans un arrangement dinucléotidique nommé CpG (cytosine-phosphate-guanine) (Bestor, 1988). Cette altération nucléotidique est catalysée par l’une des méthyltransférases de l’ADN (DNMT1, DNMT3A, DNMT3B, DNMT3L) qui utilise la S-adénosine méthionine (SAM) comme donneuse de groupements méthyles (Kareta MS, 2006).
DNMT1 est une méthyltransférase de maintenance, c’est-à-dire qu’elle a pour fonction de transmettre le profil de méthylation lors de la division cellulaire (Sharif et al., 2007). Cette enzyme agit donc en phase S du cycle cellulaire menant à la mitose en ajoutant des groupements méthyles sur le brin néosynthétisé afin que le profil de méthylation présent sur l’ADN parental soit transmis aux cellules filles. DNMT1 est recrutée à la fourche de réplication par NP95 qui la guide et l’oriente (Sharif et al., 2007). Un variant de cette enzyme, DNMT1o, est spécifiquement exprimé dans l’ovocyte et l’embryon implantatoire où il y joue un rôle similaire à DNMT1 jusqu’au stade de morula (Cirio et al., 2008). Il est également requis pour le développement adéquat du méthylome placentaire (Himes et al., 2013).
Un second type de méthyltransférases permet la méthylation de novo, soit sans qu’un profil de méthylation préexistant ne les guide (Okano M, 1999). Il s’agit de DNMT3A, DNMT3B et du cofacteur DNMT3L, des méthyltransférases impliquées principalement dans l’établissement d’un nouveau profil de méthylation dans les cellules germinales primordiales et dans l’embryon préimplantatoire (voir section 1.2.7). DNMT3A et DNMT3L sont requises pour l’établissement des empreintes sur les gènes à réprimer dans les lignées germinales (Bourc'his et al., 2001; Kaneda et al., 2004).