Étude des effets d’un extrait de peptides du lait sur la
réponse immune chez la souris saine
Mémoire
Maëlle Rajaonary
Maîtrise en sciences et technologie des aliments
Maître ès Sciences (M.Sc.)
Québec, Canada
III
Résumé
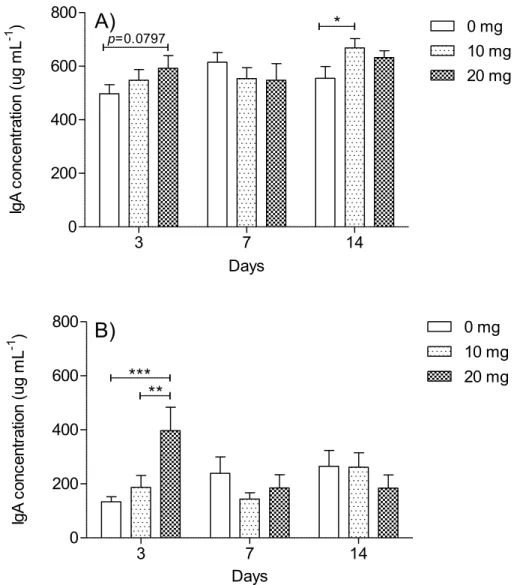
Un isolat de protéines de lactosérum commercial hydrolysé enzymatiquement (IPL-H), contenant le peptide β-LG f96-99, a été administré à des souris saines pendant 3, 7 et 14 jours selon 3 doses (0, 10 ou 20 mg) pour évaluer son effet au niveau intestinal. Les taux d’IgA sériques ont augmenté significativement uniquement au jour 14 avec 10 mg. Les taux d’IgA fécales ont augmenté considérablement au jour 3. Ces taux ont triplé avec la dose 20 mg comparé au groupe contrôle. Aucune différence significative n’a été observée aux jours suivants pour les taux IgA fécales, ni pour l’expression du gène TGF-β au jour 3. L’IPL-H induirait une réponse rapide et locale via la production d’IgA au niveau intestinal et une réponse lente et faible dans le sérum. Le peptide β-LG f96-99 présent dans cet hydrolysat pourrait être associé aux effets observés.
V
Table des matières
RÉSUMÉ ... III TABLE DES MATIÈRES ... V LISTE DES TABLEAUX ... VII LISTE DES FIGURES ... IX LISTE DES ABREVIATIONS ... XI REMERCIEMENTS ... XIII AVANT-PROPOS ... XV
INTRODUCTION ... 1
CHAPITRE I : REVUE DE LITTERATURE ... 3
1. Structure et fonctions biologiques des protéines du lactosérum ... 5
1.1. β-lactoglobuline ... 5
1.2. α-lactalbumine ... 6
1.3. Glycomacropeptide ... 7
1.4. Immunoglobulines ... 8
1.5. Albumine sérique bovine ... 8
1.6. Lactoferrine ... 8
1.7. Lactoperoxydase ... 9
2. Système immunitaire... 10
2.1. Immunité innée... 10
2.2. Immunité spécifique ... 11
2.3. Rôle des cytokines dans la réponse immunitaire ... 15
2.4. Méthodes d’analyses immunologiques ... 18
3. Activités immunomodulantes des peptides issus de l’hydrolyse des protéines du lactosérum ... 22
3.1 Hydrolysats enzymatiques et fractions peptidiques issus des protéines du lactosérum ... 22
3.2. Peptides issus de la β-lactoglobuline ... 26
3.3 Peptides issus de l’α-lactalbumine ... 27
VI
CHAPITRE II : EFFECT OF A HYDROLYZED WHEY PROTEIN ISOLATE ON THE IMMUNE SYSTEM OF
HEALTHY MICE ... 31
RÉSUMÉ ... 33
ABSTRACT ... 34
1. Introduction ... 35
2. Material and methods ... 37
2.1. Materials ... 37
2.2. Preparation of WPI hydrolysate ... 37
2.3. Chemical analyses ... 38
2.4. Mice protocol ... 39
2.5. IgA determination in serum and feces ... 39
2.6. RNA extraction ... 40
2.7. Determination of genes expression ... 40
2.8. Immunohistochemistry ... 40
2.9. Fluorescence microscope analysis ... 41
2.10. Effect of H-WPI on J774 cells ... 41
2.11. Statistical analyses ... 42
3. Results and discussion... 43
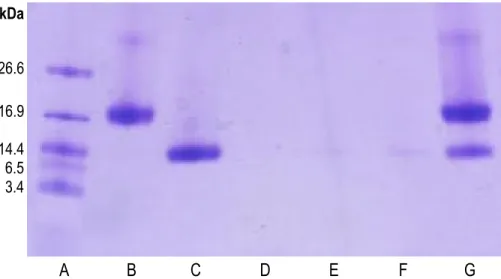
3.1. Composition of the H-WPI ... 43
3.2. Immunomodulatory effects of H-WPI ... 46
CONCLUSION ... 55
CONCLUSION GÉNÉRALE ... 57
VII
Liste des tableaux
IX
Liste des figures
CHAPITRE I : Revue de littérature
Figure 1 : Structure 3D d’un monomère du variant A de la β-lactoglobuline ... 6
Figure 2 : Structure 3D de l’α-lactalbumine. ... 7
Figure 3 : La réponse immunitaire innée. ... 11
Figure 4 : La réponse immunitaire acquise... 12
Figure 5 : Différenciation des cellules T. ... 16
Figure 6 : Action des cytokines dans la différenciation et la conversion des Th ... 17
Figure 7 : Principe du test sandwich ELISA ... 18
Figure 8 : Principe de l'immunofluorescence directe. ... 20
CHAPITRE II : Effect of a hydrolyzed whey protein isolate on the immune system of healthy mice Figure 1: SDS-PAGE profiles (Tris-Tricine gel). ... 44
Figure 2: Reversed phase-high performance liquid chromatography (RP-HPLC) profile of hydrolyzed-whey protein isolate (H-WPI) ... 45
Figure 3: IgA levels in serum and feces of mice after the gavage during 3, 7 and 14 days with PBS or two doses of the hydrolyzed-whey protein isolate (10, 20 mg) ... 48
Figure 4: Genes expression of TGF-β, AID, TSLP and BAFF as determined by RT-qPCR on mice Peyer’s patches RNA after gavage during 3 days with PBS or two doses of the hydrolyzed-whey protein isolate (10, 20 mg). ... 50
XI
Liste des abréviations
Ac : anticorps
ACE : angiotensin converting enzyme ADNc : ADN complémentaire
Ag : antigène
AID : activation-induced cytidine deaminase ARNm : ARN messagers
BAFF : facteur d’activation des cellules B
BSA : bovine serum albumin (albumine sérique bovine) CMH : complexe majeur d’histocompatibilité
ConA : concanavaline A
CPA : cellules présentatrices de l’antigène CPL : concentré de protéines de lactosérum
CSR : class-switch recombination (ou commutation de classe) CTL : LT cytotoxique
E.coli : Escherichia coli
ELISA : enzyme-Linked Immunosorbent Assay
EU : endotoxin units
GMP : glycomacropeptide HMS : hypermutation somatique H-WPI : hydrolyzed whey protein isolate
Ig : immunoglobuline
IL : interleukine
IPL : isolat de protéines de lactosérum
IPL-H : isolat de protéines de lactosérum hydrolysé kDa : kilo daltons
LAL : limilus amebocyte lysate
LB : lymphocytes B
LC-MS : liquid chromatography–mass spectrometry LF : lactoferrine
LP : lactoperoxydase LPS : lipopolysaccharides
XII
NK : natural killer
PAMPs : pathogen-associated molecular patterns PBS : phosphate-buffered saline
PRR : pattern recognition receptor
qPCR : polymerase chain reaction (PCR) quantitative en temps réel RP-HPLC : reverse-phase high-performance liquid chromatography SDS-PAGE : sodium dodecyl sulfate polyacrylamide gel electrophoresis sIgA : IgA sécrétoires
TGF-β : transforming growth factor beta (facteur de croissance de transformation β) Th : T helper (ou auxiliaire)
Treg : T régulateur
TSLP : lymphopoïétine stromale thymique UF : ultrafiltration
WP : whey proteins WPI : whey protein isolate α-LA : α-lactalbumine β-LG : beta-lactoglobuline
XIII
Remerciements
La réalisation de ce mémoire n’aurait pas été possible sans la contribution de plusieurs personnes à qui je souhaite adresser ma reconnaissance.
Je tiens tout d’abord à remercier la Dre Sylvie Gauthier, ma directrice de recherche, pour m’avoir confié ce projet et m’avoir soutenue à travers toutes les étapes de ce mémoire. Sa patience, sa rigueur et sa disponibilité m’ont guidé pendant ces deux dernières années.
Je souhaite exprimer toute ma gratitude envers le Dr Yvan Boutin, mon codirecteur de recherche, pour son encadrement, sa confiance et ses conseils éclairés.
Je remercie le Dr Jean-Christophe Vuillemard pour avoir accepté d’effectuer la pré-lecture de ce mémoire.
Je tiens à remercier tout particulièrement Diane Gagnon, pour son incroyable dévotion accordée à son travail et pour m’avoir accompagnée tout au long de mes expériences et ce, malgré les nombreuses difficultés rencontrées.
Je remercie tous mes collègues de laboratoire, notamment Fred, Nassim et Gabriel, ainsi que toute l’équipe du secteur biologie de chez TransBioTech, en particulier Marie-Josée et Elodie, pour leur générosité et leur support moral et intellectuel tout au long de ma démarche. Merci à Vincent Tellier, pour avoir réalisé les essais animaliers.
Je n'oublie pas ma famille pour m’avoir soutenue tout au long de mes études, avoir cru en moi et m’avoir donné la chance de partir à l’étranger. Mes remerciements s’adressent également à Nolwenn, Dinh, Raphaël et Aubéri pour leur amitié et soutien inestimable.
Enfin, ce projet n’aurait pas pu avoir lieu sans le soutien financier du Conseil de Recherches en Sciences naturelles et en Génie du Canada (CRSNG).
XV
Avant-propos
Ce mémoire porte sur l’étude de l’effet de l’ingestion orale d’un hydrolysat de protéines de lactosérum sur le système immunitaire chez la souris saine. Une introduction générale vient présenter le contexte du projet de recherche. Le mémoire est ensuite divisé en deux chapitres.
Le premier chapitre est une revue de littérature abordant les caractéristiques du lactosérum et ses composés, notamment la β-lactoglobuline. Elle présente également les notions d’immunologie nécessaires à la compréhension du projet. Elle résume ensuite les travaux de la littérature portant sur les effets immunomodulateurs des protéines et peptides du lactosérum ainsi que leurs hydrolysats. Elle est suivie de l’hypothèse et des objectifs de recherche.
Le second chapitre est écrit en anglais et présenté sous la forme d’un article scientifique. Il décrit les effets d’un hydrolysat de protéines de lactosérum au niveau intestinal dans un modèle murin in vivo. Il décrit les protocoles expérimentaux ainsi que les résultats obtenus et leur interprétation. Les données expérimentales ont été obtenues par l’auteur, assistée par des professionnels de recherche. L’interprétation des résultats et la rédaction du mémoire ont également été réalisées par l’auteur avec l’aide de la Dre Sylvie Gauthier, directrice du projet et coauteur de l’article ainsi que du Dr Yvan Boutin, codirecteur et coauteur de l’article.
Ce chapitre est suivi d’une conclusion générale présentant les perspectives de recherche possibles à la suite de ces travaux.
1
Introduction
Le lait est un aliment reconnu pour sa richesse en protéines, lipides et lactose ainsi qu’en nutriments comme le calcium, phosphore et certaines vitamines. Ses propriétés nutritives sont d’autant plus intéressantes que le lait contient des composés bioactifs ayant des effets sur la santé. C’est en effet l’unique aliment nécessaire pour répondre aux besoins du nouveau-né. Il permet de soutenir sa croissance rapide et contient des composés stimulant le développement de son système immunitaire pour répondre aux diverses agressions de l’environnement ainsi que des composés anti-inflammatoires (Blewett et al., 2008).
Depuis une dizaine d’années, les consommateurs prennent de plus en plus conscience du rôle que l’alimentation peut jouer sur leur bien-être et leur santé. L’intérêt pour les nutraceutiques et les aliments fonctionnels est grandissant. De ce fait, de nombreuses recherches sont effectuées pour mieux comprendre les bienfaits des composantes alimentaires sur la santé humaine.
C’est pourquoi plusieurs études ont été réalisées sur le lait et ses protéines. En outre, les protéines du lactosérum sont reconnues non seulement pour leur excellente qualité nutritionnelle et leur bonne digestibilité (de Wit, 1998), mais aussi pour les effets physiologiques variés qu’elles initient dans l’organisme suivant leur ingestion. De plus, certains peptides contenus dans la séquence primaire de ces protéines ont été associés à diverses activités biologiques : opioïde, antihypertensive, antithrombotique, antimicrobienne, antivirale, antioxydante, insulinotropique et immunomodulatrice (Madureira et al., 2010).
Les effets des protéines de lactosérum, de leurs hydrolysats enzymatiques ou de peptides issus de ces protéines sur la modulation du système immunitaire ont été mis en évidence dans de nombreux travaux (Miyauchi et al., 1997 ; Wong et al., 1998 ; Mahmud et al., 2004 ; Mercier et al., 2004 ; Prioux et al., 2004 ; Biziulevicius et al., 2006 ; Saint-Sauveur et al., 2008, 2009a ; Saint-Sauveur, 2009b ; Jacquot et al., 2010 ; Hébert-Leclerc, 2011). Par exemple, Saint-Sauveur et al. (2008) ont démontré que certaines fractions peptidiques, isolées par focalisation isoélectrique d’un hydrolysat enzymatique d’isolat de protéines de lactosérum (IPL), stimulaient la prolifération de splénocytes murins de même que la sécrétion de cytokines de type Th1. D’autres travaux ont démontré que ces fractions peptidiques permettaient d’accroître les niveaux d’IgA dans le sérum sanguin chez des souris infectées ou non par Escherichia coli O157:H7 (Saint-Sauveur et al., 2009a). Les peptides potentiellement responsables des effets observés ont été identifiés et caractérisés par spectrométrie de masse, mettant en évidence différents modes d’actions (Saint-Sauveur, 2009b). En outre, les fragments β-LG f9-14 et β-LG f96-99 stimulent la sécrétion de cytokines antiinflammatoires (réponse de type Th2) tandis que le peptide β-LG f146-148 favoriserait la sécrétion de
2
cytokines pro-inflammatoires (réponse de type Th1) (Saint-Sauveur, 2009b). Enfin, une étude in vivo chez des souris saines a montré que l’ingestion orale du peptide β-LG f96-99 sous forme purifiée induisait une augmentation significative des quantités d’IgA dans les fèces, de même qu’un accroissement de la production d’IL-4 dans une culture de splénocytes (Hébert-Leclerc, 2011). Ces travaux suggèrent donc que le peptide β-LG f96-99 a un effet stimulateur sur la réponse immune adaptative. Toutefois, ces résultats ont été obtenus à partir d’un peptide de synthèse et des travaux devaient donc être réalisés afin de valider les effets immunomodulateurs de ce peptide dans des mélanges complexes, ces derniers offrant un meilleur potentiel commercial à titre d’ingrédient nutraceutique.
Le présent travail de recherche visait donc à démontrer que l’ingestion d’un hydrolysat enzymatique de protéines de lactosérum, contenant la séquence β-LG f96-99, permettrait d’accroître les effets immunomodulateurs associés à la réponse immune adaptative et ce, dans un modèle animal de souris saines.
3
CHAPITRE I :
5
1.
Structure et fonctions biologiques des protéines du
lactosérum
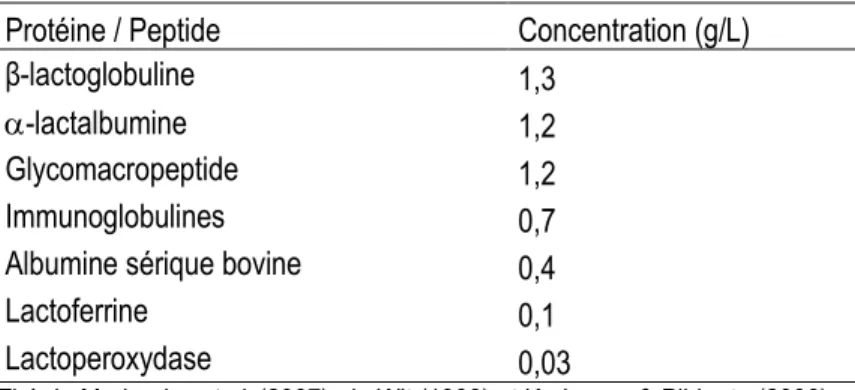
Les protéines du lactosérum représentent seulement 20% des protéines du lait (Madureira et al., 2010). Le Tableau 1 présente la composition en protéines et peptides du lactosérum. Les principales protéines sont la β-lactoglobuline (β-LG), l'-lactalbumine (-LA), l'albumine sérique bovine (BSA) et les immunoglobulines (Igs). La β-LG et l'-LA représentent 70 à 80% des protéines du lactosérum (Chatterton et al., 2006). Ce sont donc les protéines les plus importantes. On retrouve des protéines moins abondantes comme la lactoferrine, des enzymes, des facteurs de croissance ainsi que des peptides issus de la dégradation enzymatique des caséines tels le glycomacropeptide et les protéose-peptones. Il faut cependant noter que les concentrations des protéines du lactosérum peuvent varier selon la source laitière (bovine, caprine, ovine), l’alimentation de l’animal, le type de fabrication fromagère (lactosérum doux ou acide) et la qualité de la transformation du lait en fromage (Madureira et al., 2007).
Tableau 1 :
Teneur en protéines et peptides du lactosérum bovin.
Protéine / Peptide Concentration (g/L)
β-lactoglobuline 1,3
-lactalbumine 1,2
Glycomacropeptide 1,2
Immunoglobulines 0,7
Albumine sérique bovine 0,4
Lactoferrine 0,1
Lactoperoxydase 0,03
Tiré de Madureira et al. (2007), de Wit (1998) et Korhonen & Pihlanto (2006).
1.1. β-lactoglobuline
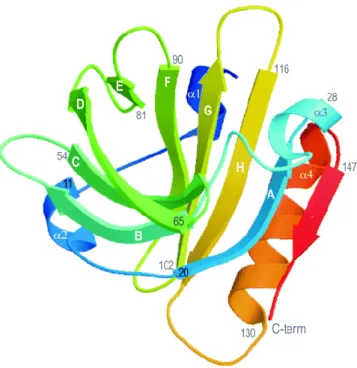
La β-LG est absente dans le lait humain (Chatterton et al., 2006). Dans le lait bovin, elle représente environ 58% des protéines du lactosérum, ce qui en fait la protéine dominante (Madureira et al., 2007). Dans le lait, la β-LG est présente sous forme de dimères identiques. Un monomère est constitué d’une chaîne de 162 résidus d’acides aminés et sa masse molaire est de 18,6 kDa. Ce monomère est stabilisé par deux ponts disulfures intra-chaînes (Cys 66–Cys 160 et Cys 106–Cys 119). Un groupement thiol libre est positionné sur le résidu 121 (Sakurai et al., 2009) et ce groupement permet de stabiliser la structure tertiaire de la β-LG grâce à des liaisons hydrogène (Burova et al., 1998a ; 1998b). La structure secondaire de la β-LG est majoritairement constituée de feuillets β. On retrouve une hélice α à trois tours à l'extrémité C-terminale, suivie de huit feuillets β anti-parallèles (A à G) formant un calice hydrophobe au centre de la molécule
6
(Figure 1). Un neuvième feuillet β (I) est présent en position C-terminale de la molécule, lequel est impliqué dans la formation des dimères (Kontopidis et al., 2004). La β-LG possède plusieurs variants génétiques dont le plus commun est le variant A (Madureira et al., 2007).
Figure 1 :
Structure 3D d’un monomère du variant A de la β-lactoglobuline (Oliveira et al.,
2003).
La structure tridimentionnelle de la β-LG est proche de celle des lipocalines. Cela lui confère la capacité de se lier à de petits ligands hydrophobes et lui donne un rôle potentiel de transporteur de molécules (Sawyer & Kontopidis, 2000 ; Jameson et al., 2002). Les fonctions biologiques de la β-LG ont surtout été attribuées à des peptides issus de son hydrolyse enzymatique. Les propriétés répertoriées jusqu’à ce jour sont : inhibition de l'enzyme de conversion de l'angiotensine (ACE), activité antibactérienne, antivirale, opioïde, anti-cancérigène, inhibition de l'adhésion de pathogènes et activité hypocholestérolémiante (Chatterton et al., 2006 ; Hernández-Ledesma et al., 2008).
1.2. α-lactalbumine
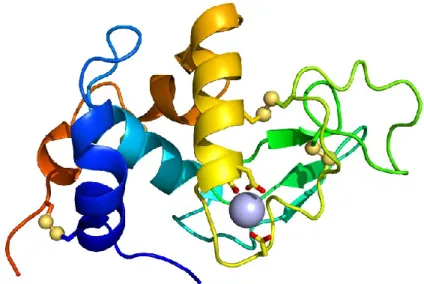
L’-LA est la deuxième protéine en importance dans le lactosérum. Elle représente 20% des protéines totales (Madureira et al., 2007). Elle est composée de 123 résidus d’acides aminés et sa masse molaire est de 14,1 kDa. La structure secondaire est composée d’un domaine composé de quatre hélices α et d’un domaine en feuillet β (Figure 2) (Pike et al., 1996). Sa structure globulaire compacte est stabilisée par quatre ponts disulfures (Edwards et al., 2009). Une boucle, présente entre les deux domaines, permet de stabiliser la structure native de la protéine et on y retrouve un site de liaison du calcium de haute affinité
7 (Kuwajima et al., 1986). Trois variants génétiques de l’-LA ont été identifiés, soient les variants A, B et C (Fox, 1989).
Figure 2 :
Structure 3D de l’α-lactalbumine (tiré de :
http://www.intechopen.com/books/milk-protein/
).
L’-LA est une métalloprotéine pouvant fixer le calcium, mais aussi le zinc et d’autres ions métalliques (Permyakov & Berliner, 2000). Elle participe, à titre de coenzyme, à la biosynthèse du lactose (de Wit, 1998). Sa structure montre des similarités avec le lysozyme, mais l’-LA ne possède pas de propriétés bactéricides (Jouan, 2002). Néanmoins, elle possède de nombreuses propriétés biologiques associées aux peptides libérés lors de son hydrolyse enzymatique. On compte parmi ses propriétés : inhibition de l'ACE, activité anti-cancérigène, antimicrobienne, opioïde, anti-stress, amélioration des capacités cognitives et amélioration du sommeil (Chatterton et al., 2006).
1.3. Glycomacropeptide
Le glycomacropeptide (GMP), ou caséinomacropeptide, est un peptide et représente environ 20% des protéines du lactosérum. Il s’agit du fragment 106-109 de la κ-caséine. Il contient 64 résidus d’acides aminés et a un poids moléculaire d’environ 8 kDa. Il est libéré par hydrolyse des caséines κ lors de la fabrication du fromage (Jelen, 2004). Le GMP possède la capacité de se lier aux toxines du choléra et aux entérotoxines d’E. coli, de réduire l’adhésion des bactéries et des virus de même que leur colonisation, d’inhiber la production des sécrétions gastriques et de réguler la pression sanguine (Thomä-Worringer et al., 2006).
8
1.4. Immunoglobulines
Les immunoglobulines (Igs) représentent 10% du total des protéines du lactosérum bovin. La structure de base des Igs est constituée de 2 chaînes lourdes de 53 kDa chacune et de 2 chaînes légères identiques de 23 kDa qui sont liées par des ponts disulfures. La masse molaire totale est supérieure à 150 kDa. Les sites de fixation des antigènes sont constitués des parties N-terminales d’une chaîne lourde et d’une chaîne légère. Le lait bovin contient majoritairement 3 classes d’immunoglobulines : les IgG, IgM et IgA. Les IgG1 constituent 75% des immunoglobulines du lactosérum.
Les fonctions reconnues des IgG sont des fonctions d’opsonisation, de fixation du complément et de neutralisation de l’attachement des microorganismes ou toxines à leurs cibles. Les IgM ont sensiblement les mêmes fonctions mis à part l’opsonisation. Dans le cas des IgA, elles neutralisent les toxines virales et bactériennes, induisent une agglutination des antigènes et inhibent l’adhésion des bactéries pathogènes aux cellules épithéliales de la muqueuse intestinale. Les IgA sont résistantes à l’action protéolytique des enzymes digestives (Korhonen et al., 2000).
1.5. Albumine sérique bovine
L’albumine sérique bovine (BSA) représente 8% des protéines totales du lactosérum (Farrell et al., 2004). Elle est également présente dans le sérum sanguin. Elle contient 582 résidus d’acides aminés pour un poids moléculaire de 66 kDa. Elle présente une homologie de 76% avec l’albumine sérique humaine.
La BSA peut se lier aux acides gras libres, à d’autres lipides et aux composés aromatiques. Elle participe ainsi à la synthèse des lipides. Elle possède des propriétés anti-oxydantes et anti-cancérigènes (Madureira et al., 2007).
1.6. Lactoferrine
La lactoferrine (LF) représente environ 1% des protéines du lactosérum bovin. Il s’agit d’une protéine constituée d’une chaîne polypeptidique de 691 résidus d’acides aminés. Son poids moléculaire est de 80 kDa (Legrand et al., 2008). La LF est une glycoprotéine globulaire faisant partie des transferrines. Elle présente donc la capacité de lier les atomes de fer. Elle est présente dans la plupart des fluides corporels comme le lait, les larmes, la salive et les mucus (Farrell et al., 2004).
Les propriétés biologiques de la LF sont vastes, incluant des activités antimicrobiennes contre les bactéries, virus, moissisures et parasites, ainsi que des activités anti-cancérigènes et anti-inflammatoires. Cela est dû à sa capacité à se lier tant aux cellules hôtes qu’aux cellules pathogènes (Legrand et al., 2008).
9
1.7. Lactoperoxydase
La quantité de lactoperoxydase (LP) dans le lactosérum est inférieure à 1% (Madureira et al., 2007). Sa chaîne polypeptidique contient 612 résidus d’acides aminés et sa masse molaire est de 78 kDa. Elle contient un groupement hème lié à son centre catalytique et sa conformation est stabilisée par un ion calcium (Boots & Floris, 2006).
La LP est surtout utilisée dans les procédés de conservation en industrie agroalimentaire. Elle possède en effet un pouvoir antimicrobien induit par les produits de la catalyse du thiocyanate et du peroxyde d’hydrogène par cette même protéine (Kennedy et al., 2000).
10
2.
Système immunitaire
L’organisme met en place des systèmes de défense complexes afin de se protéger des différents pathogènes présents dans l’environnement. Les pathogènes doivent d’abord affronter des barrières physiques telles que la peau et les muqueuses. L’organisme se protège aussi grâce à diverses sécrétions (sueur, larmes, salive, etc.) qui contiennent des composés antimicrobiens. La flore commensale, c’est-à-dire la flore normale des organes tels que le tube digestif, entre en compétition avec les pathogènes en empêchant leur fixation au niveau du site visé.
Lorsque ces défenses sont insuffisantes, les pathogènes peuvent être détruits par le système immunitaire. Il existe deux catégories de réponse : l’immunité innée ou non spécifique et l’immunité spécifique ou adaptative. L’immunité innée est la première ligne de défense mise en place lors de l’infection par un pathogène. Sa réponse est rapide, mais il n’y a pas d’amélioration après des contacts répétés avec le pathogène. L’immunité spécifique, quant à elle, va réagir rapidement lors de contacts avec des antigènes déjà rencontrés. Elle est donc plus lente à se développer, mais elle permet une réponse ciblée. Ces deux systèmes travaillent conjointement pour protéger l’organisme.
2.1. Immunité innée
L’immunité innée est non spécifique et donc polyvalente. Présente dès la naissance, sa réponse est rapide dès le contact avec l’agent pathogène quel qu’il soit : virus, bactérie ou parasite. Son mode d’action est toujours similaire ; il est basé sur la reconnaissance du soi et du non-soi.
Les récepteurs PRRs (Pattern Recognition Receptors) sont présents sur les macrophages, les cellules dendritiques, les cellules NK (Natural Killer), les polynucléaires, les mastocytes et certaines cellules épithéliales. Ces PRRs reconnaissent des motifs moléculaires appelés PAMPs (Pathogen-Associated Molecular Patterns) qui sont associés aux pathogènes.
Une fois l’interaction PRR-PAMP effectuée, un signal est émis et enclenche la sécrétion de cytokines et de facteurs solubles induisant la réponse inflammatoire. Ces facteurs solubles permettent de recruter et activer des cellules du système immunitaire. La sécrétion de ces molécules induit une réponse inflammatoire aigüe, laquelle est régulée par les cytokines anti-inflammatoires. Les chimiokines permettent d’attirer les phagocytes par chimiotactisme. Ces derniers vont ingérer le pathogène par endocytose pour le détruire (Figure 3). Ces phagocytes peuvent être des macrophages, des cellules dendritiques ou des polynucléaires.
11
Figure 3 :
La réponse immunitaire innée. Certains leucocytes, les granulocytes dans le sang
et les macrophages dans les tissus, phagocytent et digèrent les pathogènes et
rejettent ensuite leurs débris.
(tiré de :
http://crdp.ac-amiens.fr/enviro/air/air_maj3_detail_p1_1.htm
).
2.2. Immunité spécifique
L’immunité spécifique a besoin de plus de temps que l’immunité innée pour répondre à l’infection par un pathogène. Elle est caractérisée par des réactions spécifiques à un antigène (Ag) et donc par la diversité de ses réponses, mais aussi par la mémoire immunologique. Un premier contact avec l’antigène nécessite plusieurs jours pour entraîner une réponse tandis qu’au deuxième contact, la réponse sera plus rapide et plus importante.
L’immunité adaptative fait intervenir les lymphocytes qui sont porteurs de récepteurs leur permettant de reconnaître certains Ag spécifiques. Cela permet une réponse spécifique à l’Ag. La reconnaissance d’un motif moléculaire pathogène par un lymphocyte entraîne l’expansion clonale, c’est-à-dire la prolifération des lymphocytes porteurs des récepteurs spécifiques de l’Ag. Ainsi, des clones de ces lymphocytes spécifiques sont produits pour lutter contre l’Ag.
On distingue les lymphocytes B (LB) et les lymphocytes T (LT). Ils sont produits dans la moelle osseuse et leur maturation se fait dans la moelle osseuse et dans le thymus, respectivement. On compte deux sous-populations de LT. Les LT cytotoxiques (CTL) expriment des marqueurs de surface CD8 et détruisent les cellules infectées par un virus et les cellules tumorales. Les LT auxiliaires ou « helper » (Th) expriment le CD4 et aident les cellules B dans leur croissance et leur différenciation. Les LT reconnaissent l’antigène que lorsqu’il a été capturé, transformé et présenté par des cellules spécialisées que l’on nomme cellules présentatrices de l’antigène (CPA). Parmi ces cellules, on compte les cellules dendritiques et les macrophages. Ces cellules expriment les molécules du complexe majeur d’histocompatibilité (CMH II) à leur surface. Les CPA capturent l’antigène par phagocytose et le digère. Les peptides générés suite à cette digestion s’installent dans la niche peptidique des molécules du CMH afin d’être présentés à la surface de la cellule. C’est alors que les LT sont capables de reconnaître les peptides antigéniques. La présentation de l’Ag aux LT naïfs entraîne l’émission de différents signaux qui vont induire leur différenciation (Figure 4).
12
Les LT activés vont alors aider les LB à produire leurs anticorps.
L’immunité spécifique comprend deux types de mécanismes, soient l’immunité humorale et l’immunité cellulaire, lesquels seront décrits ci-après.
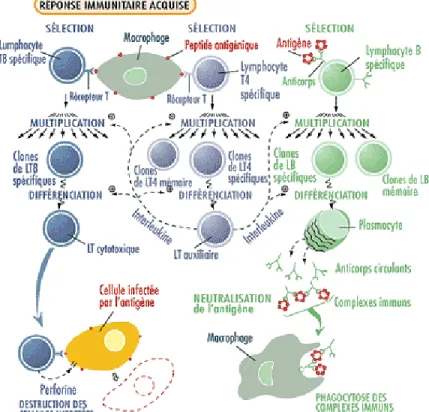
Figure 4 :
La réponse immunitaire acquise. Les macrophages présentent à leur surface des
fragments peptidiques du pathogène endocyté précédemment. Ces peptides sont
reconnus par les lymphocytes T, dont les LT4 et LT8. Les LT4 et LT8 spécifiques
de l’antigène sont sélectionnés et prolifèrent. Les LT4 spécifiques se différencient
en LT auxiliaires ou helper et sécrétent des interleukines qui vont recruter d’autres
lymphocytes tels que les LT cytotoxiques (CTL). Ces CTL produisent de la
perforine qui attaque les membranes des cellules infectées par l’antigène. D’autre
part, les lymphocytes B spécifiques reconnaissent directement l’antigène et se
multiplient. Certains se différencient en plasmocytes qui vont libérer des anticorps
circulants. Cette différenciation est stimulée par l’interleukine. Les anticorps
produits se lient à l’antigène pour former des complexes immuns qui seront
reconnus et phagocytés par les macrophages
13 2.2.1. Immunité humorale
L’immunité humorale peut être transférée d’un individu immunisé à un individu non immunisé grâce aux anticorps (Ac) sériques. Elle est activée par l'interaction des lymphocytes B avec un antigène spécifique suivie de leur prolifération et différenciation en plasmocytes, puis de la sécrétion d’Ac. Les plasmocytes vont sécréter différents types d’immunoglobulines (Igs) : les IgM, IgG, IgE, IgA et IgD. Cette sécrétion est dépendante des signaux qu’auront reçu les LB de la part des LT.
Les IgM sont les premiers anticorps produits par les LB. Lorsqu’ils sont présents à la surface de ces molécules, ils agissent comme récepteur pour les Ag. Ils sont également présents dans le sang sous forme de molécule soluble. Les IgM peuvent se lier avec une très grande efficacité aux antigènes et ce, jusqu’à ce que les IgG aient été produits en quantité suffisante.
Les IgG sont le type d’immunoglobulines le plus abondant dans le sang. Elles ont un rôle d’opsonines et facilitent ainsi la reconnaissance des antigènes par les phagocytes. Ce sont les seules Igs à pouvoir traverser la barrière placentaire et fournir au fœtus l’immunité humorale passive.
Les IgE jouent un rôle significatif dans le renforcement de l’inflammation aigüe, la protection contre les parasites et la réaction d’hypersensibilité de type I. Elles se lient aux basophiles, mastocytes et éosinophiles en présence d’antigène.
Les IgA sont synthétisées au niveau des glandes mammaires et salivaires, mais aussi au niveau des tractus respiratoires, gastro-intestinaux et génito-urinaires. Il faut noter que plus de 80% des cellules productrices d’immunoglobulines sont situés dans les intestins, qui de ce fait constituent le principal organe effecteur de l’immunité humorale. Les IgA sont par ailleurs les anticorps les plus abondants dans les muqueuses. Leur rôle est donc primordial au niveau intestinal. A ce niveau, les lymphocytes B IgA+ vont produire des IgA sécrétoires (sIgA). La synthèse se fait dans les plaques de Peyer, les follicules lymphoïdes isolés et la lamina propria. Les sIgA ont un rôle important dans la sélection et le maintien de la flore normale. Ce rôle dans l’homéostasie de la flore est essentiel pour prévenir une stimulation excessive du système immunitaire. Dans les muqueuses, les sIgA vont prévenir l’interaction des antigènes avec l’épithélium et faciliter leur élimination grâce à des mouvements péristaltiques et au système muco-ciliaire. Cela limite ainsi la pénétration des bactéries sous la couche épithéliale intestinale. Ce mécanisme est nommé exclusion immune. Aussi, dans la lamina propria, les IgA polymériques vont se lier aux antigènes ayant franchi la barrière intestinale, traverser la couche épithéliale par transcytose et ré-excréter les antigènes dans la lumière intestinale (Corthésy et al., 2002 ; Suzuki & Fagarasan, 2009 ; Brandtzaeg, 2010).
14
Les IgD sont utilisées comme récepteurs pour les antigènes par les LB. Elles agissent en collaboration avec les IgM.
Les anticorps n’éliminent pas directement l’antigène. Cette destruction se fait via différents mécanismes comme l’opsonisation, la neutralisation, l’agglutination et l’activation du complément. Ces mécanismes favorisent la phagocytose des antigènes, l’inhibition de l’activité biologique de l’antigène et des toxines et la dégradation de la membrane du pathogène.
L’immunité humorale met donc en jeu les lymphocytes B et la production d’immunoglobulines pour reconnaître et éliminer les pathogènes par une réponse spécifique. L’activation de LB mémoire va permettre une réponse immunitaire secondaire.
2.2.2. Immunité à médiation cellulaire
L’immunité cellulaire peut être transférée d’un individu immunisé à un individu non immunisé grâce aux lymphocytes T de l’individu immunisé. Elle est induite par les lymphocytes T auxilliaires (Th) et les lymphocytes T cytotoxiques (CTLs) activés après contact avec l’antigène. L’immunité cellulaire intervient dans la lutte contre les pathogènes intracellulaires (virus et certaines bactéries) se trouvant soit dans des cellules hôtes, soit dans des phagocytes les ayant endocytés et présentés. Ce type d’immunité joue un rôle dans les réactions de rejet de greffe, d’hypersensibilité retardée et de destruction des cellules cancéreuses.
Les Th (CD4+) reconnaissent les antigènes liés au CMH de type II présent sur les macrophages, les cellules dendritiques et les LB. Dans le cas des CTL (CD8+), ils reconnaissent les peptides liés aux molécules du CMH de type I. La reconnaissance des peptides de l’antigène déclenche un signal pour la transcription des gènes codant pour les cytokines et leurs récepteurs.
Les CTL effectuent une cytolyse grâce aux mécanismes de nécrose et d’apoptose. La nécrose est effectuée par les perforines et granzymes sécrétées par les CTL. L’apoptose, ou signal de mort programmée, est déclenchée suite à la sécrétion de Fas-ligand qui se lie au Fas de la cellule infectée.
Les macrophages et les cellules NK sont également impliqués dans l’immunité cellulaire. Certains LT naïfs CD4 se différencient en Th1 après contact avec les CPA. En présence d’un signal co-stimulateur, les Th1 sécrètent des IFN-γ qui vont activer les macrophages. Ils sécrètent également de l’IL-2. L’IFN-γ et l’IL-2 activent alors les cellules NK qui vont-elles même sécréter de l’IFN-γ pour activer les macrophages. Les macrophages ainsi activés sécrètent des composés permettant la destruction des pathogènes dans les phagosomes.
15 Certaines sous-populations de Th sont impliquées dans l’hypersensibilité retardée. Au premier contact avec l’antigène, certains Th sont alors sensibilisés à cet antigène spécifique. Après la deuxième exposition, les Th1 activent les macrophages ce qui cause la production de cytokines inflammatoires. Des cellules inflammatoires non spécifiques vont aussi être recrutées. Les Th2 vont sécréter de l’IL-4 et IL-5 et activer les éosinophiles.
2.3. Rôle des cytokines dans la réponse immunitaire
Les lymphocytes Th ont un rôle clé dans la défense immunitaire. En effet, tout comme les lymphocytes T (CD8), les cellules NK, les lymphocytes B et les cellules non lymphoïdes, ils sécrètent des cytokines pouvant agir sur les cellules les ayant sécrétées elles-mêmes ainsi que sur d’autres cellules immunitaires afin de moduler leurs réponses (Kindt et al., 2008). Les cytokines sont des molécules de faible poids moléculaire. Elles peuvent induire la croissance, la différenciation, le chimiotactisme et l’activation et/ou l’augmentation de la cytotoxicité. Certaines cytokines peuvent avoir des effets similaires et une cytokine peut être produite par différents groupes de cellules. Elles jouent donc un rôle clé dans la communication entre les différentes cellules immunitaires dans le but de réguler la réponse.
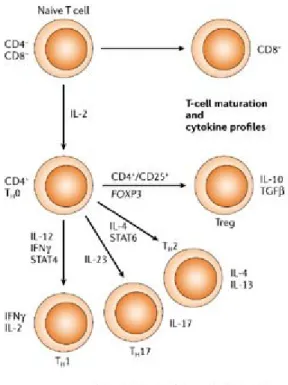
Après contact avec l’antigène, les lymphocytes T CD4+ naïfs vont être activés et vont se différencier, entre autres, en cellules Th. Ces cellules sont classées en trois catégories principales: Th1, Th2 et Th17. Il existe aussi un groupe de LT CD4+ qui ont une capacité de régulation des réponses immunes. Ces LT régulateurs (Treg) représentent un groupe hétérogène de cellules. Ces lymphocytes expriment différents facteurs de transcription et transcrivent des gènes différents (Zhu & Paul, 2010) (Figure 5).
Les cellules Th1 sont caractérisées par leur production d’IFN-γ, mais elles sécrètent aussi de l’IL-2, IL-3 et du TNF-α. Elles sont capables d’activer et recruter les cellules T et les macrophages sur le site d’infection. Elles sécrètent aussi le GM-CSF (Granulocyte Macrophage Colony Stimulating Factor) et certaines chémokines qui vont induire la différenciation des Th1 en macrophages. L’IL-3 augmente la production et la libération de monocytes par la moelle osseuse. Les cytokines des Th1 sont généralement associées à une inflammation anormalement importante. La différenciation en Th1 est favorisée par l’IL-12 et l’IFN-γ.
Les cellules Th2 sécrètent principalement de l’IL-4, mais également de l’IL-5, IL-6 et IL-10. Elles encouragent la prolifération des lymphocytes B et la production d’anticorps, notamment d’IgA et IgE (Zhu et al., 2010). L’IL-4 induit la différenciation des cellules Th vers le Th2. A partir d’un certain seuil de présence, la voie Th2 est préférée à la voie Th1 (Mosmann & Subash, 1996). Les Th2 sont liées aux réactions allergiques. Il faut noter que les cytokines des groupes Th1 et Th2 ont des effets antagonistes.
16
Les cellules Th17 produisent les cytokines IL-17A et F ainsi que les IL-21 et IL-22. Elles jouent un rôle important dans la protection contre l’entrée des pathogènes dans le tractus gastro-intestinal et dans l’inflammation. Le TGF-β et l’IL-23 induisent la différenciation des Th en Th17.
Les cellules Treg sécrètent de manière importante le TGF-β et l’IL-10. Elles sont essentielles dans le maintien de la tolérance immunologique et l’inhibition de réponses immunitaires excessives.
Figure 5 :
Différenciation des cellules T. Chaque sous-population de Th possède un patron
de production de cytokine caractéristique et leur différentiation est déterminée par
le profil cytokinique de l’environnement (Korzenik & Podolsky, 2006).
La différenciation des Th est donc influencée par les cytokines présentes dans l’environnement. Chaque cytokine caractéristique de la catégorie de Th qu’elle représente va exercer un rétrocontrôle positif sur la sous-population qui la sécrète et va exercer un rétrocontrôle négatif sur l’autre sous-population. Ces cytokines vont aussi permettre d’atteindre un équilibre entre les différentes populations de Th. On parle d’homéostasie immunitaire (Figure 6) et un déséquilibre trop important pourrait causer certaines maladies.
17
Figure 6 :
Action des cytokines dans la différenciation et la conversion des Th. Grâce à l’effet
des cytokines, les sous-populations de Th s’équilibrent jusqu’à atteindre
l’homéostasie immunitaire. Dans certaines situations, une sous-population peut se
convertir en une autre (pointillés verts) afin de favoriser la réponse immunitaire
désirée (Wan & Flavell, 2009).
Le profil cytokinique de l’environnement influence donc la différenciation des cellules Th. Les cytokines représentent ainsi des marqueurs clés de la réponse immunitaire.
2.3.1. Production d’IgA mucosales
Les IgA peuvent être produites dans les muqueuses par le phénomène de commutation de classe. On parle de commutation de classe ou class-switch recombination (CSR) lorsque l’exon Cµ d’un IgH est remplacé par un autre exon CH, ce qui permet de créer des IgG, IgE et IgA. Ce mécanisme est habituellement sous le contrôle de cytokines produites par les LT (Cerruti & Rescigno, 2008 ; Cerruti, 2008). Ainsi, le TGF-β (facteur de croissance de transformation β), produit par les LT présents dans les plaques de Peyer est l’un des facteurs les plus importants dans le mécanisme de CSR conduisant à la production d’IgA dans l’intestin. D’autres molécules comme l’AID (activation-induced cytidine deaminase) sont requises pour le CSR et l’hypermutation somatique (HMS). L’HMS apparaît lorsqu’une mutation ponctuelle est présente dans la région variable des exons, améliorant leur affinité pour l’antigène. La cytokine TSLP (lymphopoïétine stromale thymique) active les cellules dendritiques et induit ainsi la production de cytokines telles que TGF-β1 qui induisent la production d’IgA par les cellules T CD4+.
18
Toutefois, plusieurs études ont montré que la production d’IgA pouvait également être indépendante de l’action des LT. Ainsi le BAFF (facteur d’activation des cellules B) et APRIL (ligand induisant la prolifération), produits principalement par les cellules dendritiques, induisent la CSR chez les LB.
2.4. Méthodes d’analyses immunologiques
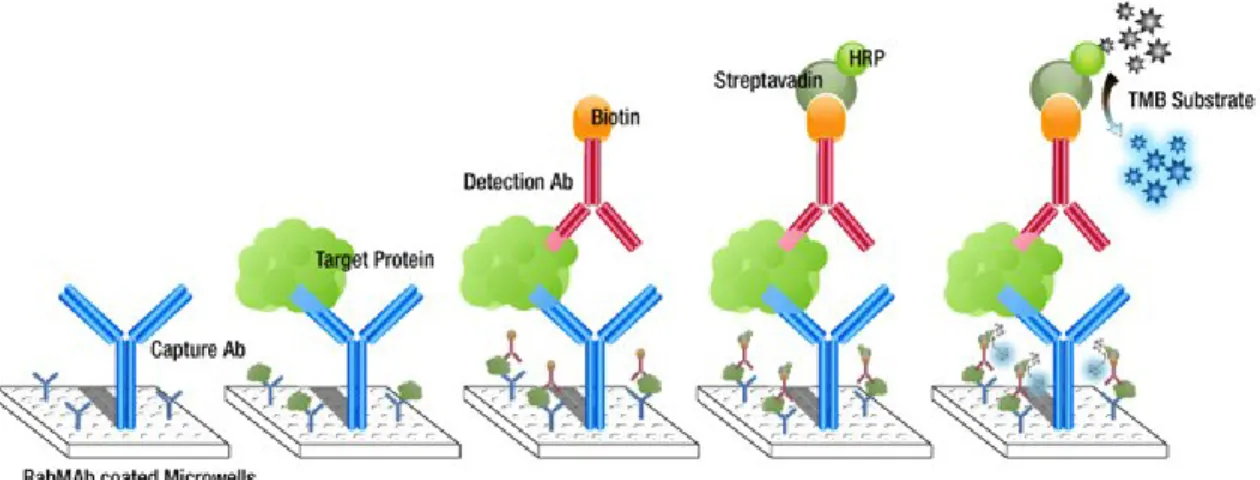
2.4.1. Méthode ELISALa méthode ELISA (Enzyme-Linked Immunosorbent Assay) permet de déterminer la présence et la concentration d’un antigène spécifique ou d’un anticorps spécifique à un antigène. C’est une méthode simple, rapide et sensible. Le DAS ELISA ou Double Antibody Sandwich ELISA sera décrit (Figure 7). Deux anticorps spécifiques reconnaissant des épitopes différents de l’antigène sont utilisés. La première étape consiste à fixer l’anticorps de capture sur le support, c’est-à-dire un puits de microtitration. L’échantillon possédant l’antigène est ensuite ajouté au puits. Il est ainsi fixé par l’anticorps de capture. Un anticorps de détection conjugué à la biotine est déposé et se fixe à l’antigène recherché. L’enzyme streptavidine-HRP (horseradish peroxydase), qui présente une forte affinité pour la biotine, est ensuite ajoutée au puits. Entre chaque étape, un lavage du puits est effectué afin d’éliminer tout composé non fixé. Une solution révélatrice de TMB (tetramethylbenzidine), substrat de la peroxydase, est enfin déposée. Le produit de réaction est soluble et coloré. L’intensité de la coloration peut être quantifiée par spectrophotométrie et la concentration peut être déterminée grâce à une courbe étalon. Dans le cadre de notre étude, la méthode ELISA a été utilisée pour quantifier les IgA sériques et fécaux.
19 2.4.2. Immunofluorescence de coupes histologiques
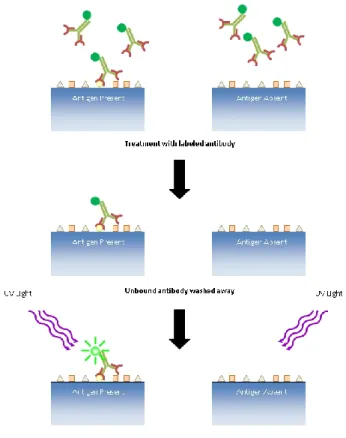
Les techniques d’immunofluorescence reposent sur la visualisation d’un antigène dans des cellules ou des coupes de tissus en le liant à un anticorps spécifique, lequel est conjugué à un colorant fluorescent tel que l’isothiocyanate de fluorescéine (FITC). Ces colorants ne modifient pas la spécificité des anticorps auxquels ils sont liés. La fluorescence peut être quantifiée grâce à différentes techniques. Il existe deux méthodes principales d’immunofluorescence : l’immunofluorescence directe et indirecte. L’immunofluorescence directe est moins fréquemment utilisée, mais elle présente l’avantage d’avoir des temps de coloration des échantillons plus courts et des procédures de marquage double et triple plus simples (Robinson et al., 2010).
On parle d’immunofluorescence directe lorsque l’anticorps lui-même est marqué par le colorant fluorescent et appliqué directement sur les cellules étudiées (Figure 8). Les échantillons colorés sont ensuite examinés par microscopie à fluorescence. La lumière émise par le complexe antigène-anticorps peut être visualisée et quantifiée sous une certaine longueur d’onde. L’image obtenue montre ainsi les différentes régions où les anticorps marqués se sont liés aux antigènes. Il est alors possible d’étudier plusieurs anticorps en même temps et ce, en leur associant des molécules fluorescentes différentes. Dans notre étude, cette technique a été utilisée afin de déterminer l’expression quantitative et qualitative des IgA dans les muqueuses intestinales (Audigié et al., 1992 ; Robinson et al., 2010).
20
Figure 8 :
Principe de l'immunofluorescence directe (tiré de :
http://www.di.uq.edu.au/directif
).
21 2.4.3. Expression des gènes par qPCR
La qPCR (PCR quantitative en temps réel) est actuellement la méthode la plus sensible pour détecter et quantifier les ARN messagers (ARNm) d’un organe, tissu ou cellule. Ils sont en effet présents en trop faible quantité pour pouvoir être détectés par Northern Blot. D’autant plus que cette technique ne permet pas de quantification précise de l’expression génique. La qPCR permet un suivi en temps réel car des sondes fluorescentes tels que SYBR Green sont utilisées. Cette sonde se fixe à l’ADN double brin et la fluorescence émise est quantifiée à chaque cycle. Plus l’ADN est amplifié, plus le signal fluorescent sera important. Un seuil d’amplification est défini dans la phase exponentielle de la réaction. Il correspond à une augmentation significative de la fluorescence et permet d’obtenir un numéro de cycle seuil ou Ct (SABiosciences, 2014).
Les ARN totaux sont dans un premier temps extraits des tissus étudiés après lyse et homogénéisation. Les ARN sont soumis à une transcription inverse et l’ADN complémentaire (ANDc) est ainsi synthétisé. Une PCR quantitative en temps réel (qPCR) est effectuée sur l’ADNc en utilisant des amorces spécifiques aux gènes recherchés. Les conditions de qPCR sont les mêmes pour tous les gènes, soit A) 95°C, 10 minutes, 1 fois B) 95°C, 15 secondes et ensuite 60°C, 1 minute, 42 fois, et C) protocole de dissociation pour s’assurer de l’absence de dimères d’amorces.
Le niveau d’expression relatif des gènes est déterminé par la méthode comparative du delta-delta Ct (ΔΔCt) : les valeurs de Ct du gène d’intérêt sont normalisées grâce à un contrôle endogène puis comparées à celles d’un gène de référence.
∆ ∆ Ct = ∆ Ct échantillon - ∆ Ct réference
Puisque les cytokines sont synthétisées suite à la transcription de certains gènes, la technique PCR en temps réel a donc été utilisée dans le cadre de notre étude pour mesurer leur expression au niveau des muqueuses intestinales.
22
3.
Activités immunomodulantes des peptides issus de
l’hydrolyse des protéines du lactosérum
3.1
Hydrolysats enzymatiques et fractions peptidiques issus des protéines du
lactosérum
Plusieurs travaux ont étudié les effets immunomodulateurs d’hydrolysats enzymatiques de protéines du lactosérum lors d’études in vitro ou in vivo. La majorité des hydrolysats étudiés ont été préparés à l’aide d’enzymes gastro-intestinales telles la pepsine, trypsine ou chymotrypsine. Dans certains de ces travaux, les hydrolysats ont été séparés en fractions peptidiques par focalisation isoélectrique, une méthode permettant la séparation des peptides sur la base de leur point isoélectrique. Les effets immunomodulateurs de ces fractions peptidiques ont également été mesurés en vue de déterminer si certaines caractéristiques des peptides pouvaient être associées aux effets observés. De façon générale, les variables mesurées lors de ces études étaient : la prolifération cellulaire, la sécrétion de cytokines et/ou d’immunoglobulines.
3.1.1 Etudes in vitro
Saint-Sauveur et al. (2008) et Mercier et al. (2004) ont étudié les effets immunomodulateurs d’hydrolysats enzymatiques (trypsine+chymotrypsine) issus d’isolats de protéines de lactosérum (IPL), fabriqués par microfiltration ou par chromatographie d’échange ionique (CEI), de même que de fractions peptidiques obtenues à partir de ces hydrolysats par focalisation isoélectrique. Les effets de ces produits ont été évalués sur des splénocytes murins en absence et en présence de concanavaline A (ConA). Ces auteurs ont montré que l’IPL microfiltré et son hydrolysat stimulaient la prolifération des splénocytes en absence et en présence de ConA. Cependant, à forte concentration et en présence de ConA, l’hydrolysat de cet IPL avait un effet inhibiteur sur la prolifération des splénocytes (Saint-Sauveur et al., 2008). Dans le cas des fractions peptidiques, elles stimulaient toutes, peu importe leur pH (acide, neutre ou basique), la prolifération des splénocytes en absence et en présence de ConA. Au niveau de la sécrétion de cytokines par les splénocytes, les auteurs ont montré que l’hydrolysat d’IPL microfiltré stimulait la production d’IFN-γ en présence de ConA, alors qu’aucun effet n’a été observé en absence de mitogène. Les fractions peptidiques ont, quant à elles, stimulé la sécrétion de cytokines de type Th1 (IL-2, IFN-γ), les plus efficaces étant les fractions acide et neutre (Saint-Sauveur et al. 2008). D’autre part, Cross & Gill (1999) ont démontré qu’un hydrolysat pepsine+pancréatine, préparé à partir d'un concentré de protéines du lactosérum (CPL) enrichi en GMP (35%), n’avait aucun effet sur la prolifération de splénocytes murins en présence de ConA ou de lipopolysaccharides (LPS), mais avait un effet inhibiteur sur la sécrétion de certaines cytokines (IL-4, IFN-γ) en présence de ConA.
23 Iskandar et al. (2013) ont étudié un isolat de protéines de lactosérum traité par hautes pressions, lequel a été hydrolysé à l’aide de la pepsine puis d’un mélange trypsine-chymotrypsine-peptidase ; l’hydrolysat ainsi obtenu a ensuite été séparé par ultrafiltration (UF) sur une membrane de 10 kDa afin d’éliminer les protéines/peptides de hautes masses moléculaires. Les auteurs ont démontré que le permeat UF, composé de peptides ayant une masse inférieure à 1 kDa, avait un effet inhibiteur sur la sécrétion d’IL-8 par des cellules épithéliales respiratoires stimulées par des lipopolysaccharides. De plus, les résultats ont montré que le traitement de pressurisation exacerbait les propriétés anti-inflammatoires de l’IPL. Une précédente étude avait également démontré qu’un IPL, aussi traité par hautes pressions puis digéré à l’aide de la pepsine suivi d’une digestion par un mélange trypsine-chymotrypsine, augmentait sa capacité à inhiber la sécrétion d’IL-8 par les cellules épithéliales intestinales (Piccolomini et al., 2012).
Dans le cas des hydrolysats enzymatiques de protéines de lactosérum, le choix des enzymes utilisées pour leur fabrication aurait donc un impact important sur la prolifération cellulaire et la sécrétion de cytokines. Néanmoins, la nature du produit hydrolysé, surtout sa composition en protéines du lactosérum, serait un autre facteur pouvant influencer les effets observés. En outre, certains travaux se sont intéressés à mesurer les effets immunomodulateurs de fractions protéiques purifiées du lactosérum et ont montré des résultats contradictoires.
Mercier et al. (2004) ont démontré que des hydrolysats trypsine+chymotrypsine de protéines purifiées du lactosérum (β-LG, α-LA, LF) n’avaient pas d’effet sur la prolifération des splénocytes murins. Prioult et al. (2004) ont toutefois démontré que des fractions peptidiques isolées d’un hydrolysat trypsine+chymotrypsine de β-LG stimulait la prolifération des splénocytes murins, mais uniquement à forte concentration. Ces auteurs ont également montré qu’un hydrolysat de β-LG, préparé à partir des protéases de Lactobacillus paracasei, n’influençait pas la prolifération des splénocytes murins ni la sécrétion des cytokines IFN-γ et IL-10 par ces cellules, alors qu’il avait un effet inhibiteur sur la production d’IL-4. Par contre, la séparation de cet hydrolysat par focalisation isoélectrique a permis d’obtenir une fraction peptidique acide ayant un effet inhibiteur sur la prolifération des splénocytes murins et sur la sécrétion d'IFN-γ et d'IL-4, alors qu’un effet stimulateur a été observé dans le cas de la sécrétion d’IL-10. Ces résultats ont donc conduit les auteurs à conclure que cette fraction acide pouvait induire une tolérance orale envers la β-LG. Aussi, Wong et al. (1998) ont démontré qu’un hydrolysat trypsique de β-LG stimulait la prolifération et la production d’IgM par les splénocytes murins. Les travaux de Mahmud et al. (2004) ont, pour leur part, montré que des hydrolysats de β-LG préparés à l’aide de différentes enzymes digestives (pepsine, trypsine, chymotrypsine ou pancréatine) stimulaient tous la prolifération des splénocytes murins.
24
Enfin, Miyauchi et al. (1997) ont démontré qu’un hydrolysat pepsique de LF stimulait la prolifération des splénocytes murins et la production d'IgM, IgG et IgA, et ce, en présence ou en absence de mitogènes. Les résultats obtenus pour les IgA ont été confirmés au niveau des plaques de Peyer. Par contre, dans la même étude, un hydrolysat trypsique de LF n’a pas permis d’observer les mêmes effets stimulateurs.
Ces travaux montrent à nouveau que l’ampleur de la stimulation des splénocytes murins et les effets sur la sécrétion de cytokines varient selon les types d’enzymes utilisées pour la fabrication des hydrolysats, de même qu’en fonction du pH des fractions peptidiques isolées à partir des hydrolysats (Saint-Sauveur et al., 2008 ; Mercier et al., 2004 ; Prioult et al., 2004 ; Mahmud et al., 2004 ; Miyauchi et al., 1997).
3.1.2. Etudes in vivo
Des travaux in vivo ont évalués les effets de l’ingestion orale d’hydrolysats de protéines du lactosérum sur le système immunitaire. Pacheco & Sgarbieri (2005) ont alimenté pendant 7 semaines des souris avec une diète composée de 20% d’un CPL hydrolysé par la pancréatine, l’alcalase ou le Protamex. Leurs travaux ont démontré un effet positif sur les taux de glutathion dans le foie des souris. Selon les auteurs, ces hydrolysats pourraient avoir un effet stimulateur sur la détoxification des réactifs intermédiaires du métabolisme oxydatif. D’autre part, il est connu que le glutathion joue un rôle primordial dans l’activation et le fonctionnement des lymphocytes B et T (Wong & Watson, 1995).
Les travaux de Shimizu et al. (2006) ont démontré que l’ingestion orale chez la souris pendant 6 semaines d’une ration composée à 50% d’un hydrolysat enzymatique de protéines de lactosérum, permettait de diminuer des lésions cutanées induites par Dermatophagoides preronyssinus de même que les taux d’E-sélectine. Incorporé à des formules lactées spécifiques, ce type d’hydrolysat pourrait donc avoir un effet bénéfique chez les nourrissons souffrant de dermatite atopique.
Saint-Sauveur et al. (2009a) ont étudié les effets de l’ingestion orale pendant 7 jours d’un hydrolysat trypsine+chymotrypsine d’IPL et de ses 3 fractions peptidiques (acide, F1 ; neutre, F2 ; basique, F3) chez des souris Balb/c saines ou infectées par E. coli O157:H7. Chez les souris saines, l’hydrolysat et les fractions peptidiques ont stimulé les niveaux sériques d’IgA. De plus, la fraction F2 (neutre) a stimulé la sécrétion d’IFN-γ dans le sang, alors que la fraction F1 (acide) l’a au contraire inhibée. Chez les souris infectées, seule la fraction F3 (basique) a permis d’accroître la production des IgA sériques en plus d’induire une augmentation de la sécrétion de TGF-β1 et ce, tant chez la souris saine que la souris infectée. Cette fraction peptidique basique (F3) pourrait donc favoriser la vigilance immunologique lors d’une infection.
Chez un modèle murin souffrant d’asthme, l’ingestion d’un extrait de protéines de lactosérum enrichi en TGF-β a permis de diminuer l’inflammation des voies aériennes, des IgE sériques ainsi que la production de
25 cytokines de type Th2, alors qu’une stimulation de la production de cellules Treg a été observée (Chen et al., 2013). Kume et al. (2012) ont administré pendant 14 jours une formule contenant des protéines de lactosérum et des produits laitiers fermentés à des souris par voie entérale, avant d’induire une hépatite par la concanavaline A. Cette diète a permis d’obtenir des concentrations en TNF-α, IL-6 et IFN-γ dans le plasma, en TNF-α et IFN-γ dans le foie et en IL-6 et IFN-γ dans la rate significativement plus faibles que pour le groupe contrôle.
Au niveau intestinal, Yasumatsuya et al. (2012) ont étudié l’effet de diètes contenant du lait écrémé, du lactosérum ou du lactosérum+lait écrémé chez des veaux noirs japonais durant 60 jours à compter du 3ème jour après la naissance du veau. La diète comprenant des protéines de lactosérum a permis de stimuler, de manière significative, la production d’IgA fécales après 14 jours, ce qui serait dû à une stimulation des IgA au niveau des muqueuses intestinales. Chez le rat souffrant de désordres du petit intestin, Kume et al. (2014) ont démontré que l’ingestion orale pendant 14 jours d’une diète contenant des peptides de lactosérum et des produits laitiers fermentés avait un effet protecteur. Les auteurs ont en effet observé une diminution de la formation d’ulcères et des concentrations plus faibles en IL-6 que le groupe contrôle au niveau des tissus de l’iléon. Vinderola et al. (2007) ont, quant à eux, étudié les effets de l’ingestion de lait fermenté par le Lactobacillus helveticus R389 à pH 6 pendant 2, 5 et 7 jours au niveau des muqueuses intestinales de souris BALB/c saines. Pour toutes les durées d’administration, une augmentation du nombre de cellules productrices IgA, IL-10, IL-2 et IL-6 a été démontrée. La production des sIgA totaux dans la lumière du petit intestin a été stimulée chez les souris ayant reçu le produit pendant 2 jours, de même que la production d’IL-6 par les cellules épithéliales du petit intestin après 7 jours d’ingestion. Chez le porcelet prématuré, différentes diètes composées de concentrés de protéines de lactosérum ont permis d’aider à la maturation de leur intestin, c’est-à-dire au développement de leur structure intestinale ainsi que de leur capacité à digérer et absorber les nutriments (Li et al., 2013).
Quelques travaux ont aussi étudié les effets in vivo d’hydrolysats enzymatiques de protéines de lactosérum purifiées. Par exemple, l’étude de Biziulevicius et al. (2006) a démontré une augmentation de la phagocytose par les macrophages péritonéaux chez des souris BALB/c, et ce, après l’ingestion pendant 5 jours d’hydrolysats de β-LG fabriqués à partir de la pepsine, trypsine, chymotrypsine ou pancréatine. Aussi, Wang et al. (2000) ont étudié les effets de l’ingestion orale d’un hydrolysat pepsique de LF. Ce régime a été administré pendant 3 jours à des souris souffrant d’un cancer du côlon. Les auteurs ont observé une augmentation importante des cellules NK, des LT CD4+ et CD8+ et des LB IgA+ et IgM+ au niveau des tissus lymphoïdes et de la lamina propria de l’intestin grêle. L’ingestion de l’hydrolysat de LF aurait donc un effet immunomodulateur au niveau de la muqueuse intestinale.
26
Globalement, ces études in vivo semblent démontrer que l’ingestion orale d’hydrolysats enzymatiques de protéines de lactosérum ou leurs fractions peptidiques a bien des répercutions tant sur l’immunité innée (Biziulevicius et al., 2006) que l’immunité adaptative (Pacheco & Sgarbieri, 2005 ; Wang et al., 2000 ; Shimizu et al., 2006 ; Saint-Sauveur et al., 2009a).
3.2. Peptides issus de la β-lactoglobuline
Peu d’études in vitro ou in vivo ont évalué les effets immunomodulateurs de peptides issus des protéines majeures du lactosérum, essentiellement de la β-LG et l’α-LA. Les travaux de Jacquot et al. (2010) ont étudié les effets in vitro de séquences peptidiques de la β-LG sur la prolifération de splénocytes murins et la sécrétion de cytokines en présence ou en absence de ConA. Il a été démontré que les peptides β-LG f15-20, f55-60, f84-91, f92-105 et f139-148 stimulent la croissance des splénocytes murins en absence de ConA, mais seuls les fragments f15-20, f55-60 et f139-148 stimulent aussi la prolifération de ces cellules en présence de ConA. Par contre, les fragments f102-105 et f104-108 ont montré un effet inhibiteur sur la prolifération cellulaire. D’autre part, les peptides β-LG f15-20, f55-60 et f139-148 modifient le profil des cytokines sécrétées de manière très variée. La séquence β-LG f15-20 stimule la production d’IL-4 et IFN-γ en absence de ConA. En présence du mitogène, aucun effet significatif n’a été observé. En absence de ConA, le fragment f55-60 inhibe la production d’IFN-γ tandis qu’en présence de ConA, il inhibe celles de l’IL-4 et IL-2. Enfin, le peptide f139-148 favorise la synthèse d’IFN-γ en absence et en présence de mitogène ainsi que la production d’IL-4 en présence de ConA.
Saint-Sauveur (2009b) a caractérisé par LC-MS les peptides contenus dans les fractions issues d’un hydrolysat trypsine+chymotrypsine d’IPL, lesquelles avaient précédemment montré un effet stimulateur sur la prolifération des splénocytes murins et la sécrétion de certaines cytokines (Saint-Sauveur et al., 2008). Cinq peptides issus de la β-LG ont ainsi été identifiés et étudiés de façon plus spécifique dans un modèle de splénocytes murins ex vivo. Les résultats ont démontré que les fragments β-LG f9-14, f96-99, f146-148 et f139-141 stimulent la prolifération des splénocytes, tandis que le peptide β-LG f33-40 l’inhibe. De plus, les peptides β-LG f9-14 et β-LG f96-99 stimulent la sécrétion de cytokines anti-inflammatoires (réponse de type Th2), alors que le fragment β-LG f146-148 induit la sécrétion de cytokines pro-inflammatoires (réponse de type Th1). Le peptide β-LG f96-99 semble donc associé à des effets anti-inflammatoires. Une étude ultérieure a donc été réalisée chez des souris saines (Hébert-Leclerc, 2011) afin d’évaluer les effets immunomodulateurs de ce peptide, sous forme purifiée, suivant son ingestion orale pendant 7 jours selon 3 doses (0,1, 0,25 et 0,5 mg par jour). Aux doses 0,1 et 0,5 mg par jour, ce peptide a entrainé une augmentation significative des quantités d’IgA mesurées dans les fèces, sans toutefois modifier les niveaux d’IgA sériques. De plus, la production d’IL-4 par les splénocytes a été stimulée pour la dose de 0, 25 mg/j, alors qu’aucun changement significatif n’a été observé dans le cas de l’IL-2, IL-17 et IFN-γ. Le peptide β-LG
27 f96-99 administré oralement aurait donc un effet stimulant sur la réponse immunitaire adaptative de souris saines.
Enfin, les travaux de Pecquet et al. (2000) ont montré que certaines fractions peptidiques présentes dans un hydrolysat de β-LG induisaient une tolérance humorale, mucosale et cellulaire après leur ingestion orale chez la souris. Les auteurs ont identifié deux fractions, la première riche en peptides β-LG f84-91, f92-99,100 et f125-138 et l’autre fraction riche en f(61,62-69):S–S:(149-162). Ces deux fractions entraînaient l’inhibition de la production d’IgE sériques anti-β-LG, la prolifération de splénocytes spécifiques à la β-LG, ainsi qu’une réponse de type hypersensibilité retardée. Les auteurs ont donc suggéré que ces fractions induisaient la tolérance orale envers la β-LG et réduisaient son potentiel allergénique.
Ces diverses études montrent donc que différentes séquences peptidiques dans la β-LG peuvent présenter des effets très variables sur la réponse immunitaire.
3.3
Peptides issus de l’α-lactalbumine
Différents peptides issus de l’α-LA ont été identifiés et caractérisés pour leurs effets sur le système immunitaire dans le cadre d’études in vitro ou in vivo. En outre, les peptides α-LA f18-19, f50-51 (Tyr-Gly) et f18-20 (Tyr-Gly-Gly) augmenteraient de manière significative la prolifération de lymphocytes sanguins humains stimulés par la ConA (Kayser & Meisel, 1996). D’autre part, les travaux de Jacquot et al. (2010) ont démontré que le peptide α-LA f10-16 stimulait la prolifération des splénocytes murins avec et sans ConA, tandis que le peptide f104-108 avait un effet inhibiteur sur la prolifération des mêmes cellules (Jacquot et al., 2010). Le fragment α-LA f51-53 (Gly-Leu-Phe) permettrait d’amplifier l’adhérence des macrophages et la phagocytose des hématies sénescentes sur des cellules humaines (Gattegno et al., 1988), en plus d’encourager la production d’anion superoxide par les neutrophiles dans un modèle murin in vitro (Migliore-Samour et al., 1992).
Dans le cadre d’études in vivo, Berthou et al. (1987) ont démontré que le même peptide (α-LA f10-16) permettait à des souris de mieux résister à une infection par Klebsiella pneumoniae et d’augmenter la phagocytose par les macrophages péritonéaux in vitro. En fait, il semble que ce peptide possède des récepteurs spécifiques sur les neutrophiles et monocytes humains (Jaziri et al., 1992). Enfin, Tsuruki & Yoshikawa (2005) ont démontré que chez des rats nouveau-nés, ce fragment prévient l’alopécie induite par l’étoposide, agent anticancéreux, suite à son administration par injection ou ingestion orale.
Ces études démontrent que les différents peptides contenus dans l’α-LA présentent des effets intéressants sur le système immunitaire aussi bien in vitro qu’in vivo.