N° d’ordre : 2317 UNIVERSITE MOHAMMED V-AGDAL
FACULTE DES SCIENCES
RABAT
THESE DE DOCTORAT ES-SCIENCES
(DOCTORAT D’ETAT)
Présentée par
LAARABI SAID
Discipline: Biologie
Spécialité: Physiologie végétale
EFFET DES CONDITIONS STRESSANTES AERIENNES ET
SOUTERRAINES SUR L'IMPEDANCE ELECTRIQUE
FOLIAIRE DE JEUNES PLANTES
Soutenue le 16 novembre 2006, devant le jury
B. CHLYAH
PrésidentProfesseur à la Faculté des Sciences de Rabat-Agdal
K. EL KINANI
ExaminateurProfesseur à la Faculté des Sciences de Rabat-Agdal
A. ETTOUHAMI
ExaminateurProfesseur à la Faculté des Sciences de Rabat-Agdal
M. BEKKALI
ExaminateurDédicaces
Je dédie ce travail :
A ma femme Samira
A ma fille Mariam
A mon fils Mahdi
A toute ma famille
A ma belle famille
TABLE DES MATIERES
Avant-propos Abréviations
Préface ……….1
I. ANALYSE BIBLIOGRAPHIQUE
…..……….……….. 4I .1 GENESE ET CARACTERISTIQUES DES SIGNAUX ELECTRIQUES……… 4
I.2. MOYENS ET MECANISMES DE L’ABSORPTION DES ELEMENTS MINERAUX………. 5
I.3. L’EAU, LA PLANTE ET LA BIOELECTRICITE………..…...…13
I.4. MESURE DE L’IMPEDANCE………..………..…..21
I.5. INSTRUMENTS DE MESURE………...…...….. 24
II. MATERIEL ET METHODES
……….…… 27II.1. MATERIEL BIOLOGIQUE …..……….……….…. 27
II.2. CONDITIONS DE CULTURE ………...………..………. 27
II.2.1. Culture en hydroponie (aquiculture) ……….….. 27
II.2.2. Culture sur sable………. 28
II.2.3. Application de conditions atmosphériques particulières ………... 28
II.2.3.1. Variation de l’humidité relative de l’air (HRA) ……….. 28
II.2.3.2. Variation de l'agitation de l'air (AA)……… 30
II.3. MESURE DE L’IMPEDANCE……….. 31
II.3.1. Appareillage, obtention et traitement des résultats……….…… 31
II.3.2. Mesures ………33
II.4. EVALUATION DE LA CROISSANCE……….….. 35
II.5. CALCUL STATISTIQUE……….. 35
III. RESULTATS
………...……….…... 36III.1. ANALYSE SPECTROMETRIQUE, IN VIVO, DE L'IMPEDANCE DES ORGANES AERIENS DE CERTAINES PLANTES MONO- ET DICOTYLEDONES………. ……….….…. 37
III.1.1. Comparaisons électrospectromètriques entre les espèces testées……….…. 38
III.1.2. Comparaisons électrospectromètriques entre les organes aériens d'une même espèce……….…. 42
III.1.3. Comparaisons électrospectromètriques entre les organes opposés d'une même plante……….………. 43
III.1.4. Comparaisons électrospectromètriques en fonction de l'âge.……….... 44
III.2. ANALYSE SPECTROMETRIQUE, IN VIVO, DE L'IMPEDANCE DE LA PREMIERE FEUILLE DE MAÏS EN FONCTION DES CONDITIONS HYDRIQUES DU SOL ET DE L’ATMOSPHERE………..……….…….. 49
III.2.1. Apport d'eau et impédance électrique en air calme….………..… 50
III.2.2. Apport d'eau et impédance électrique en air agité ou fortement humide………... 52
III.3. EFFET DES CONDITIONS STRESSANTES SOUTERRAINES SUR
L’IMPEDANCE ELECTRIQUE FOLIAIRE CHEZ LES JEUNES PLANTES
DE MAÏS……….…..…. 57
III.3.1. Effet de la concentration en éléments nutritifs sur les paramètres électriques de l’impédance……….………. 59
III.3.2. Effet du stress osmotique (PEG200)………. 61
III.3.3. Effet du stress salin (NaCl)……… 63
III.3.4. Effet du stress acide (CH3COOH)……….……… 65
III.3.5. Effet du KCN, un inhibiteur du métabolisme……….. 66
III.3.6. Comparaison de l’effet des différents facteurs stressants utilisés……….. 67
IV. DISCUSSION ……….……….…….. 68
V. CONCLUSION ET PERSPECTIVES……..……….….75
VI. REFERENCES BIBLIOGRAPHIQUES………..78
Avant propos
Le présent travail qui relève du domaine de diagnostic foliaire par des méthodes électriques a été réalisé au Laboratoire de physiologie végétale de la Faculté des Sciences de l’Université MohammedV de Rabat-Agdal, sous la direction du Professeur Khalifa El KINANI.
Les aspects physiques et informatiques ont été co-encadrés par les Professeurs Aziz ETTOUHAMI et Mohammed LIMOURI du Laboratoire de conception et système du département de physique de la même Faculté.
Je voudrais exprimer ma profonde reconnaissance à Monsieur le Professeur Khalifa El KINANI qui m’a proposé le thème de ce travail auquel il a apporté un intérêt constant. J’ai beaucoup appris avec lui aussi bien sur les plans théorique et pratique que sur le plan humain. Je voudrais remercier les Professeurs Aziz ETTOUHAMI et Mohammed LIMOURI qui nous ont aidé à mettre sur pied un système de mesure des paramètres électriques et d’exploitation des données recueillies.
Je voudrais aussi exprimer ma sincère gratitude à Madame Bouchra CHLYAH Professeur à la Faculté des Sciences de Rabat qui a toujours été présente aussi bien dans la rédaction des articles qui constituent la base de cette thèse que dans la rédaction de la thèse elle même. La vivacité de son esprit critique et sa riche expérience en matière de formation de jeunes chercheurs m’ont servi comme phare de sécurité. Je la remercie vivement pour avoir accepté de présider le jury qui évalue le présent travail.
Le Professeur Aziz Ettouhami du département de physique de notre Faculté continue comme toujours à m’apporter aide et assistance dans l’élaboration du présent travail. Qu’il trouve ici ma profonde reconnaissance et mes sincères remerciements.
Le Professeur Mohammed Limouri du même département de physique et co-encadrant de mon travail ne peut, pour des raisons de santé, assister au premier couronnement de cette coopération entre les départements de biologie et de physique qui est la soutenance d’une thèse. Que le Professeur Mohammed Limouri trouve ici aussi mes sincères remerciements et mes souhaits de prompt rétablissement.
Le Professeur Mohammed Bekkali de la Faculté des Sciences de Aïn Chock de Casablanca, malgré l’éloignement et ses nombreuses occupations a tenu à nous rencontrer plusieurs fois pour mieux présenter le présent travail et à apporter les éléments qui y manquaient. Je lui apporte ici ma profonde reconnaissance et mes sincères remerciements.
De même pour le Professeur José Antonio Fernandez de la Faculté des Sciences de Malaga qui, dans un premier temps m’a autorisé à travailler dans son Laboratoire et où j’ai appris d’autres méthodes d’électrophysiologie, et, dans un deuxième temps, n’a pas hésité à lire ma thèse, à nous envoyer un rapport pertinent sur cette thèse et à venir enfin faire part du jury qui évalue l’apport scientifique de cette thèse. Que Monsieur le Professeur José Antonio Fernandez trouve ici ma profonde reconnaissance et mes sincères remerciements. J’espère que ces premières ébauches de coopérations seront utiles pour nos deux pays.
Je voudrais aussi exprimer mes remerciements à tout le personnel- enseignants et personnel administratif- du Laboratoire de physiologie végétale de notre Faculté qui m’a toujours apporté l’aide et le soutien moral nécessaires pour l’élaboration de ce travail.
Ce dernier n’aurait pu être mené à bien sans l’appui financier du Programme d’Appui à la Recherche Scientifique (PARS. Agro 106) du Ministère marocain de l’Education Nationale et de l’Enseignement Supérieur. Je tiens ici à remercier les équipes scientifique et administrative
Abréviations
AA : air agité
ABA : acide abscissique AIA : acide indolacétique APG : acide phosphoglycérique ATP : adénosine triphosphate ATPase : adénosine triphosphatase
CCCP : carboxyle cyanide-m-chlorophényle hydrazone CH3COOH : Acide acétique
-CN : cyanure
Cp : capacité parallèle
CSB : courbe spectrométrique de bioimpédance CRM : capacité de rétention maximale
DCCD: dicyclocarbodiimide DES: diethyle stilbestrol FC : fréquence caractéristique Fig. : figure
Flle : feuille
HR : humidité relative
HRA : humidité relative de l'air élevée Hyd : hydroponie IV : indice de vigueur Hyp : hypocotyle Hz : Hertz KHz : Kilo Hertz K: Kilo Ohm MHz : Méga Hertz 1,0N : une dose normale NaCl : Chlorure de sodium nF : nano Farad
PEG : polyéthylène glycol PEP : phosphoenolpyruvate
PEP-carboxylase : phosphoenolpyruvate-carboxylase pH : potentiel hydrogène
PHA : Potentiel hydrique de l’Atmosphère Rp : résistance parallèle
Tabl. : tableau
Z : impédance complexe du circuit ; impédance (résistance ohmique + résistance capacitive). Zi : partie imaginaire
Zr : partie réelle mol : micromole
Préface
Déterminer les besoins d’un semis de façon rapide et fiable est toujours un souhait à réaliser pour les agronomes et les exploitants agricoles. Le dignostic est d’autant plus intéressant que la plante cultivée est plus jeune. Dans ces conditions et en cas du besoin, le recours à des mesures adéquates peut être rentable. Actuellement bon nombre de laboratoires travaille sur la possibilité d’utiliser les signaux électriques pour diagnostiquer l’état physiologique des végétaux. C’est ainsi que sur des organes ou des morceaux d’organes détachés de la plante mère on mesure des paramètres électriques tels que l’impédance ou les potentiels d’action ou de repos .
Dans le présent travail on mesure in vivo l’impédance des organes aériens de jeunes plantes cultivées et qui ont été soumises à des conditions stressantes aériennes et souterraines.
Ce travail, faisant l’objet d’une thèse de Doctorat d’Etat, a été réalisé au Laboratoire de physiologie végétale de la Faculté des Sciences de l’Université Mohammed V de Rabat-Agdal, sous la direction du professeur Khalifa El Kinani. Les aspects physique et informatique ont été co-encadrés par les professeurs Aziz Ettouhami et Mohammed Limouri du Laboratoire « conception et système » de la faculté des Sciences de Rabat-Agdal. C’est donc une coopération entre les départements de Biologie et de Physique.
Le travail a été rendu possible grâce à un financement du Ministère de l’Enseignement Supérieur et de la Recherche Scientifique dans le cadre du Programme d’Appui à la Recherche Scientifique (PARS). Notre projet est identifié « PARS Agro 106 ».
Ce travail a servi de base pour les publications suivantes :
Publications dans des revues à comité de lecture :
-Laarabi S., El Kinani Kh., Ettouhami A. et Limouri M. (2005a) Impédance in vivo des
organes aériens de certaines plantes mono- et dicotylédones. C. R. Biologies, 328, 253-262.
-Laarabi S., El Kinani Kh., Ettouhami A. et Limouri M. (2005b) Analyse spectrométrique,
in vivo, de l'impédance de la première feuille de Maïs (Zea mays L.) en fonction des conditions hydriques du sol et de l’atmosphère. C. R. Biologies 328, 493-503.
-Laarabi S., El Kinani Kh., Ettouhami A. et Limouri M. [en préparation] Effet des
conditions stressantes souterraines sur l’impédance électrique foliaire chez les jeunes plantes de Maïs (Zea mays L.).
Communications
-Laarabi S., El Kinani Kh., Ettouhami A., Limouri M. et Essaid A. Diagnostic foliaire par
des méthodes de biophysique. Poster et communication publiée dans le document du « Colloque international de Biotechnologie: quelles opportunités pour le Maroc? », tenu à Rabat du 3 au 5 juin, 2002.
I. ANALYSE BIBLIOGRAPHIQUE
I.1. GENESE ET CARACTERISTIQUES DES SIGNAUX
ELECTRIQUES………..……… 4
I.2. MOYENS ET MECANISMES DE L’ABSORPTION DES
ELEMENTS MINERAUX……….………. 5
I.3. L’EAU, LA PLANTE ET LA BIOELECTRICITE……….. 13
I.4. MESURE DE L’IMPEDANCE………... 21
I.
ANALYSE BIBLIOGRAPHIQUE:
I.1. Genèse et caractéristiques des signaux électriques:
Les premiers exemples de signaux électriques chez les plantes ont été identifiés et décrits déjà en 1873 par John Burdon-Sanderson. Les signaux sont à distance et ils peuvent dépasser les dimensions assez grandes d’une plante monocellulaire. John Burdon-Sanderson un électrophysiologiste de l'Université Collège de Londres, étudia, sur demande de Charles Darwin, les mécanismes des mouvements rapides pour piéger les insectes chez les feuilles de
Dionea muscipula, une plante carnivore, appelée communément gobe-mouche. Darwin pensait
que ces mécanismes pouvaient être semblables à ceux des réflexes nerveux des animaux. Il a été remarqué ensuite que les signaux électriques à longue distance et au sein d’une même plante sont impliqués, aussi bien, dans les mouvements des feuilles des plantes sensitives au toucher comme le Mimosa pudica, que dans les mouvements de piégeage des insectes par les tentacules foliaires de diverses espèces de plantes carnivores (les Droséracées).
Cependant beaucoup de phytobiologistes étaient peu disposés à considérer l'idée que les plantes peuvent utiliser les signaux électriques à longue distance dans une large gamme de phénomènes de coordination outre que ceux mentionnés ci-dessus. Pour cela ils avançaient plusieurs arguments :
a- les plantes et les animaux sont différents.
b- les plantes chez qui on a observé les signaux électriques constituent un cas particulier : elles sont excitables donc différents des plantes ordinaires.
c- les difficultés d'identification de phénomènes physiologiques dans lesquels le courant électrique interne semblerait être impliqué.
Malgré ces réticences, beaucoup d’essais ont été réalisés depuis 1878, date de publication du travail de Kunkel (cité par Meylan, 1971) qui considérait que dans la plante, les courants d’eau constituent les forces électromotrices qui créent les biopotentiels.
Aujourd’hui, il devient de plus en plus évident qu’au niveau cellulaire, les plantes et les animaux ont beaucoup en commun. Les organes d’une plante, à différents degrés, sont excitables. Toute action externe, mécanique, thermique ou chimique amène la plante à émettre un signal électrique qui se propage à travers les tissus et qui, enregistré, a l’allure d’un potentiel d’action. L'implication des signaux électriques à grande distance dans de nombreuses formes des phénomènes de coordination chez les plantes semble s’imposer (Thain et Wildon, 1992). Cependant lorsqu’on parle de propriétés électriques chez les végétaux, on pense surtout aux ions avec leurs aux charges électriques, absorbés et accumulés dans les différents tissus par ces organismes vivants.
I.2. Moyens et mécanismes de l’absorption des éléments minéraux par les plantes :
Pour bien croître, mieux se développer et assurer un bon rendement, les végétaux doivent avoir à leur disposition, outre la lumière et une température adéquate, de grandes quantités d’eau et d’éléments minéraux. Depuis toujours les biologistes et les agronomes s’efforcent de déterminer les quantités optimales pour rentabiliser les mesures agronomiques entreprises dans le domaine de la nutrition hydrique et minérale.
La dernière mesure est onéreuse même dans les pays producteurs d’énormes rendement agricoles. Elle doit ensuite être équilibrée qualitativement et quantitativement. Les différents éléments nutritifs ne sont pas absorbés dans les mêmes proportions. Ainsi Bieleski et Ferguson (1983) ont observé que l’absorption des éléments minéraux nutritifs par Actinida chinensis, une
Teneur en éléments minéraux dans les tissus (feuilles et fruits) d’ Actinidia chinensis * et dans le sol sur lequel il a poussé** (Bieleski et Ferguson, 1983).
N K P Ca Mg Tissu (a) 170 80 9 28 14 Solution du sol (Extraction, b) 1-3 1-2 0,0005-0,002 0,5-1,5 2-4 a/b 57-170 40-80 4500-18000 19-56 3,5-7
* en mole/kg de matière fraîche ** en mole/l d’extraction
A la lumière des données du tableau ci-dessus, on peut faire les remarques suivantes :
- quantitativement les éléments minéraux sont absorbés différemment. C’est ce qu’on appelle l’absorption sélective.
- Après la mise en contact des racines de la plante ici testée avec la solution du sol l’accumulation des éléments minéraux ne s’est pas faite spontanément.
Dans deux solutions inertes de différentes concentrations l’écoulement passif prend fin lorsque les concentrations s’équilibrent. Chez la plante, avec le temps et l’âge, l’absorption continue même si la concentration de certains éléments nutritifs à l’intérieur dépasse celle à l’extérieur. L’absorption s’est donc faite contre le gradient de concentration. Elle utilise l’énergie métabolique.
Ces mouvements ioniques, ayant lieu dans un milieu aqueux et n’étant autres que des mouvements de charges électriques, participent largement dans l’électrogenèse des potentiels diffusionnel et transmembranaire lesquels, comme courant électrique, mesurés entre deux points donnés doivent, selon la loi d’Ohm, traverser une résistance. Arrivées aux membranes cellulaires qui sont nombreuses (plasmiques, mitochondriales, chloroplastiques, etc.), les charges sont spontanément séparées et déposées de part et d’autre des membranes qui forment donc un condensateur virtuel avec une capacité électrique.
Ces paramètres électriques sont liés entre eux par les équations suivantes :
* Capacité (C) :
Q = C.E / F (1),
où Q : quantité de charges électriques en équivalent.cm2 C : capacité membranaire en Farad
E : différence de potentiel en Volts F : nombre de Farad
* Différence de potentiel membranaire (Em) :
Em = [R.T / F] . [Ln (Pk.Cko+ PNa.CNao+ PCl.CCli) / (Pk.Cki+ PNa.CNai + PCl.CClo)] (2),
Où R : Constante des gaz parfaits, soit 1,987 cal.mol-1= 8,315 joules.mol-1 T : Température absolue en degré Kelvin
F : Nombre (constante) de Faraday = 96489 coulombs, c’est la charge électrique portée par une mole et dont l’équivalent calorifique est 23,06 cal.mol-1
Ln : Logarithme népérien, soit 2,303 log10
Pk: Coefficient de perméabilité de l’ion K+(de même pour le sodium Na+et le Chlore Cl-)
Cko, i : concentration externe (o) et interne (i) du K+.
* Conductance (G):
G = F2(ΦKin+ ΦNain) / R . T , (3)
où ΦKin: Flux entrant du potassium (K+)
R, T, F ont leur signification habituelle, ci-dessus indiquée. * Résistance électrique (Re):
Nous remarquons que dans l’expression de Goldman(2) seuls trois ions sont mentionnés. C’est qu’avant on considérait que seuls ces ions sont décisifs dans la genèse des potentiels électriques.
Les expériences menées avec un pH de la solution externe, contrôlé et croissant, montrent une nette influence de ce facteur sur la différence de potentiel transmembranaire ou le potentiel d’action (Kitasato,1968; Slayman, 1970; El Kinani,1973). Il est intéressant de noter que le maximum de l’action est observé avec des pH acides, entre 3 et 4,5. Or, l’acide indol-3-acétique favorise la croissance par l’extrusion vers la paroi squelettique de protons qui font relâcher la trame moléculaire de cette paroi et la rendent élastique. L’élongation cellulaire est accompagnée par une baisse du pH du milieu jusqu’à 4,5 (Mazliak, 1982).
Dans la formule de Goldman manquent aussi des cations bivalents tels que le Mg2+ et Ca2+, dont on connaît le rôle dans la vie d’un végétal. Le premier entre dans la structure de la chlorophylle et le second cimente la paroi squelettique des cellules végétales. Les deux éléments chimiques jouent aussi d’autres rôles.
Depuis le début du 20èmesiècle, on sait qu’une cellule est plus excitable dans un milieu pauvre que dans un milieu riche en calcium. Cet effet est expliqué par l’interaction des ions Ca2+avec les charges négatives des phospholipides membranaires (Dubois et al., 1999). D’après ces auteurs le lien du Ca2+ avec les phospholipides entraîne une diminution de la probabilité d’ouverture des canaux sensibles au potentiel.
El Kinani (1973) note que l’amplitude du potentiel d’action diminue chez les feuilles des plantes cultivées sur des doses faibles ou fortes (extrêmales) de la solution de Knop que chez les feuilles cultivées sur doses moyennes de cette solution nutritive et qui assurent une meilleure croissance des plantes. Il a noté aussi que le rapport K/Ca chez les plantes cultivées
sur des doses optimales est plus élevé que chez les plantes cultivées sur des doses stressantes. C’est la diminution du Ca2+qui a causé l’augmentation de ce rapport.
Pour un organisme vivant la synthèse et la consommation de l’énergie sont très variables. Le mouvement des ions l’est aussi. On doit s’attendre donc, à des valeurs différentes lorsqu’on mesure les paramètres électriques sous différentes conditions.
On se pose la question : quelles sont les forces motrices et quels chemins empruntent les ions pour arriver à l’intérieur de la plante, de la cellule ?
Chez les végétaux, celle-ci est limitée par deux membranes. L’une, externe, de nature chimique pectocellulosique, appelée paroi squelettique. La deuxième, appelée membrane plasmique est de nature lipoprotéïque.
La paroi squelettique est constituée de cellulose, d’hémicellulose et de pectines qui ne sont autres que des acides polyuronique qui, grâce à leur groupement carboxylique (-CHOO(-)) se lient aux ions, de la solution nutritive, portant une charge positive. Ils jouent le rôle d’échangeurs de cations et augmentent la concentration des substances positivement chargées. Ces substances accumulées dans l’espace libre (Moorby, 1981; cité par Polevoï, 1989) sont transportées ensuite à l’intérieur de la cellule et des organites intracellulaires en passant à travers la membrane plasmique. Cette dernière, de nature lipoprotéique, est tapissée de pores, eux-mêmes de nature protéique et appelés canaux ioniques. Ce sont des voies de passage des ions.
Les canaux sont nombreux et spécifiques. On les classe d’après leur sélectivité ionique, leur système d’activation ou leur gènes responsables.
Si on prend un organe végétal telle que la feuille, grossièrement, elle comprend l’épiderme, le mésophylle (partie synthétisante) et un réseau de vaisseaux de distribution. Les canaux qui se trouvent dans ces différentes parties, même s’ils conduisent le même élément chimique comme le potassium K+, par exemple, se caractérisent par des propriétés et des structures moléculaires différentes (Dubois et al., 1999; Shabala et al., 2002; Pilot et al., 2003).
Le potassium, élément le plus abondant dans la majorité des plantes cultivées (Marschner, 1995), est conduit par une grande variété de canaux, et de transporteurs codés par 75 gènes (Shabala, 2003). Ils sont modulés par le potentiel membranaire et ce lorsqu’il y a déplacement de charges électriques ou changement de structure à l’intérieur (au sein) du canal. Ces canaux sont aussi activés par des ions tels que le calcium et le sodium ou inhibés par l’ATP (on les écrit KCa, KNa et KATP ). Ils sont, en fin, sensibles aux facteurs environnementaux telles que la
lumière, la température, la sécheresse et la salinité.
L’ouverture et la fermeture de ces canaux dépendent aussi des ions imperméants qui ne peuvent passer par le canal. Elles dépendent aussi des récepteurs membranaires qui, parfois, jouent le rôle de canaux ou sont couplés à des protéïnes G qui régulent directement ou indirectement l’ouverture des canaux. La protéïne, armature du canal, elle-même, constitue dans certaines conditions une barrière au passage des ions. En effet le polypeptide qui constitue cette protéine contient un segment comportant une suite d’acides aminés portant une charge positive. Ce segment interagit avec l’extrémité N de la protéine et forme une boucle qui obstrue le canal et l’inactive. L’obsturation peut aussi être due à l’extrémité C.
Ayant passé par les canaux ioniques grâce, en grande partie, aux potentiels électrochimiques, les éléments minéraux sont pris et redistribués aux différents organites par des transporteurs intracytoplasmiques. Ces substances chimiques qui fixent les éléments minéraux et les relâchent aux lieux et moments opportuns jouent en quelque sorte, le rôle d’enzymes transporteurs. On les trouve sur les membranes plasmiques et les membranes des autres
organites. Dans une revue bibliographique, Shabala (2003) dresse une liste des transporteurs de K+. Il y indique aussi la fonction et le site de ces transporteurs dans les feuilles de différentes espèces végétales.
Le transport via les canaux se fait dans les deux sens : de l’extérieur vers l’intérieur de la cellule et ses organites ou de l’intérieur vers l’extérieur. Ainsi on trouve, par exemple, les canaux sélectifs rectifiants du K+vers l’intérieur ( in KIR) et vers l’extérieur ( out ward-KOR).
Il existe aussi des canaux que nous appelons mixtes qui sont non sélectifs (NSCC : non-selective cation channel) et qui laissent passer les ions K+, Na+, Ca2+et Mg2+dans les deux sens. Dans l’organisme vivant beaucoup de réactions biochimiques sont accompagnées d’un dégagement d’hydrogène. L’accumulation de cet élément risque d’entraîner une acidification du milieu cellulaire qui doit être neutre à légèrement acide. L’hydrogène en excès est évacué hors de la cellule. Ce travail est accompli par une enzyme qui joue le rôle de pompe à protons et appelée H+- ATPase. Le mouvement des ions H+ crée une différence de potentiel de pH (ΔpH) et une différence de potentiel électrochimique (ΔΨ) qui constituent non seulement la force électromotrice pour le drainage des ions H+ mais aussi la source d’énergie pour le transport de solutés par l’intermédiaire des canaux ioniques et des transporteurs secondaires (Michelet et Boutry, 1995).
Les H+-ATP-ases génèrent un courant sortant hyperpolarisant. De ce fait les cellules végétales ont généralement un potentiel de repos beaucoup plus négatif (-100 à -200mV) que le potentiel d’ équilibre des ion K+. Cette négativité crée le gradient de concentration des ions K+ qui entrent dans les cellules par des canaux K+rectifiants entrants.
d’acides aminés (dans le cas de ΔpH) ou pour l’absorption de K+, Mg2+, Ca2+, Mn2+, etc., (dans le cas de ΔΨ).
L’absorption des éléments minéraux peut se faire aussi par les transports actif et passif agissant simultanément. C’est le cas de la pinocytose, un phénomène qui commence par une invagination de la membrane plasmique suivi d’un remplissage de cette invagination par la solution ambiante. Viennent après un étranglement et un détachement de la vésicule qui va fusionner d’habitude avec une autre membrane pour constituer une vésicule de digestion. Le contenu cellulaire se trouve ainsi enrichi d’une certaine quantité d’éléments minéraux qui vont sans doute changer les rapports ioniques.
Bien qu’observé depuis longtemps par de nombreux chercheurs (Levis, 1931; cité par De Robertis et al., 1970) la pinocytose reste un phénomène mal étudié. On ne connaît ni la quantité d’éléments minéraux concernés, ni le moment, ni les conditions environnementales qui favorisent l’avènement du phénomène.
Dans le même ordre d’idées, malgré l’existence d’une régulation pour harmoniser les phénomènes physiologiques, la plante se trouve désarmée quand elle pousse dans un milieu contenant des quantités excessives de certains éléments minéraux : l’absorption continue à avoir lieu même s’il y a toxicité provoquée par le déséquilibre des rapports ioniques. Ce déséquilibre et l’état physiologique de la plante provoquent une baisse de l’excitabilité et par conséquent une baisse de certains paramètres électriques, en l’occurrence l’amplitude du potentiel d’action enregistré comme signal électrique (El Kinani, 1973).
Donc, les canaux ioniques, les transporteurs, les pompes ioniques (K+ / Ca2+-ATPases, H+ -ATPase, potentiels électrochimiques) et les mécanismes de la pinocytose constituent les instruments de transport des éléments minéraux de la solution nutritive externe vers l’intérieur de la plante.
Ce transport est rendu possible par la présence d’eau. Ici aussi interviennent des forces physico-chimiques, biologiques et agronomiques. L’eau qui coûte cher, doit être bien gérée pour assurer le meilleur rendement. Son efficacité dépend du volume mis à la disposition de la plante, aussi bien dans l’air que dans le sol.
I.3. L’eau, la plante et la bioélectricité :
Des graines conservées pour être semées ou consommées contiennent à peu prés 15% d’eau de leur poids sec. Trempées dans l’eau pour être semées elles absorbent l’eau dont la teneur atteint au bout d’une à 3 heures les 70 à 80% du poids sec des graines. Dans ces conditions celles-ci germent et donnent un nouveau végétal. De quoi s’agit-il ? L’eau a facilité le mouvement et le métabolisme des substances de réserve contenues dans les graines. Les réactions biochimiques nécessaires à la croissance et au maintien en vie de la plante ne peuvent avoir lieu que dans un milieu aqueux. Dans la photosynthèse, ce phénomène par lequel la plante produit la matière organique et l’oxygène, l’eau, grâce à la lumière et la chlorophylle, constitue la matière première qui va réduire le gaz carbonique.
Tout en croissant le végétal a toujours besoin de grandes quantités d’eau car celle-ci outre sa participation au métabolisme pourrait, grâce à sa capacité calorifique et sa chaleur de vaporisation élevées, emmagasiner de grandes quantités d’énergie. Dans ce cas-là l’eau est donc un protecteur du végétal, comme des autres organismes vivants, contre les fluctuations de température. Elle leur évite les chocs thermiques momentanés et leur permet de réguler leur régime thermique.
La quantité des éléments minéraux nutritifs drainés par l’eau et introduite dans la plante est proportionnelle à leur concentration dans le sol (Gunar et al., 1973).
Cette dernière dose exerce une pression osmotique qui retient l’eau et rend difficile son absorption. Cet état de faits est confirmé par l’utilisation d’un agent osmotique le polygluquine pour imiter les pressions osmotiques développées par des doses croissantes de la solution nutritive de Knop.
Les doses extrêmes de 0,1 et 4,0 fois la concentration de cette solution nutritive font diminuer la teneur en eau des feuilles, l’accumulation de la matière sèche (= croissance) et l’excitabilité exprimée par une diminution de la vitesse de montée du potentiel d’action. Ce dernier paramètre de la bioélectricité est mieux exprimé lorsque l’humidité relative de l’air (HR) commence à diminuer (El Kinani, 1973).
La conductance, comme paramètre bioélectrique, ou l’inverse de la résistance (1/Re) diminue avec l’augmentation de la pression osmotique (Gunar et al, 1974). Ainsi la plante est confrontée à un premier obstacle, souterrain, l’empêchant d’absorber la quantité nécessaire d’eau, mais favorisant une forte accumulation d’éléments minéraux, accumulation qui devient toxique et diminue la croissance. Les paramètres électriques sus-indiqués, diminuent aussi avec l’augmentation de la pression osmotique de la solution nutritive et la forte accumulation des éléments minéraux.
La partie aérienne de la plante affronte, elle, d’autres facteurs stressants, influençant son régime hydrique et ce, même, lorsque les conditions nutritives, souterraines, sont favorables à son développement normal. La transpiration, dont l’un des rôles premiers est l’approvisionnement de la plante en eau et en éléments minéraux, est fortement dépendant des conditions environnementales telles que la lumière, la température, l’humidité relative de l’air, et la vitesse du mouvement de l’air. Ajoutés à la structure anatomique de la feuille (stomates et cuticule), lesquels favorisent l’évaporation, donc une perte d’eau, à la suite de quoi le potentiel hydrique dans les cellules baisse c’est à dire que la force de succion augmente, ce qui entraîne une
absorption de l’eau à partir du xylème des nervures foliaire ceci génère instantanément un écoulement de la sève, dans les vaisseaux conducteurs, à partir des racines vers les feuilles. Les conditions environnementales, ci-dessus rappelées, sont en perpétuel changement et l’évaporation l’est de même.
Nobel (1970), se basant sur les potentiels hydriques de l’atmosphère et de la plante a calculé que les feuilles d’un végétal ne peuvent perdre de l’eau que lorsque l’humidité relative de l’air (HRA) est égale ou dépasse les 99,6%. Or, toujours d’après cet auteur, même au cours des pluies diluviennes l’HRA dépasse rarement les 99%. D’où l’évidence de l’intervention du mécanisme de la régulation stomatique lors de la variation de l’HRA.
Ce dernier paramètre du potentiel hydrique, intervenant surtout dans les phénomènes de la transpiration, doit influencer la vie des végétaux.
Le potentiel hydrique de l’atmosphère peut être calculé en appliquant la formule suivante : Φwv= RT/Vw
.
Ln (HRA/100)Le potentiel hydrique de l’atmosphère est exprimé en grandes valeurs négatives, car des diminutions minimes de l’HRA correspondent à de grandes augmentations de ces valeurs. A 20°C la constante des gaz parfaits R est égale à 8,3143 j/mole.°k et le volume V de vapeur d’eau à 17,984 cm3/mole. Donc à 20°C :
RT/V = (8,3143.293,16)/17,984 = 135,5j/ cm3=1355bars
A 100% d’HRA, Ln (100/100) = Ln (1) = o, c'est-à-dire que le potentiel hydrique de l’atmosphère est nul.
A 99%, Φwv= 1335. Ln(99/100) = -13,6 bars et de là, on obtient les valeurs suivantes négatives
Potentiel hydrique de l’Atmosphère (PHA) et Humidité Relative de l’Air (HRA) correspondante :
HRA 90 80 70 60 50 40 30 20 10
PHA -142 -300 -480 -690 -936 -1240 -1635 -2170 -3120
Ainsi la force motrice du flux hydrique du sol vers l’atmosphère, en traversant la plante, peut atteindre plusieurs centaines d’atmosphères et les végétaux se dessècheraient rapidement s’il n’y a pas la régulation de la transpiration.
Le problème qui se pose donc consiste non seulement à apporter de l’eau aux végétaux mais il conviendrait aussi de les aider à mieux lutter contre ce qu’on pourrait appeler la sécheresse atmosphérique quasi permanente.
Dans ces conditions il serait utile de mentionner certains résultats des recherches concernant l’impact de l’HRA sur les phénomènes physiologiques.
Utilisant des paramètres de la transpiration, telles que son intensité et sa productivité, Polevoï (1989) conclue que seulement 2,2% du flux hydrique traversant la plante est utilisé pour la synthèse des substances constituant l’organisme végétal, les 97,8% restant sont consommés dans l’évaporation.
Bien que toutes les parties supérieures d’une plante peuvent évaporer de l’eau, la transpiration, comme on le sait, est effectuée par les feuilles et essentiellement par les stomates, ces pores qui tapissent les surfaces foliaires.
Ainsi par leur mouvement d’ouverture et de fermeture les stomates participent au métabolisme et agissent sur les phénomènes électriques de la plante par les mouvements des ions et de leurs charges électriques.
L’ouverture et la fermeture des stomates dépendent de plusieurs facteurs externes et internes. Parmi les facteurs externes les plus importants sont l’HRA, le niveau d’apport d’eau, la lumière et la température. Quant aux facteurs internes tels que la concentration en CO2, l’état de
l’hydratation de la plante, la composition et la proportion ionique, les phytohormones sont intensément étudiés actuellement. L’âge des feuilles et leur stade de développement influencent aussi le comportement des stomates.
Avec les progrès techniques et le développement des appareils de mesure, le métabolisme de la plante est pris en considération pour mieux expliquer les mécanismes intervenant dans le comportement des stomates.
Ainsi, les processus physiologiques de production d’énergie que sont la glycolyse et le cycle de Krebs (chaîne respiratoire) ont pour but la transformation de substances chimiques, dont certaines tout en étant sur la voie d’être transformées jouent d’autres rôles dans la cellule végétale. C’est le cas du malate que l’on retrouve dans ces processus et qui joue un rôle important dans le comportement des cellules stomatiques, et par conséquent dans le régime hydrique des végétaux. Se basant sur des données bibliographiques dont les travaux de Raschke et Resemann (1986), Polevoï (1989) donne le schéma suivant de l’osmorégulation des mouvements stomatiques : Paroi Squelettique H+ K+ glucose PEPc malate K+ cytoplasme CO2 Vacuole
L’ouverture des stomates dépend de la sortie des ions H+ des cellules stomatiques. Ce processus est lié à l’activation des pompes-H+ du plasmalemme en réponse à l’action de facteurs internes ou externes.
La sortie des ions H+est couplée à l’entrée des ions K+dans la cellule puis dans sa vacuole. Le potassium provient de l’espace libre et des cellules avoisinantes. Le transport des ions K+dans la vacuole est couplé à son tour à l’entrée de deux types d’anion : les ions Cl-et le malate. La forte sortie des ions H+ induite par la lumière provoque une augmentation du pH cytoplasmique jusqu’à 7,2 et plus, ce qui favorise l’activité de la phosphoenolpyruvate-carboxylase (PEP-phosphoenolpyruvate-carboxylase) dont l’optimum d’activité est observé à un pH : 7,5 à 8,0. Cette enzyme accélère la carboxylation du phosphoenolpyruvate formé à partir du glucose après dégradation de l’amidon, ce qui entraîne une augmentation de la teneur en malate dans les cellules stomatiques.
La teneur en malate est régularisé par une liaison inverse et négative entre la quantité du malate synthétisé et l’activité de la PEP-carboxylase, la valeur du pH cytoplasmique et l’existence du CO2 pour la carboxylation du PEP et la formation du malate qui expliquent la sensibilité des
cellules stomatiques aux concentrations du CO2dans les tissus.
L’augmentation dans les vacuoles des cellules stomatiques de la teneur en éléments osmotiquement actifs (K+, malate, Cl-) entraîne un flux hydrique dans les vacuoles, une augmentation de la pression de turgescence, une tension inverse des parties élastiques de la paroi squelettique et, par conséquent, l’ouverture des ostioles. Les cytokinines peuvent aussi prendre part dans la régulation du comportement des stomates, elles favorisent l’absorption du K+et activent ainsi les H+, K+-ATPases du plasmalemme.
Lorsque les ostioles se referment la teneur en K+, Cl- et malate dans les cellules stomatiques diminue. Ce processus est régulé par le CO2 et l’acide abscissique. Avec de hautes
concentrations de CO2 respiratoire, le milieu intérieur des stomates devient acide ce qui
entraîne une diminution dans l’activité de la PEP-6-carboxylase. L’acide abscissique, dont la teneur augmente avec le déficit hydrique, cause la fermeture des ostioles et perturbe l’échange H+/K+dans les cellules stomatiques.
L’amidon, le glucose, le fructose-1,6-diphosphate et l’APG sont produits lors des réactions sombres de la photosynthèse, dans le cycle de Calvin, surtout. Or, la régulation de ce cycle se fait par l’intermédiaire de la ribulose-1,5-diphosphate-carboxylase et de la fructose-1,6-diphosphatase, enzyme dont l’activité est contrôlée par la concentration en Mg2+du stroma. A l’obscurité le pH et la concentration en Mg2+diminuent ce qui a pour conséquence d’inhiber l’activité catalytique de ces deux enzymes et donc de stopper le cycle de Calvin (Berkaloff et al., 1981).
Vers la moitié des années 70 du dernier siècle, on commençait à supposer que les acides organiques étaient, entre autres, un des facteurs jouant un rôle dans le mouvement des stomates (Mansfield et Jones, 1971). Les différentes hypothèses qui existaient concernent l’acide glycolique, l’acide abscissique, les cations et le CO2. Discutant toutes ces théories, Louguet
(1974) se posait à juste raison la question de savoir si l’accumulation de ces substances dans la plante constitue la cause ou les conséquences du mouvement stomatique.
Les handicaps des mesures agronomiques rappelées ci-dessus à savoir une humidité et une nutrition minérale insuffisantes ou excessives sont considérés parmi les conditions stressantes que peuvent subir un semis. Les conditions stressantes- assez nombreuses- peuvent être de
conséquent et dans la plupart des cas, diminue. Dans le 2ème cas, lorsque les conditions de stressantes sont destructives et ceci peut se passer aussi au début du 1er cas, la plante selon Polevoï (1989) réagit par :
1. une augmentation de la perméabilité membranaire et une dépolarisation de son potentiel électrique.
2. un influx du Ca2+dans le cytoplasme. Ces ions viennent de la paroi squelettique et des compartiments internes : vacuole, mitochondries, etc.
3. une acidification du cytoplasme. 4. un montage de microfilaments.
5. une accélération de l’absorption de O2,de la consommation de l’ATP et de la libération
de radicaux libres.
6. une augmentation des processus hydrolitiques. 7. une activation de la synthèse de protéïnes du stress. 8. une activation de la pompe à protons.
9. une activation de la teneur en éthylène et en acide abscissique. Ces deux substances arrêtent le métabolisme et l’acide abscissique.
Nous avons rappelé plus haut qu’El Kinani (1973) avait observé que la conductance et les paramètres de la réaction bioélectrique enregistrée, après excitation, sous forme de potentiel d’action dépendent de l’apport des éléments minéraux et de l’état hydrique du sol et de l’atmosphère.
Travaillant sur le Maïs, Fromm et Fei (1998) ont constaté que, dans des conditions de sécheresse, l’absorption du CO2 et la transpiration diminuent. Ils ont observé aussi que le stress
hydrique créé autour des racines, induit une propagation dépolarisante du potentiel électrique de surface.
L’impédance, un autre paramètre électrique, est intensément étudiée actuellement chez les organismes vivants.
I.4. Mesure de l’impédance :
Comme nous venons de le voir, les paramètres des potentiels électriques, ci-dessus signalés, dépendent des courants hydroioniques lesquels sont fonction des structures, de l'état physiologique des organismes considérés et des conditions environnantes. Parmi les structures il s'agit surtout des membranes cellulaires qui enveloppent le contenu cellulaire ou limitent des organites, tels que les chloroplastes ou les mitochondries, lieux de processus biochimiques intenses. Un échange ionique presque permanent s'opère entre l'intérieur et l'extérieur de ces organites, sur les membranes desquels il y a une forte accumulation d'ions et de charges électriques. C'est pour cette raison que les membranes sont considérées comme des condensateurs (Taylor, 1965). D'un point de vue chimique les membranes cellulaires sont constituées en grande partie par des lipides et des protéines. Les résidus d'acides gras constituant les lipides sont apolaires et ont une faible constante diélectrique. Ils sont considérés comme de mauvais conducteurs. Les membranes ont, par conséquent, des résistances et des capacités électriques assez élevées (Lehninger, 1972). L’ensemble de ces deux paramètres constitue l’impédance (résistance ohmique + résistance capacitive).
Pour évaluer l’ordre de grandeur de ces deux paramètres, et leur somme, plusieurs schémas de mesure équivalents ont été proposés. Dans ces schémas, le passage du courant électrique continu à travers un système biologique, comme dans le cas des électrolytes, fait naître le
capacité statique et de la capacité de polarisation. Ce dernier phénomène rend difficile la mesure de la capacité, surtout lorsqu'on utilise un courant continu qui, outre la polarisation, entraîne une désintégration du protoplasme. Cet endommagement des cellules fait augmenter leur conductance.
Le courant alternatif, par contre, élimine l’effet de polarisation. On l'utilise en introduisant, aussi dans le schéma équivalent de mesure, une deuxième résistance appelée impédance capacitive. Dans ces conditions et contrairement aux simples électrolytes, la conductance se trouve dépendante de la fréquence. Elle augmente jusqu'à une valeur maximale avec l'augmentation de la fréquence. Au-delà de cette fréquence, appelée fréquence caractéristique (FC), la conductance diminue.
Cette méthode de mesure avec utilisation du courant alternatif et d’une résistance capacitive dans le circuit de mesure a révélé aussi que la résistance change avec l’état physiologique du matériel biologique testé. Elle diminue fortement dès l’apparition des premiers signes de la mort.
Comme nous l’avons rappelé plus haut, la somme des valeurs des résistances d’un système biologique est appelée impédance. En électrotechnique on comprend par impédance un ensemble composé d’une résistance ohmique et d’une réactance. La dernière englobe les résistances capacitives et inductives. Comme dans les systèmes biologiques l’induction n’est pas observée, l’impédance constitue la somme géométrique des résistances ohmique et capacitive.
Voulant expliquer le phénomène d’un point de vue biologique, certains chercheurs ( Repo et al., 2000) considèrent que les propriétés du courant qui passe à travers les espaces apoplastiques (espace de circulation en dehors du cytoplasme cellulaire, et notamment dans les espaces intercellulaire et dans les parois squelettiques des cellules) et symplastique (espace
constitué par les cytoplasmes de l’ensemble des cellules liés par des plasmodesmes) du tissu testé dépendent de la fréquence du courant et des propriétés du tissu.
Comme les membranes cellulaires ont une impédance électrique élevée aux faibles fréquences le courant circule dans l’espace apoplastique lequel détermine l’impédance électrique totale. Dans l’espace apoplastique les ions sont les moyens de transport du courant. Quand la fréquence est grande l’impédance diminue et l’espace symplastique devient conducteur. Les résistances apoplastique et symplastique forment alors un circuit parallèle.
Pour caractériser la conductance électrique par des cellules vivantes on recourt à des schémas équivalents c’est à dire à des combinaisons de résistances ohmique et capacitive qui, à première vue, peuvent modéliser les paramètres électriques cellulaires.
L’expérience a montré que les cellules vivantes et les tissus se caractérisent par une variation de l’impédance lorsqu’on détermine celle-ci à différentes fréquences du courant alternatif. Il est démontré que, dans ces conditions de mesure, on observe une variation des deux composantes de l’impédance, l’active et la réactive. Dans un tel système, si on désigne par Z l’impédance du circuit, ses composantes, appelées aussi et respectivement résistance réelle et résistance imaginaire et dépendantes de la fréquence du courant, sont fonction l’une de l’autre. Si Zi et la partie imaginaire et Zr la partie réelle, on a :
Zi = f(Zr).
C’est cette fonction qui fait ressortir ce que l’on a appelé plus haut fréquence caractéristique (FC) qui marque le sommet d’une parabole. Dans la partie « Matériel et méthodes » page 32 nous nous arrêtons sur le calcul de ces composantes. La courbe obtenue à différentes fréquences est appelée aussi spectre d’impédance.
testé qui sont concernées. Ainsi se sont développées les idées de mesures tomographiques afin d'évaluer, à l'instar des techniques du scanner, les propriétés électriques de différents compartiments. Pour ce faire, des systèmes multi-électrodes ont été développés (Harker et Maindonald, 1994).
Ainsi des mesures de l’impédance électrique ont été élaborées et utilisées pour estimer et évaluer la présence de virus (Greenham et al., 1978), le statut nutritionnel (Greenham et al., 1982), l’état sanitaire général de la plante( Mc Dougall et al., 1987), l’endommagement des fruits (Cox et al., 1993), l’intensité du gel (Repo et al., 1994), la variation structurale des cellules suivant l’induction de l’éthylène par les courants électriques (Inaba et al., 1995), la viabilité des cellules au cours de la congélation croissante (Privé et Zhang, 1996), la maturité des fruits (Harker et Maindonald, 1994; Omoaka et al., 1998), la sensibilité à la salinité (Mancuso et Maindonald, 1996), la capacité de l’enracinement des boutures (Mancuso, 1999).
I.5. Instruments de mesure :
La résistance électrique des cellules végétales, entant que tissus, varie entre 50.103 et 500.103 ohm.cm2 (Clarkson, 1974). Ceci suppose que les appareils de mesures doivent avoir une impédance d’entrée très grande donc des courants d’entrée très faible (10-4 à 10-14A) (Meylan, 1971).
Dans les études récentes, pour la mesure de l’impédance on a utilisé des appareils tels que l’HP4284A ou l’HP16048 (Zhang et Willison, 1992b ; Repo et al., 1994 ; Omaoka et al., 1998 ; Mancuso, 1999 ; Väinölä et Repo, 2000). Les mesures ont été faites entre 42 et 62 fréquences différentes et allant de 20 Hz à 1MHz.
Un problème, non moins important, concerne les électrodes pour capter le signal électrique. Les deux types d’électrodes destinés à être introduits dans les cellules géantes ou à être posés en surfaces et proposés par Osterhout et Harris en 1928 (cités par Meylan, 1971) ne cessent d’être améliorés.
On doit utiliser des électrodes impolarisables (non ionisables), réversibles, isoélectriques, dont la symétrie élimine par compensation la force électromotrice propre (Meylan, 1971). Les électrodes couramment utilisées sont ceux du type Ag-Ag/Cl ou ceux au calomel. Cependant, Zhang et Willison (1992b) et Omaoka et al. (1998) ont utilisé des électrodes en cuivre.
Les mesures des propriétés électriques qui ont fait l’objet des publications que nous avons citées ont été faites sur des organes, dans la plupart des cas, détachés de la plante-mère (Repo et al., 1994 ; Privé et Zhang, 1996 ; Mancuso et Maindonald, 1996 ; Mancuso, 1999).
Il est établi aujourd’hui que toute action mécanique (blessures ou excisions), thermique ou chimique que subit un organisme vivant l’excite et stimule chez lui un nouveau courant hydro-ionique de durée plus ou moins longue. Ceci entraîne des changements électrophysiologiques dans l’organisme testé (Jaffe, 1980; Bacic et Delmer, 1981).
Profitant des facilités qu’offrent les progrès technologiques, nous nous sommes proposés de mesurer in vivo l’impédance d’organes de jeunes plantes grâce à l’utilisation d’électrodes autocollantes qui minimisent l’action mécanique. Nous nous sommes proposés aussi de mesurer l’impédance chez des plantes cultivées dans des conditions stressantes en matière d’apport d’éléments nutritifs et aussi en fonction des conditions hydriques du sol et de l’atmosphère. Nous espérons comparer nos résultats avec ceux obtenus par El Kinani (1973) qui a mesuré les paramètres de la réaction bioélectrique de la feuille de blé, cultivé aussi, dans des conditions stressantes analogues.
II. MATERIEL ET METHODES
II.1. MATERIEL BIOLOGIQUE ……….. 27
II.2. CONDITIONS DE CULTURE ……….. 27
II.2.1. Culture en hydroponie (aquiculture) ……….. 27
II.2.2. Culture sur sable……… 28
II.2.3. Application de conditions atmosphériques particulières ……….. 28
II.2.3.1. Variation de l’humidité relative de l’air (HRA) ………. 28
II.2.3.2. Variation de l'agitation de l'air (AA)………... 30
II.2.4. Application de conditions souterraines particulières.……..…….. 31
II.3. MESURE DE L’IMPEDANCE………31
II.3.1. Appareillage, obtention et traitement des résultats……… 31
II.3.2. Mesures ………...……33
II.4. EVALUATION DE LA CROISSANCE……….35
II.5. CALCUL STATISTIQUE………35
II. MATERIEL ET METHODES :
II.1. Matériel biologique :
Les plantes qui ont servi dans cette étude sont le Potiron (Cucurbita maxima L.), le Tournesol (Helianthus annuus L.), la variété Doukalia du Maïs (Zea mays L.) -largement propagé et appréciée par les agriculteurs pour sa rusticité et son adaptation à la sécheresse- cultivés en salle de culture et l'Oseille (Rumex sp.) acheté sur le marché.
II.2. Conditions de culture :
Dans la salle de culture la photopériode est de 12h par 24h. L'intensité lumineuse de 10000 Lux (125 mol/m2
/s) (George, 1993) est assurée par un ensemble de lampes incandescentes et fluorescentes. Ce mode d’illumination électrique, réchauffant, ne laisse pas l’humidité relative dépasser les 50 à 60%. A l’aide d’un climatiseur, la température est maintenue à 22°C le jour et 15°C la nuit.
Les graines devant être semées sont rincées massivement à l’eau du robinet. Elles sont ensuite maintenues pendant une heure dans l’eau pour imbibition après quoi elles sont mises à germer dans une bassine de faible profondeur entre deux couches de papier filtre mouillées et recouvertes par une plaque de verre. Après trois jours, la plaque et le papier filtre supérieur sont enlevés pour laisser les plantes prendre un port droit.
II.2.1. Culture en hydroponie (aquiculture) :
Huit jours après le semis, les plants en bon état et de tailles semblables sont repiqués dans des pots pourvus de couvercles percés de six trous dont un central servant à l'aération, les cinq autres trous servent à contenir les plantes qui y sont maintenues à l’aide du coton. Seules les racines sont plongées dans la solution nutritive de Knop, dont la constitution, légèrement
Une telle concentration est désignée, dans le présent travail, par dose normale (Kn). Pour étudier l’effet de la concentration sur l’impédance (résistance et capacité) nous avons cultivé les plantes sur Kn/10, Kn, 2xKn et 4xKn.
II.2.2. Culture sur sable :
Les graines mises à germer sont repiquées à raison de 10 graines par pot dès que la radicule perce les enveloppes. Quatre jours plus tard, 5 plantules montrant une croissance normale sont laissées se développer, les autres sont éliminées. L'humidité du sable (Annexe I) est calculée sur la base de sa Capacité de Rétention Maximale (CRM) (Laarabi, 1996). Dans des essais préliminaires, nous avons constaté que 20 et 80% de la CRM étaient défavorables pour le développement des plantes. Nous avons retenu donc 40 et 60%. Le niveau d'humidité est maintenu constant par pesée quotidienne de chaque pot et par un apport d'eau distillée, équivalent aux pertes de poids mesurés. Avant d'être mis dans les pots, le sable est mélangé à la solution nutritive, dont le volume est calculé en tenant compte de la quantité de sable mise dans le pot de culture et du niveau d’humidité désiré.
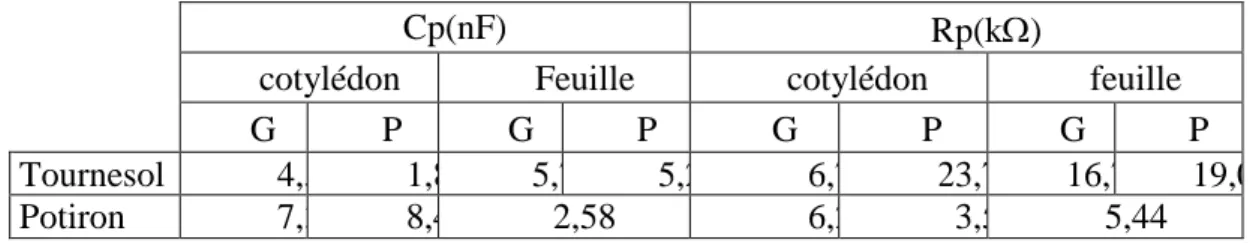
Le jour de l'imbibition des graines est considéré comme premier jour de la vie de nos plants. Les mesures sont faites sur les plantes entières, âgées de 14 jours ou toutes les semaines à partir de cet âge lorsqu'on veut suivre l'évolution des paramètres électriques en fonction de l'âge.
II.2.3. Application de conditions atmosphériques particulières : II.2.3.1. Variation de l’humidité relative de l’air (HRA) :
Pour élever l’humidité relative de l’air, nous avons construit l’enceinte hygrométrique suivante: Les parois internes d’une chambre de test en bois de 0,55 x 0,55 x 0,35 m3 sont tapissées par une bande d’éponge synthétique de 1cm d’épaisseur, recouverte par 2 couches de gaze et alimentée continuellement par un filet d’eau du robinet. L’excès d’eau d’imbibition de cette bande est recueilli sur un fond métallique muni d’un orifice pour évacuation.
La chambre de test est dépourvue de couvercle (voir figure1). Les plantes qui s’y trouvent reçoivent donc le même éclairement que celles qui sont à l’extérieur et qui servent de témoin. La température à l’intérieur de l’enceinte -aussi- ne subit pas de changement. L’éponge et les deux couches de gaze permettant une notable évaporation, l’humidité relative de l’air augmente de 20 à 30% par rapport à l’extérieur de l’enceinte en régime diurne. En lumière éteinte l’humidité relative de l’air devient presque saturante. Dans notre étude les plantes ont subi l’effet de l’élévation de l’humidité relative en régime continu (jour et nuit) pendant 48 heures avant la mesure des paramètres de l’impédance électrique. Ensuite elles sont laissées croître jusqu’à l’âge de 23 jours sous ce régime continu de l’élévation de l’humidité relative.
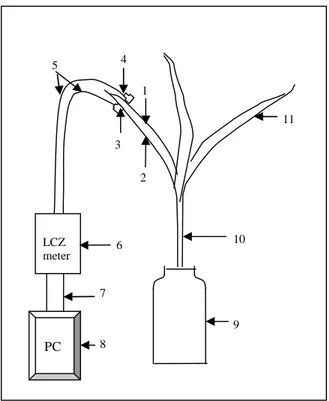
Figure 1. Vue d’ensemble d'un essai.
1- Chambre de test pour abriter les plantes soumises à un niveau élevé d'Humidité Relative de l'Air (HRA) ou à une ventilation.
(3)
(2)
II.2.3.2. Variation de l'agitation de l'air (AA) :
A l’aide d’un ventilateur placé à 10 cm de la paroi de la chambre de test décrite plus haut, nous avons crée un flux d’air qui atteint les feuilles des plantes en pots placés au milieu de la chambre de test. La paroi de cette chambre qui se trouve devant le ventilateur et celle qui lui est opposée sont percées de trous de 3,5 cm de diamètre permettant une circulation dans un sens unique du courant éolien traversant la chambre de test (voir figure 2). Dans nos expérimentations les plantes étaient soumises à la ventilation en régime continu (jour et nuit) pendant 48heures avant la mesure des paramètres de l’impédance électrique. Puis elles sont laissées continuer leur croissance sous ce régime continu de ventilation jusqu’à l’âge de 23 jours.
Figure 2. Dispositifs de culture des plantes et de mesure de leurs paramètres électriques. 1-Ventilateur. 2- Chambre de test. 3- Pot de culture. 4- Appareil de mesure de bioimpédance.
5- PC pour l'acquisition et l'exploitation de données. 6- Orifices permettant le passage du flux éolien.
II.2.4. Application de conditions souterraines particulières :
Pour étudier l’effet d'un inhibiteur du métabolisme (KCN) et de divers autres facteurs du milieu extérieur sur les paramètres électriques de l’impédance (capacité et résistance) divers traitements ont été envisagés. Des plantes de Maïs sont cultivées en hydroponie avec une dose normale (Kn) de la solution de Knop. Au 14èmejour on mesure l’impédance de la 1ère feuille. Cette mesure sert de témoin. Juste après, et sans enlever les électrodes, on ajoute dans chaque pot de culture (de volume 720ml) 10ml de l’une ou l’autre des solutions suivantes :
Cyanure (KCN) - 10mM
Acide acétique (CH3COOH) - 1%
Polyéthylène glycol 200 (PEG 200) - (2%) Chlorure de sodium (NaCl) - 10mM
Une heure plus tard on mesure l’impédance des feuilles chez qui on a déjà mesuré ce paramètre avant le traitement.
II.3. Mesure de l’impédance :
II.3.1. Appareillage, obtention et traitement des résultats :
La plante est modélisée comme une résistance en série ou en parallèle avec un condensateur (figure 3).
Rp
Rs
Ce modèle, appelé simple, donne des informations sur les changements que peut subir un essai comprenant un témoin et différents traitements, et ce par les variations des valeurs des éléments constituant le schéma; en revanche, le modèle appelé double, comprenant une capacité supplémentaire en série, caractérise des tissus morts et ceux ayant subi des dommages mineurs (Zhang et Willison, 1992a; Zhang et al.,1993).
Le système proposé comporte une injection électrique. La caractérisation de la zone ciblée se fait à l'aide de l'impédance complexe Z du circuit, qui comporte une résistance et une réactance. Ces composantes respectivement appelées aussi résistance réelle et résistance imaginaire dépendent de la fréquence du courant alternatif et sont fonction l'une de l'autre.
La fonction Zi = f (Zr) fait ressortir ce que l'on appelle une fréquence caractéristique (FC) marquant le sommet d'une parabole. Les résistances, réelle(Zr) et imaginaire(Zi), sont calculées par les formules suivantes :
Résistance réelle : Zr () = Rs+ [Rp/ (1+ (CRp)2)] Résistance imaginaire : Zi () = CRp2/ (1+ (CRp)2
) En effet :
D’après Laarabi et al. (2002; 2005a, b) l’impédance équivalente du circuit de la figure 3 est : Z = Rs+ [(Rp/jC)/ (Rp+ (1/jC))] = Rs+ [Rp/ (1+jRpC)] = Rs+ [Rp (1-jRpC)/ (1+Rp2C22)] = [Rs+ (Rp/ (1+Rp2C22))]-[jRp2C/ (1+Rp2C22)] = Zr+Zi, où : Zr = [Rs+ (Rp/ (1+Rp2C22))] et Zi = [Rp2C/(1+Rp2C22)]
Pour les faibles fréquences (<100KHz), Rs est négligeable devant [Rp/(1+Rp2
C22)] ;par conséquent ZrRp/ (1+ (RpC)2
Rp: résistance mesurée de la plante C : capacité mesurée de la plante : fréquence de la mesure
L'appareil de mesure est un LCZ meter 2345. Il est calibré par l'utilisation de la correction du circuit open/short pour éliminer l'impédance de polarisation de l'interface des électrodes. La capacité et la résistance sont mesurées dans une gamme de fréquences de 40Hz à 100KHz (34 fréquences). Les mesures sont saisies automatiquement dans un PC relié à l'appareil de mesure par une interface GBIP (IEEE 488), que nous avons programmé (un logiciel de commande et de traitement est développé pour cette étude (Annexe II)) pour balayer la gamme de fréquence lorsqu'on injecte un signal électrique d’amplitude 1V généré par le LCZ meter. Pour capter le signal électrique émis par la plante, nous avons utilisé des électrodes autocollantes utilisées en électrocardiologie et jetables après leur première utilisation. Nous les avons découpées dans des électrodes de marque Schiller Ag. L’endroit servant à la connection avec le LCZ meter est laissé intact. L’électrode ainsi obtenue ressemble à une râpe à fromage de 1cm2 de surface. La manche sert à la connection par l’intermédiaire de fils livrés avec le LCZ meter. Pour une feuille de graminée, par exemple, l’électrode est placée parallèlement à la nervure centrale. La manche et les fils de connection vont vers le sommet de la feuille. La surface des premières feuilles de toutes les plantes testées est supérieure à 1cm2. Ces feuilles ne présentent pas, à l’œil nu, de signes de vieillesse, qui se caractérisent, comme on le sait, par un desséchement.
II.3.2. Mesures :
Le jour de l'imbibition des graines est considéré comme premier jour de la vie de nos plants. Les mesures sont faites sur les plantes entières, âgées de 14 jours ou toutes les semaines à partir
L'organe végétal (cotylédon, feuille ou tige) est placé entre les deux électrodes. Pour la feuille, par exemple, une électrode est placée sur la face supérieure et la deuxième au même endroit, mais sur la face inférieure (fig. 4). La différence de dimensions entre les organes opposés chez une même plante est connue (Güven et Desbies, 1978). Nous avons opté pour la désignation "Grand, G" ou "Petit, P" pour en faire la différence.
Figure 3. Schéma de mesure de l'impédance électrique de la première feuille de Maïs.
1- face supérieure de la première feuille. 2- face inférieure de la première feuille. 3- partie autocollante de l’électrode. 4- zone de connection de l’électrode. 5- fils reliant les 2 électrodes à l'appareil de mesure. 6- LCZ meter. 7- interface IEEE488. 8- PC. 9- pot de culture. 10- épicotyle. 11- deuxième feuille.
LCZ meter PC 2 3 5 7 8 9 10 11 6 4 1
II.4. Evaluation de la croissance :
Les plantes qui ont servi aux mesures des paramètres électriques de l’impédance sous les différentes conditions sont laissées continuer leur développement soit en présence de l'humidité relative élevée ou du vent soit dans leurs conditions anciennes de culture (pour les plantes cultivées à différentes doses de la solution de Knop) soit dans les nouvelles conditions de culture (en présence de KCN, d’acide acétique, de polyéthylène glycol 200 ou de NaCl) jusqu’à l’âge de 23 jours. les différentes conditions sont laissées pour continuer leurs développements. A cet âge nous avons mesuré, à l’aide d’une règle graduée, la plus grande longueur (L) et la plus grande largeur (l) de la deuxième feuille étant donné sa forme ellipsoïdale. La croissance de la plante est évaluée sur la base de l’indice de vigueur (IV) de la 2èmefeuille que nous avons défini comme étant le produit de la plus grande longueur (L) par la plus grande largeur (l) :
IV(cm2
)=L x l.
II.5. Calcul statistique :
Les données que nous avons présentées sont sous forme de moyenne ± l’écartype (à l’aide d’un logiciel statistique SPSS) qui sont calculés sur la base du nombre de répétitions (n) que nous avons pu faire ((n3) pour chaque échantillon) sans que les mesures soient trop étalées dans le temps (chaque balayage des 34 fréquences dure environ 2 min).
III. RESULTATS
III.1. ANALYSE SPECTROMETRIQUE, IN VIVO, DE L'IMPEDANCE
DES ORGANES AERIENS DE CERTAINES PLANTES MONO- ET
DICOTYLEDONES
………... ………….37III.2. ANALYSE SPECTROMETRIQUE, IN VIVO, DE L'IMPEDANCE
DE LA PREMIERE FEUILLE DE MAÏS EN FONCTION DES
CONDITIONS HYDRIQUES DU SOL ET DE L’ATMOSPHERE
…. 49III.3. EFFET DES CONDITIONS STRESSANTES SOUTERRAINES SUR
L’IMPEDANCE ELECTRIQUE FOLIAIRE CHEZ DE JEUNES
III.1. ANALYSE SPECTROMETRIQUE, IN VIVO, DE L'IMPEDANCE
DES ORGANES AERIENS DE CERTAINES PLANTES MONO- ET
DICOTYLEDONES.
III.1.1. Comparaisons électrospectromètriques entre les espèces testées
……. 38III.1.2. Comparaisons électrospectromètriques entre les organes aériens
d'une même espèce
……….…. 42III.1.3. Comparaisons électrospectromètriques entre les organes opposés
d'une même plante
……….…………. 43Cette première partie représente les résultats préliminaires qui nous ont permis de choisir l’organe reflétant le mieux l’état physiologique de la plante. Le choix de l’espèce, de son organe et de son âge seront justifiés plus loin.
Nous avons vérifié la reproductibilité des mesures en utilisant des résistances et des capacités connues. Les résultats exposés ci-dessous représentent la moyenne des mesures faites sur 3 plantes.
Ces résultats nous permettent de procéder à des comparaisons électrospectromètriques entre les espèces testées, entre les organes d'une même plante, entre les organes opposés d'une même plante et entre les différents âges des différentes espèces.
III.1.1. Comparaisons électrospectromètriques entre les espèces testées :
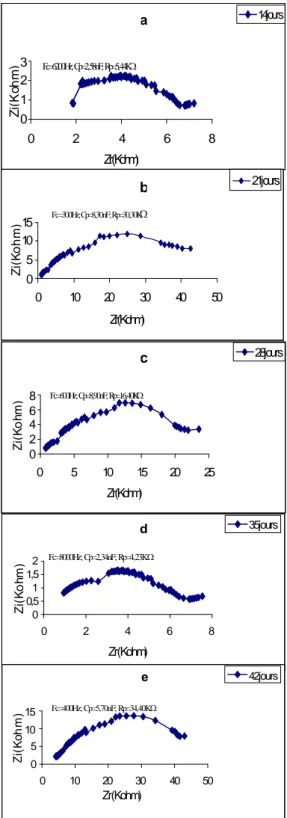
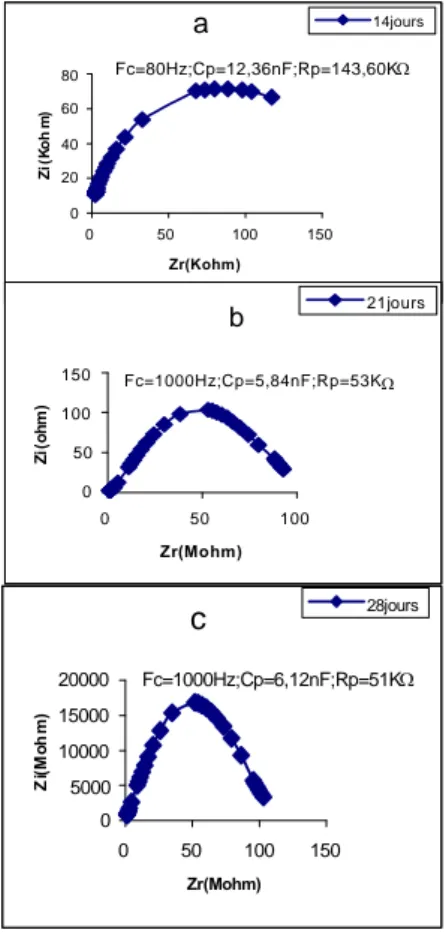
Les mesures sont faites sur la tige et la première feuille chez le Tournesol, le Potiron et le Maïs âgés de 14 jours.
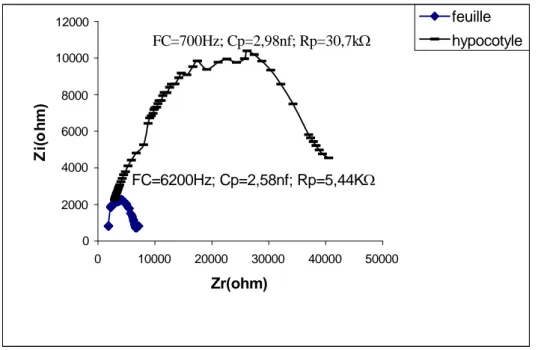
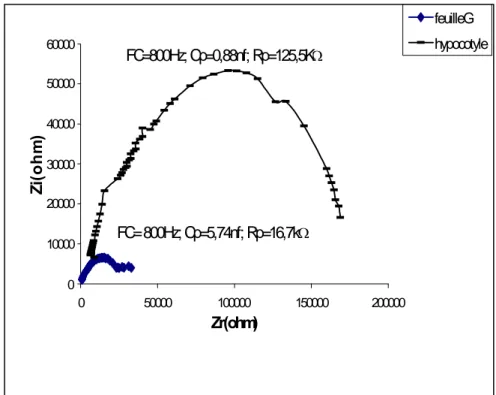
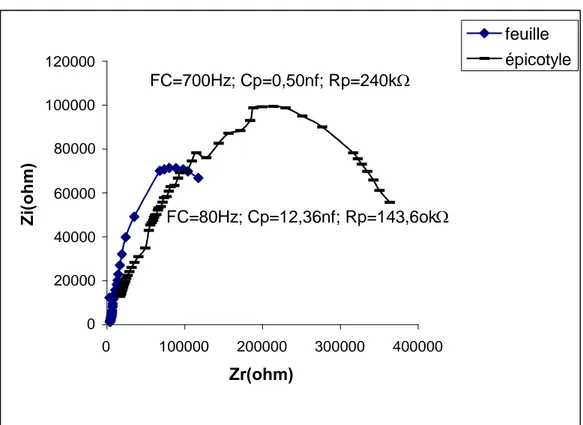
Les résultats de mesure sont présentés sur les figures 5, 6 et 7 sous forme de courbes spectrométriques. Sur ces courbes chaque point est calculé en fonction de la fréquence de mesure, de la résistance parallèle (Rp) et de la capacité parallèle (Cp) mesurées. Les paramètres électriques mesurés, exprimés sous forme de courbes et caractérisant les tissus, font ressortir la grande différence structurale qui existe entre la feuille et la tige et ce, indépendamment de l'espèce testée. De plus, une nette différence dans l’amplitude existe aussi entre les courbes spectrométriques de bioimpédance (CSB) des feuilles dicotylédones d'une part (fig. 5, 6) et celles de l'espèce monocotylédone de l'autre (fig. 7).
Les CSB de la tige du Potiron (fig. 5) et du Maïs (fig. 7), par comparaison à celle du Tournesol (fig. 6), accusent une certaine irrégularité aux environs de la fréquence caractéristique (sommet de la courbe). Nous pensons que cette irrégularité est due au facteur "âge" étudié plus loin.
En comparant les paramètres des impédances des feuilles des différentes espèces testées nous constatons que la feuille du Maïs accuse la plus grande capacité (ou accumulation de charges électriques) et la plus grande résistance (figure 5, 6 et 7).
Le Tournesol et le Potiron sont des plantes en C3chez qui la fixation du gaz carbonique (CO2)
aboutit à la formation de l'acide phosphoglycérique. Le Maïs, lui, est une plante en C4chez qui
cette première étape de fixation de CO2 aboutit à la formation d'acides dicarboxyliques
(oxaloacétique, malique, aspartique). Les données de l'impédance de la feuille de Maïs nous ont incités à mesurer celle d'une plante se distinguant par une grande teneur en acides, en l'occurrence l'Oseille.
Figure 5 : Impédance de l'hypocotyle et de la première feuille de potiron âgé de 14 jours.
0 2000 4000 6000 8000 10000 12000 0 10000 20000 30000 40000 50000 Zr(ohm) Z i( o h m ) feuille hypocotyle FC=700Hz; Cp=2,98nf; Rp=30,7k FC=6200Hz; Cp=2,58nf; Rp=5,44K
Figure 6 :Impédance de l'hypocotyle et de la première feuille (G) du tournesol âgé de 14 jours. FC=800Hz; Cp=5,74nf; Rp=16,7k 0 10000 20000 30000 40000 50000 60000 0 50000 100000 150000 200000 Zr(ohm) Zi (o h m ) feuilleG hypocotyle FC=800Hz; Cp=0,88nf; Rp=125,5K
Figure 7 : Impédance de l'épicotyle et de la première feuille de maïs âgé de 14 jours. 0 20000 40000 60000 80000 100000 120000 0 100000 200000 300000 400000 Zr(ohm) Z i( o h m ) feuille épicotyle FC=80Hz; Cp=12,36nf; Rp=143,6ok FC=700Hz; Cp=0,50nf; Rp=240k