LA GLUCURONIDATION DES ACIDES BILIAIRES
EST UNE CIBLE PHARMACOLOGIQUE
PROMETTEUSE POUR LE TRAITEMENT DES
PATHOLOGIES CHOLESTATIQUES
Thèse
Martin Perreault
Doctorat en pharmacie
Philosophiae doctor (PhD)
Québec, Canada
© Perreault Martin, 2013
iii
Résumé
Introduction : La glucuronidation a pour effet de rediriger l’élimination des acides biliaires (AB) vers l’urine. En état cholestatique, caractérisé par une interruption du flux biliaire, ce métabolisme pourrait représenter une cible pharmacologique car il peut être stimulé par certains agonistes de récepteurs nucléaires. Le rein exprime aussi toutes les protéines œuvrant cette voie biologique, donc, cet organe est suspecté comme étant un joueur prédominant dans l’homéostasie des AB lors de cholestase. Objectif 1 : Évaluer l’effet de la glucuronidation sur la toxicité des AB. Après avoir déterminé la toxicité différentielle des AB dans le modèle cellulaire hépatique HepG2 en utilisant des tests moléculaires classiques (mesure de l’activité de la caspase 3, évaluation de la nécrose et de l’apoptose par FACS et mesure de la prolifération cellulaire par MTS et BCA), nous avons démontré que la glucuronidation des AB diminuait leurs propriétés pro-nécrotique et pro-apoptotique, ainsi que leur toxicité générale. Objectif 2 : Caractériser la glucuronidation hépatique et rénale des AB. L’expression (protéine et ARNm) des UGT a été quantifiée dans le foie et le rein humain. Ensuite, les constantes cinétiques de la glucuronidation rénale et hépatique des AB ont été déterminées, ce qui a mené à l’exposition des propriétés allostériques de ces réactions. Objectif 3 : Caractériser la glucuronidation des AB effectuées par les membres de la famille des UGT2A. Des microsomes surexprimant soit l’UGT2A1, l’UGT2A2 ou l’UGT2A3 ont été utilisés en essais enzymatiques afin d’extrapoler leurs constantes cinétiques de la glucuronidation des AB. Les enzymes UGT2A1 et UGT2A2 ont démontrées une excellente activité de glucuronidation des AB. Conclusion : La glucuronidation des AB diminue leur toxicité et semble être effectuée par un complexe oligomérique. Le mécanisme enzymatique catalysant la glucuronidation des AB dans le foie et le rein présente des différences majeures, mais offre un rendement similaire en état physiologique normal. Cependant, le rein possède une meilleure capacité d’adaptation à une surcharge d’AB. En somme, les résultats présentés indiquent que la glucuronidation rénale et hépatique des AB est une cible thérapeutique pour le traitement de la cholestase, cependant, elle doit être mieux caractérisée afin d’être optimisée et utilisée.
v
Abstract
Introduction: Glucuronidation redirect bile acids (BA) elimination toward the urine. During cholestasis, a condition characterized by a bile flow interruption, this metabolism may represent a pharmacological target, because it can be stimulated by numerous nuclear receptor agonists. The kidney also expresses all proteins involved in this biological pathway, therefore, this organ is suspected as a predominant player in BA homeostasis during cholestasis. Objective 1: Evaluate the effect of glucuronidation on BA toxicity. After determining the differential BAs toxicity in the selected liver model cell (HepG2) using molecular tests (caspase 3 activity measurement, necrosis and apoptosis evaluation by FACS and proliferation assessment using MTS reduction and total protein content evaluated by BCA), we have demonstrated that BA glucuronidation decreased their pro-necrotic and pro-apoptotic properties, and, therefore, their general toxicity. Objective 2: Characterizing the hepatic and renal BA glucuronidation. The expression (protein and mRNA) of various UGT was quantified in human liver and kidney. Then, the kinetic constants for BA glucuronidation in human kidney and liver extracts were determined, which led to the exposure of the allosteric properties of these reactions. Objective 3: Characterizing BA glucuronidation carried out by UGT2As. Microsomes over-expressing either UGT2A1, UGT2A2 or UGT2A3 have been used in enzyme assays to extrapolate the kinetic constants for BA glucuronidation by these enzymes. UGT2A1 and UGT2A2 Glucuronidation decreases BAs toxicity and seems to be performed by a oligomeric enzyme complex. Major differences have been observed between the liver and kidney enzymatic mechanism of BA glucuronidation, but they offers similar performance in normal physiological state. However, the kidney has a better ability to adapt to an overload of BA. In sum, the results presented in this thesis indicate that renal and hepatic BA glucuronidation is a therapeutic target for the treatment of cholestasis, however, it must be better characterized and optimized in order to be used.
vii
Avant-Propos
Plusieurs analyses quantitatives ont été effectuées à l’aide de la spectrométrie de masse et de la chromatographie liquide sous haute pression (HPLC-MS/MS) afin de quantifier les acides biliaires glucuronides (AB-G) produits lors des diverses expériences contenues dans ce document. M. Patrick Caron a contribué à tous mes articles scientifiques car il est le concepteur de la méthode analytique visant la quantification des AB-G par HPLC-MS/MS [1]. Ensuite, M. Jocelyn Trottier a aussi eu un rôle majeur dans la production des résultats sujets de ce document, il a effectué toutes les analyses de quantification des AB-G par HPLC-MS/MS.
Quatre stagiaires m’ont assisté dans mes travaux pratiques de Doctorat : Mme Magali Maudoux, Mme Viktoria Mühlbauer, Mme Amélie Dallaire-Théroux et M. Louis Gauthier-Landry. Mme Maudoux m’a assisté pour les immunobuvardages quantifiant les diverses UGT dans le rein et le foie humain (figure 2, chapitre 5). Mme Mühlbauer a travaillé à l’optimisation des stratégies de PCR quantitatif utilisées subséquemment pour quantifier l’expression des transcrits des différentes UGT dans le foie et le rein humain (table 3 et supplemental material 8 du chapitre 5). Mme Dallaire-Théroux a effectué le travail d’optimisation des essais enzymatiques visant à caractériser l’activité de glucuronidation des acides biliaires par les membres de la famille des UGT2A (chapitre 4). M. Louis Gauthier-Landry m’a assisté pour une partie des essais enzymatiques visant à caractériser l’activité de glucuronidation des acides biliaires par les membres de la famille des UGT2A et à caractériser les propriétés allostériques de la glucuronidation hépatique et rénale des acides biliaires.
Les manipulations qui ont menées à l’article « Glucuronidation reduces bile acids hepatotoxicity but minimally contributes to their removal in urine during biliary obstruction. » ont principalement été effectuées par l’auteur de cette thèse et le Dr Jocelyn
Trottier. J’ai effectué toutes les manipulations qui sont présentées dans les figures 2 à 5, tandis que le Dr Trottier a effectué et analysé les dosages urinaires de la figure 1. De plus, le Dr Trottier a analysé par HPLC-MS/MS le contenu cellulaire et du milieu de culture en
viii
AB-G pour la figure 5. Ensuite, j’ai analysé tous les résultats des figures 2 à 5. J’ai écrit le manuscrit final conjointement avec mon directeur de recherche; le Dr Barbier.
L’article intitulé « Urinary elimination of bile acid glucuronides under severe cholestatic situations: contribution of liver and kidney glucuronidation reactions. » est l’œuvre de 5 auteurs. Premièrement, le Dr Barbier a conçu ce projet ainsi que son design expérimental. J’ai effectué toutes les expériences de PCR quantitatif en temps réel et j’ai supervisé ma stagiaire pour l’optimisation de ces méthodes. Ensuite, les analyses d’expression protéique ont aussi été réalisées par l’auteur de cette thèse. Les anticorps utilisés pour les expériences d’immunobuvardage proviennent tous, à l’exception de l’anti-UGT1A4, du Dr Alain Bélanger (Université Laval, Québec, Canada). Pour ce qui est de l’anti-UGT1A4, il provient du Dr B. Burchell (University of Dundee, Dundee, Scotland). L’expression protéique de l’UGT1A3 mesurée par spectrométrie de masse a été réalisée par la plateforme protéomique du centre de recherche du CHUL. J’ai produit tous les essais enzymatiques qui ont servi à définir les constantes cinétiques de la glucuronidation rénale et hépatique des acides biliaires à l’aide de fractions protéiques humaines provenant de la compagnie Xenotech. La quantification du contenu en AB-G par HPLC-MS/MS a été faite par M. Jocelyn Trottier à l’aide de la méthode développée par M. Patrick Caron. Finalement, l’analyse de tous les résultats est de mon cru et l’écriture de l’article scientifique a été faite conjointement; moi et le Dr Barbier.
L’article portant sur la caractérisation de la glucuronidation des acides biliaires par les membres de la famille des UGT2A, intitulé « The human UDP-glucuronosyltransferase UGT2A1 and UGT2A2 enzymes are highly active in bile acid glucuronidation. », a été
réalisé en utilisant des extraits protéiques de cellules d’insecte Sf9 infectées par baculovirus afin qu’elles surexpriment une UGT. Ces fractions protéiques ont été produites en Finlande, dans le laboratoire du Dr Moshe Finel. Mme Amélie Dallaire Théroux a effectué l’optimisation du tampon d’essai enzymatique. Ensuite, avec l’aide du stagiaire Louis Gauthier-Landry, j’ai effectué toutes les expériences d’essais enzymatiques de cet article. La quantification du contenu en AB-G par HPLC-MS/MS a été faite par M. Jocelyn Trottier à l’aide de la méthode développée par M. Patrick Caron. J’ai effectué toutes les
ix analyses de l’article et j’ai écrit le manuscrit final conjointement avec mon directeur de recherche; le Dr Barbier.
L’article « Hepatic and renal glucuronidation of bile acids is differentially affected by exo- and endogenous UDP-glucuronosyltransferase substrates. » est une des plus grandes fiertés survenant de mes travaux de Doctorat. D’ailleurs, les résultats présentés dans cet article ont mérité un prestigieux prix lors du congrès ISSX en novembre à Dallas, ils ont été choisis parmi les 6 meilleurs de tous les travaux étudiants du congrès. Lorsque nous avons réalisé que l’UGT1A3 n’était pas exprimée dans le rein humain et que ce dernier possédait une activité de formation des acides biliaires ester-glucuronides comparable à celle du foie, le Dr Barbier m’a donné carte blanche au niveau intellectuel pour identifier l’UGT responsable de ce métabolisme dans le rein humain. Donc, pour ce qui est de l’élaboration de ce projet de recherche, il est entièrement de mon cru. Ensuite, j’ai effectué toutes les expériences d’essais enzymatiques de cet article avec l’aide de Louis Gauthier-Landry, stagiaire dans notre équipe de recherche à ce moment. La quantification du contenu en AB-G par HPLC-MS/MS a été faite par M. Jocelyn Trottier à l’aide de la méthode développée par M. Patrick Caron. J’ai effectué toutes les analyses et j’ai écrit le manuscrit final conjointement avec mon mentor; le Dr Barbier.
xi
Remerciement
Bien sûr, je tiens à remercier mon laboratoire d'accueil lors de mon doctorat. Premièrement, la majeur partie de ces remerciements son adressés à mon directeur de recherche: Olivier Barbier. Vient ensuite les assistants de recherche: Mélanie Verreault et Jocelyn Trottier. Finalement, le reste est pour les nombreux étudiants que j'ai eu la chance de côtoyer pendant mes études supérieures.
Ensuite, je me dois de remercier ma femme, Emmanuelle, qui a su se trouver des activités solitaires car je n'ai pas été suffisamment présent pendant mes études doctorales. Aussi, je te remercie pour mes deux fils, James Aaron et Derek. C’est pour eux que j'ai fais ces études afin de leur apporter une preuve que tous les rêves sont possibles et que lorsque l'on désire vraiment quelque chose, un effort soutenu peut nous mener à ce but. Aussi, je me dois de remercier mes parents pour leur support moral, non seulement pendant mes études, mais plutôt depuis le début de mon existence. Finalement, je veux remercier mes deux belles-familles, qui m'ont encouragé et su s'occuper de ma famille à ma place lorsque je devais faire des heures de fou. De plus, je dois remercier spécialement Mme Anye Lemay, qui a pris son courage à deux mains et a effectué plusieurs corrections dans ce manuscrit.
Table des matières
Résumé ... ii
Abstract ... v
Avant-Propos ... vii
Table des matières ... xii
Liste des abréviations ... xv
Liste des tableaux ... xvii
Liste des figures ... xx
Chapitre 1 :Introduction ... 1
1.1. Glucuronidation des acides biliaires et importance des niveaux sériques et urinaires des acides biliaires glucuronides chez l’homme ... 2
1.2. Modulation de la glucuronidation hépatique des acides biliaires par les récepteurs nucléaires ... 4
1.3. But et objectifs du projet de recherche ... 4
2. Les acides biliaires ... 5
2.1. Les acides biliaires sont importants dans l’absorption intestinale des composés liposolubles de l’alimentation ... 6
2.2. La synthèse des acides biliaires ... 7
2.2.1. La synthèse des acides biliaires primaires ... 8
2.3. Le cycle entérohépatique des acides biliaires ... 16
2.3.1. Transporteurs hépatocytaires ... 17
2.3.2. Les canules biliaires ... 23
2.3.3. La vésicule biliaire ... 24
2.3.4. Modifications bactériennes pour former les acides biliaires secondaires ... 24
2.3.5. Autres modifications des acides biliaires par les bactéries du tractus intestinal .... 26
2.3.6. Les entérocytes ... 27
2.3.7. Élimination des acides biliaires dans les fèces ... 29
2.3.8. Retour au foie des acides biliaires ... 29
2.3.9. Oxydation des acides biliaires ... 31
2.3.10. Réduction des formes kétos des acides biliaires ... 35
2.4. Élimination urinaire des acides biliaires ... 35
2.4.1. Transport basolatéral des acides biliaires dans les hépatocytes. ... 37
2.4.2. Concentration intra-hépatique en acides biliaires ... 38
2.4.3. Transport des acides biliaires dans le sang ... 38
2.4.4. Comparaison des concentrations intra-hépatique et sanguine en acide biliaire ... 40
2.4.5. Filtration glomérulaire des acides biliaires ... 40
2.4.6. Transport des acides biliaires dans les cellules de tubule proximal rénal ... 41
2.4.7. Concentrations urinaires en acides biliaires chez l’homme ... 41
2.4.8. Comparaison des concentrations sanguine et urinaire en acide biliaire ... 42
2.5. Conjugaison des acides biliaires à des groupements hautement polaires... 42
2.5.1. Concentration plasmatique, urinaire et biliaire des formes d’acides biliaires conjugués à un groupement hautement polaire ... 43
xiii
2.6. Régulation de la synthèse et de la conjugaison des acides biliaires ... 54
2.6.1. Récepteurs nucléaires ... 55
2.6.2. Le récepteur couplé à une protéine G TGR5 ... 60
2.6.3. Le « fibroblast growth factor » 19 (FGF19) et le récepteur de « fibroblast growth factor » 4 (FGFR4) ... 61
2.6.4. Autres modes de régulation ... 63
2.6.5. Cellules de Kupffler ... 63
3. Maladies hépatiques reliées aux acides biliaires ... 64
3.1. Toxicité des acides biliaires ... 65
3.1.1. Toxicité extra-hépatique des acides biliaires ... 65
3.1.2. Toxicité hépatique des acides biliaires ... 66
3.1.3. Protection des types cellulaires hépato-biliaires contre les effets toxiques des acides biliaires ... 69
3.1.4. La cholestase ... 69
3.1.5. Traitement de la cholestase ... 76
Chapitre 2: Problématique et hypothèse générale ... 80
1. Problématique ... 81
2. Hypothèse générale ... 81
Chapitre 3: La glucuronidation des acides biliaires diminue leur toxicité ... 83
1. Données préliminaires ... 84
2. Hypothèse ... 84
3. Objectifs spécifiques de l’étude ... 84
4. Résumé de l’article: ... 85
5. Article scientifique : Glucuronidation reduces bile acids hepatotoxicity but minimally contributes to their removal in urine during biliary obstruction. ... 86
6. Discussion ... 113
Chapitre 4: La glucuronidation des acides biliaires par les membres de la famille UGT2A ... 116
1. Données préliminaires ... 117
2. Hypothèse ... 117
3. Objectif spécifique de l’étude ... 118
4. Résumé de l’article: ... 118
5. Article scientifique : The human UDP-glucuronosyltransferase UGT2A1 and UGT2A2 enzymes are highly active in bile acid glucuronidation. ... 119
6. Discussion ... 139
La glucuronidation rénale des acides biliaires ... 144
1. Données préliminaires ... 145
2. Hypothèse ... 147
3. Objectifs spécifiques de l’étude ... 147
4. Résumé de l’article: ... 147
5. Article scientifique : Urinary elimination of bile acid glucuronides under severe cholestatic situations: contribution of liver and kidney glucuronidation reactions. ... 149
6. Discussion ... 202
La glucuronidation des acides biliaires semble être une réaction allostérique, mais dont le mécanisme de glucuronidation diffère entre le foie et le rein ... 208
xiv
1. Données préliminaires ... 209
2. Hypothèse ... 210
3. Objectif spécifique de l’étude ... 210
4. Résumé de l’article: ... 210
5. Article scientifique : Hepatic and renal glucuronidation of bile acids is differentially affected by exo- and endogenous UDP-glucuronosyltransferase substrates. ... 212
6. Discussion ... 250
Chapitre 7: Discussion générale du projet de recherche et conclusion ... 252
1. Homéostasie des acides biliaires ... 253
1.2. Importance de la glucuronidation des acides biliaires pour le contrôle de l’homéostasie de ces molécules ... 254
1.3. Importance de la glucuronidation extrahépatique des acides biliaires dans l’homéostasie de ces molécules ... 255
1.4. Effets de la glucuronidation des acides biliaires sur l’élimination de ces molécules ... ... 255
1.5. Perspectives expérimentales pour l’étude du transport rénale des acides biliaires glucuronides ... 256
2. Mécanisme enzymatique de la glucuronidation des acides biliaires ... 257
2.2. Types de cinétique obtenus pour la glucuronidation des acides biliaires ... 257
2.3. Caractère allostérique de la glucuronidation des acides biliaires ... 259
2.4. Modification post-transcriptionnelle des UGT et implication dans la glucuronidation des acides biliaires ... 261
2.5. Perspective expérimentale pour l’étude des mécanismes enzymatiques gouvernant la glucuronidation rénale et hépatique des acides biliaires ... 261
3. Défis expérimentaux concernant l’étude de la glucuronidation ... 262
3.2. Méthodes pouvant être utilisées pour confirmer les observations obtenues à l’aide d’un criblage enzymatique utilisant des microsomes ou des bacculosomes ... 263
3.3. La glucuronidation hépatique et rénale des acides biliaires est un modèle de choix pour l’étude des mécanismes de la glucuronidation ... 264
4. Développement d’un traitement contre la cholestase basé sur la stimulation de la glucuronidation des acides biliaires par des agonistes pharmaceutiques de récepteurs nucléaires ... 265
4.2. La glucuronidation extrahépatique pourrait être aussi une cible thérapeutique potentielle pour le traitement de la cholestase ... 267
4.2.1. Importance de la glucuronidation rénale des acides biliaires pour le traitement de la cholestase ... 268
4.3. La caractérisation du transport des acides biliaires glucuronides doit être accomplie pour exploiter entièrement la glucuronidation des acides biliaires pour le traitement de la cholestase ... 268
5. Conclusion ... 269
xv
Liste des abréviations
AB = acide biliaire
AB-AA = acide biliaire conjugué à un acide aminé AB-G = acide biliaire glucuronide
ABH = acide biliaire hydrolase
AB-S = acide biliaire conjugué à un groupement sulfate ACOX2 = acyl-CoA oxydase-2
AKR1C4 = 3α-hydroxystéroïde déshydrogénase AKR1D1 = Δ4-3-oxostéroïde- 5β-réductase AMACR = 2-méthylacyl-CoA racémase
ASBT = apical sodium Na+-dependent bile salt transporter
BACAT = acide biliaire coenzyme A : acide aminé N-acyltransférase BACTE = acide biliaire coenzyme A thioestérase
BAL = acide biliaire coenzyme A ligase BSEP = bile salt export pump
CA = acide cholique
CAR = constitutive androstane receptor CDCA = acide chénodéoxycholique CH25H = 25-CHOL-hydroxylase CHOL = cholesterol
C27 3β-HSD = 3β-hydroxy-Δ5-C27-stéroid oxydoreductase
CoA = coenzyme A
CTPR= cellule de tubule proximal rénal CYP = cytochrome P450
CYP46A1 = cholesterol-24S-hydroxylase DCA = acide déoxycholique
FGF = fibroblast growth factor
FGFR = récepteurs de fibroblast growth factor FXR = farnesoid X receptor
HCA = acide hyocholique
HDCA = acide hyodéoxycholique HEP = hépatocyte
HNF4 = hepatocyte nuclear factor 4
HPLC-MS/MS = chromatographie liquide sous haute pression couplée à la spectrométrie de masse
11β-HSD1 = 11β-hydroxystéroïde déshydrogénase 1 7α-HXC = 7α-hydroxycholestérol
GAB = acide biliaire conjugué à la glycine GST = glutathione-S-transférase
i2 = isoforme 2
IBAP = intestinal bile acid binding protein
IL-1β = interleukine-1β LCA = acide lithocholique
xvi
LCB = ligation du conduit biliaire LXRα = liver X receptor α
MAPK/JNK = mitogène activated protein kinase MDR3 = multidrug resistance 3
MRP = multidrug resistance-associated protein NRF2 = Nuclear factor-E2-related factor 2
NTCP = sodium (Na+) taurocholate cotransporting polypeptide OATP = organic anion-transporting polypeptides
OSTα/β = organic solute transporter alpha-beta
PAPS = 3´-phosphoadénosine 5´-phosphosulfate PBC = cirrhose biliaire primitive
PSC = cirrhose sclérosante primaire PXR = pregnane X receptor
RE = réticulum endoplasmique RN = récepteurs nucléaires
ROS = espèces d’oxygène réactives RXRα = retinoic X receptor α
SHP = short heterodimer partner PPARα = peroxisome proliferator-activated receptor α SREBP-c = sterol response element binding protein-c
SULT = sulfotransférases
TAB = acide biliaire conjugué à la taurine TNF-α = tumor nercrosis factor α
UDCA = acide ursodéoxycholique
UDPGA = acide uridine 5’-diphosphateglucuronique UGT = uridine 5’-diphosphate-glucuronosyltransférases VDR = récepteur de la vitamine D
xvii
Liste des tableaux
Chapitre 1 :
Tableau 1 : pourcentage des différentes espèces d’acides biliaires dans le sérum humain. Tableau 2 : Pourcentage en acides biliaires glucuronides et sulfates dans la bile, l’urine et le sérum humain.
Tableau 3 : Résumé des effets des récepteurs nucléaires FXR, PPARα, LXRα, PXR, CAR, VDR et NRF2 sur le métabolisme hépatique des AB.
Chapitre 4 :
Tableau 4.1 : Paramètres cinétiques de la glucuronidation des AB par l’UGT2A3. Chapitre 5 :
Tableau 5.1 : Corrélation des concentrations d’acides biliaires glucuronides dans le plasma et l’urine de patients cholestatiques.
xx
Liste des figures Chapitre 1 :
Figure 1 : Mécanisme enzymatique de la glucuronidation du CDCA en position 24. Figure 2: Structure des différents acides biliaires.
Figure 3 : Les acides biliaires présentent une polarité planaire.
Figure 4 : Initiation de la synthèse des acides biliaires par la voie classique et la voie alternative.
Figure 5 : Étape de modification du squelette stéroïdien dans la synthèse des acides biliaires.
Figure 6 : L’oxydation et le raccourcissement de la chaîne latérale pendant la synthèse d’acides biliaires.
Figure 7 : Transporteurs impliqués dans le cycle entéro-hépatique des acides biliaires. Figure 8 : Formation des micelles mixtes d’acides biliaires.
Figure 9 : Mécanisme enzymatique impliqué dans le maintient de l’intégrité de la membrane apicale des hépatocytes.
Figure 10 : Mécanisme proposé par Ridlon et al. pour la 7α-déhydroxylation des acides biliaires primaires menant à la formation des acides biliaires secondaires.
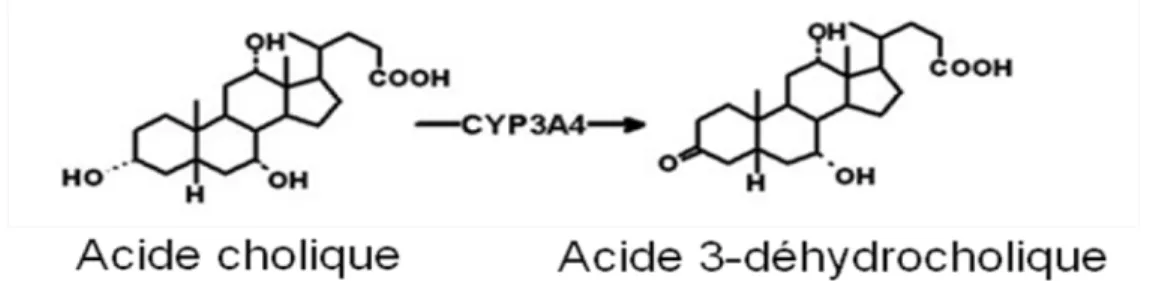
Figure 11 : Métabolisme de l’acide cholique menant à la formation de l’acide 3-déhydrocholique.
Figure 12 : Réactions d’oxydation hépatique survenant sur l’acide chénodéoxycholique. Figure 13 : Métabolisme oxydatif hépatique de l’acide lithocholique.
Figure 14 : Transporteurs impliqués dans l’élimination urinaire des acides biliaires. Figure 15 : Nomenclature de la famille des UGT.
Figure 16 : Structure du gène UGT1.
Figure 17 : Résultats de criblages enzymatiques identifiant les UGT impliquées dans la glucuronidation des acides biliaires.
Figure 18: Schéma résumant les principales étapes de l’activation des récepteurs nucléaires.
Figure 19 : Régulation de la synthèse des acides biliaires par le « farnesoid X receptor »
via la répression de la transcription du gène CYP7A1.
Figure 20 : Mode de régulation de l’expression du CYP7A1 n’impliquant pas le « farnesoid X receptor ».
Figure 21 : Les acides biliaires causent l’apoptose des hépatocytes par la voie intrinsèque, extrinsèque et le stress du réticulum endoplasmique.
xxi Figure 23 : Coupe histologique d’un foie d’un patient atteint de PSC.
Chapitre 4 :
Figure 4.1 : Optimisation du tampon d’essai enzymatique. Chapitre 5 :
Figure 5.1 : Les cellules de tubule proximal rénal humain primaire expriment la batterie enzymatique nécessaire pour effectuer la glucuronidation des acides biliaires.
Figure 5.2 : Accumulation et stabilité des dérivés glucuronides du CDCA, du DCA et du LCA dans les cellules HepG2.
Figure 5.3 : Les cellules RPTEC expriment l’UGT1A3 au niveau de l’ARNm mais n’expriment pas la protéine UGT1A3.
xxii
Chapitre 1
Introduction
1. Introduction
Les acides biliaires (AB) sont des molécules détergentes endogènes produites à partir du cholestérol (CHOL). Leur principale fonction est d’aider à la solubilisation du CHOL, des vitamines liposolubles (A, D, E et K) et des lipides dans le tractus gastro-intestinal afin de favoriser leur absorption. Ce faisant, il est reconnu que la synthèse et la réabsorption intestinale des AB sont un facteur majeur dans l’homéostasie du CHOL. D’ailleurs, la synthèse d’AB représente la majeure partie du catabolisme du CHOL chez l’humain (1).
Le concept que les AB sont aussi des molécules signalisatrices a émergé en 1999 quand trois laboratoires différents ont rapporté que ces derniers étaient capables d’activer le récepteur nucléaire (RN) «Farnesoid X Receptor» (FXR) (1). Depuis, la recherche sur les AB a subi un regain d’attention. Plusieurs gènes impliqués dans plusieurs mécanismes biologiques ont été découverts comme étant régulés par les AB.
Dans un même ordre d’idées, les pathologies reliées aux AB sont aussi un axe de recherche actif. Plusieurs maladies génétiques sont reliées à une mutation dans une enzyme clé de la synthèse, du métabolisme ou de la signalisation des AB. Au niveau du foie, un blocage des conduits biliaires par divers phénomènes biologiques (cancer, maladies auto-immunes, toxicité médicamenteuse, grossesse, etc.) peut mener à une accumulation hépatique d’AB. Cet état, appelé cholestase, cause la dégradation du tissu due, notamment, à une toxicité des AB reliée entre autre à leur propriété détergente (2).
Ensuite, le foie possède plusieurs mécanismes d’autoprotections afin d’éviter une accumulation toxique d’AB. D’une part, les hépatocytes (HEP) possèdent des voies de signalisation leur permettant d’interrompre la synthèse des AB. En second lieu, des transporteurs ayant une bonne affinité pour les AB sont présents sur les membranes basolatérale et apicale des HEP. Puis, le foie peut exprimer les enzymes nécessaires afin de métaboliser les AB dans le but de les rendre plus solubles et ainsi plus facilement transportables dans les fluides corporels en vue d’une élimination urinaire ou biliaire.
2
Parmi ces dernières, la glucurono-conjugaison, catalysée par les enzymes de la famille des uridine-5’-diphosphate-glucuronosyltransférases (UGT), est une réaction de phase 2 qui augmente l’hydrophilicité de ces molécules cibles (figure 1). Pour ce faire, les UGT transfèrent un groupement glucuronide (glucide polaire à 5 carbones) provenant de son cofacteur, l’acide uridine-5’-diphosphateglucuronique (UDPGA), sur un groupement acide, alcool, thiol ou amine de la molécule visée.
1.1.
Glucuronidation des acides biliaires et importance des
niveaux sériques et urinaires des acides biliaires
glucuronides chez l’homme
En état normal, les AB-glucuronides (AB-G) sont très peu retrouvés dans la bile (environ 2,5 % des AB totaux) (3). Ce pourcentage augmente pour les niveaux sérique et urinaire, qui passent à 7,6 % et à 13 % respectivement (4-6). Ce gradient de concentration suggère que la glucuronidation des AB redirige l’élimination des AB d’un mode biliaire à urinaire. D’ailleurs, en état cholestatique, dans lequel le flux biliaire est interrompu, la glucuronidation des AB est naturellement augmentée (3, 5, 6).
3
Figure 1 : Mécanisme enzymatique de la glucuronidation du CDCA en position 24.
La glucuronidation est une réaction de type SN2 qui est catalysée par les enzymes de la famille des uridine-5’-diphosphate-glucuronosyltransférases. CDCA : acide chénodéoxycholique.
4
1.2.
Modulation de la glucuronidation hépatique des
acides biliaires par les récepteurs nucléaires
La régulation de l’homéostasie des AB est primordiale, car ces molécules sont toxiques lorsque retrouvées en grande concentration. Plusieurs RN sont impliqués dans ce processus. Pour ce faire, ils régulent la transcription de gènes impliqués dans la synthèse, le transport et le métabolisme des AB. De plus, ces protéines peuvent être activées par des molécules pharmacologiques. La stimulation du métabolisme et du transport des AB par ces voies semble être prometteuse pour le traitement de la cholestase; une situation pathologique caractérisée par une interruption du flux biliaire qui cause une rétention hépatique des AB.
1.3.
But et objectifs du projet de recherche
Bien que des molécules pharmacologiques, dont certaines sont des activateurs de RN, soient présentement étudiées pour le traitement des pathologies cholestatiques dans de petites études cliniques, l’effet de ces dernières sur la glucuronidation des AB n’a jamais été évalué dans le contexte de la cholestase jusqu’à maintenant (7-9). Cette réaction est considérée comme accessoire, donc son potentiel thérapeutique a reçu peu d’attention (10).
Par conséquent, le but de l’étude est de caractériser la glucuronidation des AB chez l’humain ainsi que ses effets sur l’homéostasie des AB en situation cholestatique, et ce, afin de démontrer la glucuronidation des AB comme cible thérapeutique pour le traitement de la cholestase.
Dans l’intention de démontrer la glucuronidation des AB comme cible thérapeutique pour le traitement des pathologies cholestatiques, les objectifs de l’étude étaient de caractériser 1) la glucuronidation hépatique et rénale des AB, 2) les propriétés allostériques de ces deux types de glucuronidation 3) la glucuronidation des AB par les membres de la famille des UGT2A et 4) de déterminer l’effet de la glucuronidation des AB sur le devenir des effets toxiques de ces molécules.
5
2. Les acides biliaires
Les AB sont les constituants majeurs de la bile chez l’humain et leur synthèse hépatique exerce une force qui stimule le mouvement de cette dernière (11). Environ, 12 grammes d’AB sont présents dans l’organisme et approximativement 500mg d’AB sont synthétisés par jour (12, 13). Les divers AB retrouvés chez l’Homo sapiens possèdent tous 24 carbones et diffèrent par le nombre et la position des groupements hydroxyles sur leur squelette stéroïdien (figure 2) (14). Ils sont des molécules amphipathiques, formées à partir du CHOL, qui exercent plusieurs tâches importantes dans l’organisme. Leur fonction physiologique principale est de favoriser la solubilisation et l’absorption des lipides alimentaires, des vitamines liposolubles et du CHOL dans l’intestin (15). Pour ce faire, les AB forment des micelles cylindriques mixtes avec des molécules de CHOL et de phospholipides (16). La synthèse ainsi que l’élimination fécale et urinaire des AB constituent la principale forme d’élimination du CHOL chez l’homme (12, 17). En fait, environ 90 % du métabolisme du CHOL chez l’humain consistent à produire des AB (12). Donc, les AB ont un rôle majeur dans le maintien de l’homéostasie du CHOL en régulant son absorption et une forte partie de son élimination. De plus, les AB sont des molécules signalétiques. D’ailleurs, leurs structures leur permettent d’activer spécifiquement certains RN et récepteurs membranaires (18-20). Ensuite, les AB jouent un rôle très important dans la défense intestinale contre les pathogènes et dans le maintien de l’homéostasie de la flore bactérienne intestinale (21). Aussi, comme les AB sont des détergents naturels, il a été démontré que ces molécules étaient cytotoxiques à haute concentration (22).
6
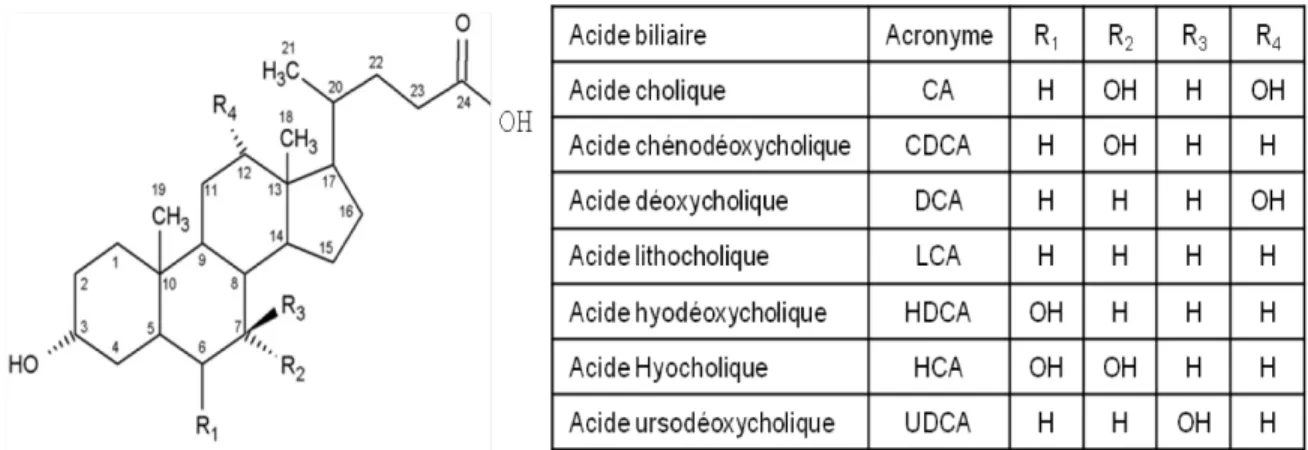
Figure 2: Structure des différents acides biliaires.
Les différents AB possèdent tous la même structure de base et diffèrent entre eux selon le nombre et la position de leurs fonctions alcool. Les différents carbones retrouvés sur le squelette stéroïdien sont numérotés de 1 à 24.
2.1.
Les acides biliaires sont importants dans l’absorption
intestinale des composés liposolubles de l’alimentation
Contrairement aux molécules normalement connues pour former des micelles, qui possèdent une tête hydrophile et une queue hydrophobe, les AB ont plutôt une polarité planaire (figure 3) (23). Mise à part quelques exceptions, tous leurs groupements polaires sont orientés dans la même direction (en α) sur leur squelette stéroïdien, qui est relativement rigide chimiquement et presque plat (21).
En plus de solubiliser les molécules hydrophobes provenant de l’alimentation dans l’intestin, les AB aident au métabolisme des lipides. Pour effectuer la lipolyse, la lipase doit pouvoir être en contact avec le triglycéride afin d’en libérer du glycérol ainsi que ses acides gras (21). Les AB enlèvent les émulsifiants ainsi que les protéines autour des macromolécules contenant les triglycérides à métaboliser et facilitent l’accès de la lipase
7 lorsqu’elle est couplée à la colipase (21, 24, 25). De plus, le pouvoir micellaire des AB leur permet de solubiliser les lipides relargués par l’activité de la lipase, ce qui aide à garder l’activité de cette dernière à un haut niveau (25, 26).
Figure 3 : Les acides biliaires présentent une polarité planaire.
2.2.
La synthèse des acides biliaires
Principalement, 7 AB sont retrouvés chez l’homme (4). Ces AB peuvent être séparés en trois catégories, soit les AB primaires, les AB secondaires et les AB hydroxylés (figure 2). Les AB primaires, l’acide cholique (CA) et l’acide chénodéoxycholique (CDCA), proviennent de la synthèse hépatique des AB à partir du CHOL (12). Ensuite, les AB secondaires, l’acide déoxycholique (DCA), l’acide lithocholique (LCA) et l’acide ursodéoxycholique (UDCA), sont issus du métabolisme des AB primaires par la flore bactérienne intestinale (15). Finalement, le cytochrome P450 (CYP) 3A4 hépatique peut
8
oxyder certaines espèces d’AB pour former les AB hydroxylés, soit l’acide hyocholique (HCA) et l’acide hyodéoxycholique (HDCA) (12).
Le foie étant le site de synthèse des AB, ces derniers sont présents en grande concentration dans ce tissu (56.6 nmol/g de foie) (27). En effet, cet ensemble d’AB est composé à 41 % de CDCA, 21 % de CA, 27 % de DCA et seulement 4,6 % de LCA, laissant environ 6 % de l’ensemble des AB intra-hépatiques qui est composé de HCA, HDCA et d’UDCA (27, 28).
2.2.1. La synthèse des acides biliaires primaires
La synthèse des AB se doit d’être finement modulée afin de garder une homéostasie adéquate du CHOL et afin de fournir suffisamment d’AB dans l’intestin pour la digestion. Deux voies de synthèse peuvent mener aux AB primaires à partir du CHOL, la voie classique et la voie alternative (29). Après leurs synthèses, les AB primaires sont conjugués à un acide aminé, soit la glycine (GAB) ou la taurine (TAB), afin d’augmenter leur capacité à former des micelles (30). Les voies de synthèse des AB peuvent être décrites en trois grandes étapes : 1) l’initiation de la synthèse; 2) la modification du squelette stéroïdien et 3) l’oxydation et le raccourcissement de la chaîne latérale.
2.2.1.1. Initiation de la synthèse
2.2.1.1.1. Voie classique
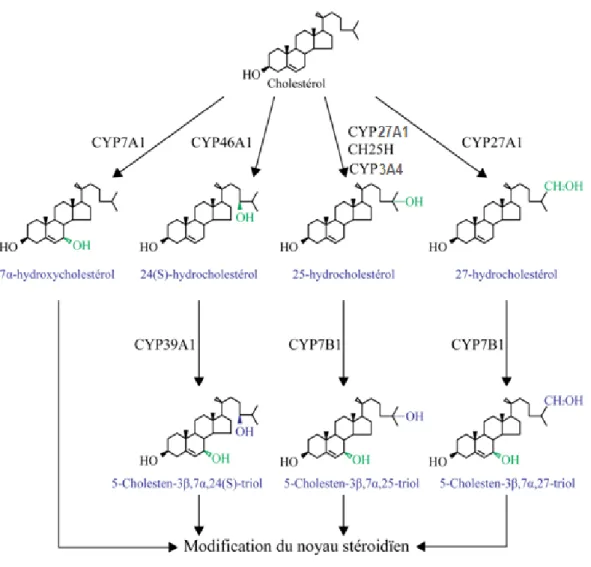
La voie classique de synthèse des AB est exclusivement hépatique et est initiée par le CYP7A1 (figure 4). Ce dernier procède à l’hydroxylation du CHOL sur son carbone 7 pour former le 7α-hydroxyCHOL (7α-HXC) (12). La réaction que cette enzyme microsomale catalyse sur le CHOL est l’étape limitante dans la synthèse classique des AB. D’ailleurs, les souris déficientes en Cyp7a1 ont 75 % moins d’AB (31).
9
2.2.1.1.2. Voie alternative
Lorsque les chercheurs ont engendré des souris déficientes en CYP7A1, ils se sont aperçus que ces souris étaient quand même capables de produire des AB par une autre voie que la voie classique (32). Il a ensuite été montré que le 24-HXC, le 25-HXC et le 27-HXC pouvaient être utilisés pour former des AB. Ces HXC sont formés par le « cholesterol-24S-hydroxylase » (CYP46A1), le 25-cholestérol-cholesterol-24S-hydroxylase (CH25H) et le CYP27A1, respectivement (figure 4) (12). Chez l’humain, il est difficile de déterminer quelle fraction de la production d’AB provient de la voie alternative. Cependant, il a été évalué que cet apport est d’environ 5 à 10 % (12).
Le CHOL ne peut passer la barrière hémato-encéphalique. Donc, ce dernier se doit d’être transformé en 24-HXC pour être en mesure de le faire (33). L’enzyme microsomale CYP46A1 est exprimée principalement au cerveau chez l’humain et est impliquée dans l’élimination du CHOL dans cet organe (33, 34). Cette enzyme peut hydroxyler le CHOL sur son carbone 24 ou 25 pour former le 24-HXC et le 25-HXC, respectivement (12, 35). Cependant, son activité est beaucoup plus grande pour la formation du 24-HXC comparativement au 25-HXC (36). En situation normale, environ 0,7 % de la production d’AB commence avec le 24-HXC. Donc, cette voie d’initiation de la synthèse des AB est considérée comme mineure (12).
Le CH25H, du groupe d’enzyme métabolisant les lipides, possède l’activité nécessaire pour former le 25-HXC à partir du CHOL (12). L’ARNm de cette protéine microsomale est retrouvé faiblement dans la majorité des tissus et fortement dans les poumons (12). Cependant, l’expression de cette enzyme chez l’humain est beaucoup plus faible comparativement aux modèles murins, donc son rôle dans la synthèse du 25-HXC chez l’humain est controversé (35). Les souris déficientes en Ch25h n’ont aucune différence quant à leur profil d’AB et de HXC, donc le 25-HXC est retrouvé chez ces souris (12, 37). Les CYP3A4 et CYP27A1 sont aussi capables de former le 25-HXC (35, 37). Cependant, leur rôle dans la production du 25-HXC reste à être caractérisé (37).
10
Le CYP27A1 est une enzyme résidente de la mitochondrie capable de catalyser l’hydroxylation du CHOL en position 24, 25 et 27 (12, 38). Cependant, elle possède une plus grande activité pour la formation du 27-HXC (12). D’ailleurs, cet oxystérol est le plus abondant chez l’humain et la souris (39, 40). Chez cette dernière, environ 25 % des AB sont synthétisés à partir du 27-HXC (12).
Afin d’être convertis en AB, le 24-HXC, le 25-HXC et le 27-HXC doivent être hydroxylés en position 7 (figure 4). Deux CYP microsomaux catalysent ce processus, le CYP39A1 et le CYP7B1 (12). Les deux enzymes sont fortement exprimées dans le foie, tandis que leur ARNm est faiblement détecté dans l’épithélium des yeux pour le CYP39A1 et dans le rein, la prostate et le cerveau pour le CYP7B1 (12). Le CYP39A1 est capable d’hydroxyler en position 7 le 24-HXC, le 25-HXC et le 27-HXC. Cependant, il a une plus grande activité pour le 24-HXC comparativement aux deux autres, contrairement au CYP7B1 qui n’a pas d’affinité pour le 24-HXC (12, 41). Les souris déficientes en CYP7B1 ont un taux élevé de 25-HXC et de 27-HXC, mais un taux normal de 24-HXC (12, 39).
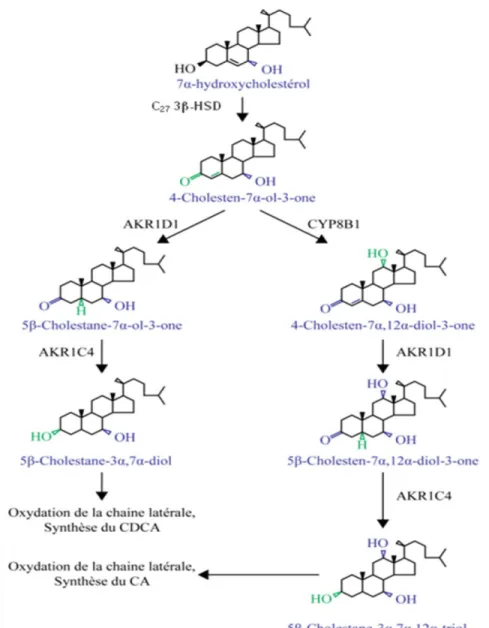
1.1.1.1. La modification du squelette stéroïdien
À cette étape du processus de synthèse des AB, les produits des voies alternative et classique empruntent le même chemin pour devenir des AB primaires (figure 5). Premièrement, l’enzyme 3β-hydroxy-Δ5-C
27-stéroïde oxydoréductase (C27 3β-HSD)
catalyse l’isomérisation du double lien entre les carbones 5 et 6 (Δ5) vers la position Δ4 des intermédiaires hydroxylés en position 7α (12, 42). Aussi, cette enzyme convertit la fonction alcool en position 3 de ces mêmes oxystérols en fonction cétone (12, 42). Chez l’humain, la C27 3β-HSD est la seule enzyme catalysant cette réaction, une déficience de cette enzyme
bloque la production d’AB (12).
Le CYP8B1 peut hydroxyler les différents produits de la C27 3β-HSD en position
12α (12). Cette enzyme résidente du RE est responsable de la production différentielle des AB primaires. Si elle exerce son activité, du CA sera produit, tandis que lorsqu’elle ne le fait pas, il y a production de CDCA (12). Le CA étant plus hydrophile que le CDCA, on attribue au CYP8B1 le contrôle de l’hydrophobicité du pool d’AB.
11
Figure 4 : Initiation de la synthèse des acides biliaires par la voie classique et la voie alternative.
Le cholestérol est représenté en noir, les nouvelles modifications en vert et les modifications provenant de réactions subséquentes en bleu.
Figure adaptée de Russell DW, Annu Rev Biochem, 2003 (12).
12
Ensuite, le reste de la synthèse des AB est identique pour les deux AB primaires. Les molécules résultant des réactions faites par la C27 3β-HSD ou par la CYP8B1 sont
sujettes à une réduction de leurs liens doubles dans l’anneau-A de leur squelette catalysé par la Δ4-3-oxostéroïde-5β-réductase (AKR1D1). Cette enzyme est cytosolique, donc les intermédiaires doivent passer d’un milieu hydrophobe (la membrane du RE) vers un environnement hydrophile (12). Le mécanisme par lequel ce phénomène se produit reste inconnu jusqu’à maintenant.
L’étape finale de la modification du squelette du CHOL est la retransformation en fonction alcool à la position 3, à partir de la cétone. Cette réaction cytoplasmique est produite par la 3α-hydroxystéroïde déshydrogénase (AKR1C4) (12).
1.1.1.1. L’oxydation et le raccourcissement de la chaîne latérale
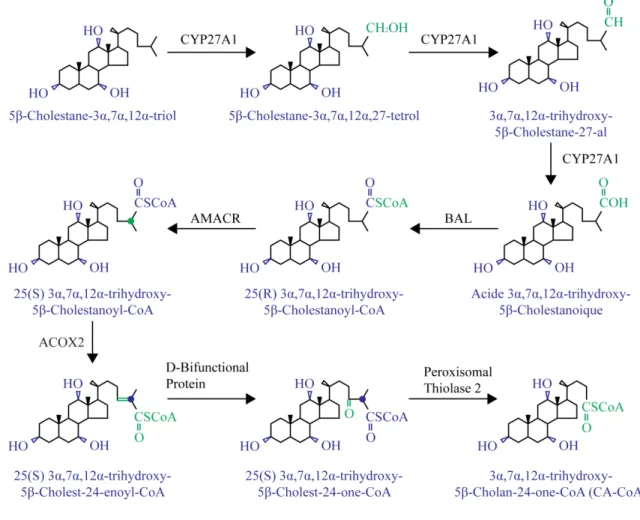
La première étape du processus d’oxydation et de réduction de la chaîne latérale des AB est catalysée par le CYP27A1, qui est résident de la mitochondrie (figure 6). Ce dernier oxyde la chaine latérale successivement jusqu’à l’obtention d’une fonction acide, en passant par un dérivé alcool puis un aldéhyde, sur le carbone 27 de l’AB en devenir (12). Après avoir été oxydés, les intermédiaires sortent de la mitochondrie et se rendent au peroxysome afin de subir les dernières étapes de raccourcissement de leurs chaînes latérales.
Ensuite, l’AB coenzyme A (CoA) ligase (BAL) active le stérol en le conjuguant à un groupement CoA (12). Le carbone 25 des intermédiaires d’AB à 27 carbones est prochiral, car la CYP27A1 catalyse l’hydroxylation de son substrat de manière stéréospécifique, ce qui produit presque exclusivement l’isomère 25(R) (12). Cette forme doit être modifiée en isomère 25(S) avant que la chaîne latérale puisse être écourtée. Cette réaction est catalysée par l’enzyme 2-méthylacyl-CoA racémase (AMACR) (12).
13
Figure 5 : Étape de modification du squelette stéroïdien dans la synthèse des acides biliaires.
Les nouvelles modifications sont en vert et les modifications provenant de réactions subséquentes en bleu.
Figure adaptée de Russell DW, Annu Rev Biochem, 2003 (12).
14
La réaction qui mène à la diminution du nombre de carbones compris dans la chaîne latérale des AB ressemble à la β-oxydation des acides gras. Un lien double est formé, dans le cas de la synthèse des AB, en trans à la position 24-25. Ce lien est formé par l’acyl-CoA oxydase-2 (ACOX2) (12). Ensuite, la protéine « D-bifunctional » forme une cétone en position 24 à partir du lien Δ24 (12). Premièrement, elle hydrate le lien avec une molécule d’eau formant un intermédiaire portant un alcool en position 24, qui pourra être transformé par oxydation en fonction cétone. Différents domaines de la protéine catalyse ces deux réactions. Les souris déficientes pour la protéine « D-bifunctional » sont quand même en mesure de former des AB à 24 carbones, ce qui laisse croire qu’une autre enzyme a aussi l’activité nécessaire pour effectuer cette réaction, du moins chez la souris (43).
La dernière réaction survenant dans le raccourcissement de la chaîne latérale des AB est réalisée par l’enzyme « peroxisomal thiolase 2 » (12). Celle-ci coupe le lien entre les carbones 24 et 25, en utilisant une molécule de CoA, pour produire un AB conjugué à un CoA et une molécule de propionyl-CoA (12). Comme dans le cas des souris protéine « D-bifunctional » K.O., des AB possédant 24 carbones sont détectés chez les souris déficientes en « peroxisomal thiolase 2 » (44).
15
Figure 6 : L’oxydation et le raccourcissement de la chaîne latérale pendant la synthèse d’acides biliaires.
Les étapes d’oxydation et de raccourcissement de la chaîne latérale des AB sont similaires pour la production du CA et du CDCA. Les nouvelles modifications sont en vert et les modifications provenant de réactions subséquentes en bleu.
Figure adaptée de Russell DW, Annu Rev Biochem, 2003 (12).
16
1.1.1.2. Conjugaison des acides biliaires à un acide aminé
Les intermédiaires d’AB-CoA sont habituellement conjugués à un acide aminé, la glycine ou la taurine, dans le péroxysome par l’acide biliaire CoA : acide aminé N-acyltransférase (BACAT) (12). Cette réaction augmente leur caractère amphiphile et, du fait même, elle amplifie les propriétés détergentes des AB (45). De plus, elle rend les AB plus hydrosolubles, donc ils ne peuvent plus passer au travers des membranes cellulaires par diffusion passive et se doivent d’être transportés activement hors des HEP (12). Pour ce faire, l’amidation des AB diminue leur pKa, ce qui mène à leur ionisation à pH physiologique, comme dans le cas de la conjugaison du CA avec la glycine qui diminue son pKa de 6,4 à 4,4 (23). De plus, ce changement de pKa permet de favoriser la solubilisation, donc l’incorporation, des AB dans la bile (45). Le ratio d’AB conjugués à la glycine ou à la taurine chez l’humain est dépendant seulement de la concentration des deux acides aminés et ne semble pas engendrer de conséquence au niveau fonctionnel ou régulatoire (12). En effet, une diète riche en protéine favorise la formation de TAB tandis qu’une diète végétarienne joue en faveur de la formation de GAB (1). Par ailleurs, les AB-CoA peuvent aussi être déconjugés du CoA pour former les AB libres (12, 46). Cette réaction est catalysée par la AB-CoA thioestérase (BACTE) résidente du péroxysome (12, 46).
1.2.
Le cycle entérohépatique des acides biliaires
La synthèse et le transport actif des AB forment un flux qui force la bile à se déverser vers la vésicule biliaire (47). La bile est stockée dans cet organe jusqu’à l’arrivée de nourriture au niveau du petit intestin, ce qui provoque la libération du transmetteur hormonal cholécystokinine, par les cellules de la muqueuse proximale intestinale (48). Cette hormone peptidique stimule la contraction de la vésicule biliaire et mène à la libération de son contenu dans le petit intestin, site où les AB jouent leur rôle physiologique principal (48). La concentration en AB dans le petit intestin varie entre 4 et 20 mM (21). La plupart des AB sont absorbés activement dans l’iléum (49), cependant une petite partie de ceux-ci continuent leur chemin jusqu’au gros intestin. La flore bactérienne résidente du côlon est capable d’abord de déconjuguer les AB et ensuite de déhydroxyler les AB
17 primaires pour former les AB secondaires, soit le DCA et le LCA, à partir du CA et du CDCA respectivement (29). Les AB secondaires sont aussi absorbés par l’intestin. Ensuite, tous les AB intestinalement absorbés sont retournés au foie via la veine porte. Cette suite d’évènements constitue le cycle entéro-hépatique des AB. Environ 5 % des AB par cycle sont éliminés avec les fèces (50). Ce processus fait en sorte que les AB sont recyclés environ 20 fois, en moyenne, avant d’être éliminés (51). De retour au foie, le CYP3A4 peut hydroxyler le CDCA et le LCA pour former les AB hydroxylés, soit le HCA et le HDCA, respectivement (52-54).
1.2.1. Transporteurs hépatocytaires
Les AB libres peuvent diffuser à travers les membranes dues à leur lipophilicité (47). Cependant, la majorité des AB hépatiques sont conjugués, donc plus hydrophiles, ce qui ne leur permet plus d’envisager ce mode de transport et doivent être transportés activement (figure 7) (47).
18
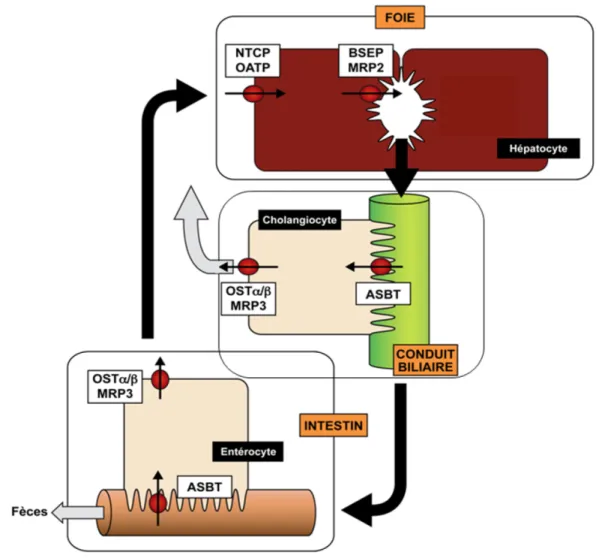
Figure 7 : Transporteurs impliqués dans le cycle entéro-hépatique des acides biliaires.
Les trois types cellulaires impliqués dans ce cycle sont montrés dans les rectangles noirs tandis que les organes dans lesquels on les retrouve sont indiqués par des rectangles orange. Les transporteurs orchestrant le cycle entéro-hépatique des AB sont présents dans les rectangles blancs.
Figure adaptée de Zollner et al., Wien Med Wochenschr, 2006 (55).
19
1.2.1.1. Protéines catalysant le transport des acides biliaires vers les canules biliaires
1.2.1.1.1. Le transporteur «bile salt export pump» (BSEP)
BSEP est une grosse protéine de 1321 acides aminés qui est exprimée de manière homogène dans les HEP de toutes les zones du foie (56). Elle est la protéine principalement impliquée dans le transport des AB vers les canaux et la vésicule biliaire. Des expériences immunohistochimiques ont permis de démontrer que cette protéine était exprimée sur la membrane apicale des HEP (57). Ensuite, elle est très active pour le transport des AB conjugués à un acide aminé (AB-AA) (47, 56). Dans cette suite d’idées, la présence d’AB-AA stimule son activité ATPase (58). Néanmoins, elle possède aussi de l’activité, cependant plus faible, pour les AB libres (56). Son importance dans le transport hépatique apical des AB est illustrée par les patients atteints de cholestase intrahépatique familiale, qui est causée par une mutation qui engendre une baisse de l’activité de BSEP (voir section 2.1.4.3) (59). Finalement, le mouvement des AB effectué par BSEP est une force importante qui stimule le mouvement de la bile vers la vésicule biliaire (60).
1.2.1.1.2. Le transporteur «multi-drug resistance protein 2» (MRP2)
MRP2 est un membre de la famille des transporteurs ABC, donc il catalyse du transport actif nécessitant l’hydrolyse d’ATP (61). Cette protéine est principalement retrouvée sur la membrane apicale des HEP, mais est aussi exprimée dans d’autres tissus comme les intestins et les reins (62). MRP2 possède de l’activité pour plusieurs molécules conjuguées à un glucuronide, un sulfate ou un glutathion (63). D’ailleurs, MRP2 est le transporteur responsable du transport de la bilirubine mono- et di-glucuronide vers la bile (64). En effet, les patients atteints du syndrome Dubin-Johnson, qui est causé par des mutations dans le gène codant pour la protéine MRP2, présentent des accumulations hépatique, sérique et urinaire de bilirubine mono et di-glucuronidée (65). Aussi, ce transporteur possède une grande activité pour l’estrone-3-sulfate ainsi que pour l’estradiol-3 et -17β-glucuronides (62, 64). En raison de la similarité de structure entre ces molécules et
20
les AB-G et sulfates, les chercheurs influents dans le monde de la recherche sur les AB tiennent pour acquis que MRP2 transportent les AB-G et sulfates (14, 47, 55, 66).
1.2.1.2. Formation de la bile
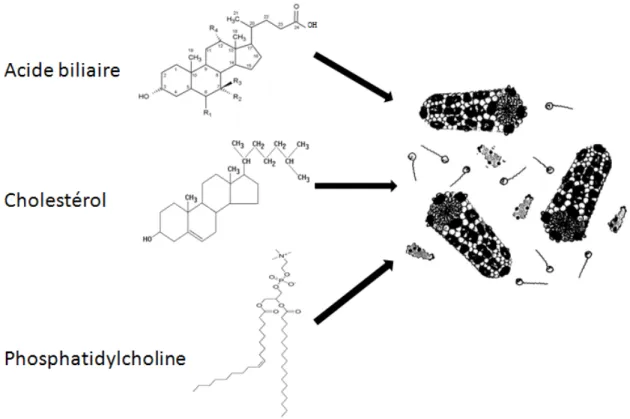
Un adulte normal produit de 0,4 à 0,8 litre de bile par jour (26). Ce fluide corporel est très important pour la digestion, mais aussi pour l’élimination de molécules endogènes et exogènes telles les hormones stéroïdiennes, la bilirubine, le bisphénol A, le fénofibrate, etc. La bile résulte d’un mouvement de l’eau à travers les jonctions serrées et les aquaporines causé par le transport actif de molécules au pouvoir osmotique, les AB sont les pincipales molécules causant ce phénomène (67, 68). D’ailleurs, la bile est une solution complexe composée à 95 % d’eau avec comme composant organique principal les AB, mais plusieurs autres composants y sont aussi retrouvés. La bile est également un fluide riche en CHOL et en phospholipide, principalement de la phosphatidylcholine (69). Ces deux composés ont une grande importance dans la digestion facilitée par les AB, car ces trois molécules forment des micelles mixtes qui seront utiles pour la solubilisation des composants lipophiles de l’alimentation (figure 8) (70). Bien que les AB extra-hépatiques soient en mesure d’extraire des molécules de phosphatodylcholine et de CHOL de la membrane plasmique des HEP, ces molécules doivent se retrouver dans la couche externe de cette membrane, donc du transport actif doit avoir lieu pour que ces molécules se retrouvent en grande quantité dans ce compartiment cellulaire (26).
21
Figure 8 : Formation des micelles mixtes d’acides biliaires.
L’assemblage de molécules de cholestérol, d’acides biliaires et de phospholipides mène à la formation de micelles mixtes de forme cilyndrique.
Figure adaptée de Hofmann A., News Physiol Sci., 1999 (70).
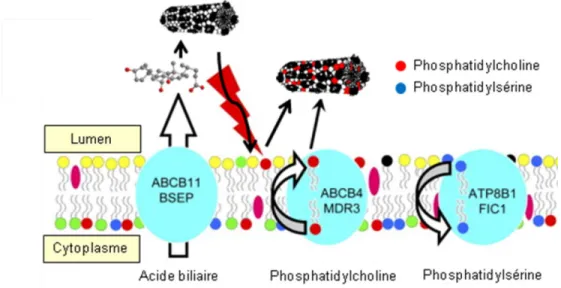
1.2.1.2.1. Flipase de phosphatidylcholine et de phosphatidylsérine
La protéine «Multidrug resistance 3 » (MDR3), ou aussi nommé ABCB4, est la principale responsable de la translocation de phosphatidylcholine vers la couche externe des membranes cytoplasmiques des HEP (figure 9) (67). Aussi, il semble que MDR3 interagisse directement avec les micelles d’AB pour favoriser l’incorporation de phosphatidylcholine dans celles-ci (71). D’ailleurs, les patients portant une mutation dans le
22
gène codant pour cette protéine ont très peu de phosphatidylcholine dans leur bile (72). Ce membre de la famille des transporteurs ABC est majoritairement retrouvé sur la membrane apicale des HEP (73). Ensuite, afin de garder la symétrie au sein de la membrane cytoplasmique des HEP, le transporteur ATP8B1 transloque des molécules de phosphatidylsérine de la couche externe vers la couche intérieure (74).
Figure 9 : Mécanisme enzymatique impliqué dans le maintient de l’intégrité de la membrane apicale des hépatocytes.
Figure adaptée de Groen et al., Gastroenterology, 2011 (71).
1.2.1.2.2. Transporteurs du cholestérol
Les transporteurs ABCG5 et ABCG8 sont les principales protéines impliquées dans la sécrétion du CHOL dans la bile (74). Ces transporteurs sont exclusivement exprimés dans le foie et l’intestin, et comportent seulement 6 des 12 domaines transmembranaires habituellement retrouvés chez les membres de la famille des transporteurs ABC (67, 74). De plus, afin de transporter le CHOL vers la couche extérieure de la membrane
23 cytoplasmique des HEP, ces deux protéines doivent travailler sous forme de dimère (75). Cependant, le mécanisme fonctionnel de ce transport est encore mal connu (74). Mais leur importance dans le transport du CHOL est démontrée chez les personnes portant les mutations ABCG5 R50C et ABCG8 D19H qui augmentent l’activité de ces protéines (76). Ces porteurs ont une plus grande sécrétion biliaire de CHOL et donc, une plus grande chance de développer des calculs biliaires (77).
1.2.2. Les canules biliaires
Les cholangiocytes sont les cellules épithéliales qui forment les parois des canaux biliaires (78). En plus de leur rôle structural, elles participent également à la formation de la bile, principalement par une sécrétion hydro-électrolytique, mais elles modifient aussi sa composition en AB (78, 79). D’ailleurs, les cholangiocytes sont exposées à de grandes concentrations d’AB (environ 5mM), donc ces cellules se doivent d’être équipées afin de faire face à un tel défi (51). En effet, elles expriment les transporteurs ASBT, MRP3 et le dimère protéique OSTα/OSTβ qui permet de réguler l’entrée et la sortie d’AB dans ces cellules (tous décrits plus tard à la section 2.3.7.1) (figure 7) (80). Ensuite, les cholangiocytes excrètent des ions bicarbonates (ion alcalin), qui les protègent des effets toxiques des AB en gardant les AB sous leurs formes protonés (81). D’ailleurs, les cholangiocytes, dont l’expression du transporteur responsable de l’excrétion d’ions bicarbonates « anion exchanger 2 » est inhibé par interférence à l’ARN, se voient plus sensibles aux effets toxiques des AB (81). De plus, une diminution de la présence de l’« anion exchanger 2 » est observée dans les biopsies hépatiques de patients atteints de cirrhose biliaire primitive et a été proposée comme jouant un rôle majeur dans la pathogénèse de cette maladie (82). Ensuite, les cholangiocytes présentent un glycocalyx d’environ 25nm d’épaisseur (81). Cette couche protectrice est très hydrophile, ce qui empêche les AB d’atteindre et de détruire la membrane cytoplasmique des cholangiocytes (81). De plus, le glycocalyx retient les ions bicarbonates, ce qui crée un gradient de pH dans le conduit biliaire qui présente un pH plus élevé aux environs des cholangiocytes et plus faible au centre du conduit (81). Ce phénomène a pour effet de mener à la protonation des AB retrouvés aux abords des cholangiocytes, ce qui diminue l’entrée d’AB dans ces
24
cellules et favorise l’ionisation des AB au centre du conduit biliaire afin d’augmenter leur solubilité et ainsi faciliter leur incorporation dans la bile (81).
1.2.3. La vésicule biliaire
Dans la vésicule biliaire, les concentrations d’AB peuvent atteindre 50mM (51); c’est pourquoi les cellules de cet organe se doivent d’être très résistantes aux dommages causés par de grandes concentrations d’AB. Il a été noté que cette résistance provient, entre autre, de la présence d’une grande quantité de CHOL dans leur membrane cytoplasmique (83). En plus d’emmagasiner la bile afin de réguler son largage dans l’intestin, la vésicule biliaire joue un rôle dans le contrôle du flux biliaire. Les cellules épithéliales de cet organe expriment le récepteur membranaire TGR5 (décrit à la section 2.6.2) qui, lorsqu’il est activé par les AB, stimule le flux biliaire afin de remplir la vésicule biliaire de bile (84). Ensuite, le déversement du contenu de la vésicule biliaire dans l’intestin est régulé par l’ingestion de nourriture, plus précisément les protéines et les acides gras (85). À la suite de cet évènement, les cellules entéro-endocrines du duodénum relâchent l’hormone peptidique cholécystokinine dans la circulation sanguine, ce qui force la vésicule biliaire à se contracter et à verser son contenu dans l’intestin (48).
1.2.4. Modifications bactériennes pour former les acides biliaires
secondaires
La capacité de dégrader le CHOL et ses métabolites est répandue chez les membres du règne des procaryotes (23). Dans le cas des AB, plusieurs souches de bactéries aérobies peuvent dégrader ces derniers jusqu’à l’obtention de CO2 (23). De plus, certaines souches
de bactéries anaérobiques sont en mesure de croître en utilisant le CA comme source d’énergie et le nitrate comme accepteur d’électrons (23).
Lors du cycle entéro-hépatique des AB, une partie des AB primaires est modifiée en AB secondaires dans le gros intestin, majoritairement par des bactéries anaérobies du genre
25 petit intestin soit très efficace (~95 %), le fait qu’il y a environ 12 cycles entéro-hépatiques par jour chez l’homme expose le côlon à 400 – 800 mg d’AB par jour (15). La première étape du processus de formation des AB secondaires est la déconjugaison des AB de leurs acides aminés (glycine ou taurine) (86). L’enzyme acide biliaire hydrolase (ABH) est responsable de cette activité et a été retrouvée chez plusieurs membres des familles
Bacteroides, Clostridium, Lactobacillus, Bifidobacteriumm, Enterococcus et Listeria (15,
87). De plus, les ABH retrouvés dans ces différentes souches sont actives sur une grande gamme de pH, allant de 4,2 à 7,0, ont des affinités différentielles pour les divers AB conjugués à la glycine ou à la taurine et diffèrent au niveau de leurs poids moléculaires (80 – 250 kDA) (86). La majorité des ABH ont une préférence pour les dérivés d’AB conjugués à la glycine (87). L’importance de cette réaction pour les bactéries est encore mal comprise, mais des évidences démontrent que chez Listeria monocytogenes, la délétion du gène codant pour l’ABH diminue sa viabilité et sa virulence dans l’intestin humain (86). Ensuite, les AB primaires libres sont de potentiels candidats à la 7α-déshydroxylation, ce qui résulte en la formation des AB secondaires (14). Certains membres du genre Eubacterium et Clostridium sont les seules bactéries à avoir démontré de l’activité 7α-déhydroxylase pour les AB primaires (87). Cette réaction est effectuée en plusieurs étapes par des enzymes codées par des gènes regroupés sur l’opéron bai (figure 10) (86). Après avoir été internalisé dans la bactérie par un transporteur d’AB, l’AB libre est premièrement conjugué à une molécule de CoA sur sa fonction acide (87). Ensuite, cet AB-CoA est oxydé pour obtenir un AB-3-oxo, puis en un intermédiaire 3-oxo-Δ4 (87).
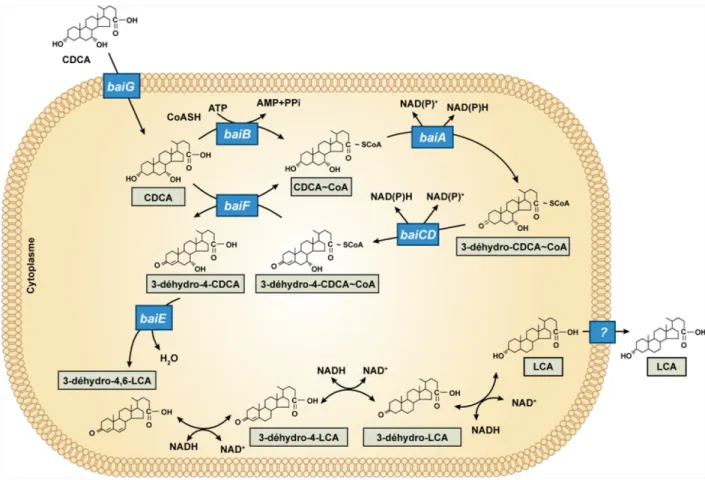
Ensuite, l’AB-3-oxo-Δ4 est déconjugué du CoA pour retrouver sa fonction acide. Après, le 3-déhydro-4-AB voie sa fonction alcool en position 7 réduite pour ainsi former un double lien entre ses carbones 6 et 7. Finalement, le 3-déhydro-4,6-AB subit trois réductions subséquentes, ce qui le transformera en AB secondaire, soit en LCA à partir du CDCA ou en DCA à partir du CA (14, 86, 87).
26
Figure 10 : Mécanisme proposé par Ridlon et al. pour la 7α-déhydroxylation des acides biliaires primaires menant à la formation des acides biliaires secondaires.
Figure adaptée de Ridlon et al., J Lipid Res., 2006 (86).
1.2.5. Autres modifications des acides biliaires par les bactéries du
tractus intestinal
Plusieurs autres modifications des AB peuvent être effectuées par les enzymes exprimées par les différents membres de la flore bactérienne intestinale. En fait, chaque fonction alcool présente sur le CDCA et le CA peuve être épimérisée ou oxydée en fonction cétone (1, 86). D’ailleurs, la formation de l’UDCA provient de l’épimérisation par la flore
27 intestinale de la fonction alcool du CDCA en position 7 (88). Cependant, à l’exception de l’UDCA, ces formes d’AB sont très peu étudiées et, donc leur importance sur le plan physiologique reste encore à être déterminée.
1.2.6. Les entérocytes
Les entérocytes sont les cellules qui forment l’épithélium de la paroi intestinale. Ces cellules portent un grand nombre de microvillosités et sont impliquées dans l’absorption des nutriments provenant de l’alimentation.
1.2.6.1. Les transporteurs d’acides biliaires présents dans les entérocytes
1.2.6.1.1. Le transporteur «apical sodium Na+-dependent bile salt
transporter» (ASBT/SLC10A2)
ASBT est une glycoprotéine de 48kDa, dont le transcrit de 4kb provient d’un gène situé sur le chromosome 13p33 (47). Dans l’intestin, ASBT est exprimé sur la membrane apicale des entérocytes (89). Ce transporteur possède de l’activité pour les AB conjugués et pour les AB libres. Cependant, il a une préférence pour les AB conjugués à la taurine ou a la glycine (47). De plus, il est plus actif et a plus d’affinité pour les AB dihydroxylés, comme le CDCA, le HDCA et le DCA, comparativement aux AB trihydroxylés, comme le CA et le HCA. Toutefois, l’épimérisation d’un groupement alcool, comme celui ayant lieu sur le CDCA pour former l’UDCA, diminue fortement l’affinité de ASBT pour les AB dihydroxylés (90). Le mécanisme exact impliquant ASBT dans l’absorption intestinale des lipides, des vitamines liposolubles et du CHOL reste mal compris. Ces molécules sont solubilisées à l’intérieur de micelles mixtes d’AB dans la lumière de l’intestin. Ces macromolécules sont trop volumineuses pour être transportées par des transporteurs protéiques. Cependant, les souris qui ont le gène ASBT délété voient leur bassin d’AB enrichi en CA, mais diminué de 80 %, malgré une majeure augmentation de l’activité de leur CYP7A1 (91). De plus, l’élimination fécale d’AB est augmentée de 10 à 20 fois chez ces souris (91).
28
1.2.6.1.2. Le dimère «organic solute transporter alpha-beta» (OSTα/β)
Les protéines OSTα et OSTβ ne présentent pas d’activité de transport pour les AB à l’état monomérique. Néanmoins, cette activité est présente lorsqu’elles sont sous forme de dimère (92). Le dimère OSTα/β est situé sur la membrane basolatérale des entérocytes et il est reconnu comme jouant un rôle majeur dans le transport des AB du cytoplasme de ces cellules vers la circulation sanguine qui retourne au foie via la veine porte (93). D’ailleurs, les souris déficientes pour OSTα ont une un taux d’absorption intestinale des AB dramatiquement réduit, sans pour autant avoir une augmentation de l’activité de leur CYP7A1 (94). Deux formes du complexe OSTα/β ont été identifiées, un hétérodimère comprenant une sous-unité OSTα et une sous-unité OSTβ de même qu’un hétéromultimère comprenant deux sous-unités OSTα et une sous-unité OSTβ (95). Des évidences démontrent que l’association des protéines OSTα et OSTβ pour former le dimère actif a lieu dans le RE (93). L’interaction physique entre OSTα et OSTβ est nécessaire non seulement pour son activité, mais aussi à la localisation du complexe sur la membrane basolatérale (96).
1.2.6.2. Transport des acides biliaires à travers les entérocytes par la protéine «intestinal bile acid binding protein» (IBABP)
IBABP est une protéine qui se lie aux AB après leur arrivée dans le cytoplasme des entérocytes (97). Deux molécules de CA-glycine peuvent se lier à la même protéine de IBABP chez l’humain avec une coopérativité positive (47). Peu d’études portent sur cette protéine, et des souris déficientes pour IBABP seraient d’une grande utilité afin de mieux comprendre le rôle de cette protéine dans l’absorption intestinale des AB (47).
29
1.2.7. Élimination des acides biliaires dans les fèces
Une quantité considérable d’AB est relâchée chaque jour dans les fèces (entre 300 et 600 mg) (86). De cette perte, environ 80 % de ces AB sont du LCA et du DCA libres (50 % : 50 %) (98). Les AB primaires libres viennent ensuite avec environ 2 % chaque du contenu en AB des fèces (98). En raison du rétrocontrôle que les AB exercent sur leur propre synthèse, celle-ci compense de manière équimolaire à l’élimination fécale des AB (12, 15).
1.2.8. Retour au foie des acides biliaires
Après avoir été transportés à travers les entérocytes, les AB se retrouvent dans le sang de la veine porte, majoritairement liés à l’albumine (12, 99). La veine porte sert à apporter le sang des organes digestifs vers le foie. Le rôle physiologique majeur de ce système est de s’assurer que les molécules xénobiotiques aient un premier passage hépatique avant de se retrouver dans la circulation sanguine. Le foie est connu pour être le site majeur où les enzymes de détoxification sont exprimées (100). De retour au foie, les AB se doivent d’être transportés par des protéines résidentes de la membrane basolatérale des HEP afin de pénétrer dans le foie et ainsi poursuivre leur périple dans un autre cycle entéro-hépatique (12).
1.2.8.1. Transporteurs impliqués dans l’absorption hépatocytaire des acides biliaires
Plusieurs transporteurs résidents de la membrane des HEP ont été démontrés pour posséder de l’activité pour les AB (47, 101). Cependant, le rôle et l’apport exact de ces protéines dans l’absorption hépatocytaire des AB restent encore mal compris. Malgré tout, il est connu que la majeure partie de ce sentier métabolique est sodium-dépendant (47, 99).