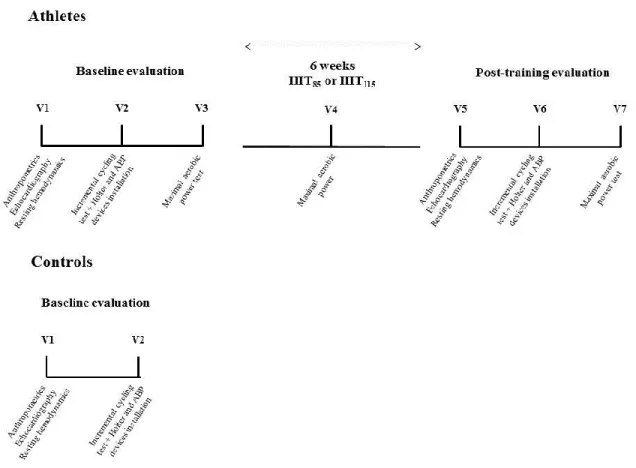
Effets de 6 semaines d’entraînement par intervalles à
haute intensité sur la fonction cardiaque de repos, la
pression artérielle ambulatoire et la variabilité de la
fréquence cardiaque chez des athlètes masculins
d’endurance
Mémoire
Olivier Le Blanc
Maîtrise en kinésiologie
Maître ès sciences (M. Sc.)
Québec, Canada
© Olivier Le Blanc, 2015
iii
Résumé
Il existe encore plusieurs interrogations par rapport à la fonction cardiaque de repos chez l’athlète d’endurance. L’entraînement par intervalles à haute intensité (HIIT) est de plus en plus populaire chez les athlètes, mais ses effets sur la fonction cardiaque de repos demeurent encore inconnus. Le but de cette étude fut donc d’étudier les effets de six semaines d’HIIT sur la fonction cardiaque de repos, la pression artérielle ambulatoire (PAA) et la variabilité de la fréquence cardiaque (VFC) chez l’athlète de sport d’endurance. Après six semaines d’entraînement, les structures et fonctions du ventricule gauche (VG) ainsi que la VFC sont restées similaires. L’HIIT a diminué la PAA. En conclusion, ces résultats suggèrent que six semaines d’HIIT n’affectent pas la fonction cardiaque de repos, ni la VFC, mais permettent de diminuer la PAA d’athlètes d’endurance.
v
Abstract
There is still a lot of interrogations regarding the mechanisms underlying the resting cardiac function adaptations of endurance athletes. High intensity interval training (HIIT) seems to be the new trend in this population. The impact of this training method on resting cardiac function in endurance athletes is still unknown. The purpose of this study was to investigate the impact of six weeks of HIIT on the cardiac function at rest, ambulatory blood pressure monitoring (ABPM) and heart rate variability (HRV) in endurance athletes. Following six weeks of HIIT, no sign of ventricular dilatation nor hypertrophy in the left ventricle (LV) were observed. Diastolic and systolic functions were preserved following training. HIIT decreased ABPM, reflected by a lowered systolic (SBP), mean (MAP) and pulse (PP) pressures. HRV remained at baseline level. These results suggest that six weeks of HIIT does not affect cardiac function at rest, nor HRV, but reduces ABP.
vii
Table des matières
Résumé ... iii
Abstract ... v
Table des matières ... vii
Liste des tableaux ... xi
Liste des figures ... xiii
Liste des abréviations... xv
Avant-propos ... xxi
Chapitre 1 : La fonction cardiaque ... 1
Le cœur ... 1 L’anatomie du cœur ... 1 La circulation sanguine ... 3 La conduction cardiaque ... 6 L’électrocardiogramme ... 9 La fréquence cardiaque ... 10 Le cycle cardiaque ... 10 La diastole ... 10 La systole ... 11 Le débit cardiaque ... 12 Le mécanisme de Frank-Starling ... 13 La contractilité ... 13 La postcharge ... 14 La pression artérielle ... 14
Les différentes mesures de pression artérielle ... 14
Les facteurs déterminants la pression artérielle ... 16
La pression veineuse ... 17
La pression ambulatoire ... 18
L’évaluation de la fonction cardiaque ... 18
Les méthodes de mesure du débit cardiaque ... 19
L’échocardiographie ... 19
Chapitre 2 : La régulation nerveuse et hormonale de la fonction cardiaque ... 25
Le système nerveux ... 25
Le système nerveux parasympathique ... 26
Le système endocrinien... 27
La régulation du débit cardiaque ... 27
La régulation nerveuse et hormonale de la fréquence cardiaque ... 28
La régulation nerveuse et hormonale du volume d’éjection systolique ... 28
La régulation de la pression artérielle ... 28
La régulation des résistances périphériques totales ... 29
Les baroréflexes ... 30
La régulation du volume sanguin ... 31
La variabilité cardiaque... 32
Le domaine temporel ... 32
Le domaine fréquentiel ... 34
Chapitre 3 : La fonction cardiaque de repos chez l’athlète ... 37
Mécanismes physiologiques à l’effort ... 37
Les adaptations de la pression artérielle ... 38
Les adaptations de la fréquence cardiaque ... 39
Les adaptations de la structure cardiaque ... 40
Les adaptations des fonctions systolique et diastolique ... 41
Les adaptations de la fonction systolique ... 41
Les adaptations de la fonction diastolique ... 42
Le cœur d’athlète ... 42
Les cardiomyopathies hypertrophiques ... 43
Chapitre 4 : Problématique ... 45
Chapitre 5 : Article scientifique ... 47
Chapitre 6 : Discussion ... 77
La fonction cardiaque de repos des athlètes d’endurance ... 77
Les structures et fonctions du ventricule gauche ... 77
Effets des deux intensités d’entraînement sur la structure et la fonction cardiaque ... 80
Le monitoring de la pression artérielle ambulatoire ... 81
Effets des deux intensités d’entraînement sur la pression artérielle ambulatoire ... 83
Le monitoring de la variabilité de la fréquence cardiaque ... 84
Effets des deux intensités d’entraînement sur la variabilité de la fréquence cardiaque ... 85
ix
1. Taille de l’échantillon ... 86
2. Spécificité de l’échantillon ... 86
3. Installation et monitoring des dispositifs Holter et MAPA ... 87
4. Mauvaise synchronisation avec la fin de session universitaire ... 87
5. Surentraînement ... 87
6. Absence d’un affûtage standardisé ... 88
7. L’utilisation de l’échocardiographie pour une étude longitudinale ... 89
Applications pratiques ... 89
Perspectives ... 90
Conclusion ... 93
xi
Liste des tableaux
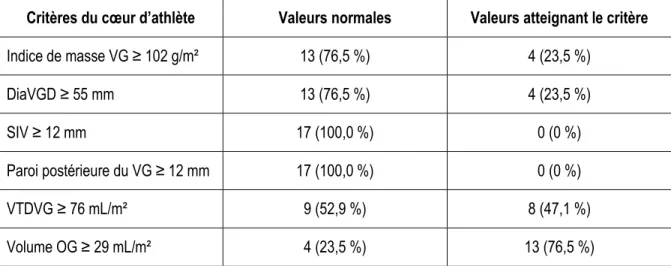
Tableau 1: Catégories de la pression artérielle chez l'adulte selon le NHLBI ... 16 Tableau 2: Fonction diastolique normale du VG mesurée par échocardiographie Doppler ... 21 Tableau 3: Comparaison des structures et fonctions du VG de nos athlètes d’endurance avec les différents critères du cœur d’athlète ... 78
xiii
Liste des figures
Figure 1: Anatomie du cœur (vue de la face antérieure) ... 3
Figure 2: Circulations systémique et pulmonaire... 5
Figure 3: Système de conduction cardiaque ... 7
Figure 4: Potentiels d’actions d’une cellule nodale et d’un myocyte cardiaque ... 9
Figure 5: Mesures des différents paramètres de la pression artérielle dans la circulation sanguine... 15
Figure 6: Image d’échocardiographie 2D, incidence à 4 cavités ... 20
Figure 7: Variabilité des intervalles RR en fonction du temps ... 33
xv
Liste des abréviations
ASDNN Moyenne des écart-types de l’intervalle RR sur des segments de 5 minutes pendant tout l’enregistrement
BF Basses fréquences
Bpm Battements par minute
CAP Cathéter artériel pulmonaire
DC Débit cardiaque
ECG Électrocardiogramme
FC Fréquence cardiaque
HF Hautes fréquences
MAPA Monitoring ambulatoire de la pression artérielle
OD Oreillette droite
OG Oreillette gauche
NN Normal to normal intervals
NNmoyen Moyenne de tous les intervalles RR dits normaux
NN50 Nombre d’intervalles NN successifs différant de plus de 50 ms
PAD Pression artérielle diastolique
PAM Pression artérielle moyenne
PAS Pression artérielle systolique
pNN50 Proportion de la division de NN50 par le total d’intervalles NN
PP Pression pulsée
RMSSD Moyenne quadratique des intervalles RR successifs
SC Surface corporelle
SDANN Écart-type de la moyenne des intervalles RR des segments de 5 minutes sur la période d’enregistrement
SDNN Écart type des intervalles NN considérés
SIV Septum interventriculaire
SNA Système nerveux autonome
SNC Système nerveux central
SNP Système nerveux parasympathique
SNS Système nerveux sympathique
TBF Très basses fréquences
VD Ventricule droit
VES Volume d’éjection systolique
VFC Variabilité de la fréquence cardiaque
VG Ventricule gauche
VO2max Consommation maximale d’oxygène
VTD Volume télédiastolique
xvii
À la mémoire de mon grand-père Jean-Paul, mon idole, avec qui j’aimerais tant pouvoir encore discuter. J’espère que tu te reposes bien dans ton petit coin de paradis et que c’est tranquille comme au lac à la Couveuse.
« Don’t stop me now, I’m having such a good time, I’m having a ball Don’t stop me now, if you wanna have a good time, just give me a call Don’t stop me now, ‘cause I’m having a good time Don’t stop me now, yeah I’m having a good time And I don’t wanna stop at all » Freddie Mercury, 1978
xix
Remerciements
Dans le cadre de mon emploi en tant qu’entraîneur-chef, je dois occasionnellement assister à des présentations données par des conférenciers experts dans le domaine de l’entraînement. Et puis voilà, cela faisait maintenant deux fois dans la même année que j’assistais à une présentation de Guy Thibault et que j’en ressortais intrigué par le monde de la recherche. Il ne m’en fallait pas plus pour décider d’aller le rencontrer à son bureau du Ministère et lui faire part de mon intérêt pour la recherche en performance sportive, ainsi que de ma déception du fait que ce créneau ne soit pas développé dans le programme de kinésiologie de l’Université Laval. Quelques semaines plus tard, j’apprenais qu’une étudiante avait la même motivation que moi et qu’un professeur du Département de kinésiologie l’avait acceptée pour une maîtrise. Comme le hasard fait souvent si bien les choses, je fus aussi accepté sous la tutelle de Patrice Brassard avec comme objectif de travailler sur le même projet que cette autre étudiante, Myriam Paquette.
Je tiens donc à remercier ces trois personnes en premier lieu, car sans elles, je n’aurais assurément pas pu passer au travers de ce projet. Patrice Brassard, mon directeur, merci pour ta disponibilité, ton support, ta rigueur bien dosée et ta motivation. Jamais je n’aurais pu tomber sur un autre directeur aussi passionné par la physiologie et la recherche que toi. Ta motivation est incroyable et je suis convaincu que cela te mènera à une carrière à la hauteur de tes attentes. Guy Thibault, mon codirecteur, en plus d’avoir été une inspiration tout au long du processus, tout a commencé grâce à toi. Merci de donner d’aussi bonnes conférences et d’avoir cette mission de vulgariser la recherche à la population. Mais surtout, merci d’avoir pris ce temps pour moi et d’avoir participé à toutes les décisions cruciales du projet Infra-Supra. Myriam Paquette, ma collègue, merci pour tout. Avoir la chance de côtoyer la meilleure étudiante au pays tous les jours, je n’en demandais pas tant. Bref, évoluer dans cet environnement d’excellence aura été toute une expérience!
D’ailleurs, l’équipe Brassard a elle aussi évolué depuis mon arrivée. Merci à tous ceux et celles qui ont participé de près et de loin au projet; Alexandra, Simon, Pascale, Louis-Charles, Andrée-Anne, Alexandre, Sophie et les autres. Je vous souhaite du succès dans tous vos projets.
Finalement, un merci spécial à mon entourage en or, qui m’a supporté tout au long de mes études. Ma famille, au grand complet, qui sera assurément très fière de me voir compléter ce diplôme. Mes amis, les gars du « Wolfpack », avec qui je passe encore toujours d’aussi bons moments. Francis, mon employeur et mon mentor, qui pourra enfin m’avoir à ses côtés à temps plein. Et Stéphanie, mon âme sœur, ma copine, avec qui j’ai bien l’intention de passer le reste de ma vie. Merci!
xxi
Avant-propos
L’article inséré dans ce mémoire a été rédigé en collaboration avec Patrice Brassard, Guy Thibault, Myriam Paquette et Dr. Paul Poirier. Il a été soumis dans la semaine du 25 septembre 2015 pour publication au « Journal of Applied Physiology ». C’est la finalisation de mon projet de maîtrise. J’ai participé à toutes les étapes du projet, que ce soit pour la recherche de commandites matérielles, le recrutement des participants, le choix des protocoles, les séances d’expérimentation et d’entraînement, l’analyse des données, j’ai également rédigé une revue de la littérature de la fonction cardiaque (non publiée) et je suis l’auteur principal de cet article.
Patrice Brassard, Ph.D., professeur-chercheur au Département de kinésiologie de l’Université Laval et chercheur au Centre de recherche de l’Institut universitaire de cardiologie et de pneumologie de Québec est le directeur de mes travaux de maîtrise. Il a contribué à chacune des étapes du projet, plus particulièrement à l’élaboration du protocole de recherche et à la révision de l’article. Ce fut l’expert à consulter pour tout questionnement en lien à la physiologie de l’exercice et la méthodologie scientifique.
Guy Thibault, Ph.D., chercheur au ministère de l’Éducation, de l’Enseignement supérieur et de la Recherche et professeur associé au Département de kinésiologie de l’Université Laval a agi comme codirecteur pour mes travaux de maîtrise, en participant à l’élaboration du protocole de recherche ainsi qu’à la révision de l’article. Ce fut l’expert à consulter pour tout questionnement en lien à l’entraînement cardiovasculaire par intervalles. Myriam Paquette a maintenant gradué à la maîtrise en kinésiologie et elle était membre de notre équipe de recherche. Dans le cadre de son projet de maîtrise connexe au mien, elle a fortement contribué à toutes les étapes du projet; au recrutement des participants, aux expérimentations et séances d’entraînement des participants et elle a également participé à la révision de cet article.
Dr Paul Poirier, cardiologue et professeur titulaire à l’Institut universitaire de cardiologie et de pneumologie de Québec, a participé à ce projet en tant que collaborateur à l’élaboration du protocole de recherche et à la révision de l’article scientifique. Son expertise nous a permis de faire des choix éclairés par rapport aux trois dimensions de l’étude, soit la fonction cardiaque de repos, la pression artérielle ambulatoire et la variabilité de la fréquence cardiaque.
1
Chapitre 1 : La fonction cardiaque
La fonction cardiaque, par définition, est le rôle que tient le cœur en permanence pour assurer la circulation sanguine et répondre aux besoins des organes et des tissus du corps humain. C’est-à-dire, pomper le sang et en contrôler le débit afin d’assurer une perfusion sanguine permettant le maintien de l’équilibre dans l’ensemble du corps. L’objectif de ce chapitre du mémoire est de présenter de façon claire et précise le cœur et ses différentes structures, ainsi que d’expliquer leurs rôles dans le système circulatoire.
Le cœur
Le système circulatoire, qu’on appelle aussi système cardiovasculaire chez l’humain, est composé de trois constituants principaux : le cœur, les vaisseaux sanguins et le sang. Le cœur est un muscle qui a comme unique fonction de pomper le sang dans les vaisseaux sanguins afin de le transporter dans tout le corps. Le cœur se situe dans le thorax au niveau du médiastin moyen, plus précisément au centre du sternum, de la colonne vertébrale et des poumons tout en reposant sur le diaphragme. Il possède une forme particulière s’apparentant à une pyramide triangulaire. Lorsque l’on observe sa face antérieure, on peut remarquer que la partie inférieure de son côté gauche forme une pointe. Il arrive cependant, pour approximativement 0,01 % des naissances, que le cœur d’une personne se retrouve dans la partie droite du thorax et que sa position soit inversée vers la droite [1]. C’est ce qu’on appelle la dextrocardie, elle peut être accompagnée ou non d’une inversion des organes ou de différentes malformations. Le cœur d’un adulte pèse en moyenne 300 grammes chez l’homme et 250 grammes chez la femme [2].
L’anatomie du cœur
Le cœur est enveloppé d’un tissu sérofibreux s’appelant le péricarde, constitué de deux feuillets (pariétal et viscéral) qui sont accolés l’un sur l’autre. L’espace entre les deux feuillets du péricarde contient un liquide lubrifiant, le liquide péricardique, qui permet de faciliter les mouvements de contraction et relaxation cardiaque. Le tissu musculaire cardiaque se trouve sous le péricarde viscéral et se nomme le myocarde. Les cellules musculaires qui forment le myocarde et permettent sa contraction sont nommées les myocytes et elles sont de type striées. D’ailleurs, ces cellules ont la particularité de pouvoir se renouveler au cours de la vie à un rythme qui décroit en fonction du vieillissement [3]. La couche interne tapissant le myocarde se nomme l’endocarde et sa couche externe l’épicarde. Les cellules tapissant la surface interne des cavités cardiaques et des vaisseaux sanguins sont les cellules endothéliales.
Il existe plusieurs façons de distinguer les parties du cœur. Tout d’abord, la base du cœur est la partie postérieure, elle est constituée de l’oreillette gauche (OG), d’une petite partie de l’oreillette droite (OD) et des extrémités proximales des veines pulmonaires et de celles des veines caves inférieure et supérieure. L’apex, la pointe à l’avant du cœur, est constitué de la partie inférolatérale du ventricule gauche (VG). L’apex et la
base du cœur se connectent par quatre faces différentes. La face antérieure est orientée vers l’avant, c’est la partie du cœur qu’on observe tout juste derrière le sternum et les côtes. Les faces pulmonaires gauche et droite sont les parties du cœur qui sont situés contre leur poumon respectif. La face diaphragmatique est la partie basse du cœur qui repose contre le diaphragme. Cependant, il est plus fréquent de simplement diviser le cœur en deux parties différentes : le cœur droit (sang désoxygéné) et le cœur gauche (sang oxygéné), chaque côté possédant un ventricule et une oreillette. Les oreillettes sont des chambres qui servent à recevoir le sang veineux se déversant dans le cœur et à l’accumuler. Les ventricules eux, sont des chambres qui ont pour rôle de pomper le sang dans la circulation sanguine au travers des artères. Ils ont une paroi plus épaisse que les oreillettes, car ils ont besoin de plus de force pour créer des pressions permettant le déplacement du sang dans tout le corps humain (VG) ainsi que dans les poumons (VD). Chaque ventricule assure la fonction de pompe pour une circulation sanguine différente (expliqué au point 1.1.2). Les deux oreillettes sont séparées par le septum interauriculaire et les deux ventricules sont séparés par le septum interventriculaire (SIV). Ces parois empêchent le sang de circuler à travers les différents compartiments. Aussi, une paroi sépare l’OD du VG, c’est le septum auriculoventriculaire.
Entre chaque oreillette et ventricule, on retrouve une valve qui a pour rôle de laisser traverser le sang en empêchant le reflux vers l’oreillette. Ce sont les valves auriculo-ventriculaires. On appelle la valve tricuspide celle qui relie l’OD au ventricule droit (VD), car elle est formée par trois valvules fibreuses. Celle qui relie l’OG au VG possède deux valvules, c’est donc la valve bicuspide (ou valve mitrale). Ces deux valves fonctionnent grâce à un processus passif, le gradient de pression. Elles ne s’ouvrent que quand la pression dans l’oreillette est plus grande que celle dans le ventricule. À l’inverse, quand la pression est plus grande dans le ventricule, les valves sont fermées et cela empêche le reflux de sang dans les oreillettes. De plus, le mouvement des valves est limité par le travail des muscles papillaires, qui sont situés dans les parois des ventricules et qui sont reliés aux valves par des cordages tendineux. Cela sert à empêcher une éventuelle éversion de la valve dans l’oreillette du fait des pressions élevées dans les ventricules. Ensuite, les deux valves se situant entre les ventricules et les troncs artériels aortique et pulmonaire sont les valves sigmoïdes. Leur fonctionnement est passif tout comme les valves auriculo-ventriculaires. Elles permettent au sang de traverser dans le tronc artériel pendant la contraction ventriculaire et elles empêchent le reflux sanguin dans le ventricule lors de la relaxation ventriculaire. Elles ne possèdent pas de cordages tendineux, la fermeture se fait uniquement par coaptation.
3
Figure 1: Anatomie du cœur (vue de la face antérieure)
Tiré du site : http://auto.img.v4.skyrock.net/7911/65517911/pics/2631540068_1.jpg
La circulation sanguine
La circulation sanguine se distingue par deux trajets différents, soit la circulation systémique et la circulation pulmonaire. Le cœur droit est associé à la circulation pulmonaire (petite circulation) tandis que le cœur gauche est associé à la circulation systémique (grande circulation). Le cœur a donc une fonction de double pompe, car il doit envoyer le sang dans deux circulations différentes.
La circulation systémique débute au niveau du VG. Ce dernier a une paroi plus épaisse que le VD, car il doit envoyer le sang sur une plus grande distance (dans presque tous les organes et tissus du corps). C’est donc pourquoi le 2/3 tiers de la masse du cœur est située du côté gauche. Le sang oxygéné pompé par le VG passera par la valve aortique afin d’arriver dans l’aorte. L’aorte se divise ensuite en plusieurs artères qui se ramifient en artères de plus en plus petites, qui deviennent éventuellement des artérioles et ensuite des vaisseaux capillaires. Le sang qui traverse l’aorte continuera de circuler par les différentes artères qu’il traverse. Ces dernières sont composées en partie de fibres musculaires lisses, l’endothélium, leur permettant de se contracter (vasoconstriction) et de se dilater (vasodilatation). Le sang oxygéné atteindra ultimement les vaisseaux capillaires d’un organe ou un tissu afin de permettre les échanges et de libérer une partie de son contenu en oxygène dans les cellules.
Ensuite, il sera recyclé par les veinules. Les veinules se regroupent et forme les veines. Une fois rendu dans les veines, le sang est drainé jusqu’aux veines caves supérieure (en haut du diaphragme) ou inférieure (sous le diaphragme) par un phénomène qu’on appelle le retour veineux. Le retour veineux est fonction de l’action de pompe des muscles squelettiques, du pouls artériel et de l’effet de succion du diaphragme [4]. Les veines se font écraser par la contraction des muscles squelettiques qui fait circuler le sang, elles possèdent des valves empêchant le sang de refluer vers l’organe d’où il provient. Les veines caves recueillent presque tout le sang désoxygéné provenant des organes et tissus du corps. L’OD se remplit de sang jusqu’à ce que sa pression interne dépasse celle du VD. C’est à ce moment que le sang désoxygéné traverse la valve tricuspide et remplit le VD. Le transfert du sang se fait d’abord par gradient de pression, mais il se termine par une contraction de l’oreillette qui permet un meilleur remplissage [5]. Cette contraction auriculaire ne renvoie qu’une très petite quantité de sang dans les veines, malgré le fait qu’il n’y ait pas de valves entre les veines caves et l’oreillette, car la contraction induit une constriction des sites d’entrée de sang veineux dans l’oreillette, ce qui augmente la résistance au flux rétrograde. Le même phénomène se produit dans la contraction de l’OG et des veines pulmonaires. La contraction de l’OG représente 15-30 % du remplissage diastolique [6].
La circulation pulmonaire débute quand le sang veineux désoxygéné du VD est pompé au travers de la valve pulmonaire et propulsé dans le tronc pulmonaire, qui lui se divise en deux artères pulmonaires pour irriguer les poumons droit et gauche. Une fois que le sang désoxygéné a traversé les artères pulmonaires et leurs ramifications, il finit par atteindre les capillaires pulmonaires des alvéoles où se produisent les échanges gazeux. C’est l’objectif ultime de la respiration, le sang désoxygéné profite des réserves d’air inspiré pour s’oxygéner. Le sang oxygéné est ensuite drainé par les veinules qui se regroupent ensuite en veines puis finalement en quatre veines pulmonaires qui acheminent le sang dans l’OG. Le sang passe ensuite au travers de la valve mitrale de la même façon qu’au travers de la valve tricuspide, c’est-à-dire par gradient de pression suivie d’une contraction de l’oreillette. Cela permet de remplir le VG de sang oxygéné et de l’acheminer dans la circulation systémique.
5
Figure 2: Circulations systémique et pulmonaire
Tiré du site : http://s3.e-monsite.com/2011/01/11/20090500grande-et-petite-circulation-v2-jpg.jpg En dehors des deux circulations, le cœur possède son propre système d’irrigation sanguine. On y retrouve des artères, artérioles, capillaires, veinules et veines comme dans les autres organes. Le sang qui traverse ces artères est le débit sanguin coronaire et il a pour origine les artères coronaires (gauche et droite) qui sont issues de l’aorte. Ces dernières drainent le sang de l’aorte qui reflue vers la valve aortique lorsque cette dernière se ferme suite à la contraction du ventricule gauche. Une fois que le sang a transféré une partie de son oxygène aux différentes cellules du cœur, il est ensuite recueilli par les veinules et les veines cardiaques qui se rejoignent pour la plupart dans un plus gros vaisseau qui est le sinus coronaire. Ce dernier termine sa route au même endroit que les veines caves, c’est-à-dire dans l’OD.
D’autre part, il est aussi important de comprendre que la circulation sanguine est un système influencé par des variables hémodynamiques qui sont constamment en relation, soit la pression artérielle, le débit sanguin et la résistance à l’écoulement. Le sang se déplace toujours d’une zone de forte pression vers une zone de plus faible pression. La pression exercée par le liquide qu’est le sang se nomme la pression artérielle et représente la force par unité de surface que le sang exerce sur la paroi d’un vaisseau. L’origine de cette pression est l’action de pompe du cœur qui provoque l’écoulement du sang. Une fois le sang rendu dans la circulation
systémique, la pression sanguine va varier tout au long du système cardiovasculaire en fonction de la différence de pression et de la résistance. On mesure le débit en unité de volume par unité de temps (ex : L/min). Le débit sanguin se calcule par la division du différentiel de pression sur la résistance, soit par la formule Q = ∆P / R [4]. La mesure de la pression artérielle, ou des différences de pressions, se fait en millimètres de mercure (mm Hg), car à l’origine on déterminait la pression artérielle en fonction de la hauteur d’une colonne de mercure qu’elle pouvait soulever [7].
La résistance, elle, se mesure entre deux points pour une différence de pression donnée. C’est le frottement qui entrave le flux sanguin. Cette friction du sang sur la paroi des vaisseaux se manifeste de façon plus importante loin du cœur, c’est pourquoi on parle en général de résistance périphérique. On la calcule par la formule R = 8Lη / πr4 où L représente la longueur du vaisseau, η est la viscosité du sang, r est le rayon interne du vaisseau et 8/π est une constante mathématique. Donc, plus un vaisseau sanguin est long, plus la résistance y sera grande. La viscosité du sang (résistance inhérente d’un liquide à l’écoulement) affecte aussi la résistance, mais elle est relativement constante chez un individu sain. Comme la viscosité et la longueur des vaisseaux sanguins sont normalement invariables chez un adulte, le diamètre des vaisseaux est donc le facteur qui a le plus d’influence sur la résistance périphérique. Plus un vaisseau sanguin est petit, plus la friction sera forte, car la proportion de sang en contact avec les parois est alors plus grande. C’est ce qui explique qu’une fois rendu dans les artérioles et les capillaires sanguins, où le diamètre des vaisseaux est parfois extrêmement petit, la circulation sanguine est beaucoup plus lente que dans les grosses artères près du cœur. On ne peut donc pas mesurer la résistance vasculaire directement. Par contre, on peut la calculer lorsqu’on connait le débit et la différence de pression.
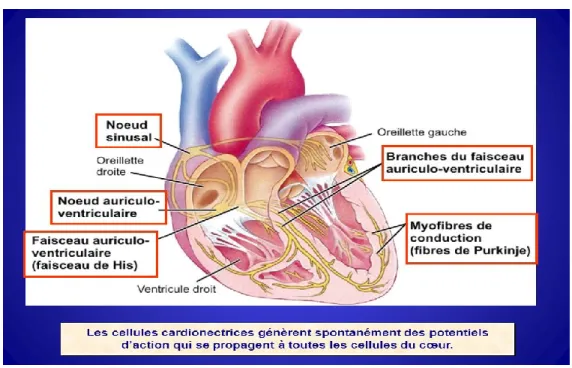
La conduction cardiaque
Le cœur est un organe particulier, car il est constitué d’un tissu nodal qui lui confère la faculté de se contracter de façon automatique. C’est-à-dire qu’il possède des cellules musculaires non-contractiles (cardionectrices ou nodales) qui émettent des influx nerveux à intervalles réguliers. Une fois transférés, ces influx ont pour fonction de stimuler les cellules myocardiques contractiles. Cette séquence automatique et hiérarchisée allant de l’impulsion électrique initiale jusqu’à la contraction des ventricules se nomme la conduction intracardiaque. Les cellules cardionectrices et les myocytes cardiaques possèdent des jonctions communicantes qui permettent la propagation des potentiels d’action d’une cellule à l’autre. Une fois l’influx nerveux transmit, les myocytes cardiaques convertissent l’énergie chimique en énergie mécanique et c’est de cette façon qu’elles se contractent pour pomper le sang. Le cœur n’a pas besoin de recevoir une commande du système nerveux pour effectuer une contraction. En fait, en l’absence de toute stimulation nerveuse ou humorale, le cœur bat aux environs de 100 battements par minute (bpm) [8].
7 L’activité électrique cardiaque prend naissance au niveau du nœud sinusal, qui se situe dans l’OD (près de l’embouchure de la veine cave supérieure). Elle permet le début de la dépolarisation auriculaire. On appelle rythme sinusal la fréquence à laquelle le nœud sinusal génère une impulsion électrique, soit de 60 à 100 fois par minute [9]. Le nœud sinusal est souvent comparé à un pacemaker. L’impulsion électrique du nœud sinusal se diffuse très rapidement d’une cellule à l’autre dans les deux oreillettes jusqu’à l’atteinte du nœud auriculo-ventriculaire (situé à la base de l’oreillette droite). C’est ce qui déclenche la contraction presque simultanée des oreillettes lors du remplissage ventriculaire. Le nœud auriculo-ventriculaire transmet l’impulsion électrique de façon plus lente vers le faisceau de His (ou faisceau auriculo-ventriculaire), qui se situe au niveau du SIV. Ce léger délai du transfert des potentiels d’action permet aux oreillettes de terminer leur contraction avant que commence celle des ventricules. Le faisceau de His permet un transport rapide de l’influx jusqu’à l’apex du cœur. C’est là que commence la dépolarisation des ventricules. Le faisceau se divise en deux branches destinées à chacun des ventricules, la droite étant plus longue que la gauche. Ces branches se divisent en plusieurs ramifications constituant le réseau de Purkinje; elles assurent la transmission de l’influx à l’ensemble des myocytes des deux ventricules afin d’engendrer une contraction simultanée de ceux-ci. La contraction est légèrement plus précoce au niveau de l’apex, ce qui rend la contraction encore plus efficace.
Figure 3: Système de conduction cardiaque
Tiré du site : http://images.slideplayer.fr/3/1145790/slides/slide_39.jpg La conduction des potentiels d’action dans les myocytes cardiaques se fait de façon assez similaire à celle des cellules musculo-squelettiques. Au repos, la membrane cytoplasmique est beaucoup plus perméable au potassium qu’au sodium. La dépolarisation initiale du potentiel d’action est rapide et elle se fait grâce à une augmentation par rétrocontrôle positif de la perméabilité au sodium. La perméabilité au potassium diminue et cela contribue à la dépolarisation membranaire. Par la suite, contrairement aux cellules des muscles
squelettiques, la perméabilité au sodium de la membrane baisse et elle atteint un plateau à 0 mV au lieu de continuer à se repolariser. Ce plateau est dû au fait que la perméabilité au potassium reste inférieure à la valeur de repos (car les canaux restent fermés suite à la dépolarisation initiale) et que car la perméabilité au calcium est augmentée (ce phénomène est aussi engendré suite à la dépolarisation initiale). Les canaux calciques s’ouvrent plus lentement que les canaux sodiques et ils restent ouverts plus longtemps. C’est ce qui explique que la cellule myocardique reste dépolarisée tout au long de la contraction. Il y a donc entrée d’ions calcium dans la cellule via des canaux calciques de type L de la membrane qui sont potentiel-dépendants. Ces ions calcium sont à l’origine du couplage excitation-contraction, ils permettent la libération d’une plus grande quantité de calcium par le réticulum sarcoplasmique et c’est ce qui génère la contraction. Plus le niveau de calcium libéré dans le cytoplasme de la cellule est élevé, plus les sites de fixation de la troponine sont saturés, donc plus le nombre de ponts transversaux actifs est élevé et plus grande est la force de contraction du myocarde. Les canaux calciques finissent par s’inactiver et c’est à ce moment que d’autres canaux potassiques s’ouvrent pour repolariser la membrane. De plus, une différence majeure avec les cellules du muscle squelettique est que les myocytes cardiaques possèdent une période réfractaire beaucoup plus longue (250 ms au lieu de 1 à 2 ms) [4]. En fait, elles sont incapables de générer une contraction tétanique soutenue, car le muscle ne peut être excité assez tôt pour qu’il y ait sommation des contractions (comme c’est le cas dans le muscle squelettique). La période réfractaire fait suite au potentiel d’action, elle représente le temps où la membrane ne peut être ré-excitée. Le potentiel d’action dans les myocytes cardiaques subit un plateau; cela allonge la période réfractaire. Elle est presque aussi longue que la période de contraction, alors que c’est tout le contraire dans le muscle squelettique.
D’autre part, la conduction dans les cellules cardionectrices se produit d’une façon très différente. Le nœud sinusal, par son potentiel de « pacemaker », amène le potentiel membranaire au seuil de façon graduelle et cela initie un potentiel d’action qui déclenche la dépolarisation de d’autres cellules cardiaques. Tout commence par une diminution progressive de la perméabilité de la membrane au potassium, ce qui implique la fermeture des canaux potassiques. Ensuite, des canaux cationiques (canaux sodiques de type F), c’est-à-dire des canaux qui s’ouvrent lorsque le potentiel membranaire est négatif, laissent entrer des ions sodium dans la cellule. Il y a un troisième type de canaux, soit les canaux calciques de type T, qui s’ouvrent très brièvement suite à l’ouverture des canaux sodiques de type F. Ces mécanismes de pacemaker permettent au potentiel membranaire d’atteindre le seuil, ce qui engendre un potentiel d’action. Ce sont ensuite les canaux calciques de type L qui entament la dépolarisation en laissant entrer d’autres ions calcium dans la cellule. Tout se termine par l’ouverture des canaux potassiques qui permettront la repolarisation de la membrane. Lorsque le potentiel membranaire redevient négatif, les mécanismes de pacemaker sont de nouveau activés et le cycle recommence. C’est ce qui confère l’automatisme au nœud sinusal.
9
Figure 4: Potentiels d’actions d’une cellule nodale et d’un myocyte cardiaque
Tiré du site : https://brunoanselme.files.wordpress.com/2014/04/cellules-cardiaques.jpg
L’électrocardiogramme
L’électrocardiogramme (ECG) est le tracé que l’on obtient grâce à un appareil, l’électrocardiographe, qui permet de détecter l’activité électrique cardiaque retransmise jusqu’à la peau au travers les liquides extracellulaires. C’est une méthode qui est fréquemment utilisée pour dépister des pathologies cardiaques [10]. On l’utilise tant au repos qu’à l’effort. Son analyse peut permettre de repérer rapidement des anomalies du rythme cardiaque. Trois complexes principaux caractérisent les battements cardiaques sur le tracé qu’est l’ECG. L’onde P, qui est de faible amplitude, représente le passage de l’impulsion électrique du nœud sinusal au nœud auriculoventriculaire, soit la dépolarisation des oreillettes. Le complexe QRS comprend trois ondes et représente la dépolarisation des ventricules, soit le passage de l’impulsion électrique du faisceau de His au réseau de Purkinje jusqu’aux parois des ventricules. D’ailleurs la repolarisation des oreillettes est masquée, car elle se produit durant le complexe QRS et elle est de plus faible amplitude. L’onde T, qui est aussi de faible amplitude, représente l’impulsion électrique de la repolarisation des ventricules. L’ECG ne mesure pas directement l’activité électrique des myocytes cardiaques, il mesure les courants retransmis dans le liquide extracellulaire qui eux sont influencés par différentes cellules cardiaques. La position des électrodes peut varier afin d’obtenir différentes dérivations (12) de l’ECG, ce qui affectera le tracé des ondes P, QRS et T.
La fréquence cardiaque
Lorsque le tracé de l’ECG est normal et qu’il y a une onde P avant chaque complexe QRS, on dit que le rythme est sinusal, c’est-à-dire que le rythme des battements est régulier et se situe entre 60 et 100 bpm [10]. Chaque onde P est identique et est suivie d’un complexe QRS et chaque complexe QRS est précédé d’une onde P. Lorsque la fréquence sinusale est sous les 60 bpm, c’est une situation de bradycardie sinusale. Lorsque la fréquence sinusale est au-dessus de 100 bpm, c’est une situation de tachycardie sinusale. Cependant, certains auteurs proposent de modifier les valeurs à 50 et 90 bpm [9]. La fréquence cardiaque de repos est une mesure qui varie beaucoup d’un individu à l’autre, car elle peut être modulée par plusieurs facteurs d’origine différente. Bien qu’elle soit dictée à l’origine par la fonction « pacemaker » du nœud sinusal, la fréquence cardiaque est aussi régulée par le système nerveux autonome (SNA) [11]. La régulation nerveuse de la fréquence cardiaque est expliquée dans le chapitre 2 du mémoire, tout comme l’effet de certaines hormones et de certains récepteurs mécaniques. Plusieurs variables physiologiques ont aussi un effet sur la fréquence cardiaque : l’âge, le sexe, l’entraînement à l’exercice, les émotions, la température et le stress, etc.
Le cycle cardiaque
Bien que le cœur puisse battre à différentes fréquences, cela se produit toujours sous la forme d’un cycle de contractions et de relaxations. Et ce, peu importe le rythme des battements. C’est ce qu’on appelle le cycle cardiaque. Que ce soit au niveau des oreillettes ou des ventricules, deux phases principales caractérisent le cycle cardiaque : la systole et la diastole. La systole représente la période de temps où le ventricule se contracte afin d’éjecter son sang dans un tronc artériel. La diastole représente la période de temps où le ventricule se relaxe et se remplit de sang. Ces deux phases du cycle cardiaque s’enchaînent et se répètent sans cesse tant que le cœur d’un individu continu de battre. Les étapes caractérisant ces phases sont les mêmes pour les deux ventricules, cependant les pressions systolique et diastolique du VD et du tronc pulmonaire sont plus basses que celles du VG et du tronc aortique.
La diastole
La diastole se divise en quatre phases principales, soit la relaxation ventriculaire isovolumétrique, le remplissage ventriculaire, la diastase et la contraction auriculaire [12]. La séquence caractérisant le début de la diastole se nomme la protodiastole et elle débute par la relaxation ventriculaire isovolumétrique, soit à la toute fin de la systole. C’est le début de la repolarisation ventriculaire (onde T). La pression devient plus basse dans les ventricules que dans les troncs artériels remplis de sang, ce qui ferme les valves aortiques et pulmonaires. Les ventricules se relâchent et les valves auriculoventriculaires restent fermées, car la pression ventriculaire est toujours plus grande que la pression auriculaire. Cette phase se termine quand la pression
11 ventriculaire devient plus basse que la pression auriculaire. C’est à ce moment que s’ouvrent les valves auriculoventriculaires afin de pouvoir transférer le sang veineux des oreillettes dans les ventricules. C’est le remplissage précoce, il correspond à environ 70 % du remplissage sanguin du VG et se fait simplement par gradient de pression [13]. La contraction ventriculaire précédente a comprimé les éléments élastiques du ventricule de façon à ce que ce dernier tend à s’épandre, ce qui abaisse sa pression interne rapidement et augmente la vitesse du débit sanguin au début du remplissage. La pression ventriculaire continue de diminuer malgré son remplissage, elle peut même devenir négative pour un court laps de temps [14]. Plus la pression interne du ventricule est diminuée lors de la relaxation isovolumétrique, plus forte sera la succion aspirant le sang de l’oreillette lors du remplissage précoce [5]. Donc même pour une pression auriculaire basse, ce phénomène d’aspiration permet au remplissage ventriculaire d’avoir lieu. Les valves sont maintenues ouvertes tant que la pression auriculaire reste supérieure à la pression ventriculaire, cela permet éventuellement au sang provenant des veines de continuer son chemin directement dans le ventricule. C’est la diastase (ou mésodiastole), les pressions de l’OG et du VG s’équilibrent et le remplissage est maintenant plus lent. Pendant ce temps, le sang quitte les troncs artériels vers les circulations pulmonaire et systémique (ainsi que dans les artères coronaires), ce qui diminue la pression dans les troncs artériels. Tout juste avant la fin de la diastole (télédiastole), le nœud sinusal envoie un influx qui déclenche la contraction des oreillettes (remplissage tardif). Cette contraction augmente la pression auriculaire et permet de faire passer un dernier volume de sang dans le ventricule. La contraction de l’OD survient tout juste avant celle de l’OG. Le volume de sang contenu dans le ventricule à la fin de la diastole se nomme le volume télédiastolique (VTD). Finalement, le remplissage ventriculaire dépend de quatre facteurs principaux; la fréquence cardiaque (influence la durée de la diastole), la relaxation du myocarde (influence la pression dans le ventricule), les caractéristiques de l’OG, de la valve auriculoventriculaire et des veines pulmonaires ainsi que les caractéristiques passives du VG (principalement la compliance, soit la distensibilité des parois du ventricule).
La systole
La systole se divise en deux évènements principaux, soit la contraction ventriculaire isovolumétrique et l’éjection ventriculaire. La contraction ventriculaire isovolumétrique se produit lorsque les valves auriculoventriculaires, aortique et pulmonaire sont fermées. Cela se produit immédiatement après la contraction auriculaire. L’influx nerveux envoyé par le nœud sinusal a atteint le nœud auriculoventriculaire et continue vers le tissu ventriculaire afin de déclencher la dépolarisation des ventricules (complexe QRS). Les fibres myocardiques des ventricules se contractent, mais ne peuvent se raccourcir car les valves sont fermées et le sang est incompressible. Le sang ne peut pas être éjecté, donc le volume à l’intérieur du ventricule reste le même. Cette contraction isovolumétrique augmente donc la pression à l’intérieur du ventricule très
rapidement, ce qui a d’ailleurs refermé la valve auriculoventriculaire (pour empêcher le reflux sanguin dans l’oreillette) presque instantanément.
Une fois que cette pression excède celle des troncs artériels, les valves sigmoïdes s’ouvrent et c’est le début de l’éjection ventriculaire. La pression étant élevée à l’ouverture de la valve, la vitesse du débit sanguin atteint sa valeur maximale au début de l’éjection ventriculaire et elle diminue par la suite. La pression ventriculaire continue d’augmenter car plus les fibres myocardiques se raccourcissent plus le volume de sang ventriculaire diminue, ce qui permet une meilleure contraction donc une meilleure éjection du sang. La pression dans les troncs artériels augmente selon la pression ventriculaire, les valves sigmoïdes n’opposent qu’une très faible résistance au flux sanguin. Les valeurs maximales de pression ventriculaire et de pression dans les troncs artériels sont atteintes avant la fin de la systole, la force de la contraction ventriculaire diminue même si cette dernière n’est pas encore terminée. On passe alors d’une phase d’accélération vers une phase de décélération. La vitesse d’éjection diminue donc en fin de systole et elle devient éventuellement plus lente que la vitesse à laquelle le sang circule dans les artères, ce qui diminue la pression dans le tronc artériel et résulte en débit sanguin continu entre le VG et l’aorte [15].
Une des particularités du VG lors de la systole est la torsion créée par la contraction de sens opposé entre les fibres de la région de l’apex (sens antihoraire) et celle des fibres de la région basale (sens horaire), ce qui permet d’améliorer l’éjection ventriculaire [16]. D’ailleurs, le remplissage diastolique du VG est aussi favorisé par ce mécanisme, car lorsque la contraction se termine et que les fibres reprennent leur orientation d’origine, cela produit un effet de succion dans l’OG [5]. Le volume sanguin restant dans le ventricule à la fin de la systole se nomme le volume télésystolique (VTS). Le volume de sang que les ventricules éjectent à chaque battement au travers des valves sigmoïdes se nomme le volume d’éjection systolique (VES). On peut le calculer par la formule VES = VTD – VTS. Au repos, les valeurs moyennes de ces volumes au niveau du VG pour un adulte sont de 70 mL pour le VES, 132 mL pour le VTD et 65 mL pour le VTS, mais elles sont très variables au travers de la population [4]. Finalement, la contraction du VG commence tout juste avant celle du VD.
Le débit cardiaque
Le débit cardiaque (DC) est le volume total de sang (normalement exprimé en litres) pompé par minute par chaque ventricule. C’est le volume de sang qui traverse la circulation systémique ou pulmonaire à chaque minute. Il se calcule par la formule suivante : DC = FC X VES où FC est la fréquence cardiaque en battements par minute et VES est le volume d’éjection systolique en L par battement. La valeur moyenne du débit cardiaque d’un homme au repos est d’environ 5,0 L/min [17]. C’est également une valeur qui est très variable entre les individus. Le volume sanguin total d’un homme est d’environ 5,0 L, ce qui implique que tout le sang fait le trajet d’une circulation en une minute au repos. À l’effort, les deux paramètres déterminant le débit
13 cardiaque peuvent augmenter de façon à ce que le débit cardiaque d’un individu sédentaire non entrainé puisse atteindre 20-25 L/min et celui d’un athlète jusqu’à plus de 35 L/min [17, 18]. Le volume sanguin total fait alors le trajet du circuit plusieurs fois par minute. Tel que mentionné au point 1.1.5, la fréquence cardiaque est sous l’influence des systèmes nerveux et endocrinien et ces mécanismes sont expliqués au chapitre 2. En règle générale, la stimulation des nerfs parasympathiques diminue la fréquence cardiaque tandis que celle des nerfs sympathiques l’augmente [19]. L’activité parasympathique est celle qui prédomine au repos, ce qui explique que la fréquence cardiaque de repos moyenne soit d’environ 70 bpm. Le VES peut lui aussi être modulé. En effet, comme les ventricules ne se vident pas complètement lors de la systole, une augmentation de la force de contraction (contractilité) peut ainsi augmenter le VES. Plusieurs facteurs différents peuvent affecter le contrôle du VES. Les principaux sont les modifications du VTD (aussi appelé la précharge), les modifications de l’amplitude des influx du système nerveux sympathique envoyés vers les ventricules et la postcharge, soit la pression dans les artères s’opposant au sang pompé par les ventricules.
Le mécanisme de Frank-Starling
Le mécanisme de Frank-Starling est une relation longueur-tension dans les ventricules, baptisé d’après le nom des deux physiologistes qui l’ont découvert. Le principe est le suivant : une augmentation de la pression de remplissage du ventricule résulte en une augmentation de la force de contraction de ce dernier. Plus le VTD est grand, plus les fibres myocardiques sont étirées, plus le ventricule va développer de force dans sa contraction et plus grand sera le VES [20]. Cela signifie que pour une fréquence cardiaque donnée, une augmentation du retour veineux résulte en une augmentation du VTD, donc une augmentation du VES et du débit cardiaque. De plus, ce mécanisme est essentiel pour réguler le volume sanguin total entre les deux circulations sanguines [21]. Par exemple, si la circulation pulmonaire augmente par un plus grand pompage du VD, le remplissage du VG augmente et cela résulte en une augmentation du pompage du VG, donc une augmentation du débit sanguin de la circulation systémique.
La contractilité
D’autre part, il faut éviter de confondre une augmentation de la force de contraction par augmentation du VTD tel que par le mécanisme de Frank-Starling, avec une augmentation de la contractilité qui, elle, peut provenir d’une stimulation nerveuse ou humorale. La contractilité est justement définie par une augmentation de la force de contraction pour un même VTD. L’augmentation de la contractilité représente une éjection plus complète du VTD. On l’observera au travers de la fraction d’éjection, qui représente la vidange du ventricule. La fraction d’éjection se calcule par le rapport de VES/VTD et elle est exprimée en pourcentage. Elle varie
entre 55-75 % dans des conditions de repos [22]. Elle dépend de la contractilité, de la postcharge, du VTS, du VTD et du volume sanguin initial.
La postcharge
La postcharge est fonction de la pression artérielle, elle représente la force de résistance que rencontrent les fibres myocardiques lors de leur contraction. Plus la pression artérielle est grande, plus la charge à vaincre par le ventricule est grande. La fraction de raccourcissement du myocarde et sa vélocité de contraction sont donc inversement proportionnelles à la postcharge. Cependant, chez l’individu en bonne santé, elle est un facteur qui a beaucoup moins d’influence sur le VES que le mécanisme de Frank-Starling et la contractilité.
La pression artérielle
La pression sanguine artérielle, définie auparavant dans le mémoire comme la sommation des forces exercées par le sang par unité de surface de la paroi des artères, varie pendant le cycle cardiaque. Dans un système de circulation où tous les conduits sont de même dimension, la pression diminue au fur et à mesure que le fluide s’éloigne de la pompe. C’est ce qu’on observe aussi dans le corps humain, même si les vaisseaux sanguins n’ont pas tous la même dimension. Les artères qui sont le plus prêt du cœur sont celles où la pression mesurée est la plus élevée. Cette pression diminue au fur et à mesure que le sang atteint les artérioles, cela continue dans le même sens dans les vaisseaux capillaires. La pression dépend du volume sanguin et de la compliance du vaisseau. La compliance peut être vue comme la facilité d’un vaisseau sanguin à s’étirer. Tout comme la fréquence cardiaque, la pression artérielle est régulée par plusieurs mécanismes. Le SNA, le système endocrinien, des récepteurs mécaniques et des facteurs locaux peuvent tous avoir un impact sur la régulation de la pression artérielle. Les mécanismes de régulation de la pression artérielle sont expliqués dans le chapitre 2 du mémoire.
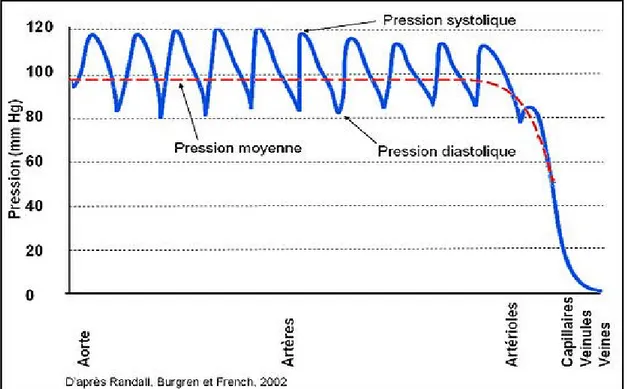
Les différentes mesures de pression artérielle
La pression artérielle systolique (PAS) est la pression maximale atteinte dans un vaisseau lors de la systole. La pression artérielle diastolique (PAD) est la pression sanguine minimale atteinte lors de la diastole. On mesure généralement la PAS et la PAD avec un sphygmomanomètre. Un brassard avec un stéthoscope installé au niveau de l’artère brachiale est relié à une colonne de mercure ou à un dispositif affichant des valeurs numériques. Le principe est simple, on gonfle tout d’abord la pression du brassard de façon à ce qu’elle soit plus élevée que la PAS, il n’y a donc pas de bruit audible dans le stéthoscope car cela crée une occlusion de l’artère. Il faut ensuite dégonfler lentement le brassard. La pression affichée sur la colonne de mercure ou le dispositif à l’apparition du premier bruit de Korotkoff correspond à la PAS et celle du dernier bruit à la PAD [23]. Ces bruits sont causés par la turbulence du sang dans le vaisseau qui s’ouvre tranquillement et qui fait traverser le sang à grande vitesse par gradient de pression. On exprime les pressions
15 artérielles systolique et diastolique en mm Hg. La pression artérielle moyenne (PAM), représente la moyenne de la pression artérielle durant un cycle cardiaque. On peut l’estimer par différentes formules, dont PAM = PAD + (PAS - PAD / 3) [23]. Au repos, la diastole dure normalement le deux tiers d’un cycle cardiaque et la systole l’autre tiers, la formule de la PAM en tient compte. La PAM est très importante, car elle représente la pression de perfusion dans tout l’organisme pendant tout le cycle cardiaque. Elle semble d’ailleurs être la valeur la plus fiable pour le pronostic de problèmes cardiovasculaires [24]. La PAM est aussi égale au produit du débit cardiaque et des résistances périphériques totales. La pression pulsée (PP), aussi appelée la pression différentielle, est la pression apportée par le battement d’un cycle cardiaque (un pouls). Elle se calcule donc par la différence entre la PAS et PAD (PP = PAS - PAD) [23].
Figure 5: Mesures des différents paramètres de la pression artérielle dans la circulation sanguine
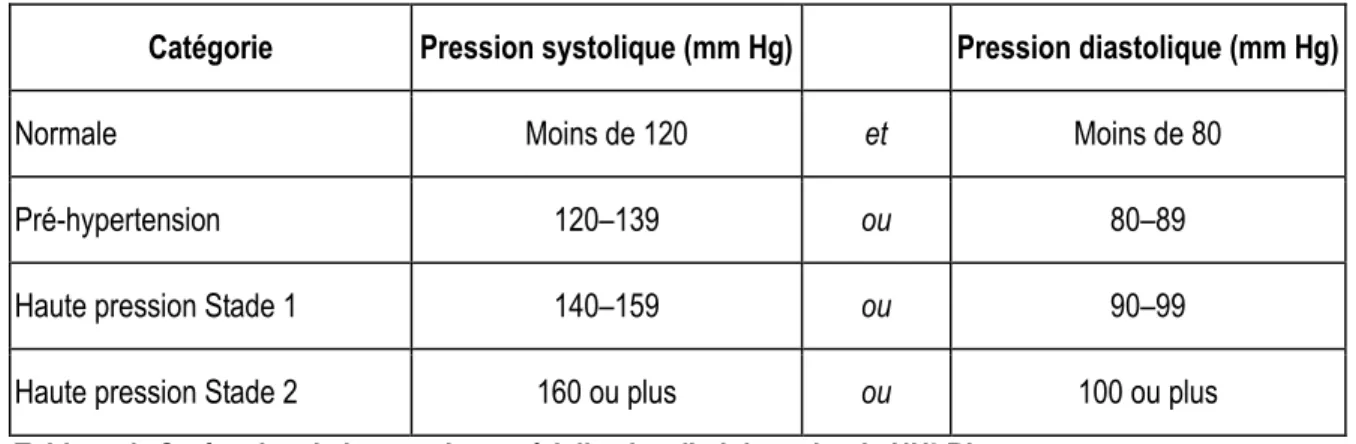
Voici également les différentes classifications de la pression artérielle, selon le National Heart, Lung and Blood
Institute des États-Unis (NHLBI). L’hypertension artérielle est un facteur de risque des maladies
cardiovasculaires, son dépistage a donc une importance primordiale pour la santé de la population [25].
Catégorie Pression systolique (mm Hg) Pression diastolique (mm Hg)
Normale Moins de 120 et Moins de 80
Pré-hypertension 120–139 ou 80–89
Haute pression Stade 1 140–159 ou 90–99
Haute pression Stade 2 160 ou plus ou 100 ou plus
Tableau 1: Catégories de la pression artérielle chez l'adulte selon le NHLBI
Tiré et traduit du site: http://www.nhlbi.nih.gov/health/health-topics/topics/hbp
Les facteurs déterminants la pression artérielle
Les principaux facteurs déterminants la pression artérielle sont le VES, la vitesse d’éjection du VES et la compliance artérielle (distensibilité). Plus le VES ainsi que la vitesse à laquelle le sang est éjecté sont élevés, plus la pression dans l’artère augmentera. Pour la compliance, plus une artère est rigide (manque d’élasticité), plus grande sera la pression dans cette artère. Les artères sont des conduits où la résistance à l’écoulement est relativement faible. En fait, elles sont riches en tissu élastique, ce qui leur permet d’accumuler du sang et de servir de réservoir de pression. Cette fonction très importante permet aux artères de participer au pompage du sang, même pendant la diastole. En effet, seulement le tiers du VES quitte les artères durant la systole. Le reste du sang s’accumule par distension des parois de l’artère. Cela augmente la pression dans l’artère et une fois l’éjection du ventricule terminée, pendant la diastole, l’artère se resserre progressivement et cela expulse le reste du sang vers les artérioles. La pression dans les artères ne descend pas jusqu’à zéro. Comme l’éjection de sang vers les artérioles est progressive, il reste encore du sang dans les artères à la contraction ventriculaire suivante.
Les artérioles, dont le diamètre est nettement inférieur aux artères, sont les vaisseaux où la résistance périphérique est la plus importante. La proportion des fibres élastiques de la paroi est moins importante que pour les artères, mais la proportion de la paroi en fibres musculaires lisses est plus importante. Leur forte capacité à produire une vasoconstriction et une vasodilatation leur permet de contrôler le rayon, donc le diamètre du vaisseau, et de réguler le débit sanguin en fonction des besoins des différents organes ou tissus du corps. Elles ont donc une forte influence sur le débit sanguin dans les vaisseaux capillaires et sur la PAM. On appelle le tonus intrinsèque la capacité des artérioles à fournir une constriction spontanée qui permet d’augmenter ou de diminuer le débit sanguin. Elles sont soumises à un contrôle extrinsèque du SNA tout
17 comme les artères, mais elles ont aussi des mécanismes intrinsèques indépendants des systèmes nerveux et endocrinien. Les mécanismes intrinsèques sont aussi appelés les contrôles locaux, on y retrouve l’hyperhémie active et réactive, l’autorégulation du débit et la réponse à un traumatisme. L’hyperhémie active est une augmentation du débit sanguin par vasodilatation suite à une augmentation de l’activité métabolique de l’organe concerné. On observe une baisse locale de la concentration en oxygène (O2) du tissu, alors que celle de plusieurs autres métabolites augmente (dioxyde de carbone (CO2), ions hydrogènes (H+), adénosine, etc.). L’hyperhémie réactive est une augmentation du débit sanguin dans un organe faisant suite à une interruption du débit. On observe une vasodilatation des artérioles (due à la présence des facteurs locaux) pendant que le débit sanguin est interrompu. Dès que la résistance à l’écoulement est levée, le débit sanguin au travers des artérioles devient plus élevé. La vasodilatation artériolaire constatée lors de l’autorégulation du débit est fonction des mêmes facteurs que l’hyperhémie active. La différence est qu’elle n’est pas déclenchée suite à une augmentation de l’activité métabolique mais plutôt suite à une diminution de la pression artérielle d’un organe. Finalement, tout traumatisme impliquant une lésion tissulaire s’accompagne d’une relaxation du muscle artériolaire de l’organe ou du tissu.
Les capillaires sanguins sont des vaisseaux encore plus petits que les artérioles. Ils offrent une résistance assez élevée au flux sanguin. Cependant, ce sont les vaisseaux sanguins les plus nombreux et ils occupent une surface transversale énorme, ce qui diminue la résistance totale du sang circulant à leur niveau. Ils atteignent tous les organes et tissus du corps et rejoignent pratiquement toutes les cellules. Ce sont les vaisseaux où le sang circule le plus lentement, car ce sont ceux où il y a le plus de ramifications, ce qui est idéal pour optimiser les processus d’échanges de gaz, de nutriments et de produits métaboliques. Car plus le sang circule lentement, plus il y a de temps disponible pour les échanges. Le capillaire typique est constitué d’une seule couche d’endothélium. Le débit sanguin dans les capillaires dépend de deux facteurs principaux. Le premier est le débit sanguin artériolaire. La vasodilatation des artérioles augmente le débit dans les capillaires tandis que la vasoconstriction a l’effet contraire. Le deuxième facteur est la présence de sphincters précapillaires, qui sont des anneaux de muscle lisse pouvant se contracter ou se relâcher en fonction des facteurs métaboliques locaux. Plus le nombre de sphincters ouverts est élevé, plus le débit sanguin dans l’organe sera grand.
La pression veineuse
Une fois hors des capillaires, le sang s’écoule dans les veinules puis dans les veines. Les veines sont des vaisseaux sanguins où la pression interne est beaucoup plus basse que dans les artères. Comme la pression du sang dans les capillaires est rendue très basse suite à la résistance qui lui a été opposée et la distance qu’il a parcourue, l’action de pompe du cœur ne suffit plus pour faire retourner le sang à l’oreillette droite. Les veines sont des vaisseaux très compliants, la majeure partie du volume sanguin s’y accumule. Comme la
pression dans l’OD est presque nulle, le principe de gradient de pression permet d’attirer le sang. Cependant, la pression dans les veines périphériques (en dehors de la cage thoracique) est très faible donc la vitesse à laquelle le sang retourne vers le cœur l’est aussi. De plus, les veines périphériques possèdent des valvules qui empêchent le reflux sanguin. Le retour veineux est aussi possible par l’effet de succion et de pression créé par le pompage des muscles squelettiques et respiratoires (augmentation de la pression abdominale). La pression veineuse est régulée par le système nerveux sympathique, qui peut réduire le diamètre de façon réflexe par vasoconstriction suite à une modification du volume sanguin. Les veines sont des vaisseaux tellement compliants que cette vasoconstriction augmente le flux sanguin plutôt que de le réduire comme dans les artérioles. Des variations du retour veineux affectent donc le volume télédiastolique et cela résulte en des changements du débit cardiaque.
La pression ambulatoire
Bien que la pression artérielle de repos soit un paramètre physiologique intéressant, il est souvent plus pertinent de la mesurer de façon ambulatoire, c’est-à-dire à plusieurs moments d’une journée, comme par exemple pendant 24 heures. Le monitoring ambulatoire de la pression artérielle (MAPA) est un dispositif portatif qui permet de recueillir plusieurs mesures de la pression artérielle au cours d’une journée, en fonction du protocole désiré. Les principales mesures obtenues sont la PAS, PAD, PAM et PP ainsi que la fréquence cardiaque à chaque mesure de pression. Des logiciels permettent ensuite d’obtenir les moyennes, les valeurs maximales et minimales ainsi que de tracer des graphiques représentant la pression artérielle en fonction du temps, ainsi que de différencier les valeurs de la journée complète à celles du jour et de la nuit. Les dispositifs MAPA calculent la PAM grâce à différents algorithmes. Cette valeur fournie par l’appareil est presque toujours différente de la valeur calculée par la formule PAM = PAD + (PAS - PAD / 3) [23]. Il est donc préférable de calculer les valeurs de PAM en fonction des valeurs de PAS et de PAD recueillies au cours de l’enregistrement. Le MAPA permet de différencier une hypertension artérielle temporaire (syndrome de la blouse blanche) à une hypertension artérielle chronique. Il reflète donc mieux la pression artérielle du sujet au quotidien [26, 27]. Les valeurs obtenues sont de 10 à 50 % plus basse qu’en clinique. C’est un outil qui permet le dépistage de plusieurs maladies cardiovasculaires et qui est donc un meilleur prédicteur que la simple prise de pression artérielle par un professionnel en milieu clinique [25, 26, 28].
L’évaluation de la fonction cardiaque
L’évaluation de la fonction cardiaque peut se faire sous différents aspects, que ce soit par la mesure du débit cardiaque, du débit sanguin coronarien ou encore des paramètres de la fonction diastolique ou systolique. Plusieurs méthodes permettent de mesurer ces paramètres physiologiques, mais la technique idéale n’existe toujours pas. Chaque technique possède ses propres inconvénients, que ce soit dans la précision ou la
19 fiabilité des mesures, le coût de la méthode, l’influence du technicien sur les données mesurées, le fait qu’elle soit invasive ou non, etc.
Les méthodes de mesure du débit cardiaque
Tout d’abord, il existe quatre techniques de dilution d’un indicateur dans le sang pour déterminer le débit cardiaque. Elles sont basées sur l’équation de Stewart-Hamilton, selon laquelle DC = mi (la quantité de l’indicateur sanguin) divisé par ∫c(t)dt (l’aire sous la courbe de dilution de l’indicateur, qui est fonction de la concentration sanguine de l’indicateur en fonction du temps) [29]. Ces techniques invasives sont la thermodilution intermittente par injection d’un bolus froid dans un cathéter artériel pulmonaire [30], la thermodilution continue dans un cathéter artériel pulmonaire [31], la thermodilution intermittente par injection d’un bolus transpulmonaire [32] et la dilution transpulmonaire du lithium [33]. D’autre part, le principe de Fick stipule que pour un organisme à l’état stable et sans shunt intrapulmonaire, DC = VO2 (consommation d’oxygène) / CaO2-CvO2 (différence artério-veineuse en O2). La méthode de Fick permet donc de mesurer le débit cardiaque, mais elle nécessite aussi un cathéter artériel pulmonaire [34] afin de mesurer la concentration artérielle et veineuse en O2. Cependant, une méthode non-invasive basée sur le principe de Fick permet de calculer le débit cardiaque grâce à l’analyse du CO2 à l’expiration et dans la circulation. C’est la technique de réinhalation au CO2 [35]. Le débit cardiaque peut aussi être mesuré par l’analyse du pouls artériel périphérique et la reconstruction d’algorithmes selon le modèle de Wesseling et coll. [36]. Plusieurs appareils différents permettent l’exécution de cette méthode, tel que le Nexfin qui fonctionne par photopléthysmographie [37].
Le débit sanguin coronaire, lui, peut être mesuré par angiographie cardiaque. Cela nécessite l’introduction d’un cathéter cardiaque afin d’injecter un bolus colorant dans le cœur. On effectue ensuite des radiographies à haute vitesse permettant d’obtenir les images démontrant le sang coloré circulant dans les compartiments cardiaques et la circulation coronaire [38]. Cette méthode permet aussi d’obtenir certaines mesures de la fonction diastolique.
L’échocardiographie
L’échocardiographie fut d’abord introduite sous le mode temps-mouvement (TM) avec le doppler transœsophagien par L. Franzin en 1976 [39], ce qui a permis d’obtenir des images de qualité sur le mouvement des parois cardiaques. Le mode TM permet l’évaluation des distances anatomiques et la synchronisation temporelle de différents évènements. Quelques années plus tard, Hanrath développa l’échocardiographie bidimensionnelle (2D) et cela permis de mesurer les dimensions des oreillettes et des ventricules en temps réel et donc, d’éventuellement enregistrer le tout sous forme de vidéo [40]. Depuis ce temps, l’échocardiographie s’est bien développée et il existe maintenant plusieurs techniques et méthodes