UNIVERSITÉ DE SHERBROOKE
L'influence de l’exocytose mastocytaire sur la réponse hémodynamique à la big-endothéline-1
Par
LAURENCE VINCENT
Département de pharmacologie et physiologie
Mémoire présenté à la Faculté de médecine et des sciences de la santé en vue de l’obtention du grade de maitre ès sciences (M. Sc.) en pharmacologie
Sherbrooke, Québec, Canada Février, 2020
Membres du jury d’évaluation
Dr Pedro D’Orléans-Juste, Directeur de recherche, Programme de pharmacologie, Département de Pharmacologie-Physiologie
Dr Michel Grandbois, Évaluateur interne au programme, Programme de pharmacologie, Département de Pharmacologie-Physiologie
Dr Ahmed Chraïbi, Évaluateur externe au programme, Programme de physiologie, Département de Pharmacologie-Physiologie
« Le bonheur n’est pas au sommet de la montagne, mais dans la façon de la gravir. »
R
ÉSUMÉ
L'influence de l’exocytose mastocytaire sur la réponse hémodynamique à la big-endothéline-1
Par
Laurence Vincent Programmes de pharmacologie
Mémoire présenté à la Faculté de médecine et des sciences de la santé en vue de l’obtention du diplôme de
maitre ès sciences (M.Sc.) en pharmacologie, Faculté de médecine et des sciences de la santé, Université de
Sherbrooke, Sherbrooke, Québec, Canada, J1H 5N4
La protéase mastocytaire de type 4 (mMCP-4), l’isoforme de la chymase humaine chez la souris, est une sérine protéase synthétisée et emmagasinée dans les granules sécrétoires des mastocytes des tissus conjonctifs. Notre laboratoire a précédemment démontré une contribution importante de la mMCP-4 dans la génération d’ET-1 à partir de la big-ET-1 in vitro et in vivo. Nous avons rapporté que la mMCP-4 pouvait produire l’ET-1 (1-31) à partir de la big-ET-1, et que celle-ci doit subir une hydrolyse par l’endopeptidase neutre pour former l’ET-1, le peptide vasoactif responsable de l’effet presseur. Nous avons également rapporté la répression génique de la mMCP-4 réduisait d’environ 40% la réponse biologique de la big-ET-1, ce qui suggère une contribution dynamique de la mMCP-4 dans la génération d’ET-1.
L’activité enzymatique de la chymase étant exclusivement dépendante de sa sécrétion par les mastocytes, le but principal de cette étude était de montrer l’influence de l’état de stabilité mastocytaire sur la réponse hémodynamique mMCP-4-spécifique de la big-ET-1.
Nous avons utilisé la souris comme modèle expérimental. Dans un premier temps, nous avons évalué l’activité spécifique de la mMCP-4 par des essais fluorogéniques in vitro dans les mastocytes suite à l’administration d’agents modulateurs de l’exocytose, le C48/80 et le cromolyn en tant que sécrétagogue et stabilisateur mastocytaires, respectivement. Cette activité enzymatique a été diminuée de manière significative chez les mastocytes en présence de C48/80, démontrant que cet agent induit la déplétion du contenu granulaire en mMCP-4 chez ce type cellulaire. En contraste, le cromolyn a favorisé la stabilisation du contenu granulaire, montrée par une activité hydrolytique supérieure. En deuxième lieu, par une méthode de dosage par spectrométrie de masse, nous avons évalué la production d’un métabolite, l’ET-1 (1-31), issu de l’hydrolyse de la big-ET-1 par la mMCP-4. Nous avons pu observer une augmentation significative de la quantité relative d’ET-1 (1-31) produite par les mastocytes en présence de C48/80 in vitro, et une inhibition complète de cette conversion en présence de cromolyn. En dernier lieu, nous avons évalué l’influence de l’exocytose mastocytaire sur la réponse biologique de la big-ET-1 chez la souris anesthésiée. Nous avons rapporté une potentiation de la réponse pressive à la big-ET-1 suivant l’administration d’un dégranulateur mastocytaire, et une diminution de cette réponse suivant l’administration d’un stabilisateur mastocytaire, suggérant une atteinte à la voie métabolique chymase/NEP dans la génération d’ET-1.
En conclusion, notre étude a permis de confirmer une participation importante de l’état de stabilité mastocytaire sur la réponse pressive de la big-ET-1 chez la souris.
T
ABLE DES MATIÈRES
Résumé ... i
Table des matières ... v
Liste des communications ... viii
Liste des figures ... ix
Liste des tableaux ... x
Liste des abréviations ... xi
Remerciements ... xiii
Introduction ... 1
1 Les mastocytes ... 1
1.1 Préambule ... 1
1.2 Le développement et différenciation des mastocytes ... 1
1.2.1 Précurseurs cellulaires ... 1
1.2.2 Principaux régulateurs de la différenciation mastocytaire ... 4
1.2.2.1 Le SCF et son récepteur KIT ... 4
1.2.2.2 Interleukine-3 ... 6
1.3 Classification des mastocytes ... 6
1.4 Caractéristiques et libération des médiateurs mastocytaires ... 7
1.5 Rôles physiologiques et pathologiques des mastocytes ... 10
2 La dégranulation mastocytaire ... 11
2.1 Activation via les récepteurs membranaires ... 11
2.1.1 Activation immunologique par les récepteurs FcεRI ... 12
2.1.2 Activation non-immunologique via les récepteurs MRGPRX2/Mrgprb2 ... 13
2.2 Physiologie des granules mastocytaires ... 14
2.3 Voies sécrétoires des mastocytes ... 15
2.3.1 Voie de dégranulation régulée ... 15
2.3.2 Voie de sécrétion constitutive ... 16
2.4 Modulation pharmacologique de l’exocytose chez les mastocytes ... 18
2.4.1 Activation des mastocytes par le C48/80 ... 18
2.4.2 Stabilisation des mastocytes par le cromolyn ... 19
3 La chymase ... 21
3.1 Caractéristiques générales de la chymase ... 21
3.2 Classification des chymases mastocytaires ... 21
3.3 Activation et inhibition physiologique de la chymase ... 22
3.4 Substrats de la chymase ... 24
3.5 Inhibiteurs pharmacologiques de la chymase ... 25
3.6 Rôle de la chymase en conditions physiopathologiques ... 26
4 L’endothéline-1 ... 27
4.1 Historique ... 27
4.2 Structure et biosynthèse de l’endothéline-1... 28
4.2.2 Voie dépendante de la chymase mastocytaire ... 29
4.3 Les récepteurs de l’endothéline-1 ... 30
4.3.1 Signalisation des récepteurs de l’endothéline-1 ... 30
4.3.2 Effet pharmacologique de l’endothéline-1 ... 32
5 L’angiotensine II ... 32
5.1 Le système rénine-angiotensine ... 32
5.2 Structure et biosynthèse de l’angiotensine II ... 33
5.2.1 Voie dépendante de l’enzyme de conversion de l’angiotensine ... 33
5.2.2 Voie dépendante de la chymase mastocytaire ... 33
5.3 Les récepteurs de l’angiotensine II ... 35
5.3.1 Signalisation des récepteurs de l’angiotensine II ... 35
5.3.2 Effet pharmacologique de l’angiotensine II ... 36
Question principale ... 37 But de l’étude ... 37 Hypothèse ... 37 Objectifs ... 37 Matériel et méthodes ... 38 1 Animaux ... 38 2 Peptides utilisés ... 38 3 Méthodologie générale ... 40
3.1 Vérification du génotypage des souris ... 40
3.1.1 Extraction d’ADN ... 40
3.1.2 Amplification de l’ADN par réaction en chaîne de la polymérase ... 40
3.2 Isolation des mastocytes péritonéaux ... 41
3.3 Préparation des échantillons tissulaires ... 42
3.3.1 Prélèvement et homogénéisation des cœurs et poumons ... 42
3.3.2 Dosage protéique ... 43
3.4 Mesure de l’activité hydrolytique à l’aide d’un substrat fluorogénique ... 44
3.4.1 Essais enzymatiques avec mastocytes péritonéaux ... 44
3.4.2 Essais enzymatiques avec homogénats de tissus ... 45
3.4.3 Essais enzymatiques avec la chymase recombinante ... 45
3.5 Mesure de l’activité hydrolytique à l’aide d’un substrat colorimétrique ... 46
3.6 Étude in vivo ... 47
3.6.1 Chirurgie ... 47
3.6.2 Enregistrement et injections ... 47
3.6.3 Analyse des données ... 48
3.7 Étude de la production d’ET-1 (1-31) par les mastocytes péritonéaux ... 48
4 Étude des paramètres hémodynamiques chez la souris anesthésiée ... 49
4.1 Protocoles expérimentaux ... 49
4.2 Justification des voies d’administration et des doses ... 49
5 Analyses statistiques ... 50
Résultats ... 51
1 Confirmation du génotypage des souris ... 51
2 Étude des mastocytes péritonéaux ... 52
2.1 Isolation et décompte des mastocytes péritonéaux ... 52
2.2 Effet du C48/80 et du cromolyn sur la viabilité cellulaire ... 52
2.3 Activité enzymatique mMCP-4-dépendante des mastocytes péritonéaux ... 54
2.4 Effet du C48/80 et du cromolyn sur l’activité enzymatique des mastocytes ... 56
3 Étude de l’activité enzymatique dans les tissus ... 58
3.1 Effet du C48/80, du cromolyn et du TY-51469 sur l’activité chymotrypsine dans les homogénats de tissus pulmonaires ... 58
3.2 Effet du C48/80 et du cromolyn sur l’activité chymotrypsine dans les homogénats de ventricule gauche ... 58
4 Étude de spécificité ... 61
5 Production in vitro d’ET-1 (1-31) par des mastocytes péritonéaux ... 62
6 Étude des paramètres hémodynamiques chez la souris anesthésiée ... 64
6.1 Étude de la réponse pressive à l’injection de big-ET-1 ... 64
6.1.1 Effets opposés du C48/80 et du cromolyn sur la courbe dose-réponse de la big-ET-1 ... 64
6.1.2 Étude de la réponse pressive à l’injection des produits de métabolisme de la big-ET-1 ... 68
6.1.3 Effets du TY-51469 sur la réponse hémodynamique à la big-ET-1 ... 71
6.2 Étude de la réponse pressive à l’injection d’Ang I ... 73
6.2.1 Courbe dose-réponse à l’Ang I ... 73
6.2.2 Effet du TY-51469 sur la réponse pressive à l’injection d’Ang I ... 73
6.2.3 Effet du C48/80 et du cromolyn sur la réponse pressive à l’injection d’Ang I ... 75
6.2.4 Étude de la réponse pressive à un analogue ECA-résistant de l’Ang I ... 76
Discussion ... 78
1 Résumé des résultats et validation de l’hypothèse ... 78
2 Originalité de la présente étude ... 79
3 Validation des modèles expérimentaux ... 80
3.1 Impact de la répression génique de la mMCP-4 au niveau des mastocytes péritonéaux et chez la souris in vivo ... 80
3.2 Analyse de spécificité du C48/80 et du cromolyn ... 81
4 Rôle de l’exocytose mastocytaire dans la réponse à la big-ET-1 in vivo 82 4.1 Activation mastocytaire ... 82
4.2 Stabilisation mastocytaire ... 84
5 Limites et approches alternatives ... 87
Conclusion générale ... 88
Perspectives ... 88
L
ISTE DES COMMUNICATIONS
Présentations par afficheVincent, L., Touil, H., Desbiens, L., Lapointe C. et D’Orléans-Juste, P. Effet opposés de la
dégranulation et de la stabilisation mastocytaire sur la réponse hémodynamique à la big-endothéline-1. Journée PHARE, Novembre 2018.
Vincent, L., Lapointe, C., Ly, K., Gagnon, H., Lo, M. et D’Orléans-Juste, P. La
dégranulation mastocytaire exacerbe les réponses biologiques dépendantes de la chymase. Congrès DOCC, Mai 2019.
Contribution à des articles de recherche
Desbiens, L., Lapointe, C., Gendron, L., Gharagozloo, M., Vincent, L., Pejler, G., Gris, D. et D’Orléans-Juste, P. (2019) Experimental Autoimmune Encephalomyelitis potentiates mouse mast cell protease 4-dependent pressor responses to centrally or systemically administered big endothelin-1. J Pharmacol Exp Ther 370(3): 437-46.
L
ISTE DES FIGURES
Figure 1 : Développement des mastocytes et des basophiles à partir de cellules souches
hématopoïétiques ... 3
Figure 2 : Voie de signalisation du récepteur KIT et de son ligand, le facteur de croissance des cellules souches ou SCF, chez les mastocytes ... 5
Figure 3 : Étapes de dégranulation mastocytaire, de production de novo de médiateurs et de réapprovisionnement en granule ... 8
Figure 4 : Principaux récepteurs et ligands impliqués dans l’activation des mastocytes ... 12
Figure 5 : Voies sécrétoires des mastocytes ... 17
Figure 6 : Morphologie des granules mastocytaires ... 18
Figure 7 : Mécanisme d’activation de la chymase par la DPPI en présence d’héparine ... 23
Figure 8 : Biosynthèse de l’ET-1 ... 28
Figure 9 : Contribution de la chymase et de l’ECA dans la production d’Ang II ... 34
Figure 10 : Dosage protéique par la méthode de Bradford ... 44
Figure 11 : Amplification des gènes par PCR ... 51
Figure 12 : Décompte mastocytaire chez les souris WT et mMCP-4 KO ... 53
Figure 13 : Activité enzymatique dans les mastocytes péritonéaux ... 55
Figure 14 : Activité enzymatique dans les mastocytes péritonéaux prétraités au C48/80 et au cromolyn ... 57
Figure 15 : Effet du C48/80 et du cromolyn sur l’activité enzymatique dans les tissus pulmonaires en absence ou en présence de TY-51469 ... 59
Figure 16 : Effet du C48/80 et du cromolyn sur l’activité enzymatique dans les tissus ventriculaires gauches ... 60
Figure 17 : Étude de l’interaction possible entre le C48/80, le cromolyn et le TY-51469 et l’activité enzymatique de la rmMCP-4. ... 61
Figure 18 : Conversion de la big-ET-1 en ET-1 (1-31) par des mastocytes péritonéaux ... 63
Figure 19 : Effet du C48/80 et du cromolyn sur les courbes doses-réponses à la big-ET-1 . 65 Figure 20 : Réponse pressive à l’injection de la big-ET-1 ... 66
Figure 21 : Profil hémodynamique à l’injection de la big-ET-1 ... 67
Figure 22 : Réponse pressive à l’injection d’ET-1 (1-31) ... 69
Figure 23 : Réponse pressive à l’injection d’ET-1 ... 70
Figure 24 : Contribution de la chymase dans la réponse pressive à la big-ET-1 ... 72
Figure 25 : Courbes doses-réponse à l’Ang I ... 74
Figure 26 : Effet du C48/80 et du cromolyn sur la réponse pressive à l’Ang I ... 75
L
ISTE DES TABLEAUX
Tableau 1 : Caractéristiques des différents sous-types de mastocytes chez la souris et
l’humain ... 7
Tableau 2 : Médiateurs mastocytaires ... 9
Tableau 3 : Sécrétagogues et activateurs des mastocytes. ... 20
Tableau 4 : Stabilisateurs et inhibiteurs de la dégranulation des mastocytes ... 20
Tableau 5 : Caractéristiques des différentes chymases retrouvées dans les mastocytes humains et de souris ... 22
Tableau 6 : Substrats de la chymase ... 24
Tableau 7 : Substrats de la mMCP-4 ... 25
Tableau 8 : Espèces chez lesquelles les inhibiteurs de la chymase ont été validés ... 26
Tableau 9 : Caractéristiques des sous-types de récepteurs de l’endothéline ... 31
Tableau 10 : Caractéristiques des sous-types de récepteurs de l’angiotensine II ... 36
Tableau 11 : Liste des composés peptidiques et inhibiteurs ... 39
Tableau 12 : Caractéristiques des amorces utilisées dans le génotypage des souris ... 41
L
ISTE DES ABRÉVIATIONS
∆PAM variation de pression artérielle moyenneAng I angiotensine I
Ang II angiotensine II
AT1R récepteur à l’Ang II de type 1
AT2R récepteur à l’Ang II de type 2
AT4R récepteur à l’Ang II de type 4
big-ET-1 big-endothéline-1
BMCP bipotent basophil/mastcell progenitors
BSA albumine sérique bovine
C48/80 composé 48/80
CLHP chromatographie en phase liquide à haute performance
CMP common myeloid progenitors
CS-A chondroïtine-4-sulfate CS-E chondroïtine-4,6-sulfate
CTMC mastocyte des tissus conjonctifs
DMSO dimetyl sulfoxide
DPPI dipeptidyl peptidase I
DS dermatan sulphate
ECA enzyme de conversion de l’angiotensine ECE enzyme de conversion de l’endothéline ED50 dose efficace médiane
ET-1 endothéline-1
ET-1 (1-31) endothéline-1 (1-31)
ET-2 endothéline-2
ET-3 endothéline-3
FcεRI récepteur du fragment Fc de la chaîne ε des IgE
FDA food and drug administration
FGF-2 récepteur 2 des facteurs de croissance
GMP granulocyte/monocyte progenitors
GRB2 growth-factor-receptor-bound protein 2 IgE immunoglobuline de type E
IL interleukine
IP3 inositol 1,4,5-triphosphate
ITAM récepteur immun basé sur la tyrosine
JAK-STAT janus kinase-signal transducer and activator of transcription
KCl chlorure de potassium
Kd constante de dissociation
KO knock out
LDL lipoprotéine de basse densité MAPK mitogen activated proteine kinase
MCP mast cell progenitors
MCTC mastocyte tryptase-chymase
MEP megakaryocyte/erythrocyte progenitors MES acide 2-(N-morpholino) éthanosulfonique MMC mastocyte des tissus muqueux
mMCP protéase mastocytaire
mMCP-4 KO souris déficiente pour la protéase mastocytaire murine de type 4 MMP-9 métalloprotéinase matricielle 9
Mrgprb2 mas-related G protein coupled receptor b2
NaCl chlorure de sodium
NEM N-ethylmaleimide
NEP néprilysine
NO oxyde nitrique
PAM pression artérielle moyenne
pbs paire de base
PBS tampon phosphate saline
PCR réaction en chaîne de la polymérase PI3K phophatidylinositol 3-kinase
PLCɣ phospholipase Cɣ
préproET-1 préproendothéline-1 p-value valeur de probabilité
RCPG récepteur couplé aux protéines G
RE réticulum endoplasmique
rmMCP-4 mMCP-4 recombinante
SCF facteur de cellules souches SEM erreur standard sur la moyenne
SNARE soluble N-ethylmaleimide-sensitive factor-attachment protein receptors SPE extraction en phase solide
SRA système rénine-angiotensine STIM1 stromal interaction molecule 1 TGF-β1 facteur de croissance tumorale TNF-α facteur de nécrose tumorale UST unité de souris transgénique
VAMP vesicle associated membrane proteins
R
EMERCIEMENTS
Tout d’abord, je tiens à remercier sincèrement mon directeur de recherche, le Pr Pedro D’Orléans-Juste, de m’avoir donné l’opportunité d’intégrer son laboratoire. Son esprit scientifique, rigoureux et novateur complète généreusement ses qualités humaines exceptionnelles, son altruisme, son empathie et son sens de l’humour. Merci Pedro, ce fut pour moi l’expérience la plus stimulante que j’ai pu connaître à ce jour.
Je tiens également à remercier mes collègues de laboratoire : Catherine Lapointe pour ta présence rayonnante au laboratoire, Hanène Touil pour ta gentillesse et ton amitié, Louisane Desbiens pour ton savoir-faire incroyable et Martin Houde pour tes connaissances illimitées, avec qui j’ai souvent eu des discussions très enrichissantes. Je vous remercie d’avoir contribué à la belle atmosphère du laboratoire.
J’aimerais remercier ma précieuse amie, Elsa, pour nos innombrables discussions scientifiques toujours très intéressantes et qui a su, malgré la distance, m’offrir son support et son écoute tout au long de mes études.
Je désire également remercier mes sœurs, Marie-Caroline et Louise pour leur soutien tout au long de mon parcours. Un grand merci à mes parents Monique et Léonard pour votre écoute, votre appui et votre support qui ont été essentiels à mon bien-être et à ma réussite. Merci de me faire confiance, de m’encourager et surtout de m’avoir grandement aidé, émotionnellement et financièrement, à poursuivre mes études graduées.
Finalement, je remercie les Pr Michel Grandbois, Ahmed Chraïbi et Pedro d’Orléans-Juste d’avoir accepté de corriger ce mémoire.
I
NTRODUCTION
1
L
ES MASTOCYTES
1.1 Préambule
Les mastocytes ont été décrits pour la première fois par le Dr Paul Ehrlich dans sa thèse de doctorat en 1878 (Ehrlich, 1878). La coloration cellulaire à l’aide d’un colorant basique comme le bleu de toluidine lui a permis d’observer que ces cellules tissulaires possédaient des granules cytoplasmiques de taille importante en grand nombre. Il les baptisa Mastzellen, pour « cellules bien nourries », persuadé qu’elles avaient une fonction nutritionnelle. Il fut également le premier à décrire le phénomène de dégranulation mastocytaire. Ce n’est qu’en 1953 que fut établi le rôle des mastocytes dans les réactions d'hypersensibilité immédiate. Riley et West ont montré que les mastocytes contenaient de l’histamine et pouvaient libérer, lors d’une stimulation, ce médiateur reconnu comme étant responsable du choc anaphylactique (Mota, 1994; Riley et West, 1953). Par la suite, de nombreuses études ont permis de mettre en lumière les rôles physiologiques et immunologiques de la dégranulation mastocytaire et de la libération de médiateurs dans l’environnement extracellulaire.
Dans le cadre de cette étude, nous nous intéressons à l’impact de l’activation et de l’inhibition pharmacologique des mastocytes sur la génération d’endothéline-1 (ET-1), un puissant vasoconstricteur des vaisseaux sanguins, par une enzyme exclusivement présente au niveau des granules mastocytaires, la protéase mastocytaire de type 4 (mMCP-4), qui sera discutée plus en détail dans une section dédiée.
1.2 Le développement et différenciation des mastocytes 1.2.1 Précurseurs cellulaires
Les mastocytes se développent à partir de cellules souches hématopoïétiques pluripotentes présentes dans la moelle osseuse. Ces cellules expriment les marqueurs de surface CD34+ et CD117 ou c-Kit, récepteur du facteur de cellules souches (stem cell factor,
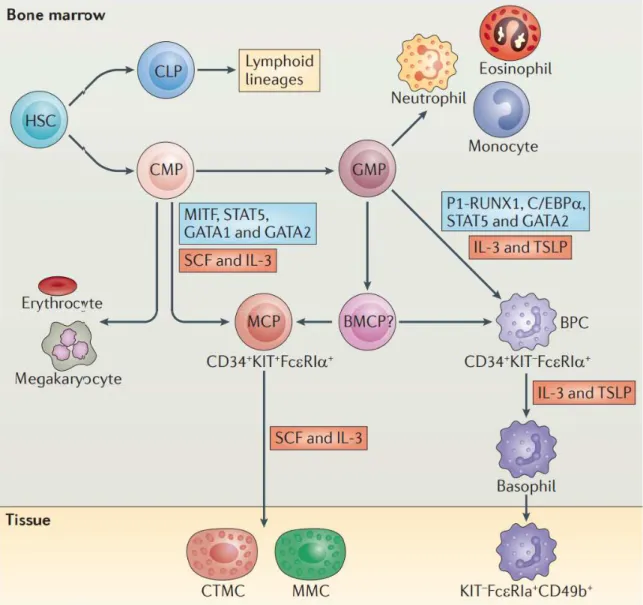
ou SCF). Ces marqueurs peuvent influencer la différentiation des mastocytes en fonction de leur localisation tissulaire, sous l’action de cytokines environnantes. Les mastocytes proviennent des progéniteurs communs myéloïdes (common myeloid progenitors, ou CMP) qui sont également à l’origine d’autres lignages hématopoïétiques (Kondo et al., 1997). Ces derniers peuvent ensuite se différencier en progéniteurs des mégacaryocytes et des érythrocytes (megakaryocyte/erythrocyte progenitors, ou MEP), en progéniteurs des monocytes et des granulocytes (granulocyte/monocyte progenitors, ou GMP) ou directement en progéniteurs des mastocytes (mast cell progenitors, ou MCP). Contrairement à de nombreuses cellules hématopoïétiques libérées dans la circulation systémique sous forme mature et fonctionnelle, les progéniteurs des mastocytes migrent à partir de la moelle osseuse vers la périphérie en tant que cellules indifférenciées par des mécanismes encore mal définis. Ces progéniteurs migrent ensuite dans les tissus où ils peuvent donner naissance aux deux sous-groupes majeurs des mastocytes, les mastocytes des tissus muqueux (mucosal mast cell, ou MMC) et les mastocytes des tissus conjonctifs (connective tissue mast cell, ou CTMC), qui seront discutés plus en détail dans la section suivante (Figure 1) (Akashi et al., 2000). Récemment, Arinobu et al. (2005) et Qi et al. (2013) ont identifié des progéniteurs bipotents des basophiles et des mastocytes (bipotent basophil/mast cell progenitors, ou BMCP) dans la rate de souris, suggérant une relation de développement étroitement liée entre la lignée des basophiles et des mastocytes.
Figure 1 : Développement des mastocytes et des basophiles à partir de cellules souches hématopoïétiques.
1.2.2 Principaux régulateurs de la différenciation mastocytaire
Les mastocytes maturent au niveau des microenvironnements tissulaires conjonctifs ou muqueux sous l’influence de différents facteurs de croissance spécifiques (Metcalfe et al., 1995). Ces derniers incluent le SCF, le ligand du récepteur de la tyrosine kinase c-kit et l’interleukine (IL)-3. D’autres médiateurs tels que IL-4, IL-9 et IL-10 peuvent également jouer un rôle important dans le développement et la maturation mastocytaire (Galli, 2000). Le phénotype des mastocytes peut être modifié suivant leur localisation. En effet, les travaux de Nakano et al. (1985) ont montré que les mastocytes injectés dans un nouveau microenvironnement tissulaire peuvent acquérir les caractéristiques phénotypiques et fonctionnelles des mastocytes résidents.
1.2.2.1 Le SCF et son récepteur KIT
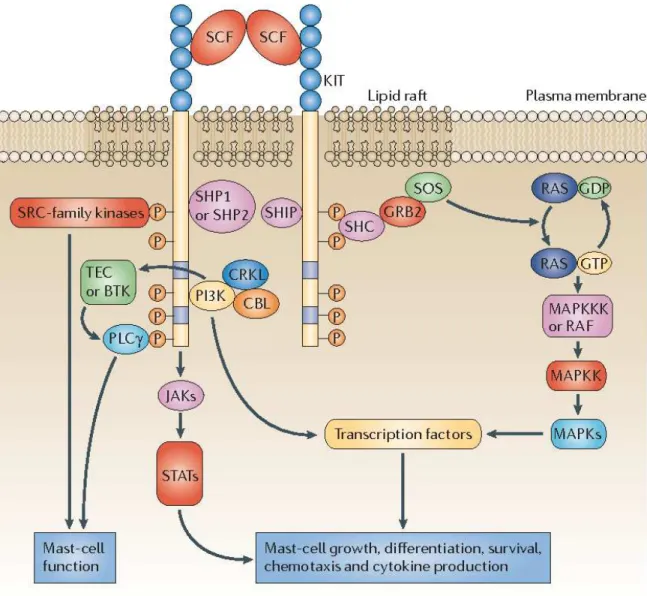
Le SCF, aussi connu sous le nom du ligand KIT, est un facteur de croissance qui existe à la fois sous forme soluble et sous forme liée à la membrane. Ce facteur de croissance est exprimé par les cellules fibroblastes et les cellules épithéliales (Lennartsson et Rönnstrand, 2012). Sous forme de dimère, le SCF active le récepteur de tyrosine kinase c-kit, aussi appelé KIT. La dimérisation de KIT induit une autophosphorylation des résidus de tyrosines de la queue cytoplasmique, ce qui entraîne par la suite le recrutement de diverses molécules adaptatrices telles que la phospholipase Cɣ (PLCɣ), les kinases de la famille de SRC, le GRB2 ou la phophatidylinositol 3-kinase (PI3K) permettant l’activation de la voie de signalisation JAK-STAT et des MAPK. Ces voies de signalisation favorisent la prolifération, la migration, la survie et la différenciation des progéniteurs hématopoïétiques (Figure 2) (Gilfillan et Tkaczyk, 2006). Chez l’humain, une mutation dans le gène du récepteur KIT peut provoquer la dérégulation de cette voie de signalisation entraînant une trop forte activation du récepteur, provoquant le phénomène pathologique de mastocytose systémique. Chez ces patients, la mutation D816V (substitution d’un résidu d’acide aspartique pour un résidu de valine) dans le domaine catalytique est la plus fréquente et entraîne une autophosphorylation constitutive du récepteur KIT, indépendamment du SCF. Cette pathologie entraîne une accumulation des mastocytes dans certains organes et un relargage constitutif de médiateurs mastocytaires au niveau local (Chatterjee et al., 2015).
Figure 2 : Voie de signalisation du récepteur KIT et de son ligand, le facteur de croissance des cellules souches ou SCF, chez les mastocytes.
1.2.2.2 Interleukine-3
L’IL-3 est une cytokine produite par plusieurs types cellulaires tels que les fibroblastes et les lymphocytes T. Lorsqu’elle est associée au SCF, elle stimule la différenciation des cellules souches hématopoïétiques, le développement et la maturation des mastocytes. Toutefois, elle ne semble pas indispensable à la génération des mastocytes puisque les souris dépourvues du gène de l’IL-3 (IL-3-/-) ne démontrent pas d’anomalies phénotypiques, à
l’exception d’un nombre réduit de mastocytes. Lantz et al. (1998) ont montré que l’IL-3 n’était pas essentielle à la génération des mastocytes en conditions physiologiques, mais contribuerait à l’augmentation du nombre de mastocytes tissulaires chez la souris en conditions pathologiques. Leurs travaux indiquent que l’IL-3 et le SCF joueraient un rôle synergique dans l’immunité et la prolifération des mastocytes.
1.3 Classification des mastocytes
On distingue deux sous-types majoritaires de mastocytes basés sur le contenu en protéases granulaires, soit les mastocytes des tissus muqueux ou MMC, qui contiennent la tryptase, et les mastocytes des tissus conjonctifs ou CTMC, qui contiennent la tryptase, la chymase et la carboxypeptidase A. Les MMC sont principalement localisés au niveau de la muqueuse du système gastro-intestinal et dans la lamina propria des voies respiratoires (Metcalfe et al., 1997). Les CTMC sont localisés dans la sous-muqueuse de l’appareil gastro-intestinal, dans la peau, dans le péritoine et à proximité des vaisseaux sanguins (Aldenborg et Enerbäck, 1985). D’un point de vue phénotypique, les deux sous-types se distinguent par leur taille, leur teneur en histamine, la nature du protéoglycane formant les granules de sécrétion et leur contenu en protéases. L’héparine est retrouvée exclusivement dans les CTMC, tandis que les MMC produisent la 4-sulfate (CS-A), la chondroïtine-4,6-sulfate (CS-E) et le dermatan sulfate (DS) (Mulloy et al., 2017). D’un point de vue fonctionnel, il est intéressant de noter que les MMC sont peu sensibles au cromolyn, un agent stabilisateur de mastocyte utilisé pour prévenir la dégranulation, ou au composé 48/80 (C48/80), un inducteur de la dégranulation. Au contraire, les CTMC sont stabilisés par le cromolyn et dégranulent en réponse au C48/80 (Pearce et al., 1982).
Ces deux sous-types sont aussi séparés chez l’homme en fonction de leur contenu en protéases et de leur localisation, soit les mastocytes tryptase-chymase (MCTC) et les
mastocytes tryptase (MCT), homologues aux CTMC et aux MMC, respectivement. Les
principales différences phénotypiques entre les sous-types de mastocytes chez l’humain et la souris sont représentées dans le Tableau 1.
Tableau 1 : Caractéristiques des différents sous-types de mastocytes chez la souris et l’humain. [Reproduit intégralement à partir (Bradding et Arthur, 2016)]
Mastocytes de souris Mastocytes humains
Caractéristiques MMC CTMC MCT MCTC
Contenu en protéase Chymase Chymase Tryptase Tryptase, chymase,
carboxypeptidase, cathepsine G Type de protéoglycanes Chondroïtine
sulfatée Héparine Héparine Héparine
Localisation Tissus mucosaux Tissus
conjonctifs ou séreux Épithélium, lamina propria Lamina propria, tissus conjonctifs, peau Marquage en
immunohistochimie Bleu alcian + Safranine + Safranine + Safranine +
Relargage LTC4 +++ - +++ +
Relargage PGD2 + + +++ +++
Activation par le FcεRI Oui Oui Oui Oui
Activation par la
substance P Non Oui Non Oui
Réponse aux C5a Oui Oui Non Oui
Inhibé par le cromolyn Non Oui Oui (faible) Non
Abréviations : CTMC, mastocytes des tissus conjonctifs ; FcεRI, récepteur du fragment Fc de la chaîne ε des IgE ; LTC4, leucotriène C4 ;
MCT, mastocytes positifs pour la tryptase ; MCTC, mastocytes positifs pour la tryptase et la chymase; MMC, mastocytes des tissus muqueux ; PGD2, prostaglandine D2.
1.4 Caractéristiques et libération des médiateurs mastocytaires
Les mastocytes sont mieux connus pour la production d’histamine associée aux réactions allergiques et à une vasodilatation lors de leur activation. Toutefois, les mastocytes synthétisent une multitude de facteurs de croissance, de protéases, de cytokines, de chimiokines et de métabolites d’acides gras (Blank et Vitte, 2015).
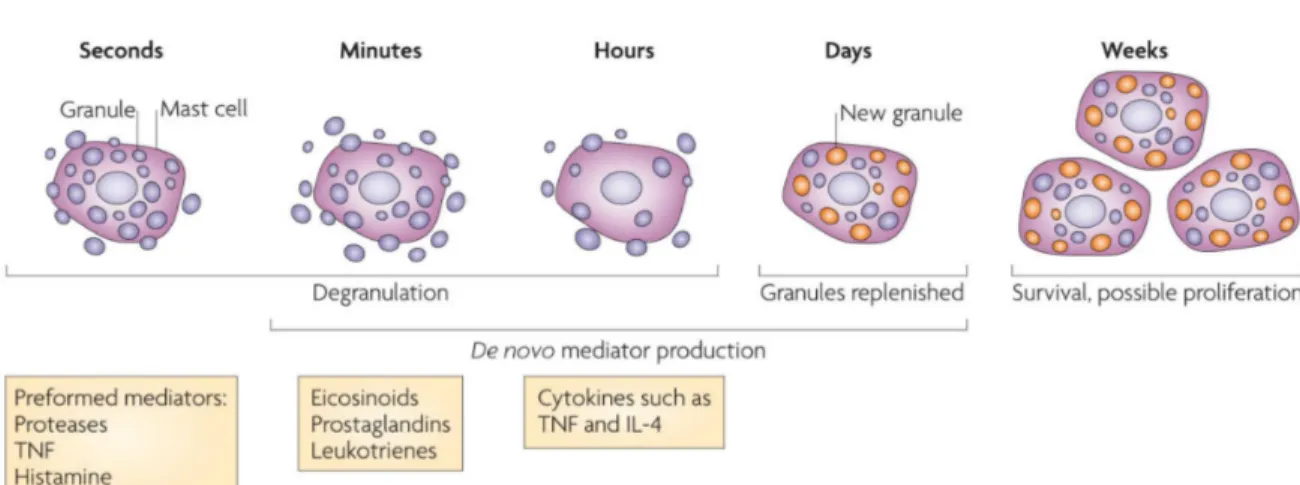
La libération des médiateurs par les mastocytes se produit en 3 vagues distinctes (Figure 3). Lors de l’activation, la réaction de dégranulation des mastocytes induit d’abord le relargage des médiateurs préformés dans les granules, responsables des effets aigus de
l’activation des mastocytes. Une seconde vague survient dans les 15 à 30 minutes suivant la stimulation et engage la libération de médiateurs lipidiques nouvellement synthétisés dérivés des phospholipides membranaires. Finalement, une troisième vague survient dans l’heure suivant la stimulation, impliquant la synthèse de novo de cytokines, de chimiokines et de facteurs de croissance par induction de la transcription et de la traduction (Abraham et St. John, 2010; Blank, 2011; Wang et al., 2011). Il est intéressant de noter que les mastocytes peuvent participer à plusieurs épisodes de dégranulation et nécessitent un temps de régénération des granules d’environ 72 heures (Blank, 2011). Le Tableau 2 présente les différents médiateurs dits préformés et nouvellement synthétisés, ainsi que leurs caractéristiques physiopathologiques correspondantes.
Il est possible que certains stimuli favorisent la production de médiateurs en absence d’une réponse de dégranulation. Toutefois, les mécanismes de libération dans l’espace extracellulaire sont encore peu définis dans la littérature à ce jour (Stow et al., 2009; Lorentz et al., 2012). Les mécanismes d’exocytose par les mastocytes seront discutés dans une prochaine section.
Figure 3 : Étapes de dégranulation mastocytaire, de production de novo de médiateurs et de réapprovisionnement en granule.
Tableau 2 : Médiateurs mastocytaires. [Modifié de (Theoharides et al., 2007) et (Blank et
Vitte, 2015)] Synthèse Catégorie
biochimique
Exemples Rôle physiopathologique
Préformés Amines biogènes Histamine Vasodilatation, angiogenèse, augmentation de la perméabilité vasculaire, bronchoconstriction
Sérotonine Vasoconstriction, nociception Chimiokines IL-8, MCP-1, MCP-3,
MCP-4
Chimio attraction, infiltration tissulaire des leucocytes Enzyme Tryptase
Chymase
Carboxypeptidase A
Sérine-protéases spécifiques du mastocyte, fortement basique, aux multiples effets : dégradation de la matrice extracellulaire, effets pro-inflammatoires, nociception
Granzyme B Sérine protéase cytotoxique inductrice d’apoptose
Cathepsines C,D,E Protéases pléiomorphes : pro inflammatoire, pro-apoptotique, activatrice des sérines-protéases
Métalloprotéinases Dégradation de la matrice extracellulaire Kininogénases Conversion des kininogènes en kinines
Peroxydases Détoxification de formes réactives de l’oxygène ; effet anti bactérien Phospholipases Production de dérivés des phospholipides
Procaspases Effet pro-apoptotique
Arylsulfatases Hydrolyse des lipides et protéoglycanes NO synthase Production d’oxyde nitreux
Médiateurs peptidiques
Bradykinines Vasodilatation, augmentation de la perméabilité vasculaire, bronchoconstriction, nociception, activation mastocytaire
Somatostatine Effets sur le système nerveux central, l’appareil digestif, le système endocrinien Substance P Vasodilatation, nociception, activation mastocytaire
VEGF Angiogenèse, réparation tissulaire
Protéoglycanes Héparine Stabilisateur des tétramères de tryptase ; possible rôle antibactérien
Acide hyaluronique Non dégradé : composant de la matrice cellulaire support de migration cellulaire Dégradé : interaction avec des récepteurs toll-like et effet pro-inflammatoire Chondroïtine sulfate Composant de la matrice cellulaire ; association aux protéines dans des
structures complexes Synthèse
de novo
Cytokines IL1, 3, 4, 5, 6, 9, -10, -13, -16
Pro-inflammatoire, migration cellulaire, nociception
INF-ɣ, MIF, TNF-α Pro-inflammatoire, prolifération cellulaire et activation des cellules Th2 Facteurs de
croissance SCF, GM-CSF, GnRH-1, bFGF, NGF, VEGF Prolifération des cellules mastocytes Métabolites des
phospholipides LTB4 Chimio attraction des leucocytes LTC4 Vasoconstriction, nociception
PAF Activation plaquettaire, vasodilatation, pro-inflammatoire PGD2 Bronchoconstriction, nociception
NO Vasodilatation, neuromodulation
Abréviations : bFGF, facteur de croissance des fibroblastes ; GM-CSF, facteur stimulant des colonies de granulocytes et de macrophages ; GnRH-1, hormone de libération des gonadotrophines hypophysaires ; IL, interleukine ; INF-ɣ, interféron gamma ; LTB4, leucotriène B4 ;
LTC4, leucotriène C4 ; MCP, protéine chemoattractante ; MIF, facteur d’inhibition de la migration des macrophages ; NGF, facteur de
croissance neuronal ; NO, oxyde nitrique ; PAF, facteur d’activation plaquettaire ; PGD2, prostaglandine D2 ; SCF, facteur de cellules
1.5 Rôles physiologiques et pathologiques des mastocytes
Les mastocytes sont localisés dans tout l’organisme, plus particulièrement au niveau des muqueuses et des tissus conjonctifs à l’interface entre l’hôte et l’environnement. Cette localisation stratégique permet aux mastocytes d’être une des premières lignes de défense de l’organisme contre les pathogènes en plus de posséder la capacité de communiquer avec différents types cellulaires en fonction de la nature des médiateurs inflammatoires libérés (Abraham et St. John, 2010). Les mastocytes ont longtemps été considérés comme les cellules effectrices de l’allergie. En revanche, dans les dernières années, plusieurs études ont permis d’associer le mastocyte à de nombreux processus immunitaires allant de l’initiation de la réponse immunitaire contre les pathogènes jusqu’à la résolution de l’inflammation (Galli et Tsai, 2010). Par ailleurs, des rôles non-immunitaires ont également été décrits, tel que l’interaction avec les neurones dans des phénomènes de nociception et l’interaction avec les cellules endothéliales et musculaires lisses au niveau des vaisseaux sanguins (Abraham et St. John, 2010). De plus, les mastocytes jouent un rôle dans la cicatrisation, le remodelage tissulaire et les maladies auto-immunes (Krishnaswamy et al., 2001; Rao et Brown, 2008). Des études démontrent aussi une contribution des mastocytes dans les pathologies cardiovasculaires et le remodelage ventriculaire (Levick et al., 2011). Les mastocytes semblent participer au développement de l’athérosclérose, de l’inflammation coronaire et de l’ischémie cardiaque (Metzler et Xu, 1997). De plus, en conditions physiologiques, le nombre de mastocytes reste constant, tandis qu’en situations pathologiques, le nombre de mastocytes augmente considérablement en raison d’un recrutement accru au site de l’inflammation (Stone et al., 2010). Cette migration du sang vers les tissus par les mastocytes est médiée par la libération de cytokines, dont le facteur de nécrose tumorale (TNF-α) et l’IL-4, capable de moduler l’adhésion intercellulaire (Amin, 2012). En effet, des études effectuées dans des modèles murins d’infarctus du myocarde démontrent une accumulation massive de mastocytes dans la région infarcie du cœur (Engels et al., 1995; Houde et al., 2018).
2
L
A DÉGRANULATION MASTOCYTAIRE
La plus grande particularité morphologique du mastocyte est qu’il possède un contenu granulaire extrêmement riche qui, après une stimulation appropriée, libère un large spectre de médiateurs inflammatoires. La relâche de certains médiateurs varie en fonction de la nature du stimulus. Ces médiateurs sont isolés du cytoplasme et sont renfermés à l’intérieur des granules de sécrétion. Lorsque les mastocytes reçoivent un signal capable d’activer les mécanismes de signalisation cellulaire conduisant à l’augmentation du calcium intracellulaire et à la mobilisation des granules, ils sont en mesure de libérer le contenu granulaire dans le milieu extracellulaire de manière rapide et massive, permettant un effet biologique maximal. Cette section décrit les mécanismes d’activation des mastocytes, les voies de sécrétion ainsi que les propriétés pharmacologiques associées à ce phénomène.
2.1 Activation via les récepteurs membranaires
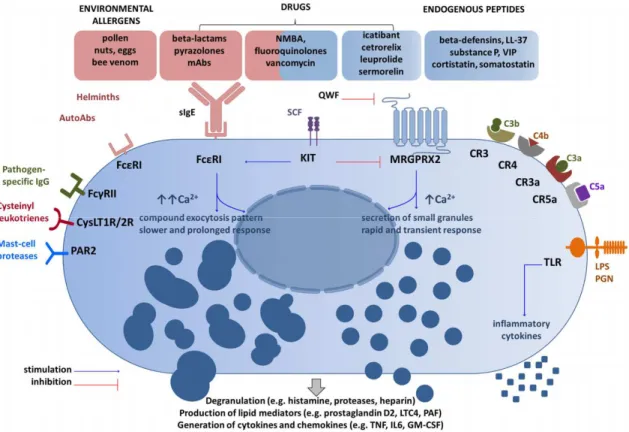
Les mastocytes constituent une population de cellules hétérogènes particulièrement sensibles aux différents microenvironnements tissulaires au cours du développement et de la maturation. La localisation tissulaire des mastocytes mène à une expression distincte dans les protéases synthétisées et dans l’expression des récepteurs membranaires (Xing et al., 2011; Dwyer et al., 2016). De plus, tel que mentionné plus tôt, le phénotype des mastocytes est hautement modulable en fonction des stimuli inflammatoires, des facteurs de croissance, des cytokines et des métabolites environnementaux (Kitamura, 1989). Dans la Figure 4, on observe différents récepteurs membranaires participant à l’activation des mastocytes. La stimulation peut être déclenchée par la liaison des anticorps spécifiques de l’antigène avec les récepteurs correspondants, appelée activation immunologique. La stimulation induite par des substances telles que des neuropeptides, des cytokines ou des composés sécrétagogues est appelée activation non-immunologique. L’une ou l’autre de ces stimulations permettent ensuite la dégranulation mastocytaire. Par contre, celle-ci est engendrée via des mécanismes biologiques différents (Rosengard et al., 1986).
Figure 4 : Principaux récepteurs et ligands impliqués dans l’activation des mastocytes.
[Figure 1 de (Porebski et al., 2018) provenant d’une source « open access » ne nécessitant pas de permission particulière pour la reproduction]
2.1.1 Activation immunologique par les récepteurs FcεRI
L’activation classique d’un mastocyte lors d’une réaction inflammatoire se produit par l’intermédiaire du récepteur du fragment Fc de la chaîne ε des IgE (FcεRI). Ce type de récepteur possède une forte affinité aux immunoglobulines de type E (IgE). La reconnaissance de l’antigène par les IgE liées à leur récepteur FcεRI entraîne l’agrégation des récepteurs et l’initiation de la cascade de signalisation permettant la dégranulation et le relargage de médiateurs par les mastocytes. Le récepteur FcεRI est un complexe tétramérique composé de trois sous-unités (αβɣ2). La sous-unité α contient le site de fixation aux IgE. Les sous-unités β et ɣ, contenant les motifs d’activation des récepteurs immuns basés sur la tyrosine (immunoreceptor tyrosine-based activation motifs, ou ITAM) interviennent dans la transduction des signaux (Kraft et Kinet, 2007; Wernersson et Pejler, 2014). La
dégranulation des mastocytes peut également être déclenchée par l’agrégation des récepteurs pouvant reconnaître les IgG (FcɣRII et FcɣRIII) exprimés à la surface. Ces récepteurs peuvent fixer les IgE, mais avec une faible affinité.
L’activation immunologique des mastocytes via les récepteurs FcεRI ou FcɣRI déclenche la phosphorylation des ITAM des sous-unités β et ɣ par la tyrosine kinase LYN. Ce processus permet l’activation d’autres tyrosines kinases telles que FYN et SYK, essentielles pour la phosphorylation de nombreuses protéines impliquées dans la signalisation de la dégranulation des mastocytes. Le mécanisme se poursuit par l’induction d’une augmentation des niveaux de calcium intracellulaire par le réticulum endoplasmique (RE) et par un afflux de calcium extracellulaire. En effet, l’activation de la voie de signalisation en aval de FcεRI ou FcɣRI favorise la formation d’inositol 1,4,5-triphosphate (IP3), qui induit également la libération de calcium du RE à la suite de l’interaction avec son récepteur. Cet influx de calcium active le capteur STIM1 (Stromal interaction molecule 1),
qui interagit avec Orai1 à la surface de la membrane plasmique pour former des canaux d’entrée de calcium à partir de l’environnement extracellulaire. Les mécanismes contrôlant la fusion des granules et leur exocytose via la membrane plasmique sont complexes et restent encore mal caractérisés à ce jour (Azouz et al., 2014). Cet influx de calcium permet la fusion membranaire sous le contrôle de protéines de la famille des SNARE (soluble N-ethylmaleimide-sensitive factor–attachment protein receptors) et des VAMP (vesicle associated membrane proteins). Collectivement, ces évènements conduisent à la dégranulation massive des mastocytes et à la synthèse et la sécrétion de nouveaux médiateurs (Rivera et al., 2008).
2.1.2 Activation non-immunologique via les récepteurs MRGPRX2/Mrgprb2
L’activation des mastocytes peut se produire indépendamment de l’immunité acquise, soit par l’activation du récepteur Mrgprb2 (Mas-related G protein coupled receptor b2) chez la souris, orthologue du récepteur MRGPRX2 chez l’humain. Ce récepteur, faisant partie de la famille des récepteurs couplés aux protéines G (RCPG), est capable de lier la substance P ou le C48/80, mais aussi d’autres sécrétagogues tels que des médiateurs inflammatoires ou des agents associés à des réactions allergiques, ce qui en fait
une cible idéale dans l’inflammation associée à certains traitements thérapeutiques (McNeil et al., 2015).
L’activation non-immunologique des mastocytes via le récepteur Mrgprb2 induit un influx de calcium intracellulaire relativement bref, suivi de l’adressage rapide à la membrane plasmique de granules sphériques de petite taille et au relargage rapide dans le milieu extracellulaire. En contraste avec l’activation immunologique, les granules sécrétoires ne fusionnent pas dans le cytoplasme avant d’être relâchées dans l’environnement extracellulaire (Gaudenzio, 2018).
2.2 Physiologie des granules mastocytaires
Les mastocytes peuvent contenir jusqu’à 1000 granules sécrétoires, occupant près de 40% du volume cellulaire. Programmés pour libérer dans le milieu extracellulaire de manière rapide et massive, les mastocytes peuvent sécréter presque 100% de leur contenu en médiateurs préformés dans un seul évènement de stimulation, comme dans le cas du choc anaphylactique (Blank, 2011). Tandis que toutes les cellules eucaryotes sont capables de transporter et d’exocytoser les protéines par une voie de sécrétion constitutive, certaines cellules, dont les mastocytes, sont en mesure de sécréter leur contenu cytoplasmique de manière régulée.
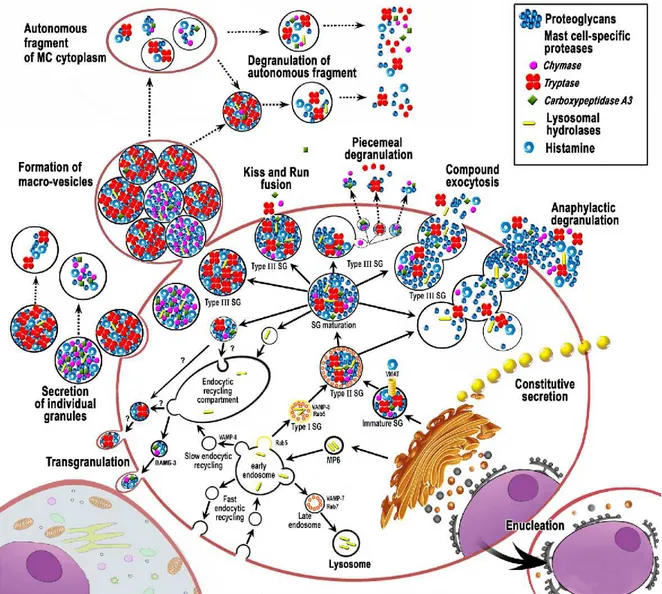
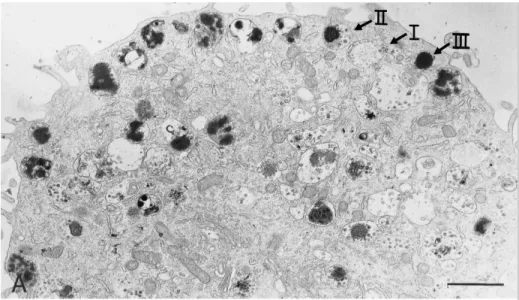
Dans la Figure 5, on peut observer plusieurs types de granules distincts. Les travaux de Raposo et al. (1997) ont permis de mettre en évidence, à l’aide de la microscopie électronique, la présence de 3 types de granules (type I, II et III) morphologiquement distincts dans le cytoplasme des mastocytes (Figure 6). Les granules de type I proviennent de la voie lysosomale/endosomale. Les granules de type II contiennent un noyau protéique dense entouré d’une grande quantité de corps vésiculaires en périphérie et sont formés par la fusion des granules de sécrétion de type I avec des granules de sécrétion immatures provenant du réseau trans-Golgien. Les granules de type III correspondent au stade final de maturité granulaire (Raposo et al., 1997; Blank et al., 2014). Ces granules sont ensuite soumises à de nouvelles modifications puis à l’accumulation de protéases mastocytaires. L’exocytose peut ensuite se produire constitutivement ou selon un mécanisme de sécrétion régulée (Atiakshin et al., 2019).
2.3 Voies sécrétoires des mastocytes 2.3.1 Voie de dégranulation régulée
La voie de sécrétion régulée des mastocytes est déclenchée par l’augmentation de la concentration de calcium intracellulaire. Cette exocytose peut s’effectuer de différentes manières (Figure 5) (Atiakshin et al., 2019; Klein et Sagi-Eisenberg, 2019):
- Par exocytose classique; - Par exocytose multiple;
- Par dégranulation fragmentaire;
- Par exocytose selon un mécanisme de Kiss-and-Run; - Par dégranulation anaphylactique;
- Par sécrétion de granules individuelles.
La libération par exocytose classique implique la fusion d’une seule granule de sécrétion avec la membrane plasmique suivie d’une libération du contenu granulaire en entier. La libération par exocytose multiple permet préalablement la fusion de plusieurs granules à l’intérieur du cytoplasme formant une seule granule, entraînant une décharge plus puissante dans le milieu extracellulaire (Klein et Sagi-Eisenberg, 2019). La voie de dégranulation fragmentaire (ou piecemeal exocytosis) permet une sécrétion sélective dont l’intensité dépend des conditions du microenvironnement tissulaire. Cette voie de sécrétion implique d’abord une compartimentalisation des granules, puis des vésicules intermédiaires possédant un contenu protéique spécifique se détachent progressivement de la granule. Ces vésicules se déplacent plus rapidement à l’intérieur de la cellule et permettent un transport rapide et différentiel des médiateurs jusqu’à la membrane plasmique pour leur sécrétion (Dvorak, 2005). L’exocytose selon un mécanisme de Kiss-and-Run a été proposé dans les années 1970 comme étant un mode d’exocytose alternatif où les vésicules sécrétoires ne sont pas complètement fusionnées, mais seulement en contact avec le plasmalemme (Ceccarelli et al., 1972). Ce contact forme un pore de fusion transitoire permettant la sécrétion de petites quantités de médiateurs sans échange de lipides ou de protéines entre la granule sécrétoire et la membrane plasmique. Cette voie permet également de limiter la grosseur et la quantité des médiateurs libérés (Blank et al., 2014). La dégranulation anaphylactique a lieu suite à une activation immunologique dans une situation de réaction
allergique. Cette sécrétion provoque la libération massive de médiateurs inflammatoires et de protéases (Blank et al., 2014). Il peut également y avoir la formation de macro-vésicules, produites par une invagination de la membrane plasmique. Il est intéressant de noter que cette structure post-cellulaire dépourvue de noyau peut être localisée dans la région extracellulaire pendant un certain temps, représentant une réserve tissulaire de protéases, tel que la chymase, l’enzyme principalement étudiée dans le cadre de l’étude présentée dans ce mémoire (Atiakshin et al., 2019).
2.3.2 Voie de sécrétion constitutive
Les mécanismes menant à l’exocytose constitutive des mastocytes sont encore très peu détaillés dans la littérature à ce jour. Cette voie de sécrétion a lieu en absence de stimulus. Contrairement à la dégranulation régulée des mastocytes, la voie de sécrétion constitutive n’est pas contrôlée par la modulation de la concentration de calcium intracellulaire (Rosengard et al., 1986). Les médiateurs sont d’abord synthétisés sous forme de précurseurs solubles ou transmembranaires dans le RE, puis acheminés dans des vésicules jusqu’au complexe de Golgi pour d’autres modifications post-traductionnelles. Ils sont ensuite chargés dans des petites vésicules de transport ou des endosomes de recyclage qui seront acheminés directement à la surface de la cellule pour une sécrétion constitutive (Lacy et Stow, 2011).
Figure 5 : Voies sécrétoires des mastocytes.
Figure 6 : Morphologie des granules mastocytaires. Visualisation des 3 types de granules
mastocytaires (type I, II et III) par microscopie électronique. [Figure 3 de (Raposo et al., 1997) reproduite avec la permission]
2.4 Modulation pharmacologique de l’exocytose chez les mastocytes
Plusieurs équipes de recherche se sont intéressées aux fonctions et à la survie mastocytaire afin de mettre en lumière l’implication des différents médiateurs libérés dans le développement de diverses pathologies inflammatoires et cardiovasculaires (Bot et al., 2008). Dans le cadre de ce projet, nous avons respectivement utilisé le C48/80 et le cromolyn en tant que sécrétagogue et stabilisateur mastocytaire, afin d’évaluer les propriétés pharmacologiques in vitro et in vivo de la mMCP-4 contenue dans les granules mastocytaires.
2.4.1 Activation des mastocytes par le C48/80
Le C48/80 est un composé polymérique, produit par une réaction de condensation du N-méthyl-p-méthoxyphénéthylamine avec le formaldéhyde. C’est un composé largement utilisé en tant qu’activateur non-immunologique des mastocytes. Il a été caractérisé comme étant un activateur de la relâche d’histamine pour la première fois en 1951 (Paton, 1951). Le
C48/80 active et dégranule spécifiquement les mastocytes via les récepteurs Mrgprb2, provoquant ainsi des réponses inflammatoires dans divers modèles animaux. Il a été démontré que l’injection intrapéritonéale de C48/80 chez le rat induit la dégranulation et la libération de médiateurs par les CTMC présents au niveau du péritoine de manière dose-dépendante (Irman-Florjanc et Erjavec, 1983). L’induction de l’exocytose par le C48/80 peut être observée au microscope optique (Riley et West, 1955; Mota, 1963). Les MMC semblent toutefois insensibles à l’action du C48/80 puisqu’aucun changement morphologique n’est observé dans ces cellules après l’administration de doses susceptibles de provoquer une dégranulation complète (Enerbäck, 1966). À titre informatif, une liste des sécrétagogues connus est répertoriée dans le Tableau 3.
2.4.2 Stabilisation des mastocytes par le cromolyn
Le cromolyn, aussi connu sous le nom de cromoglycate disodium, a été synthétisé pour la première fois en 1965 dans le but de développer un analogue de la khelline, un bronchodilatateur (Shapiro et König, 1985). D’abord reconnu pour son potentiel thérapeutique dans le traitement de l’asthme, il a été utilisé dans l’étude des réactions anaphylactiques dans des modèles animaux et dans l’inhibition de la relâche des médiateurs inflammatoires par l’activation immunologique et non-immunologique des mastocytes (Sinniah et al., 2017). Malgré que le cromolyn ait été approuvé par l’Agence américaine des produits alimentaires et médicamenteux (Food and Drug Administration, ou FDA) en 1973, le mécanisme d’inhibition est très peu connu dans la littérature. Il est probable que cette stabilisation soit médiée par l’inhibition de l’influx de calcium extracellulaire nécessaire à l’initiation de la dégranulation (Foreman et Garland, 1976). Le cromolyn s’est avéré efficace dans plusieurs modèles animaux, dont le rat, la souris, le primate et l’humain (Assem et Mongar, 1970; Goose et Blair, 1969; Samoszuk et Corwin, 2003). Il est intéressant de noter que la stabilisation des mastocytes ne se limite pas aux réactions IgE-dépendante, mais également à l’activation non-immunologique des mastocytes par le C48/80, par exemple comme décrit dans les travaux de Orr et al. (1971). Une liste des stabilisateurs mastocytaires connus est répertoriée dans le Tableau 4.
Tableau 3 : Sécrétagogues et activateurs des mastocytes.
Nom Mécanismes Nature du composé Références
Anaphylatoxin
C3a ou C5a Ligand du récepteur du complément C3aR ou C5aR Peptide endogène
(Mousli et al., 1994)
Calcium ionophore A23187
Augmente le calcium
intracellulaire Transporteur d’ions de Ca2+, de Mg2+
(Yecies et al., 1979)
C48/80 Agoniste des récepteurs mrgprb2 Composé non peptidique (Rothschild, 1970; McNeil
et al., 2015)
Cortistatin-14 Agoniste des récepteurs mrgprb2 Neuropeptide endogène (Robas et al., 2003; Subramanian et al., 2011)
Mastoparan Agoniste des récepteurs mrgprb2 Activateur de la voie de
signalisation de la PLA2 et PLC
Composé provenant du venin de la guêpe
(Higashijima et al., 1990; Mousli et al., 1990; Jones et Howl, 2006)
Morphine Activation de la voie de
signalisation de la PLC Opioïde
(Casale et al., 1984)
Neomycin Activation des récepteurs PTX Antibiotique (Aridor et Sagi-Eisenberg,
1990)
PAMP[9-20]/
PAMP-12 Agoniste des récepteurs mrgprb2 Analogue tronqué de la proadrénomédulline [1-20]
(Kamohara et al., 2005)
Substance P Agoniste des récepteurs PTX Activation de la voie de signalisation de la PLC
Agoniste des récepteurs NK-1 et mrgprb2
Neuropeptide de la famille des tachykinines
(Ferry et al., 2001; Tatemoto et al., 2006; Bot
et al., 2010)
Abréviations : Ca2+, calcium ; C48/80, composé 48/80 ; Mg2+, magnésium ; NK-1, neurokinin 1 ; PAMP, motifs moléculaires associés aux
pathogènes ; PLA2, phospholipase A2 ;PLC, phospholipase C ; PTX, toxine pertussis.
Tableau 4 : Stabilisateurs et inhibiteurs de la dégranulation des mastocytes.
Nom Mécanismes Classe thérapeutique Références
Bepostatine Antagoniste sélectif des récepteurs H1 de l’histamine
Antihistaminique (Kato et al., 1997)
Cromolyn Préviens l’influx de calcium
intracellulaire (?) Stabilisateur mastocytaire
(Cox, 1971)
Ketotifen Antagoniste des récepteurs H1 de
l’histamine
Antihistaminique (Castillo et al., 1991)
Lodoxamide Préviens l’influx de calcium
intracellulaire (?) Stabilisateur mastocytaire
(Case, 1982)
Nedocromil Inhibiteur de la synthèse des prostaglandines et leucotriènes
Stabilisateur mastocytaire (Shaw et Kay, 1985)
Oloplatadine Antagoniste des récepteurs H1 de
l’histamine
Inhibiteur du récepteur ICAM-1
Antihistaminique et stabilisateur mastocytaire
(Sharif et al., 1996)
Pemirolast Antagoniste des récepteurs H1 de
l’histamine
Inhibiteur des canaux calciques
Antihistaminique et stabilisateur mastocytaire
(Yamashita et al., 1999)
Tranilast (?) Antiallergique (Azuma et al., 1976)
3
L
A CHYMASE
3.1 Caractéristiques générales de la chymase
Synthétisées et emmagasinées au niveau des granules de sécrétion des mastocytes, les chymases ont été identifiées pour la première fois en 1959 (Benditt, 1959). Ce sont des endopeptidases monomères appartenant à la famille des sérines protéases présentant des spécificités analogues à la chymotrypsine, c’est-à-dire qu’elles clivent préférentiellement le côté carboxylique d’un lien peptidique suivant un acide aminé aromatique comme la phénylalanine, la tyrosine ou le tryptophane (Pejler et al., 2007). Aussi, cette classe d’enzyme se distingue par la présence de trois résidus d’acides aminés qui interviennent ensemble dans le site actif formant la triade catalytique. Cette triade catalytique fait intervenir un résidu acide, basique et nucléophile. Dans le cas de la chymase, il s’agit de l’acide aspartique-102, l’histidine-57 et la sérine-195 (Carter et Wells, 1988; Reiling et al., 2003).
3.2 Classification des chymases mastocytaires
Plusieurs chymases identifiées chez différentes espèces ont été divisées en deux groupes, soit les α-chymases et les β-chymases, divisées en fonction de leur structure et leur spécificité de substrats (Gallwitz et Hellman, 2006). On ne retrouve qu’une seule α-chymase chez l’humain. Chez la souris, on retrouve plusieurs isoformes de protéases mastocytaires (mMCP). Parmi celles-ci, on retrouve une seule α-chymase (mMCP-5) et trois β-chymases (mMCP-1, mMCP-2 et mMCP-4). Basée sur la similarité de séquence, mMCP-5 semble être l’homologue le plus probable de la chymase humaine. Par contre, un essai de spécificité de clivage a permis de démontrer que l’activité enzymatique de la mMCP-5 s’apparente à celle de l’élastase (Kunori et al., 2002). Également, mMCP-1 et mMCP-2 ont des localisations tissulaires et des activités enzymatiques absentes ou différentes de la chymase humaine (Pejler et al., 2010). La mMCP-4, en revanche, est celle qui présente le plus d’homologie fonctionnelle avec la chymase humaine au niveau de son activité enzymatique de type chymotrypsine, de sa spécificité de substrat, de sa localisation tissulaire, mais également au
niveau de ses propriétés de liaison avec un protéoglycane (Tchougounova et al., 2003; Pejler et al., 2010; Semaan et al., 2015). Le Tableau 5 présente les caractéristiques des différentes chymases en fonction de leurs types cellulaires chez l’humain et la souris.
Tableau 5 : Caractéristiques des différentes chymases retrouvées dans les mastocytes humains et de souris. [Informations tirées de (Pejler et al., 2010)]
Espèce Sous-type mastocytaire Enzyme Gène Activité protéolytique
Humain MCTC α-chymase CMA1 Activité chymotrypsine
MCT - - - Souris CTMC α-chymase (mMCP-5) β-chymase (mMCP-4) mcpt5 mcpt4 Activité élastase Activité chymotrypsine MMC β-chymase (mMCP-1) β-chymase (mMCP-2) mcpt1 mcpt2 Activité chymotrypsine Inactive
Abréviations : CTMC, mastocytes des tissus conjonctifs ; MCT, mastocytes positifs pour la tryptase ; MCTC, mastocytes positifs pour la tryptase et la chymase ; MMC, mastocytes des tissus muqueux ; mMCP, protéase mastocytaire murine.
3.3 Activation et inhibition physiologique de la chymase
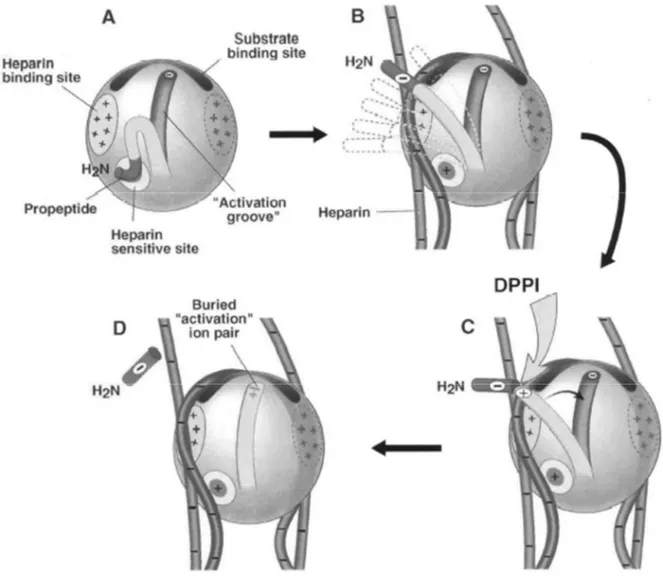
La chymase est d’abord synthétisée au niveau du RE rugueux, sous forme de proenzyme inactive. Avant d’être stockée à l’intérieur des granules de sécrétion, elle doit subir une maturation qui consiste au clivage d’un dipeptide acide en position N-terminal par la dipeptidyl peptidase I (DPPI), aussi appelée Cathepsine C. La liaison de la chymase inactive à l’héparine, jouant le rôle de protéoglycane chargé négativement, favorise un repliement favorable de la proenzyme de façon à ce que le dipeptide soit exposé et clivé par la DPPI. Le clivage provoque un rapide changement conformationnel empêchant un second clivage par la DPPI et permettant l’activation de l’enzyme (Murakami et al., 1995). La schématisation de ces étapes d’activation est présentée dans la Figure 7. Le pH dans les granules de sécrétion est de 5.5, ce qui permet de maintenir la chymase sous forme inactive, dont le pH optimal pour son activité hydrolytique se situe entre 7.0 et 9.0 (Bacani et Frishman, 2006).
Suivant sa sécrétion dans la matrice extracellulaire, la chymase peut être rapidement inhibée de manière irréversible par des protéines plasmatiques appartenant à la famille des serpines, dont l’α1-antitrypsine, l’α2-antichymotrypsine et l’α1-inhibiteur de protéinase
l’α2-macroglobuline, qui emprisonne la chymase active de manière covalente et empêche
une activité enzymatique prolongée. À la suite de sa sécrétion par les mastocytes, la chymase reste liée à l’héparine, ce qui peut ralentir de manière significative l’inhibition par les serpines, et contribuer à l’augmentation de sa demi-vie (Walter et al., 1996). De plus, la chymase liée à l’héparine est capable de dégrader l’inhibiteur α1-antitrypsine
(Lindstedt et al., 2001). Le rôle régulateur de l’héparine dans la modulation de la bioactivité de la chymase peut également se manifester par la sélectivité de ses substrats, la limitation de sa mobilité et la prolongation de son activité enzymatique après dégranulation (Pejler et al., 2007).
Figure 7 : Mécanisme d’activation de la chymase par la DPPI en présence d’héparine.
3.4 Substrats de la chymase
La synthèse d’angiotensine II (Ang II) par la chymase est bien documentée dans la littérature (Pejler et al., 2010; Froogh et al., 2017). En effet, la chymase est capable de cliver la liaison Phe8-His9 de l’angiotensine I (Ang I), pour former le peptide vasoactif. Par ailleurs,
la chymase joue également un rôle significatif dans la génération d’ET-1, passant par la production d’endothéline-1 (1-31) (ET-1 (1-31)), un intermédiaire de 31 acides aminés formé par le clivage de la liaison Tyr31–Gly32 de la big-endothéline-1 (big-ET-1) par la chymase
(Houde et al., 2013). Le Tableau 6 regroupe les principaux substrats de la chymase. Cependant, dans la présente étude, nous nous intéressons à l’étude des propriétés pharmacologiques de la chymase dans un modèle de souris. Une liste de substrats spécifiques pour la mMCP-4 provenant d’études utilisant un modèle animal réprimé pour la mMCP-4 ou l’enzyme recombinante est présentée dans le Tableau 7.
Tableau 6 : Substrats de la chymase.
Substrat Activité biologique Référence
Albumine Dégradation (Raymond et al., 2003)
Ang I Conversion (Urata et al., 1990a)
Apolipoprotéine E, A-II Dégradation (Lee et al., 2002)
Big-ET-1 Conversion (Nakano et al., 1997)
Bradikinine Inactivation (Reilly et al., 1985)
Fibronectine Dégradation (Lazaar et al., 2002; Tchougounova et al.,
2003)
Kallikréines Activation (Reilly et al., 1985)
Neurotensine Hydrolyse (Goldstein et al., 1991)
Plasmine Dégradation (Tchougounova et Pejler, 2001)
Procollagen Activation et dégradation (Kofford et al., 1997)
Procollagénase Activation et clivage (Saarinen et al., 1994)
Pro-MMP-9 Activation (Tchougounova et al., 2005)
SCF Activation (Longley et al., 1997; de Paulis et al., 1999)
Substance P Dégradation (Caughey et al., 1988)
TGF-β Activation (Taipale et al., 1995)
Thrombine Dégradation (Pejler etbKarlström, 1993; Tchougounova
et Pejler, 2001)
Vitronectine Dégradation (Banovac et al., 1993)
Abréviations : Ang I, angiotensine I ; Big-ET-1, big-endothéline-1 ; MMP, métalloprotéinase matricielle ; SCF, facteur de cellule souche ; TGF-β, facteur de croissance transformant.
Tableau 7 : Substrats de la mMCP-4.
Substrat Activité biologique Référence
Ang I Conversion (Caughey et al., 2000)
Big-ET-1 Conversion (Fecteau et al., 2005; Houde et al., 2013;
Semaan et al., 2015)
Élastine Dégradation (Sun et al., 2009)
Fibronectine Dégradation (Tchougounova et Pejler, 2001;
Tchougounova et al., 2003)
IGF-1 Dégradation (Houde et al., 2018)
IL-6 Dégradation (Sun et al., 2009)
Plasmine Dégradation (Pejler et al., 1994; Tchougounova et Pejler,
2001)
Pro-MMP-9 et pro-MMP-2 Activation (Tchougounova et al., 2005)
Thrombine Dégradation (Pejler et al., 1994; Tchougounova et Pejler,
2001)
TNF-α Dégradation (Sun et al., 2009; Piliponsky et al., 2012)
VEGF Activation (Sun et al., 2009)
Abréviations : Ang I, angiotensine I ; Big-ET-1, big-endothéline-1 ; IGF-1, insulin-like growth factor 1 ; IL, interleukine ; MMP, métalloprotéinase matricielle ; TNF-α, facteur de nécrose tumorale ; VEGF, vascular endothelial growth factor.
3.5 Inhibiteurs pharmacologiques de la chymase
Plusieurs inhibiteurs, présentés dans le Tableau 8, ont différentes puissances et sélectivités pour la chymase et ont été développés dans le but d’évaluer et de limiter la contribution de l’enzyme dans certaines pathologies cardiovasculaires. Par contre, bien que plusieurs de ces inhibiteurs sont adéquats dans le traitement des pathologies chez les modèles animaux, la plupart ont échoué lors des premiers essais cliniques en raison d’effets secondaires indésirables (Ahmad et Ferrario, 2018). Cela pourrait être expliqué en partie en raison de la variabilité dans l’expression génique de la chymase et des fonctions biologiques de l’enzyme chez les différentes espèces. En effet, tel que mentionné plus tôt, les humains possèdent une seule α-chymase, les souris possèdent une α-chymase mais aussi plusieurs β-chymases. La chymase chez l’humain et le chien ne dégrade pas l’Ang II, contrairement à la mMCP-4 et la mMCP-1 chez les rongeurs, qui ont une activité angiotensinase (Miyazaki et al., 2006).
Par ailleurs, plus récemment, le Fulacimstat (ou BAY1142526), un inhibiteur de la chymase active pouvant être administré par voie orale, est actuellement en cours de développement par Bayer Healthcare (Kanefendt et al., 2019). Des études préliminaires

![Tableau 2 : Médiateurs mastocytaires. [Modifié de (Theoharides et al., 2007) et (Blank et Vitte, 2015)]](https://thumb-eu.123doks.com/thumbv2/123doknet/3378318.97810/22.918.103.845.163.1022/tableau-médiateurs-mastocytaires-modifié-theoharides-al-blank-vitte.webp)