THERMODYNAMIQUE : ENTROPIE DÈS LE DÉBUT
Michele D’ANNA
Alta Scuola Pedagogica, Locarno (Suisse)
MOTS-CLÉS : THERMODYNAMIQUE – ENTROPIE – IRRÉVERSIBILITÉ – MACHINES THERMIQUES
RÉSUMÉ : Même dans un cours d’introduction, l’enseignement de la thermodynamique devrait se fonder sur l’entropie. En effet celle-ci peut être introduite et définie grâce à ses propriétés phéno-ménologiques, dont la plus remarquable est que l’entropie peut être produite mais ne peut jamais être détruite dans n’importe quel phénomène naturel. Cette propriété nous donne aussi une clé pour repérer les processus irréversibles. Une discussion du rendement des machines thermiques est pré-sentée en guise de conclusion.
ABSTRACT : Even an introductory course on thermodynamics should be based on entropy. The concept could be introduced and defined thanks to its phenomenological characteristics, the most relevant being the fact that entropy can be produced, but can never be destroyed in whatever natural phenomenon. This characteristic also lends itself to introduce irreversible processes. In conclusion there is a discussion of the efficiency of thermal engines.
1. L’ENTROPIE ET SES PROPRIÉTÉS – LA TEMPÉRATURE COMME POTENTIEL THERMIQUE
Il est souhaitable d’introduire dès le début de l’enseignement de la thermodynamique une grandeur extensive thermique (Kocher et Sciarini, 2005). Il s’agit bien sûr de l’entropie, une grandeur souvent considérée comme difficile et qui n’aurait pas de place dans un cours scientifique de base. En réalité, l’entropie correspond au mot chaleur du langage quotidien, une notion bien familière à tout le monde. Dans l’approche didactique qu’on va discuter (Herrmann, 2005) l’entropie est considérée comme une grandeur primaire et elle est présentée aux élèves à travers un modèle opératif. L’entropie est caractérisée par les propriétés suivantes, qui constituent la synthèse d’une série d’observations expérimentales :
• elle peut être stockée ;
• elle peut être transportée d’un corps à l’autre ; • elle est soumise à une loi de bilan ;
• elle n’obéit pas à une loi de conservation : elle peut être produite mais jamais être détruite ; • elle joue le rôle de porteur d’énergie dans les phénomènes thermiques.
Pour ce qui concerne la grandeur thermique intensive, toujours en partant d’activités expérimentales, on peut reconnaître que les différences de température jouent le rôle de « poussée » (ou « force motrice ») dans les phénomènes thermiques. La température est ainsi reconnue comme potentiel thermique : plus la température d'un corps est élevée, plus d'entropie il contient.
2. QUELQUES EXEMPLES
2.1. Exemple 1 : Contact thermique entre corps à température différente
Considérons le contact thermique entre des corps à température différente : que se passe-t-il entre les deux corps ? Au moyen de deux détecteurs thermiques, on peut déterminer la température en fonction du temps pour chacun des deux objets (que nous supposons homogènes) :
On constate qu’au bout d’un certain temps, le système atteint une situation d’équilibre : avec le temps, la différence de température entre les corps a la tendance à diminuer jusqu’à s’anéantir (figure 2). Face au modèle général, ce comportement nous suggère quelques questions : pourquoi
Figure 1 - Contact thermique entre des corps à température différente. a) Un cylindre en aluminium est chauffé et ensuite inséré dans un anneau circulaire, toujours en aluminium et de la même masse. b) Les deux objets sont placés
tout de suite après dans un récipient isolant.
Figure 2 - Au bout d’un certain temps, le système atteint une situation d’équilibre: la température des deux objets assume une valeur commune et constante.
2.2. Exemple 2 : Le thermo-générateur
Quand on place un petit morceau de glace sur la surface supérieure du thermo-générateur (engendrant ainsi une différence de température entre ses deux surfaces), on constate qu’il est en mesure de faire fonctionner un petit moteur électrique.
Figure 3 - Le thermo-génerateur: le courant d’entropie généré par la différence de température entre les deux « surfaces » du thermo-générateur est à l’origine d’une tension électrique qui peut servir, par exemple, à
2.3. Exemple 3 : La conduction thermique
Figure 4 - La conduction thermique: une extrémité d’une barre de cuivre est maintenue « chaude » à l’aide d’un sèche-cheveux (flèche rouge); l’autre (flèche bleue) est mise en contact avec un thermo-générateur. Ce dernier alimente un
petit moteur électrique capable d’entretenir la rotation d’une hélice.
Que se passe-t-il dans la barre ? Pour simplifier la description de ce phénomène, on va modéliser le système en examen selon le schéma de la figure 5.
Nous choisissons la barre de cuivre comme le système physique auquel nous appliquons les relations de bilan. Le principe de la conservation de l’énergie et la relation générale entre les inten-sités du flux d’énergie et ceux des grandeurs extensives qui le véhiculent, nous permettent d’écrire les relations nécessaires :
IEterm, 1 = IEterm, 2 , T1. IS1 = T2. IS2
La première exprime le fait que, dans les conditions choisies, le flux de l’énergie qui entre a la même valeur que celui qui sort de la barre ; la seconde constitue sa traduction dans le langage thermique adapté à la situation qu’on est en train de considérer : l’intensité du flux d’énergie (aussi bien à l’entrée qu’à la sortie de la barre de cuivre) peut être exprimée par le produit entre l’intensité du flux d’entropie et la température (absolue) à laquelle a lieu l’échange thermique.
Étant donné que, par hypothèse T1 est plus grand que T2, nous pouvons conclure que l’intensité du
courant d’entropie à la sortie est supérieure à l’intensité du courant à l’entrée. Cela est interprété en disant que, dans le processus de conduction thermique, il y a production d’entropie à l’intérieur de la barre. De façon formelle, nous pouvons exprimer ce fait par la relation IS2 = IS1 +
!
S, qui n’estrien d’autre que l’expression de la loi de bilan adaptée à notre situation, et dans laquelle le symbole
!
S représente le taux instantané de production d’entropie. Dans un régime stationnaire, l’équationFigure 5 - Schéma des échanges thermiques. a) Les échanges d’entropie interviennent uniquement aux extrémités de la barre, l’une et l’autre en contact thermique avec deux réser-voirs dont les températures T1 et T2 sont supposées constantes.
b) Le long de la barre de cuivre il y a un transport d’entropie: la différence de température entre les deux extrémités consti-tue la poussée au transfert de l’entropie.
Figure 6 - L’intensité du courant d’entropie à la sortie de la barre est donnée par la somme de deux
contributions: l’intensité du courant d’entropie à l’entrée de la barre et le taux instantané de
production dans la barre.
3. QUE NOUS APPREND CE MODÈLE ?
Nous sommes maintenant en mesure de formuler des considérations générales à propos de notre modèle et de les appliquer dans quelques cas concrets.
3.1. L’entropie et le IIe principe de la thermodynamique
Pour commencer, il faut souligner le fait que l’entropie peut être produite mais qu’elle ne peut ja-mais être anéantie. Cette affirmation constitue à tous les effets une formulation du second principe de la thermodynamique, une formulation qui est particulièrement simple et qui peut être utilisée efficacement pour reconnaître les processus irréversibles.
3.2. Production d’entropie et irréversibilité
Une seconde remarque a pour objet précisément le fait que la production d’entropie est une caractéristique nécessaire et suffisante pour déterminer l’irréversibilité d’un processus : lorsqu’un processus est irréversible, il y a toujours production d’entropie, et vice-versa ! Cet aspect est particulièrement intéressant car parmi la grande variété des phénomènes dissipatifs qui nous entourent il y en a certains qui peuvent être facilement caractérisés et reconnus. En particulier, les phénomènes suivants sont toujours accompagnés par la production d’entropie et par conséquent ils
- la conduction électrique à travers un métal (due à une différence de potentiel électrique) ; - la conduction thermique (due à une différence de température) ;
- les frottements mécaniques (dus à une différence de vitesse entre les corps en contact) ;
- et parmi les réactions chimiques (dues à une différence de potentiel chimique) celles non couplées, notamment les combustions.
3.3. Énergie et non-conservation de l’entropie
Un troisième aspect qu’il vaut la peine de souligner est le fait que, du point de vue énergétique, la production d’entropie a toujours un coût : au cours d’un processus dissipatif une partie de l’énergie du système est liée à l’entropie produite, et n’est donc plus disponible pour être exploitée pour d’autres fins, c'est-à-dire pour créer d’autres différences de potentiel. Du point de vue quantitatif, le taux de dissipation de l’énergie peut être exprimé par le produit entre le taux de production de l’entropie et la température à laquelle celle-ci est produite :
Ce résultat nous permet de préciser un aspect à propos de la non-conservation de l’entropie,
un fait qui est indiqué parfois comme l’obstacle majeur dans l’introduction du concept même d’entropie : si d’un côté il est vrai que l’entropie peut être produite, de l’autre cette production n’est pas libre, mais au contraire elle est soumise au principe de la conservation de l’énergie, un principe qui exprime donc ici pleinement son rôle de principe régulateur de validité générale.
On peut même affirmer que chaque processus irréversible est caractérisé par la production d’exactement autant d’entropie que cela est exigé par la loi de conservation de l’énergie.
Prenons en considération, par exemple, les aspects énergétiques de la conduction thermique ;
toute l’énergie « libérée » par la chute de l’entropie de la température T1 à la température T2 n’est
couplée à aucun autre porteur, mais elle est totalement soumise à dissipation :
Figure 7 - Bilan énergétique pour le cas de la conduction thermique: la puissance thermique est totalement dissipée, c’est-à-dire que la totalité de l’énergie qui sort du système est toujours liée au
3.4. Machines thermiques
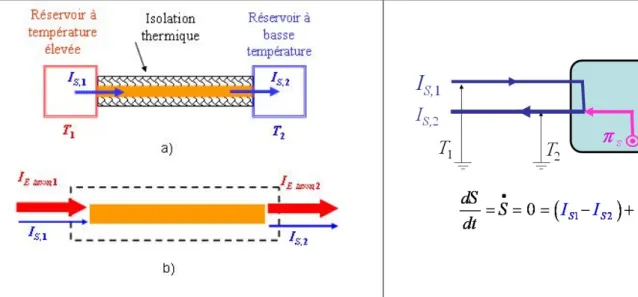
Les deux remarques qu’on vient de discuter nous permettent aussi de discuter les aspects fondamentaux concernant les machines thermiques. Afin d’obtenir le maximum de rendement, il faut éviter des processus comportant une production d’entropie : il s’agit, en particulier, d’éviter tous les processus au cours desquels le fluide de travail entre en contact avec des parties de la ma-chine ayant une température différente de sa propre température. Si l’on envisage comme d’habitude une machine qui emploie le gaz idéal, cette condition impose des limitations sévères, en gardant comme seules candidates les transformations isoentropiques (ou adiabatiques réversibles) et isothermiques. Comme on pourra aisément le constater, ces considérations nous mènent directement, et de façon naturelle, à considérer le cycle de Carnot bien connu.
Que peut-on dire à propos du rendement d’une machine thermique ? Prenons d’abord le cas d’une machine réversible. En accord avec la représentation que nous venons de discuter, cette situation peut être représentée par le schéma de la figure 8.
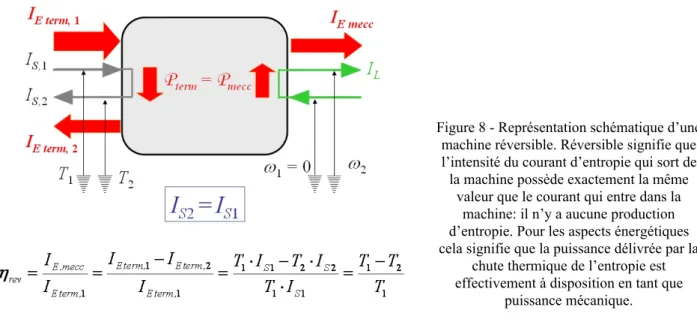
Figure 8 - Représentation schématique d’une machine réversible. Réversible signifie que l’intensité du courant d’entropie qui sort de la machine possède exactement la même
valeur que le courant qui entre dans la machine: il n’y a aucune production d’entropie. Pour les aspects énergétiques cela signifie que la puissance délivrée par la
chute thermique de l’entropie est effectivement à disposition en tant que
puissance mécanique.
Dans ces conditions, pour exprimer le rendement, il suffit d’adapter la définition bien connue au cas instantané : d’abord nous utilisons la loi de conservation de l’énergie, en exprimant la puissance mécanique disponible comme différence entre les flux thermiques d’énergie à l’entrée et à la sortie de la machine ; ensuite nous utilisons trois fois la relation entre l’intensité du courant d’énergie, l’intensité du courant d’entropie et la température ; pour terminer il nous suffit de rappeler la relation d’égalité entre l’intensité des courants d’entropie à l’entrée et à la sortie de la machine, relation garantie par la condition de réversibilité que nous avons postulée.
Cela fait, nous retrouvons l’expression bien connue pour le rendement d’une machine thermique réversible et du même coup nous sommes prêts à nous occuper du cas général d’une machine irréversible. Dans cette situation nous avons le schéma illustré figure 9.
Figure 9 - Représentation schématique d’une machine non réversible: elle est caractérisée par le fait qu’il y a une production d’entropie. En ce qui concerne les aspects énergétiques cela signifie que la puissance délivrée par la chute thermique de l’entropie n’est plus complètement à disposition en tant que puissance mécanique, puisque une partie est absorbée par la production d’entropie.
Pour le rendement nous pouvons procéder exactement comme auparavant : l’unique différence -mais décisive - est constituée du fait que cette fois-ci les courants d’entropie à l’entrée et à la sortie de la machine n’ont plus la même valeur : en conséquence du caractère irréversible, à la sortie il y a plus d’entropie qu’à l’entrée. Cela signifie que l’expression algébrique que nous obtenons pour le rendement de la machine thermique a une valeur inférieure par rapport à celle d’une machine réversible qui utilise des réservoirs thermiques avec les mêmes températures. De cette façon, nous avons donc une caractérisation complète des deux cas possibles que, si nous le désirons, nous pouvons fondre sans aucune difficulté dans la formulation courante du théorème de Carnot.
BIBLIOGRAPHIE
KOCHER U., SCIARINI S. (2005). Équation de bilan, poussée, courant et résistance: du poulailler à la formalisation disciplinaire, Communication JIES, Chamonix, 2005.
HERRMANN F. (2005). Le KPK: un cours de physique basé sur des analogies. Bulletin de l’Union des Physiciens, 870, 43-58.