Université de Lille Faculté de Pharmacie de Lille Année Universitaire 2018/2019
MEMOIRE
POUR LE DIPLOME D'ETUDES SPECIALISEES DE BIOLOGIE MEDICALE
Soutenu publiquement le 24 septembre 2019 Par M. BOULHAT Belkacem
conformément aux dispositions réglementaires en vigueur tient lieu de
THESE EN VUE DU DIPLOME D’ETAT DE DOCTEUR EN PHARMACIE
_____________________________
Intérêt du diagnostic rapide des infections respiratoires par approche syndromique chez l’enfant au Centre Hospitalier de Valenciennes
_____________________________
Membres du jury :
Président : Docteur Anne GOFFARD, MCU-PH, CHRU Lille
Assesseur(s) : Professeur Karine FAURE, PU-PH, CHRU Lille
Université de Lille Faculté de Pharmacie de Lille Année Universitaire 2018/2019
MEMOIRE
POUR LE DIPLOME D'ETUDES SPECIALISEES DE BIOLOGIE MEDICALE
Soutenu publiquement le 24 septembre 2019 Par M. BOULHAT Belkacem
conformément aux dispositions réglementaires en vigueur tient lieu de
THESE EN VUE DU DIPLOME D’ETAT DE DOCTEUR EN PHARMACIE
_____________________________
Intérêt du diagnostic rapide des infections respiratoires par approche syndromique chez l’enfant au Centre Hospitalier de Valenciennes
_____________________________
Membres du jury :
Président : Docteur Anne GOFFARD, MCU-PH, CHRU Lille
Assesseur(s) : Professeur Karine FAURE, PU-PH, CHRU Lille
Université de Lille
Président : Jean-Christophe CAMART
Premier Vice-président : Damien CUNY
Vice-présidente Formation : Lynne FRANJIÉ
Vice-président Recherche : Lionel MONTAGNE
Vice-président Relations Internationales : François-Olivier SEYS
Directeur Général des Services : Pierre-Marie ROBERT Directrice Générale des Services Adjointe : Marie-Dominique SAVINA
Faculté de Pharmacie
Doyen : Bertrand DÉCAUDIN
Vice-Doyen et Assesseur à la Recherche : Patricia MELNYK Assesseur aux Relations Internationales : : Philippe CHAVATTE Assesseur à la Vie de la Faculté et aux
Relations avec le Monde Professionnel : Thomas MORGENROTH
Assesseur à la Pédagogie : Benjamin BERTIN
Assesseur à la Scolarité : Christophe BOCHU
Responsable des Services : Cyrille PORTA
Faculté de Pharmacie de Lille
3, rue du Professeur Laguesse - B.P. 83 - 59006 LILLE CEDEX ( 03.20.96.40.40 - Ê : 03.20.96.43.64
Liste des Professeurs des Universités - Praticiens Hospitaliers
Civ. NOM Prénom Laboratoire
Mme ALLORGE Delphine Toxicologie
M. BROUSSEAU Thierry Biochimie
M. DÉCAUDIN Bertrand Pharmacie Galénique
M. DEPREUX Patrick ICPAL
M. DINE Thierry Pharmacie clinique
Mme DUPONT-PRADO Annabelle Hématologie
M. GRESSIER Bernard Pharmacologie
M. LUYCKX Michel Pharmacie clinique
M. ODOU Pascal Pharmacie Galénique
M. STAELS Bart Biologie Cellulaire
Liste des Professeurs des Universités
Civ. NOM Prénom Laboratoire
M. ALIOUAT El Moukhtar Parasitologie
Mme AZAROUAL Nathalie Physique
M. BERTHELOT Pascal Onco et Neurochimie
M. CAZIN Jean-Louis Pharmacologie – Pharmacie clinique
M. CHAVATTE Philippe ICPAL
M. COURTECUISSE Régis Sciences végétales et fongiques
M. CUNY Damien Sciences végétales et fongiques
Mme DELBAERE Stéphanie Physique
M. DEPREZ Benoît Lab. de Médicaments et Molécules
Mme DEPREZ Rebecca Lab. de Médicaments et Molécules
M. DUPONT Frédéric Sciences végétales et fongiques
M. DURIEZ Patrick Physiologie
M. FOLIGNE Benoît Bactériologie
M. GARÇON Guillaume Toxicologie
Mme GAYOT Anne Pharmacotechnie Industrielle
M. GOOSSENS Jean François Chimie Analytique
M. HENNEBELLE Thierry Pharmacognosie
M. LEMDANI Mohamed Biomathématiques
M. LUC Gerald Physiologie
Mme MELNYK Patricia Onco et Neurochimie
M. MILLET Régis ICPAL
Mme MUHR – TAILLEUX Anne Biochimie
Mme PAUMELLE-LESTRELIN Réjane Biologie Cellulaire
Mme PERROY Anne Catherine Législation
Mme ROMOND Marie Bénédicte Bactériologie
Mme SAHPAZ Sevser Pharmacognosie
M. SERGHERAERT Eric Législation
Mme SIEPMANN Florence Pharmacotechnie Industrielle
M. SIEPMANN Juergen Pharmacotechnie Industrielle
M. WILLAND Nicolas Lab. de Médicaments et Molécules
Liste des Maîtres de Conférences - Praticiens Hospitaliers
Civ. NOM Prénom Laboratoire
Mme BALDUYCK Malika Biochimie
Mme GARAT Anne Toxicologie
Mme GOFFARD Anne Bactériologie
M. LANNOY Damien Pharmacie Galénique
Mme ODOU Marie Françoise Bactériologie
M. SIMON Nicolas Pharmacie Galénique
Liste des Maîtres de Conférences
Civ. NOM Prénom Laboratoire
Mme ALIOUAT Cécile Marie Parasitologie
M. ANTHERIEU Sébastien Toxicologie
Mme AUMERCIER Pierrette Biochimie
Mme BANTUBUNGI Kadiombo Biologie cellulaire
Mme BARTHELEMY Christine Pharmacie Galénique
Mme BEHRA Josette Bactériologie
M BELARBI Karim Pharmacologie
M. BERTHET Jérôme Physique
M. BERTIN Benjamin Immunologie
M. BLANCHEMAIN Nicolas Pharmacotechnie industrielle
M. BOCHU Christophe Physique
M. BOSC Damien Lab. de Médicaments et Molécules
M. BRIAND Olivier Biochimie
M. CARNOY Christophe Immunologie
Mme CARON Sandrine Biologie cellulaire
Mme CHABÉ Magali Parasitologie
Mme CHARTON Julie Lab. de Médicaments et Molécules
M CHEVALIER Dany Toxicologie
M. COCHELARD Dominique Biomathématiques
Mme DANEL Cécile Chimie Analytique
Mme DEMANCHE Christine Parasitologie
Mme DEMARQUILLY Catherine Biomathématiques
M. DHIFLI Wajdi Biomathématiques
Mme DUMONT Julie Biologie cellulaire
Mme DUTOUT-AGOURIDAS Laurence Onco et Neurochimie
M. EL BAKALI Jamal Onco et Neurochimie
M. FARCE Amaury ICPAL
Mme FLIPO Marion Lab. de Médicaments et Molécules
Mme FOULON Catherine Chimie Analytique
M. FURMAN Christophe ICPAL
Mme GENAY Stéphanie Pharmacie Galénique
M. GERVOIS Philippe Biochimie
Mme GOOSSENS Laurence ICPAL
Mme GRAVE Béatrice Toxicologie
Mme GROSS Barbara Biochimie
M. HAMONIER Julien Biomathématiques
Mme HAMOUDI Chérifa Mounira Pharmacotechnie industrielle
Mme HANNOTHIAUX Marie-Hélène Toxicologie
Mme HELLEBOID Audrey Physiologie
M. HERMANN Emmanuel Immunologie
M. KAMBIA Kpakpaga Nicolas Pharmacologie
M. KARROUT Youness Pharmacotechnie Industrielle
Mme LALLOYER Fanny Biochimie
M. LEBEGUE Nicolas Onco et Neurochimie
Mme LECOEUR Marie Chimie Analytique
Mme LEHMANN Hélène Législation
Mme LELEU-CHAVAIN Natascha ICPAL
Mme MARTIN Françoise Physiologie
M. MOREAU Pierre Arthur Sciences végétales et fongiques
M. MORGENROTH Thomas Législation
Mme MUSCHERT Susanne Pharmacotechnie industrielle
Mme NIKASINOVIC Lydia Toxicologie
Mme PINÇON Claire Biomathématiques
M. PIVA Frank Biochimie
Mme PLATEL Anne Toxicologie
M. POURCET Benoît Biochimie
M. RAVAUX Pierre Biomathématiques
Mme RAVEZ Séverine Onco et Neurochimie
Mme RIVIERE Céline Pharmacognosie
Mme ROGER Nadine Immunologie
M. ROUMY Vincent Pharmacognosie
Mme SEBTI Yasmine Biochimie
Mme SINGER Elisabeth Bactériologie
Mme STANDAERT Annie Parasitologie
M. TAGZIRT Madjid Hématologie
M. VILLEMAGNE Baptiste Lab. de Médicaments et Molécules
M. WELTI Stéphane Sciences végétales et fongiques
M. YOUS Saïd Onco et Neurochimie
M. ZITOUNI Djamel Biomathématiques
Professeurs Certifiés
Civ. NOM Prénom Laboratoire
M. HUGES Dominique Anglais
Mlle FAUQUANT Soline Anglais
M. OSTYN Gaël Anglais
Professeur Associé - mi-temps
Civ. NOM Prénom Laboratoire
M. DAO PHAN Hai Pascal Lab. Médicaments et Molécules
Maîtres de Conférences ASSOCIES - mi-temps
Civ. NOM Prénom Laboratoire
M. BRICOTEAU Didier Biomathématiques
Mme CUCCHI Malgorzata Biomathématiques
M. FRIMAT Bruno Pharmacie Clinique
M. GILLOT François Droit et Economie pharmaceutique
M. MASCAUT Daniel Pharmacie Clinique
M. ZANETTI Sébastien Biomathématiques
M. BRICOTEAU Didier Biomathématiques
AHU
Civ. NOM Prénom Laboratoire
Mme DEMARET Julie Immunologie
Mme HENRY Héloïse Biopharmacie
Faculté de Pharmacie de Lille
3, rue du Professeur Laguesse - B.P. 83 - 59006 LILLE CEDEX Tel. : 03.20.96.40.40 - Télécopie : 03.20.96.43.64
http://pharmacie.univ-lille2.fr
L’Université n’entend donner aucune approbation aux opinions
émises dans les thèses ; celles-ci sont propres à leurs auteurs.
REMERCIEMENTS :
A ma présidente de jury :
Madame le Docteur Anne GOFFARD
Maître de conférence des universités – Praticien hospitalier Faculté de pharmacie de Lille – CHRU de Lille
Je vous remercie de me faire l’honneur de présider le jury de ma thèse. Je vous remercie également pour votre engagement et votre implication dans l’enseignement au sein de la faculté de pharmacie. Je vous témoigne ici ma plus grande reconnaissance et mon plus profond respect.
A ma directrice de thèse :
Madame le Docteur Frédérique CANIS
Praticien hospitalier
Laboratoire de microbiologie – CH de Valenciennes
Je vous remercie de m’avoir fait l’honneur d’encadrer ce travail et de la confiance que vous m’avez accordé. Un grand merci aussi pour tout ce que vous m’avez appris durant mon stage d’interne, votre professionnalisme et votre rigueur m’ont beaucoup apporté. Je vous témoigne ici mon plus profond respect.
A mes juges :
Madame le Professeur Karine FAURE
Professeur des universités – Praticien hospitalier
Faculté de médecine de Lille – Chef de service des maladies infectieuses – CHRU de Lille
Je tiens à vous remercier d’avoir accepté de juger ce travail et de l’intérêt que vous avez porté à cette thèse. Veuillez trouver ici le témoignage de ma reconnaissance et de mon plus profond respect.
Madame le Docteur Elena AUBRY-DEGARDIN
Praticien hospitalier
Service de pédiatrie – CH de Valenciennes
Je vous remercie d’avoir accepté de juger ce travail, je vous suis reconnaissant de votre implication dans cette étude. Je vous témoigne ici mon plus grand respect.
Je remercie également,
La société GenMark de nous avoir confié cette étude et des kits réactifs offerts pour la réalisation de ce travail.
L’ensemble des biologistes rencontrés durant mes stages d’internes et plus particulièrement les biologistes du CH de Valenciennes et du CH de Tourcoing où j’ai appris énormément. Docteur Mouna Lazrek pour la relecture de la partie virologie de ce travail.
L’ensemble des techniciens du CH de Valenciennes notamment l’équipe de biologie moléculaire, Axelle et Claudine qui m’ont énormément aidé dans ce travail.
L’ensemble des techniciens du CH de Tourcoing pour m’avoir tant appris en paillasse de bactériologie.
Madame Frédérique Vernhes, statisticienne missionnée par la société GenMark pour la réalisation du coté statistique de cette étude et surtout pour sa grande disponibilité.
Mes co-internes, en particulier Adé et Lulu qui m’ont soutenu durant la rédaction de ce travail.
A ma mère pour m’avoir permis de suivre ces études et de m’avoir soutenu et épaulé durant toute cette longue épopée.
A mes frères et sœurs, notamment Nadia et Kader qui m’ont supporté dans les bons moments comme dans les mauvais.
A mes amis, Pierre Nach, Mélodie, Julie et Matthieu d’avoir été présents durant toutes ces années de fac. Pierrot pour m’avoir supporté en colocation et m’avoir soutenu durant la préparation au concours d’internat. Hamid pour les relectures sans fin, merci beaucoup de m’avoir consacré du temps.
Liste des abréviations
OMS : Organisation mondiale de la santé IRA : infection respiratoire aigue
MERS-CoV : coronavirus du syndrome respiratoire du Moyen-Orient VRS : virus respiratoire syncytial
PCR : polymerase chain reaction (amplification en chaine par polymérase) mPCR : PCR multiplex
RP ePlex® : Panel Respiratoire ePlex® CHV : Centre Hospitalier de Valenciennes ORL : Oto-rhino-laryngologiste
CNR : Centre National de Référence ADN : acide désoxyribonucléique ARN : acide ribonucléique
SRAS : syndrome respiratoire aigu sévère VIH : virus de l’immunodéficience humaine
BPCO : bronchopneumopathie chronique obstructive RT-PCR : reverse transcriptase PCR
Ct : seuil de cycle
SIL : Système de gestion de l’Information du Laboratoire HRV : Human Rhinovirus
IC : Immunochromatographie
ELISA : Enzyme-Liked Immuno Assay LBM : Laboratoire de Biologie médicale DMS : Durée Moyenne de Séjour
Table des matières
Table des illustrations ... 17 INTRODUCTION ... 21 GENERALITES ... 25 I. Les infections respiratoires aiguës chez l’enfant ... 27 A. Définition ... 27 B. Epidémiologie ... 27 C. Etiologies des Infections respiratoires aigue de l’enfant ... 29 1. Virus ... 29 2. Bactéries ... 45 II. Approche syndromique ... 52 A. Définition ... 52 B. Automates disponibles ... 52 1. PCR simplex ... 52 2. Trousses syndromiques ... 53 3. PCR multiplex syndromique ... 55 MATERIELS ET METHODES ... 59 I. Méthodes diagnostiques de laboratoire de biologie ... 61 A. Méthode de biologie moléculaire multiplex ePlex® ... 61 B. Méthodes conventionnelles au laboratoire du CH de Valenciennes (CHV) ... 64 1. Virus de la grippe ... 64 2. Virus Respiratoire Syncythial ... 65 3. Adénovirus ... 65 4. Coqueluche ... 66 C. Evaluation des performances du panel RP sur l’automate ePlex® ... 66 1. Principe de l’étude ... 66 2. Choix et conservation des échantillons ... 67 II. Evaluation clinique de l’utilisation de l’approche syndromique (multiplex) ... 68 A. Description de l’étude et choix des échantillons ... 68 1. Principe de l’étude ... 68 2. Objectifs de l’étude ... 68 3. Méthode ... 69 Critères d’inclusion ... 694. Choix et conservation des échantillons ... 70 5. Recueil des données ... 70 6. Analyses statistiques ... 71 RESULTATS ... 73 I. Evaluation des performances de l’automate ePlex® ... 75 A. Analyse comparative des techniques ... 75 1. Grippe ... 75 2. VRS ... 76 3. Adénovirus ... 76 4. Bordetella pertussis et parapertussis ... 77 B. Taux de positivité des microorganismes ... 78 C. Les co-infections ... 79 II. Evaluation clinique de l’utilisation de la méthode ePlex® ... 81 A. Caractéristiques démographiques ... 81 1. Répartition des patients en fonction de l’âge ... 82 2. Répartition en fonction de la symptomatologie clinique ... 83 3. Parcours des patients ... 83 B. Délais de rendu de résultats ... 84 C. Durée moyenne de séjour hospitalier ... 85 D. Durée de traitement anti-microbien ... 86 E. Epidémiologie microbienne des enfants de moins de 15 ans pendant la période épidémique étudiée ... 88 1. Micro-organismes détectés ... 88 2. Co-infections ... 89 DISCUSSION ... 93 CONCLUSION ... 105 ANNEXES ... 109 BIBLIOGRAPHIE ... 113
Table des illustrations
Figure 1 Schéma de l'appareil respiratoire. ... 27 Figure 2 Taux d'incidence des symptômes grippaux et pourcentage de cas de grippe durant la saison hivernale 2017/2018. ... 28 Figure 3 Taux d’incidence de consultations en fonction de l’âge durant la saison hivernale 2017/2018. ... 29 Figure 4 Taux de détection des adénovirus en France pendant la saison hivernale 2017/2018 – Réseau RENAL ... 30 Figure 5 Distribution hebdomadaire des cas suspects d’infection à MERS-CoV, en France, Octobre 2012 – Décembre 2015.) ... 32 Figure 6 Taux de détection des métapneumovirus en France pendant la saison hivernale 2017/2018 – Réseau RENAL ... 34 Figure 7 Taux de détection des métapneumovirus en France pendant la saison hivernale 2017/2018 – Réseau RENAL ... 36 Figure 8 Nombres et pourcentages des prélèvements positifs pour le virus de la grippe et le VRS durant la saison hivernale 2017/2018. ... 38 Figure 9 Evolution hebdomadaire de la part de la grippe causant des hospitalisations après un passage aux urgences, par groupe d'âge en France pendant la saison hivernale 2017/2018 - Réseau OSCOUR. ... 39 Figure 10 Taux de détections des virus parainfluenza (PIV) en France pendant la saison hivernale 2017/2018 – Réseau RENAL ... 41 Figure 11 Proportion de passages pour bronchiolite parmi les passages aux urgences en France chez les enfants de moins de 2 ans. ... 43 Figure 12 Taux de détections des VRS en France pendant la saison hivernale 2017/2018 – Réseau RENAL. ... 44 Figure 13 Nombres de cas confirmés de coqueluche déclarés par les bactériologistes de 1996 à 2015. ... 46 Figure 14 Nombre d'isolats de B. pertussis et B. parapertussis reçus ou isolés au CNR depuis 1995. ... 46 Figure 15 Evolution du nombre de cas et du taux d’incidence pour 100 000 des cas notifiés de légionellose, France, 1988 – 2018. ... 49
Figure 16 Nombre de cas mensuel notifiés de légionellose en France selon la date
de début des signes, 2010-2018. ... 49
Figure 17 Répartition des méthodes de diagnostic des cas de légionellose notifiés en France de 1997 à 2018. ... 51
Figure 18 Automate GeneXpert® de Cepheid. ... 53
Figure 19 Automate Allplex® de Seegene. ... 54
Figure 20 Automate ePlex® de Genmark ... 56
Figure 21 Automate Fimarray® de Biofire. ... 56
Figure 22 Automate Verigene® de Luninexcorp. ... 57
Figure 23 Principe du fonctionnement de la technologie eSensor® ... 62
Figure 24 Schéma détaillant le principe de l'étude de comparaison des méthodes conventionnelles et multiplex. ... 67
Figure 25 Schéma détaillant le principe de l'étude de l’impact clinique de la technique ePlex®. ... 69
Figure 26 Histogramme comparatif des pathogènes détectés par chaque technique (ePlex® panel RP vs techniques conventionnelles). ... 79
Figure 27 Histogramme montrant les fréquences de détection seul ou en co-infection de chaque pathogène par le panel RP ePlex®. ... 80
Figure 28 Schéma du principe de l'évaluation clinique du test multiplex ePlexÒ. ... 81
Figure 29 Représentation de la distribution des âges en fonction du groupe d'inclusion. ... 82
Figure 30 Représentation de la distribution des délais de rendu de l’ensemble des tests en fonction du groupe d’inclusion. ... 84
Figure 31 Représentation de la distribution des délais de rendu de chaque test en fonction du groupe d’inclusion. ... 85
Figure 32 Histogramme montrant les fréquences de détection seul ou en co-infection de chaque pathogène par le panel RP ePlex®. ... 91
Tableau 1 Distribution des cas de syndromes grippaux selon le sexe. ... 28
Tableau 2 Distribution des cas de syndromes grippaux selon l'âge. ... 28
Tableau 3 Répartition des métapneumovirus en fonction de l’âge. France entière Réseau Sentinelles saison hivernale 2017-2018. ... 34
Tableau 4 Distribution des cas de grippe selon l'âge durant la saison hivernale 2017/2018. ... 38
Tableau 5 Données de surveillance chez les enfants de moins de 2 ans à partir des données SOS médecins, OSCOUR®, réseau national de laboratoires hospitaliers et Sentinelles, du 16/10/2017 au 01/04/ 2018. ... 43 Tableau 6 Description et limites de détection des agents pathogènes du panel RP ePlex®. ... 63 Tableau 7 Sensibilités et spécificités des kits Xpert® GenFlu de Cepheid. ... 64 Tableau 8 Sensibilité et spécificité des tests immunochromatographiques BinaxNowÒ de Alere/Abbott ... 65 Tableau 9 Synthèse des taux de positivité des pathogènes par les deux groupes TLU/ePlexÒ ... 78 Tableau 10 Durées de séjour aux urgences pédiatriques du CHV. ... 86 Tableau 11 Durées de séjour dans les services d'hospitalisation du CHV. ... 86 Tableau 12 Durée de traitements anti-infectieux tous services confondus pour les groupes TLU et ePlex®. ... 87 Tableau 13 Durée de traitements anti-infectieux dans le service de pédiatrie pour les groupes TLU et ePlex®. ... 87 Tableau 14 Synthèse des taux de positivité des pathogènes par les deux groupes TLU/ePlex®. ... 88 Tableau 15 Synthèse des co-infections retrouvées par les deux groupes TLU/ePlex®. ... 89 Tableau 16 Proportions des co-infections et détails du nombre de pathogènes détectés par échantillon avec la technique ePlex®. ... 90
Les infections respiratoires aiguës sont un réel problème de santé publique. Elles sont la cause de morbidités et de mortalités importantes surtout chez certaines populations telles que les personnes âgées et les enfants. Durant la décennie 1980-1990, l’OMS avait réalisé de nombreuses études et établit plusieurs directives concernant les infections respiratoires aigües. Selon les plus récentes estimations de l’OMS, les infections respiratoires aiguës (IRA) sont la deuxième cause de décès dans le monde et représentent 18,1% des décès chez les enfants de moins de 15 ans dans les pays en développement (1). On estime qu'environ 25% des décès avant l’âge de 5 ans sont imputables aux IRA dans ces pays (2). Les différentes épidémies de syndrome respiratoire aigu sévère au cours de ces dernières années, grippe A (H1N1) en avril 2009 et dernièrement l’apparition d’un nouveau coronavirus MERS-CoV en 2012 ont permis de rappeler l’importance et la gravité des infections respiratoires aiguës.
La plupart des IRA sont causées par des virus (grippe, adénovirus, VRS…) mais également des bactéries (Bordetella pertussis, Legionella pneumophila, Chlamydia pneumoniae) les manifestations cliniques varient en fonction de l’agent incriminé et du site infecté, cela peut aller de la simple toux à une détresse respiratoire sévère. Les personnes âgées, enfants et immunodéprimés sont les plus sensibles et présentent des tableaux sévères, c’est pourquoi il est nécessaire d’identifier l’agent infectieux pour administrer le plus rapidement le traitement adéquat.
Différentes techniques existent pour détecter les microorganismes responsables d’IRA, cependant, parmi celles-ci un certain nombre sont peu sensibles et/ou peu spécifiques et consomment du temps technique pour des résultats pas toujours juste. Depuis plusieurs années la biologie moléculaire s’est largement développée avec des tests unitaires pour la détection d’un seul agent infectieux, ce qui a permis de gagner énormément en sensibilité et spécificité. Dernièrement des techniques de PCR multiplex (mPCR) par approche syndromique ont été commercialisées. Cette technique permet à partir d’un syndrome clinique de détecter plusieurs pathogènes à partir d’un seul prélèvement. Récemment des techniques rapides de diagnostic par approche syndromique sont apparues sur le marché et ont montré une réduction considérable du délai de rendu de résultats ainsi qu’une réduction de la durée d’hospitalisation. La mPCR a rendu possible la documentation de nombreuses IRA causées par des pathogènes non détectés par les techniques conventionnelles ou non prescrits par les cliniciens (3). Le laboratoire du CHV a eu
l’opportunité d’acquérir l’automate ePlex® permettant de réaliser rapidement le diagnostic par approche syndromique.
L’objectif de ce travail a été d’évaluer les performances du panel respiratoire RP ePlex® en comparant les résultats à ceux obtenus par les techniques conventionnelles utilisées au laboratoire du CHV. La deuxième partie de ce travail a été d’évaluer l’utilisation de cette technique multiplex par approche syndromique dans la prise en charge des infections respiratoires hautes de l’enfant pendant la période épidémique hivernale 2017/2018.
I.
Les infections respiratoires aiguës chez l’enfant
A. Définition
Les infections respiratoires aiguës sont causées par des agents soit viraux soit bactériens. Il en existe deux types en fonction de la localisation de l’atteinte :
- Infections respiratoires hautes, qui touchent la sphère ORL (sinus, larynx, pharynx, nez et l’oreille moyenne) provoquant des otites, rhinites, pharyngites et laryngites (4).
- Infections respiratoires basses, qui touchent les bronches et alvéoles provoquant des bronchites, bronchiolites et pneumonies. Elle est cliniquement définie par l’association ou la succession d’une toux avec expectoration, d’au moins un signe fonctionnel ou physique orientant vers une atteinte respiratoire et enfin d’au moins un signe général suggérant une infection (fièvre, sueur).
Figure 1 Schéma de l'appareil respiratoire.
B. Epidémiologie
La surveillance des syndromes grippaux par le réseau Sentinelle pour la saison 2017/2018, a eu lieu du 2 octobre 2017 au 29 avril 2018. En métropole, à peu près 2,2 millions de personnes ont consulté un médecin généraliste pour un syndrome grippal, l’incidence était de 3 381 cas / 100 000 habitants.
Figure 2 Taux d'incidence des symptômes grippaux et pourcentage de cas de grippe durant la saison hivernale 2017/2018.
L’épidémie était relativement précoce et de durée importante : elle a commencé le 20/11/2017 (semaine 45) pour finir vers le 16/04/2018 (semaine 16). Le pic d’activité a été franchi après 3 semaines d’épidémie soit en semaine 52 (du 25 au 31 décembre 2017) avec un taux d’incidence de 459 cas / 100 000 habitants (figure 2)
Durant cette période, 2759 échantillons ont été prélevés dans le cadre de la surveillance virologique des syndromes grippaux (tableaux 1 et 2).
Tableau 1 Distribution des cas de syndromes grippaux selon le sexe.
Figure 3 Taux d’incidence de consultations en fonction de l’âge durant la saison hivernale 2017/2018.
Les taux d’incidence de consultation chez le médecin généraliste pour syndromes grippaux ont été très élevés pour les enfants de moins de 4 ans et ceux entre 5 et 14 ans. Les taux les plus faibles étaient représentés par les patients de plus de 65 ans (figure 3). Ces chiffres sont assez représentatifs et fidèles des épidémies antérieures.
C. Etiologies des Infections respiratoires aigue de l’enfant
1. Virus
Adénovirus
Structure
Les adénovirus sont des virus à ADN double brin, non enveloppés et à capside icosaédrique incluant sept espèces humaines (A - G) et plus de 60 sérotypes (5). Les espèces d'adénovirus B, C, et E sont souvent associées à des infections des voies respiratoires supérieures. Ces infections sont courantes chez les enfants.
Epidémiologie
Durant la saison hivernale 2017-2018, les adénovirus ont été détectés de manière continue, le pourcentage de prélèvements positifs était faible (inférieur à 5%) (Figure 4).
Figure 4 Taux de détection des adénovirus en France pendant la saison hivernale 2017/2018 – Réseau RENAL
Clinique
Des épidémies d’adénovirus surviennent souvent dans les environnements très peuplés (6). Bien qu'il n'existe aucun vaccin disponible pour le grand public, l'introduction d'un vaccin vivant oral au sein de l'armée américaine en 2011 a permis de réduire l'incidence des épidémies d'adénovirus dans cette population. Les infections liées à l’adénovirus provoquent généralement des maladies de faible gravité mais peuvent aussi entraîner de graves pathologies chez les nourrissons ou les personnes immunodéprimées, en particulier chez les personnes ayant reçues des greffes de cellules souches hématopoïétiques (5) (6).En dehors des infections respiratoires, les adénovirus peuvent causer des gastro-entérites, des conjonctivites et des cystites (6).
Diagnostic
Différentes techniques peuvent être utilisées pour détecter l’adénovirus dans les prélèvements respiratoires, comme l’immunofluorescence indirecte, cependant cette méthode manque de sensibilité et le laboratoire doit être équipé d’un microscope à fluorescence. La recherche par PCR permet d’augmenter la sensibilité de l’examen, de réduire le temps d’analyse et le coût technicien enfin elle permet d’améliorer le délai de rendu du résultat. D’autres techniques sont utilisées pour la détection dans les selles pour la recherche d’adénovirus dans le cadre de diarrhée infectieuses.
Coronavirus
Structure
Ce sont des virus à ARN monocaténaire, enveloppés à capside hélicoïdale. Il existe 6 coronavirus en pathologie humaine : 229E et NL63 (coronavirus alpha), OC43, HKU1, SRAS (coronavirus responsable du syndrome respiratoire aigu sévère) et MERS-CoV (coronavirus beta) (7).
Epidémiologie
Entre octobre 2012 et décembre 2015, 1410 cas ont été signalés, durant cette période 4 pics d’activité ont été notifiés en France. Le premier pic coïncide avec les 2 cas confirmés d’infections à MERS-CoV (mai – juin 2013). Les trois autres pics correspondent à la période du grand pèlerinage à la Mecque. Mis à part ces pics, les cas signalés variaient entre 1 et 55 cas par mois (8) (figure 5).
Figure 5 Distribution hebdomadaire des cas suspects d’infection à MERS-CoV, en France, Octobre 2012 – Décembre 2015.)
Clinique
Les coronavirus humains sont généralement responsables d’infections des voies respiratoires supérieures bégnines ou modérées mais peuvent aussi entraîner de graves pathologies chez les personnes âgées, les jeunes enfants et les personnes immunodéprimées (7) (9). Les infections dues aux coronavirus 229E, HKU1, NL63 et OC43 sont assez courantes et ubiquitaires, tandis que celles dues au SRAS et MERS-CoV restent rares. La première apparition du coronavirus MERS-CoV a été rapportée en Arabie saoudite en 2012; ce virus est responsable d’infections respiratoires sévères chez des personnes se trouvant dans de mauvaises conditions sanitaires. Le taux de mortalité lié aux infections à coronavirus est de 40 % (7) (10).
Diagnostic
Bocavirus humain
Structure
Le bocavirus est un petit virus nu à ADN simple brin appartenant à la famille des Parvoviridae, genre bocavirus.
Clinique
Son rôle, en tant que pathogène responsable d'infections respiratoires, fait l'objet de controverses. La première description du bocavirus humain, dans des échantillons respiratoires en Suède, remonte à 2005. On estime qu'il joue un rôle dans les infections respiratoires, mais étant donné qu'on le retrouve aussi bien chez des individus symptomatiques qu'asymptomatiques, la question de son rôle en tant qu'agent pathogène est toujours d’actualité (11) (12). Des études ont montré des taux de prévalence élevés dans des échantillons respiratoires prélevés sur des enfants; toutefois, le bocavirus est souvent détecté avec d'autres virus (co-infections) et on peut le retrouver de façon prolongée ou persistante, même chez des individus asymptomatiques, ce qui rend difficile la distinction entre un portage ou une colonisation et une réelle infection (11) (13). Bien que la plupart des cas soient bénins, d’authentiques infections respiratoires ont également été rapportées (13).
Diagnostic
Seule la PCR permet d’affirmer la présence du bocavirus dans les prélèvements respiratoires. C’est un virus très peu recherché en laboratoire de routine.
Métapneumovirus
Structure
Le métapneumovirus est un virus à ARN faisant partie de la famille de virus Paramyxoviridae et est étroitement lié au Virus Respiratoire Syncytial (VRS) (14).
Epidémiologie
Durant la saison hivernale 2017-2018, le métapneumovirus était présent de façon progressive avec un faible taux de détections positives (inférieur à 5 %) (15) (figure 6).
Figure 6 Taux de détection des métapneumovirus en France pendant la saison hivernale 2017/2018 – Réseau RENAL
En métropole, 4,2% des détections positives étaient dues au métapneumovirus. D’après les données du réseau Sentinelles, chez les patients consultant pour syndromes grippaux, 4,1% des cas présentaient du métapneumovirus dans leurs prélèvements, et principalement chez les moins de 5 ans et les personnes entre 15 et 64 ans (figure 7). Sur 333 patients de plus de 65 ans atteints d’IRA, 19 métapneumovirus étaient détectés soit 5,7%.
Nombre de prélèvements positifs à métapneumovirus Pourcentage 0 – 4 ans 51 50 5 – 14 ans 12 11,7 15 – 64 ans 33 32,4 > 65 ans 6 5,9 Total 102 100
Tableau 3 Répartition des métapneumovirus en fonction de l’âge. France entière Réseau Sentinelles saison hivernale 2017-2018.
Clinique
Le métapneumovirus a été identifié comme un pathogène respiratoire important chez les jeunes enfants et comme étant le deuxième virus le plus couramment identifié dans les infections pédiatriques de l'appareil respiratoire (14). L’infection est plus sévère chez les enfants immunodéprimés ou présentant des facteurs de comorbidité, tels que l’infection au VIH ou des pathologies cardiaque; elle peut également causer de graves signes respiratoires chez les adultes immunodéprimés, en particulier ceux souffrant de BPCO, d'asthme, d'un cancer, ou chez les patients ayant subi une greffe (16).
Diagnostic
La recherche se fait uniquement par RT-PCR. Ce virus est très peu recherché par les cliniciens.
Rhinovirus et entérovirus
Structure
Les rhinovirus et entérovirus sont des virus à ARN étroitement liés, de la famille des Picornaviridae (17) (18). Il existe plus de 100 sérotypes différents, partageant tous une importante homologie séquentielle (19).
Epidémiologie
La détection des rhinovirus (HRV) a été continue tout au long de la saison 2017/2018, leur circulation a diminué lors de l'épidémie de VRS pour se maintenir à un taux faible tout au long de l'épidémie de grippe. Enfin une nouvelle augmentation est à noter, pour atteindre des taux élevés (avec un taux de détections positives de plus de 20%) les semaines suivantes (15) (figure 7).
Figure 7 Taux de détection des métapneumovirus en France pendant la saison hivernale 2017/2018 – Réseau RENAL
Clinique
Les rhinovirus peuvent être responsables de 80 % des cas de rhumes et touchent davantage les enfants que les adultes. Tout au long de l’année, ils sont responsables d'un grand nombre d'infections des voies respiratoires supérieures de faible gravité, en particulier au printemps et à l'automne (20) (21).Bien que la plupart des infections soient bénignes, le rhinovirus est également associé à des infections graves au sein des populations à risque telles que les jeunes enfants, les personnes âgées, les patients immunodéprimés et ceux souffrant d'asthme (17) (20).
Les entérovirus infectent en premier lieu l'appareil gastro-intestinal mais peuvent également provoquer des maladies respiratoires, généralement bénignes, comme le rhume mais ils peuvent également engendrer des complications plus graves, notamment chez les nourrissons (18).En 2014, une épidémie d'entérovirus D68 (EV-D68) a causé de graves infections respiratoires dont certaines se sont avérées mortelles (22).
Diagnostic
Seule la PCR permet d’affirmer la présence d’entérovirus ou de rhinovirus dans les prélèvements respiratoires. Ce virus est très peu recherché en laboratoire de routine.
Virus de la grippe
Structure
Ce sont des virus enveloppés à ARN monocaténaire composés de 8 segments et de capside hélicoïdale. Ils font partis de la famille des orthomyxoviridae genre influenza virus (23). Il existe 3 types de virus de la grippe: A, B et C (24). Il existe une certaine variabilité antigénique pour le virus de la grippe A : les dérives ou glissements antigéniques vont être responsables d’épidémies saisonnières d’intensité variable (d’où la nécessité d’un vaccin annuel) alors que les cassures ou sauts antigéniques vont être responsables des pandémies (25).
Epidémiologie
Dans l'hémisphère nord, les virus de la grippe A et B circulent durant les mois d'hiver, provoquant presque chaque année des épidémies saisonnières. Les infections dues à la grippe C sont moins courantes et ne causent en principe pas d'épidémies (24) (26).Les virus de la grippe A et B mutent, et l'impact de la grippe varie d'année en année, selon l'importance d'éventuels changements et l'efficacité des vaccins dédiés (27). Les 2 sous-types de grippe A infectant le plus souvent l'homme sont le H1N1 (et sa variante pandémique, le 2009 H1N1) et H3N2, dont la prévalence varie chaque année (26). D'autres sous-types de grippe A, plus rares, peuvent aussi infecter l'homme, notamment le H5N1 (grippe aviaire), qui peut causer des infections sévères voire mortelles dans certains cas (28).
En métropole, la surveillance épidémiologique et virologique de la grippe pour la saison 2017/2018 a débuté en semaine 40/2017 (2-8 octobre 2017) et s’est terminée en semaine 16/2018 (16-22 avril 2018). L’épidémie de grippe a débuté en Île-de-France en semaine 49/2017 (4-10 décembre 2017) et s’est étendue en quatre semaines à l’ensemble de la métropole. Elle s’est terminée en semaine 12/2018 (19-25 mars 2018). Cette épidémie a été précoce et d’une durée exceptionnellement longue (29).
Au total, 2759 prélèvements ont permis la surveillance virologique durant la période épidémique. Parmi ces échantillons, 1592 (57,7%) étaient positifs pour au moins un virus grippal.
Tableau 4 Distribution des cas de grippe selon l'âge durant la saison hivernale 2017/2018.
Figure 8 Nombres et pourcentages des prélèvements positifs pour le virus de la grippe et le VRS durant la saison hivernale 2017/2018.
On constate que l’épidémie de VRS a précédé de quelques semaines celles des virus grippaux. Contrairement à ce qui est habituellement observé, il n’y a pas eu de dissociation dans la circulation des virus grippaux et des VRS, ils ont diffusé durant la même période. Cependant il est à noter que le nombre de virus grippaux détecté était bien plus important que le nombre de VRS (figure 9).
Figure 9 Evolution hebdomadaire de la part de la grippe causant des hospitalisations après un passage aux urgences, par groupe d'âge en France pendant la saison hivernale 2017/2018 - Réseau OSCOUR.
Pendant l’épidémie, le réseau OSCOUR® a rapporté 75 500 passages pour grippe aux urgences. Parmi ces passages aux urgences, la part de la grippe a atteint son pic en semaine 52 (25 – 31 décembre 2017) avec 37/1 000 passages. Dans ces passages, 32% concernaient les moins de 5 ans, 26% les 144 ans et 15% les 5-14 ans. Il y a eu 9 729 cas (13%) qui ont conduit à une hospitalisation dont la majorité (53%) était âgée d’au moins 65 ans (29) (figure 10).
Parmi l’ensemble des hospitalisations suivant un passage aux urgences, celles dont le motif était une suspicion de grippe représentent une part de 15,4/1 000 hospitalisations post-urgences tous âges confondus. Cette proportion a dépassé 20/1 000 (20,8/1 000) hospitalisations post-urgence au cours des semaines 52/2017 (25 au 31 décembre 2017) et 01/2018, avec un pic en semaine 01 (1er janvier au 07 janvier 2018) (29).
La part de la grippe parmi les hospitalisations post-urgences a été la plus importante chez les enfants de moins de 5 ans (25/1 000 hospitalisations) et les personnes d’au moins 65 ans (10,7/1 000) (29).
Clinique
La grippe se transmet de façon directe et interhumaine par voie aérienne, ce qui explique une grande contagiosité. L'incubation (délai entre l’infection et l’apparition des symptômes) de la grippe est de 1 à 4 jours (30).
Les personnes les plus susceptibles de subir des complications dues à l'infection par le virus de la grippe sont les nourrissons et les enfants, les personnes âgées et toute personne immunodéprimée ou présentant des co-morbidités telles que des maladies cardiaques ou pulmonaires (31). Le tableau clinique est souvent marqué par un début brutal dans la majorité des cas une fièvre à 40°C associée à des frissons, à un syndrome polyalgique (myalgie) et une atteinte des voies respiratoires : rhinorrhée, toux sèche. Des symptômes gastro-intestinaux, nausées, vomissements et diarrhées, sont également fréquents (32).
Cas particulier de la grippe A 2009 H1N1
Lors de la période de la grippe de 2009 - 2010, une nouvelle souche de la grippe A, aujourd'hui connue comme 2009-H1N1, est devenu le principal virus circulant et a été responsable d'environ 95 % des infections de grippe rapportées (33).Cette souche a remplacé le virus H1N1, qui circulait auparavant chez l’homme et est courant aussi bien en Europe qu'aux États-Unis.
Diagnostic
Le diagnostic est essentiellement clinique mais dans certains cas, les cliniciens ont recours à la biologie. Des tests immunochromatographiques (IC) sont possibles. Mais le test de référence reste la biologie moléculaire pour la recherche d’ARN viral par RT-PCR. La recherche d’antigène viral par immunofluorescence indirecte est possible, mais elle est moins sensible, longue et fastidieuse. La culture virale a été abandonnée en routine. La sérologie n’a aucun intérêt dans le cadre du diagnostic des infections aigues mais dans de très rares cas, elle permet de faire un diagnostic rétrospectif.
Virus parainfluenza
Structure
Les virus parainfluenza humains (PIV) ont été découverts pour la première fois à la fin des années 1950. Ces virus sont enveloppés et de taille moyenne (150 à 250 nm) et leur génome est à ARN de polarité négative (34). Ces virus appartiennent à la famille des Paramyxoviridae, l’un des groupes de virus les plus importants et dont la croissance est la plus rapide, ce qui cause des infections humaines et animales importantes (34). Ils sont divisés génétiquement et antigéniquement en 4 types différents.
Epidémiologie
Les virus parainfluenza ont été détectés à un niveau faible tout au long de la saison 2017/2018, le taux retrouvé en début et en fin de surveillance épidémique était supérieur à 8% (15).
Figure 10 Taux de détections des virus parainfluenza (PIV) en France pendant la saison hivernale 2017/2018 – Réseau RENAL
Clinique
Les virus parainfluenza sont associés à de nombreuses pathologies comprenant l'otite moyenne, la pharyngite, la conjonctivite, trachéobronchite et des laryngites chez les enfants (35). La prévalence des virus parainfluenza est saisonnière et varie en fonction du type. Bien que la plupart des infections soient bénignes et spontanément résolutives, le virus parainfluenza peut provoquer des pneumonies potentiellement mortelles chez les personnes immunodéprimées, notamment celles souffrant de fibrose kystique ou bien les patients greffés (36).
Diagnostic
Généralement non ciblés par les cliniciens, ces virus s’inscrivent dans le cadre de l’approche syndromique, la recherche du génome viral se fait par RT-PCR. L’immunofluorescence est également possible mais moins sensible. Enfin la culture n’est plus réalisée en laboratoire de routine.
Virus respiratoire syncytial (VRS)
Structure
Ce sont des virus enveloppés à ARN comprenant 10 gènes et de capside hélicoïdale de la famille des Paramyxoviridae genre pneumovirus (37). Certaines protéines (F et G) du VRS induisent une réaction immunitaire via la synthèse d’anticorps neutralisants.
Epidémiologie
En France métropolitaine, parmi les enfants admis aux urgences, 11% (N = 56 520) concernaient une bronchiolite et 27% (N = 21 578) des hospitalisations post-urgences d’enfants de moins de 2 ans étaient en lien avec la bronchiolite. Les associations SOS Médecins ont rapporté que 7% des consultations d’enfants de moins de 2 ans avaient pour motif une bronchiolite. En milieux hospitalier, 10% des prélèvements réalisés pour la recherche de VRS ont été rendus positifs.
Figure 11 Proportion de passages pour bronchiolite parmi les passages aux urgences en France chez les enfants de moins de 2 ans.
Tableau 5 Données de surveillance chez les enfants de moins de 2 ans à partir des données SOS médecins, OSCOUR®, réseau national de laboratoires hospitaliers et Sentinelles, du 16/10/2017 au 01/04/ 2018.
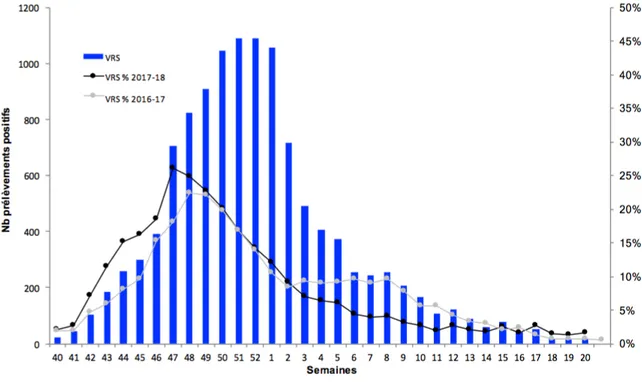
Figure 12 Taux de détections des VRS en France pendant la saison hivernale 2017/2018 – Réseau RENAL.
Les circulations du VRS et des virus grippaux n’étaient pas dissociées durant la période épidémique. Le VRS a circulé du mois d’octobre 2017 à mars 2018, on note que l’épidémie a été un peu plus intense dans les hôpitaux contrairement à la saison 2016/2017.
Clinique
Isolé en 1957 chez un enfant atteint de pneumonie, c’est l’agent étiologique le plus fréquemment retrouvé dans les bronchiolites chez les nourrissons et les jeunes enfants hospitalisés. Le VRS est la cause la plus courante d'infections respiratoires virales pédiatriques. Une infection par le VRS peut survenir à tout âge, en partie à cause du manque d'immunité à long terme après une infection, ce qui rend la réinfection fréquente. Il infecte 90% des enfants au cours des deux premières années de la vie et réinfecte fréquemment les enfants plus âgés et les adultes (37). Les personnes les plus exposées aux risques de complications et à des pathologies graves sont les très jeunes enfants, notamment les prématurés, les personnes âgées, et les immunodéprimés. Il existe deux souches de virus respiratoire syncytial : VRS A et B. Les infections dues au VRS A sont considérées comme plus sévères que celles liées au VRS B (38)(39).
Diagnostic
Les cliniciens utilisent principalement la clinique pour le diagnostic mais ils s’appuient de plus en plus sur la biologie pour conforter leur suspicion. Des techniques immunochromatographiques (IC) sont disponibles avec de bonnes sensibilité et spécificité, il est également possible de réaliser de l’immunofluorescence directe ou indirecte. Enfin la technique la plus sensible reste la biologie moléculaire par RT-PCR.
2. Bactéries
Bordetella pertussis et parapertussis
Morphologie
Bordetella pertussis est un coccobacille à Gram négatif encapsulé asporulé. Elle est aérobie stricte et immobile (40). Elle produit un certain nombre de facteurs de virulence incluant des toxines, adhésines et intégrines. La toxine de la coqueluche est un des facteurs de virulence majeurs, elle est sécrétée et provoque les symptômes de la coqueluche.
Epidémiologie
Les bordetelles sont séparées en plusieurs espèces, celles infectant l’homme sont au nombre de quatre : B. pertussis, B. parapertussis, qui sont les agents de la coqueluche, B. holmesii qui est responsable de bactériémies chez les immunodéprimés et B. bronchiseptica occasionnant des bactériémies ou des infections respiratoires(41).
Des estimations de l’OMS indique qu’en 2014, 24 millions de cas de coqueluche avait été recensés dans le monde chez les enfants de moins de 5 ans parmi ceux-ci, il y a eu 160 700 décès (42).
Figure 13 Nombres de cas confirmés de coqueluche déclarés par les bactériologistes de 1996 à 2015.
La figure 14 suivant décrit l’évolution des infections à Bordetella pertussis et parapertussis.
Figure 14 Nombre d'isolats de B. pertussis et B. parapertussis reçus ou isolés au CNR depuis 1995.
D’après le dernier rapport d’activités du CNR, les infections à Bordetella pertussis et parapertussis évoluent selon des cycles durant de 3 à 5 ans. On constate que le nombre d’infections à B. parapertussis reste faible en comparaison avec celle de B. pertussis (41).
Selon les données de santé publique, entre 31 et 51% des cas de coqueluche se déclare chez les nourrissons de moins de 3 mois. Les décès représentent 1 à 3% des cas, enfin dans 9 cas sur 10 une hospitalisation est nécessaire (43).
Clinique
La coqueluche, est une maladie respiratoire aiguë hautement contagieuse. Elle est connue pour provoquer une toux sévère et marquée d’une durée de plus de 7 jours, sans fièvre dans la majorité des cas. Chez le nourrisson elle donne une toux caractéristique, surnommée « chant du coq » lorsque le malade essaie de respirer (44).Chez les adultes, il s'agit généralement d'une infection bénigne, car les adultes ne développent pas cette toux caractéristique. Récemment, les cas de coqueluche ont augmenté, en particulier chez les jeunes enfants et les adolescents; cette recrudescence est vraisemblablement due à divers facteurs tels que l'amélioration des diagnostics et une moins bonne immunité (45). La transmission d’enfant à enfant a diminué, elle était effective durant la période précédant l’apparition du vaccin. Un changement de transmission a été observé, l’adulte joue un rôle important dans la transmission à l’enfant et au nourrisson.
Diagnostic
La sérologie repose sur la recherche des anticorps anti-toxine pertussique (spécifique de B. pertussis) et anti-adénylcyclase hémolysine. Elle a un intérêt rétrospectif car elle n’est positive qu’à partir de la troisième semaine d’infection. La sérologie est ininterprétable en cas de vaccination contre la coqueluche datant de moins de 12 mois (aucune distinction possible entre les anticorps naturels et acquis). La recherche du génome B. pertussis par PCR constitue l’examen de première intention dans les 2 premières semaines de toux.
Chlamydophiia pneumoniae
Morphologie
Il s’agit d’une bactérie intracellulaire obligatoire de la famille de Chlamydiaceae (46).
Clinique
La bactérie Chlamydia pneumoniae est une cause fréquente d'infection des voies respiratoires supérieures dont la pneumonie atypique. La transmission de C. pneumoniae est interhumaine par les sécrétions respiratoires et les épidémies sont fréquentes dans les environnements avec une importante promiscuité (47). La clinique peut aller d'un tableau respiratoire bénin à une pneumopathie grave. La période d’incubation de l’infection à C pneumoniae est d’environ 21 jours, donc plus longue que celle de nombreux autres agents pathogènes respiratoires (46).
La gravité de l'infection est variable et peut être sévère, particulièrement chez les populations à haut risque comme les personnes souffrant de maladies cardiaques et pulmonaires, de diabète et chez les personnes âgées (47). La prévalence des infections à C. pneumoniae est inconnue mais l'utilisation des diagnostics moléculaires a amélioré la détection de ce pathogène car il est difficile à identifier par les méthodes de laboratoire traditionnelles (46).
Diagnostic
Des sérologies anti-Chlamydia pneumoniae sont possibles mais il existe des réactions croisées avec d’autres espèces de chlamydia. La sérologie permet en outre un diagnostic lors d’une primo infection ou une réinfection par les suivis de cinétique des anticorps. La technique la plus sensible et spécifique reste la PCR, cependant elle est valable que durant la phase d’infection.
Legionella pneumophila
Morphologie
Il s’agit d’un bacille à Gram négatif, que l'on trouve à l'état naturel dans l'eau douce, notamment dans les lacs, les cours d'eau et les sources d’eaux chaudes.Elle se développe également facilement dans les sources d'eau chaude artificielles telles que les bains chauds, les tours de refroidissement et les systèmes de plomberie (48).
Epidémiologie
Selon santé publique, près de 1400 cas de légionellose sont déclarés en France chaque année.
Figure 15 Evolution du nombre de cas et du taux d’incidence pour 100 000 des cas notifiés de légionellose, France, 1988 – 2018.
Pour l’année 2018, on a noté une forte augmentation (+31%) du nombre de cas déclarés de légionellose par rapport au nombre de cas retrouvé en 2017. Le taux d’incidence était de 3,2/ 100 000 habitants en métropole, il est également très augmenté par rapport au taux de notification européen (2,2/ 100 000 en 2018) (49).
Figure 16 Nombre de cas mensuel notifiés de légionellose en France selon la date de début des signes, 2010-2018.
Une forte recrudescence a été observée durant le mois de juin 2018 (21% des cas notifiés en 2018) (figure 16), ce qui explique le taux d’incidence élevé en France. Les facteurs météorologiques (les fortes températures, les précipitations et l’humidité) avaient été mis en avant pour expliquer cette hausse anormale du taux d’incidence en France (50).
Clinique
Les infections surviennent par inhalation d'eau sous forme d'aérosols contenant L. pneumophila (51). La transmission d'une personne à une autre est rare. La légionellose, peut entraîner la maladie du légionnaire qui est une forme de pneumonie sévère. Elle est mortelle dans environ 10 % des cas mais peut être traitée par d'antibiotiques (48)(52). Les facteurs de risque de la maladie du légionnaire sont les maladies pulmonaires chroniques, le tabagisme, le diabète et la dépendance à l'alcool ou aux drogues, ainsi que les effets des médicaments affectant le système immunitaire. L. pneumophila est une infection à déclaration obligatoire.
Il existe une forme sporadique de légionellose : la fièvre de Pontiac qui est bénigne. Le traitement antibiotique de cette forme n'apporte aucun bénéfice (48).
Diagnostic
Le diagnostic s’appuie d’une part sur la clinique par l’apparition brutale des symptômes (fièvre, syndrome respiratoire sévère, signes extra respiratoires notamment digestifs), et d’autre part sur la biologie notamment un taux de CRP que l’on retrouve constamment très augmenté. La recherche d’antigénurie de L. pneumophila (sérogroupe 1 uniquement) est la technique la plus utilisée. La culture sur des milieux spécifiques à partir d’expectoration doit être réalisée pour le diagnostic de certitude et permet également un suivi épidémiologique. D’autres techniques sont également possibles comme les sérologies ou la recherche par PCR, ce qui permet de détecter d’autres sérogroupes de Legionella (50) (figure 17).
Figure 17 Répartition des méthodes de diagnostic des cas de légionellose notifiés en France de 1997 à 2018.
Mycoplasma pneumoniae
Morphologie
Mycoplasma pneumoniae est une bactérie sans paroi cellulaire.
Clinique
Elle est une cause majeure de maladies respiratoires, notamment de pneumopathies atypiques. M. pneumoniae se transmet de façon interhumaine par des gouttelettes respiratoires (53). Elle est souvent non diagnostiquée mais on estime qu'elle pourrait être impliquée dans 30 % des infections respiratoires (53).Elle peut entraîner des trachéobronchites ou des pneumopathies, on la retrouve essentiellement chez les jeunes adultes et les enfants scolarisés.Les épidémies de M. pneumoniae surviennent majoritairement dans les collectivités, tels que les écoles, les résidences universitaires et les maisons de soins (54).
Diagnostic
Des sérologies anti-Mycoplasma pneumoniae sont possibles mais il existe des réactions croisées avec d’autres espèces de mycoplasmes. La sérologie permet en outre un diagnostic lors d’une primo infection ou d’une réinfection par les suivis de cinétique des anticorps. La technique la plus sensible et spécifique reste la PCR,
II.
Approche syndromique
A. Définition
Une infection ne se manifeste pas nécessairement par des symptômes spécifiques d’un pathogène. Auparavant, le diagnostic des maladies infectieuses était très compartimenté, bactériologie, virologie, parasitologie et mycologie et étaient traités de façon indépendante avec des technologies différentes. Les progrès en biologie moléculaire ont permis de réunir l’ensemble de ces disciplines en un minimum d’analyses, il en a découlé une nouvelle notion : l’approche syndromique. L’approche syndromique consiste en la recherche simultanée des micro-organismes les plus fréquemment responsables d’une infection qui cause un syndrome. En biologie, on identifie différents syndromes pour lesquelles des panels ont été constitués, permettant de détecter plusieurs micro-organismes simultanément.
Le panel méningé contient des cibles pouvant détecter les micro-organismes les plus fréquemment responsables de méningites virales, bactériennes ou fongiques. Le panel gastro-intestinal permet la détection des agents pathogènes (viraux, bactériens ou parasitaires) qui sont le plus souvent incriminés dans les diarrhées infectieuses. Il existe un panel septique permettant la recherche de bactéries et levures ainsi que les gènes de résistance aux antibiotiques. Enfin le panel respiratoire permet la détection de micro-organismes responsables d’infections respiratoires aiguës hautes et parfois basses. D’autres panels multiplex (infections sexuellement transmissibles, infections respiratoires basses) sont en cours de développement et de commercialisation.
B. Automates disponibles
1. PCR simplex
Les premières PCR ont fait leurs apparitions en laboratoire de routine vers 2004, il s’agissait de PCR classiques qui détectait une seule cible (PCR simplex) et dont les étapes (extraction, amplification et détection) étaient réalisées à l’aide de différents appareils. C’est une technique dite en point final, c’est-à-dire que les
fragments d’ADN étaient détectés en fin de réaction soit par couplage avec une technique ELISA soit par migration sur gel d’agarose après un marquage par un intercalant de l’ADN (bromure d’éthidium) pour visualiser les bandes.
La PCR simplex présente plusieurs avantages, elle permet de cibler les prescriptions des cliniciens lors de symptômes cliniques évocateurs.
Figure 18 Automate GeneXpert® de Cepheid.
En 2007 les PCR spécifiques dite en temps réel ont été commercialisées. Il s’agit toujours d’une technique simplex, cependant contrairement aux techniques de PCR classique, la détection est réalisée durant la PCR, par l’utilisation de sondes fluorescentes (dont Taqman et SYBR green) qui résistent aux différentes températures des étapes de la PCR. Cette méthode permet de suivre la progression de la PCR tout au long de la réaction, il s’agit d’une analyse quantitative.
Ces systèmes sont généralement plus sensibles que les mPCR (PCR multiplex) et permettent d’obtenir un résultat rapide avec un coût moins important que les techniques multiplex.
2. Trousses syndromiques
Ces systèmes font intervenir différents appareils pour les étapes d’extraction, d’amplification et de détection qui sont réalisées séparément à des temps différents. Cela implique une durée totale d’analyse plus longue pour la plupart de ces systèmes, un temps de manipulation également plus important et ils nécessitent généralement un personnel qualifié et formé, dédié à cette activité.
Ce système permet la détection de 26 agents pathogènes respiratoires par l’utilisation de 4 panels.
Panel 1
Grippe A, grippe B, VRS A, VRS B, grippe H1, grippe H1N1 2009, grippe H3.
Panel 2
Adénovirus, entérovirus, parainfluenza 1, 2 3 et 4, métapneumovirus.
Panel 3
Bocavirus, rhinovirus, coronavirus NL63, 229E, OC43.
Panel 4
Mycoplasma pneumoniae, Chlamydia pneumoniae, Legionella pneumophila, Haemophilus influenzae, Streptococcus pneumoniae, Bordetella pertussis, Bordetella parapertussis.
Il est possible d’associer différents panels.
Le principe de cet automate repose sur une PCR en temps réel, qui permet de quantifier plusieurs cibles grâce à la valeur de nombre de cycle (Ct) qui est propre à chaque cible.
Figure 19 Automate Allplex® de Seegene.
RespiFinder
Cet automate permet la détection de 21 pathogènes, grâce à un ensemble de sondes marquées par un fluorochrome. Une fois la PCR terminée, l’analyse des
courbes de fusion permet la différenciation des acides nucléiques des pathogènes ciblés.
Les virus :
Adénovirus, bocavirus, coronavirus 229E, coronavirus HKU1, coronavirus NL63, coronavirus OC43, métapneumovirus, grippe A, grippe A H1N1, grippe B, parainfluenza 1,2,3 et 4, rhinovirus/entérovirus, VRS A, VRS B.
Les Bactéries :
Bordetella pertussis, Legionella pneumophila, Mycoplasma pneumoniae.
3. PCR multiplex syndromique
Dernièrement, des techniques multiplex syndromiques ont été mis au point, permettant d’élargir le nombre de cibles, en créant des panels selon les symptômes cliniques des patients. Ces techniques présentent certains avantages, elles permettent notamment d’obtenir des résultats en moins de 45 minutes pour certains automates. Elles permettent également de réaliser les examens, patients par patients et non en séries, ce qui est intéressant particulièrement en cas de demande urgente d’un service clinique. Cependant cette technique est très onéreuse ce qui impose d’adopter une stratégie d’utilisation. Ces automates utilisent des cassettes où toutes les réactions de PCR traditionnelles (lyse de l’échantillon, extraction des acides nucléiques, amplification et détection) sont réalisées. Il s’agit de tests unitaires où le temps de manipulation technique est réduit et où les résultats sont rendus dans un délai assez court (1 à 2 heures).
Eplex®
Le panel ePlex® RP de GenMark/ELITech permet la détection de 24 pathogènes respiratoires. La préparation de la cassette se réalise en 2 minutes et on obtient un résultat en 90 minutes.
Figure 20 Automate ePlex® de GenMark/ELITech
Cet automate utilise la PCR en microfluidique et la détection se fait par électrochimie (cf matériels et méthodes).
FilmArray® de Biofire
FilmArray® intègre la lyse de l’échantillon, l'extraction des acides nucléiques, l’amplification, la détection et l’analyse dans un système simple qui nécessite 2 minutes de préparation pour une durée totale d’analyse de 45 minutes (55).
Figure 21 Automate Fimarray® de Biofire.
Le panel respiratoire (RP2plus) commercialisé sur l’automate FilmArray®permet la détection de 22 virus et bactéries respiratoires. Le tableau suivant décrit les pathogènes recherchés par le panel respiratoire RP2plus.
Cet automate utilise la PCR en microfluidique et la détection se fait par l’étude des courbes de fusion (détermination des températures de fusions propres aux produits de PCR).
Verigene® de Luminexcorp
Verigene® est un automate de PCR multiplex utilisant un panel variable de pathogènes respiratoires et pouvant détecter jusqu’à 16 bactéries et virus fréquemment incriminés dans les infections respiratoires. Le panel est à la carte en fonction des besoins du clinicien, on peut sélectionner les microorganismes suspectés, on évite la recherche des autres agents du panel. En effet l’épidémiologie des pathogènes respiratoires varient selon la période de l’année, la localisation géographique et l’état de santé du patient.
Le coût de ce système constitue un avantage car les réactifs utilisés pour chaque agent sont achetés séparément, ce qui implique que cette technique coute moins cher que les autres automates multiplex.
Figure 22 Automate Verigene® de Luninexcorp.
Voici les pathogènes recherchés par le panel Verigene RP Flex® :
Les virus :
Adénovirus, métapneumovirus, grippe A, grippe A sous-type H1, grippe A sous type H3, grippe B, parainfluenza 1, 2, 3 et 4, rhinovirus, VRS A et B.
Les bactéries :
Bordetella pertussis, Bordetella parapertussis Bordetella holmesii.
Cette technologie fait appel aux puces à ADN, dont le principe consiste à mettre en contact des sondes (spécifiques d’un gène) avec des ARNs cibles extraits d’échantillons à analyser, ces ARNs sont marqués par des fluorochromes. Après la phase d’hybridation, une acquisition des images permet la quantification des produits d’hybridation, on obtient ainsi le reflet du niveau d’expression des différents gènes présents sur la puce.