HAL Id: dumas-01755043
https://dumas.ccsd.cnrs.fr/dumas-01755043
Submitted on 30 Mar 2018HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Distributed under a Creative Commons Attribution - NonCommercial - NoDerivatives| 4.0 International License
Utilisation des dentifrices dans le traitement de
l’hypersensibilité dentinaire
Marie Canon
To cite this version:
Marie Canon. Utilisation des dentifrices dans le traitement de l’hypersensibilité dentinaire. Sciences du Vivant [q-bio]. 2017. �dumas-01755043�
AVERTISSEMENT
Cette thèse d’exercice est le fruit d’un travail approuvé par le jury de soutenance
et réalisé dans le but d’obtenir le diplôme d’État de docteur en chirurgie dentaire.
Ce document est mis à disposition de l’ensemble de la communauté
universitaire élargie.
Il est soumis à la propriété intellectuelle de l’auteur. Ceci implique une obligation
de citation et de référencement lors de l’utilisation de ce document.
D’autre part, toute contrefaçon, plagiat, reproduction illicite encourt toute
poursuite pénale.
Code de la Propriété Intellectuelle. Articles L 122.4
UNIVERSITÉ PARIS DESCARTES
FACULTÉ DE CHIRURGIE DENTAIRE
Année 2017 N°061
THÈSE
POUR LE DIPLÔME D’ÉTAT DE DOCTEUR EN CHIRURGIE DENTAIRE Présentée et soutenue publiquement le : 26 septembre 2017
Par
Marie CANON
Utilisation des dentifrices dans le traitement de l’hypersensibilité
dentinaire
Dirigée par M. le Docteur Jean-Pierre Attal
JURY
M. le Professeur Louis Maman Président
Mme le Docteur Hélène Fron Chabouis Assesseur
Mme le Docteur Élisabeth Dursun Assesseur
Remerciements
À M. le Professeur Louis Maman
Docteur en Chirurgie dentaire Spécialiste qualifié en Chirurgie oral Habilité à Diriger des Recherches
Professeur des Universités, Faculté de Chirurgie dentaire Paris Descartes Praticien Hospitalier, Assistance Publique-Hôpitaux de Paris
Doyen de la Faculté de Chirurgie dentaire Paris Descartes
Pour m’avoir fait l’honneur d’accepter la présidence de ce jury. Pour l’oreille toujours attentive que vous prêtez aux étudiants et votre présence tout au long de nos études. Veuillez trouver ici l’expression de mon plus grand respect.
À Mme le Docteur Hélène Fron Chabouis
Docteur en Chirurgie dentaire Docteur de l’Université Paris Nord
Maitre de Conférences des Universités, Faculté de Chirurgie dentaire Paris Descartes Praticien Hospitalier, Assistance Publique-Hôpitaux de Paris
Pour m’avoir fait l’honneur de participer à ce jury. Pour votre gentillesse et votre bienveillance. Pour les soins attentifs que vous nous apprenez à prodiguer. Veuillez trouver ici l’expression de ma sincère reconnaissance.
À Mme le Docteur Élisabeth Dursun
Docteur en Chirurgie dentaire Ancien Interne des Hôpitaux Docteur de l’Université Paris 13
Maitre de Conférences des Universités, Faculté de Chirurgie dentaire Paris Descartes Praticien Hospitalier, Assistance Publique-Hôpitaux de Paris
Pour m’avoir fait l’honneur de participer à ce jury. Pour la pédagogie dont vous savez faire preuve lors de vos
enseignements. Veuillez trouver ici l’expression de ma sincère reconnaissance.
À M. le Docteur Jean-Pierre Attal
Docteur en Chirurgie dentaire
Docteur de l’Université Paris Descartes Habilité à Diriger des Recherches
Maitre de Conférences des Universités, Faculté de Chirurgie dentaire Paris Descartes Praticien Hospitalier, Assistance Publique-Hôpitaux de Paris
Pour m’avoir fait l’honneur d’accepter la direction de cette thèse. Pour votre soutien et vos précieux conseils tout au long de la rédaction de cette thèse. Pour la gentillesse et la patience dont vous savez faire preuve auprès des étudiants. Veuillez recevoir ici l’expression de tout mon respect et de mon estime.
À ma mère et ma confidente. Pour ton amour, ta force, ta douceur et la dévotion dont tu as toujours fait preuve auprès de tes enfants. Pour tout ce que tu m’as apporté jusqu’aujourd’hui et ce que tu m’apportes chaque jour.
À mon père. Pour ton amour et ton soutien constant.
Pour m’avoir accompagné lors de mes premiers pas professionnels.
À Samy. Pour chaque instant passé à tes côtés. Et pour les (encore plus) nombreux moments à venir. Pour ton extreme gentillesse, ta patience, ton humour, et ton attendrissante maladresse. Avec tout mon amour.
À ma soeur et à Thibaud. Aux nombreuses années partagées et à venir. À ma petite soeur Louise.
À mon beau-père, pour ta présence à nos côtés ces 15 dernières années et pour le commencement de cette nouvelle vie (enfin!).
À Corinne, ma “belle-mère de coeur”.
À mon grand-père, chaque moment en ta présence est précieux. À mes grands-parents, pour l’enfance qu’ils m’ont offerte.
À mes copines et copains de fac. Adèle (ta présence quasi-quotidienne, ton soutien et ton oreille attentive), Anne-Laure (ta bonne humeur à toute épreuve, ton brin de folie et ta toute nouvelle ponctualité), Gwe (ta gentillesse, ta simplicité et tes histoires rocambolesques), Justine (pour tous les bons moments passés à tes côtés), Louise (pour m’écouter patiemment râler), Clémentine ma copine nantaise, Cécilia ma copine de quartier, Mathilde, Emeline, Maxime M., Charles, Keke, Quentin, Gorguine, Arnaud, Maxou, Robin, Mathieu, Lisa, Jc.
À Lamia, ma binôme de coeur.
À Pierre, mon copain de thèse (et d’apéritif). À Jen, pour ton soutien précieux.
À Valentin, mon meilleur ami. Pour ton indéfectible amitié. Pour notre relation qui reste inchangée malgré le temps qui passe.
À mes copines de lycée. Oriane (pour tous les bons moments passés ensemble et nos galères), Zoi (pour ta bonne humeur et ta sensibilité exacerbée), Pauline (pour ta joie de vivre inébranlable), Flora,Marine.
1
Table des matières
INTRODUCTION ... 3
1: GÉNÉRALITÉS ... 4
1.1 MÉCANISME DE L’HYPERSENSIBILITÉ DENTINAIRE ... 4
1.1.1 Structure ... 4
1.1.2 Exposition dentinaire ... 4
1.2 THÉORIE DE L’HYPERSENSIBILITÉ DENTINAIRE ... 5
1.2.1 Théorie du récepteur dentinaire ... 5
1.2.2 Théorie de la transduction odontoblastique ... 5
1.2.3 Théorie hydrodynamique de Brannstömm ... 6
1.2.4 Avancées récentes ... 6
1.3 DIAGNOSTIC DE L’HYPERSENSIBILITÉ DENTINAIRE ... 8
1.3.1 Entretien médical ... 8
1.3.2 Examen clinique ... 9
1.4 TRAITEMENT DE L’HYPERSENSIBILITÉ DENTINAIRE ... 11
1.4.1 Identification et correction des facteurs favorisants ... 11
1.4.2 Traitement ambulatoire ... 11
1.4.3 Traitements au fauteuil ... 11
1.5 SYNTHÈSE ... 15
1.6 RÔLE DES FACTEURS PSYCHOSOCIAUX ET ENVIRONNEMENTAUX DANS LA PERCEPTION DE LA DOULEUR ... 17
2DENTIFRICES ET TRAITEMENT DE L’HYPERSENSIBILITÉ DENTAIRE ... 18
2.1 FORMULATION DES DENTIFRICES ... 18
2.1.1 Composition... 18
2.1.2 Rôle des différents composants dans la perméabilité dentinaire ... 19
2.1.3 Abrasivité et perte de substance ... 20
2.1.4 Synthèse ... 21
2.2 PRINCIPES ACTIFS UTILISÉS DANS LE TRAITEMENT DE L’HYPERSENSIBILITÉ DENTINAIRE ... 22
2.2.1 Novamin (calcium sodium phosphosilicate) ... 22
2.2.2 Pro-Argin (Arginine, carbonate de calcium) ... 26
2.2.3 Potassium ... 29
2.2.4 Acétate de strontium ... 31
2
2.2.6 Fluorure d’amine ... 37
2.2.7 Nano-hydroxyapatite ... 38
2.2.8 Synthèse ... 40
2.3 COMPARAISON DE L’EFFICACITÉ DES DIFFÉRENTS PRINCIPES ACTIFS DANS LE TRAITEMENT DE L’HYPERESTHÉSIE DENTINAIRE IN VIVO (ANNEXE8) ... 42
2.4 COMPARAISON DE L’EFFICACITÉ DES DIFFÉRENTS PRINCIPES ACTIFS DANS LE TRAITEMENT DE L’HYPERESTHÉSIE DENTINAIRE IN VITRO 44 2.5 IMPLICATIONS CLINIQUES DE L’ANALYSE INTERGROUPE ... 46
3PROPOSITION PROTOCOLE D’ÉTUDE ... 50
3.1 INTRODUCTION ... 50
3.1.1 Bien fondé et contexte scientifique ... 50
3.1.2 Hypothèse ... 50 3.2 MÉTHODE ... 51 3.2.1 Participants ... 51 3.2.2 Déroulement de l’étude ... 51 3.2.3 Objectif et hypothèse ... 54 3.2.4 Critère de jugement ... 54 3.2.5 Taille de l’échantillon ... 55 3.2.6 Randomisation ... 55 3.2.7 Aveugle ... 55 4CONCLUSION ... 56 BIBLIOGRAPHIE ... 57
TABLE DES FIGURES ... 62
TABLE DES TABLEAUX ... 63
3
Introduction
L’hypersensibilité dentinaire est définie comme « une douleur intense et brève provenant de la dentine exposée en réponse à un stimulus thermique (chaleur ou froid), chimique, mécanique (contact), osmotique (solutions sucrées concentrées) ou une évaporation des fluides des surfaces dentinaires ».
D’après le terme de Merskey, la douleur est « une expérience sensorielle et émotionnelle désagréable liée à une lésion tissulaire existante ou potentielle ou décrite en termes d'une telle lésion. »
La prévalence de l’hypersensibilité dentinaire au sein de la population est très variable d’une étude à l’autre (entre 3 et 73% des populations de l’Europe de l’ouest et des Etats-Unis). Les revues de littérature admettent un taux de 3 à 57%, ce qui en fait une des pathologies dentaires les plus courantes. Celle-ci est sous-estimée par tous.
Les prémolaires sont les dents les plus fréquemment touchées, devant les incisives puis les molaires. Les surfaces vestibulaires sont les plus impliquées.
La survenue de phénomène d’hypersensibilité est maximale chez les patients de 30 à 40 ans pour décroître par la suite, et supérieure chez les femmes par rapports aux hommes, probablement du fait de leur alimentation et de leur hygiène dentaire.
L’hypersensibilité semble avoir un véritable impact sur la qualité de vie des patients touchés.
De nouvelles recherches s’orientent vers des techniques telles que le laser ; cependant aucune solution thérapeutique n’a pour l’heure apporté une pleine satisfaction.
Les dentifrices désensibilisants restent le traitement de première intention bien souvent proposé aux patients dans le cadre de sensibilités dentaires.
De nombreux principes actifs ont été testés puis proposés dans l’éventail de soin des hypersensibilités.
Face à ce grand nombre de principes actifs et, plus largement, face à la multitude de dentifrices présents sur le marché français, le praticien peut avoir des difficultés à orienter sa prescription. Lesquels ont fait leur preuve ? Que prescrire en fonction du profil du patient? C’est ce que nous tenterons de déterminer dans ce travail.
Nous aborderons ensuite la possibilité de combiner l’utilisation de principes actifs aux différents modes d’actions afin d’agir sur plusieurs maillons de la chaîne de la douleur. Pour cela, nous proposerons un protocole d’étude clinique.
4
1 : Généralités
1.1 Mécanisme de l’hypersensibilité dentinaire
1.1.1 Structure
La dentine est composée de tubules dentinaires, entourés d’une matrice hyperminéralisée appelée dentine péri-tubulaire, et séparés par la dentine inter-tubulaire. Le tubule dentinaire est constitué d’un fluide et d’un prolongement odontoblastique.
Chez le patient atteint d’hypersensibilité, les tubules sont plus larges (2 fois plus) et plus nombreux (8 fois plus) que chez le patient sain1. Il existe un facteur 4 entre le rayon des tubules et le flux
dentinaire: ainsi, si le rayon tubulaire est multiplié par 2, le flux dentinaire est multiplié par 16. La susceptibilité à cette pathologie serait donc intimement liée à la structure anatomique de la dentine.
1.1.2 Exposition dentinaire
L’existence d’une hypersensibilité dentinaire présuppose l’exposition de la dentine au milieu buccal. Celle-ci peut être due à une perte d’émail, une récession parodontale ou à une combinaison des deux phénomènes. Ils sont multifactoriels.
Dans le cas des éclaircissements, des sensibilités peuvent apparaître indépendamment d’une exposition dentinaire.
Une perte d’émail peut être causée par une lésion dite « non carieuse ». Cette lésion est liée à différents phénomènes :
- Érosion : Processus chimique résultant de l’action d’acides sur les surfaces dentaires. L’origine de ces acides peut être intrinsèque ou extrinsèque.
- Attrition : Processus d’usure de 2 corps, résultant du contact dento-dentaire entre des dents antagonistes ou entre des dents adjacentes.
1Absi, Addy, et Adams, « Dentine hypersensitivity. a study of the patency of dentinal tubules in sensitive and
5
- Abrasion : Processus d’usure des surfaces dentaires par frottement avec un corps autre qu’une dent (abrasion à 2 corps). Elle peut également impliquer un autre corps interposé (abrasion à 3 corps).
- Abfraction : Perte de structure dentaire due aux forces de flexion de la dent.
Une récession parodontale est définie comme la migration de la gencive marginale apicalement à la jonction amélo-cémentaire aboutissant à l’exposition du cément de la surface radiculaire (et de la dentine par la suite).
Les étiologies d’une récession parodontale sont les suivantes : - Maladie parodontale
- Traumatisme
- Insertion freinale haute - Brossage traumatique - Automutilation - Orthodontie
- Déhiscence et fenestration de l’os alvéolaire - Piercing oral
- Traitements prothétiques iatrogènes
1.2 Théorie de l’hypersensibilité dentinaire
De nombreuses théories concernant le mécanisme d’hypersensibilité dentinaire ont été proposées. Nous citerons les principales.
1.2.1 Théorie du récepteur dentinaire
Cette théorie affirmait qu’il existait une stimulation directe des prolongements nerveux dentinaires par les stimuli. Des observations microscopiques et des études expérimentales ont mis en évidence l’absence de fibres nerveuses dans la partie externe de la dentine rendant cette théorie caduque. De plus, le plexus de Rashkov est immature avant l’éruption complète de la dent ; or des hypersensibilités dentinaires ont été constatées sur des dents immatures.
1.2.2 Théorie de la transduction odontoblastique
Cette théorie supposait qu’un stimulus chimique, thermique ou mécanique engendrait une excitation du prolongement odontoblastique. L’odontoblaste, via une jonction synaptique, provoquait alors
6
l’excitation des fibres nerveuses pulpaires. Aucune preuve scientifique n’avait prouvé l’existence d’une excitabilité odontoblastique. Närhi Mvo, lors d’observations directes au microscope a déterminé que les prolongements odontoblastiques ne s’étendent que de 0.5 à 1 mm de la pulpe, atteignant au maximum la moitié de la dentine.
1.2.3 Théorie hydrodynamique de Brannstömm
Gysi, au XIXème siècle, évoque, sans preuve scientifique, l’existence de fluides dentinaires, qui, soumis à un stimulus adéquat, provoqueraient l’activation des fibres nerveuses pulpaires.
En 1963, Brannströmm et ses collaborateurs réalisent une étude appuyant cette théorie. Les stimuli douloureux (thermique, chimique, mécanique) provoqueraient des mouvements de fluides intra-tubulaires, stimulant un barorécepteur et aboutissant à la stimulation des fibres nerveuses pulpaires α et δ.
L’application d’un jet d’air (évaporation) sur une dent présentant une hypersensibilité ferait naître une déshydratation de surface. Celle-ci provoquerait un flux dentinaire sortant et une stimulation des fibres nerveuses. Un phénomène comparable serait constaté pour les stimuli osmotiques et froids.
Au contraire, l’application d’un stimulus chaud entrainerait un mouvement de fluide entrant.
L’application d’un stimulus mécanique serait responsable d’une contraction des tubules dentinaires engendrant des mouvements de fluides sortants lors du relâchement du stimulus.
Chacun de ces stimuli, par des actions différentes, pourrait engendrer un mouvement de fluide, ayant pour conséquence la stimulation des fibres nerveuses pulpaires et l’apparition de phénomène d’hypersensibilité dentinaire.
1.2.4 Avancées récentes
Plus récemment2, l’implication des odontoblastes dans la transmission du message douloureux a été
de nouveau étudiée. Si le fonctionnement exact est encore inconnu (protéines médiatrices du signal…), les odontoblastes présenteraient des canaux ioniques à potentiel de récepteur thermosensitif et mécanique. Ils seraient ainsi capables de détecter les modifications thermiques,
7
mécaniques et les modifications de mouvements de fluides, en faisant les acteurs centraux du mécanisme d’hypersensibilité dentinaire.
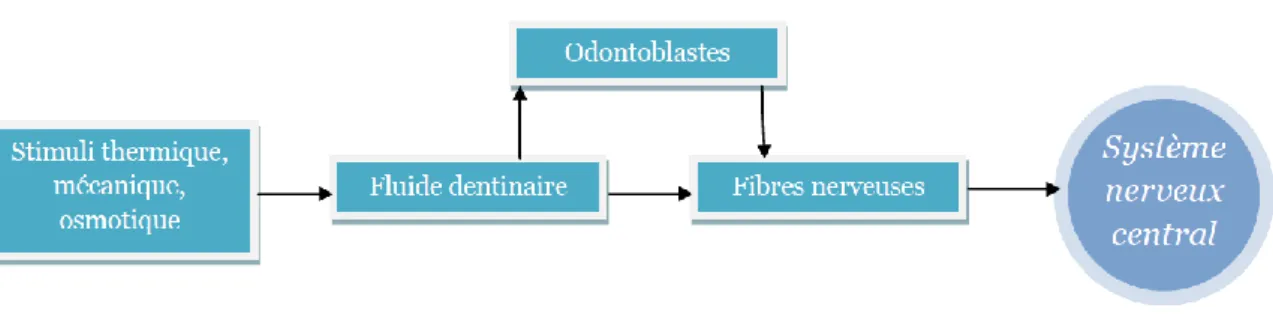
La figure 1 schématise une exposition dentinaire et les mouvements de fluide aboutissant au phénomène d’hypersensibilité, la figure 2 les différents acteurs de ce dernier.
Figure 1 : Exposition dentinaire responsable de mouvements de fluide lors de l’application de stimuli
Source : Auteur
Figure 2 : Stimuli aboutissant à la stimulation du système nerveux central dans le cadre d’une hypersensibilité dentinaire
8
1.3 Diagnostic de l’hypersensibilité dentinaire
1.3.1 Entretien médical
L’entretien médical est indispensable dans le diagnostic de l’hypersensibilité dentinaire.
Le praticien cherchera à déterminer la symptomatologie, les facteurs déclenchants, les facteurs de risques locaux et généraux.
1.3.1.1 La symptomatologie
Le patient sera questionné sur l’existence d’une douleur et sa nature (type, intensité, fréquence, rémanence).
1.3.1.2 Les facteurs déclenchants
Il peut s’agit du chaud, du froid, de la pression, du sucre, des substances acides.
1.3.1.3 Les facteurs de risques locaux et généraux
Le chirurgien-dentiste s’efforcera de mettre en évidence certains facteurs de risques généraux :
- L’alimentation : la consommation importante de boissons acides (sodas, jus de fruits, boissons énergétiques), d’agrumes, source d’acides exogènes, est responsable de phénomènes d’érosion aboutissant à une perte d’émail et à la survenue de sensibilité dentaire ;
- Le risque professionnel : certaines professions présentent un risque accru d’érosion et donc d’hypersensibilité dentinaire (nageurs professionnels, peintres, œnologues) ;
- Les médicaments : certains médicaments s’avèrent particulièrement acides (vitamine C…) ou sont responsables d’hyposialie voir d’asialie ;
- Les reflux gastro-œsophagien ;
- Les troubles du comportement de type anorexie-boulimie ; - Les maladies entraînant une sécheresse buccale.
9
Le praticien sera également particulièrement attentif aux facteurs de risques locaux :
- La thérapeutique parodontale : l’instrumentation mécanique, sonore ou ultrasonore est fortement suspectée de favoriser l’hypersensibilité dentinaire par élimination du cément voire de la dentine radiculaire. Le patient peut faire part au praticien d’antécédents de traitement parodontal lors de l’entretien ;
- L’existence d’un brossage traumatique : le chirurgien-dentiste doit questionner le patient à propos de sa technique et de son matériel de brossage. Un brossage horizontal avec une brosse à dent dure peut laisser supposer une perte de substance par abrasion ;
- Les traitements dentaires antérieurs tels que la réfection de restaurations ou les blanchiments doivent être pris en compte par le praticien.
1.3.2 Examen clinique
1.3.2.1 Diagnostics différentiels
L’hypersensibilité dentinaire est souvent décrite comme un diagnostic « d’élimination ». Lorsqu’un patient présente une doléance douloureuse, un entretien médical et un examen clinique minutieux devront être entrepris afin d’écarter les diagnostics suivants :
- dent fissurée ou fracturée ;
- restauration non étanche ou fracturée ; - lésion carieuse ;
- pulpite réversible et irréversible ; - sensibilités post-opératoires ;
- hypersensibilité en relation avec un traitement de blanchiment dentaire sur dent vivante.
1.3.2.2 Outils diagnostics
Lorsque ces hypothèses diagnostiques sont éliminées à l’aide des outils habituels (miroir, sonde, fil dentaire, réalisation d’un test au froid, de palpation, de percussion, de morsure, radiographie, vérification de l’occlusion…), le praticien peut réaliser des tests diagnostics plus spécifiques :
- seringue eau/air :
L’application d’un jet d’air sur les surfaces dentinaires exposées peut être responsable de l’apparition de la douleur.
- Sonde n°6 :
10 - Sonde Yeaple :
L’application du stimulus se fait de la même façon qu’avec la sonde n°6 mais la sonde Yeaple permet un paramétrage précis de la force appliquée en grammes. Chez un patient « sain », un stimulus d’une force allant jusqu’à 70 g ne déclenchera pas de phénomène douloureux. Chez un patient atteint d’hypersensibilité, la douleur peut apparaître dès 10 g.
La figure 3 est une photographie d’une sonde Yeaple.
Figure 3 : Sonde Yeaple
Source : jinhongfan, 2011
- Tests thermiques :
Ils sont à utiliser avec précaution au niveau de la zone dentinaire exposée car potentiellement très algogènes.
La perception douloureuse du patient est estimée à l’aide : - D’une échelle visuelle analogique (EVA) :
Il s’agit d’une échelle d’auto-évaluation reproductible, fiable et validée dans le cadre des douleurs aigües mais également chroniques. Elle se présente sous la forme d’une réglette graduée de 10 cm. Le patient déplace le curseur sur la ligne de 0 (absence de douleur) à 10 (douleur maximum imaginable) selon la douleur ressentie. Sur l’autre face se situent les graduations millimétrées (vues seulement par le soignant) permettant une estimation précise de la douleur.
11
- Du score de Schiff : lors de l’application d’un stimulus, un score est attribué à la douleur du patient selon sa réaction.
0 : Pas de réponse au stimulus.
1 : Réponse au stimulus mais possibilité de poursuite de l’application de celui-ci.
2 : Réponse au stimulus et mouvements d’évitements et/ou demande d’arrêt de celui-ci. 3 : Douleur et demande d’arrêt du stimulus.
Le diagnostic d’hypersensibilité dentinaire est confirmé pour un score de Schiff égal ou supérieur à 1.
1.4 Traitement de l’hypersensibilité dentinaire
1.4.1 Identification et correction des facteurs favorisants
Tout traitement débute par la détermination de la ou des étiologie(s) et leur gestion. Cette étape est indispensable à la validation du diagnostic et à la limitation des récidives.
1.4.2 Traitement ambulatoire
Il s’agit du traitement de première intention lorsqu’un diagnostic d’hypersensibilité dentinaire est posé. Il comprend la prescription d’un matériel dentaire adapté (brosse à dent à poils souples), d’un dentifrice et/ou d’un bain de bouche désensibilisant.
Deux modes d’action existent pour ces traitements : le blocage de la transmission nerveuse du message douloureux ou l’obstruction des canalicules dentinaires.
1.4.3 Traitements au fauteuil
Il s’agit du traitement de seconde intention, en cas d’échec des traitements ambulatoires.
1.4.3.1 Traitements non invasifs
- Pâtes prophylactiques :
Elles contiennent les mêmes principes actifs que les dentifrices (calcium phosphosilicate, arginine et carbonate de calcium) mais à des concentrations différentes et sont appliquées au fauteuil par le praticien.
12 - Gels, crèmes et mousses :
Les gels peuvent être appliqués au fauteuil par le praticien. Les plus utilisés sont les gels à base d’oxalate (potassium, ferrique). Ils permettent de réduire la perméabilité dentinaire en formant des précipités de calcium d’oxalate au sein des tubules dentinaires.
Des gels contenant les mêmes principes actifs que les dentifrices sont aussi disponibles sur le marché. C’est le cas de Sensigel de chez Pierre Fabre, composé de nitrate de potassium, qui agit en inhibant la transmission nerveuse.
Figure 4 : Gel dentaire
Source : Fabre, Oral Care, 2012
Les crèmes telles que GC tooth-mousse contenant du CPP-ACP (phosphopeptine caséine-phosphate de calcium amorphe) sont utilisées au fauteuil par le praticien, ou à la maison par le patient. Elles diminueraient l’hypersensibilité dentaire en libérant des ions calcium et phosphate et aboutiraient à la formation d’une couche protectrice de phosphate de calcium.
- Vernis :
L’application de vernis permet la formation d’un film protecteur recouvrant les tubules dentinaires. Cependant, leur efficacité est de courte durée et nécessite de nombreuses applications aux fauteuils.
- Solutions à base de glutaraldéhyde :
Le glutaraldéhyde est responsable de la précipitation des protéines intra-canaliculaires.
Dans la solution commerciale Gluma Desensitizer, associé au 2-hydroxyéthyl métahcrylate (HEMA), il réagit avec l’albumine contenue dans le fluide dentinaire provoquant sa précipitation. Cette réaction engendre la polymérisation de l’HEMA et l’obstruction des tubules dentinaires à une profondeur allant jusqu’à 200 µm.
13
La figure 5 est une photographie de la solution Gluma Desenstizer.
Figure 5 : Solution Gluma Desensitizer
Source : GACD, Gluma Desensitizer, 2017
Dans la solution commerciale Telio CS Desensitizer, le glutaraldéhyde est associé au polyéthylène glycol diméthacrylate ou PEG-DMA. Ce dernier permet la précipitation des protéines plasmatiques. Le glutaraldéhyde agit alors comme un agent de réticulation : il se fixe aux groupements amine des protéines formants des agrégats insolubles au sein des tubules dentinaires.
La figure 6 est une photographie de la solution Telio CS Desensitizer.
Figure 6 : Solution Telio CS Desensitizer
14 - Les agents adhésifs :
Les agents adhésifs (systèmes adhésifs amélo-dentinaire, ciments verres ionomères et résines composites) permettent une occlusion des tubules dentinaires au fauteuil par formation d’une couche hybride (scellement dentinaire). Leur utilisation n’est pas aisée : zone de la perte de substance souvent difficilement isolable, surface peu propice au collage, élimination mécanique des matériaux (adhésifs) nécessitant la répétition des applications au fauteuil.
1.4.3.2 Traitements invasifs
- Le laser (Nd : YAG) :
Le laser semble interrompre la transmission nerveuse et obstruer l’entrée des canalicules dentinaires. Cependant, le recul clinique de cette technique reste faible même si aucun dommage de la pulpe n’a été relaté, son coût élevé, et son utilisation requiert une certaine expérience.
- Les chirurgies de recouvrement parodontal :
Elles consistent à recouvrir la zone dentinaire mise à nue par une technique chirurgicale (lambeau déplacé coronairement ou latéralement, greffe épithélio-conjonctive, greffe de conjonctif enfoui). Elles peuvent être indiquées en seconde intention en cas de doléance du patient après échec des traitements non-invasifs ou lors de défauts localisés à fort potentiel de recouvrement (Classe I et II de la classification de Miller).
- La pulpectomie :
La pulpectomie n’est pas une solution de choix dans le traitement de l’hypersensibilité dentinaire. Elle est citée mais la décision d’entreprendre une telle thérapeutique nécessite une extrême prudence. En effet, le diagnostic d’hypersensibilité dentinaire doit avoir été posé avec certitude, les thérapeutiques alternatives toutes entreprises sans succès, et la doléance douloureuse du patient doit être très importante pour mener à la dépulpation.
1.4.3.3 Traitement alternatif
- L’hypnose :
L’hypnose est définie comme un état de conscience modifié permettant de traiter les troubles psychiques ou somatiques. Elle peut être utilisée dans la gestion de la douleur comme dans de nombreux autres domaines médicaux.
15
1.5 Synthèse
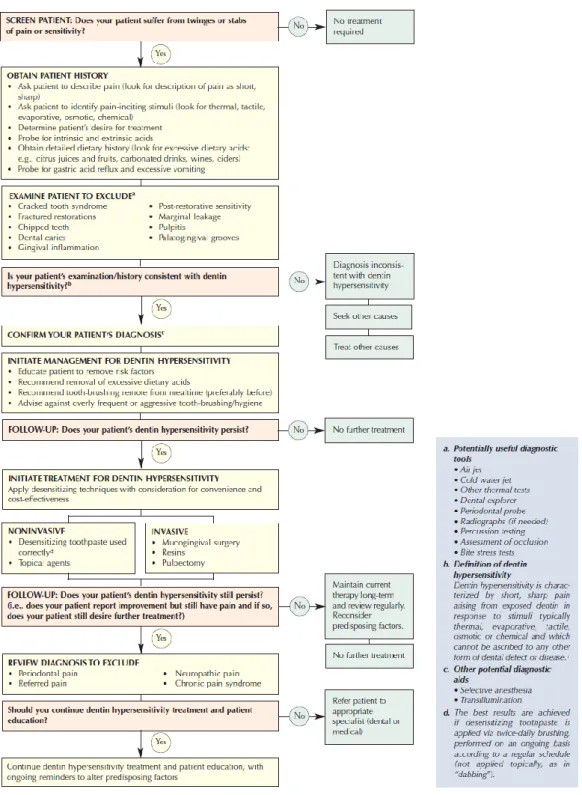
La figure 7 résume la démarche diagnostic et la prise en charge d’un patient atteint d’hypersensibilité dentinaire.
Figure 7: Diagnostic et prise en charge de l’hypersensibilité dentinaire
Source : Canadian advisory board on dentin hypersensitivity, « Consensus-based recommendations for the diagnostic and management of dentin hypersensitivity », 2003
16
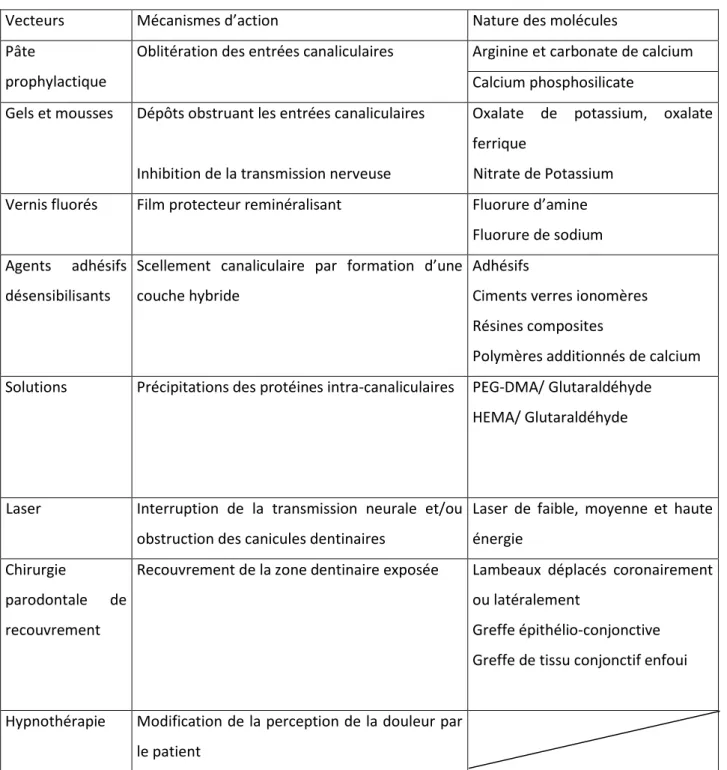
Le tableau 1 synthétise la nature et le mécanisme d’action des différents traitements de l’hypersensibilité dentaire disponibles sur le marché français.
Tableau 1 : Nature et mécanisme d’action des traitements de seconde intention de l’hypersensibilité dentinaire
Source : Auteur
Vecteurs Mécanismes d’action Nature des molécules
Pâte
prophylactique
Oblitération des entrées canaliculaires Arginine et carbonate de calcium Calcium phosphosilicate
Gels et mousses Dépôts obstruant les entrées canaliculaires
Inhibition de la transmission nerveuse
Oxalate de potassium, oxalate ferrique
Nitrate de Potassium
Vernis fluorés Film protecteur reminéralisant Fluorure d’amine
Fluorure de sodium Agents adhésifs
désensibilisants
Scellement canaliculaire par formation d’une couche hybride
Adhésifs
Ciments verres ionomères Résines composites
Polymères additionnés de calcium Solutions Précipitations des protéines intra-canaliculaires PEG-DMA/ Glutaraldéhyde
HEMA/ Glutaraldéhyde
Laser Interruption de la transmission neurale et/ou obstruction des canicules dentinaires
Laser de faible, moyenne et haute énergie
Chirurgie
parodontale de recouvrement
Recouvrement de la zone dentinaire exposée Lambeaux déplacés coronairement ou latéralement
Greffe épithélio-conjonctive Greffe de tissu conjonctif enfoui
Hypnothérapie Modification de la perception de la douleur par le patient
17
1.6 Rôle des facteurs psychosociaux et environnementaux dans la
perception de la douleur
Dans la quasi-totalité des études traitant de l’hyperesthésie dentinaire deux effets sont constatés :
- l’effet placebo, définit comme l’écart positif constaté entre le résultat thérapeutique observé lors de l’administration d’un médicament et l’effet thérapeutique prévisible en fonction des données strictes de pharmacologie.
- l’effet Hawthorne qui décrit la situation dans laquelle les résultats d’une expérience ne sont pas dus aux facteurs expérimentaux mais au fait que les sujets ont conscience de participer à une expérience dans laquelle ils sont testés ce qui se traduit généralement par une plus grande motivation.
Le rôle des facteurs psychologiques dans la gestion de la douleur n’est désormais plus à prouver. Nous pouvons donc supposer que l’écoute du patient, la délivrance d’une information adaptée et personnalisée (explication orale, fiche explicative) permettrait une plus grande motivation et une meilleure compliance aboutissant à de meilleurs résultats à terme.
Une fiche explicative à délivrer au patient atteint d’hypersensibilité dentinaire est proposée en annexe 1.
18
2 Dentifrices et traitement de l’hypersensibilité dentaire
Le choix des dentifrices dans le traitement de l’hypersensibilité dentinaire est aisément compréhensible : faciles d’utilisation, non invasifs, permettant une application par le patient à la maison. Ils présentent un recul clinique important (nombreuses études randomisées, revues systématiques de littérature).
2.1 Formulation des dentifrices
La formulation des dentifrices est particulièrement complexe. Nous rappellerons leur composition puis étudierons le rôle des différents composants dans la perméabilité dentinaire.
2.1.1 Composition
Les dentifrices comportent des excipients et des principes actifs : Les excipients sont les suivants :
- Agents polissants ou abrasifs : Ils constituent 30 à 50% du dentifrice. Ils ont une action de polissage des surfaces mais doivent être suffisamment doux pour ne pas léser l’émail et la dentine ;
- Agents moussants : Ils représentent 1 à 2% du dentifrice et sont utilisés pour favoriser le nettoyage des dents. Ils ont des propriétés émulsifiantes, mouillantes (tensioactivité), moussantes et détersives ;
- Agents humectants : Ils représentent 15 à 25 % du dentifrice. Ils sont utilisés pour éviter le durcissement de la pâte dentifrice au contact de l’air ;
- Agents épaississants : Ils représentent 0.5 à 2% du dentifrice et sont responsables de la viscosité de celui-ci ; - Arômes ; - Conservateurs ; - Agents colorants ; - Agents filmogènes ; - Edulcorants.
19
Les principes actifs sont incorporés dans la formule du dentifrice et peuvent être utilisés seuls ou associés entre eux : bactériens, blanchissants, tartre, hypersensibilité dentinaire, anti-halitose….
2.1.2 Rôle des différents composants dans la perméabilité dentinaire
De nombreuses études ont été menées attribuant la diminution de l’hypersensibilité aux principes actifs des dentifrices. Cependant, peu se sont penchées sur l’influence des excipients sur la perméabilité dentinaire.
En 1989, Addy et al3 s’interrogent sur la complexité des formulations des dentifrices.
Le but de l’étude était d’évaluer la biodisponibilité des ions métalliques et du fluor contenus dans de nombreux dentifrices et d’observer les changements de surfaces engendrés.
La biodisponibilité des principes actifs est indispensable pour qu’ils puissent prétendre à l’obturation des canalicules dentinaires. La concentration des ions métalliques a été mesurée après leur extraction en milieu aqueux (centrifugation). Dans plusieurs formulations testées, elle s’est révélée faible. Cela suggère la liaison de ces éléments avec d’autres ingrédients contenus dans le dentifrice. C’est le cas du strontium qui se lie au monofluorophosphate, ce qui provoque une chute de sa biodisponibilité.
Une comparaison au microscope de l’obstruction des tubules réalisée par les dentifrices ou par leurs composants abrasifs seuls a été effectuée. Pour certains dentifrices, l’application des seuls composants abrasifs aboutissait à une obstruction équivalente à celle des formulations complètes. En revanche, ces derniers étaient pour la plupart éliminés facilement par l’eau.
L’efficacité d’un dentifrice dans le traitement de l’hypersensibilité dentinaire ne réside donc pas uniquement dans la concentration de son principe actif dans le produit fini. La biodisponibilité de celui-ci est fondamentale pour prétendre à l’obstruction des canalicules dentinaires : les interactions « parasites » avec d’autres ingrédients doivent être limitées.
3 Mostafa et Addy, « Dentine hypersensitivity. ii. effects produced by the uptake in vitro of toothpastes onto
20
Enfin, la résistance aux attaques acides et au milieu buccal nécessite d’être examinée : si la plupart des dentifrices créent une couche de surface protégeant les tubules après utilisation, celle-ci doit être rémanente dans les cas d’hypersensibilité pour permettre un soulagement durable du patient.
2.1.3 Abrasivité et perte de substance
West et al4, en 1998, étudient l’influence des différents composants de dentifrices sur l’exposition
des tubules dentinaires.
Leurs conclusions sont les suivantes :
- Il existe une perte de substance par abrasion pour tous les dentifrices testés allant de la perte de la pellicule acquise exogène à la perte de la dentine elle-même.
- Celle-ci augmente avec la durée du brossage.
- Le pouvoir abrasif des différents constituants influe directement sur cette perte de substance.
- La phase liquide du dentifrice, constituée de détergents, se montre peu abrasive. En revanche, elle semble solubiliser la pellicule acquise exogène ensuite éliminée par le brossage.
D’autres facteurs potentialisent l’action du dentifrice sur la dentine tel que le type de brosse à dent utilisée, la méthode, la fréquence du brossage ainsi que la force appliquée.
Dans une étude publiée en 2002, West et al5 conclut qu’il existe un « temps de brossage idéal ».
Celui-ci doit permettre une interaction suffisamment longue entre le principe actif et la dentine (la profondeur de pénétration des particules augmente avec le temps de brossage) tout en limitant la perte de substance inhérente à l’abrasion du dentifrice (qui augmente également avec le temps de brossage).
L’abrasivité des dentifrices est mesurée par la « relative dentine abrasivity » ou RDA. Elle varie de 0 à 200, maximum autorisé par la FDA. Il a été constaté une corrélation significative mais faible6
(probablement due au nombre limité d’échantillon) entre la RDA d’un dentifrice et la perte de
4 West, Addy, et Hughes, « Dentine hypersensitivity: the effects of brushing desensitizing toothpastes, their solid and liquid
phases, and detergents on dentine and acrylic: studies in vitro ».
5 West, Hughes, et Addy, « Dentine hypersensitivity: the effects of brushing toothpaste on etched and unetched dentine in
vitro ».
21
substance liée à son utilisation. Les laboratoires pharmaceutiques n’ont pas l’obligation de l’apposer sur les produits et ne le communiquent que rarement ce qui est regrettable.
Les dentifrices sont catégorisés en fonction de leur RDA en abrasivité très faible, faible, moyenne, modérée et élevée (tableau 2).
Abrasivité très faible RDA<60
Abrasivité faible 61<RDA<70
Abrasivité moyenne 71<RDA<100
Abrasivité modérée 101<RDA<120
Abrasivité élevée 121<RDA<200
Tableau 2 : Abrasivité d’un dentifrice en fonction de sa RDA
Source : Auteur
2.1.4 Synthèse
La formulation des dentifrices ayant pour but d’agir sur l’hypersensibilité dentinaire est complexe puisque leur efficacité ne réside pas uniquement dans leur principe actif.
Plusieurs composants sont donc à prendre en compte :
- Les agents abrasifs ou polissants (silice artificielle ou naturelle, alumine, phosphate dicalcique…) jouent un rôle à plusieurs niveaux :
Leur pouvoir d’abrasion : lorsqu’il augmente, la perte de substance dentaire augmente, exacerbant le phénomène d’hypersensibilité. La RDA du dentifrice donne une indication sur ce paramètre comme expliqué précédemment.
Leur affinité aux tissus dentaires : lorsqu’elle augmente, la rémanence du produit sur le substrat dentaire augmente. La durée d’action du dentifrice est optimisée.
- Le principe actif dont plusieurs caractéristiques font varier l’efficacité : Le mode d’action ;
La taille des particules : lorsqu’elle augmente, la profondeur de pénétration diminue. La biodisponibilité : pour que son action soit efficace, le principe actif doit être
22
2.2 Principes actifs utilisés dans le traitement de l’hypersensibilité
dentinaire
Le principe actif idéal présente les caractéristiques suivantes : - Une action rapide ;
- Un effet persistant ;
- Inoffensif vis-à-vis de la pulpe ; - Non douloureux ;
- Facile à appliquer.
En voici la liste : phosphosilicate de calcium sodium, arginine, potassium, strontium, fluorure stanneux, fluorure d’amine, nano-hydroxyapatite.
Au préalable, notons que la majorité des études visant à déterminer l’efficacité des différents principes actifs sont réalisées par les laboratoires les commercialisant. Les liens d’intérêt sont précisés dans les annexes.
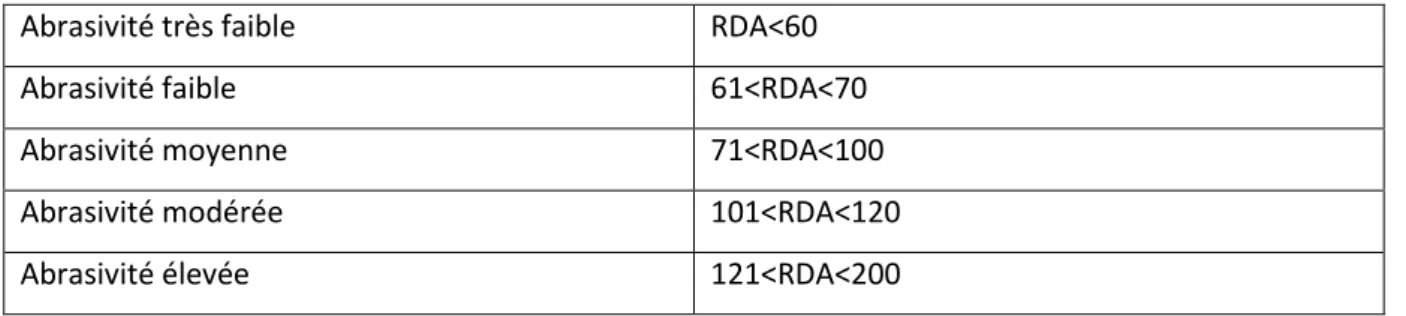
2.2.1 Novamin (calcium sodium phosphosilicate)
2.2.1.1 Mode d’action : Oblitération des tubuli
La technologie Novamin est décrite comme une forme amorphe et inorganique de calcium sodium phosphosilicate (CSPS). Développée initialement dans les années 1970 dans le cadre de matériaux de substituts osseux, elle est désormais utilisée dans le traitement de l’hyperesthésie dentinaire. Elle est constituée de calcium, de sodium, de phosphate et de silice au sein d’une matrice amorphe.
Son mode d’action au sein du milieu buccal résulte d’une succession de réactions chimiques comme décrites ci-dessous :
1- Exposition du principe actif dans le milieu buccal (salive, eau).
2- Echange d’ions sodium (Na+) du matériau et d’ions hydrogène (H+, H3O+) salivaires ; augmentation du pH buccal ; attaque de la matrice par les ions hydrogène.
Libération d’ions calcium (Ca2+) et phosphate (P5+) du matériau.
3- Saturation du milieu buccal en ions calcium et phosphate provoquant leur précipitation en phosphate de calcium.
4- Incorporation d’ions hydroxyde (OH-) et carbonate (CO(3)2-) salivaires permettant la cristallisation du phosphate de calcium en couche d’hydroxycarbonate apatite. Les particules résiduelles de Novamin agissent comme réservoirs d’ions calcium et phosphate dans le temps.
23
La figure 8 illustre les différentes réactions menant à l’obstruction tubulaire par la technologie Novamin.
Figure 8 : Oblitération des tubuli dentinaires par la technologie Novamin
24
2.2.1.2 Preuve de l’efficacité significative de la technologie Novamin dans le traitement de
l’hyperesthésie dentinaire (HD) in vivo (ANNEXE 2)
Dans l’étude pilote de Litkowski et al7, trois produits contenant des concentrations différentes de
phosphosilicate de calcium sodium sont comparés afin d’étudier l’efficacité de l’utilisation de la technologie Novamin dans le traitement de l’hyperesthésie dentinaire. Ainsi, un dentifrice à 7.5% de Novamin (2.5% Sylodent ; ce dernier étant l’abrasif utilisé), l’un à 2.5% (7.5% Sylodent) et l’un à 0% (10% Sylodent) sont étudiés. Les trois dentifrices présentent une réduction significative de l’HD à 2, 4 et 8 semaines. L’efficacité du produit numéro 3 (ou placebo) ne contenant pas de Novamin peut être expliqué par un effet placebo, un effet Hawthorne, ou par l’existence d’une obstruction des tubulis dentinaires par l’agent abrasif utilisé. Lors des comparaisons intergroupes, le dentifrice concentré à 7.5% de Novamin a montré une diminution significativement supérieure comparé à celui concentré à 0% à tous les points de contrôle et à celui concentré à 2.5% à 8 semaines. Aucune différence significative entre les groupes 2.5% de Novamin et 0% de Novamin n’a été mise en évidence. Cela suggère que l’efficacité de la technologie Novamin augmente avec sa concentration.
Dans la méta-analyse de Zhu et al8, 11 études ont été retenues pour étudier l’efficacité de l’utilisation
du phosphosilicate de calcium sodium dans le traitement de l’hypersensibilité dentaire. Ils ont conclu à l’efficacité de cette dernière avec un niveau de preuve modéré. La variabilité des protocoles (concentration de l’agent actif, forme galénique –dentifrice, bain de bouche, pâte prophylactique-, temps de brossage et usage de matériel dentaire accessoire, durée des études, stimuli appliqués, nature du produit contrôle) rend la réalisation d’une méta-analyse ardue.
La première étude de Sufi et al9 comparant la diminution de l’HD chez des patients après 8 semaines
d’utilisation d’un dentifrice contenant 5% CSPS et 1500 ppm de fluor (SMFP), 0% CSPS et 1500 ppm de fluor (SMFP) et 2 dentifrices fluorés, n’a pas été en mesure de prouver la supériorité du dentifrice contenant 5% de phosphosilicate de calcium sodium. Dans la seconde étude, aucune différence significative n’a été notée entre les groupes 5% CSPS et 0% CSPS, cela ne permet pas de conclure à
7 Litkowski et Greenspan, « A clinical study of the effect of calcium sodium phosphosilicate on dentin hypersensitivity--proof
of principle ».
8 Zhu et al., « The effect of calcium sodium phosphosilicate on dentin hypersensitivity: a systematic review and
meta-analysis ».
9 Sufi et al., « Efficacy of an experimental toothpaste containing 5% calcium sodium phosphosilicate in the relief of dentin
hypersensitivity: an 8-week randomized study (study 1) »; Sufi et al., « Efficacy of an experimental toothpaste containing 5% calcium sodium phosphosilicate in the relief of dentin hypersensitivity: an 8-week randomized study (study 2) ».
25
l’efficacité significative du phosphosilicate de calcium dans le traitement de l’hyperesthésie dentinaire.
Pradeep et al10, dans une étude contrôlée randomisée, ont cherché à déterminer l’efficacité d’un
dentifrice concentré à 5% CSPS par rapport à un dentifrice de même formulation mais ne contenant pas de CSPS (contrôle négatif) et à 5% de nitrate de potassium (contrôle positif) dans le traitement de l’hypersensibilité dentinaire. A 2 et 6 semaines de traitement, la diminution de la sensibilité était significativement supérieure chez le groupe utilisant le dentifrice à 5% de phosphosilicate de calcium.
2.2.1.3 Preuve de l’efficacité significative de la technologie Novamin dans le traitement de
l’hyperesthésie dentinaire in vitro
Les études de Burwell et al11 et Earl et al12 avaient pour but de déterminer le comportement d’un
dentifrice composé de Novamin à 5% lors d’attaques acides et mécaniques in vitro. Après une exposition répétée à un milieu acide pendant 5 jours ou 10 jours, l’observation des échantillons dentinaires au microscope a conclu à une obstruction résiduelle de la majorité des tubules dentinaires malgré une diminution de l’épaisseur de la couche protectrice de surface dans le temps. La mesure de la microdureté des échantillons dentinaires (échelle de dureté de Knoop) dans l’étude de Burwell a mis en évidence une dureté supérieure de ceux traités avec le dentifrice contenant la Novamin après 10 jours d’attaque acide par rapport aux échantillons de dentine mordancée et de dentine non mordancée.
Dans l’étude d’Earl, des mesures de l’épaisseur de la couche de surface ont été effectuées après sollicitation mécanique des échantillons dentinaires (brossage à l’aide d’une brosse à dent médium et d’une force de 100g) pendant 5 jours. Elle est plus importante chez le groupe Novamin par rapport au groupe contrôle (eau purifiée). Elle est plus importante à 5 jours qu’à 1 jour chez le groupe Novamin. Cette couche de surface est constituée de micro et nano-cristaux, d’un matériau amorphe (CSPS), de dioxyde de silicium et de titane (provenant des autres composants du dentifrice) et d’hydroxyapatite.
10 Pradeep et Sharma, « Comparison of clinical efficacy of a dentifrice containing calcium sodium phosphosilicate to a
dentifrice containing potassium nitrate and to a placebo on dentinal hypersensitivity: a randomized clinical trial ».
11 Burwell et al., « Novamin and dentin hypersensitivity--in vitro evidence of efficacy ».
12 Earl et al., « Physical and chemical characterization of the surface layers formed on dentin following treatment with a
26
Une section longitudinale des échantillons a permis d’apprécier la profondeur d’obstruction des tubules. La couche protectrice de surface formée à une épaisseur de 1 à 5 µm (3 µm en moyenne). Les sections de 9 et 12 µm ont laissé apparaître certains tubules non obturés. L’analyse chimique a mis en évidence du dioxyde de silicium et de titane au sein de ces tubules, débris provenant du dentifrice, mais aussi la présence de calcium, de phosphate et d’oxygène dont l’origine ne peut être déterminée, ces derniers étant communs au dentifrice, à l’hydroxyapatite et à la dentine.
Les dentifrices contenant de la Novamin à concentration suffisante (5%) résisteraient bien aux sollicitations acides et mécaniques inhérentes à la vie quotidienne. Ils permettraient une obstruction profonde des tubules dentinaires associée à la formation d’une couche protectrice de surface. L’épaisseur de celle-ci augmenterait avec l’utilisation répétée dans le temps du dentifrice.
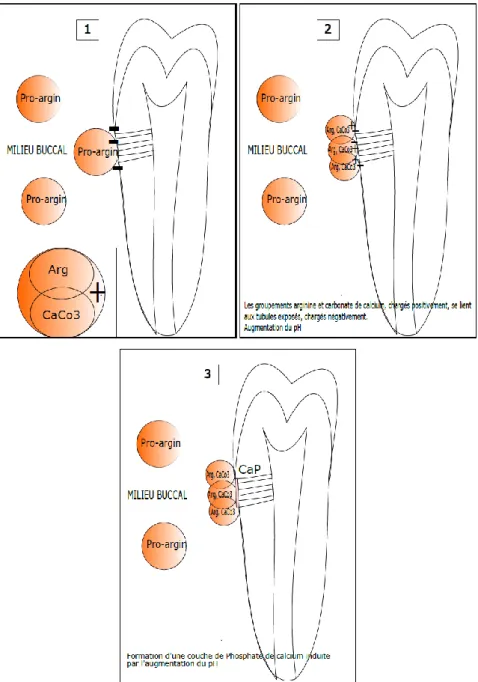
2.2.2 Pro-Argin (Arginine, carbonate de calcium)
2.2.2.1 Mode d’action : oblitération des tubuli
L’arginine est un amino-acide retrouvé dans la salive. Son association avec le carbonate de calcium mime la capacité de la salive à obstruer les canaux dentinaires. L’arginine, soluble, forme un groupement chargé positivement avec les particules insolubles de carbonate de calcium. Celui-ci réalise une liaison avec les tubules dentinaires exposés chargés négativement. Le carbonate de calcium crée un environnement basique ce qui favorise la précipitation des sels de phosphates salivaires au sein des tubules.
27
La figure 9 illustre l’oblitération tubulaire par la technologie Pro-argin
Figure 9 : Oblitération des tubuli par la technologie Pro-argin
28
2.2.2.2 Preuve de l’efficacité significative de la technologie Pro-argin dans le traitement de
l’hyperesthésie dentinaire in vivo (ANNEXE 3)
Kakar et al13 dans une étude contrôlée randomisée datant de 2013, ont conclu à une diminution de
l’HD significativement plus importante à 2, 4 et 8 semaines avec un dentifrice contenant 8% d’arginine, du carbonate de calcium et 1000 ppm de fluor MFP comparé à un dentifrice composé de carbonate de calcium et 1000 ppm de fluor MFP.
Dans une revue systématique de littérature (2013), Sharif et al14 mettent en évidence une diminution
immédiate (et qui se prolonge durant les 8 semaines des études) de l’hypersensibilité dentinaire lors de l’utilisation d’un dentifrice composé de 8% d’arginine, de carbonate de calcium, et de fluor à 1450 ppm de fluor MFP comparé à un dentifrice contenant du carbonate de calcium et 1450 ppm de fluor MFP.
La méta-analyse de Yan et al15 visant à déterminer l’efficacité des formulations contenant 8%
d’arginine, du carbonate de calcium et 1450 ppm par rapport à d’autres principes actifs ou à des produits placebos tend à prouver la supériorité de celui-ci dans le traitement de l’hypersensibilité dentinaire.
2.2.2.3 Preuve de l’efficacité significative de la technologie Pro-argin dans le traitement de
l’hyperesthésie dentinaire in vitro
Dans une étude in vitro, Petrou et al16 ont cherché à déterminer le comportement d’un dentifrice
contenant 8% d’arginine, du carbonate de calcium, et 1450 ppm de MFP.
Une observation au microscope électronique puis atomique a montré la formation d’une couche protectrice de surface associée à une obstruction par pénétration intra-tubulaire (disparition de la structure hélicoïdale collagénique après traitement). L’analyse chimique a révélé la présence de calcium et de phosphate au sein de la couche de surface ; de calcium, de phosphate et de silice au niveau intra-tubulaire. Des particules d’arginine ont été mises en évidence au sein des tubules et de la couche de surface à l’aide d’un microscope confocal à balayage laser.
13 Kakar et al., « Comparison of the clinical efficacy in reducing dentin hypersensitivity of a new dentifrice containing 8.0%
arginine, calcium carbonate, and 1000 ppm sodium monofluorophosphate to a commercially available toothpaste containing 1000 ppm sodium monofluorophosphate: an eight-week clinical trial on adults in new delhi, india ».
14 Sharif, Iram, et Brunton, « Effectiveness of arginine-containing toothpastes in treating dentine hypersensitivity: a
systematic review ».
15 Yan et al., « Arginine-containing toothpastes for dentin hypersensitivity: systematic review and meta-analysis ». 16 Petrou et al., « A breakthrough therapy for dentin hypersensitivity: how dental products containing 8% arginine and
29
La spectrométrie photo-électronique à rayons X a révélé la présence de haute concentration de carbone (néanmoins absent sous forme de carbonate), d’oxygène et de nitrogène et d’un faible niveau de calcium et de phosphate avant application du dentifrice ce qui peut être expliqué par la déminéralisation de la dentine. Après application du produit testé, il a été noté une diminution du niveau de carbone et de nitrogène parallèlement à une augmentation des niveaux de calcium, phosphate et oxygène en rapport avec une reminéralisation. La concentration en silice augmente de façon moindre.
Après une sollicitation acide (échantillon immergé dans du Coca Cola pendant 2 min), les tubules dentinaires se sont révélés totalement obstrués. La sollicitation mécanique (brossage) semble accélérer le phénomène d’obstruction.
Enfin, la diminution persistante de la conductance dentinaire à 7 jours malgré l’application continue d’un flux liquidien permet d’affirmer la résistance du dentifrice au flux dentinaire.
2.2.3 Potassium
2.2.3.1 Mode d’action : interruption de la transmission nerveuse
Son application entraînerait l’augmentation de la concentration extracellulaire de potassium provoquant la dépolarisation nerveuse et inhibant la repolarisation. Il peut être associé au nitrate (nitrate de potassium 5 %), au chlore (chlorure de potassium 3.75%), ou au citrate (citrate de potassium 5.5%). Tous contiennent la même concentration en ions potassium (2%) et agissent selon le même mécanisme. La figure 10 illustre l’action de l’ion potassium sur la transmission nerveuse du message douloureux.
Figure 10 : Inhibition de la transmission nerveuse par l’ion potassium dans le traitement de l’hypersensibilité
30
2.2.3.2 Preuve de l’efficacité significative de l’utilisation de l’ion Potassium dans le
traitement de l’hyperesthésie dentinaire in vivo (ANNEXE 4)
Deux méta-analyses (Karim et al17 - 2013; Poulsen et al18 - 2006) ont été entreprises afin d’évaluer
l’efficacité de l’utilisation de l’ion potassium dans le traitement de l’hypersensibilité dentinaire. Elles ont inclus les mêmes études. Les résultats ont montré une diminution significative de l’HD par rapport à l’utilisation d’un placebo de 2 à 12 semaines pour tous les stimuli (tactile, jet d’air, thermique). Seule la diminution subjective n’a pas révélé de preuve suffisante. Cependant, le nombre faible d’individus inclus ainsi que la variabilité des protocoles limitent les conclusions qui peuvent être tirées.
Prasad et al19, dans une étude contrôlée randomisée de 2010, comparent l’efficacité de l’utilisation
d’un dentifrice contenant du citrate de potassium à un dentifrice sans propriété désensibilisante (Colgate Total) dans le traitement de la sensibilité dentinaire. Si le dentifrice au citrate de potassium a apporté une réduction supérieure au placebo lors des tests thermoélectriques, cela n’a pas été le cas lors des tests tactiles. Il en résulte une preuve insuffisante pour affirmer le bien-fondé de l’utilisation des formulations contenant l’ion potassium chez le patient atteint d’hypersensibilité dentinaire pour cette étude.
2.2.3.3 Preuve de l’efficacité significative de l’utilisation de l’ion Potassium dans le
traitement de l’hyperesthésie dentinaire in vitro
Les dentifrices à base de potassium (strontium ou chlorure) utilisés dans le traitement de l’hypersensibilité dentaire inhibent la repolarisation nerveuse et donc la transmission de l’influx douloureux. Les paramètres tels que la mesure de l’obstruction tubulaire, de la perméabilité dentinaire ou encore de la dureté de surface sont donc insuffisants pour juger de la pertinence de leur utilisation dans le traitement de l’hypersensibilité dentinaire.
Des études in vitro mesurant ces paramètres ont néanmoins étaient menées. Bien qu’une obstruction partielle des tubules dentinaires et une diminution de la perméabilité aient été constatées in vitro après 7 jours de brossage biquotidien à l’aide de dentifrice contenant du
17 Karim et Gillam, « The efficacy of strontium and potassium toothpastes in treating dentine hypersensitivity: a systematic
review ».
18 Poulsen et al., « Potassium containing toothpastes for dentine hypersensitivity ».
31
potassium, ces derniers se sont révélés très rapidement non obstrués après exposition à un milieu acide 20.
2.2.4 Acétate de strontium
2.2.4.1 Mode d’action : Oblitération des tubuli
Le strontium peut être absorbé par l’émail et la dentine en raison de sa composition chimique proche du calcium. Il se substitue au calcium au sein de la couche d’apatite créant ainsi une couche de strontium apatite.
La figure 11 illustre l’oblitération des tubuli par l’acétate de strontium.
Figure 11 : Oblitération des tubuli par l’acétate de strontium
Source : Auteur
2.2.4.2 Preuve de l’efficacité significative de l’utilisation de l’acétate de strontium dans le
traitement de l’hyperesthésie dentinaire in vivo (ANNEXE 5)
L’étude de Li et al21 a comparé la diminution de L’HD après utilisation de dentifrices contenant 8%
d’arginine, de carbonate de calcium et 1450 ppm de fluor MFP ; 8% d’acétate de strontium, 1040
20 Wang et al., « Nerve-targeted desensitizing toothpastes occlude dentin tubules and induce mineral precipitation ». 21 Li et al., « Comparison of clinical efficacy of three toothpastes in reducing dentin hypersensitivity ».
32
ppm NaF ; 1100 ppm NaF immédiatement et à 7 jours. Aucune différence significative n’a été démontrée entre le dentifrice à base d’acétate de strontium et le dentifrice contrôle.
La méta-analyse de Karim et al22 a été menée afin de mettre en évidence l’efficacité significative de
l’utilisation des dentifrices à base de strontium (chlorure et acétate) dans le traitement de l’hypersensibilité dentinaire. Une seule étude a été retenue. Il en résulte une preuve insuffisante pour conclure à l’efficacité supérieure du strontium par rapport à un placebo dans le traitement de l’HD.
Dans une revue systématique de littérature (2015), Bae et al23 confirment la diminution de
l’hypersensibilité dentinaire lors de l’utilisation de dentifrices constitués d’arginine, de fluor, de potassium, de fluorure stanneux ; à l’exception du strontium pour lequel aucune efficacité significative n’a été mise en évidence.
2.2.4.3 Preuve de l’efficacité significative de l’utilisation de l’acétate de strontium dans le
traitement de l’hyperesthésie dentinaire in vitro
Saeki et al24 ont cherché à déterminer in vitro les propriétés mécaniques et le pourcentage
d’obstruction tubulaires d’une dentine mordancée ou non après exposition à l’acétate de strontium (en solution ou à l’aide d’un dentifrice).
Une dentine mordancée et brossée avec une pâte d’acétate de strontium présente un module d’élasticité (et donc une rigidité) et une obstruction tubulaire supérieurs à une dentine mordancée brossée avec de l’eau déminéralisée. Aucune différence significative de dureté n’est constatée. Lorsque la dentine est trempée dans une solution d’acétate de strontium, l’échantillon a un module d’élasticité inférieur à un échantillon trempé dans l’eau. La différence de module d’élasticité entre la dentine trempée ou brossée peut être expliquée par l’élimination mécanique de la couche de surface déminéralisée lors du brossage. Cette action mécanique est absente lors de l’immersion seule. En présence d’une dentine non mordancée, l’occlusion des tubules, le module d’élasticité (uniquement à 14 jours) et la dureté des sections dentinaires traitées avec l’acétate de strontium sont supérieurs à celles traitées à l’eau déminéralisée.
22 Karim et Gillam, « The efficacy of strontium and potassium toothpastes in treating dentine hypersensitivity: a systematic
review ».
23 Bae, Kim, et Myung, « Desensitizing toothpaste versus placebo for dentin hypersensitivity: a systematic review and
meta-analysis ».
33
La figure 12 représente la dentine radiculaire observée au microscope après 28 jours de traitement. L’échantillon A est traité avec une pâte à 10% d’acétate de strontium, l’échantillon B avec de l’eau déminéralisée. C et D ont été mordancés préalablement (1% d’acide citrique pendant 2 minutes). C a été traité avec la pâte à 10% d’acétate de strontium et D avec l’eau déminéralisée.
Figure 12: Images topographiques de dentine radiculaire observée au microscope à force atomique.
Source : Saeki et al, «Strontium effects on root dentin tubule occlusion and nanomechanical properties», 2016
Au microscope à force atomique, les échantillons traités à l’eau déminéralisée montrent une absence de dépôts et des tubules dentinaires béants. Ceux traités avec un brossage à l’acétate de strontium présentent une diminution du diamètre des tubules ainsi que la présence de dépôts de surface. La figure 13 présente des coupes radiculaires de dentine vues au microscope à force atomique après 14 jours de traitement. Les échantillons ont été traités préalablement avec une solution à 1% d’acide citrique. A a été trempé dans une solution à 10% d’acétate de strontium, B a été brossé avec une pâte dentifrice à 10% d’acétate de strontium.
Figure 13 : Comparaison de l’oblitération tubulaire en fonction du mode de délivrance du principe actif : pâte dentifrice ou solution.
34
Lorsque les sections ont été trempées dans la solution, des dépôts sont constatés à la surface sans reminéralisation intra-tubulaire. En effet, le brossage permet une pénétration en profondeur des particules de strontium et une meilleure adhésion à la dentine. Au contraire, la solution sature rapidement l’environnement en ions strontium inhibant les interactions ultérieures entre la dentine et ces derniers.
Les images de microscopie électronique et les analyses de spectroscopie à rayons X sont présentées en figure 14. Les échantillons dentinaires ont été brossés pendant 7 jours et stockés en milieu humide. L’analyse de spectroscopie confirme la présence de strontium entre 20 et 30 µm de la surface, les particules étant présentes au sein des tubules dentinaires.
Figure 14 : Images de microscopie électronique et résultats des analyses de spectroscopie à rayons X.
35
2.2.5 Fluorure d’étain stabilisé ou fluorure stanneux
2.2.5.1 Mode d’action : Oblitération des tubuli
Le fluorure d’étain permet la formation d’une couche de fluorophosphate d’étain à la surface de la dentine exposée, limitant les mouvements de fluides dentinaires et ainsi le phénomène d’HD. Longtemps délaissé en raison de son astringence, de son goût désagréable et de l’éventuelle apparition de colorations extrinsèques, des formulations contenant du fluorure stanneux stabilisé ont été mises sur le marché.
La figure 15 schématise l’oblitération tubulaire par le fluorure d’étain.
Figure 15 : Oblitération des tubuli par le fluorure d’étain
Source : Auteur
2.2.5.2 Preuve de l’efficacité significative de l’utilisation du fluorure stanneux stabilisé dans
le traitement de l’hyperesthésie dentinaire in vivo (ANNEXE 6)
Schiff et al25, dans deux études contrôlées randomisées en 2005 et 2006, concluent à l’efficacité d’un
traitement à 0.454% de fluorure stanneux par rapport à un traitement avec un dentifrice au fluorure de sodium à 4 et 8 semaines dans la réduction de la sensibilité dentaire.
25 Schiff et al., « Desensitizing effect of a stabilized stannous fluoride/sodium hexametaphosphate dentifrice »; Schiff et al.,
« Efficacy and safety of a novel stabilized stannous fluoride and sodium hexametaphosphate dentifrice for dentinal hypersensitivity ».