Changements morphologiques et physiologiques en
lien avec la capacité de nage chez les pétoncles
Thèse
Isabelle Tremblay
Doctorat en Biologie
Philosophae Doctor (Ph.D.)
Québec, Canada
© Isabelle Tremblay, 2014
iii
Résumé
Le système locomoteur relativement simple du pétoncle en fait un modèle animal idéal pour étudier les liens entre la performance locomotrice et les différentes composantes du système locomoteur. Cinq espèces de pétoncles (Amusuim balloti, Placopecten magellanicus, Pecten fumatus, Mimachalmys asperrima, Crassadoma gigantea), présentant une morphologie de la coquille et un comportement de nage variés, ont été comparées au niveau du comportement de nage, des capacités métaboliques du muscle adducteur, des propriétés mécaniques du ligament et de la morphologie de la coquille et du muscle adducteur. Les mesures de force lors d’une réponse de fuite simulée ont révélé que l’utilisation des deux parties du muscle adducteur varie grandement entre les espèces et varie aussi avec la morphologie de la coquille et le mode de vie. Ainsi, les pétoncles avec une coquille hydrodynamique utilisent principalement les contractions phasiques alors que les pétoncles avec une coquille de forme plutôt désavantageuse pour la nage utilisent majoritairement les contractions toniques. Aussi, le patron d’utilisation des deux parties du muscle peut être modifié afin de compenser pour une coquille de forme désavantageuse pour la nage. Les capacités métaboliques du muscle adducteur phasique reflètent le patron d’utilisation du muscle des différentes espèces. La résilience du ligament des pétoncles varie entre les espèces avec P. fumatus ayant la résilience la plus élevée. Les caractéristiques morphologiques de la coquille et du muscle adducteur diffèrent entre les espèces étudiées, mais ne reflètent pas toujours la stratégie de nage. Les analyses en composantes principales ont révélé que l’épaisseur et la masse de la coquille, la masse du muscle adducteur et les attributs morphologiques apparentés, sont étroitement liés à l’endurance de la réponse de fuite. L’intensité de cette réponse est, quant à elle, principalement prédite par l’allongement de la coquille et l’oblicité du muscle adducteur. Les liens fonctionnels et évolutifs entre la performance locomotrice et les différentes composantes du système locomoteur sont le résultat de compromis imposés par le style de vie, le type d’environnement et de prédateurs où évolue le pétoncle. Chez les pétoncles, il est important d’intégrer les différents niveaux d’organisation de l’animal car bien souvent la forme ne révèle pas tout.
v
Abstract
Due to the relative simplicity of its locomotor system, scallops are ideal for studying the links between the locomotory performance and the various components of its system. The swimming behaviour, adductor muscle metabolic capacities, and ligament properties as well as the morphology of the shell and the adductor muscle of five scallop species (Amusuim balloti, Placopecten magellanicus, Pecten fumatus, Mimachalmys asperrima, Crassadoma gigantea), each with different shell morphology and swimming behaviour, were compared. Force recording measurements during a simulated escape response revealed that the utilisation of the two parts of the adductor muscle varies markedly between the species and also varies with the shell morphology and the lifestyle of the scallop. Thus, scallop species with hydrodynamic shell shape tend to use mainly phasic contractions, while species with shell shape disadvantageous for swimming rely mostly upon tonic contractions. Also, the use of phasic and tonic muscle can be a way for scallops to compensate for a disadvantageous shell shape. The metabolic capacities of the phasic adductor muscle reflect the muscle use in the different species. The ligament resilience varied between the species, with Pecten fumatus having the highest resilience. Morphological characteristics of the shell and the adductor muscle vary between the scallop species, but do not always reflect the swimming strategy. Principal component analysis revealed that the width and mass of the shell, muscle mass and related morphological attributes, were closely linked with swimming endurance. Swimming intensity was best predicted by the aspect ratio and the obliqueness of the adductor muscle. Functional and evolutive links between locomotor performance and the various components of the locomotor system are the result of compromises imposed by the scallop life style, the type of habitat and predators present where the scallop evolves. It is important to consider and integrate the various level of organisation, as often the form does not reveal everything in scallops.
vii
Table des matières
Résumé ... iii
Abstract ... v
Table des matières ... vii
Liste des figures ... xv
Remerciements ... xxiii
Avant-propos ... xxvii
CHAPITRE 1 ... 1
Introduction générale ... 1
1. Déterminants de la performance locomotrice ... 3
1.1 Le muscle ... 3
1.2 Métabolisme musculaire ... 6
1.3 Facteurs affectant la performance locomotrice ... 9
2. Forme et fonction au niveau de la locomotion ... 10
3. Les pétoncles ... 12
3.1. Origine de la nage chez les pétoncles... 13
3.2 Évolution des modes de vie des pétoncles ... 14
3.3 Locomotion chez les pétoncles ... 14
4. Les composantes du système locomoteur ... 19
4.1 Le muscle adducteur ... 19
4.2. Le ligament ... 21
4.3. La coquille ... 24
5. Support métabolique de la nage ... 25
6. Facteurs influençant la nage des pétoncles ... 28
6.1 Forces agissant sur le pétoncle ... 28
6.2 Composantes morphologiques affectant la nage ... 30
6.3 Composantes physiologiques affectant la nage ... 32
6.4 Facteurs environnementaux affectant la nage ... 33
7. Biomécanique de la nage ... 34
8. Caractérisation de la réponse de fuite des pétoncles ... 35
9. Objectifs de la thèse ... 39
viii
Swimming away or clamming up: the use of phasic and tonic adductor muscles during escape
responses varies with shell morphology in scallops ... 41
Résumé ... 42
Abstract ... 43
Introduction ... 44
Material and methods ... 49
Scallop sampling and experimental conditions ... 49
Experimental design and force recordings ... 50
Data recordings and analysis ... 52
Anatomical and morphological measurements ... 54
Statistical analysis ... 56
Results ... 56
Shell and anatomical characteristics ... 56
Escape response recordings ... 58
Interspecific comparisons: phasic contractions ... 58
Interspecific comparisons: tonic contractions ... 61
Discussion ... 63
Eco-morphological classification versus phasic and tonic contractions... 64
Initiation of prolonged tonic contractions: metabolic fatigue or energy saving? ... 64
Habitat temperature and escape response patterns ... 67
Potential influence of ontogenetic changes on escape responses ... 67
Links between shell morphology, lifestyle and escape response behaviour ... 69
Acknowledgements ... 72
Funding... 72
CHAPITRE 3 ... 75
Scallops show that muscle metabolic capacities reflect locomotor style and morphology ... 75
Résumé ... 76
Abstract ... 77
Introduction ... 78
Materials and methods... 82
Sampling and maintenance of the scallops ... 82
ix
Anatomic and morphological measurements ... 84
Muscle protein fractions ... 84
Phosphoarginine concentrations ... 85 Enzyme assays ... 85 Myosin ATPase ... 87 Chemicals ... 88 Statistical analysis ... 88 Results ... 88
Anatomical characteristics of the experimental scallops ... 88
Phasic muscle protein concentrations ... 90
Phasic muscle phosphoarginine content ... 91
Phasic muscle enzyme activities ... 91
Myosin ATPase ... 94
Discussion ... 96
Interspecific differences in phosphoarginine levels and patterns of muscle use ... 97
Interspecific differences in enzyme activities and patterns of muscle use ... 98
Interspecific difference of myosin ATPase activity and patterns of muscle use ... 101
Potential effects of ontogenetic change on metabolic capacities ... 102
Biochemical attributes, behaviour and morphology ... 103
Acknowledgements ... 105
CHAPITRE 4 ... 107
When behaviour and mechanics meet: Scallop swimming capacities and their hinge ligament .... 107
Résumé ... 108
Abstract ... 109
Introduction ... 110
Material and methods ... 112
Experimental scallops: shell and behavioural characteristics ... 112
Muscle force measurements ... 114
Experimental setup and measurement of ligament resilience ... 116
Statistical analysis ... 116
Results ... 119
x
Hysteresis loops and muscle force production ... 119
Discussion ... 120
Acknowledgements ... 127
CHAPITRE 5 ... 129
Can scallop swimming styles be predicted from shell and adductor muscle morphology? ... 129
Résumé ... 130
Abstract ... 131
Introduction ... 132
Material and methods ... 135
Experimental scallops ... 135
Sinking test ... 135
Morphological measurements ... 136
Adductor muscle measurements ... 139
Statistical analysis ... 140
Results ... 141
Shell characteristics ... 142
Sinking test ... 142
Muscle morphology ... 142
Proportions of tonic and phasic adductor muscle ... 146
Muscle obliqueness: adductor muscle impression on left versus right valves ... 146
Muscle obliqueness: muscle position on right and left valves ... 150
Principal component analysis (PCA) of scallop morphology and behaviour ... 150
Discussion ... 157
Links between morphology and behaviour ... 157
Shell characteristics ... 159
Muscle and body morphology ... 160
Acknowledgements ... 163
CHAPITRE 6 ... 165
Discussion générale ... 165
Rappel des grandes lignes de l’étude... 166
À chacun sa combinaison… ... 168
xi
Même morphologie de la coquille, mêmes adaptations? ... 173 Bibliographie ... 175
xiii
Liste des tableaux
Tableau 1.1. Propriétés des fibres musculaires squelettiques phasiques chez les
mammifères (Modifié à partir de Hill et al. 2008) ... 7
Tableau 1.2. Principaux modes de vie chez les pétoncles (Modifié à partir d’Alejandrino et al. 2011) ... 15
Table 2.1. Shell and anatomical characteristics of experimental scallops. ... 57
Table 2.2. Behavioural parameters related to phasic contractions during escape responses by the different scallop species. ... 60
Table 3.1. Morphological characteristics, water content and condition index of experimental scallops. ... 89
Table 3.2. Phasic adductor muscle enzyme activities in different scallop and oyster species.. ... 100
Appendix 3.1 Regressions between shell height and phasic adductor mass of the scallops in the behavioural studies used to estimate the phasic adductor muscle mass of the scallops of the biochemical assays. ... 106
Table 4.1. Shell and adductor muscle characteristics of the experimental scallops and parameters related to muscle contractile activity during escape responses. ... 113
Table 4.2. Forces measured in experimental scallops. ... 115
Table 4.3. Correlations between ligament resilience and phasic contractile activity during escape responses by the experimental scallop species ... 122
Table 5.1. Shell and morphological characteristics of experimental scallops. ... 143
Table 5.2. Sinking time adjusted for 90 mm shell height ... 144
xv
Liste des figures
Figure 1.1. Molécule de myosine (Modifié à partir de Geeves 1991). ... 4 Figure 1.2. Évolution dans le temps de la contribution des différentes sources d’énergie
pendant l’activité musculaire (Modifié à partir de Berg et al. 2002) ... 9
Figure 1.3. Schémas représentant le mécanisme de la nage chez les pétoncles. A) Vue du
dessus. B) Vue latérale ... 17
Figure 1.4. Exemple de données recueillies lors des deux premiers claps chez Chlamys
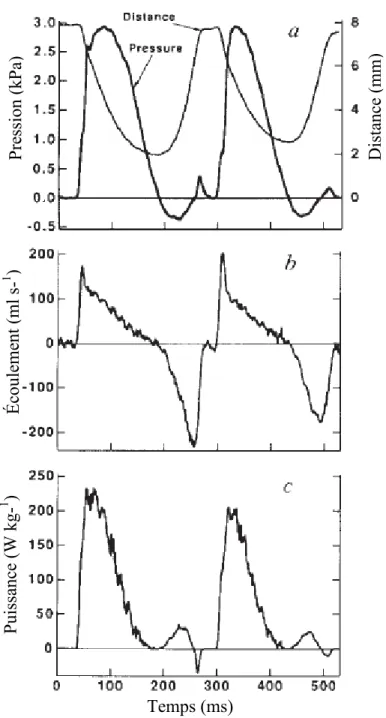
hastata. A) Pression dans la cavité du manteau et distance entre les valves (distance mesurée près de la bordure des valves au niveau du muscle adducteur). B) Taux d’écoulement de l’eau vers l’extrérieur de la cavité du manteau. C) Puissance mécanique calculée en prenant le produit de la pression (Pa) et du taux d’écoulement (m3 s-1) divisé par la masse (kg) du muscle adducteur phasique. (Fig. 1 de Marsh et al. 1992). ... 18
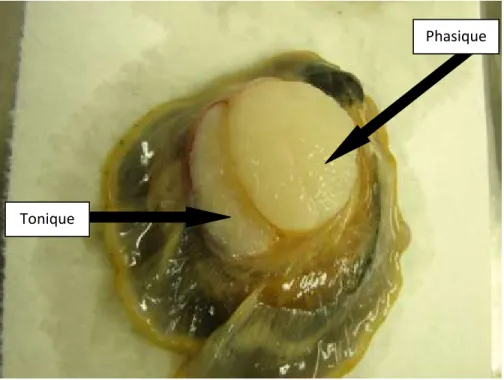
Figure 1.5. Partie phasique et tonique du muscle adducteur chez Pecten fumatus (Photo :
Isabelle Tremblay) ... 19
Figure 1.6. Intérieur de la région dorsale de la valve gauche, chez Amusium balloti,
montrant le ligament en coupe longitudinale. Échelle en centimètres (Photo : Isabelle Tremblay). B) Diagramme de la section transversale du ligament de Chlamys opercularis montrant le ligament externe ainsi que la région centrale et les régions latérales du ligament interne (Modifié à partir de Trueman 1953a). ... 22
Figure 1.7. Valve supérieure d’un pétoncle (Placopecten magellanicus). La ligne pleine
correspond à la hauteur tandis que la ligne pointillée correspond à la longueur. L’allongement de la coquille correspond à la longueur de la valve au carré/l’aire de la valve (Dadswell and Weihs 1990); (Photo : Isabelle Tremblay). ... 25
Figure 1.8. Principales voies de production d’énergie chez le pétoncle ... 26 Figure 1.9. Forces agissant sur le pétoncle dans la colonne d’eau (Modifié à partir de
Gould 1971). ... 29
Figure 1.10. Haut: Dynamomètre utilisé pour l’enregistrement des mesures de force
(Pecten fumatus). Bas: Pétoncle (Pecten fumatus) avec la valve inférieure attachée au fond du basin, rempli d’eau salée, et avec un levier, attaché au dynamomètre, inséré sous la valve supérieure (Photos : Isabelle Tremblay). ... 37
Figure 1.11. Production de force du muscle phasique et tonique lors d’une réponse de fuite
xvi
Figure 2.1. Upper valve and side view of experimental scallops. (A) Amusium balloti, (B)
Placopecten magellanicus, (C) Pecten fumatus, (D) Mimachlamys asperrima and (E) Crassadoma gigantea. Scale bar is 1cm. ... 48
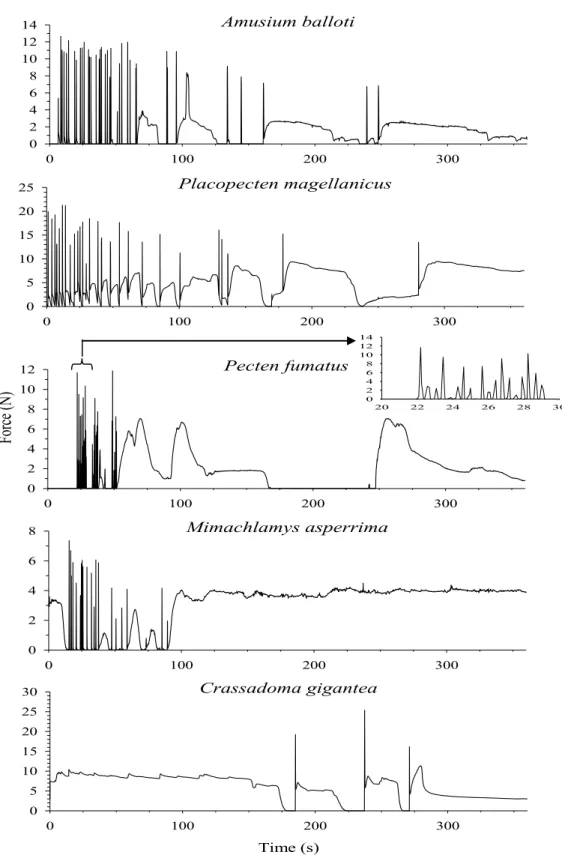
Figure 2.2. Typical force recording during an escape response for each experimental
scallop species: (A) A. balloti, (B) P. magellanicus, (C) P. fumatus, (D) M. asperrima and (E) C. gigantea. Sharp peaks correspond to phasic contractions whereas sustained force production indicates tonic contractions. ... 53
Figure 2.3. Shell dimensions. A) Solid line corresponds to shell height and dashed line is
shell length. B) Solid line corresponds to shell width. ... 55
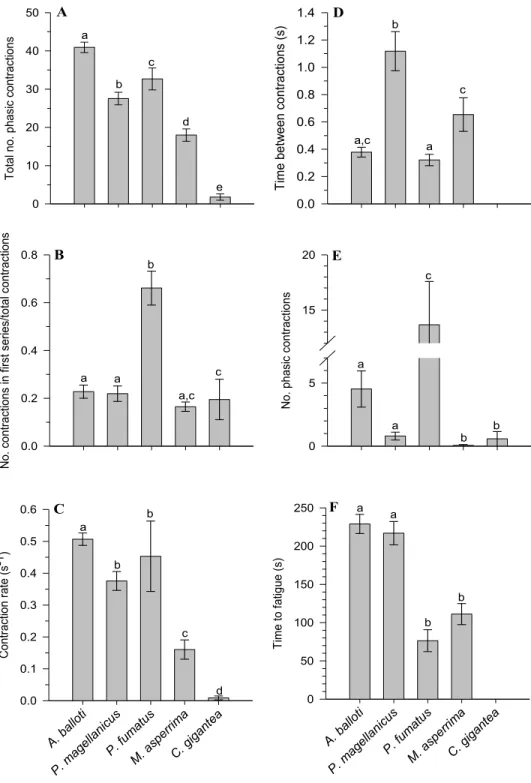
Figure 2.4. Escape response parameters related to phasic contractions. (A) Total number of
phasic contractions. (B) Total number of phasic contractions during the first series relative to the total number of phasic contractions. (C) Contraction rate during the first 30 s. (D) Minimum interval between two phasic contractions. (E) Number of phasic contractions before the first tonic contraction. (F) Time to fatigue. Data are means ± S.E. Different letters indicate significant differences (Kruskall-Wallis and multiple comparisons, P<0.05). Sample size: A. balloti N=30, P. magellanicus N=15, P. fumatus N=15, M. asperrima N=16, C. gigantea N=19 ... 59
Figure 2.5. Escape response parameters related to tonic contractions. (A) Total number of
tonic contractions. (B) Mean duration of tonic contractions. (C) Total number of phasic contractions relative to the total number of tonic contractions. (D) Time at the first tonic contraction. (E) Percentage of time spent in tonic contractions. (F) Number of tonic contractions of a duration of 5 s or more. Data are means ± S.E. Different letters indicate significant differences (Kruskall-Wallis and multiple comparisons, P<0.05). Sample size: A. balloti N=30, P. magellanicus N=15, P. fumatus N=15, M. asperrima N=16, C. gigantea N=19. ... 62
Appendix 2.1. Top: Force gauge used for monitoring the muscle force in intact scallops
(commercial scallop, Pecten fumatus, shown below). Bottom: Scallop (Pecten fumatus) with its lower valve attached to the bottom of the tank and the lever, attached to the force gauge, placed under the upper valve ... 73
Figure 3.1. Behavioural parameters and side view of experimental scallops. Data are
means ± S.E. Sample size: A. balloti N=30, P. magellanicus N=15, P. fumatus N=15, M. asperrima N=16, C. gigantea N=19. Scale bar is 1 cm. ... 81
Figure 3.2. Concentration of phosphoarginine (µmol P-Arg ∙ g-1 muscle wet mass) in the phasic adductor muscle. Means ± S.E. (N=10-23). Means with different letters are significantly different (P<0.05), as indicated by Kruskall-Wallis and a posteriori multiple comparison tests. ... 92
xvii
Figure 3.3. Enzymatic activities (U ∙ g-1 phasic muscle wet mass) in the phasic adductor muscle measured at 18°C. Values represent means ± S.E. (N=7-10 for AK and N=14-22 for others). Means with different letters are significantly different (P<0.05), as indicated by Kruskall-Wallis and multiple comparison tests. ... 93
Figure 3.4. Activity of the myosin ATPase (U ∙ mg-1 protein) in the phasic adductor muscle measured at 18°C. Values represent means ± S.E. (N=9-20). Means with different letters are significantly different (P<0.05), as indicated by Kruskall-Wallis and multiple comparison tests. ... 95
Figure 4.1. Interior of the dorsal region of the left valve of Amusium balloti showing the
ligament cut in longitudinal section. Scale is in cm. ... 110
Figure 4.2. Experimental setup for the ligament resilience. Emptied shell placed on a fixed
base, with an adjacent ruler, under the force gauge used to apply the force on the upper shell of the scallop ... 117
Figure 4.3. Typical hysteresis loops, for each experimental species, obtained by plotting
the force applied on the shell (the proxy for the ligament opening force) on the distance between the two valves. Black circles correspond to the loading curve and empty circles to the unloading curve ... 118
Figure 4.4. Ligament resilience in experimental scallop species. Data are means ± S.E.
Bars with different letters are statistically different as indicated by Kruskall-Wallis and multiple comparisons test (P<0.05). Sample size is A. balloti N=30, P. magellanicus N=15, E. bifrons N=20, P. fumatus N=15, M. asperrima N=15, C. gigantea N=16 ... 121
Figure 4.5. The ligament resilience plotted against A) the number of phasic contractions
during the first series (y=0.76+0.011x-0.0002x2, R2=0.27) and B) the phasic contraction rate during the first 30 s of the escape response for each species (y=0.75+0.23x-0.06x2, R2=0.25). Sample size is A. balloti N=30, P. magellanicus N=15, P. fumatus N=15, M. asperrima N=16. ... 123
Figure 5.1. A) Shell dimensions. Full line corresponds to shell height and dash line is shell
length on the left image and width on the right image. B) Side view of experimental scallops. Scale is 1cm ... 137
Figure 5.2. A) Phasic and tonic muscle impressions retraced on the inside of the scallop
valves. B) Diagram representing the various measurements taken to determine the position of the phasic and tonic adductor muscle. Valve on the left represents the left or upper valve, whilst the one on the right represents the right or lower valve. (B: From Soemodihardjo 1974) ... 138
Figure 5.3. Typical phasic (gray) and tonic (black) adductor muscle impressions on left (L)
and right (R) valves in experimental scallops. Arrowed line corresponds to scale: 20 mm for all species. ... 147
xviii
Figure 5.4. Percentage of tonic adductor muscle calculated from the muscle impression on
the right valve. Mean±S.E. Kruskall-Wallis and multiple comparisons (P<0.05). Sample size A. balloti N=30, P. magellanicus N=15, E. bifrons N=20, P. fumatus N=15, M. asperrima N=14, C. gigantea N=15, C. gigas N=13. ... 148
Figure 5.5. Ratio of the area of the muscle impression on left valve relative to area of the
muscle impression on right valve. Mean±S.E. Different letters indicate significant differences (Kruskall-Wallis and multiple comparisons, P<0.05). Lower case letters refers to phasic muscle while capital letters refer to tonic muscle. The dashed line indicates when the areas on the left and right valves are the same size. Ratios significantly different than unity are identified by a star (Wilcoxon signed-rank test,
P<0.05). Sample size A. balloti N=30, P. magellanicus N=15, E. bifrons N=19, P. fumatus N=15, M. asperrima N=14, C. gigantea N=16, C. gigas N=12 ... 149
Figure 5.6. Scallop adductor muscle obliqueness. Obliqueness is the ratio of the
dorso-ventral position of the adductor muscle on the left valve to that on the right valve. Mean±S.E. Different letters indicate significant differences (Kruskall-Wallis and multiple comparisons, P<0.05). Lower case letters refers to phasic muscle while capital letters refer to tonic muscle. The dashed line indicates when the ratio is equal to unity, that is when the insertion of the muscle on the right valve is closer to the hinge. Ratios significantly different than unity are identified by a star (Wilcoxon signed-rank test, P<0.05). Sample size A. balloti N=30, P. magellanicus N=15, E. bifrons N=9, P. fumatus N=15, M. asperrima N=14, C. gigantea N=14, C. gigas N=11 ... 151
Figure 5.7. The normalised scores for the morphological variables associated with the first 3 principal components. Black bars identify variables assigned to each component. The percentages indicate the proportion of variance explained by the principal component..
... 152
Figure 5.8. Scores for each scallop species for each principal component from the PCA.
The boundary of the box closest to zero indicates the 25th percentile and the boundary of the box farthest from zero indicates the 75th percentile. The full line within the box marks the median, while the dashed line marks the mean. Whiskers (error bars) above and below the box indicate the 90th and 10th percentiles. Open circles are outlying data. ANOVA and multiple comparisons, P<0.05. Sample size: A. balloti N=30, P. magellanicus N=15, P. fumatus N=15, M. asperrima N=16, C. gigantea N=19 ... 154
Figure 5.9. Normalised scores of the behavioural variables associated with the first 2 principal components. Black bars identify variables assigned to each component. The percentages indicate the proportion of variance explained by the principal component
xix
Figure 5.10. Scores for the two behavioural principal components from the PCA of our
behavioural data (Tremblay et al. 2012). The boundary of the box closest to zero indicates the 25th percentile and the boundary of the box farthest from zero indicates the 75th percentile. The full line within the box marks the median, while the dashed line marks the mean. Whiskers (error bars) above and below the box indicate the 90th and 10th percentiles. Open circles are outlying data. ANOVA and multiple comparisons, P<0.05. Sample size: A. balloti N=30, P. magellanicus N=15, P. fumatus N=15, M. asperrima N=16, C. gigantea N=18 ... 156
xxi À ma famille qui a toujours été là pour moi À mes neveux Florian et Christophe, mes petits soleils
xxiii
Remerciements
Cette thèse de doctorat a commencé bien avant que le premier mot fut écrit sur ce document. Ainsi, c’est un gros chapitre de ma vie qui arrive maintenant à sa fin. Au cours de toutes ces années pendant lesquelles j’ai mené à terme ce projet, beaucoups de gens ont contribué chacun à leur façon.
Premièrement ma directrice, Dr Helga E. Guderley, qui a cru en moi dès mes tout débuts en recherche (c’était à l’automne 2001). Merci Helga pour la confiance que tu as en moi et en mes capacités. Je suis très reconnaissante envers toi de m’avoir offert ce projet de doctorat et de m’avoir aidée à le réaliser… c’était un projet avec son lot de défis, mais je n’aurais pas pu rêver de meilleur projet. Merci aussi pour m’avoir guidée tout au cours de mon cheminement et de m’avoir aussi appris à trouver un équilibre entre la vie professionnielle et la vie personnelle.
Merci à mon co-directeur, Dr John H. Himmelman, dont la rigueur scientifique a permis d’améliorer mes travaux de recherches et manuscrits.
Merci aux membres de mon jury de thèse (Dr Jacques Larochelle, Dr Nadia Aubin-Horth et Dr Sandra E. Shumway) d’avoir accepté de lire et d’évaluer ma thèse de doctorat.
Cette thèse de doctorat est le résultat d’une étude comparative qui a nécessité l’échantillonnage de plusieurs espèces dans divers pays à travers le monde. Sans l’aide et la collaboration de plusieurs personnes et centres de recherches, il m’aurait été impossible de réaliser ce projet.
Merci à Paul Palmer, Tim Lucas, Satoshi Mikami et Sizhong (Joe) Wang du Bribie Island Aquaculture Research Centre (Bribie Island, Queensland, Australie) pour m’avoir accueillie et permis d’utiliser les installations du centre de recherche pour faire mes expériences. Merci aussi au Dr. Peter F. Duncan, qui était affilié à University of the Sunshine Coast (Mooloolaba, Queensland, Australie) au moment de mon séjour en Australie, de m’avoir aidée à me procurer les pétoncles pour mes expériences en plus d’avoir contribué à l’organisation de mon séjour et de la collaboration avec le BIARC.
xxiv
Merci à Julian Harrington, Dr Craig Mundy et à toute l’équipe du Tasmanian Aquaculture and Fisheries Institute (Hobart, Tasmanie, Australie) pour leur précieuse aide lors de la collecte des pétoncles, la réalisation de mes expériences à leur centre de recherche et aussi pour m’avoir acceuillie chaleureusement pendant mon séjour là-bas.
Merci à Bruno Myrand, Madeleine Nadeau et toute l’équipe du MAPAQ aux Îles-de-la-Madeleine (Québec, Canada) qui m’ont permis d’utiliser leurs installations pour la réalisation de mes expériences là-bas. Merci à Mélanie Bourgeois, de CultiMer, qui a fourni les pétoncles.
Merci à Brian Kingzett et à toute l’équipe du Centre for Shellfish Research (Nanaimo, Vancouver Island, Canada) : sans leur aide et collaboration il m’aurait été impossible de faire le travail avec C. gigantea (ce pétoncle si particulier).
Finalement, un merci particulier à un groupe de personnes bien particulier : The International Pectinid Workshop. C’est grâce aux collaborations et amitiés développées au fil des années avec les gens participants à ce Workshop que j’ai pu réaliser toutes les étapes de mon projet de doctorat. Que ce soit via des contacts, conseils, informations ou encouragements, vous avez tous contribué à la réalisation de ce projet.
Quand j’ai commencé mon doctorat, il y avait un labo avec des gens : Orlane Rossignol, Hernan Mauricio Cortes-Pérez et Nicolas Martin. On était un petit groupe, mais on était bien ensemble. Puis, Helga et John ont pris leur retraite et sont déménagés à Boutillier Point. Ensuite, chacun est parti à tour de rôle jusqu’au moment où j’étais la seule qui restait au labo. C’est à ce moment que j’ai demandé à Helga de me trouver un coin à Dalhousie University où je pourrais terminer d’écrire ma thèse. Je suis très reconnaissante envers le Dr Brian Hall qui m’a gentiment accueillie dans son labo. Merci au gens du labo : Zabrina, Andrew et Kate (ainsi que leurs enfants Freya et Archie). Graduellement, je me suis fait une vie à Halifax et je me retrouve maintenant enourée de gens que j’apprécie beaucoup à l’Université (Joana, Jantina, Gordon, Mike, Zoé, Lauren) et à l’extérieur de l’Université aussi (Arnold, Emma et Jordon).
Enfin, merci à Myriam Samson-Dô qui a fait l’analyse des données du ligament au chapitre 4 dans le cadre de son initiation à la recherche qu’elle a acceptée de faire avec moi.
xxv Je ne peux pas passer sous silence mes ami(e)s qui font partie de ma vie, même si nous ne sommes pas toujours capables de nous voir sur une base régulière. Chacun à votre façon vous contribuez à enrichir ma vie. Je sais que parfois le temps et la distance nous empêchent d’être ensemble aussi souvent qu’on le voudrait, mais tout cela ne change en rien le lien qui nous unit : Joëlle, Gisèle, Marie-Ève, Nikki, Marianne, Perrine, Gaëlle, Maël et William. Une pensée toute spéciale pour Peter qui est toujours là au fil des années.
Finalement et non le moindre, il y a ma famille. Tout premièrement, il y a mes parents qui m’ont toujours soutenue et encouragée dans tous mes rêves et projets même si cela était parfois difficile pour eux. Je leur dois beaucoup et je les remercie pour tout l’amour qu’ils me donnent. Mon grand frère a toujours été un modèle de détermination et de persévérance pour moi. De nous deux, il est celui qui sait où il va dans la vie et prend le chemin le plus direct pour s’y rendre. De mon côté, je suis celle qui a une idée plutôt large d’où je me dirige dans la vie, et j’ai tendance à prendre quelques détours en chemin. Mon frère et moi sommes différents, mais semblables…on se comprend et se complète. Je pourrais parler de Catherine en tant que belle-sœur, mais cela ne serait pas tout à fait exact. Au fil des années, Catherine est devenue une amie et une confidante pour moi. Martin et Catherine ont eu récemment deux adorables garçons : Florian et Christophe. Ensemble ils forment une merveilleuse famille où je suis toujours la bienvenue et avec qui j’aime aller passer du temps pour me ressourcer. Vous dites souvent que ça ne doit pas être très reposant pour moi quand je suis avec vous et les garçons. Sachez que de partager votre quotidien me permet de me vider l’esprit et de remplir mon cœur de bonheur... Florian et Christophe sont très doués pour cette tâche! Merci pour tout l’amour et le support que vous me donnez! Il y a aussi ma famille élargie : oncles, tantes, cousins, cousines, petits-cousins et petites cousines. Ils sont nombreux, mais tous importants pour moi. J’ai la chance de faire partie d’une grande famille et j’en suis consciente. Comme un phare, ils sont toujours là, inébranlables à travers le temps.
xxvii
Avant-propos
Ma thèse comprend 6 chapitres, incluant une introduction générale et une conclusion rédigées en français ainsi que 4 chapitres écrits en anglais sous forme d’articles scientifiques pour publication. Je suis la principale auteure de chacun des articles dont j’ai été responsable de la planification, l’acquisition, l’analyse et l’interprétation des données ainsi que de la rédaction. D’autres auteurs ont également contribué à cette thèse, dont ma directrice Dr Helga E. Guderley, qui est professeure titulaire récemment retraitée au département de biologie de L’Université Laval. Dr Guderley est co-auteure de tous les articles pour son implication au niveau du financement et de la planification du projet en plus de sa supervision lors de la rédaction et la révision des manuscrits.
Le chapitre 2 intitulé « Swimming away or clamming up: the use of phasic and tonic adductor muscles during escape responses varies with shell morphology in scallops » a été publié dans la revue The Journal of Experimental Biology en 2012. Je suis premier auteur de cet article qui a été écrit en collaboration avec Dr Helga E. Guderley et Dr John H. Himmelman. Mon co-directeur de thèse, Dr John H. Himmelman professeure titulaire récemment retraité au département de biologie de L’Université Laval, est co-auteur du chapitre 2 pour son implication au niveau du financement du projet et de la révision du manuscrit.
Le chapitre 3 intitulé « Scallops show that muscle metabolic capacities reflect locomotor style and morphology » a été publié dans la revue Physiological and Biochemical Zoology en 2014. Je suis premier auteur de cet article qui a été écrit en collaboration avec Dr Helga E. Guderley.
Le chapitre 4 intitulé « When behaviour and mechanics meet: Scallop swimming capacities and their hinge ligament » a été soumis à la revue The Canadian Journal of Zoology. Je suis premier auteur de cet article qui a été écrit en collaboration avec Myriam Samson-Dô et Dr Helga E. Guderley. Myriam Samson-Dô est deuxième auteur de cet
xxviii
article pour son implication dans l’acquisition d’une partie des données et dans leur analyse, ainsi que pour ses commentaires sur le manuscrit.
Le chapitre 5 intitulé « Can scallop swimming styles be predicted from shell and adductor muscle morphology? » sera prochainement soumis pour publication. Je suis premier auteur de cet article qui a été écrit en collaboration avec Dr Helga E. Guderley.
1
CHAPITRE 1
Introduction générale
2
La mobilité est une caractéristique importante des animaux et la variété des capacités locomotrices existantes est impressionnante. Par exemple, une grenouille peut nager et sauter, un cheval peut marcher, trotter et galoper, les phoques nagent tandis que leur capacité à se déplacer en dehors de l’eau est plutôt limitée. Cette diversité au niveau des capacités locomotrices se retrouve aussi à l’intérieur d’une même classe animale, par exemple les oiseaux. Dans ce groupe, on retrouve des espèces qui volent tandis que d’autres ont perdu, au cours de leur évolution, toute capacité à voler. Parmi les oiseaux qui ne volent pas, certains vont marcher et nager, par exemple les manchots, tandis que d’autres vont seulement marcher comme les kiwis endémiques de la Nouvelle-Zélande. En ce qui concerne le vol, il peut être passif ou actif. On parle de vol passif lorsque l’oiseau ne bat pas des ailes et qu’il fait du vol plané, par exemple un albatros exploitant les forts courants aériens de l’Antarctique. Quant au vol actif, il se caractérise par le battement des ailes pour combattre la gravité et les forces de traînées comme c’est le cas chez le pigeon. Ces différents modes de locomotion sont le résultat de relations complexes entre le style de vie d’un animal, son environnement, sa morphologie et ses capacités métaboliques.
Chez les animaux, les fonctions majeures telles que la locomotion et la reproduction peuvent servir de force sélective favorisant certaines morphologies et les mécanismes physiologiques sous-jacents. Par exemple, la performance locomotrice est importante pour les activités telles que la recherche de nourriture, la capture de proies, la fuite face aux prédateurs et la migration. Ces activités sont déterminantes pour la survie, la croissance et le succès reproducteur d’un animal. Ainsi, les variations au niveau des mécanismes physiologiques déterminant la performance locomotrice sont êtres sujettes à la sélection. De plus, chaque organisme présente une combinaison d’attributs morphologiques, physiologiques et biochimiques travaillant de concert afin de permettre à l’organisme de se mouvoir dans son environnement. L’étude de la locomotion représente donc un défi majeur lorsque l’on veut comprendre comment chaque composante du système fonctionne séparément ainsi que dans un ensemble comme un tout intégré.
3
1. Déterminants de la performance locomotrice 1.1 Le muscle
Les mouvements nécessaires à la locomotion chez les animaux sont générés principalement par les contractions musculaires. En effet, les cellules musculaires sont spécialisées dans la contraction. Elles sont regroupées selon leur morphologie et leur fonction en deux grands types cellules: les fibres musculaire striées et lisses. On retrouve les fibres musculaires striées au niveau du muscle squelettique et cardiaque. Le muscle squelettique est responsable des mouvements volontaires alors que le muscle cardiaque se retrouve seulement au niveau du cœur et a pour fonction de pomper le sang et l’hémolymphe dans l’organisme. Pour sa part, le muscle lisse est responsable, du moins chez les vertébrés, des mouvements involontaires comme par exemple au niveau du tube digestif et des parois vasculaires.
Le muscle est composé de plusieurs faisceaux de fibres musculaires arrangés de façon parallèle les uns aux autres. Les fibres musculaires se forment lors du développement embryonnaire lorsque plusieurs cellules, appelées myoblastes ou myocytes, se fusionnent pour donner des cellules longues, cylindriques et multinucléées. Chaque fibre musculaire est composée de plusieurs sous-unités contractiles, appelées myofibrilles, arrangées de façon parallèle. Les myofibrilles consistent en une répétition longitudinale d’unités fonctionnelles appelées sarcomères, dont le patron spatial est responsable de l’apparence striée des muscles. Les sarcomères sont composés de filaments épais, de filaments minces et de titine.
Les filaments épais sont formés principalement d’une protéine appelée myosine. Chaque molécule de myosine comprend deux chaînes lourdes identiques et plusieurs chaînes légères (Rayment et al. 1993 pour une revue complète). Une région de la molécule de myosine a la forme d’une double tête globulaire, tandis que le reste de la molécule est plutôt de forme longiligne (Fig. 1.1). C’est dans la région globuleuse de la molécule de myosine, appelée la tête, que se produit l’activité ATPasique et que se trouve le site de fixation avec l’actine. La région de la tête est formée de la partie globulaire des deux chaînes lourdes ainsi que deux ou trois (tout dépendant de l’espèce) chaînes légères de myosine (Fig. 1.1). Ces chaînes légères de la tête de la myosine diffèrent selon les types de muscles et influencent la vitesse maximale de contraction du muscle. La partie longiligne
4
de la molécule de myosine se divise en deux parties, appelées le cou et la queue, qui sont formées des parties en hélice α des chaînes lourdes de myosine entortillées les unes autour des autres (Fig. 1.1). Il existe différentes isoformes de chaînes lourdes dans le muscle strié squelettique dont certaines sont associées à une vitesse de contraction rapide (MHC-2a, MHC-2b, MHC-2x) et d’autres à une vitesse de contraction lente (MHC-1). L’expression des différentes isoformes des chaînes lourdes de myosine dépend en partie du type de fibre (rapide versus lente), mais aussi de l’espèce.
Figure 1.1. Molécule de myosine (Modifié à partir de Geeves 1991).
La titine est une protéine élastique géante qui joue un rôle structural majeur au niveau du sarcomère. En effet, la titine est importante pour l’assemblage et le maintient de la structure du sarcomère en plus de réguler l’élasticité de ce dernier. Dans le muscle, la titine est liées aux filaments de myosine et s’étend de la ligne Z à la ligne M.
Les filaments minces sont formés principalement d’une protéine appelée actine et ressemblent à deux colliers de perles enroulés l’un autour de l’autre. Chaque monomère d’actine est une protéine globulaire appelée actine-G. Plusieurs monomères d’actine-G ensembles forment une chaîne d’actine-F (filamenteuse). Ainsi, deux chaînes d’actine-F s’enroulent l’une autour de l’autre pour former la matrice du filament mince. Au niveau
chaîne légère
S1
S2
(chaînes légères de myosine) (chaîne lourdes de myosine)
Tête Cou et Queue
5 des sillons des chaînes d’actine, on retrouve une molécule filamenteuse appelée tropomyosine. Attaché à intervalles réguliers sur le filament de tropomyosine, on retrouve un complexe globulaire de protéines appelé troponine. La troponine, chez les vertébrés, contient trois sous-unités (TnT, TnI et TnC) qui ensemble établissent la position de la tropomyosine et régulent l’accès aux sites de fixation de la myosine sur l’actine.
1.1.1 La contraction musculaire
La production de force mécanique par le muscle est le résultat de l’interaction entre les filaments épais de myosine et les filaments minces d’actine qui glissent les uns sur les autres lors de l’hydrolyse de l’ATP (Huxley 1985). Le cycle de la contraction musculaire requiert la libération de Ca2+ et la présence d’ATP. La contraction du muscle squelettique est déclenchée par l’influx nerveux qui stimule la libération du calcium (Ca2+). Ainsi, le Ca2+ contenu dans le réticulum sarcoplasmique (réseau spécialisé de citernes internes) est libéré dans le cytosol, ce qui résulte en une augmentation locale de la concentration du Ca2+. Le Ca2+ ainsi libéré va se lier à la troponine C et modifier la position du complexe troponine-tropomyosine, exposant les sites de fixation de la tête de myosine. La tête de myosine, portant un ADP et un ion phosphate (Pi), va se fixer à la molécule d’actine-G et
changer l’angle de la tête. La fixation de la myosine à l’actine-G va déclencher la libération rapide du Pi et provoquer le mouvement de la tête de myosine, résultant en un
déplacement du filament d’actine et un changement de la longueur du sarcomère. Ensuite, la tête de la myosine va relâcher l’ADP et rester attachée fermement à l’actine. C’est la fixation de l’ATP sur cette tête de myosine qui va permettre la séparation des deux filaments. Une fois détachée de l’actine, la myosine va hydrolyser l’ATP (ADP + Pi) et
changer l’angle de la tête de myosine maintenant prête à s’attacher de nouveau à l’actine.
1.1.2 Types de fibres musculaires
Le muscle squelettique des vertébrés est composé de plusieurs types de fibres musculaires qui se distinguent selon leurs propriétés biochimiques, métaboliques et histologiques. Au niveau du muscle squelettique des vertébrés, quatre groupes majeurs sont reconnus : les fibres toniques et trois types de fibres phasiques.
6
Les fibres toniques se contractent très lentement et ne produisent pas de secousse. Leur cycle de contraction lent permet des contractions soutenues à faible coût énergétique. Ainsi, on les retrouve principalement au niveau des muscles posturaux.
Les fibres phasiques oxydatives lentes de type I (Tableau 1.1) se contractent et se fatiguent lentement.
Les fibres phasiques oxydatives rapides de type IIa (Tableau 1.1) ont une vitesse de contraction et un niveau d’activation rapide. Grâce à leur niveau élevé de mitochondries, les fibres de type IIa peuvent produire de l’ATP rapidement par la phosphorylation oxydative et se fatiguent lentement. On retrouve les fibres de type IIa au niveau des muscles spécialisés pour les mouvements rapides et répétitifs d’un mode de locomotion vigoureux et soutenu comme par exemple, les muscles utilisés pour le vol de certains oiseaux.
Les fibres phasiques glycolytiques rapides de type IIb (Tableau 1.1) se contractent rapidement et se fatiguent vite. Puisque leur contenu en mitochondries est faible, les fibres de type IIb s’appuient sur le métabolisme glycolytique anaérobie qui produit rapidement de l’ATP, mais elles se fatiguent rapidement. On retrouve, par exemple, des fibres glycolytiques de type IIb au niveau des muscles pectoraux du faisan qui sont utilisés pour l’envolée rapide et de courte durée de l’oiseau en fuite.
1.2 Métabolisme musculaire
Lors de la contraction musculaire, il existe deux processus majeurs nécessitant l’utilisation d’énergie sous forme d’ATP. Le premier est l’hydrolyse de l’ATP, par la myosine ATPase, lorsque les têtes de myosine se détachent de l’actine. Le second est la réabsorption du Ca2+ à partir du cytosol par le réticulum sarcoplasmique. L’ATP nécessaire peut être produite via trois mécanismes biochimiques : l’utilisation de phosphagènes, le métabolisme anaérobie (glycolyse anaérobie) et le métabolisme aérobie.
7
Tableau 1.1. Propriétés des fibres musculaires squelettiques phasiques chez les mammifères (Modifié à partir de Hill et al. 2008)
Propriétés Oxydative lente
(type I)
Oxydative rapide (type IIa)
Glycolytique rapide (type IIb)
Taux de contraction Lent Rapide Rapide
Activité de la myosine ATPase Faible Élevée Élevée
Résistance à la fatigue Élevée Intermédiaire Faible
Capacité pour la phosphorylation oxydative Élevée Élevée Faible
Activité des enzymes de la glycolyse anaérobie Faible Intermédiaire Élevée
Quantité de mitochondries Beaucoup Beaucoup Peu
Diamètre des fibres Petit Intermédiaire Large
Force produite par aire transversale Faible Intermédiaire Élevée
8
1.2.1 Utilisation des phosphagènes
Les phosphagènes sont la principale source d’énergie lors des activités intenses de courte durée qui ne nécessitent pas d’oxygène (Fig. 1.2). En effet, les phosphagènes constituent une réserve d'énergie qui peut être mise très rapidement à la disposition du système contractile. L’hydrolyse du phosphagène va produire de l’ATP. Chez les vertébrés, la phosphocréatine est le seul phosphagène tandis que les invertébrés utilisent d’autres phosphagènes, comme par exemple la phosphoarginine.
1.2.2 Métabolisme anaérobie
Le métabolisme anaérobie intervient lorsque l'activité musculaire se prolonge en absence d’oxygène et que la réserve de phosphagènes est presqu’épuisée (Fig. 1.2). Le glucose ou le glycogène servent alors de source énergétique pour la production d’ATP. Chez les vertébrés, il y a aussi production et accumulation d’acide lactique (lactate) et parfois même d’éthanol dans le muscle comme produit secondaire. En effet le pyruvate provenant de la dégradation du glucose est converti en lactate afin de régénérer le NAD+ requis pour la poursuite de la glycolyse. Au lieu de produire du lactate, les invertébrés vont accumuler d’autres produits secondaires tels que l’octopine, la strombine et l’analopine (Hochachka & Somero 2002).
1.2.3 Métabolisme aérobie
Chez les vertébrés, une activité musculaire de longue durée dépendra du métabolisme aérobie (Fig. 1.2). Au cours du métabolisme aérobie, il y a dégradation des glucides, des lipides et ultimement des protéines, les trois agissant comme source énergétique pour la production d’ATP. La phosphorylation oxydative au niveau des mitochondries va produire de l’ATP, CO2 et H2O. L'implication de l'oxygène au niveau de
la phosphorylation oxydative requiert donc une perfusion sanguine adéquate des tissus musculaires.
9
Figure 1.2. Évolution dans le temps de la contribution des différentes sources d’énergie
pendant l’activité musculaire (Modifié à partir de Berg et al. 2002).
1.3 Facteurs affectant la performance locomotrice
La performance locomotrice chez les animaux est affectée par divers facteurs abiotiques et biotiques. Chaque mode de locomotion est tout d’abord affecté par le milieu dans lequel l’animal évolue (aquatique, aérien et terrestre), ainsi que par les différentes forces physique (gravité, portance, poussée et traînée). La forme et la taille corporelle ainsi que la masse d’un individu vont influencer les différentes forces physiques auxquelles l’animal doit faire face. Les propriétés du milieu, telles la température ambiante et la disponibilité en oxygène, sont aussi des facteurs importants à considérer. En plus du niveau d’oxygénation et d’humidité, on doit aussi considérer la salinité en milieu aquatique.
La température environnementale est probablement le facteur abiotique qui affecte le plus la performance locomotrice et ce via son influence sur les taux de fonctionnement des processus physiologiques (Bennett 1990). La performance locomotrice n’est pas nécessairement une fonction linéaire de la température et sa dépendance varie selon les espèces. La température ambiante affecte peu les animaux dits endothermes, car ces derniers sont capables de reternir la chaleur et de maintenir une température corporelle
Phosphagènes Métabolisme anaérobie Métabolisme aérobie ATP Temps Énerg ie
10
élevée et stable. Pour leur part, les animaux dits ectothermes vont plutôt compter sur leur comportement afin de maintenir leur température corporelle préférée car leur capacité à retenir la chaleur est faible. Le maintien d’une température corporelle optimale va permettre aux ectothermes d'optimiser leurs fonctions physiologiques, ainsi que leur performance locomotrice. Chez plusieurs espèces d’ectothermes, la thermorégulation comportementale requiert souvent un changement important d'habitat. Dans ce cas-là, la capacité de thermorégulation comportementale est plutôt limitée. La capacité d’une espèce à tolérer des changements de température est donc d'une importance centrale pour les ectothermes. Ceci est d'autant plus vrai que la capacité locomotrice d’un animal est très importante pour sa survie et sa reproduction.
Enfin, l’état physiologique d’un animal peut aussi influencer la performance locomotrice. Puisque la locomotion est un processus dont le coût énergétique est élevé, l’état reproducteur et la santé générale d’un animal peuvent influencer la performance locomotrice. En effet, la mobilisation des réserves énergétiques au cours de la reproduction d’un animal résulte en une diminution des réserves disponibles pour soutenir la locomotion. Lorsque les réserves énergétiques générales de l’animal sont en mauvaises conditions, tous les processus physiologiques en sont affectés.
2. Forme et fonction au niveau de la locomotion
Au niveau des systèmes biologiques, le lien entre la morphologie et la physiologie est fondamental car bien souvent la forme dicte la fonction. Les processus au niveau morphologique, physiologique et biochimique seraient à la base de la locomotion et limiteraient chaque type de locomotion. Chez les vertébrés, la structure osseuse, les capacités cardiovasculaires ainsi que la taille des muscles, le type de fibre musculaire, les réserves énergétiques et les capacités métaboliques reflètent le style de locomotion de chaque espèce. Par exemple, les thons ont un corps de forme hydrodynamique en plus de présenter plusieurs adaptations au niveau physiologique (muscle rouge positionné centralement et endothermie régionale), ce qui leur permet d’augmenter considérablement leur performance de nage (Bernal et al. 2001). Les oiseaux capables de vol soutenu, tels les pigeons, ont des muscles pectoraux dotés d’une grande capacité aérobie (Pennycuick 1968,
11 Davis & Guderley 1987), tandis que les muscles requis pour l’envolée rapide des faisans ont une grande capacité glycolytique, mais se fatiguent très rapidement (Kiessling 1977, Davis & Guderley 1987, Marden 1994, Askew & Marsh 2002).
Les capacités métaboliques du système locomoteur reflètent aussi les capacités locomotrices chez les animaux. En effet, les carburants et l’oxygène doivent être transportés à travers l’organisme (via le système circulatoire et respiratoire) pour se rendre jusqu’aux tissus où ils seront utilisés. Les propriétés intrinsèques des muscles, telles que le taux d’activation et de relaxation, la vitesse maximale de contraction et la production de force, ont aussi une influence sur la performance locomotrice (Else & Bennett 1987, Bennett et al. 1989, Herrel et al. 2007, James et al. 2007, Seebacher & James 2008). Pour leur part, les propriétés contractiles des muscles devraient être liées à l’activité de l’ATPase myofibrillaire ainsi qu’aux capacités des voies métaboliques oxydative et glycolytique à produire l’ATP nécessaire au mouvement (Garland 1984, Geeves 1991, Dickson et al. 1993, Guderley 2004, Alexander 2005). La comparaison d’organismes avec des styles de locomotion très différents montre que les indicateurs de la capacité aérobie sont plus élevés chez les animaux avec une plus grande endurance (Davis & Guderley 1987, Weibel et al. 1996). Les muscles des animaux de capacité aérobie élevée ont une plus grande proportion de fibres de type I et IIa possédant une quantité élevée de mitochondries. D’un autre côté, les animaux spécialisés pour les activités intenses et de courte durée ont des muscles avec une plus grande proportion de fibres de type IIb qui se contractent rapidement et s’appuient sur le métabolisme glycolytique. La série de travaux fait par Weibel et al. (1996) compare la capacité des systèmes de captation, livraison et utilisation de l’oxygène chez le chien et la chèvre, deux mammifères de taille semblable, mais de capacité aérobie bien différente. Ces travaux montrent qu’en général les capacités des systèmes se suivent avec pour seule exception les poumons dont la capacité dépasse celle des autres parties. Quant à l’appui métabolique à l’exercice de ces deux mammifères, l’étude révèle que la capacité d’utilisation des glucides et des lipides augmente parallèlement. Ainsi, plusieurs types d’évidences suggèrent que la co-évolution des éléments du système locomoteur s’étend aussi aux capacités métaboliques musculaires.
Les études in vitro chez les vertébrés montrent plusieurs adaptations aux niveaux morphologique, physiologique et métabolique. Les études comparatives ont permis de faire
12
le lien entre l’endurance d’un organisme et sa capacité maximale de consommation d’oxygène, alors que la vitesse et l’intensité de la réponse ont été corrélées aux capacités du métabolisme anaérobie, soit via le catabolisme des phosphagènes ou via la production de lactate (ou d’octopine selon le taxon); (Bennett 1991). Mais qu’est-ce qui se passe in vivo? Qu’est-ce qui se passe au niveau de l’utilisation des voies métaboliques pendant la locomotion? Comment est utilisé le muscle pendant la locomotion?
Quand les différences au niveau de la performance sont grandes, les relations structure-fonction deviennent plus évidentes. Ainsi, nous pouvons comparer différentes espèces présentant des capacités locomotrices très variées ou même, encore mieux, comparer des organismes provenant de la même espèce mais présentant un éventail de capacités locomotrices. Cependant, la biomécanique complexe des vertébrés rend difficile l’intégration de ces connaissances avec les aspects mécaniques de l’appareil locomoteur. Parmi les invertébrés, on retrouve une famille de bivalves avec une grande diversité au niveau de la morphologie de la coquille, accompagnée d’une diversité intéressante au niveau des capacités locomotrices. Cette famille, les pectinidés, a aussi l’avantage d’avoir un système locomoteur relativement simple. Ainsi, les pétoncles sont tout désignés comme modèle animal pour comprendre les liens entre la performance locomotrice et les différentes composantes du système locomoteur.
3. Les pétoncles
Les pétoncles font partie de la classe Bivalvia qui comprend aussi l’huître, la moule et la mye. La plupart des bivalves sont sessiles, mais il existe tout de même différents modes de vie. Certains, telle la mye, s’enfouissent dans les sédiments. D’autres, tels l’huître ou la moule, vont se fixer sur des surfaces à l’aide d’un byssus ou directement en secrétant leur coquille. Quelques bivalves peuvent même aller jusqu’à percer des matériaux, tels que le bois ou la pierre, pour s’y réfugier et y vivre au fond d’un trou qu’ils ont creusé. Enfin, les pétoncles sont parmi les seuls bivalves à être capables de nager dans l’eau.
13 La famille des pectinidés comprend environ 250 espèces (Brand 2006) vivantes occupant une grande variété de niches écologiques et démontrant une grande diversité morphologique et comportementale. De plus, les pétoncles ont l’avantage de présenter un système locomoteur composé d’un seul muscle adducteur, de deux valves et d’un ligament. Cette structure biomécanique relativement simple des pétoncles, combinée à une grande diversité morphologique et comportementale, en font un modèle animal idéal pour comprendre les liens entre la performance locomotrice et les différentes composantes du système locomoteur.
3.1. Origine de la nage chez les pétoncles
Un scénario évolutif suggère que l’habilité de nage a été acquise suite à la colonisation des habitats turbides. En effet, les changements morphologiques de la coquille accompagnant la réduction ou la perte du muscle adducteur antérieur, la réduction de l’attachement par un byssus et l’ouverture du manteau (pour augmenter les courants pour la filtration) sont des modifications qui auraient permis aux ancêtres des pétoncles d’avoir accès à des eaux plus profondes et/ou turbides (Yonge 1936). Il y aurait aussi eu perte du siphon rendant ainsi l’évacuation des particules, accumulées dans la cavité du manteau, problématique. Ainsi, on remarque une amélioration du tractus ciliaire facilitant l’évacuation des sédiments accumulés et une augmentation importante du muscle adducteur strié qui permet d’augmenter la vitesse de contraction des valves et des courants transportant les sédiments hors de la cavité du manteau des pétoncles. De plus, le repli interne du manteau s’est élargi dans le but de former une ouverture pour l’entrée et la sortie de l’eau dans la cavité du pétoncle. Ces modifications structurales, qui seraient nécessaires à la nage et aux autres comportements de fuite, se seraient développées chez les ancêtres des pétoncles en réponse à des changements morphologiques accompagnant la colonisation des eaux turbides. Ainsi, les modifications au niveau de la structure de la coquille, du manteau et du muscle adducteur sont considérées comme des adaptations dérivées chez les bivalves monomyaires, soit ceux ayant un seul muscle adducteur (Drew 1906, Yonge 1936). Il y a donc eu une co-évolution de traits complexes permettant une réponse comportementale particulière chez les pétoncles.
14
3.2 Évolution des modes de vie des pétoncles
Au cours de leur développement, les larves véligères de pétoncles nagent librement dans la colonne d’eau pour ensuite se métamorphoser et se fixer au substrat par un byssus et ainsi continuer leur croissance. Éventuellement, le pétoncle va adopter un mode de vie qu’il gardera pour le reste de sa vie adulte. Il y a 6 ou 7 modes de vie, au stade adulte, dans lesquels les différentes espèces de pétoncles sont généralement regroupées. Le tableau 1.2 décrit brièvement ces modes de vie.
Les études génétiques ont montré que l’attachement via un byssus est fort probablement le mode de vie ancestral qui aurait donné naissance aux différentes espèces de pétoncles (Alejandrino et al. 2011). Les deux types d’évolution, parallèle et convergente, auraient générées par la suite les différents modes de vie observés chez les pétoncles.
Il semble que les différents modes de vie, observés chez les pétoncles au stade adulte, seraient apparus à plusieurs reprises au cours de l’évolution. Les travaux d’Alejandrino ont dénombré 17 transitions entre les différents modes de vie chez les pétoncles (Alejandrino et al. 2011). Alors que la majorité des modes de vie observés chez les pétoncles peuvent être soit un stade ancestral ou transitoire, le mode de vie cimenté apparaît seulement en tant que stade dérivé. Ce biais, au niveau des transitions entre les modes de vie, signale la présence de contraintes dues à la complexité des changements physiologiques et morphologiques nécessaires à la transition d’un mode de vie à un autre. Ainsi il a été suggéré que les pétoncles, avec un mode de vie cimenté, pourraient avoir des traits physiologiques spécifiques qui empêcheraient la transition vers un autre mode de vie.
3.3 Locomotion chez les pétoncles
En présence des prédateurs ou lors d’un contact avec ces derniers, le pétoncle peut produire un simple saut, il peut tourner sur lui-même ou il peut se déplacer horizontalement sur une distance plus ou moins longue; c’est ce dernier que l’on appelle la nage (Buddenbrock 1911). La nage chez les pétoncles provient de la propulsion de l’animal grâce à des jets d’eau produits par une succession de contractions où alternent adductions
15
Tableau 1.2. Principaux modes de vie chez les pétoncles (Modifié à partir d’Alejandrino et al. 2011).
Mode de vie Description Exemple d’espèce Références
Niché Fixé par un byssus, le pétoncle se retrouve coincé à
l’intérieur d’un corail vivant qui se développe autour du pétoncle.
Pedum spondyloideum
Yonge 1967
Cimenté Attaché de façon permanente à un substrat dur au fur et à
mesure que sa coquille se développe. Crassadoma gigantea
Yonge 1951 Attaché par un byssus Attaché temporairement au substrat par des filaments de
byssus; il peut toutefois se détacher et nager pour se relocaliser
Mimachlamys asperrima, Chlamys islandica
Young & Martin 1989, Gruffydd 1976
Enfouis Enfouis partiellement ou totalement dans une cavité
creusée par le pétoncle dans les sédiments mous
Pecten maximus, Euvola ziczac
Baird 1958, Vélez et al. 1995
Libre Repose sur les sédiments mous ou sur un substrat dur. Aequipecten opercularis,
Equichlamys bifrons, Argopecten irradians
Belding 1931, Olsen 1955, Chapman et al. 1979
Planeur Capable de nager sur plus de 5 m lors d’une réponse de
fuite; inclut une phase de nage à l’horizontal avec une composante de glisse
Amusium balloti, Placopecten magellanicus
Manuel & Dadswell 1993, Joll 1989
16
(fermetures) et abductions (ouvertures) des deux valves (Drew 1906, Dakin 1909, Buddenbrock 1911). Le pétoncle nage avec l’ouverture des valves à l’avant et la charnière à l’arrière, donnant l’impression qu’il prend des bouchées dans l’eau (Fig. 1.3). Le muscle adducteur est responsable de la fermeture des valves alors qu’un ligament non-calcifié, aux propriétés élastiques, agit comme un ressort pour l’ouverture des valves lorsque le muscle adducteur relaxe (Trueman 1953a, Alexander 1966, Marsh et al. 1976). La taille et l’orientation des jets d’eau sont contrôlées par le manteau musculaire du pétoncle. Ainsi, le pétoncle peut produire un simple jet d’eau dirigé ventralement lorsqu’il veut simplement se détacher d’un prédateur. Lorsque le pétoncle se déplace sur de longues distances, les jets d’eau sont dirigés antérieurement et sortent par les ouvertures latérales de chaque côté de la charnière (Fig. 1.3).
La dynamique de fermeture et d’ouverture des valves, ainsi que la production de force, ont été analysées par Marsh et al. (Fig. 1.4) à l’aide d’un transducteur piézo-électrique chez Chlamys hastata et Argopecten irradians (Marsh et al. 1992). Au cours de la phase initiale de fermeture des valves, l’eau est explusée de la cavité du manteau qui n’est pas scellée. La pression à l’intérieur de la cavité du manteau augmente rapidement seulement lorsque la cavité est complètement scellée par le manteau. Durant cette phase du cycle de contraction, le taux d’écoulement de l’eau et la pression à l’intérieur de la cavité du manteau sont corrélés positivement. Lorsque le muscle adducteur relaxe et que les valves s’ouvrent, grâce à la décompression du ligament, la pression dans la cavité du manteau devient négative et l’eau va s’écouler de l’extérieur vers l’intérieur de la cavité. La cavité du manteau ainsi remplie d’eau, le pétoncle est prêt pour la contraction suivante. Marsh et al. a calculé que seulement une faible portion de la force produite par le muscle adducteur est nécessaire pour la compression du ligament et l’accélération des valves et de la masse ajoutée de l’eau.
17
Figure 1.3. Schémas représentant le mécanisme de la nage chez les pétoncles. A) Vue du
dessus. B) Vue latérale.
Jet d’eau Direction de la nage
Entrée d’eau
A)
B)
Jet d’eau
Jet d’eau
Entrée d’eau
Entrée d’eau
Ventral
Dorsal
Antérieur
Postérieur
Muscle adducteur Coquille
18
Figure 1.4. Exemple de données recueillies lors des deux premiers claps chez Chlamys
hastata. A) Pression dans la cavité du manteau et distance entre les valves (distance mesurée près de la bordure des valves au niveau du muscle adducteur). B) Taux d’écoulement de l’eau vers l’extrérieur de la cavité du manteau. C) Puissance mécanique calculée en prenant le produit de la pression (Pa) et du taux d’écoulement (m3 s-1) divisé par la masse (kg) du muscle adducteur phasique. (Fig. 1 de Marsh et al. 1992).
Temps (ms) P re ssi on (k P a) Dist anc e ( mm ) Éc ouleme nt (ml s -1 ) P uiss anc e ( W kg -1 )
19
4. Les composantes du système locomoteur 4.1 Le muscle adducteur
Les pétoncles sont monomyaires, c’est-à-dire qu’ils n’ont qu’un seul muscle adducteur. Ce muscle est composé de deux parties distinctes, une partie phasique et une partie tonique (Fig. 1.5), séparées par un mince tissu conjonctif (Millman 1967, de Zwaan et al. 1980). Ces deux parties du muscle adducteur diffèrent au niveau de leur structure et de leur fonction (Chantler 2006).
Figure 1.5. Partie phasique et tonique du muscle adducteur chez Pecten fumatus (Photo :
Isabelle Tremblay).
4.1.1 Le muscle phasique
Chez la plupart des espèces, le muscle phasique compte pour la plus grande proportion du muscle adducteur. Par exemple, la partie phasique du muscle adducteur correspond à environ 80% du poids total du muscle chez Placopecten magellanicus (de Zwaan et al. 1980). Il existe cependant une certaine variabilité, entre les différentes
Tonique