Effet de l'environnement lumineux sur les relations
hôtes/parasitoïdes :
cas de la guêpe parasitoïde
Aphidius ervi et de son hôte principal le puceron du
pois Acyrthosiphon pisum
Thèse
Précillia Cochard
Doctorat en biologie
Philosophiæ doctor (Ph. D.)
Québec, Canada
© Précillia Cochard, 2019
Effet de l’environnement lumineux sur les
relations hôtes/parasitoïdes
Cas de Aphidius ervi et son hôte principal
Acyrthosiphon pisum
Thèse
Précillia Cochard
Sous la direction de :
Conrad Cloutier, directeur de recherche
Tigran Galstian, codirecteur de recherche
iii
Résumé
En milieu naturel, les organismes doivent s’adapter à un environnement lumineux changeant (alternance jour/nuit, couverture nuageuse, habitat, saison, etc.). L'utilisation croissante de longueurs d'ondes spécifiques impliquant des diodes électroluminescentes (DELs) en serres permet de surmonter le manque de lumière pendant les mois d'hiver, en aidant la photosynthèse ou la croissance végétative des cultures. Cependant, la modification de l'environnement lumineux ainsi que de la photopériode peut également modifier directement ou indirectement l'activité des insectes utiles et des insectes nuisibles qui dépendent des plantes.
Dans mon étude, nous avons étudié comment une guêpe parasitoïde fait face aux variations du spectre d'éclairement et à quel point la vision des couleurs est importante dans la localisation et la reconnaissance de son hôte. Notre modèle d’étude s’est porté sur la guêpe parasitoïde Aphidius ervi qui attaque principalement le puceron du pois Acyrthosiphon pisum. Les pucerons du pois présentent un polymorphisme de couleur et apparaissent au sein d’une même population sous la forme de morphes roses et de morphes verts.
En utilisant un montage basé sur des DELs de 5 longueurs d’ondes différentes (361, 450, 500-600, 626 and 660 nm), nous avons créé différents spectres lumineux artificiels que les parasitoïdes et leurs hôtes peuvent rencontrer dans l’environnement naturel tels que l’ombre des feuilles ou le soleil direct. Ce design nous a permis d’étudier le comportement des insectes face à un environnement lumineux changeant et totalement contrôlable en intensité lumineuse et en composition spectrale, dans un contexte d'activité locomotrice et de parasitisme.
Dans l’ensemble, les résultats suggèrent que la probabilité que les pucerons se déplacent dépendait de l’interaction entre l’environnement lumineux, le stade de développement et la variation clonale. Nous avons montré que la probabilité que les parasitoïdes soient actifs diminuait avec l’augmentation des longueurs d’onde. Les
iv
mâles étaient plus actifs que les femelles sous toutes les conditions lumineuses monochromatiques testées. Bien que la quantité de lumière réfléchie des morphes roses fût d’environ la moitié de celle des morphes verts dans les composantes cyan-vert, nous avons constaté que les deux couleurs d’hôtes ont été reconnues et attaquées dans toutes les conditions d'éclairage testées, même la lumière rouge (660 nm). Enfin, en appliquant 4 ratios de DELs rouges (R): bleues (B) utilisées pour allonger la photopériode à l'intérieur d'une chambre de croissance, nous avons montré que l’allongement de la photophase (de 8h à 16 h de lumière/jour) augmentait l'activité parasitaire quotidienne de la guêpe ainsi que son comportement en matière de ponte. Enfin, les adultes parasitoïdes nouvellement émergés étaient composés de 80 % de mâles en lumière 100R: 0B contre 50 % sous le ratio 25R: 75B.
Cette étude indique qu'A. ervi reste un bon agent de lutte biologique lorsque l'environnement lumineux est modifié. Elle est aussi la première à montrer que le ratio de lumière R: B a un impact sur l’allocation des sexes chez ce parasitoïde. Nous pensons que l’utilisation de la lumière rouge seule pour prolonger la photophase peut avoir un effet négatif sur la dynamique des populations de ces parasitoïdes en raison de son impact défavorable sur le sex-ratio en favorisant les mâles, et donc un effet négatif sur le contrôle des populations de pucerons en milieu confiné.
v
Abstract
In nature, organisms must adapt to a changing light environment (day / night alternation, cloud cover, habitat, season, etc.). The increasing use of specific wavelengths involving light emitting diodes (LEDs) in greenhouses overcomes the lack of light during winter months, helping photosynthesis or vegetative growth of crops. However, changing light environment as well as photoperiod can also directly or indirectly modify the activity of beneficial insects and plant-related pests.
In my study, we investigated how a parasitoid wasp deals with variations in the light environment and how important color vision is in locating and recognizing its host. Our study model focused on the parasitoid wasp Aphidius ervi which mainly attacks the pea aphid Acyrthosiphon pisum. Pea aphids have a color polymorphism and appear within a same population under pink morphs and green morphs.
Using a design based on LEDs of 5 different wavelengths (361, 450, 500-600, 626 and 660 nm), we have created different artificial light spectra that parasitoids and their hosts can encounter in natural environment such as leaf-shade or direct sunlight. This design allowed us to study the behavior of insects in a changing light environment that is totally controllable in light intensity and spectral composition, in a context of locomotor activity and parasitism.
Overall, the results suggest that the probability of aphids walking depended on the interaction between the light environment, the stage of development, and clonal variation. We have shown that the probability of parasitoids walking decreased with increasing wavelengths, and that males were more active than females under all monochromatic light conditions tested. Although the amount of light reflected from the pink morphs was about half that of the green morphs in the cyan-green components, we found that both host colors were recognized and attacked under all light conditions tested, even red light (660 nm). Finally, by applying 4 ratios of red (R): blue (B) LEDs used to extend the photoperiod inside a growth chamber, we have shown that the photophase elongation (from 8h to 16h of light/day) increased
vi
the daily parasitic activity of the wasp and its oviposition behavior. Finally, the newly emerged parasitoid adults were composed of 80% males in light 100R: 0B against 50% under the ratio 25R: 75B.
This study indicates that A. ervi remains a good biological control agent under different light environments. This study is also the first to show that the R: B light ratio has an impact on the decision-making of females regarding the sex of their offspring. We believe that the use of red light alone to extend the photophase may have a negative effect on the population dynamics of these parasitoids because of its adverse impact on sex ratio by favoring males, and thus a negative effect on control of aphid populations in confined environment.
vii
Table des matières
RÉSUMÉ ... III ABSTRACT ... V TABLE DES MATIÈRES ... VII LISTE DES TABLEAUX ... XIII LISTE DES FIGURES ... XV REMERCIEMENTS ... XXI AVANT-PROPOS ... XXIII
INTRODUCTION GÉNÉRALE ... 1
1.1 GÉNÉRALITÉS : LUMIÈRE ET COULEUR ... 2
1.2 SIGNAUX VISUELS : PRODUCTION ET SIGNIFICATION DE LA COULEUR DES INSECTES ... 5
1.2.1 PRODUCTION ET DIVERSITÉ DES COULEURS ... 5
1.2.2 RÔLES BIOLOGIQUES DE LA COULEUR DES INSECTES ... 6
1.3 VISION DES INSECTES ... 8
1.3.1 STRUCTURE DES YEUX COMPOSÉS DES INSECTES ... 8
1.3.2 RÔLE ET EFFETS DES UV SUR LES PLANTES ET LES INSECTES RAVAGEURS DE CULTURES ... 10
1.4 SYSTÈME D’ÉTUDE ... 11
1.4.1 LE PUCERON DU POIS,ACYRTHOSIPHON PISUM ... 12
viii
1.5 EFFETS DE L’ENVIRONNEMENT LUMINEUX SUR LA VIE DES INSECTES ... 16
1.5.1 RÉPONSE COMPORTEMENTALE DES RAVAGEURS DE CULTURES ET DE LEURS ENNEMIS NATURELS À LA VARIATION DE L’ENVIRONNEMENT LUMINEUX ... 16
1.5.2 LES EFFETS DE L’ENVIRONNEMENT LUMINEUX ET DU POLYMORPHISME DE COULEUR DES HÔTES SUR LE COMPORTEMENT DE PARASITISME ... 19
1.5.3 PHOTOPÉRIODE ET MODIFICATION DE L’ENVIRONNEMENT LUMINEUX SOUS SERRES : CONSÉQUENCES SUR LES ORGANISMES DANS CE MILIEU ... 27
1.5.4 QUESTIONS ET OBJECTIFS DE RECHERCHE ... 30
2 ÉTUDE DES EFFETS DE L’ENVIRONNEMENT LUMINEUX SUR L’ACTIVITÉ LOCOMOTRICE DE ACYRTHOSIPHON PISUM ET DE APHIDIUS ERVI ... 33
2.1 RÉSUMÉ ... 35
2.2 ABSTRACT ... 36
2.3 INTRODUCTION ... 37
2.4 MATERIALS AND METHODS ... 41
2.4.1 LIGHT ENVIRONMENT ... 41
2.4.2 STUDY ORGANISMS ... 43
2.4.3 APHID LOCOMOTOR ACTIVITY (WALKING) ... 43
2.4.4 PARASITOID LOCOMOTOR ACTIVITY (WALKING AND FLIGHT) ... 44
2.4.5 STATISTICAL ANALYSIS ... 45
ix
2.5.1 APHIDS LOCOMOTOR ACTIVITY ... 46
2.5.2 PARASITOID WALKING ACTIVITY ... 46
2.5.3 PARASITOID FLIGHT ACTIVITY ... 48
2.6 DISCUSSION ... 49
2.7 ACKNOWLEDGEMENTS ... 54
2.8 TABLES ... 55
3 ÉTUDE DE L'IMPACT DE LA VARIATION DE L'ENVIRONNEMENT LUMINEUX SUR LA CAPACITÉ DES PARASITOÏDES À LOCALISER ET DISCRIMINER LEURS HÔTES ... 59
3.1 RÉSUMÉ ... 61
3.2 ABSTRACT ... 62
3.3 INTRODUCTION ... 64
3.4 MATERIALS AND METHODS ... 67
3.4.1 LIGHT ENVIRONMENT AND EXPERIMENTAL CONDITIONS ... 67
3.4.2 STUDY ORGANISMS ... 67
3.4.3 SPECTRAL CHARACTERIZATION OF PEA APHID CLONES OF VARIABLE COLOR ... 69
3.4.4 BEHAVIORAL OBSERVATIONS ... 69
3.4.5 EXPERIMENT 1:NO-CHOICE ... 70
3.4.6 EXPERIMENT 2:HOST COLOR CHOICE AND LIGHT ENVIRONMENT ... 71
x
3.4.8 STATISTICAL ANALYSIS ... 72
3.5 RESULTS ... 73
3.5.1 APHIDS REFLECTED LIGHT SPECTRA ... 73
3.5.2 EXPERIMENT 1:NO CHOICE ... 74
3.5.3 EXPERIMENT 2:HOST COLOR CHOICE AND LIGHT ENVIRONMENT ... 76
3.5.4 EXPERIMENT 3:EGG-LAYING IN PINK AND GREEN APHIDS OF DIFFERENT SYMBIOTYPES ... 79
3.6 DISCUSSION ... 81
3.7 ACKNOWLEDGEMENTS ... 86
3.8 TABLES ... 87
4 DÉTERMINER L’EFFET DU RATIO LUMIÈRE ROUGE : LUMIÈRE BLEUE SUR LE TAUX DE PARASITISME DU PUCERON DU POIS ET LE RAPPORT DES SEXES DES ADULTES ÉMERGENTS 92 4.1 RÉSUMÉ ... 94
4.2 ABSTRACT ... 95
4.3 INTRODUCTION ... 96
4.4 MATERIALS AND METHODS ... 100
4.4.1 STUDY ORGANISMS ... 100
4.4.2 LIGHT ENVIRONMENT AND EXPERIMENTAL CONDITIONS ... 101
xi
4.4.4 STATISTICAL ANALYSIS ... 104
4.5 RESULTS ... 104
4.5.1 OVIPOSITION BEHAVIOR AND SUCCESS:PROBABILITY OF APHIDS BEING PARASITIZED AND NUMBER OF EGGS 104 4.5.2 SUCCESSFUL PARASITISM TO ADULT EMERGENCE:NUMBER OF MUMMIES FORMED AND SEX RATIO OF ADULTS 107 4.6 DISCUSSION ... 108 4.7 CONCLUSION ... 112 4.8 ACKNOWLEDGMENTS ... 113 4.9 TABLES ... 114 5 CONCLUSION GÉNÉRALE ... 115
5.1 RÉSUMÉ DES TRAVAUX ... 116
5.2 LIMITES DE L’ÉTUDE ... 119
5.3 PERSPECTIVES DE RECHERCHE ... 121
5.3.1 ÉTUDIER LA COULEUR DES PUCERONS AVEC LA MÉTHODE HBS ET LA RÉPONSE DES PARASITOÏDES 121 5.3.2 ÉTUDIER L’EFFET DE LA POSITION DE L’ÉCLAIRAGE DANS LES SERRES SUR LA RÉPARTITION SPATIALE DES INSECTES ET LE TAUX DE PARASITISME ... 123
5.3.3 ÉTUDIER L’EFFET DE LA LUMIÈRE ROUGE À LONG TERME SUR LE RAPPORT DES SEXES DES PARASITOÏDES ET LE CONTRÔLE DES POPULATIONS DE PUCERON. ... 124
xii
xiii
Liste des tableaux
Tableau 2-1 : Statistical modeling of probability of Acyrthosiphon pisum being active (walking) under controlled light environments. A split-plot binomial model was fitted to data including Light (UV, Leaves, Sun and Red) as main plot effect, Color morph (Green, Pink), Instar (Adult, Nymph) and their interactions as subplot effects, and Clone within color morph as a random effect. ... 55 Table 2-2 : Post-hoc comparisons for fixed (Light and Color*Instar) and random factors (Clone(Color)) significantly affecting (p < 0.05) probability of Acyrthosiphon pisum being active (walking) under controlled light environments, using least squares means method (LSM). ... 56 Table 2-3 : Variance analysis using a binomial model on randomized complete blocs and repeated measures for monochromatic light environments on the probability of Aphidius ervi wasps being active (walking). Factors decomposing inter-wasp variability are Sex (male, female) and the Reproductive status (virgin, mated). Measures were repeated on a same wasp through Light conditions (UV, blue, green, orange, red) and Intensity (low, medium, high). ... 57
Table 2-4 : Variance analysis using a binomial model on randomized complete blocks and repeated measures for polychromatic light environments (artificial sunlight or leaf shade) on the probability of Aphidius ervi wasps being active (walking). Factors decomposing inter-wasp variability are Sex (male, female) and Reproductive status (virgin, mated). Measures were repeated on a same wasp through Light environments (leaf-shade/dim light, leaf-shade/bright light, sunlight without UV/dim light, sunlight with UV/dim light, sunlight with UV/ bright light). ... 58 Table 3-1 : Light intensities (µW/cm2) used in experiments on behavior of Aphidius
ervi. ... 87
Table 3-2 : Characteristics of the Acyrthosiphon pisum clones used in experiments. ... 88
xiv
Table 3-3 : Phenotypes (aphid color / endosymbionts) of the seven Acyrthosiphon
pisum clones used in experiments on behavior of Aphidius ervi wasps. In the choice
experiments, green and pink aphids forming a pair either had the same or different symbionts. ... 89 Table 3-4 : Variance analysis using a binomial model (for probability variables) and a Poisson regression (other variables) on randomized complete blocks and repeated measures for behavioral traits of Aphidius ervi wasps in controlled light environments. For the host-color binary choice experiment, measures were repeated on a same wasp individual through the different light conditions (red light, leaf-shade dim light, leaf-shade bright light, sunlight dim light and sunlight bright light). ... 90 Table 4-1 : Total numbers of potentially parasitized pink and green pea aphid clones that were dissected and bred to adult emergence, under the four light environments and for both symbiotypes tested. ... 114
xv
Liste des figures
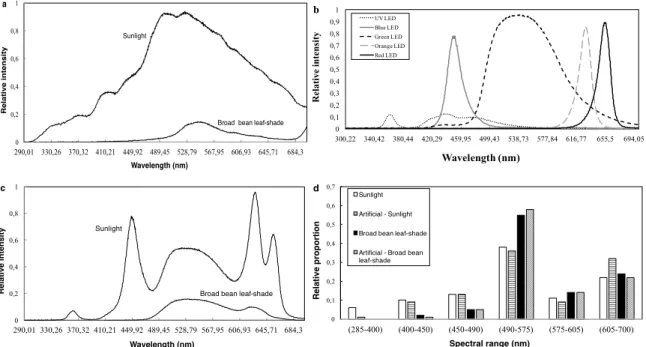
Figure 1-1 : Cône TSL représentant les 3 paramètres (Teinte, Saturation, Luminosité) servant à caractériser la couleur d’un objet (aussi appelé « HSB cone » en anglais, pour Hue, Saturation and Brightness). ... 4 Figure 1-2 : Schéma des yeux composés des insectes : apposition et superposition. Schéma adapté des figures du livre Animal Eyes de Land et Nilsson (2012). ... 9 Figure 2-1 : Spectrum of sunlight and broad bean leaf-shade between 290 and 700nm. a) Natural spectrum taken near Quebec City (46.911625, -71.051129) in mid-July at noon. b) Spectrum of the five LEDs used to create artificial illuminations.
c) Artificial spectrum created with an electronic system composed of LEDs of 5
different wavelengths. d) Comparison between natural and artificial spectrum of the relative proportion of each spectral range. ... 42 Figure 2-2 : Probability (Mean ± S.E) of being active (walking) for males and females
Aphidius ervi, under different monochromatic light environments. Significant
differences were found between light environments (F4,616 = 18.43, p < 0.001).
Different lowercase letters indicate significant differences between light environments on probability averaged on sex (p < 0.05 with Tukey method p value adjustment). Significant difference was found between males and females (F1,33 =
9.172, p = 0.005). N=24 males and N=24 females in each light environment. ... 47 Figure 2-3 : Probability (Mean ± S.E) of being active (walking) for males and females
Aphidius ervi under different polychromatic light environments. Probability of being
active was marginally insignificant according to light environments (F4,176 = 3.98, p =
0.054) but sex significantly affected it (F1,33 = 3.15, p = 0.016), mostly due to virgin
females. There are significant differences between virgin females and the other groups under the “leaf-shade/ bright” condition (virgin females vs mated females, df = 11, t = 4.652 p = 0.038; virgin females vs virgin males, df = 11, t = -6.459, p =
xvi
0.003; virgin females vs mated males, df = 11, t = 4.791, p = 0.032). N=12 wasps/ group in each light environment. ... 48 Figure 2-4 : Mean delay (± S.E) before flight (s) of males and females Aphidius ervi under leaf-shade and sunlight illumination. Different lowercase letters indicate significant differences between groups (p < 0.05 with Tukey method p value adjustment). N=15 males and females in each light environment. ... 49 Figure 3-1 : Reflected light spectra of differently-colored pea aphid clones. The mean normalized reflected light intensity from the 3 green and 4 pink morphs of the experimental pea aphid clones (N = 6 second instars per clone) used in the experiments. ... 73 Figure 3-2 : Percentage differences for the eight spectral components between green and pink pea aphid clones. The amount of reflected light varied between green and pink pea aphids for several spectral components. Differences are square-root transformed. * p-value < 0.05, *** p-value < 0.001. ... 74 Figure 3-3 : Effect of light environments and clones of the green and pink pea aphid morphs on host encountering and attacking behavior of Aphidius ervi. (A) Probability of encountering at least one aphid during a 5-min test in the no-choice experiment (#1), under different light environments. Values are means ± s.e.m. There was a significant effect of light environment (F3,152 = 4.14, P = 0.007) and aphid clone identity (F3,144 = 3.02, P = 0.03). (B) Number of encounters with aphids in the color-choice experiment (#2), where pink and green pea aphids were associated to form 3 groups based on clone identity. There was a significant effect of light environment
(F4,243 = 8.6, P < 0.0001), and significant interaction between aphid color and group
(F2,43 = 3.38, P = 0.036). (C) Number of successful attacks in the color choice experiment (#2) was also significantly affected by the light environment (F4,148 = 3.46, p = 0.01). Different lowercase letters indicate significant differences between light
xvii
environments averaged on clone identity (A), or host color + aphids group (B, C) (p < 0.05, p-value adjustment with Tukey method). ... 76 Figure 3-4 : Transitions between failed and successful attacks by Aphidius ervi, and the next host encountered in the host color choice experiment (#2). (A) The color of the attacked aphid (failed or successful attack) had no influence on the color of the next aphid encountered. Values are means ± s.e.m. (B) Wasps were more likely to search for a new aphid when the previous attack was successful. Different lowercase letters indicate significant differences between type of transitions (p < 0.05, p-value adjustment with Tukey method). ... 78 Figure 3-5 : Impact of host color and experience on successful attack and egg laying behaviors of Aphidius ervi in the egg laying experiment (#3). Probability of successful attack in aphid abdomen (A) and oviposition frequency (B) were affected by interaction between aphid color and learning experience. Frequency of egg laying transitions were higher between aphids of different colors (C). Values are means ± s.e.m. Different lowercase letters indicate significant differences (p < 0.05, p-value adjustment with Tukey method). ... 80 Figure 4-1 : Experimental design. Four supplemented LEDs light environments were tested, R stands for Red LEDs (660 nm) and B for Blue LEDs (440 nm). Four proportions of red/blue light were tested (100R0B = 100 % of red, 75R25B = 75% of red 25 % of blue, 50R50B = 50 % of red 50 % of blue, 25R75B = 25 % of red 75 % of blue). A) Top view of the growth chamber for one block, containing 16 experimental units (rectangles with vertical stripes for aphids with endosymbiont R. insecticola, or horizontal stripes for aphids with both defensive symbionts H. defensa + F. symbiotica). B) Experimental unit containing one broad bean plant without aphids, placed between two plants with either 20 green or 20 pink aphids with either the R. insecticola symbiont alone, or with the dual defensive symbiotype H. defensa + F. symbiotica. One female Aphidius ervi was introduced at the beginning of the 24 h experiment. ... 102
xviii
Figure 4-2 : The probability of aphids being parasitized was affected by A) the ratios of red: blue lights (F3,185 = 9.87, p-value < 0.0001), and B) sampling occasions in the
24h experimental cycle (F1,185 = 36.2, p-value < 0.0001). ... 105
Figure 4-3 : Models comparison for the probability of aphids being parasitized against the proportion of blue light in the LED-extended light environment. Circles represent the observed proportions of aphids parasitized at the end of the 24 h experiment for each proportion of blue light tested (0%, 25%, 50% and 75%). Blue
solid line is the linear model: Parasitism = 0.002456*(Blue) + 0.478688. Red dotted line is the logarithmic model: Parasitism = 0.04662*log(Blue) + 0.43648. The
logarithmic model best explained the results based on the AIC criterion (DAIC for linear regression = 2.71, DAIC for logarithmic model = 0). ... 106 Figure 4-4 : The mean number of A. ervi eggs per parasitized aphid was affected by
A) the time of samplings (F1,161 = 66.3, p-value < 0.0001) and B) interaction between
aphid clone color (dotted green line for green aphids, solid pink line for pink aphids) and symbiotype (F1,161 = 6.55, p-value = 0.011). ... 107
Figure 4-5 : Mean rate (%) of mummification (± S.E) was affected by A) the presence of defensive endosymbionts (df = 1, deviance = 15.7, p-value < 0.001) and B) the color of the host clones (df = 1, deviance = 5.33, p-value = 0.02), but not by their interaction (df = 1, deviance = 0.0013, p-value = 0.97). ... 108
Figure 4-6 : Proportion of males that emerged from parasitized aphids of the second sampling occasion (8 h dark + 8 h “Daylight” + 8 h “LEDs”) against the proportion of blue light in the environment. Circles represent the data for the proportion of males that emerged as a function of the proportion of blue light tested (0%, 25%, 50% and 75%). Blue solid line and red long dashed line represent the estimated proportion of emerging males against the proportion of blue light (logarithmic curve (red long
dashed line): Prop_males = 0.06020(± 0.02694)*-(log(Blue)) + 0.77036(± 0.08845); linear regression (blue solid line) : Prop_males = -0.003237(± 0.001751)*(Blue) + 0.715528(± 0.077314). The logarithmic model was the best compared to linear
xix
regression based on the AIC criterion (DAIC for linear regression = 2.57, DAIC for logarithmic model = 0). ... 109 Figure 5-1 : Schéma de synthèse des résultats obtenus dans l’étude. Les heures indiquées dans le haut de l’image sont à reliées à la composition du spectre solaire, mais ne reflètent pas le temps écoulé entre les diverses étapes de la recherche des hôtes et du comportement de parasitisme. ... 116 Figure 5-2 : Capture d’écran de l’utilisation de la méthode HSB (Hue, Saturation, Brightness) pour caractériser la couleur d’un objet. Les valeurs du pixel sélectionné s’affichent dans l’encadré rouge. La valeur de la teinte (H) est en degrés, car elle se lit sur un cercle chromatique (entre 0° et 360°). Les valeurs de la saturation (S) et de la luminosité (B) sont en pourcentages. ... 122
xx
« Si nous prenons la nature pour guide, nous ne nous égarerons jamais » Cicéron (106 – 43 a.v. J.-C.)
À mes parents, pour m’avoir soutenue, À mes frères et sœurs, pour m’avoir motivée À toi, pour être toujours resté à mes côtés.
xxi
Remerciements
C’est ici que je m’attèle à la partie la plus agréable et en même temps la moins facile de la rédaction puisque ne voulant offenser personne, j’espère que ma liste de remerciements sera exhaustive.
Un projet de doctorat ne peut être le fruit d’un travail individuel mais bien d’une réflexion en équipe. Aussi je tiens à remercier particulièrement mon directeur le docteur Conrad Cloutier ainsi que mon co-directeur le docteur Tigran Galstian pour leur aide précieuse, leurs conseils avisés et les discussions éclairées que nous avons pu avoir tout au long de mon parcours afin de pouvoir mener à bien ce projet. Je suis ravie d’avoir pu constater que la biologie et la physique sont à la fois deux mondes bien distincts avec leur vocabulaire bien spécifique, et très complémentaires dont ma thèse en est le résultat.
Les autres membres de mon comité, la docteure Julie Turgeon et la docteure
Véronique Martel, pour nos échanges durant les réunions d’encadrement, vos
idées et le partage de votre savoir qui m’ont permis d’avancer et de me poser les bonnes questions pour continuer d’avancer. Je remercie également la docteure
Emma Despland d’avoir immédiatement accepté d’examiner ma thèse.
Je souhaite remercier également Jean-Frédéric Guay, l’homme à tout faire du labo. Toujours disponible pour aider, conseiller, relire, bricoler, débriefer ... aller boire une (plusieurs) bières … Bref, un collègue devenu ami depuis ma première arrivée ici en 2013.
Toujours en espérant n’oublier personne, je remercie celles et ceux ayant contribué de près ou de loin à mon projet, m’ayant soutenue moralement : Sandra
Flores, pour m’avoir renseigné sur la dure réalité de la vie de doctorant et les
conseils que tu as pu me donner ; Patrick Larochelle, Louis Haéberlé et Laurent
Chaussé pour toute la partie technique/soudure/physique (bien des heures de joie)
xxii
parasitisme ; Julie Turgeon, pour le prêt de son laboratoire ; Jonathan
Franchomme, pour l’aide lors de ma première année ; Morgane Canovas, dernière
arrivée dans l’équipe mais très vite devenue une amie et une co-équipière pour se plaindre de la vie (c’est bien connu, les français sont râleurs !).
Mes meilleurs amis, Didine, PA et Sophie pour avoir été présents lors de mes (trop peu) retours en France !
Ma famille, en particulier mes parents, Pascal et Christine, mes frères Cody et Stevee et ma sœur Merryl. Pour tous les moments passés sur Skype (tous les jours !) à me conseiller, me remotiver, me donner des recettes de cuisine pour survivre, pour les beaux moments pendant mes vacances lors de mes retours en France, la fierté que j’ai pu avoir de vous voir évoluer chacun dans votre voie. Je remercie également ma belle-famille dont Nathalie et Clara, d’être venues nous rendre visite à plusieurs reprises, ou même de venir habiter avec nous (Benoit) afin de nous sentir un peu plus chez nous, ici.
À Romain, mon conjoint, mon ami et mon confident, qui me supporte depuis le début, qui m’a suivi au Canada, qui a dû subir les cris, les pleurs, les périodes de stress et de remise en question mais également les moments de joie … Je ne te remercierai jamais assez . Sans oublier mon chat Dominos (alias : Titi, Marguerite, Bernard, Vomito, l’obèse et j’en passe), pour avoir mangé à deux reprises mes chargeurs d’ordinateur, quelques câbles de téléphone, et pour toutes les grasses-matinées que je n’ai pas pu faire grâce (ou plutôt, à cause) de toi.
xxiii
Avant-propos
Ma thèse vise à explorer les effets de l’environnement lumineux sur les interactions entre un ravageur de cultures le puceron du pois et son agent de lutte biologique la guêpe parasitoïde Aphidius ervi. De façon originale je tente d’identifier si un environnement lumineux ou une longueur d’onde en particulier, permet au parasitoïde de localiser plus rapidement son hôte ou au contraire ralentit sa détection et sa reconnaissance. J’utilise des techniques de contrôle électronique de l’environnement lumineux et des méthodes de suivi comportementales. Ce travail comporte 5 chapitres : un chapitre d’introduction et un chapitre de conclusion en français ainsi que 3 chapitres principaux correspondant aux articles en anglais. J’ai participé à cette thèse depuis l’analyse de la littérature pertinente à ce travail, l’élaboration des questions de recherche, la mise en place des protocoles expérimentaux et la réalisation des expériences, ainsi que la prise de données, l’analyse des résultats jusqu’à la rédaction des articles.
La première partie de ma thèse est une introduction générale. Elle présente le cadre théorique de mon travail en y détaillant les définitions des concepts généraux utilisés. Je présente mes espèces d’études ainsi que l’état des connaissances concernant les effets de la variation de l’environnement lumineux sur l’activité locomotrice, l’émergence, ainsi que sur le comportement de parasitisme. Enfin, j’expose les objectifs de ma thèse et les questions auxquelles je souhaite apporter des réponses.
Le chapitre 2 concerne les effets de l’environnement lumineux, tant au niveau qualitatif (longueurs d’ondes présentes) que quantitatif (intensité lumineuse) sur l’activité locomotrice du puceron du pois et de la guêpe parasitoïde Aphidius ervi, étudiés séparément. Ce chapitre est présenté sous forme d’article « Light environments differently affect parasitoid wasps and their hosts’ locomotor activity » publié dans la revue Journal of Insect Behavior en novembre 2017 (DOI : 10.1007/s10905-017-9644-y).
xxiv
Le chapitre 3 étudie les effets de la modification de l’environnement sur le comportement de parasitisme de Aphidius ervi sur son hôte le puceron du pois au travers d’expériences de choix et de non-choix par rapport à la couleur de l’hôte. Ce chapitre est présenté sous forme d’article « The influence of light environment on host color preference in a parasitoid wasp » paru dans la revue Ecological Entomology en septembre 2018 (DOI : 10.1111/een.12678).
Le chapitre 4 permet d’examiner les effets de la proportion de lumières rouge et bleue sur le taux de parasitisme et le rapport des sexes des adultes émergents dans un contexte plus appliqué, en simulant une culture sous serre. Ce chapitre est présenté sous forme d’article « The Proportion of Blue Light Affects Parasitoid Wasp Behavior in LED-extended Photoperiod in Greenhouses: Increased Parasitism and Offspring Sex Ratio Bias » publié dans la revue Biological Control en mars 2019 (DOI: 10.1016/j.biocontrol.2019.03.004).
En conclusion (chapitre 5), je résume et discute des principales contributions de mon travail aux connaissances déjà existantes, je présente les limites de l’étude et propose des perspectives de recherche.
1
2
1.1 Généralités : lumière et couleur
La source lumineuse la plus répandue est d’origine thermique : le soleil chauffé à une certaine température émet un spectre spécifique. D'autre sources de lumière existent telles que la chimioluminescence, où une réaction entre des composés chimiques génère de la lumière (ou bioluminescence chez les organismes vivants, comme les lucioles, certaines pieuvres des grandes profondeurs de l'océan, voir la synthèse de Widder et Falls 2014 ; ou encore certains champignons, voir la synthèse de Stevani et al., 2013). La bioluminescence est souvent utilisée dans la communication sexuelle, la défense ou la recherche de nourriture (Chapman, 2013).
La lumière est un paramètre abiotique essentiel dans la vie des organismes vivants. Depuis les travaux de Tournois (1912) puis de Garner et Allard (1920), on sait que l'alternance jour/nuit ou photopériodisme est un facteur essentiel régulant par exemple la croissance et la reproduction des végétaux. Cette photopériode est un signal utilisé aussi par les animaux, qui initie des changements physiologiques, développementaux ou comportementaux intervenant par exemple dans la reproduction ou la migration (voir la synthèse de Bradshaw et Holzapfel 2007). Toutefois, les organismes vivants ne répondent pas seulement à la longueur du jour et de la nuit, mais également à des indices chromatiques (relatif à la longueur d'onde), achromatiques (relatif à l'intensité) (synthèse de Osorio et Vorobyev 2008) ou à la vibration du champ électrique de la lumière (polarisation, Marshall et Cronin 2011). La lumière naturelle dite « blanche » est constituée de l’ensemble des longueurs d’ondes composant le spectre « visible » par les êtres humains (c.-à-d. : entre 400 et 700 nm), mais aussi des longueurs d’ondes faisant partie de « l’invisible » pour les hommes mais visibles pour d'autres organismes : ce sont les ultra-violets (longueurs d’ondes < 400 nm) et les infrarouges (longueurs d’ondes > 700 nm). L'environnement lumineux naturel arrivant à la surface de la terre contient des radiations UV, qui ne sont pas filtrées par la couche d'ozone (5% de l'énergie solaire). Ce sont principalement des UV-A (310-400 nm) et un peu d'UV-B (280-310
3
nm), ils peuvent être néfastes et sont souvent évités par les organismes vivants (par le biais de pigments absorbants par exemple). Pour les animaux qui perçoivent les UV comme les insectes (Chittka et al., 1994), les oiseaux (synthèse de Bennett et Cuthill 1994) ou les lézards (Abramjan et al., 2015), ces radiations sont utilisées dans des domaines aussi variés que la recherche de nourriture (synthèse de Honkavaara, Johanna et al., 2002), l'orientation (oiseaux : Wiltschko et al., 2014), la sélection sexuelle (Secondi et Théry 2014) et même dans les interactions inter-spécifiques (exemple : l'araignée prédatrice Portia labiata utilise les réflexions UV de sa proie qui est le mâle de l'araignée Cosmophasis umbratica pour le localiser, Bulbert et al., 2015).
La lumière nous permet de distinguer visuellement des objets les uns des autres. En frappant la surface d'un objet, elle a une influence sur la couleur perçue de cet objet, qui peut être décrite par l'interaction de 3 paramètres (Figure 1-1), auxquels peuvent répondre les animaux (Antignus, 2000) :
• La teinte ou longueur d’onde dominante réémise par la surface (λmax), aussi
appelée chromaticité : C'est l'une des principales propriétés de la couleur. Elle est souvent représentée par une position sur un cercle chromatique, où le rouge primaire est à 0°, le vert primaire à 120° et le bleu primaire à 240°. • La saturation de la couleur ou pureté de la teinte : C'est une combinaison
entre l'intensité lumineuse et sa teinte, définie sur une échelle du gris (0%) à une couleur pure (100%). La couleur la plus saturée (ou pure) est obtenue en utilisant une seule longueur d'onde en forte intensité. Si l'intensité diminue, la saturation va diminuer. On peut aussi dé-saturer une couleur en y ajoutant du blanc, du noir, du gris ou sa couleur complémentaire.
• La luminosité (intensité lumineuse), qui fait référence à la réflexion globale : La quantité de lumière disponible qui va être captée par les photorécepteurs est essentielle et a affecté l'évolution des yeux (voir Land et Nilsson 2012). Par exemple, les animaux vivant la nuit ou en eaux profondes ont des yeux particulièrement grands afin de capter le maximum de lumière (Primates : Kirk 2004; oiseaux de rivage : Thomas et al., 2006) ; pour une compréhension
4
plus complète de l'évolution des yeux, de la structure et fonction des photorécepteurs, voir l'article de Michael Land sur la photoréception sur le site www.britannica.com.
Sur la planète, les arthropodes représentent la grande majorité (66%) des espèces de tous les organismes vivants, soit environ 990 000 espèces connues à ce jour (Chapman, 2013). Comparés aux vertébrés qui ne composent que 3 % de toutes les espèces animales, les insectes en représentent 75 %. Ils sont ubiquistes et peuvent être herbivores, carnivores, parasites/parasitoïdes, ou décomposeurs. Ils ont un taux de reproduction élevé et sont généralement de petite taille, ce qui en fait un groupe idéal pour les études de biologie moléculaire, cellulaire, évolutives ou encore écologiques.
Figure 0-1 : Cône TSL représentant les 3 paramètres (Teinte, Saturation, Luminosité) servant à caractériser la couleur d’un objet (aussi appelé « HSB cone » en anglais, pour Hue, Saturation and Brightness).
5
1.2 Signaux visuels : production et signification de la couleur des
insectes
1.2.1 Production et diversité des couleurs
Une partie de la lumière blanche incidente qui frappe la surface d'un insecte est absorbée et l'autre est diffusée. C'est cette lumière diffusée, soit réfléchie par la surface soit transmise au travers de la surface qui est à l'origine de la couleur observée. Ainsi la couleur est structurale lorsque la nature physique de la surface ne permet la réflexion que de certaines longueurs d'ondes, les autres étant transmises. Elle peut aussi être pigmentaire, lorsque la structure moléculaire d'un pigment produit par l'insecte facilite l’absorption d’une partie des longueurs d'ondes, diffusant les autres.
Couleurs structurales – La forme et la structure variées des épidermes
d'insectes peuvent être responsables de couleurs iridescentes. Ce sont des mécanismes physiques qui expliquent pourquoi les ailes du papillon du genre
Morpho nous apparaissent bleu-métallique, ou pourquoi la carapace du scarabée
japonais change de couleur selon l'angle sous lequel on le regarde (Ragaei et Sabry 2015).
Couleurs pigmentaires – Les insectes sont capables de synthétiser la plupart
de leurs pigments, sauf les flavonoïdes et caroténoïdes acquis par leur alimentation (cependant, voir la partie 1.4.1.3 pour les cas des pucerons). Pour une synthèse récente de la biochimie et de la biosynthèse de ces pigments, voir celle de Shamim
et al., (2014). Sans faire une liste exhaustive, nous pouvons citer la mélanine, qui
donne une couleur noire à la cuticule des insectes, la renforce et offre une protection contre les UV. Les ommochromes sont jaunes, rouges ou bruns et absorbent principalement l'UV. Ils sont largement distribués chez les insectes dans les cellules accessoires des yeux composés, généralement associés avec des ptérines. Les
quinones produisent des couleurs telles que le violet, le bleu, le vert ou encore
6
jaunes, orange et rouges et sont importants dans la vision des insectes (précurseurs des pigments visuels). La séquestration de flavonoïdes, qui sont des métabolites secondaires des plantes (rôle dans l'attraction des pollinisateurs et défense contre les herbivores) procurent une couleur crème ou jaune.
1.2.2 Rôles biologiques de la couleur des insectes
La couleur des insectes, que ce soit la couleur des ailes, de la cuticule des adultes, ou encore celle des stades larvaires a une importance écologique. Le plus souvent, elles ont un rôle dans la défense contre les prédateurs vertébrés mais peuvent aussi être très utiles dans la reconnaissance intra-spécifique (Chapman, 2013; p.813).
Relations inter-spécifiques – Les couleurs peuvent aider à dissimuler l'insecte
de la vue de ses prédateurs (cryptisme). Souvent, les hôtes/proies sélectionnent des surfaces sur lesquelles elles sont le moins visibles comme les phasmes par exemple. Parfois, le but est de surprendre le prédateur (comportement
déimatique). C'est le cas du paon-du-jour (Inachis io, Lépidoptère), qui déploie ses
ailes lorsqu'il est dérangé par un prédateur (Vallin et al., 2007). Ses ailes possèdent des ocelles de couleur bleue et jaune entourés de noir, rappelant celles du paon. Dans le cas de la famille des Nymphalidés ou des Lycénidés (Howse, 2013), les ocelles sont plus petits et situés aux extrémités des ailes, de façon à éloigner le regard des prédateurs de la tête du papillon (marques de détournement). La couleur peut aussi refléter la toxicité de l'insecte et ainsi prévenir le prédateur du danger encouru s'il le mange (aposématisme). Par exemple, la saturation de la couleur rouge des élytres des coccinelles est corrélée avec la concentration en alcaloïdes, ce qui en fait un signal honnête (Marìa Arenas et al., 2015). Enfin, on trouve aussi le mimétisme. Dans le cas du mimétisme müllérien, plusieurs espèces se ressemblent et ont toutes un goût désagréable pour le prédateur. Ainsi, l'évitement d'une des espèces entraînera l'évitement des autres également. Dans le cas du mimétisme batésien, une espèce inoffensive adopte le même patron de couleurs qu'une espèce nocive, dans ce cas, on parle de signal « malhonnête ».
7
Relations intra-spécifiques – La couleur est un facteur important dans la
reconnaissance intra-spécifique des insectes diurnes, comme c'est le cas chez les libellules, les demoiselles et les papillons. Elle sert dans le cas de la sélection inter-sexuelle (choix des partenaires) et intra-inter-sexuelle (compétition entre individus de même sexe). Par exemple, la diminution de la réflectance UV des bandes blanches situées sur les ailes de la demoiselle Megaloprepus caerulatus, est corrélée avec l'augmentation de la probabilité de perdre la compétition territoriale (Xu et Fincke 2015). Le mâle de la piéride de la rave (Pieris rapae) montre plus de tentatives d'accouplement envers les femelles plus colorées (contenant plus de ptérines). De plus, l'intensité de la coloration est positivement corrélée à la fécondité de la femelle, ce qui constitue un signal honnête pour le mâle (Tigreros et al., 2014; Xu et Fincke 2015).
Les polymorphismes de couleur que l'on retrouve souvent chez de nombreux insectes et arthropodes sont des exemples parfaits du maintien des polymorphismes via la sélection d’équilibre. Chez certains pucerons (voir la partie 1.4.1.3), les morphes de couleur sont maintenus par une prédation fréquence-dépendante de deux ennemis naturels (Losey et al., 1997). Il a été montré que la co-existence de deux couleurs de pucerons n’est pas toujours expliquée par une sélection de prédation, mais par une relation symbiotique entre les fourmis et les pucerons, qui favorisait fortement une proportion intermédiaire des deux couleurs de pucerons
Macrosiphoniella yomogicola (Watanabe et al., 2016). Le mécanisme sous-jacent
n’est pas encore élucidé mais une hypothèse émise est que comme toute la colonie exige la présence de fourmis pour survivre, un morphe avec un taux de reproduction élevé produisant vraisemblablement un miellat de qualité médiocre (morphe rouge dans l’étude) peut tirer parti de l’existence de l’autre morphe plus attrayante pour les fourmis (morphe vert) et donc une assistance accrue des fourmis.
8
1.3 Vision des insectes
1.3.1 Structure des yeux composés des insectes
La perception de la lumière par les insectes est permise grâce à deux sortes de photorécepteurs : les ocelles et les yeux composés. Les ocelles (de 1 à 3) sont disposés en triangle sur la tête de l'insecte et sont de simples capteurs de l'intensité lumineuse, ne permettant pas la formation d'images mais plutôt de mesurer la photopériode ou de détecter la polarisation de la lumière (Wellington, 1974). La capacité à former des images et la vision des couleurs (capacité à discriminer des stimuli visuels par le contenu chromatique et non l’intensité lumineuse) sont permises par les yeux composés. Les yeux composés des insectes sont formés de nombreuses unités anatomiquement identiques appelées ommatidies (jusqu'à 30 000 chez les libellules (Tillyard, 1917). Chacune de ces unités permet de percevoir un point de l'image de l'environnement. Les ommatidies sont formées par 8 - 9 cellules photo-réceptrices (R-cellules, Briscoe et Chittka 2001) composées elles-mêmes :
• D’une surface rassemblant la lumière : le rhabdomère. Les rhabdomères de chaque cellule photo-réceptrice peuvent être soudés pour former un rhabdome, ou indépendants augmentant la résolution par ommatidie (Zelhof
et al., 2006). Les yeux des insectes actifs le jour et ceux actifs la nuit
s'organisent de façon différente (Land, 1992), on distingue donc des yeux d'apposition et des yeux de superposition. Pour résumer de façon simpliste, les insectes diurnes possèdent les yeux d'apposition (Figure 1-2) : les rhabdomères des cellules photo-réceptrices sont soudés et toute la lumière est focalisée dans le rhabdome central. L'ommatidie est entourée par des cellules pigmentaires de telle façon que la lumière arrivant par d'autres angles soit supprimée. Les insectes nocturnes possèdent des yeux de superposition : les pigments des cellules pigmentaires sont « mobiles », ainsi la lumière peut arriver de différents angles augmentant la sensibilité (jusqu'à 1000 fois supérieure à celle des yeux d'apposition) mais réduisant la
9
résolution (voir la synthèse de Warrant et Dacke 2011). Il existe évidemment, comme dans tous systèmes biologiques des exceptions, c.-à-d. dans notre cas des espèces nocturnes possédant des yeux d'apposition ; c'est le cas par exemple de l'abeille charpentière Xylocopa tranquebarica (Hyménoptère, Apidé) (Somanathan et al., 2009).
• D’un pigment visuel : association entre un chromophore rétinien sensible à la lumière et une opsine (protéine). La séquence protéique de l’opsine ainsi que la structure du chromophore vont affecter l’absorption maximale du pigment visuel. La grande majorité des insectes possèdent trois types de récepteurs : des récepteurs sensibles à l’UV (λmax ≈ 350 nm), au bleu (λmax ≈
440 nm) et au vert (λmax ≈ 530 nm) (Peitsch et al., 1992; Briscoe et Chittka
2001), ils ont donc une vision trichromatique comme les hommes. La vision des couleurs a pour la première fois été mise en évidence chez les abeilles par Karl von Frisch en 1914.
Figure 0-2 : Schéma des yeux composés des insectes : apposition et superposition. Schéma adapté des figures du livre Animal Eyes de Land et Nilsson (2012).
10
1.3.2 Rôle et effets des UV sur les plantes et les insectes ravageurs de cultures
Depuis la découverte du trou dans la couche d'ozone il y a un peu plus de 30 ans par Farman et al., (1985), et l'augmentation des radiations UV-B (280 – 320 nm) qui s'en sont suivies, l’étude de l’effet de ces radiations sur les organismes vivants est devenue un sujet très convoité (Williamson et al., 2014). Les effets des UV sur les plantes cultivées et leur rendement soulèvent beaucoup d’interrogations. Un grand nombre d’études ont montré que l’augmentation de la radiation des UV-B cause des dommages au niveau de l’ADN, la modification de l’expression de certains gènes, la production de métabolites secondaires (spécialement des molécules absorbant les UV, comme les flavonoïdes), ou encore des changements morphologiques comme l’anatomie des feuilles, et leur épaisseur, l’induction de trichomes (pour des synthèses, voir : Kakani et al., 2003; Caldwell et al., 2007; Raviv et Antignus 2007; Ballaré et al., 2011).
Les modifications tant moléculaires que morphologiques causées par ces radiations vont se répercuter dans les interactions avec les insectes herbivores (contrôle des populations par les ressources ou “bottom-up”), en étroite relation avec les plantes mais aussi avec les ennemis naturels des insectes herbivores. Les conséquences peuvent avoir lieu au niveau de la performance des insectes herbivores sur les plantes soumises aux radiations UV, avec une réduction du taux d’herbivorie probablement due à l'accumulation de composés phénoliques (Foggo
et al., 2007; Mazza et al., 2013). Foggo et al. (2007) supposent que si les herbivores
se reproduisent moins sur les plantes en condition UV+, alors les parasitoïdes
devraient rencontrer plus d’hôtes en condition UV- et augmenter ainsi la probabilité de déposer plus d’œufs, favorisant leur valeur adaptative. Or, leurs résultats montrent que certains parasitoïdes sont significativement plus attirés par le complexe hôte/plante soumis aux radiations UV. L'hypothèse évoquée serait une plus grande concentration de composés volatils émis par les plantes en conséquence directe à leur exposition aux UV-B ; composés qui ressemblent à ceux
11
induits lors de la réponse de défense des plantes face aux herbivores (synthèse de Ballaré et al., 2011). Il a été montré que certains insectes phytophages, comme les thrips, sont capables de détecter le rayonnement UV-B solaire et, en conditions de choix, préféraient les environnements lumineux contenant moins d’UV-B (Mazza et
al., 2002)
Outre le trou dans la couche d'ozone et l'augmentation des radiations UV qui en découle, il ne faut pas oublier que l'environnement lumineux en général varie en fonction de l’heure de la journée, de la couverture nuageuse, de la saison (dû à l’inclinaison de l’axe de rotation de la terre autour du Soleil), mais aussi en fonction de l’habitat (sous une feuille par exemple) ou dans les cultures sous serres (Moss et Loomis 1952; Johnsen et al., 2006; Bergstrand et al., 2016). Dans un environnement lumineux naturellement changeant, il semble important pour les insectes se basant sur la vision, et notamment celle des couleurs, de pouvoir localiser leur cible quelle que soit la composition du spectre lumineux. En effet, lorsque l’éclairage change, la couleur réfléchie par les objets sera différente aussi.
1.4 Système d’étude
Cette thèse utilise comme modèle le parasitoïde Aphidius ervi et son hôte principal le puceron du pois, Acyrthosiphon pisum. Le parasitoïde originaire d’Europe, a été largement introduit en Amérique du Nord, en Europe et d’autres régions dans le cadre de programmes de lutte biologique classique afin de lutter contre plusieurs espèces de pucerons ravageurs de cultures fourragères et céréalières (Stary, 2009). Ces programmes de lutte biologique sont mis en place depuis 1882 en Amérique du Nord, notamment par Agriculture et Agroalimentaire Canada pour contrôler les populations de puceron du pois, de la pomme de terre, de la digitale et du pêcher.
12
1.4.1 Le puceron du pois, Acyrthosiphon pisum
1.4.1.1 Le cycle de vie
Le puceron du pois Acyrthosiphon pisum fait partie de la famille des Aphididés (Hémiptères), et de la sous-famille des Aphidinés, constituant environ la moitié des 4700 espèces de pucerons décrites à ce jour (von Dohlen et al., 2006).
À l’automne, les femelles pondent des œufs qui vont passer l’hiver et éclore au printemps suivant (Dixon, 1977). Les individus produits au printemps sont des femelles fondatrices, vivipares qui vont subir 4 mues (entre 7 et 10 jours) avant d’être au stade de reproduction. Elles produiront par parthénogenèse (c.-à-d. de façon clonale) entre 4 et 12 femelles par jour (environ une centaine dans leur vie), vivipares également. Lorsque la colonie est surpeuplée, des femelles ailées vivipares sont produites leur permettant de se disperser et de fonder une nouvelle colonie. À l’automne une génération d’individus sexués, mâles et femelles ovipares, est produite (en réponse au raccourcissement de la longueur du jour et à la chute des températures). Les femelles fécondées vivipares vont pondre les œufs qui passeront l’hiver jusqu’au printemps suivant.
1.4.1.2 Les endosymbiotes
Tous les pucerons sont en association symbiotique avec des bactéries (Manzano-Marın et al., 2017). On retrouve un endosymbiote primaire ou obligatoire car nécessaire à la survie et à la reproduction de tous les individus et chez toutes les espèces. C’est le cas de Buchnera aphidicola, aidant à l’obtention des nutriments qui ne sont pas acquis en assez grande quantité dans le phloème des plantes (Douglas, 2003). On retrouve aussi des endosymbiotes secondaires ou facultatifs non nécessaires à la survie des pucerons, mais ils peuvent l’améliorer dans certaines conditions. Par exemple : les bactéries Hamiltonella defensa, Serratia
symbiotica, PAXS (aujourd’hui connu sous le nom de Candidatus Fukatsuia symbiotica; Manzano-Marın et al., 2017), Regiella insecticola, Rickettsiella sp. Ces
13
résistance aux parasitoïdes et pathogènes fongiques (augmentation de la réponse immunitaire ou interruption du développement des tératocytes permettant aux larves de parasitoïdes de détourner les ressources nutrionnelles destinées aux embryons de pucerons; Oliver et al., 2003; Ferrari et al., 2004; Ferrari et al., 2004; Scarborough
et al., 2005; Guay et al., 2009), la résistance à la chaleur (Montllor et al., 2002), ou
une meilleure performance sur une plus grande variété de plantes (Tsuchida et al., 2004; Wagner et al., 2015). Ces bactéries peuvent agir de façon synergique lorsqu’elles sont présentes simultanément dans les pucerons (Guay et al., 2009; Oliver et al., 2010). Toutefois, l'hébergement d'endosymbiotes n'est pas libre de coût et peut réduire la durée de vie des hôtes Aphis fabae (Vorburger et Gouskov 2011). Oliver et al., (2008) ont également observé une réduction de la fréquence de pucerons A. pisum infectés par H. defensa dans une population (de laboratoire) non soumise à la présence de parasitoïdes suggérant un coût de la possession de H.
defensa lorsque la pression exercée par les parasitoïdes est négligeable.
1.4.1.3 Origine et polymorphisme de la couleur des pucerons
Les études sur les substances colorantes des espèces d’Aphididae ont débuté avec Todd et ses collaborateurs dès 1948 (Duewell et al., 1948). Ils nomment le pigment soluble dans l’eau, présent dans l’hémolymphe des pucerons vivants la protoaphine. Trois autres pigments dérivant de ce premier ont aussi été mis en évidence : la xanthoaphine (jaune), la chrysopahine (orange) et l’érythroaphine (rouge). Les pigments verts sont des quinones polycycliques et leurs glycosides (Bowie et al., 1966; Brown, 1973).
Les pucerons du pois A. pisum peuvent être trouvés principalement sous 2 couleurs dans une même population : rose et vert. La couleur des pucerons semble avoir 2 origines différentes. Premièrement, la présence d’un gène fongique, acquis au cours de l’histoire évolutive par transfert latéral, code pour la synthèse de caroténoïdes (non hydro-solubles). La caroténoïde désaturase présente dans les morphes roses, présente une mutation chez les morphes verts provoquant la perte du torulène (caroténoïde) et donc de la couleur rouge (Moran et Jarvik 2010). La
14
couleur est codée par un seul gène colorama à 2 allèles, l’allèle rose étant dominant sur l’allèle vert : les morphes roses ont donc pour génotype PP ou Pp, les morphes verts sont pp (Caillaud et Losey 2010). Deuxièmement, l'infection par l'endosymbiote facultatif du genre Rickettsiella modifie la couleur du corps des pucerons, du rose au vert. L’intensité de couleur verte est positivement corrélée avec la densité de l’infection par Rickettsiella (Tsuchida et al., 2010).
La couleur des pucerons peut aussi varier en fonction des conditions environnementales subies. À partir d’une même femelle fondatrice, Dombrovsky et
al., (2009) ont pu obtenir plusieurs variants de couleur du puceron du pois, des
mélanges d’individus roses, jaunes ainsi que quelques individus verts sur une même plante, en conditions optimales (20°C et nourriture en quantité nécessaire). Pour déterminer si des variations physiologiques pouvaient être associées aux variations de couleur, le taux de survie des pucerons a été testé dans des conditions extrêmes (4°C et sans nourriture). Les résultats montrent que les variants verts peuvent survivre pendant une longue période (DL50 : 10 jours), alors que les variants roses meurent beaucoup plus tôt (DL50 : 5 jours). Ainsi, la couleur des pucerons pourrait être reliée à leurs capacités de survie dans des conditions extrêmes.
Plus récemment, une étude a suggéré que les caroténoïdes, produites en grande quantité chez les pucerons, pourraient faire partie d’un système de photosynthèse archaïque (transfert d’électrons photo-induits). Elles permettraient donc aux pucerons de fabriquer leur propre énergie à partir des rayons lumineux (Valmalette et al., 2012). De plus, les morphes roses et verts contiennent la même quantité de réserve énergétique mais répartie différemment (Ahsaei et al., 2013). En effet, les clones verts contiennent une plus grande proportion de protéines que les clones roses ; alors que les clones roses contiennent plus de glucides et de lipides que les clones verts.
Le polymorphisme de la couleur chez le puceron du pois semble donc refléter différents mécanismes. Premièrement, il est adapté et maintenu par la pression de prédation/parasitisme inversement densité dépendante exercée par les ennemis
15
naturels (Losey et al., 1997). Deuxièmement, il est aussi associé au rôle écologique spécifique de chacun des deux morphes dans la population (Ahsaei et al., 2013), à savoir que les clones roses sont plus actifs dans la dispersion et la colonisation de nouvelles plantes hôtes, en produisant plus d'individus ailés que les clones verts (Weisser et Braendle 2001). Cette plus grande activité dans le déplacement des morphes roses serait, selon les auteurs, associée à leurs plus grandes réserves en lipides et glucides (Ahsaei et al., 2013).
1.4.2 La guêpe parasitoïde, Aphidius ervi
Aphidius ervi appartient à la famille des Braconidés (Hyménoptères). Cette
famille comprend plus de 40 000 espèces décrites et réparties sur 47 sous-familles (Beyarslan et Aydogdu 2013). Ce sont des parasitoïdes endoparasitoïdes ou ectoparasitoïdes d’autres insectes, le plus souvent de larves de Coléoptères, Diptères et Lépidoptères mais aussi d’Hémiptères comme c’est le cas pour Aphidius
ervi (voir le chapitre 6 du livre de Quicke, 2014).
Aphidius ervi est un endoparasitoïde koïnobionte, c.-à-d. que l’hôte continue
son développement après la ponte de l’œuf à l’intérieur de celui-ci (Pennacchio et Digilio, 1989). Il s’attaque principalement aux pucerons du pois (Acyrthosiphon
pisum), de la pomme de terre (Macrosiphum euphorbiae) et du pêcher (Myzus persicae). Lorsque la femelle a localisé un puceron (détaillé dans la partie 1.5.2.1),
elle le palpe avec ses antennes afin de l’examiner. Si le puceron est acceptable, la femelle replie son abdomen sous son corps et perce le corps du puceron avec son ovipositeur. Une fois encore, si le puceron est acceptable, la femelle y dépose un œuf. L’œuf éclos rapidement et la larve commence son développement en se nourrissant de l’intérieur du puceron. Le puceron prend finalement une couleur pâle et forme une momie caractéristique de la pupaison de la larve. L’adulte émerge au bout de 5 à 10 jours, en découpant une ouverture circulaire sur la face supérieure de la momie.
16
Le système de détermination sexuelle est haplo-diploïde chez les Hyménoptères. Dans ce système, la femelle provient d’un œuf fécondé, elle est diploïde. Le mâle d’un œuf non fécondé et est haploïde. La mère a donc la capacité de contrôler le sexe de sa progéniture en fécondant ou non l’œuf qu’elle va pondre.
1.5 Effets de l’environnement lumineux sur la vie des insectes
L'environnement lumineux à l'échelle d'un insecte varie grandement en qualité (composition spectrale) et en quantité de lumière (intensité lumineuse) en fonction de l'heure du jour, de la couverture nuageuse, de l'habitat, si le spectre solaire est direct ou diffus (Endler, 1993; Johnsen et al., 2006). Par exemple, une bonne partie du rayonnement ultraviolet, auquel sont sensibles les insectes, est bloquée par la végétation. En premier lieu il est nécessaire de distinguer d'une part, les effets de l'environnement lumineux sur l'activité générale des insectes et d'autre part les effets liés à la vision, sur leurs capacités à distinguer et reconnaître des « objets » (p. ex. des hôtes).
1.5.1 Réponse comportementale des ravageurs de cultures et de leurs ennemis naturels à la variation de l’environnement lumineux
1.5.1.1 Activité locomotrice
À ma connaissance il n’y a eu que peu d’études considérant la variation de l’activité locomotrice des insectes parasitoïdes en fonction de la modification du spectre lumineux, et non pas seulement de l'alternance jour/nuit. Quelques études ont montré que l’environnement lumineux, tant au niveau de l’intensité lumineuse qu’au niveau des longueurs d’ondes appliquées, avait un impact sur l’activité locomotrice des insectes herbivores ou sur celle de leurs prédateurs. Par exemple, chez Orius sauteri (Hémiptère, Anthocoridé), Wang et al., (2013) ont montré que la vitesse de déplacement des femelles adultes était réduite en faible intensité (1000 lux vs 5000 lux) et pour les courtes longueurs d’ondes (courte longueur d’onde LED bleu = 478 nm vs grande longueur d’onde LED rouge = 678 nm). De même, chez
17
lumineuse augmente la vitesse locomotrice des adultes. Les grandes longueurs d’ondes (> 520 nm) ont aussi un effet d’augmentation de la vitesse de déplacement (Tan et al., 2014). L'activité générale étant plus élevée à forte intensité, elle peut se répercuter par une augmentation du nombre d'hôtes tués ou parasités lorsque l'insecte est dans un environnement bien éclairé, comme c'est le cas pour Aphelinus
asychis (Schirmer et al., 2008).
Il est aussi intéressant de distinguer les deux types de locomotion que les insectes ont à leur disposition, à savoir la marche et le vol (Mound 1962). En effet, ces deux types de locomotion peuvent mettre en évidence deux phases de localisation de l'hôte, la recherche à longue distance par le vol et à courte distance avec la marche. Mound (1962) fait l’hypothèse que l’activité de vol de l'herbivore
Bemisia tabaci (Hémiptère, Aleyrodidé) est un compromis entre le comportement
migratoire déclenché par la sensibilité aux UV et la réaction d’atterrissage contrôlée par la sensibilité au jaune/vert (sensibilité visuelle qui peut être reliée à la gamme spectrale de lumière réfléchie dans laquelle se trouve leur plante hôte). Cette hypothèse a trouvé du soutien par des études sur les effets des plastiques bloquant les UV dans les cultures sous serres. Par exemple, l'activité de vol des pucerons ailés de Myzus persicae (Hémiptère, Aphididé), de la mouche blanche Trialeurodes
vaporariorum (Hémiptère, Aleyrodidé) ainsi que celle du thrips des petits fruits Frankliniella occidentalis (Thysanoptère, Thripidé) est réduite lorsque les UV sont
filtrés diminuant de ce fait l'infestation de nouvelles plantes (Chyzik et al., 2003; Doukas et Payne 2007a; Kigathi et Poehling 2012).
D’un autre côté, il semble y avoir très peu d'études détaillées sur l'activité locomotrice des parasitoïdes en fonction des longueurs d'ondes auxquelles ils peuvent être soumis dans leur environnement naturel. Une étude a montré que l'intensité lumineuse peut influencer l'activité de vol (Gu et Dorn 2001) : on observe une augmentation du nombre de parasitoïdes Cotesia glomerata (Hyménoptère, Braconidé) qui déclenchent le vol lorsque l'intensité lumineuse est plus élevée (1600 lux vs 600 lux). La faible intensité lumineuse diminue également le nombre de vols
18
orientés vers le complexe plantes/hôtes, diminuant ainsi l'efficacité du contrôle biologique de la piéride du chou Pieris brassicae (Lépidoptère, Pieridé) par ce parasitoïde à faible intensité lumineuse. Les études concernant les effets de l'environnement lumineux (composition du spectre et intensité) sur l'activité locomotrice des parasitoïdes restent encore trop peu nombreuses.
1.5.1.2 Émergence
L'environnement lumineux affecte les rythmes circadiens des insectes (et des organismes vivants en général). Il est donc important dès le développement des larves d'insectes jusqu'au moment où l'adulte éclot et pour son activité locomotrice par la suite. L'éclosion, en plus de l'activité locomotrice, ont été particulièrement étudiées chez la mouche du vinaigre, Drosophila melanogaster (Diptère, Drosophilidé) (Chapitre 9 dans Kumar 2002). L'intensité lumineuse ainsi que le spectre d'action ont été décrits pour le rythme d'éclosion de D. melanogaster, et il semble que ces deux paramètres de la lumière interagissent pour avancer ou retarder le rythme circadien d'éclosion. Par exemple, la lumière bleue (457 nm) est la longueur d'onde la plus efficace pour retarder le rythme d'éclosion (Kumar 2002, p.96). L'activité locomotrice est déclenchée par des longueurs comprises entre 350 et 650 nm pour des mouches de type sauvage alors que le spectre est réduit de 400 à 525 nm pour des mouches aveugles, montrant l'importance des yeux composés dans cette photoréception (Kumar 2002, p.97).
Chez beaucoup de parasitoïdes, les mâles émergent avant les femelles – de quelques heures à quelques jours (protandrie) – et en tirent un bénéfice en s'accouplant avec les femelles avant qu'elles ne se dispersent (synthèse de Boulton
et al., 2015). C’est le cas chez A. ervi, où le pic d’émergence des mâles apparaît 2
h après le début de la photophase. Le pic d’émergence des femelles est compris entre 3 et 6 h après le début de la photophase (He 2008). Dans cette étude, l'intensité lumineuse est restée constante et ainsi seul le temps depuis le début de