Université de Sherbrooke
Le rôle de DUSP4 dans l’athérosclérose
Par Donovan Fouere Programme de physiologie
Mémoire présenté à la Faculté de médecine et des sciences de la santé en vue de l’obtention du grade de maitre és en science (M. Sc.) en physiologie
Sherbrooke, Québec, Canada Été 2021
Membres du jury d’évaluation
Pedro Geraldes Ph.D., programme de Physiologie Abdelaziz Amrani Ph.D., programme d’Immunologie Mannix Auger-Messier Ph.D., programme de Physiologie
Résumé
Le rôle de DUSP4 dans l’athérosclérose Par
Donovan Fouere Programme de physiologie
Mémoire présenté à la Faculté de médecine et des sciences de la santé en vue de l’obtention du diplôme de maitre en sciences (M.Sc.) en physiologie, Faculté de médecine et des sciences de la santé, Université de Sherbrooke, Sherbrooke, Québec,
Canada, J1H 5N4
L’athérosclérose est à l’origine de nombreuses maladies cardiovasculaires et il s’agit d’une des principales complications macrovasculaires qui est directement lié à l’obésité. Ce phénomène entraine la formation de plaques de gras à l’intérieur de l’aorte due à l’accumulation de cholestérol dans l’espace sous-endothélial. Les voies de signalisations intracellulaires MAPK régissent l’ensemble des étapes menant à la formation de ces plaques et sont régulées par de nombreuses phosphatases comme les DUSPs. Notre laboratoire s’intéresse particulièrement aux rôles de DUSP4 sur le développement des maladies cardiovasculaires et les maladies rénales. Dans ce contexte, nous avons voulu déterminer le rôle de DUSP4 dans le développement de l’athérosclérose. Quelques études ont révélé qu’une délétion de DUSP1 dans un modèle de souris Apoe-/- entraine une importante diminution du pourcentage de plaques athérosclérotiques. Est-ce que la délétion de DUSP4 chez une souris Apoe-/- entraine également une diminution de la pathologie? Nos objectifs de recherches sont de déterminer le rôle de DUSP4 sur le développement de l’athérosclérose ainsi que sur l’expression des marqueurs inflammatoires clés exprimés par les macrophages. Des modèles de souris Apoe-/- et Apoe-/- Dusp4-/- ont été soumis à une diète riche en gras à partir de 2 mois d’âge et euthanasiés à 3 mois. L’aorte des souris a été soumise à une coloration en phase Oil red O pour calculer le pourcentage de plaque. L’artère bronchiocéphalitique a été isolée pour l’observation de la complexité de la plaque par marquage immunohistochimique au trichrome de Masson, Mac-2 et a-SMA. Le sang a été récolté afin de déterminer le profil inflammatoire des différents groupes de souris par Luminex et cytométrie de flux. Les modèles de souris Apoe-/- et Apoe-/- Dusp4-/-, sans diète gras, ont été utilisés afin d’isoler les macrophages péritonéaux après stimulation au thioglycolate à 3 mois d’âge. Ces cellules ont été traitées avec et sans palmitate à 75 µM durant 24h afin d’isoler les protéines et l’ARNm afin d’étudier l’activation de p38, ERK, JNK, l’expression de DUSP4 par immunobuvardage et l’expression de cytokines inflammatoires par RT-qPCR. In vivo, nos résultats ont démontré que le pourcentage de plaque, la complexité de la plaque et le profil proinflammatoire était fortement réduit chez les souris Apoe-/- Dusp4-/- par rapport aux souris Apoe-/-. Ex vivo, nous avons observé que le palmitate active p38 et ERK et augmente l’expression de DUSP4 dans les macrophages. Nous avons constaté que la délétion DUSP4 a entrainé une suractivation de p38 et ERK avec le palmitate et augmentée l’expression de DUSP1, IL-1a, CCL2 et M-CSF. En conclusion, nos résultats ont permis de montrer que la délétion de DUSP4 entraine une diminution de l’athérosclérose et que le palmitate induit l’activation de p38 et ERK dans les macrophages. Le rôle de DUSP4 et du palmitate reste encore à préciser dans le processus inflammatoire menant au développement de l’athérosclérose.
Table des matières
Résumé ... 2
Table des matières ... 3
Liste des figures ... 5
Liste des tableaux ... 7
Liste des abréviations ... 8
1. Introduction ... 10
1.1. L’obésité ... 10
1.2. Les Lipides ... 11
1.2.1. La classification des lipides ... 11
1.2.2. Le métabolisme des AG et du cholestérol ... 13
1.2.3. Les lipoprotéines ... 15
1.2.4. Les formes de la dyslipidémie ... 18
1.3. Les maladies cardiovasculaires ... 19
1.3.1. L’athérosclérose ... 20
1.3.2. La maladie des artères périphériques ... 23
1.4. La physiologie du système cardiovasculaire ... 24
1.4.1. Généralité ... 24
1.4.2. L’anatomie de l’aorte ... 26
1.5. La physiologie du système immunitaire ... 28
1.5.1. Généralité ... 28
1.5.2. Le système immunitaire inné ... 29
1.5.3. Le système immunitaire adaptatif ... 32
1.6. Les facteurs inflammatoires ... 34
1.6.1. Les chemokines ... 34
1.6.2. Les cytokines ... 37
1.7. Voies de signalisation MAPK dans les monocytes/macrophages ... 43
1.7.1. La voie ERK1/2 ... 44
1.7.2. La voie p38 ... 46
1.7.3. La voie JNK ... 47
1.8. Les protéines tyrosines phosphatases ... 48
1.8.1. Les PTP classiques ... 48 1.8.2. Les DUSPs ... 49 1.8.3. Spécificité et Régulation ... 50 1.8.4. DUSP1 ... 52 1.8.5. DUSP4 ... 53 1.8.6. DUSP6 ... 53
Objectifs ... 58
2. Matériel et Méthodes ... 59
2.1. Modèle animal ... 59
2.2. La préparation du palmitate ... 60
2.3. Les macrophages murins péritonéaux ... 61
2.4. Analyses protéiques par immunobuvardage ... 62
2.5. Analyse de l’expression ARNm – PCR quantitative ... 67
2.5.1. Extraction ARNm/ Dosage Nanodrop ... 67
2.5.2. Transcriptase inverse en ADNc ... 67
2.5.3. qPCR ... 68
2.6. Analyse Luminex ... 70
2.7. Analyse par cytométrie de flux ... 72
2.8. Immunohistologie ... 72
2.9. Coloration par Oil Red O des aortes de souris ... 73
2.10. Analyses statistiques ... 74
3. Résultats ... 75
3.1. Projet in vivo ... 75
3.1.1. Les effets de DUSP4 sur la formation des plaques athérosclérotiques ... 75
3.1.2. Les effets de DUSP4 sur la structure de la plaque ... 76
3.1.3. Les effets de DUSP4 sur les niveaux des cytokines/chemokines en circulation ... 78
3.1.4. Le niveau de monocyte en circulation ... 81
3.2. Projet ex vivo ... 84
3.2.1. Les effets du palmitate et de DUSP4 sur l’expression de DUSP4 et sur l’activation des MAPK dans les macrophages péritonéaux ... 84
3.2.2. Les effets du palmitate et de DUSP4 sur l’expression des DUSPs et des marqueurs inflammatoires dans les macrophages péritonéaux ... 86
Discussion ... 91
Perspectives ... 101
Conclusion ... 104
Remerciement ... 105
Liste des figures
Figure 1 : Les membres de la famille des lipides
Figure 2 : Synthèse des céramides et de DAG à partir du Palmitoyl-CoA
Figure 3 : La composition des lipoprotéines en pourcentage
Figure 4 : Les lipoprotéines de transport
Figure 5 : La pathophysiologie de l’athérosclérose
Figure 6 : La structure d’une artère
Figure 7 : L’anatomie de l’aorte
Figure 8 : L’activation des macrophages
Figure 9 : La maturation des lymphocytes T CD4+ et leurs rôles dans
l’athérosclérose
Figure 10 : Les voies de signalisations cellulaires MAPK
Figure 11 : Les différents sous-groupes de DUSPs et leurs structures
Figure 12 : Les différents mécanismes de régulation des DUSPs
Figure 13 : Organisation de l’expérience in vivo
Figure 14 : Le programme de qPCR
Figure 15 : Les effets de DUSP4 sur la formation des plaques
athérosclérotiques
Figure 16 : Les effets de DUSP4 sur la complexité de la plaque
Figure 17 : Les effets de DUSP4 sur les niveaux des cytokines/chemokines
en circulation
Figure 18 : Le niveau de granulocytes et de monocytes en circulation
Figure 19 : Les effets du palmitate sur l’expression de DUSP4 et de
l’invalidation génétique de DUSP4 sur l’activation des MAPK dans les
macrophages péritonéaux
Figure 20 : Les effets du palmitate sur l’expression de DUSP4 et de
l’invalidation génétique de DUSP4 sur l’expression ARNm des DUSPs et
des marqueurs inflammatoires dans les macrophages péritonéaux
Liste des tableaux
Tableau 1 : Les valeurs d’indice de masse corporelle associé aux risques
de complications cardiovasculaires
Tableau 2 : La nomenclature des AG à longue chaine
Tableau 3 : La composition du tampon de lyse
Tableau 4 : La composition de Laemmli 4X
Tableau 5 : La composition pour 2 gels d’acrylamide
Tableau 6 : La liste des anticorps utilisés pour l’expérience
d’immunobuvardage
Tableau 7 : La liste des amorces murines qPCR utilisées
Tableau 8 : La composition pour un échantillon et pour 24 échantillons
de qPCR
Tableau 9 : La liste des billes utilisées dans l’expérience du Luminex
Tableau 10 : La préparation d’anticorps utilisé pour l’expérience de
cytométrie de flux
Liste des abréviations
AG : Acides grasApo : Apolipoprotéines Arg : Arginase
BCA : Bronchiocephalitiques artere CML : Cellules musculaires lisses DAG : Diacylglycérol
DUSP : Dual specificity phosphatase
ERK : Extracellular signal regulated kinases FBS : Fetal bovin serum
Gr-1 : Marqueur de granulocyte 1 HDL : High density lipoprotein
ICAM-1 : Intracellular adhesion molecule 1 IFNg : Interféron gamma
IL : Interleukines
JNK : c-Jun N-terminal kinase LDL : Low density lipoprotein oxLDL : LDL oxydés
LFA-1 : Lymphocyte function associated antigen 1 LPS : Lipopolysaccharides
MAPK : Mitogen-activated protein kinase
GM/M-CSF : Granulocytes/macrophages colony stimulating factor MCP : Monocyte chemoattractant protein 1
NOX : Nicotinamide adénine dinucléotide phosphate NFkB : Nuclear factor kB
NO : Nitric oxyde
PBS : Solution saline tamponnée phosphate P/S : Pénicilline/streptomycine
PTP : Protéines tyrosines phosphatases RCPG : Récepteurs couplés aux protéines G
RPM : Rotation par minute
RPMI : Roswell Park Memorial Institute Medium RTK : Récepteurs à activité tyrosine kinase ROS : Radical oxygen species
TG : Triglycérides
TGFb : Transforming growth factor b
Th/Treg : Lymphocytes T auxiliaires et régulateurs TLR : Récepteurs de types Toll-Like
TNFa : Tumor nuclear factor a
VCAM-1 : Vascular cell adhesion molecule 1 VLA-4 : Very late antigen 4
1. Introduction
1.1. L’obésité
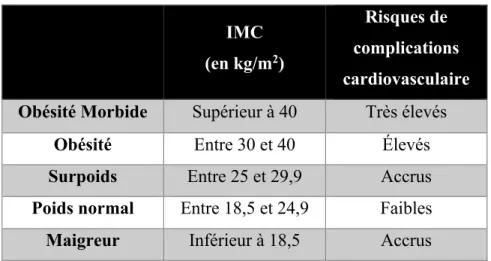
L’obésité se définit comme étant une accumulation anormale ou excessive de graisse corporelle représentant un risque pour la santé (WHO, 2017). L’obésité, le surpoids ou le poids normal sont classés en fonction de l’indice de masse corporelle (IMC). Il s’agit du rapport (en kg/m2) se basant sur le poids (en kilogramme) en fonction de la taille (en mètre)
de l’individu (Tableau 1).
Tableau 1: Les valeurs d’indice de masse corporelle associé aux
risques de complications cardiovasculaires
IMC
(en kg/m2)
Risques de complications cardiovasculaire
Obésité Morbide Supérieur à 40 Très élevés Obésité Entre 30 et 40 Élevés Surpoids Entre 25 et 29,9 Accrus Poids normal Entre 18,5 et 24,9 Faibles Maigreur Inférieur à 18,5 Accrus
L’Organisation mondiale de la santé a répertorié en 2016 que plus de 1,9 milliard de la population mondiale était en situation de surpoids et que 650 millions d’entre eux étaient obèses. Ce chiffre a été multiplié par trois depuis 1975. En 2018 au Canada, environ 7,3 millions d’individus âgés de 18 ans et plus étaient obèses, soit environ 26,8 % de la population du pays. En outre, plus de 36 % de la population étaient en situation de surpoids (Statistique Canada, 2019). L’obésité est fortement liée au déséquilibre de la balance énergétique qui se compose de la consommation d’énergie et de la dépense d’énergie (Blüher et al., 2019). Certaines perturbations génétiques peuvent également venir modifier cette balance énergétique (O’Rahilly et al., 2006). En 1997, une étude a mis en évidence
chez une famille consanguine du Pakistan une mutation dans le gène codant pour la leptine, hormone de la satiété, menant à une diminution de sa production et donc à une importante disposition à l’obésité chez ces individus (Montague et al., 1997). Ces paramètres sont fortement influencés par le manque d’activité physique ou par une alimentation inadéquate, qui sont les principales causes de ce phénomène. Les complications de l’obésité ne sont pas seulement esthétiques, mais touchent également l’ensemble des systèmes physiologiques. Les niveaux de lipides en circulation retrouvés chez les individus obèses et en surpoids augmentent le risque de dépôt de ces corps gras à l’intérieur des artères, favorisant ainsi le développement de nombreuses complications cardiovasculaires (Abbasi et al., 2002). Le système immunitaire est également perturbé chez les personnes souffrant d’obésité. L’augmentation de la taille et du nombre d’adipocytes (lieux de stockage des lipides) favorise l’infiltration des cellules immunitaires et la sécrétion des molécules pro-inflammatoires ainsi que de nombreuses pathologies comme l’athérosclérose, la néphropathie ou le diabète (Shoelson et al., 2007). Les complications cardiovasculaires sont les premières causes de mortalité au monde (WHO, 2017) ; par conséquent, la communauté scientifique du monde entier rassemble connaissances et ressources afin de lutter contre ce phénomène grandissant.
.
1.2. Les lipides
1.2.1. La classification des lipides
Les lipides font partie des trois principaux substrats énergétiques utilisés par la quasi-totalité des cellules de l’organisme. Ils se retrouvent principalement dans l’alimentation, mais peuvent également être synthétisés par les cellules. Ils sont regroupés en plusieurs sous-catégories et se distinguent les uns des autres par leurs structures chimiques. Il s’agit des triglycérides (TG), des acides gras (AG), des phospholipides membranaires, du glycérol et du cholestérol représentés dans la Figure 1. En plus de leur capacité à fournir de l’énergie, ils sont également utilisés pour la synthèse de certaines hormones, de molécules inflammatoires et participent à la fluidité et à la structure membranaire (de Carvalho et al., 2018). Les AG sont regroupés en plusieurs sous-catégories réparties en
fonction de la longueur de leur chaîne latérale (petite, moyenne ou longue), du nombre d’insaturation de cette chaîne (polyinsaturée, mono-insaturée et saturée) et de l’orientation de l’insaturation (position cis ou position trans). Le Tableau 2 rassemble les principales familles des AG à longue chaîne.
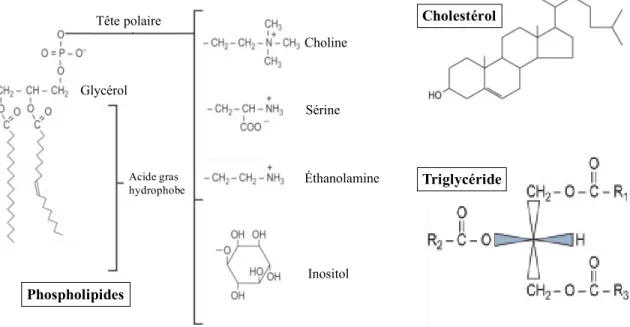
Figure 1 : Les membres de la famille des lipides.
Les phospholipides sont composés d’une molécule de diacylglycérol hydrophobe et d’une tête polaire pouvant prendre la forme de choline, de sérine, d’éthanolamine ou d’inositol. Le cholestérol est un composé métabolique important dans la structure et la fluidité des membranes cellulaires et dans la synthèse de certaines hormones. Les triglycérides sont composés d’une molécule de glycérol attachée par trois chaînes d’acide gras. Il s’agit de composés lipidiques représentant une grande réserve d’énergie qui sont principalement retrouvés dans les tissus adipeux (Adaptée de Fahy et al., 2011).
Glycérol Acide gras hydrophobe Tête polaire Choline Sérine Éthanolamine Inositol Cholestérol Triglycéride Phospholipides
Tableau 2 : La nomenclature des AG à longue chaîne
Les AG sont classifiés selon leur structure chimique. Les AG saturés représentent les AG sans double liaison entre deux atomes de carbones et regroupent les acides lauriques, myristiques, palmitiques, stéariques et arachidiques. Les AG mono-insaturés composés majoritairement des acides palmitoléiques et oléiques regroupent les molécules possédant une insaturation. Les acides linoléiques, linoléniques et arachidoniques font partie de la famille des AG polyinsaturées (Adaptée de Cuvelier et al., 2004).
1.2.2. Le métabolisme des AG et du cholestérol
La transformation des AG est principalement située à l’intérieur du tissu adipeux et du foie. Leur dégradation peut se faire dans l’ensemble des tissus à l’exception des organes glucodépendants comme le cerveau. Le métabolisme des AG comprend leur catabolisme en acétyl-CoA, leur synthèse à partir de ce dernier et leur élongation/désaturation. Sous l’action de la triglycéride lipase, les triglycérides sont dégradés en AG et glycérol à
Acides gras saturés
Nom usuel Nomenclature Formule chimique
Acide Laurique 12 : 0 CH3(CH2)10COOH
Acide Myristique 14 : 0 CH3(CH2)12COOH
Acide Palmitique 16 : 0 CH3(CH2)14COOH
Acide Stéarique 18 : 0 CH3(CH2)16COOH
Acide Arachidique 20 : 0 CH3(CH2)18COOH
Acides gras mono et polyinsaturés
Nom usuel Nomenclature Formule chimique
Acide
Palmitoléique 16 : 1 CH 3(CH 2) COOH5CH CH(CH 2) 7
Acide Oléique 18 : 1 CH3(CH2)7CH
CH(CH2)7COOH
Acide Linoléique 18 : 2 CH3(CHCH(CH2)42CH CHCH)7COOH2CH Acide Linolénique 18 : 3 CH3CH2CH CHCH2CH CHCH2CH CH(CH2)7COOH Acide Arachidonique 20 : 4 CH3(CH2)4CH CHCH2CH CHCH2CH CHCH2CH CH(CH2)3COOH
l’intérieur de la cellule. Une fois dans la cellule, les AG sont catabolisés par la voie de la ß-oxydation, qui les transforme en acétyl-CoA à l’intérieur des mitochondries afin de fournir de l’énergie sous forme d’ATP à la cellule. Cette oxydation aérobique n’étant pas réversible, les AG peuvent être synthétisés de trois manières, soit à partir de l’acétyl-CoA qui mène à la formation du palmitate, soit par élongation mitochondriale de ce dernier ou soit par l’élongation/désaturation menant à la formation des AG insaturés. Une fois formés, les AG participent à la synthèse de certaines molécules bioactives comme les céramides et des sphingolipides qui sont produites à partir de palmitoyl-CoA et la sérine. De plus, afin de reformer les triglycérides dont ils sont issus, les AG participent à la synthèse du 1,2 diacylglycérol (DAG), une autre molécule bioactive importante. La Figure 2 présente un résumé de ces réactions. Ces composés participent à la régulation de certaines voies de signalisations cellulaires (Macrae et al., 2013) et sont également impliqués dans le processus de plusieurs pathologies cardiovasculaires (Ota et al., 2007 ; Erion et al., 2010).
Figure 2 : Synthèse des céramides et de DAG à partir du
Palmitoyl-CoA
Pour la synthèse du DAG, le palmitoyl-CoA est fusionné avec une molécule de glycérol 3 phosphate (G3P) grâce à la G3P acyltransférase pour former l’acide lysophosphatidique. Ce dernier est transformé en acide phosphatidique et DAG par l’action de deux acyl
1,2 Diacylglycérol (DAG) Glycérol-3-phosphate (G3P) Acide lysophosphatidique Acide phosphatidique Acyl transférase Palmitoyl-CoA Sérine 3-Cétosphinganine Sphinganine Dihydrocéramide Céramide + 3- Cétosphinganine synthase 3- Cétosphinganine réductase Dihydrocéramide réductase Acyl-CoA transférase Triglycéride Acyl transférase Acyl transférase Acyl transférase
transférases. Le DAG peut finalement poursuivre sa transformation en triglycéride. Pour la synthèse des céramides, l’ajout d’une molécule de sérine au palmitoyl-CoA entraîne la formation de la 3-Cétosphingamine sous l’action de la 3-Cétosphingamine synthétase. La 3-Cétosphingamine réductase, l’acyl-CoA transférase et la dihydrocéramide réductase achèvent la formation des céramides.
Le cholestérol est synthétisé à partir de l’acétyl-CoA, dans le foie et les intestins, pour participer à la synthèse des acides biliaires, des hormones stéroïdiennes et de la vitamine D ou être estérifié afin de faciliter son transport et son stockage. Le taux de cholestérol retrouvé en circulation est principalement assuré par la synthèse endogène qui représente les deux tiers du cholestérol. Le reste est assuré par l’apport alimentaire (Kapourchali et al., 2016). Le cholestérol et les TG, étant des molécules hydrophobes, nécessitent d’être associés à des vésicules pour permettre leur transport vers l’ensemble de l’organisme.
1.2.3. Les lipoprotéines
Il existe 5 classes de lipoprotéines de transport qui se distinguent entre elles par leurs densités et leurs compositions en lipides et en protéines : les chylomicrons, les chylomicrons remnant, les very low density lipoprotein (VLDL), les low density lipoprotein (LDL) et les high density lipoprotein (HDL). La Figure 3 représente un schéma de la composition lipidique des différentes lipoprotéines de transport.
Ces vésicules expriment différentes protéines membranaires ayant diverses fonctions : ce sont les apolipoprotéines (Apo). Une fois passée la barrière intestinale, les lipides alimentaires quittent les intestins, pour rejoindre la circulation sanguine abord des chylomicrons. La Figure 4 présente un résumé schématisé du transport des lipides à travers les lipoprotéines. Ces derniers sont les vésicules les plus volumineuses et contiennent une importante quantité de lipides. Ils contiennent à leur surface l’Apo B48 qui permet leur transport vers les muscles et le tissu adipeux. Différentes études ont démontré qu’un niveau élevé d’Apo B48 en circulation corrèle avec une augmentation du processus d’athérosclérose et des risques de développer un diabète de type 2. L’Apo C-2 est une autre apolipoprotéine clé, qui joue le rôle de coactivateur de la lipoprotéine lipase qui permet la
conversion des TG en AG, afin de faciliter l’entrée des lipides à l’intérieur des organes. Des modifications de certains gènes codants pour l’ApoC-2 et la lipoprotéine lipase sont retrouvées chez certaines personnes atteintes d’hypertriglycéridémies héréditaires (Johansen et al., 2012). Issus des tissus périphériques, les chylomicrons remnants ont cédé une grande partie de leur TG, présentent des niveaux de cholestérol élevés et ont la particularité d’exprimer l’apolipoprotéine E qui a pour but de transporter le cholestérol exogène vers le foie. Un modèle murin n’exprimant pas cette protéine présente un niveau de chylomicron remnant et de VLDL élevé, ce qui en fait un modèle de choix utilisé par la plupart des groupes de recherches étudiant le développement de l’athérosclérose (Veseli et al., 2017). Quittant le foie, les VLDL assurent le transport du cholestérol endogène vers les tissus périphériques. Ces lipoprotéines exprimant l’Apo B100 permettent la distribution des TG, des AG et du cholestérol aux tissus périphériques. Par la suite, elles sont recyclées dans le foie ou transformées en LDL. Connues dans le langage courant comme le « mauvais cholestérol », elles ont la plus haute concentration en cholestérol et expriment l’Apo C2 et l’Apo A. Ces vésicules de transport sont captées par les tissus périphériques et le foie qui possèdent des récepteurs spécifiques (LDLR) capables de les endocyter, mais ce sont les seules lipoprotéines capables d’être captées par les macrophages. Des modèles de souris Ldlr-/- présentent un taux de LDL élevé en circulation, ce qui en fait aussi un modèle de
choix pour l’étude de l’athérosclérose (Veseli et al., 2017). L’internalisation des LDL par les macrophages sera détaillée dans la section 1.3.1. La membrane des LDL peut subir plusieurs modifications chimiques (acétylation ou oxydation) qui sont à l’origine de certaines complications vasculaires. Les HDL, connus comme étant le « bon cholestérol » dans le langage courant, sont les particules les plus denses de la famille des lipoprotéines. En effet, elles ont pour principale fonction de capter l’excédent de cholestérol des tissus périphériques pour le retourner vers le foie (Rosenson et al., 2012). Synthétisés par le foie et les intestins, les HDL participent aux échanges des lipides et des Apo avec les chylomicrons et les VLDL.
Figure 3: La composition des lipoprotéines en pourcentage
Les lipoprotéines de transport sont composées des triglycérides, du cholestérol, des phospholipides et des protéines avec des pourcentages variables. Les chylomicrons sont composés à 90% de TG, 5% de cholestérol, 3% de phospholipides et 2% de protéines. Les VLDL sont composées à 60%, 20%, 15% et 5% de TG, cholestérol, phospholipides et protéines respectivement. Les LDL sont composées à 8% de TG, 25% de cholestérol, 30% de phospholipides, 40% de protéines et les HDL à 5%, 25%, 30% et 40% de TG, cholestérol, phospholipides et protéines respectivement.Figure 4 : Les lipoprotéines de transport
(1) Les lipides alimentaires traversent la barrière intestinale par les érythrocytes dans les chylomicrons (Chy). (2) Une fois passée la circulation sanguine ces derniers libèrent une
Chylomicrons VLDL LDL HDL
Triglycérides Cholestérol Phospholipides Protéines
Lipides alimentaire Intestin Chy Tissus adipeux Foie Rem Tissus adipeux Muscles VLDL LDL HDL 1 2 3 4a 4b 4c 5 HDL HDL
partie de leur contenu dans les tissus adipeux (2) et sortent sous forme de chylomicron remnants (Rem) en direction du foie (3). Le foie produit les VLDL (4a) qui libèrent les lipides qu’ils contiennent vers les tissus adipeux et les muscles (4b) pour se transformer en LDL (4c). L’excès de VLDL peut également se recycler vers le foie. Les HDL ont pour but de recycler le cholestérol et les triglycérides excédentaires provenant des LDL, des VLDL et des tissus (5).
1.2.4. Les formes de la dyslipidémie
La dyslipidémie est un phénomène qui se définit comme étant une modification anormale du niveau de lipides en circulation (Couvert et al., 2010). Il s’agit plus précisément d’un niveau anormalement élevé de cholestérol total, de triglycérides ou de LDL en comparaison avec un niveau faible de HDL. Ce phénomène peut entraîner de nombreuses complications cardiovasculaires et peut être causé par de mauvaises habitudes de vie (alimentation riche en gras et sédentarité), par certaines anomalies génétiques héréditaires et par certains désordres métaboliques ou endocriniens. Par exemple, le diabète, l’hyperthyroïdie ou encore les maladies rénales chroniques sont souvent associés à certaines formes de dyslipidémie chez les patients, et par ce fait même, au risque de développer certaines complications coronariennes (West et al., 1983 ; Howard et al., 2000 ; Schofield et al. 2016). Le terme dyslipidémie rassemble l’hyper/hypocholestérolémie, l’hyper/hypotriglycéridémie et l’hyper/hypolipoprotéinémie correspondant à une élévation ou une diminution importante du taux de cholestérol ou de TG ou des deux respectivement, mais aussi du niveau de lipoprotéines. Des mutations génétiques, retrouvées chez certains individus, entraînent un ralentissement ou une accélération du métabolisme des lipides. L’hypobêtalipoprotéinémie, par exemple, est provoquée par une erreur dans le gène codant pour l’ApoB. Dans ce cas, les cellules intestinales ne peuvent pas empaqueter les lipides dans les vésicules, ce qui entraîne une accumulation des lipides dans l’intestin et une diminution de la cholestérolémie sanguine (Couvert et al., 2010). À l’opposé, l’hyperbêtalipoprotéinémie est une maladie héréditaire provoquant une importante hypercholestérolémie chez les individus d’une même famille. Ces derniers présentent des niveaux normaux de triglycérides, mais un niveau important de cholestérol total. La
dyslipidémie ne provoque pas de symptômes particuliers, mais est à l’origine d’importantes complications vasculaires. L’athérosclérose représente la principale conséquence des différentes formes de dyslipidémies et constituera le principal sujet de discussion dans la prochaine section sur les maladies cardiovasculaires.
1.3. Les maladies cardiovasculaires
Les maladies cardiovasculaires rassemblent les pathologies ciblant le cœur et le système circulatoire. L’Organisation mondiale de la santé a classé ce groupe de maladies comme étant la première cause de décès au monde. Vers la fin des années 1940 aux États-Unis, l’étude Framingham a été amorcée afin de mieux comprendre les différentes causes liées aux maladies cardiovasculaires (Dawber et al., 1957). Elle a permis d’associer notamment l’hypertension artérielle, la dyslipidémie, les mauvaises habitudes alimentaires avec de nombreuses complications cardiovasculaires. À ce jour, cette étude regroupe plusieurs cohortes sur près de trois générations de patients et l’hérédité devient un nouveau paramètre d’investigation. En effet, certains désordres métaboliques et certaines modifications génétiques ou épigénétiques ont été identifiés dans les dernières décennies et mis en corrélation avec certaines pathologies cardiovasculaires (Andersson et al., 2019 ; Blüher et al., 2019). En clinique, la dyslipidémie se diagnostique à partir de plusieurs tests sanguins faits chez les personnes de plus de 40 ans ayant des antécédents d’hypertension, une forme de diabète, une forme de dyslipidémie héréditaire, une atteinte rénale, une maladie inflammatoire chronique et chez les personnes présentant un IMC supérieur à 30 kg/m2.
Une personne présentant une concentration de cholestérol total (CT) supérieure à 5 mmol/L et un rapport CT/HDL supérieur ou égal à 6 accroît le risque de complications vasculaires et nécessite une prise en charge médicale. Afin de mieux comprendre les pathologies associées au système cardiovasculaire, quelques exemples vont être décrits dans les prochaines sections.
1.3.1. L’athérosclérose
L’athérosclérose est une maladie inflammatoire chronique, se traduisant par une accumulation de lipides et de cellules inflammatoires à l’intérieur de l’espace sous-endothélial des vaisseaux (Torres et al., 2015). Ce projet s’intéressant exclusivement aux macrovaisseaux, l’aorte sera donc l’exemple utilisé pour décrire cette maladie. Lors d’un stade avancé de la pathologie, de nombreuses complications vasculaires peuvent apparaître comme étant des accidents cérébrovasculaires, l’ischémie du myocarde et des membres inférieures. Les principales causes sont le tabagisme, une diète riche en gras et le manque d’activité physique. La physiopathologie de l’athérosclérose est un processus long et complexe menant à la formation de « bouchons de gras » appelée plaques athérosclérotiques. Les conditions d’hypercholestérolémies, mentionnées précédemment, entraînent une augmentation de l’infiltration des LDL à l’intérieur des artères. Une fois passée la barrière endothéliale, ces lipoprotéines peuvent subir plusieurs modifications aux niveaux membranaires, l’oxydation et l’acétylation en sont des exemples. En effet, des groupes de recherches ont démontré que l’oxydation des LDL (oxLDL) participe à l’activation des cellules endothéliales (Steinbrecher et al., 1984 ; Steinberg et al., 2009). Le dysfonctionnement endothélial a été décrit pour la première fois par le chercheur Rudolph Virchow en 1856, lorsque ce dernier a observé qu’une accumulation de lipides localisés corrélait avec une augmentation de la perméabilité membranaire. Près d’un siècle plus tard, ce sont les chercheurs Russell Ross et John A. Glomset qui émettent l’hypothèse « Response to Injury Hypothesis ». Cette hypothèse explique que des lésions artérielles peuvent être provoquées par certaines substances nocives à l’extérieur et à l’intérieur des vaisseaux (cholestérol, tabac, cholestérol oxydé, hyperglycémie…), entraînant ainsi une augmentation de la perméabilité de ces derniers et favorisant le processus d’athérosclérose (Steinberg et al., 2009). Les études réalisées par la suite ont démontré que le dysfonctionnement endothélial se traduit majoritairement par une augmentation de l’expression des molécules d’adhésion, de la sécrétion de molécules chemoattractantes, de la production de monoxyde d’azote (NO) et d’espèces réactives à l’oxygène (ROS) (Nakashima et al., 1998 ; Dawson et al., 1999 ; Ley et al., 2001 ; Barlic et al., 2007). L’augmentation de la production de NO cause l’inhibition de facteur de transcription jouant
un rôle dans la régulation de l’expression des molécules d’adhésion et de certaines sélectines (Neumann et al., 2000).
Le dysfonctionnement endothélial a pour conséquence d’augmenter le recrutement et l’adhésion des cellules immunes vers la barrière vasculaire. Important membre du système inné, les monocytes sont recrutés en premier et infiltrés dans l’espace sous-endothélial. Une fois différenciés en macrophage, ils ont pour rôle de phagocyter les oxLDL afin de nettoyer les vaisseaux du cholestérol accumulé. Les macrophages expriment de nombreux récepteurs de type scavenger pour permettre la phagocytose des microorganismes et également des LDL. Les récepteurs comme CD36, LOX-1 ou encore SR-A participent à la phagocytose des LDL et à la progression de l’athérosclérose (Rader et al., 2005). Lors de la phagocytose des lipoprotéines, ces dernières sont dégradées à l’intérieur des lysosomes et le cholestérol est accumulé sous forme de gouttelette lipidique à l’intérieur du réticulum endoplasmique. Ce phénomène est favorisé par l’activité enzymatique des LDL et par leur modification structurale. Lors de cette étape, les macrophages sont transformés en cellules spumeuses. De nombreuses études ont montré qu’une délétion du récepteur SR-A dans les macrophages ou dans un modèle de souris entraîne une diminution de la formation des cellules spumeuses (Suzuki et al., 1997 ; Sakaguchi et al., 1998 ; Rader et al., 2005). Certains mécanismes sont utilisés par les macrophages pour éliminer le cholestérol qu’ils ont accumulé ; on parle alors d’efflux de cholestérol. Une fois les LDL ou les oxLDL phagocytées, elles sont par la suite fusionnées dans les lysosomes pour libérer le cholestérol dans le cytosol. Ici, le cholestérol libre peut-être incorporé à l’intérieur des autophagosomes et expulsé à l’extérieur des macrophages. La forme estérifiée du cholestérol peut être dé-estérifiée et relâchée directement dans la circulation par diffusion à travers la membrane ou bien emmagasinée à l’intérieur des HDL.
Les cellules musculaires lisses (CML), composant la couche du média, sont activées et prolifèrent vers l’endothélium où elles sécrètent plusieurs composants de la matrice extracellulaire afin de former un cap fibreux qui sert à protéger les plaques de la rupture et de diminuer l’effet de fibrose. Cependant, une rupture du cap est possible, libérant l’ensemble du contenu des plaques dans la circulation, ce qui déclenche le processus de coagulation. La rupture de la plaque peut être expliquée par l’inhibition de la synthèse de
aussi par la dégradation du cap fibreux pas les métalloprotéinases 4 (Vacek et al., 2015). La formation de caillots est à l’origine de nombreuses complications cardiovasculaires liées à l’athérosclérose comme les accidents cérébrovasculaires, les attaques cardiaques, mais également l’ischémie des membres inférieurs. La figure 5 met en image la pathophysiologie de l’athérosclérose.
Des décennies de recherche ont permis de mettre en place certaines solutions pour diminuer la formation des plaques athérosclérotiques en régulant les niveaux de cholestérol. La statine est un inhibiteur de l’hydroxymethylglutaryl coenzyme A réductase (HMG-CoA réductase) qui est une enzyme clé dans la synthèse du cholestérol endogène et fait partie des traitements les plus utilisés pour traiter la dyslipidémie. Il a été démontré que la statine entraîne une diminution du développement des maladies coronariennes chez les patients atteints d’hypercholestérolémie. Plus récemment, des inhibiteurs de la proprotéine convertase subtilisin-kexin de type 9 (PCSK9), qui permettent la réduction du niveau de LDL en circulation, ont été développés. Ils ont pour effet de diminuer l’activité de PCSK9 qui est une protéase hépatique qui induit la destruction des récepteurs LDL (Palasubramaniam et al., 2019). Pour diminuer le processus athérogène, la baisse de la cholestérolémie est une étape importante, mais la diminution de l’inflammation a également son importance.
Figure 5 : La pathophysiologie de l’athérosclérose
Les conditions de dyslipidémie entraînent l’infiltration du cholestérol à l’intérieur de l’espace sous-endothélial, ce qui favorise l’expression des molécules d’adhésion à la surface de l’endothélium vasculaire (1). Cette étape favorise l’infiltration des monocytes circulant à l’intérieur des vaisseaux (2) qui, en se différenciant en macrophages, forment des cellules spumeuses. Sous l’action des cellules T, le processus inflammatoire s’amplifie pour former des corps nécrotiques (3). La rupture de l’endothélium entraîne la formation de caillot (4) menant à de nombreuses complications cardiovasculaires (Adapté de C. Dawson et al., 1999).
1.3.2. La maladie des artères périphériques
La maladie des artères périphériques (MAP) fait partie des anomalies macrovasculaires provoquées par le développement des plaques athérosclérotiques au niveau des membres inférieurs. C’est une pathologie retrouvée principalement chez les individus de plus de 50 ans dont la prévalence augmente avec l’âge (Criqui et al., 2014). Comme pour
l’athérosclérose, le tabagisme, la sédentarité ou les mauvaises habitudes alimentaires sont les principales causes de la maladie des artères périphériques. D’autres pathologies comme l’hypertension artérielle, la dyslipidémie ou le diabète augmentent le risque de développer de telles complications ciblant les membres inférieurs. Comme mentionné précédemment, l’athérosclérose provoque le rétrécissement de la lumière artérielle, diminuant ainsi l’apport sanguin ou ischémie. Dans le cas de la MAP, les nombreuses plaques formées vers les membres inférieurs (principalement les jambes) entraînent une ischémie de ces derniers, ce qui a pour conséquence de diminuer l’apport en oxygène dans les muscles. Chez la plupart des personnes saines, le processus d’angiogenèse, c’est-à-dire la formation de nouveaux vaisseaux sanguins, vise à contourner ce problème et permettre ainsi l’irrigation de la jambe. Chez les personnes diabétiques par exemple, le phénomène d’angiogenèse est altéré ce qui mène, dans la plupart des cas, à la nécrose des membres et à leur amputation. Pratiquer une activité physique régulière, combinée avec une diète saine, demeure la principale recommandation des professionnels de la santé.
1.4. La physiologie du système cardiovasculaire
1.4.1. Généralité
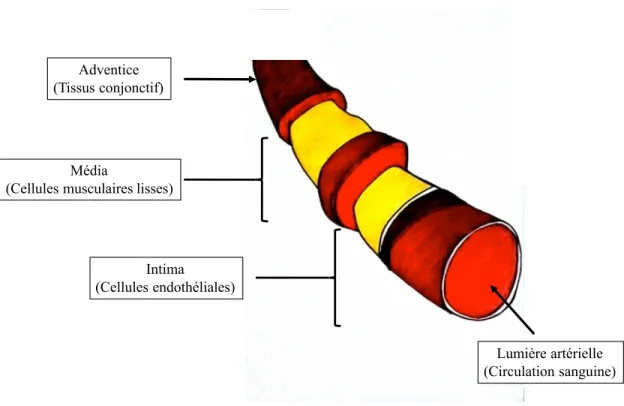
Le système cardiovasculaire est composé du cœur et de l’ensemble du réseau vasculaire, qui rassemble les vaisseaux sanguins et lymphatiques. La circulation sanguine prend son origine à la sortie du ventricule gauche où le sang est chargé en oxygène. Lors de la systole, la pression à l’intérieur du ventricule est élevée, ce qui entraîne l’ouverture de la valve aortique et permet la propulsion du sang à l’intérieur de l’aorte. Du cœur vers les tissus, les artères se rétrécissent et se subdivisent en plusieurs artérioles qui alimentent les cellules de leur contenu (oxygène et nutriments). À la sortie des cellules, les veinules transportent l’ensemble des déchets métaboliques et le dioxyde de carbone vers le cœur pour être relâchées vers l’extérieur. Ce cheminement est favorisé par la pression artérielle, le débit sanguin et les conditions physiologiques de l’organisme. Au niveau tissulaire, les artères sont composées de trois différentes sous-couches entourant la lumière artérielle ou le lumen. La première couche qui est en contact direct avec la circulation sanguine est l’intima
qui est composée principalement des cellules endothéliales, d’une membrane basale et des fibres d’élastines. La deuxième sous-couche, le média, est composée majoritairement des cellules musculaires lisses et la dernière sous-couche est appelée l’adventice qui se compose des fibres de collagènes et de tissus élastiques permettant de maintenir l’intégrité des vaisseaux. Un schéma des trois sous-couches composant l’artère est présenté à la Figure 6.
Dans un contexte pathologique, les CML participent à la synthèse de molécules inflammatoires, à la synthèse des composés de la matrice extracellulaire et aux processus de vasodilatation/vasoconstriction. Certains stress, comme la déshydratation, entraînent la sécrétion d’hormones et de différents médiateurs capables d’influencer la vasodilatation ou la vasoconstriction des vaisseaux et de réguler la pression. Un autre composant important du système circulatoire est le système lymphatique qui assure le transport de la lymphe. Cette dernière est composée principalement de liquide interstitiel, des lipides provenant du foie et des intestins, mais également des globules blancs (essentiellement des lymphocytes). Le réseau lymphatique est très vaste et est constitué de nombreux vaisseaux pouvant former des nœuds permettant la rencontre des cellules immunes avec les cellules étrangères. Ces nœuds permettent l’activation des cellules immunitaires et aussi de créer des liens entre le système immunitaire inné et le système immunitaire adaptatif qui seront décrits plus tard.
Figure 6 : La structure d’une artère
Les artères sont composées de trois principales sous-couches. L’intima est la première couche et est la plus proche de la circulation sanguine. Elle est composée principalement de cellules endothéliales permettant un échange contrôlé des éléments sanguins vers les tissus. La deuxième est constituée principalement de cellules musculaires lisses qui permettent la contraction musculaire et est appelée le média. L’intégrité de l’artère est assurée par l’adventice.
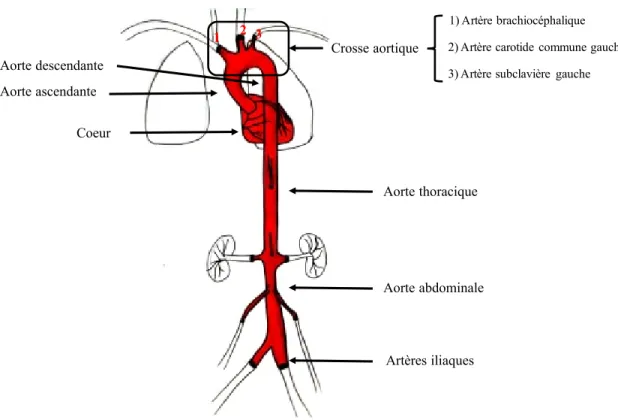
1.4.2. L’anatomie de l’aorte
L’aorte est la plus grosse artère de l’organisme qui s’étend de la sortie du ventricule gauche jusqu’aux artères iliaques situées dans la région abdominale. Son principal rôle est de transporter le sang oxygéné, les nutriments et les composants immunitaires vers l’ensemble de l’organisme. De par sa longueur, l’aorte est divisée en plusieurs parties : l’aorte ascendante, la crosse aortique, l’aorte descendante (ou thoracique) et l’aorte abdominale. L’aorte ascendante est séparée du ventricule gauche par la valve aortique qui, en s’ouvrant, libère une grande quantité de sang provoquant une forte élévation de la pression. Ce
Adventice (Tissus conjonctif)
Média
(Cellules musculaires lisses)
Intima
(Cellules endothéliales)
Lumière artérielle (Circulation sanguine)
changement de pression est compensé par l’élasticité de cette section et par son large diamètre. L’aorte ascendante est composée des sinus aortiques droit et gauche donnant naissance aux artères coronariennes qui entourent le myocarde. La crosse aortique, qui succède à l’aorte ascendante, possède plusieurs bifurcations : l’artère brachiocéphalique (BCA), l’artère carotide commune gauche et l’artère subclavière gauche. Ces dernières servent principalement à l’irrigation du cou et des bras. L’aorte thoracique s’étend le long de la colonne vertébrale jusqu’à la vertèbre thoracique T12. La dernière section est l’aorte abdominale qui se termine par sa division en artères iliaques communes situées à la hauteur de la quatrième lombaire (voir Figure 7).
Figure 7 : L’anatomie de l’aorte
L’aorte quitte le ventricule gauche vers l’aorte ascendante puis la crosse aortique. Cette dernière est composée des artères brachiocéphalitique (1), de la carotide commune gauche (2) et l’artère subclavière gauche (3). L’aorte thoracique s’entend jusqu’aux reins pour laisser place à l’aorte abdominale qui se sépare en deux au niveau des artères iliaques.
Coeur Aorte ascendante Aorte descendante Artères iliaques Aorte thoracique Aorte abdominale Crosse aortique 1 2 3 1) Artère brachiocéphalique 2) Artère carotide commune gauche 3) Artère subclavière gauche
1.5. La physiologie du système immunitaire
1.5.1. Généralité
Le système immunitaire a pour principal objectif de distinguer les cellules du soi et du non-soi afin de combattre les attaques provenant de l’extérieur de l’organisme. Pour ce faire, plusieurs mécanismes de défense sont utilisés par l’ensemble des cellules de ce système pour mieux combattre les microorganismes. Elles peuvent sécréter une grande diversité de molécules inflammatoires, utilisées pour attirer et activer d’autres cellules immunitaires afin de détruire les cellules nuisibles, d’induire la réparation tissulaire ou encore de ralentir le processus inflammatoire une fois la menace éloignée. Les cellules du système immunitaire sont produites à l’intérieur des organes lymphoïdes primaires comme la moelle osseuse ou le thymus. D’autres organes comme la rate, les ganglions lymphatiques, les amygdales, l’appendice ou les plaques de Peyer (cellules intestinales) servent à la maturation des cellules immunitaires, mais ce sont aussi des lieux de rencontre entre les cellules immunes et les microorganismes étrangers. Le processus inflammatoire s’orchestre en plusieurs étapes très complexes, mais qui seront simplifiées dans les prochaines lignes. Dans le cas d’une infection bactérienne, les cellules touchées vont produire des molécules chemoattractantes afin de diriger les cellules immunitaires vers le lieu d’infection : c’est l’étape de chemotaxie. Par la suite, les cellules immunitaires quittent la circulation pour se diriger à l’intérieur de la zone infectée par l’étape d’extravasation afin d’être activées par des molécules appelées cytokines. Pour finir, les cellules vont amorcer l’étape de résolution en déclenchant plusieurs mécanismes de défense et réduire le processus inflammatoire. De par la grande variété des dangers situés à l’extérieur et à l’intérieur de l’organisme, de nombreux acteurs inflammatoires sont mis à contribution et peuvent être regroupés dans deux grandes familles, soit le système inné et le système adaptatif.
1.5.2. Le système immunitaire inné
Le système immunitaire inné est composé des cellules myéloïdes regroupant les neutrophiles, les basophiles, les monocytes/macrophages/cellules dendritiques et les éosinophiles. Ce système agit en premier au lieu d’infection et participe à l’activation des cellules du système adaptatif par la présentation d’antigène. Les monocytes/macrophages étant les principaux acteurs de l’initiation de la formation des plaques athérosclérotiques, les prochaines sections aborderont essentiellement ces types cellulaires. Les monocytes sont des cellules phagocytaires mononuclées produites principalement par la moelle osseuse. Elles sont constituées de nombreux granules à l’intérieur de leur cytoplasme enfermant une importante activité enzymatique utilisée pour la lutte contre les microorganismes.
Ces phagocytes sont des cellules mobiles qui possèdent une grande quantité de récepteurs et de glycoprotéines membranaires utilisés pour l’adhésion cellulaire, leur mobilité, leur prolifération, leur différenciation, leur caractérisation, etc. Il existe deux grandes familles de monocytes en circulation qui peuvent se distinguer par certains marqueurs de surfaces. Chez la souris, les monocytes exprimant fortement le marqueur de granulocyte de type 1 (Gr-1) font partie de la famille des monocytes « classiques » en comparaison avec les monocytes « non classiques » qui n’exprimeront pas ou peu cette glycoprotéine (Woollard et al., 2010). Ces deux sous-classes ne se distinguent pas seulement par l’expression des marqueurs de surface spécifiques, mais également par leur rôle dans le processus inflammatoire. En effet, les monocytes classiques ou Gr-1+ sont associés à une activité pro-inflammatoire en comparaison avec les monocytes Gr-1- qui sont associés à une activité anti-inflammatoire (Woollard et al., 2010). Une étude a démontré que l’hypercholestérolémie provoque une augmentation de la prolifération des cellules Gr-1+ en circulation, ce qui favorise la formation des plaques athérosclérotiques chez le modèle de souris Apoe-/- (Swirski et al., 2007). À ce jour, le rôle des monocytes anti-inflammatoires
Gr-1- sur le processus d’athérosclérose n’a pas été encore clarifié. Les monocytes expriment également une grande diversité d’intégrines comme le very late antigen 4 (VLA-4) et le lymphocyte function associated antigen 1 (LFA-1), qui permettent la liaison avec les molécules d’adhésion exprimées à la surface des cellules endothéliales comme la
vacular adhesion molecule 1 (VCAM-1) et l’intercellular adhesion molecule 1 (ICAM-1) respectivement (Galkina et al., 2007). En 1998, le groupe de recherche du docteur Shipesh Patel, à l’aide d’un marquage spécifique des macrophages des souris Apoe-/- et d’une
injection d’anticorps anti-VLA-4 et d’anti-ICAM-1, a réussi à démontrer l’importance de ces deux molécules dans l’infiltration des monocytes à l’intérieur de l’aorte. En effet, l’inhibition de ces intégrines entraîne une diminution entre 65 et 75 % de l’infiltration des monocytes à l’intérieur de l’aorte des groupes de souris Apoe-/- (Patel et al., 1998). À la suite de l’étape d’extravasation, les monocytes se différencient en macrophages sous l’action de différents facteurs comme les macrophage colony stimulating factor (M-CSF) ou les granulocytes/macrophages colony stimulating factor (GM-CSF). Ces cellules matures ont pour rôles de phagocyter les microorganismes extérieurs ou les débris cellulaires, de réparer les lésions tissulaires et permettent également la présentation de l’antigène aux cellules du système adaptatif. Comme mentionné précédemment, les macrophages ont également la capacité de phagocyter et digérer les LDL retrouvées à l’intérieur les tissus et les artères.
L’étape d’activation des macrophages est un processus complexe dépendant de l’environnement inflammatoire dans lequel ils se trouvent. Ce mécanisme est représenté dans la Figure 8. L’activation de type « classique » des macrophages, ou macrophage M1, est provoquée par des cytokines pro-inflammatoires comme l’interféron gamma (IFNg), l’interleukine 1 alpha (IL-1a), IL-1b ou le tumoral necrosis factor alpha (TNFa) et ils participent à la production de cytokines pro-inflammatoires, la production de monoxyde d’azote, la production des radicaux libres et la présentation de l’antigène (Gordon et al., 2014). Dans le cas de l’athérosclérose, les macrophages M1 amplifient la modification des LDL, l’activation des cellules endothéliales et augmentent la formation des cellules spumeuses (Lee et al., 2018). L’activation de type « alternative » des macrophages, ou macrophages M2, est médiée principalement par les cytokines IL-4 et l’IL-13, qui jouent un rôle anti-inflammatoire en participant à la réparation tissulaire et à l’atténuation de l’inflammation (Gordon et al., 2014). Certains marqueurs des M2 ont été répertoriés comme l’Arginase 1 (Arg 1), la molécule résistine (Fizz 1), la chitinase 3 (Ym-1) ou le récepteur du mannose (MR), influençant négativement la production de NO notamment (Raes et al., 2002). En 2016. une étude menée par la professeure Monica de Gaetano a
démontré, chez des patients atteints d’une maladie coronarienne, que les macrophages M2 participent à la stabilité des plaques formées à l’intérieur des artères (de Gaetano et al., 2016). Dans le cas de l’athérosclérose, les macrophages M2 sont capables de capter plus de cholestérol que les macrophages M1, mais participent davantage à leur excrétion en dehors de l’aorte (Bi et al., 2019). Sous l’influence de l’IL-10, les macrophages M1 peuvent changer leurs phénotypes pour le profil M2 afin d'atténuer le processus inflammatoire.
Figure 8 : L’activation des macrophages
Différenciés à partir des monocytes, les macrophages peuvent être activés en macrophages M1 ayant un effet pro-inflammatoire sous l’influence de plusieurs cytokines comme l’IFNg et le TNFa. Les cytokines IL-4 et IL-13 favorisent l’activation des macrophages M2 qui ont une fonction anti-inflammatoire et favorisent la réparation tissulaire. L’IL-10 incite les M1 à adopter un profil M2 afin de résoudre l’inflammation
IL-4, IL-13 IFNg, TNFa, IL-1a, IL-1b M1 Macrophages M2 Macrophages Macrophages Pro-inflammatoire Proathérogène Anti-inflammatoire Réparation tissulaire IL-10
1.5.3. Le système immunitaire adaptatif
Le système adaptatif est composé des cellules lymphoïdes comme les lymphocytes T, les lymphocytes B et les cellules tueuses naturelles (NK). Ces dernières naissent dans le thymus ou dans la moelle osseuse avant d’être dirigées vers les organes lymphoïdes périphériques, où ils seront activés par la reconnaissance des antigènes présentés notamment par les macrophages. Cette rencontre permet l’activation et la différenciation des lymphocytes T en lymphocytes auxiliaires (Th), cytotoxiques (Tc) et régulateurs (Treg) qui participent activement à la régulation de nombreuses fonctions immunitaires. Les lymphocytes Th se divisent en plusieurs sous-populations comme les Th1, les Th2, les Th9, les Th17 et les Th22, mais pour des raisons pratiques, seules les deux premières sous-unités et les Treg seront décrites.
Sous l’influence des cytokines pro-inflammatoires, comme IL-2 et IL-12, les lymphocytes T naïfs se différencient en Th1 qui se distinguent par l’expression de certains facteurs de transcriptions spécifiques comme T-bet, STAT1 (Luckheeram et al., 2012) et l’expression de certains récepteurs aux chemokines comme le récepteur à motif CXC de type 3 (CXCR3) et le récepteur à motif CC de type 5 (CCR5) (Saigusa et al., 2020). Les Th1 sont impliqués dans l’élimination des pathogènes, ainsi que dans le recrutement des cellules phagocytaires qui participent notamment à la progression de l’athérosclérose (Mallat et al., 2009). En effet, les lymphocytes Th1 produisent de l’IFNg, qui se trouve être un important acteur dans la formation des plaques athérosclérotiques, en participant notamment à l’initiation de l’inflammation et à la réduction de la prolifération des cellules musculaires lisses (Saigusa et al., 2020).
Les cellules T naïves (Figure 9
)
peuvent aussi se différencier en lymphocytes Th2 par l’action des cytokines anti-inflammatoires comme IL-4 et IL-13 (Luckheeram et al., 2012). Les Th2 sont sollicités pour combattre les parasites extracellulaires, pour la différenciation des lymphocytes B ainsi que dans certains mécanismes liés à l’asthme (Mallat et al., 2009). Le rôle des lymphocytes Th2 dans l’athérosclérose n’a pas encore été clairement établi et reste un sujet à controverse (Saigusa et al., 2020). En effet, un groupe de recherche a voulu étudier l’impact de la délétion d’IL-12 dans un modèle de souris Apoe-/-. Cette délétion aeu pour effet de diminuer l’infiltration des Th1, mais a augmenté l’infiltration des Th2, ce qui a eu pour effet de diminuer le processus athérogène (Huang et al., 2019).
Afin de diminuer le processus inflammatoire, les lymphocytes T régulateurs sont impliqués dans le processus de réduction de l’athérosclérose (Mallat et al., 2009 ; Saigusa et al., 2020). Ils produisent certaines cytokines anti-inflammatoires comme IL-10 et le transforming growth factor beta (TGFb) qui jouent un rôle négatif dans la prolifération des cellules T pro-inflammatoires. Des études ont démontré qu’une diminution d’une de ces cytokines amplifie le pourcentage de dépôt lipidique à l’intérieur de l’aorte (Oslund et al., 1999 ; Robertson et al., 2003).
Figure 9 : La maturation des lymphocytes T CD4+ et leurs rôles dans
l’athérosclérose
Les lymphocytes T auxiliaires naïfs, sous l’action de nombreuses cytokines, se différencient en des lymphocytes Th1, Th2 ou Treg. L’effet d’IL-2, IL-3, TNFa et l’IFNg entraîne l’activation des Th1 qui participe à la prolifération des cellules musculaires lisses, et au développement des plaques athérosclérotiques. Les lymphocytes Th2 sont activés par
Lymphocyte T Naïfs CD4+ Th 1 T-bet + Th 2 GATA3 + Treg FOXP3+ IFNg, TNFa, IL-2, IL-3
IL-4, IL-5, IL-13
TGFb, IL-10 Stabilisation de la plaque
Anti-inflammatoire Anti-inflammatoire Anti-athérogène Diminution expression VCAM-1 Diminution prolifération CML Pro-inflammatoire Proathérogène
les cytokines IL-4, IL-5 et IL-13 et favorisent le processus anti-inflammatoire. L’IL-10 et le TGFb entraînent l’activation des lymphocytes Treg qui favorisent la stabilité de la plaque et participent à la réduction des plaques.
1.6. Les facteurs inflammatoires
1.6.1. Les chemokines
Les récepteurs aux chemokines sont pour la plupart des récepteurs couplés aux protéines G (RCPG). Ce sont des récepteurs composés de sept domaines transmembranaires avec un domaine N-terminal permettant la liaison du ligand au récepteur et un domaine C-terminal intracellulaire permettant l’activation des voies de signalisation, la dégradation du récepteur et son recyclage. La liaison du ligand entraîne un changement de conformation du récepteur et permet le recrutement de la protéine hétérotrimérique G. Une molécule de GDP liée à la sous-unité G est remplacée par une molécule de GTP afin de permettre sa liaison au récepteur et sa dissociation des deux autres sous unité Gß/g et Ga. Une fois dissociées, ces sous-unités activent de nombreuses voies de signalisation. Le recrutement de la ß-arrestine en C-terminal du récepteur entraîne l’internalisation du récepteur dans le cytosol où il sera dégradé, recyclé à la membrane ou activera d’autres voies de signalisation cellulaires. L’activation des récepteurs aux chemokines active l’étape de chemotaxie, qui consiste à attirer les cellules immunes vers le site d’infection.
Les chemokines sont des molécules de petite taille, comprise entre 8 kDa à 12 kDa, qui sont regroupées en 4 familles (C, CC, CXC, CX3C) et réparties en fonction du nombre et de la localisation des résidus cystéines en N-terminal (Deshmane et al., 2009). Cette région est importante pour la liaison au récepteur et pour l’activation des voies de signalisation intracellulaires. Lors de l’initiation de l’inflammation, de nombreuses cytokines pro-inflammatoires induisent la sécrétion de chemokines et ainsi forment un gradient chemotactique pour permettre la migration des cellules vers le lieu d’infection. Cette étape a également pour rôle de diriger les leucocytes vers les organes lymphoïdes comme la moelle osseuse, les ganglions, la rate ou le thymus pour maintenir l’homéostasie du système immunitaire. Ces étapes essentielles font également partie d’un équilibre fragile
qui, lorsqu’il est perturbé, provoque de nombreuses pathologies inflammatoires. Depuis plusieurs années, certaines recherches sont réalisées afin de mieux comprendre les mécanismes chemotactiques. Parmi les principaux marqueurs impliqués dans l’attraction des cellules myéloïdes, la protéine chemoattractante des monocytes 1 (MCP-1 ou CCL2) fait partie des molécules les plus importantes. Découverte en 1983, cette molécule est un membre de la famille des chemokines de type C-C et participe fortement à l’attraction des monocytes vers l’endothélium vasculaire. Le RCPG de MCP-1 possède deux variants, soit CCR2A et CCR2B, qui se distinguent entre eux par leurs différences structurales en C-terminal. MCP-1 est associé à une activité pro-inflammatoire en favorisant la chemotaxie ainsi que la présentation de l’antigène, mais possède également un rôle anti-inflammatoire impliquant le recrutement des lymphocytes T régulateurs. Étudiés dans un premier temps dans les maladies virales comme l’infection au VIH, MCP-1 et son récepteur ont très vite suscité l’attention dans l’étude des maladies cardiovasculaires. Des modèles de souris Apoe-/-Ccr2-/- ou Apoe-/- Ccl2-/- ont permis de mieux comprendre le rôle de cette chemokine dans le processus athérogène. Il a été démontré que le groupe de souris Apoe-/-Ccr2-/- présentait moins de plaques athérosclérotiques que les souris possédant CCR2, ce qui s’explique notamment par une diminution de l’infiltration des monocytes à l’intérieur de l’aorte et une diminution des lésions artérielles (Boring et al., 1998). Dans la même famille de chemokine, CCL5 ou RANTES participent également au recrutement des monocytes en se liant au récepteur CCR5. Sa découverte, à la fin des années 1990, a été fortement remarquée, car ce dernier est un corécepteur pour le virus VIH. CCR5 est également un récepteur pour les ligands CCL3 ou CCL4. De nombreuses recherches ont été effectuées sur le rôle de RANTES dans le cancer du sein, mais également dans les maladies cardiovasculaires. Des études ont démontré que les patients exprimant un variant de CCR5, qui entraîne l’inactivation de ce dernier, présentent un niveau élevé de HDL et un niveau plus faible de triglycéride en circulation comparativement aux individus ne l’exprimant pas (Hyde et al., 2010). Comme MCP-1, des antagonistes de CCR5 ou une délétion complète de ce récepteur provoquent une diminution de l’infiltration des monocytes et de la formation des plaques athérosclérotiques chez la souris (Jones et al., 2011). Seul représentant de la famille des chemokines CX3C, la fractalkine ou CX3CL1 est également un élément important dans le processus inflammatoire. En comparaison avec les molécules
décrites précédemment, CX3CL1 peut être retrouvée sous forme soluble en circulation, mais aussi à la surface des membranes. Ces deux formes de ligands permettent aussi bien la migration des leucocytes vers l’endothélium que leur adhésion. Cette chemokine possède un seul récepteur, nommé CX3CR1, exprimé à la surface des monocytes, des neurones, des cellules NK, des microgliales et certaines sous-population de lymphocytes T. Le niveau d’expression de ce récepteur varie d’une sous-unité de monocytes à l’autre. En effet, les monocytes non classiques expriment plus ce récepteur que les monocytes classiques qui pourraient avoir un rôle dans le passage des monocytes de la moelle osseuse vers la circulation sanguine. De plus, la liaison de CX3CL1 à son récepteur augmente la survie des monocytes et le recrutement des lymphocytes pro-inflammatoires (Lee et al., 2018). Quelques études ont démontré l’importance des récepteurs CCR2, CCR5 et CX3CR1 et de leurs ligands dans le processus athérogène. L’équipe du professeur Combadière, en utilisant un modèle murin Apoe-/-Ccl2-/- Cx3cr1-/-, a démontré une augmentation du niveau de cholestérol, du taux de monocytes en circulation et de la corrélation avec une diminution de la formation des plaques athérosclérotiques par rapport au groupe contrôle. Dans le même groupe, ils ont démontré qu’une inhibition de CCR5 accentue le phénomène observé (Combadière et al., 2008). Un autre groupe de recherche a démontré le rôle de ces marqueurs dans les sous-populations de monocytes accumulées à l’intérieur des plaques (Tacke et al., 2007). Important membre de la famille des cytokines CXC, la chemokine CXCL4 participe activement au développement de l’inflammation. En plus de sa participation dans l’attraction des monocytes, cette chemokine est importante dans la formation des plaquettes dans les cas de lésions tissulaires ou de rupture des plaques. L’interaction de CXCL4 avec CCL5 a également été observée dans le processus de chemotaxie. En effet, la sécrétion de ces deux chemokines à la surface des cellules endothéliales entraîne la formation d’un complexe hétérodimérique qui permet d’augmenter l’adhésion des monocytes, ainsi que leurs extravasations (Domschke et al., 2019). Une étude a également révélé que CXCL4 était impliquée dans l’apoptose des cellules endothéliales et dans les mécanismes de cytotoxicité (Woller et al., 2008). CXCL4 est également retrouvée dans la survie et la prolifération des monocytes, mais aussi dans leur différenciation. Des études ont montré qu’une stimulation des macrophages avec CXCL4 entraînait un profil M1 et M2 combiné, qui laisse à penser que l’existence d’un
nouveau type d’activation des macrophages existerait. Certaines études n’hésitent pas à mentionner un profil M4 (Gleissner et al., 2010). Cette nouvelle activation des macrophages semble produire en majorité des cytokines pro-inflammatoires, mais semble moins exprimer de récepteurs responsables menant à la formation des cellules spumeuses comme CD36. Une étude menée par le professeur Nassar a voulu mieux comprendre la fonctionnalité des macrophages M4 en présence de LDL. Ce faisant, ils ont pu démontrer que CXCL4 inhibe la liaison des LDL pour leurs récepteurs, ce qui favorise la formation des LDL oxydées. Ils ont également révélé que la chemokine augmentait la liaison des oxLDL aux cellules endothéliales et aux macrophages. Ces liaisons sont retrouvées dans la formation des cellules spumeuses formant les plaques athérosclérotiques (Nassar et al., 2003).
1.6.2. Les cytokines
Parmi les médiateurs inflammatoires d’importance, les cytokines font partie d’un réseau complexe et essentiel de molécules capables de régir l’ensemble des fonctions du système immunitaire. Ce sont de petites molécules sécrétées par la totalité des cellules immunitaires qui permettent la communication et l’interaction entre elles. Contrairement aux chemokines, les cytokines ne servent pas à attirer les cellules vers le lieu d’infection, mais peuvent induire la sécrétion des chemokines. Ces molécules peuvent agir de manière autocrine, paracrine ou endocrine sur les cellules cibles et peuvent être divisées en deux groupes. Les cytokines pro-inflammatoires sont utiles pour l’initiation et le développement du processus inflammatoire tandis que les cytokines anti-inflammatoires ralentissent le processus inflammatoire et inhibent l’action des cytokines pro-inflammatoires.
1.6.2.1. Les cytokines pro-inflammatoires
Parmi les cytokines pro-inflammatoires indispensables dans l’amorce de l’inflammation, le TNFa et l’IFNg font partie des protéines essentielles. Ce sont les premières cytokines à être sécrétées lors d’une infection et elles permettent notamment de produire un grand