Rôle du récepteur 1 de la sphingosine-1-phosphate
dans la pneumopathie d’hypersensibilité
Thèse
Carole-Ann Huppé
Doctorat en sciences cliniques et biomédicales
Philosophiæ doctor (Ph. D.)
Rôle du récepteur 1 de la sphingosine-1-phosphate
dans la pneumopathie d’hypersensibilité
Thèse
Carole-Ann Huppé
Sous la direction de :
David Marsolais, PhD, directeur de recherche
Mathieu Morissette, PhD, codirecteur de recherche
Résumé
La pneumopathie d’hypersensibilité (PHS) est une maladie pulmonaire causée par l’exposition répétée à certains agents contenus dans les bioaérosols. La PHS est caractérisée par le recrutement de neutrophiles, l’accumulation de lymphocytes au poumon pouvant s’organiser sous forme de tissus lymphoïdes tertiaires (TLT), la production d’anticorps spécifiques contre l’agent causal et peut conduire au développement de fibrose pulmonaire. Un enjeu de la PHS est la difficulté à poser un diagnostic avec un degré de confiance élevé, puisque l’agent causal n’est pas identifié chez 30 % des patients et qu’il n’existe pas de signe clinique unique à cette maladie. Compte tenu du diagnostic tardif et de l’incapacité des traitements actuels à rétablir une fonction pulmonaire normale chez les patients atteints de PHS chronique, il n’existe aucun traitement efficace pour la PHS chronique. L’objectif général de cette thèse était d’améliorer notre compréhension des mécanismes impliqués dans la persistance de l’inflammation pulmonaire dans la PHS et d’identifier de nouvelles cibles thérapeutiques potentielles.
Les modulateurs pharmacologiques du récepteur 1 de la sphingosine-1-phosphate (S1P1) régulent la
circulation des lymphocytes entre les différents organes lymphoïdes et sont actuellement utilisés dans le traitement de certaines maladies inflammatoires. L’objectif poursuivi dans une première étude était de déterminer l’impact d’un ligand de S1P1 dans la pathogénèse de la PHS expérimentale. Pour ce faire, des
souris ont été exposées trois jours consécutifs par semaine durant trois semaines à l’archée immunogène
Methanosphaera stadtmanae (MSS) et traitées avec un agoniste de S1P1, RP001. Dans la PHS expérimentale,
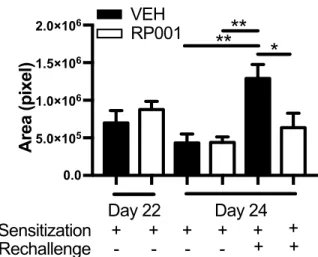
RP001 prévient le recrutement de neutrophiles, la réactivation des TLT et l’accumulation d’anticorps spécifiques à l’antigène induit par un rechallenge à MSS.
De par la nature de la PHS, les individus sont exposés à la fois à des antigènes T-dépendants et des antigènes indépendants. Ainsi, dans une deuxième étude, nous voulions évaluer l’impact d’un antigène T-indépendant sur la réponse d’hypersensibilité pulmonaire. Chez des souris sensibilisées à MSS, un challenge avec le lipopolysaccharide (LPS) augmente le nombre de neutrophiles, active les lymphocytes au poumon et provoque l’accumulation d’IgG1 contre MSS dans le lavage bronchoalvéolaire. Puisque nous avions montré dans l’étude précédente qu’un agoniste de S1P1 interfère avec l’accumulation d’anticorps spécifiques à
l’antigène, le second objectif de cette étude était de déterminer l’impact direct d’un ligand de S1P1 sur
l’activation et les fonctions des lymphocytes B induites par un antigène T-indépendant. Un agoniste de S1P1 inhibe la libération de cytokines et l’augmentation des molécules de co-stimulation à la surface du
lymphocyte B induites par le LPS, ce qui diminue sa capacité à activer les lymphocytes T.
Bien que l’on considère que les lymphocytes B et les médiateurs solubles qu’ils produisent soient impliqués dans le développement de la PHS, peu d’études se sont intéressées à la régulation des lymphocytes
B dans cette maladie. Dans une troisième étude, les objectifs étaient de caractériser les différentes sous-populations de lymphocytes en circulation chez les patients PHS et de déterminer l’impact d’un ligand de S1P1 sur l’activation des lymphocytes B humains induite par un antigène T-indépendant. Nous avons
effectué des prélèvements sanguins chez dix patients atteints de PHS chronique et dix sujets témoins appariés pour l’âge, le sexe et le statut tabagique. Chez les patients PHS, la proportion de lymphocytes B mémoires circulants est réduite et les médiateurs solubles liés à leur mobilisation sont augmentés comparativement aux sujets témoins, alors que les lymphocytes T ne semblent pas modulés. De plus, un ligand de S1P1 prévient
l’augmentation des molécules de co-stimulation à la surface des lymphocytes B isolés ainsi que la libération de TNF et d’IL-6; une fonction insensible à la dexamethasone.
En conclusion, cette thèse met en évidence certaines altérations des populations circulantes de lymphocytes B chez les patients atteints de PHS chronique. Nous avons également identifié deux nouveaux acteurs potentiels dans la pathogénèse de la PHS, soit la réponse T-indépendante et les modulateurs du récepteur S1P1. En effet, nous avons montré qu’un agoniste de S1P1 prévient la réactivation de la réponse
d’hypersensibilité pulmonaire dans la PHS expérimentale et inhibe les fonctions des lymphocytes B induites par un antigène T-indépendant. Ainsi, cette thèse permet de mieux comprendre les mécanismes de persistance de l’inflammation et d’identifier le récepteur S1P1 comme une cible potentielle pour altérer certaines fonctions des
Abstract
Hypersensitivity pneumonitis (HP) is a pulmonary disease caused by repetitive exposure to some components of bioaerosols. HP is characterized by neutrophil recruitment in the airways, B cell-enriched tertiary lymphoid tissue formation in the lung and antigen-specific antibody accumulation that can lead to pulmonary fibrosis. HP diagnosis is challenging since causal agent cannot be identified in 30% of cases and there is no distinct clinical sign for the disease. Given the late diagnosis and the inability of current treatment to restore normal lung function in chronic HP, there is no effective treatment for chronic HP. The objective of this thesis was to improve the knowledge on persistent inflammation mechanisms in HP and to identify new therapeutic targets.
Sphingosine-1-phosphate receptor 1 (S1P1) modulators control lymphocyte migration between
lymphoid organs and are currently used or under investigation to treat some inflammatory diseases. The objective of the first study was to determine the impact of S1P1 modulators on experimental HP
progression. Mice were exposed three consecutive days a week for three weeks to the immunogen archaea
Methanosphaera stadtmanae (MSS) and treated with an S1P1 agonist, RP001. In experimental HP, RP001
prevents neutrophil recruitment, TLT reactivation and antigen-specific antibody accumulation induced by MSS rechallenge.
Because HP is caused by environmental agents, patients are exposed to both dependent and T-independent antigens. Thereby, in a second study, the objective was to evaluate the impact of T-T-independent antigen on experimental HP. In MSS-sensitized mice, lipopolysaccharide (LPS) challenge induces an increase in neutrophilic inflammation, activates pulmonary lymphocytes and induces MSS-specific IgG1 accumulation in the bronchoalveolar lavage. Since we showed that S1P1 ligands interfere with antigen-specific antibody
accumulation, the second objective of this study was to determine the impact of S1P1 ligands on
T-independent antigen-induced B cell activation and functions. An S1P1 agonist inhibits LPS-induced cytokine
release and co-stimulatory molecule increase leading to a decrease in their ability to activate T cells.
Even though it is assumed that B cells and their production of soluble mediators are central to HP pathogenesis, few studies were interested in their regulation in this disease. In a third study, the objectives were to characterize circulatory lymphocyte sub-populations in HP and to determine the impact of S1P1
ligands on human B cell activation induced by T-independent antigens. Venous blood of ten chronic HP patients and ten control subjects paired for age, sex and smoking status were analyzed. The proportion of circulating memory B cells are reduced, and B cell-related soluble mediators are increased in chronic HP patients compared to control subjects, while T cell populations were similar between the two groups. Furthermore, an
S1P1 ligand prevents co-stimulatory molecule increase and cytokine release (TNF, IL-6), which is insensitive to
dexamethasone.
In conclusion, we unravel circulating B cell alterations in chronic HP patients. We also identify two potential actors implicated in HP pathogenesis, the T-independent response and the S1P1 modulators. We
showed that an S1P1 agonist prevents the reactivation of experimental HP and inhibits T-independent
antigen-induced B cell functions. Thus, this thesis improves the knowledge regarding persistent inflammation in HP and identifies the S1P1 receptor as a potential target to interfere with HP-related B cell functions.
Table des matières
Résumé ... ii
Abstract ... iv
Table des matières ... vi
Liste des tableaux ... x
Liste des figures ... xi
Liste des abréviations ... xiii
Remerciements ... xv
Avant-propos ... xvi
Introduction ... 1
Immunité pulmonaire ... 1
Réponse immunitaire innée pulmonaire ... 1
Réponse immunitaire adaptative pulmonaire ... 2
Lymphocytes T ... 3
Développement des lymphocytes T ... 3
Fonctions des lymphocytes T et maladies pulmonaires chroniques ... 4
Lymphocytes B ... 5
Développement des lymphocytes B ... 5
Activation des lymphocytes B ... 7
Lymphocytes B mémoires ... 9
Fonctions des lymphocytes B et maladies pulmonaires chroniques ... 10
Tissus lymphoïdes tertiaires ... 11
Limites de l’utilisation de modèles murins pour l’étude de maladies inflammatoires ... 12
Hypersensibilité pulmonaire ... 13
Bioaérosols ... 13
Mécanismes d’hypersensibilité ... 13
Pneumopathie d’hypersensibilité ... 14
Pathogenèse de la pneumopathie d’hypersensibilité ... 16
Modèles murins de PHS ... 16
PHS chez l’humain ... 17
Sphingosine-1-phosphate ... 18
S1P extracellulaire ... 20
Récepteurs de la S1P ... 21
Récepteur 1 de la sphingosine-1-phosphate ... 22
Signalisation du récepteur 1 de la sphingosine-1-phosphate ... 22
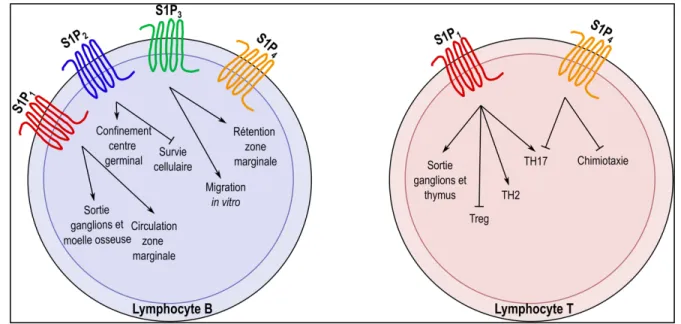
Rôles du récepteur S1P1 dans l'immunité pulmonaire ... 23
Ligands pharmacologiques du récepteur 1 de la sphingosine-1-phosphate ... 26
Rôles des autres récepteurs de la S1P dans l’immunité pulmonaire ... 27
Impacts de la S1P et du récepteur S1P1 sur les maladies pulmonaires ... 28
Problématique, hypothèses et objectifs ... 30
Chapitre 1: A sphingosine-1-phosphate receptor 1 agonist inhibits tertiary lymphoid tissue reactivation and hypersensitivity in the lung ... 30
Chapitre 2: S1P1 contributes to endotoxin-enhanced B cell functions sustaining hypersensitivity pneumonitis ... 31
Chapitre 3: Alterations of B cells in chronic hypersensitivity pneumonitis and their modulation by S1P1 ligands ... 31
Chapitre 1. A Sphingosine-1-phosphate Receptor 1 Agonist Inhibits Tertiary Lymphoid Tissue Reactivation and Hypersensitivity in the Lung. ... 33
1.1 Résumé ... 34
1.2 Abstract ... 35
1.3 Introduction ... 36
1.4 Methods ... 37
1.4.1 Preparation of Methanosphaera stadtmanae. ... 37
1.4.2 Animals. ... 37
1.4.3 Airway exposure protocol. ... 37
1.4.4 Bronchoalveolar lavage fluid analyses. ... 37
1.4.5 Histology. ... 38 1.4.6 Immunofluorescence. ... 38 1.4.7 Flow cytometry. ... 38 1.4.8 Immunoglobulin titration. ... 39 1.4.9 ELISA. ... 39 1.4.10 Statistical analyses. ... 39 1.5 Results ... 39
1.5.1 MSS exposure induces partially organized B-cell-rich TLTs ... 39
1.5.3 RP001 inhibits MSS rechallenge-induced accumulation of CXCL13 in the lung ... 41
1.5.4 RP001 alleviates critical features of MSS-induced HP-like experimental disease ... 41
1.6 Discussion ... 42
1.7 References ... 44
1.8 Figures and Figure Legends ... 48
1.9 Supplementary Information ... 56
Chapitre 2. S1P1 contributes to endotoxin-enhanced B cell functions involved in hypersensitivity pneumonitis60 2.1 Résumé ... 61
2.2 Abstract ... 62
2.3 Introduction ... 63
2.4 Material and Methods ... 64
2.4.1 Preparation of Methanosphaera stadtmanae. ... 64
2.4.2 Animals. ... 64
2.4.3 Experimental HP. ... 64
2.4.4 B cell culture. ... 64
2.4.5 MSS-specific IgG1 and cytokine quantification. ... 65
2.4.6 Flow cytometry. ... 65
2.4.7 OT-II T cell activation assay. ... 65
2.4.8 Statistical analyses. ... 65
2.5 Results ... 65
2.5.1 A TLR4 ligand exacerbates HP signs. ... 65
2.5.2 S1P1 is increased in B cells in the course of experimental HP. ... 66
2.5.3 The S1P1 ligand RP001 downregulates S1P1 in B cells during experimental HP. ... 67
2.5.4 RP001 inhibits B cell activation and TNF release in response to LPS. ... 67
2.5.5 RP001 blunts LPS-enhanced cooperation between B cells and T cells. ... 68
2.6 Discussion ... 68
2.7 References ... 71
2.8 Figures and Figure Legends ... 75
2.9 Supplementary Material ... 81
Chapitre 3. Alterations of B cells in chronic hypersensitivity pneumonitis and their modulation by S1P1 ligands ... 87
3.1 Résumé ... 88
3.3 Introduction ... 90
3.4 Material and methods ... 90
3.4.1 Patients. ... 90
3.4.2 B cell isolation and culture conditions. ... 91
3.4.3 Flow cytometry. ... 91
3.4.4 Soluble mediator quantification. ... 91
3.4.5 Statistical analyses. ... 92
3.5 Results ... 92
3.5.1 Subject’s Characteristics. ... 92
3.5.2 Proportions of circulating memory B cells are reduced in cHP patients. ... 92
3.5.3 Plasma concentration of CXCL13 and BAFF is increased in cHP patients. ... 92
3.5.4 S1P1 ligands perturb B cell activation in response to TLR9 activation. ... 93
3.5.5 Differential impact of S1P1 ligands and Dexamethasone on cytokine release. ... 94
3.6 Discussion ... 94
3.7 References ... 97
3.8 Figures and Figure Legends ... 101
3.9 Supplementary Material ... 107
Discussion générale ... 110
Impacts de ligands de S1P1 sur la PHS expérimentale ... 110
Contribution d’un antigène T-indépendant à l’amplification de la réponse spécifique à l’antigène dans la PHS ... 113
Expression du récepteur S1P1 sur les lymphocytes B dans la PHS expérimentale ... 114
Effets de ligands de S1P1 sur l’activation et les fonctions des lymphocytes B induites par un antigène T-indépendant ... 115
Dérégulations des populations de lymphocytes B dans la PHS chronique ... 117
Conclusion ... 120
Liste des tableaux
Supplemental Table 2-1: Antibodies used for flow cytometry analysis. ... 82 Table 3-1 Patients characteristics. ... 101 Table 3-2 Plasmatic concentration of immunoglobulins is similar between cHP patients and controls. ... 103
Liste des figures
INTRODUCTION
Figure 1: Polarisation des lymphocytes T. ... 4
Figure 2: Développement des lymphocytes B. ... 6
Figure 3: Mécanismes d'activation des lymphocytes B par des antigènes dépendants et T-indépendants. ... 7
Figure 4: Pathogénèse de la pneumopathie d'hypersensibilité. ... 18
Figure 5: Synthèse de la sphingosine-1-phosphate. ... 20
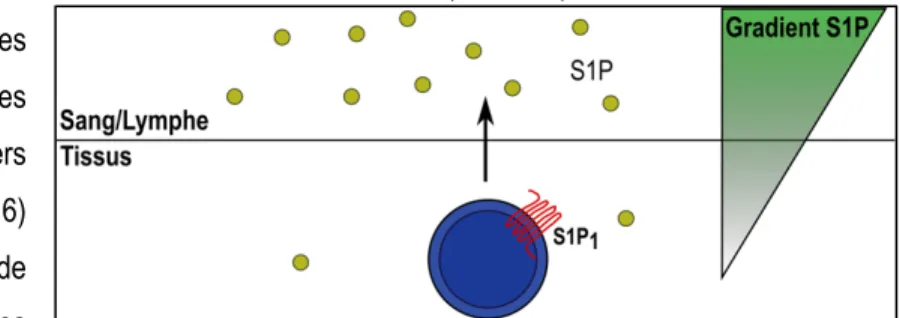
Figure 6: Gradient de S1P entre la circulation et les tissus. ... 21
Figure 7: Rôle des récepteurs de la S1P sur les lymphocytes. ... 22
Figure 8: Signalisation du récepteur S1P1. ... 23
CHAPITRE 1
Figure 1-1 Subchronic exposure to MSS induces TLT formation. ... 48Figure 1-2 Histological modifications induced by MSS and RP001. ... 49
Figure 1-3 S1P1 agonism prevents TLT reactivation upon MSS rechallenge. ... 50
Figure 1-4 The S1P1 agonist RP001 inhibits lymphocyte accumulation in the lung. ... 51
Figure 1-5 RP001 increases lymphocyte numbers in inguinal lymph nodes. ... 52
Figure 1-6 S1P1 distribution in TLTs and lymph nodes. ... 53
Figure 1-7 RP001 inhibits MSS rechallenge-induced CXCL13 increase in the lung. ... 54
Figure 1-8 RP001 prevents the reactivation of MSS-induced hypersensitivity and inhibits determinants of diffuse alveolar damage. ... 55
Supplemental Figure 1-1: RP001 induces lymphopenia. ... 56
Supplemental Figure 1-2: MSS exposure induces 10-fold increase of normalized levels of mRNA encoding for CXCL13 in the lung. ... 57
Supplemental Figure 1-3: RP001 preferentially decreases CXCL13 mRNA levels in the lung of MSS-rechallenged mice. ... 58
CHAPITRE 2 Figure 2-1: LPS challenge exacerbates pre-existing experimental HP. ... 75
Figure 2-2: Impact of LPS challenge on lymphocyte subsets in mediastinal lymph nodes. ... 76
Figure 2-3:S1P1-eGFP is increased on B cells during experimental HP. ... 77
Figure 2-4: RP001 induces S1P1 downregulation in B cells. ... 78
Figure 2-5: RP001 reduces LPS-induced activation of B cells. ... 79
Figure 2-6: RP001 reduces the capacity of B cells to trigger antigen-specific T cell activation in vitro. 80 Supplemental Figure 2-1: TLR4 genetic deletion reduces B cell accumulation and MSS-specific IgG1s in experimental HP induced by LPS-containing MSS. ... 83
Supplemental Figure 2-4: RP001 reduces S1P1-eGFP in T cells, lymphatic endothelial cells, but not in
blood endothelial cells. ... 86
CHAPITRE 3 Figure 3-1 Circulating memory B cells are altered in cHP patients compared to controls. ... 102
Figure 3-2 CXCL13 and BAFF are increased in cHP patient compared to controls. ... 104
Figure 3-3 Ozanimod inhibits CpG-induced B cell activation. ... 105
Figure 3-4 Ozanimod reduces CpG-induced TNF and IL-6 release ex vivo. ... 106
Supplemental Figure 3-1 Ozanimod does not interfere with TLR-induced T cell activation. ... 109
DISCUSSION Figure 9: L’agoniste de S1P1 réduit l’expression de l’IL-17 dans le poumon. ... 111
Liste des abréviations
ABC: ATP-binding cassette
AID: Activation-induced cytidine deaminase
ANCA: Anti-neutrophil cytoplasmic antibodies
APRIL: a proliferation inducing ligand
BAFF-R: Récepteur de BAFF BAFF: B-cell activating factor
BAL: Lavages bronchoalvéolaires; Bronchoalveolar lavage BALF: Bronchoalveolar lavage fluid
BCMA: B-cell maturation protein
BCR: Récepteur de lymphocyte B; B cell receptor BEC : Blood endothelial cell
BSA: Bovine serum albumin
CCP: Cyclic citrullinated peptide
cHP : Chronic hypersensitivity pneumonitis
CRIUCPQ: Centre de recherche de l’institut universitaire de cardiologie et de pneumologie de Québec CRP: C-reactive protein
CVID: Common variable immune deficiency
DAMP : Motifs moléculaires associés aux dangers; Damage-Associated Molecular Pattern FMO: Fluorescence minus one
HP : Hypersensitivity pneumonitis
HRCT: High-resolution computed tomography
Ig: Immunoglobuline
IPF: Idiopathic pulmonary fibrosis
IUCPQ: Institut universitaire de cardiologie et de pneumologie de Québec LEC : Lymphatic endothelial cell
LPP : Lipides phosphates phosphatases LPS : Lipopolysaccharide
MFI: Median fluorescence intensity
MHCI : Complexe majeure d’histocompatibilité de type I; Major histocompatibility complex class I MHCII : Complexe majeure d’histocompatibilité de type II; Major histocompatibility complex class II mLN : Mediastinal lymph node
MPOC: Maladie pulmonaire obstructive chronique MSS : Methanosphaera stadtmanae
Myd88: Myeloid differentiation primary response 88 NK : Natural Killer
OVA : Ovalbumine
PAMP : Motifs moléculaires associés aux pathogènes; Pathogen-Associated Molecular Pattern PBMC: Peripheral blood mononuclear cell
PHS : Pneumopathie d’hypersensibilité RF: Rhumatoid factor S1P : Sphingosine-1-phosphate S1P1 : Récepteur 1 de la sphingosine-1-phosphate S1P2: Récepteur 2 de la sphingosine-1-phosphate S1P3 : Récepteur 3 de la sphingosine-1-phosphate S1P4 : Récepteur 4 de la sphingosine-1-phosphate S1P5 : Récepteur 5 de la sphingosine-1-phosphate SGPL1 : Sphingosine-1-phosphate lyase
SPHK2: Sphingosine kinase 2
SPP : Phosphatases spécifiques à la sphingosine-1-phosphate SR: Saccharopolyspora rectivirgula
TACI: Transmembrane activator and CAML interactor
TCR: Récepteur de lymphocyte T; T cell receptor
TD: T-dépendant
Th : T effecteur; T helper
TI: T-indépendant
TLR : Récepteur de type Toll; Toll-like receptor
TLT : Tissus lymphoïdes tertiaires; Tertiary lymphoid tissue TNF : Tumor necrosis factor
Remerciements
La réalisation de ce doctorat est sans contredit ma plus grande réussite à ce jour et elle n’aurait pas été possible sans vous tous.
Tout d’abord, je voudrais remercier mon directeur de recherche, David Marsolais. Sa passion contagieuse pour les découvertes scientifiques de toute sorte, son enthousiasme débordant pour des résultats qui m’apparaissaient souvent bien peu convaincants au premier abord et sa grande rigueur scientifique m’ont grandement inspirée.
Je voudrais également remercier mon co-directeur de recherche, Mathieu Morissette. J’ai beaucoup apprécié nos discussions sur la science, son expertise et ses idées innovantes ont réellement contribué à l’avancement de mon projet.
Je voudrais remercier Pascale, qui m’a inspirée tout au long de mon parcours doctoral par son engagement et son désir de toujours donner son maximum. Elle m’a donné le goût jour après jour d’atteindre les plus hauts niveaux et m’a poussée à sortir de ma zone de confort à plusieurs reprises.
Je voudrais remercier mes amies, Julyanne, Ariane, Anne-Sophie, qui m’ont suivie depuis si longtemps et qui rendent le doctorat moins difficile, puisqu’on est toutes dans le même bateau. Je voudrais remercier tous les membres de l’équipe Marsolais qui se sont succédés au fil du temps, Anne-Marie, David, Magali, et qui, à leur manière, ont su apporter de la joie et aussi de précieux conseils dans mon doctorat. Je voudrais aussi remercier tous les étudiants/professionnels de recherche de l’axe pneumologie que j’ai côtoyés durant mes études pour leurs suggestions toutes plus pertinentes les unes que les autres et bien entendu leur amitié, leur rire et leur écoute.
Je voudrais remercier les membres de ma famille, Nathalie, Mario et Jean-Philippe, qui m’ont toujours supportée et plus particulièrement mes parents qui ont su m’inculquer la persévérance et le sens du travail, des qualités qui m’ont été bien utiles pour compléter mon doctorat. Je souhaite également remercier mon amoureux, Mathieu, qui, surtout dans le dernier sprint pour terminer mon doctorat, a accepté mes sautes d’humeur, m’a réconfortée dans mes périodes de découragements et était toujours présent pour célébrer mes réussites. Je voudrais également remercier ses sœurs, Marie-Claude et Fanny, qui sont bien vite devenues des amies et qui étaient là sans le savoir pour me changer les idées quand j’en avais le plus de besoins.
Avant-propos
Les articles intégrés dans cette thèse de doctorat sont tous issus de travaux originaux réalisés dans le cadre de mon doctorat. Je suis l’auteure principale pour chacun de ces trois articles publiés, acceptés ou soumis durant mon doctorat.
Le manuscrit présenté dans le chapitre 1 intitulé «A Sphingosine-1-phosphate Receptor 1 Agonist Inhibits Tertiary Lymphoid Tissue Reactivation and Hypersensitivity in the Lung» a été publié dans le journal Mucosal
Immunology en ligne le 19 avril 2017 et dans l’édition papier de janvier 2018 volume 11, numéro 1, aux pages
112-119. La version intégrée dans la thèse est identique à celle publiée dans le journal excepté pour la numérotation des figures qui a été modifiée pour correspondre aux différents chapitres de cette thèse. Les expériences présentées dans cet article et sa rédaction ont été réalisées en collaboration avec Pascale Blais Lecours, Ariane Lechasseur, David Gendron, Anne-Marie Lemay, Elyse Bissonnette, Marie-Renée Blanchet, Caroline Duchaine, Mathieu Morissette, Hugh Rosen et David Marsolais. J’ai réalisé la conception de l’étude et des expériences en collaboration avec Pascale Blais Lecours, Caroline Duchaine, Mathieu Morissette, Hugh Rosen et David Marsolais. L’acquisition des données a été exécutée en laboratoire par moi-même, Pascale Blais Lecours, Ariane Lechasseur, David Gendron et Anne-Marie Lemay. L’analyse et l’interprétation des résultats ont été réalisées par moi-même, Pascale Blais Lecours, Ariane Lechasseur, Mathieu Morissette, Hugh Rosen et David Marsolais. J’ai rédigé avec une importante contribution de Pascale Blais Lecours, Mathieu Morissette et David Marsolais la première version du manuscrit. Tous les auteurs ont ensuite participé à la révision du manuscrit et ont fait des suggestions bonifiant grandement la qualité de l’article. Marc Veillette a été remercié à titre de gestionnaire de la plateforme de cytométrie en flux pour son expertise et son assistance technique.
Le manuscrit présenté dans le chapitre 2 intitulé «S1P1 contributes to endotoxin-enhanced B cell functions
involved in hypersensitivity pneumonitis» a été publié en ligne le 14 avril 2020 sur le site du American Journal
of Respiratory Cell and Molecular Biology. La version intégrée dans la thèse est identique à celle publiée en
ligne sur le site du journal excepté pour la numérotation des figures qui a été modifiée pour correspondre aux différents chapitres de cette thèse. Cette étude a été réalisée en collaboration avec Pascale Blais Lecours, Emilie Bernatchez, Jean-François Lauzon-Joset, Caroline Duchaine, Hugh Rosen, Geneviève Dion, Kelly McNagny, Marie-Renée Blanchet, Mathieu Morissette et David Marsolais. J’ai réalisé la conception de l’étude et des expériences en collaboration avec Pascale Blais Lecours, Caroline Duchaine, Geneviève Dion, Mathieu Morissette et David Marsolais. L’acquisition des données a été exécutée en laboratoire par moi-même, Pascale Blais Lecours et Emilie Bernatchez. L’analyse et l’interprétation des résultats ont été réalisées par moi-même, Pascale Blais Lecours, Emilie Bernatchez, Kelly McNagny, Marie-Renée Blanchet, Mathieu Morissette et David
Marsolais. J’ai rédigé avec une importante contribution de Pascale Blais Lecours, Jean-François Lauzon-Joset, Mathieu Morissette et David Marsolais la première version du manuscrit. Tous les auteurs ont ensuite participé à la révision du manuscrit et ont fait des suggestions bonifiant grandement la qualité de l’article. Marc Veillette a été remercié à titre de gestionnaire de la plateforme de cytométrie en flux pour son expertise et son assistance technique.
Le manuscrit présenté dans le chapitre 3 et intitulé «Alterations of B cells in chronic hypersensitivity pneumonitis and their modulation by S1P1 ligands» est achevé et a été soumis une première fois pour publication dans le
American Journal of Respiratory and Critical Care Medicine le 20 mars 2020. Une version révisée est en cours
d’évaluation dans le European Respiratory Journal Open Reasearch en date du 20 août 2020. Cette étude a été réalisée en collaboration avec Pascale Blais Lecours, Geneviève Dion, Mathieu Morissette et David Marsolais. Tous les auteurs ont participé à la conception de l’étude. Le recrutement des patients et la supervision de l’aspect clinique de l’étude ont été réalisés par le Dre Geneviève Dion. Les expériences ont été réalisées par moi-même et Pascale Blais Lecours. L’analyse des résultats a été réalisée par moi-même, Pascale Blais Lecours et David Marsolais. Tous les auteurs ont participé à l’interprétation des résultats et ont contribué grandement à la rédaction et la révision du manuscrit. Les participants de l’étude et les infirmières de recherche, Luce Bouffard et Brigitte Fortin, ont été remerciés pour leur contribution essentielle à l’étude. Le Dr. Éric Wagner et le personnel du laboratoire d’immunologie et d’histocompatibilité clinique du CHU de Québec-Université Laval ont été remerciés pour leur analyses des profils d’auto-anticorps et d’immunoglobulines circulants. Le Dr. Yvon Cormier a été remercié pour sa contribution intellectuelle à l’étude.
Introduction
Immunité pulmonaire
Le système immunitaire protège l’individu contre la multitude de microorganismes (bactéries, virus, champignons, parasites) potentiellement pathogènes se retrouvant dans l’environnement. Ce système doit être régulé finement puisqu’une réponse insuffisante permettrait aux pathogènes d’infecter leurs hôtes, alors qu’une réponse démesurée contribue au développement de maladies auto-immunes ou d’hypersensibilité. Le système immunitaire se divise typiquement en deux types de réponse, soit l’immunité innée et l’immunité adaptative ou immunité acquise (1). Cependant, le système immunitaire est avant tout un système dynamique et plusieurs types cellulaires sont impliqués tant dans l’immunité innée qu’adaptative (1). Le système immunitaire étant vaste et complexe, seuls les concepts nécessaires à la compréhension des études présentées dans cette thèse seront introduits.
Réponse immunitaire innée pulmonaire
La réponse immunitaire innée permet la reconnaissance rapide d’agents pathogènes potentiels à l’aide de récepteurs reconnaissants des structures particulières partagées par plusieurs microorganismes dans le but de favoriser leur élimination. Au poumon, les types cellulaires principalement impliqués dans la réponse immunitaire innée sont les cellules épithéliales, les macrophages, les neutrophiles, les éosinophiles et les cellules dendritiques.
La première ligne de défense contre les invasions est la couche de cellules épithéliales. Ces cellules créent une barrière physique entre l’air extérieur et l’environnement pulmonaire par la régulation des jonctions intracellulaires et la production de mucus, mais contribuent aussi activement à l’élimination du pathogène par la libération de composés antimicrobiens, de chimiokines et de signaux de dangers (2, 3). Dans l’immunité innée, une multitude de récepteurs permettent l’identification de motifs moléculaires associés aux pathogènes (PAMP) et de motifs moléculaires associés aux dommages (DAMP) permettant d’identifier un agent pathogène ou un danger pour le maintien de l’homéostasie pulmonaire. Il existe plusieurs catégories de récepteurs, mais dans le contexte de cette thèse nous nous sommes intéressés aux Toll-like receptor (TLR). L’humain exprime 10 TLR, tandis que la souris exprime 12 TLR différents, chacun ayant une spécificité distincte contre certaines composantes des microorganismes; par exemple, le TLR4 reconnait le lipopolysaccharide (LPS) contenu dans la membrane de certaines bactéries, alors que le TLR9 reconnait une séquence d’ADN particulière enrichie dans le génome des microorganismes (motif CpG) (4). Les TLR sont des armes à double tranchant puisque, malgré leur rôle primordial dans la reconnaissance des agents pathogènes favorisant le développement d’une réponse immunitaire innée, leur activation peut conduire à l’exacerbation de maladies respiratoires existantes
dont la pneumopathie d’hypersensibilité (PHS) et l’asthme (5-8). Les macrophages alvéolaires sont des cellules résidentes des voies respiratoires exprimant plusieurs TLR et qui parcourent le poumon pour éliminer les particules, polluants, allergènes ou microorganismes par phagocytose (3). Les macrophages alvéolaires ont un rôle majeur dans le contrôle de l’homéostasie pulmonaire. Ces cellules peuvent à la fois produire des cytokines inflammatoires permettant le recrutement de leucocytes, dont les neutrophiles, et des cytokines régulatrices permettant d’éliminer les cellules apoptotiques afin de favoriser un retour à l’homéostasie (3). Le neutrophile est le premier leucocyte recruté au site de l’inflammation et agit habituellement dans les premiers 48h afin d’éliminer l’agent pathogène par différents mécanismes. Le neutrophile peut libérer des granules contenant des protéases et des oxydases, dégrader l’agent pathogène dans des phagosomes suivant sa phagocytose ou libérer des brins d’ADN décondensé pour piéger les microorganismes (3). En plus des fonctions qui lui sont habituellement attribuées, le neutrophile produit des cytokines et représente une source non négligeable d’IL-17A dans la PHS (9). Outre le neutrophile, certains types cellulaires sont recrutés dans des contextes particuliers, dont l’éosinophile, qui est recruté au poumon chez les individus souffrant d’asthme allergique. L’éosinophile contribue au développement de la réponse immune par la libération de composés cytotoxiques contenus dans des granules ainsi que par la production de médiateurs lipidiques, de facteurs de croissance et de cytokines (10). Si l’agent pathogène persiste malgré tous les systèmes en place, une réponse adaptative spécifique contre l’agent impliqué sera développée grâce aux cellules dendritiques qui font le pont entre l’immunité innée et adaptative. Malgré leur faible nombre au poumon, ces cellules sont très sensibles aux changements dans l’environnement et peuvent facilement percevoir la présence d’un microorganisme, d’un allergène ou d’un polluant. Les cellules dendritiques captent l’agent problématique et migrent aux ganglions lymphatiques afin d’activer les lymphocytes participant à la réponse immune adaptative (11).
Ainsi, la réponse immunitaire innée permet à l’organisme de réagir rapidement à la présence d’un agent pathogène dans le but de l’éliminer ou de restreindre sa propagation en amont du développement d’une réponse immunitaire adaptative spécifique contre cet agent.
Réponse immunitaire adaptative pulmonaire
La réponse immunitaire adaptative implique principalement les lymphocytes B et les lymphocytes T et est basée sur la reconnaissance spécifique d’un antigène permettant de développer une mémoire d’exposition. Les lymphocytes expriment à leur surface des récepteurs spécifiques activant la cellule par la reconnaissance d’un antigène en particulier lorsque ce dernier leur est présenté par le complexe majeur d’histocompatibilité de type I (MHCI) ou de type II (MHCII). L’activation des lymphocytes induit leur prolifération et leur différenciation en cellules effectrices et/ou en cellules mémoires (1). Les cellules mémoires survivent plusieurs années dans l’organisme et permettent lors d’une seconde exposition au même antigène une réponse plus rapide et d’une
pathogènes, les lymphocytes sont également impliqués dans l’établissement et l’exacerbation de plusieurs maladies pulmonaires (14, 15).
Lymphocytes T
Développement des lymphocytes T
Les progéniteurs lymphoïdes issus des cellules souches hématopoïétiques de la moelle osseuse migrent dans le thymus pour amorcer la différenciation en lymphocytes T naïfs. Dans le thymus, les progéniteurs lymphoïdes exprimant le récepteur CXCR4 migrent en réponse à la chimiokine CXCL12 pour se positionner adéquatement et assurer leur différenciation en lymphocytes T (16). Les lymphocytes T subissent par la suite plusieurs réarrangements géniques permettant de définir un plus grand répertoire de récepteurs de lymphocytes T (TCR) afin de reconnaître spécifiquement une grande variété d’antigènes (1). Ces réarrangements ne sont pas tous concluants et des étapes de sélection subséquentes permettent de sélectionner les lymphocytes T reconnaissant uniquement les agents exogènes. La nature des lymphocytes T générés (effecteurs ou cytotoxiques) est déterminée dans le thymus par l’expression unique à la surface du lymphocyte T naïf du co-récepteur CD4 ou CD8, respectivement (1).
Les lymphocytes T naïfs quittent ensuite le thymus en réponse à plusieurs signaux, dont le signal généré par la liaison de la sphingosine-1-phosphate (S1P) au récepteur 1 de la sphingosine-1-phosphate (S1P1)
(17, 18). Les lymphocytes T naïfs circulent entre les différents organes lymphoïdes sous l’influence des récepteurs S1P1 et CCR7 afin de favoriser la rencontre avec les cellules présentatrices d’antigènes. Le récepteur
CCR7, dont les ligands CCL19 et CCL21 sont principalement exprimés par les cellules stromales et les cellules dendritiques, contrôle l’entrée et la localisation des lymphocytes T dans la zone riche en lymphocytes T des organes lymphoïdes (19). La reconnaissance par le TCR d’un antigène spécifique présenté par les cellules présentatrices d’antigènes active la cellule, ce qui conduit à l’augmentation des marqueurs d’activation CD69, CD25 et CD44 et la diminution de S1P1 (15).
Une faible proportion des cellules effectrices, tant chez les CD4+ que les CD8+, se différencient en
cellules mémoires et contribuent à la réactivation rapide de la réponse immunitaire lors d’une seconde exposition au même antigène (20, 21). Les lymphocytes T mémoires se divisent en trois sous-populations: les cellules de la mémoire centrale, les cellules de la mémoire effectrice et les cellules mémoires résidentes. Les lymphocytes T de la mémoire centrale circulent entre les différents organes lymphoïdes et la circulation sanguine (21, 22). Lorsqu’ils lient leur antigène, les lymphocytes T de la mémoire centrale prolifèrent et se différencient en cellules effectrices tout comme les lymphocytes T naïfs. Cependant, ces cellules sont plus sensibles à l’antigène que les lymphocytes T naïfs et possèdent des réserves de CD40L leur permettant d’interagir très rapidement avec les cellules dendritiques et les lymphocytes B suivant une réexposition à l’antigène (21). Les lymphocytes T de la mémoire effectrice circulent entre la circulation sanguine, les organes lymphoïdes et les tissus
non-lymphoïdes (22, 23). Contrairement aux cellules de la mémoire centrale, ces cellules conservent certaines fonctions effectrices et produisent des cytokines quelques heures seulement après une réexposition à l’antigène (21). Les lymphocytes T mémoires résidents se développent directement dans les tissus non-lymphoïdes quelques jours après l’exposition à un antigène ou à un agent infectieux (23). Ces cellules ne circulent pas et sont maintenues dans les tissus non-lymphoïdes pour plusieurs mois (23). Les lymphocytes T mémoires résidents développés au poumon à la suite à d’une infection pulmonaire sont suffisants pour protéger l’organisme contre une seconde exposition à l’agent infectieux (24, 25).
Fonctions des lymphocytes T et maladies pulmonaires chroniques
Le rôle principal des lymphocytes T est la production de cytokines et de composés cytotoxiques dans le but de favoriser l’élimination d’un agent spécifique.
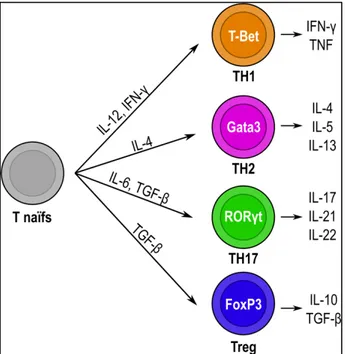
Les lymphocytes T CD4+ se différencient
en cellules effectrices de différentes polarités (T helper (TH)1, TH2, TH17 ou lymphocytes T régulateurs (Treg)) en fonction des cytokines présentes dans l’environnement pulmonaire (15) (Figure 1). Les lymphocytes TH1 permettent une réponse adéquate contre les infections pulmonaires par la production d’IFNg (15). Les souris déficientes pour l’IFNg, par exemple, ne contrôlent pas adéquatement la dissémination de la bactérie Mycobacterium tuberculosis
comparativement aux souris sauvages (26). Les lymphocytes TH2 sont impliqués dans l’élimination des parasites, ainsi que dans la réponse allergique
par la production d’IL-4, IL-5 et IL-13 (15). La déplétion des lymphocytes T CD4+ dans un modèle murin d’asthme
allergique prévient l’hyperréactivité bronchique et le recrutement des éosinophiles, alors que ces fonctions sont restaurées suivant le transfert de lymphocytes T CD4+ (27). La réponse TH17, caractérisée par la production
d’IL-17, IL-22 et IL-21, est souvent associée aux maladies auto-immunes et aux maladies d’hypersensibilité, dont la PHS (15). Le transfert de lymphocytes T CD4+ d’une souris sensibilisée vers une souris naïve est
d’ailleurs suffisant pour induire le développement de la PHS (28). Les Treg restreignent l’inflammation entre autres par la production de cytokines, dont l’IL-10, et sont souvent dérégulés dans les maladies d’hypersensibilité (15). Chez les patients atteints de PHS, les Treg sont réduits et ne parviennent plus à prévenir la prolifération des lymphocytes T effecteurs (29, 30).
En plus de produire des cytokines (TNF et IFNg), les lymphocytes T CD8+ libèrent des composés
cytotoxiques, dont la perforine, la granzyme et le Fas-ligand, pour éliminer l’agent pathogène ou la cellule anormale (31). Bien que les lymphocytes T CD8+ soient surtout associés à la réponse antivirale et la réponse
anti-tumorale, ils sont augmentés dans les maladies pulmonaires chroniques (32-34). La déplétion des lymphocytes T CD8+ dans un modèle murin d’asthme allergique prévient l’hyperréactivité bronchique et le
recrutement d’éosinophiles (35). De plus, chez les patients atteints de la maladie pulmonaire obstructive chronique (MPOC) ou de la PHS subaiguë, le nombre de lymphocytes T CD8+ est augmenté, mais leur rôle
demeure incertain (33, 34).
Ainsi, les lymphocytes T participent activement au développement de maladies pulmonaires chroniques. De plus, les lymphocytes T sont nécessaires pour certaines fonctions des lymphocytes B.
Lymphocytes B
Développement des lymphocytes B
Les lymphocytes B conventionnels (B-2) se développent dans la moelle osseuse à partir de cellules souches hématopoïétiques et poursuivent leur maturation dans les organes lymphoïdes périphériques pour former les différentes populations de lymphocytes B (lymphocytes B folliculaires et lymphocytes B de la zone marginale).
Les lymphocytes B dans la moelle osseuse suivent 3 phases de développement (pro-, pre- et immature) définies par la nature des réarrangements qui surviennent au niveau des gènes codant pour le récepteur de lymphocytes B (BCR) (36). Ces réarrangements définissent la spécificité du lymphocyte B et forment le vaste répertoire permettant la reconnaissance de 5 x 1013 antigènes distincts (36). Plusieurs points de contrôle lors de
la maturation de ces cellules permettent d’éliminer les cellules autoréactives et préviennent le développement de maladies auto-immunes (36). Les lymphocytes B immatures quittent la moelle osseuse de façon dépendante du récepteur S1P1 pour compléter leur développement dans la rate (37) (Figure 2).
Dans la rate, les lymphocytes B requièrent des signaux de survie pour compléter leur cycle de maturation sinon, ils entrent en apoptose (1). Les lymphocytes B suivent un stade de maturation transitionnel composé de trois phases (T1, T2 et T3) lors desquelles ils ne prolifèrent pas et ont une très courte durée de vie, comparativement aux cellules matures (38). Le «B-cell activating factor» (BAFF) est un facteur de survie essentiel par sa liaison au récepteur de BAFF (BAFF-R) (39). Les souris déficientes pour BAFF ou BAFF-R ont une réduction des lymphocytes B matures dans les organes lymphoïdes secondaires et une diminution de la réponse humorale due à une incapacité pour les lymphocytes B de passer du stade T1 à T2 (39, 40). BAFF lie également deux autres récepteurs, le «Transmembrane activator and CAML interactor» (TACI) et le «B-cell maturation protein» (BCMA), dont l’inhibition simultanée provoque une diminution des lymphocytes B circulants (41). Contrairement au BAFF-R, ces deux récepteurs peuvent également lier le «a proliferation inducing ligand»
(APRIL). Les données suggèrent que les récepteurs BCMA et TACI ont des rôles fonctionnels redondants, puisque l’absence de BCMA a peu d’impact sur le développement des lymphocytes B, alors qu’une déficience en TACI est plutôt associée à une hyperprolifération et une augmentation du nombre de lymphocytes B dans les organes lymphoïdes secondaires (42, 43).
Il existe plusieurs sous-populations de lymphocytes B matures exprimant des marqueurs de surface distincts et ayant des fonctions particulières déterminées par leur localisation. Les lymphocytes B de la zone marginale de la rate sont des lymphocytes B matures localisés dans une zone critique pour la reconnaissance des particules et des microorganismes du sang. Les lymphocytes B-1 sont d’origine fœtale et ne peuvent être complètement régénérés par le transfert de moelle osseuse suivant une irradiation chez la souris (44). Les lymphocytes B-1, enrichis dans la cavité péritonéale, se retrouvent dans les tissus périphériques lors d’inflammation et dans la circulation sanguine (45). Les lymphocytes B-1 ont été identifiés chez la souris, mais leur équivalent dans le sang périphérique chez l’humain demeure contesté (46). Les lymphocytes B de la zone marginale et les lymphocytes B-1 sont principalement activés par des antigènes T-indépendants et produisent majoritairement des immunoglobulines (Ig) M (45). Ces cellules ont un répertoire de BCR limité afin de reconnaître rapidement différentes composantes répandues chez les microorganismes (45). Les lymphocytes B folliculaires sont prédominants dans la rate et peuvent survivre pendant des mois. Ces cellules circulent entre les organes lymphoïdes et la circulation sanguine/lymphatique sous l’influence de différentes chimiokines afin de faciliter la rencontre avec l’antigène (45).
Ce processus développemental conduit à l’établissement de lymphocytes B matures naïfs qui doivent
Activation des lymphocytes B
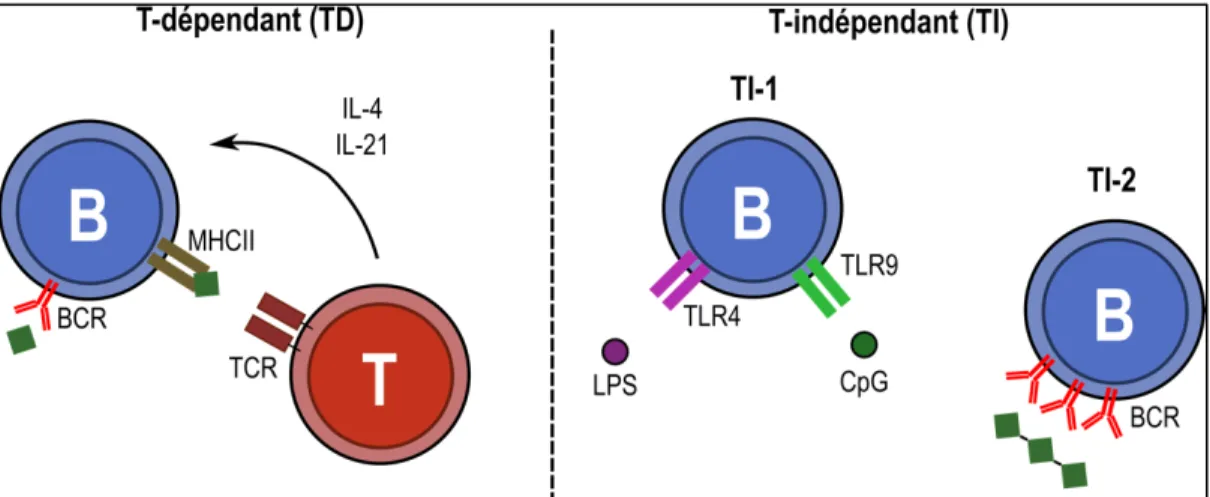
Les lymphocytes B sont activés par deux catégories d’agents distincts, soit les antigènes T-indépendants et les antigènes T-dépendants (Figure 3). Les antigènes T-T-indépendants activent les lymphocytes B sans l’implication du lymphocyte T. Il s’agit du mécanisme d’activation privilégié par les lymphocytes B-1 et les lymphocytes B de la zone marginale. En plus de l’activation directe des lymphocytes B, les antigènes T-indépendants peuvent interagir avec l’activation T-dépendante (47). La prolifération et la différenciation en cellules effectrices ou mémoires des lymphocytes B folliculaires se produisent dans les centres germinatifs et sont typiquement induites par un antigène T-dépendant (Figure 2).
Les antigènes T-indépendants activent les lymphocytes B selon deux mécanismes différents. Les antigènes T-indépendants de type 1 regroupent plusieurs molécules retrouvées en majeure partie chez les microorganismes et activent les lymphocytes B en liant les TLR à la surface de la cellule (48). Ce mécanisme d’activation dépend de l’expression des différents TLR à la surface du lymphocyte B qui est modulée en fonction des sous-populations et de leur niveau d’activation (49, 50). Les lymphocytes B murins expriment à la fois le TLR4 (récepteur pour le LPS) et le TLR9 (récepteur pour le motif CpG) (49, 51-53). Contrairement aux lymphocytes B murins, les lymphocytes B humains naïfs expriment des niveaux faibles de TLR à leur surface et n’expriment pas le TLR4 dans des conditions normales (54). Cependant, la liaison spécifique de l’antigène au BCR augmente l’expression de certains TLR chez le lymphocyte B (50, 55).
En plus d’activer directement le lymphocyte B, les antigènes T-indépendants de type 1 peuvent agir comme adjuvant et augmenter le niveau d’activation et la production d’anticorps en réponse à un antigène T-dépendant (47, 52, 56). Ex vivo, les ligands du TLR4 et du TLR9 sont suffisants pour induire la prolifération et la différenciation des lymphocytes B en cellules productrices d’anticorps (52, 56). Chez la souris, les ligands des TLR par la signalisation avec la protéine adaptatrice «Myeloid differentiation primary response 88» (Myd88) augmentent la production d’anticorps et contribuent aux fonctions régulatrices des lymphocytes B. Les souris
Figure 3: Mécanismes d'activation des lymphocytes B par des antigènes dépendants et T-indépendants.
avec une délétion spécifique de Myd88 sur les lymphocytes B produisent moins d’anticorps ou ont une altération du profil d’anticorps généré (47, 57). Les lymphocytes B de ces souris libèrent également moins d’IL-10, ce qui contribue à l’exacerbation de la réponse immune dans un contexte d’encéphalomyélite auto-immune expérimentale (51, 53, 58).
Chez l’humain, les ligands des TLR, en collaboration avec les mécanismes T-dépendants, favorisent l’activation optimale des lymphocytes B naïfs (50). Les plasmocytes circulants et les lymphocytes B mémoires expriment davantage de TLR et sont plus sensibles à leurs ligands. Le CpG, ligand du TLR9, induit la prolifération et la différenciation en cellules productrices d’anticorps des lymphocytes B mémoires (55, 59). Les ligands des TLR amplifient également la production d’anticorps par les plasmocytes circulants, mais n’ont aucun effet sur les plasmocytes résidants de la moelle osseuse qui n’expriment pas de TLR (60, 61).
Les antigènes T-indépendants de type 2 sont des molécules de haut poids moléculaire possédant des séquences répétées qui induisent l’activation de la cellule en liant plusieurs BCR à la fois (48, 62). Les lymphocytes B activés par un antigène T-indépendant produisent principalement des IgM rapidement après la liaison de l’antigène et ne développent pas une réponse mémoire à long terme (48, 62).
Les antigènes T-dépendants sont principalement des protéines qui activent les lymphocytes B par la liaison spécifique au BCR. Les lymphocytes B clivent l’antigène et un peptide résultant de ce clivage est présenté aux lymphocytes T par le MHCII dans les centres germinatifs. Les lymphocytes T activés produisent en retour des cytokines nécessaires pour l’activation du lymphocyte B. Plusieurs chimiokines, dont la CXCL13, contrôlent la migration des lymphocytes B vers les centres germinatifs et l’organisation spatiale des différentes sous-populations au sein du follicule (63). La CXCL13 lie le récepteur CXCR5 exprimé notamment par les lymphocytes B matures et l’absence de la CXCL13 inhibe la formation de centres germinatifs bien définis dans les organes lymphoïdes secondaires (63). Dans les centres germinatifs, les lymphocytes B oscillent entre la zone obscure et la zone claire. Dans la zone obscure, les cellules prolifèrent et subissent plusieurs mutations lors du processus d’hypermutations somatiques permettant d’accroître l’affinité du BCR envers leur antigène (64, 65). Les lymphocytes B modifient également la classe d’Ig exprimée à leur surface, un processus catalysé par l’enzyme «Activation-induced cytidine deaminase» (AID) (64, 65). Dans la zone claire, les cellules testent la spécificité du BCR muté contre un bassin d’antigènes présentés par les cellules dendritiques folliculaires (64, 65). La reconnaissance de l’antigène par le BCR induit une augmentation de l’expression du MHCII et des différentes molécules de co-stimulation (CD80, CD86, CD40) exprimées à la surface de la cellule qui sont requises pour l’interaction avec les lymphocytes T (66). Le lymphocyte B ayant capté l’antigène va présenter son peptide aux lymphocytes T folliculaires qui participent à la différenciation des lymphocytes B dans les centres germinatifs par la production de cytokines, dont l’IL-21 et l’IL-4 (67, 68). La signalisation des récepteurs pour l’IL-21 et l’IL-4 contribue au processus de mutations hypersomatiques et de prolifération des lymphocytes B dans la zone obscure des centres germinatifs (69, 70). L’absence de ces récepteurs conduit à une diminution
importante du nombre de cellules productrices d’anticorps ou plasmocytes (69, 70). Les lymphocytes B sélectionnés en fonction de l’affinité de leur BCR pour l’antigène se différencient ou retournent dans la zone obscure pour proliférer, alors que les lymphocytes B non sélectionnés sont éventuellement éliminés par apoptose (64, 65). Les lymphocytes B avec la plus haute affinité se différencient en plasmocytes sous l’influence de Blimp-1 (67). Les plasmocytes sont présents dans les tissus et peuvent soutenir la réponse humorale à long terme en migrant dans la moelle osseuse (67). Les autres lymphocytes B de haute affinité se différencient en cellules mémoires présentes tant dans la circulation que dans les tissus (67).
Lymphocytes B mémoires
Les lymphocytes B mémoires survivent plusieurs années tant en circulation que dans les tissus (12, 71). Lors d’une seconde exposition, ces cellules sont réactivées, prolifèrent plus rapidement et produisent davantage d’anticorps que les cellules naïves (71). Une dérégulation des lymphocytes B mémoires est d’ailleurs associée à diverses maladies inflammatoires (72-75).
Les lymphocytes B mémoires peuvent exprimer uniquement des IgM à leur surface et n’avoir donc pas subi de changements de classe d’Ig ou de mutations hypersomatiques (non modifiés; «non-isotype switched») ou exprimer plusieurs types d’Ig et avoir subi un changement de classe d’Ig et des mutations hypersomatiques (modifiés; «isotype switched») (71, 76, 77). Les lymphocytes B modifiés produisent plus d’anticorps lors d’une seconde exposition que les lymphocytes B non modifiés qui, plus souvent, migrent vers les centres germinatifs et prolifèrent (76-78). De plus, la génération de lymphocytes B mémoires non modifiés survient plus tôt après l’immunisation que la génération de lymphocytes B mémoires modifiés (79).
L’étude des lymphocytes B mémoires chez la souris est ardue et basée sur des modèles transgéniques complexes étant donné l’absence de marqueurs de surface bien définis (80). L’exposition à un agent infectieux induit le développement de lymphocytes B rapidement activés par une seconde exposition avec le même agent (81). De plus, les modèles murins ont permis d’identifier une nouvelle population de lymphocytes B mémoires résidents s’accumulant au poumon suivant une infection pulmonaire (82). Ces cellules mémoires sont conservées au poumon plusieurs mois après l’élimination de l’agent infectieux et contribuent à la réponse humorale lors d’une seconde exposition (82). Les lymphocytes B mémoires survivent plusieurs années indépendamment des facteurs de survie BAFF et APRIL, de l’interaction avec les lymphocytes T folliculaires ou de la présence constante de faibles concentrations d’antigène (79, 83).
Contrairement à la souris, l’humain possède des marqueurs de surface bien caractérisés permettant d’identifier les deux sous-types de lymphocytes B mémoires en circulation en se basant sur l’expression de IgD et CD27 (77). Les cellules en circulation exprimant à la fois IgD et CD27 à leur surface sont les lymphocytes B mémoires non modifiés, alors que les cellules exprimant uniquement le CD27 sont les lymphocytes B mémoires modifiés (84). La modulation de ces deux populations de lymphocytes B mémoires chez l’humain est une caractéristique souvent mise en évidence dans plusieurs maladies avec une forte composante inflammatoire,
dont le syndrome de Sjögren, l’arthrite rhumatoïde, le lupus systémique érythémateux et la fibrose pulmonaire (72-75).
Fonctions des lymphocytes B et maladies pulmonaires chroniques
La fonction caractéristique du lymphocyte B est la production d’anticorps contre un agent en particulier. Les anticorps se lient aux agents pathogènes pour favoriser leur reconnaissance par le système immunitaire et restreindre leur propagation. Lors d’une infection virale, la liaison d’un anticorps neutralise le virus et empêche ce dernier de pénétrer dans les cellules (85). Les anticorps possèdent également une région conservée à leur base (région Fc) qui est reconnue par différents récepteurs exprimés par plusieurs types cellulaires, dont les neutrophiles et les macrophages (1). Lors de la liaison à ces récepteurs du complexe anticorps-antigène, les cellules libèrent le contenu de leurs granules ou éliminent l’agent pathogène par phagocytose (1). Outre la production d’anticorps, le lymphocyte B libère des cytokines, dont le TNF, l’IL-6 et l’IL-10 (14). La production de cytokines par les lymphocytes B et la nature de ces cytokines sont déterminées par les médiateurs inflammatoires présents dans le microenvironnement pulmonaire et le stade de différenciation des lymphocytes B (86). Tout comme la cellule dendritique et le macrophage, le lymphocyte B exprime constitutivement des niveaux élevés de MHCII et présente l’antigène aux lymphocytes T (87). Ces différentes fonctions du lymphocyte B sont centrales au développement de plusieurs maladies pulmonaires.
Chez les patients atteints de fibrose pulmonaire, on note une réduction des lymphocytes B mémoires non modifiés en circulation (75) et une association entre une concentration plasmatique élevée de CXCL13 et un pronostic réservé (88). Dans un modèle murin de fibrose pulmonaire, une altération des lymphocytes B par la délétion de l’expression de CD19 diminue le score fibrotique en réduisant l’accumulation des Ig et des cytokines pro-inflammatoires (89). Le lymphocyte B est également grandement impliqué dans le développement d’emphysème pulmonaire caractéristique de la MPOC. En effet, le développement d’emphysème est associé à une augmentation de l’expression de gènes liés à la réponse des lymphocytes B (90). De plus, l’absence de lymphocytes B matures protège les souris du développement d’emphysème pulmonaire induit par l’exposition à la fumée de cigarette (91). Lors d’une exposition à des poussières organiques, ils contribuent au développement de la réponse immunitaire, puisqu’en l’absence de lymphocytes B fonctionnels, la production de cytokines pro-inflammatoires et la formation de tissus lymphoïdes tertiaires (TLT) sont réduites (92). De plus, l’inflammation pulmonaire dans un modèle murin de PHS est réduite chez la souris dont le développement des lymphocytes B est altéré (93). D’un autre côté, l’impact des lymphocytes B sur le développement de l’asthme expérimental est incertain et leur absence ne semble pas altérer la magnitude de la réponse immunitaire (94, 95). Ainsi, le lymphocyte B participe activement au développement et au maintien de la réponse immunitaire impliquée dans plusieurs maladies pulmonaires.
Tissus lymphoïdes tertiaires
Les TLT pulmonaires sont des structures se formant directement au poumon lors d’une période d’inflammation chronique par un mécanisme complexe impliquant plusieurs médiateurs inflammatoires, dont l’IL-17 et la CXCL13. Dans les maladies pulmonaires, les TLT peuvent être bénéfiques ou délétères selon le contexte de la maladie.
Les TLT pulmonaires se composent principalement de lymphocytes B et de lymphocytes T et se forment en association avec un vaisseau sanguin ou une bronche, ce qui leur confère aussi le titre de tissus lymphoïdes associés aux bronches (96). Les médiateurs nécessaires pour l’induction et le maintien des TLT ne sont pas universels et varient en fonction de la nature de l’antigène ou de l’agent infectieux ayant conduit à leur formation (96). La formation des TLT au poumon ne nécessite pas la présence de cellules inductrices d’organes lymphoïdes et de lymphotoxine a, qui sont des signaux essentiels pour la formation des ganglions lymphatiques (97, 98). Généralement, l’établissement d’une réaction inflammatoire au poumon provoque le recrutement de lymphocytes T CD4+ libérant des cytokines pro-inflammatoires, dont l’IL-17 et l’IL-13, ainsi que le recrutement
de cellules dendritiques libérant de la lymphotoxine b. Les cytokines IL-17 et IL-13 sont essentielles pour la formation des TLT dans plusieurs modèles murins (96, 99, 100). Ces cytokines contribuent à l’activation de cellules résidentes, dont les cellules endothéliales lymphatiques, les fibroblastes ou certains types de cellules dendritiques (101). Ces cellules activées produisent des chimiokines permettant le recrutement de lymphocytes dans le TLT (101). La chimiokine CXCL13 est requise pour le développement des TLT, car elle induit le recrutement des lymphocytes B dans le tissu en liant son récepteur, le CXCR5. D’ailleurs, une déficience en CXCL13 ou en CXCR5 inhibe grandement la formation des TLT pulmonaires (100, 102, 103). D’autres chimiokines, dont CCL19, CCL21 et CXCL12, permettent d’améliorer le niveau d’organisation des TLT, mais les TLT peuvent tout de même se former en leur absence (96, 103). Les cellules dendritiques, par la production de lymphotoxine b et de chimiokines, sont plutôt impliquées dans le maintien des TLT au poumon (104, 105). Les veinules à endothélium épais, qui sont des vaisseaux spécialisés facilitant l’entrée des lymphocytes du système lymphatique vers les organes lymphoïdes, se retrouvent dans les TLT bien organisés et contribuent au recrutement de lymphocytes (106).
Les TLT sont formés dans plusieurs contextes pathologiques, dont l’infection pulmonaire, la MPOC, l’asthme, la PHS, le cancer du poumon non à petites cellules et la réaction de rejet d’une greffe pulmonaire (98, 107-110). Les TLT sont des sites locaux d’activation de la réponse immunitaire adaptative. Les lymphocytes B retenus dans ces structures prolifèrent et partagent de nombreuses caractéristiques avec les lymphocytes B des centres germinatifs dans les ganglions lymphatiques (111). La réponse des lymphocytes T est également plus rapide lorsque des TLT déjà formés sont présents au poumon (104, 112). Par ailleurs, en l’absence de
tissus lymphoïdes secondaires, les TLT sont suffisants pour l’établissement d’une réponse immune adaptative et pour assurer l’élimination du virus de l’influenza (104). Des lymphocytes Treg peuvent également s’accumuler au niveau des TLT dans certains cas particuliers et restreindre l’inflammation, notamment à la suite d’une greffe du poumon (110). Les TLT peuvent être bénéfiques ou délétères selon le contexte de la maladie. La présence de TLT est associée à un meilleur pronostic chez les individus atteints d’un cancer du poumon non à petites cellules, mais au contraire corrèle avec la sévérité de la maladie et la présence d’emphysème chez les patients MPOC (107, 109, 113). La PHS induit la formation de TLT pulmonaires (114), mais nous ignorons toujours leur rôle dans cette maladie.
Limites de l’utilisation de modèles murins pour l’étude de maladies inflammatoires
L’utilisation de modèles murins a grandement fait avancer les connaissances actuelles sur le système immunitaire et les maladies pulmonaires (115, 116). Cependant, l’inefficacité de certaines drogues chez l’humain, alors qu’elles étaient très efficaces chez la souris, montre qu’il faut être prudent avec l’interprétation des résultats obtenus à partir de modèles animaux, particulièrement lorsqu’il est question du système immunitaire (117).
Bien que les étapes de développement des lymphocytes soient assez bien conservées entre l’humain et la souris, certaines différences fondamentales persistent entre les deux espèces (118). Tout d’abord, la nature des leucocytes contenue dans le sang périphérique est différente. Chez la souris, les lymphocytes sont prédominants dans la circulation sanguine (75-90%), alors que chez l’humain ce sont les neutrophiles qui sont majoritaires (50-70%) (118). De plus, certaines classes d’Ig sont uniques à la souris (IgG2a, IgG2b), alors que d’autres n’ont été identifiées que chez l’humain (IgG4, IgA1, IgA2) (118). Bien que plusieurs classes d’Ig soient communes aux deux espèces, il est impossible de faire des comparaisons directes, puisque les récepteurs reconnaissant la région Fc diffèrent par leur nature, par leur capacité à lier certaines Ig et par leur distribution (119). Alors que la polarité des lymphocytes T dans les modèles animaux est bien définie, cette division des lymphocytes T est plus confuse chez l’humain et certaines cytokines sont impliquées dans des réponses de polarités différentes (118). Par ailleurs, l’inflammation provoque des modifications d’expression de gènes et des modifications épigénétiques tant chez l’humain que chez la souris. Toutefois, une controverse persiste à savoir si le profil des gènes modifiés par différents évènements, dont le syndrome de détresse respiratoire aiguë ou une infection, chez la souris est représentatif des gènes impliqués chez l’humain (120, 121). Finalement, les souris développent spontanément des tissus lymphoïdes tertiaires pulmonaires, alors que ces structures sont absentes chez l’humain en bonne santé (122).
En conclusion, les modèles animaux sont indispensables pour l’étude des maladies pulmonaires, mais les biais relatifs aux résultats obtenus doivent être pris en considération et une approche combinant à la fois des données chez la souris et chez l’humain est à privilégier.
Hypersensibilité pulmonaire
Bioaérosols
Les bioaérosols sont des particules en suspension dans l’air de petite taille pénétrant dans les voies respiratoires lorsqu’elles sont inhalées (123). L’exposition aux bioaérosols est la cause de plusieurs maladies pulmonaires, dont la PHS.
Les bioaérosols sont composés d’agents biologiques complets (vivants ou morts), fragmentés ou de produits de ces derniers dont la taille varie du nanomètre jusqu’à 100 µM (123). De par leur petite taille, les bioaérosols pénètrent dans les voies respiratoires et se déposent plus ou moins profondément dans le système respiratoire en fonction de leurs propriétés physico-chimiques (diamètre aérodynamique, forme, densité, polarité, etc.) (123). L’exposition aux bioaérosols représente un enjeu de santé majeur et une cause fréquente de maladies occupationnelles (124). Outre leur implication dans le développement d’infections pulmonaires, les bioaérosols peuvent également provoquer une réponse toxique, une réaction allergique ou une réaction d’hypersensibilité (123, 124). La composition des bioaérosols varie selon le type d’environnement, le moment de la journée ou la saison lors de laquelle l’échantillon d’air a été prélevé (125, 126). Les bioaérosols sont hétérogènes et les différents agents biologiques qu’ils contiennent interagissent, ce qui influence la réponse immunitaire au poumon (125, 127, 128). En effet, pour une même quantité d’endotoxines, des échantillons d’air de sources différentes activent différemment les cellules dendritiques in vitro (127). De plus, dans un modèle murin de PHS, la combinaison d’endotoxines et de la mycobactérie Mycobacterium immunogenum augmente l’infiltration de leucocytes dans le parenchyme pulmonaire comparativement à la mycobactérie seule (128).
Malgré le lien indéniable existant entre les bioaérosols et les maladies pulmonaires, peu d’études se sont intéressées à la contribution des différents agents retrouvés dans l’air sur le développement et la persistance de l’inflammation pulmonaire dans les maladies d’hypersensibilité pulmonaire.
Mécanismes d’hypersensibilité
Une réponse d’hypersensibilité est une réaction exagérée du système immunitaire en réponse à un agent non infectieux qui peut avoir une origine endogène ou exogène. La classification de l’hypersensibilité en quatre types de réponse proposée par Gell et Coombs remonte aux années 1960 et, bien que ces concepts soient contestés de nos jours, ils sont toujours enseignés dans les livres de référence (129). L’hypersensibilité de type I est médiée par la production d’IgE, la dégranulation des mastocytes et la libération rapide d’histamines et de leucotriènes. L’asthme allergique est un exemple classique d’une réaction d’hypersensibilité de type I (129). L’hypersensibilité de type II est causée par la reconnaissance de l’antigène par des IgG conduisant à l’activation du complément, le recrutement de granulocytes et l’induction de dommages tissulaires provoqués