Enjeux et conséquences génomiques et écologiques
des ensemencements de soutien du touladi (Salvelinus
namaycush)
Thèse
Olivier Morissette
Doctorat en Biologie
Philosophiæ Doctor (Ph. D.)
Québec, Canada
© Olivier Morissette, 2019
ii
Résumé de la thèse
Comprendre et prédire les conséquences des outils de gestion des populations de poissons exploités par la pêche sportive est un des grands défis de la science de la conservation. Particulièrement, il subsiste une grande incertitude quant aux impacts de l’ensemencement. Bien qu’étant un outil généralement efficace, les ensemencements peuvent engendrer un grand bouleversement pour les populations qui y sont soumises, menaçant d’entraver leur productivité et leur persistance. Le touladi (Salvelinus namaycush) est un salmonidé d’eau douce nord-américain dont l’exploitation par la pêche sportive est fortement soutenue par l’ensemencement. L’objectif principal des travaux de cette thèse était d’identifier les impacts écologiques et génomiques de l’ensemencement de soutien chez cette espèce. Pour ce faire, nous avons exploré ces impacts potentiels dans trois grands aspects de l’écologie du touladi ; (1) la croissance et la condition (2) la niche trophique et (3) l’utilisation des habitats thermiques. Ces approches nous ont permis d’identifier l’écotype (planctophage ou ichtyophage) des populations sources et cibles de l’ensemencement comme un facteur déterminant des conséquences à court et moyen terme. Spécifiquement, nos analyses ont montré l’émergence de régimes de croissance divergents chez les populations planctophages ensemencées, certains individus ensemencés démontrant une grande taille, malgré l’habitat peu productif. La proportion individuelle des allèles exogènes chez ces touladis était corrélée à un indice de condition plus faible, suggérant une dépression hybride. L’analyse des ratios isotopes stables de carbone (δ13C) et d’azote (δ15N) a montré une potentielle partition de la niche trophique au sein
des populations d’écotype planctophage. Les individus locaux semblent être déplacés, probablement par exclusion compétitive, vers une niche pélagique profonde atypique pour ces populations. Finalement, la thermométrie des carbonates biogéniques, par l’analyse des ratios des isotopes stables d’oxygène (δ18O) de l’otolithe, a montré une utilisation différentielle des
habitats thermiques dans les populations planctophages ensemencées. Les touladis ensemencés utilisant des habitats généralement plus chauds que les hybrides et les locaux. Ces résultats ont souligné l’importance que les particularités inhérentes aux populations sauvages doivent prendre dans la planification des mesures de gestion. L’ignorance de ces traits et des adaptations locales des populations les met à risque de voir leur productivité et leur survie décliner.
iii
Thesis abstract
Understanding and predicting management consequences on exploited fish stocks represents one of the major challenges of conservation science. There are still considerable uncertainties about the impacts of supplementation stockings on wild populations. Although generally efficient, supplementation can represent a major disturbance for populations, threatening to hinder their productivity and sustainability. Lake Trout (Salvelinus namaycush) is a North American freshwater salmonid whose exploitation by angling is strongly supported by stocking. The main objective of this thesis was to identify the ecological and genomic impacts of supplementation stockings on Lake Trout. To do this, we explored the impacts in three major domains of lake trout ecology; (1) growth and condition (2) trophic niche and (3) use of thermal habitats. These approaches allowed us to identify ecotypes (planktivorous or piscivorous) of the stocking source and target populations as a factor determining magnitude of short- and medium-term consequences. Specifically, our analyzes showed emergence of two divergent growth regimes in stocked planktivorous populations, with around 20 % of stocked individuals showing larger body size despite unsuitable habitat. The proportion of exogenous alleles of hybrid individuals correlated with a lower condition index, suggesting outbreeding depression. The analysis of stable isotope ratios of carbon (δ 13C) and nitrogen (δ15N) suggest a
partition of niche for planktivorous stocked populations. Local individuals were displaced, probably by competitive exclusion, to a profundal/pelagic niche, atypical for these populations. Finally, biogenic carbonate thermometry, by analysis of otolith oxygen stable isotope ratios (δ18O), showed differential use of thermal habitats within stocked planktivorous
populations. Stocked Lake Trout were using warmer habitats than hybrids and local individuals. These results underscored the importance of the inherent particularities of wild populations in the planning of management measures. Ignorance of these specific traits, and local adaptations, puts supplemented population at risk of declining productivity and survival.
iv
Tables des matières
Résumé de la thèse ... ii
Thesis abstract ... iii
Tables des matières ... iv
Liste des figures ... vii
Liste des tableaux ... ix
Remerciements ... xii
Avant-Propos ... xiv
Introduction ... 1
1.1 L’exploitation des stocks de poissons, le grand bouleversement ... 1
1.1.1 La situation des pêcheries à toutes échelles ... 1
1.1.2 L’aménagement comme outil de mitigation ... 1
1.1.3 La biologie intégrative ou avoir plusieurs cordes à son arc ... 2
1.2 Le soutien anthropogénique des populations ...2
1.2.1 Les ensemencements au Québec ... 2
1.2.2 Les impacts de l’ensemencement de soutien, la génétique ... 3
1.2.3 L’hybridation introgressive dans les petites populations, le sauvetage génétique ... 4
1.2.4 Les impacts de l’ensemencement de soutien; l’écologie ... 4
1.3 Le concept de niche écologique ...5
1.3.1 La niche écologique : définition ... 5
1.3.2 Mesures des niches écologiques ... 6
1.3.3. Analyse des isotopes stables ... 6
1.4 Modèle d’étude, le touladi ...7
1.4.1 Description et biologie ... 7
1.4.2 Variabilité des formes et des stratégies de vie ... 8
1.4.3 Écotypes en petits lacs boréaux ... 8
1.4.4 La pêche sportive au touladi ... 9
1.5 Définitions des objectifs et organisations du projet ... 10
Chapitre 1. Supplementation stocking of Lake Trout (Salvelinus namaycush) in small boreal lakes: ecotypes influence on growth and condition ... 12
2.1 Résumé ... 12 2.2 Abstract ... 13 2.3 Introduction ... 14 2.4 Methods ... 17 2.4.1 Study design ... 17 2.4.2 Stocking history ... 18
2.4.3 Fish sampling and phenotype scoring ... 18
2.4.4 Genotype-by-sequencing analyses ... 19
2.4.5 Bioinformatics ... 19
2.4.6 Loci quality and filtering ... 20
2.4.7 Individual assignment ... 20
2.4.8 Individual age estimation ... 20
2.4.9 Modeling the population effects of stocking ... 21
v
2.4.11 Calculation of growth parameters ... 22
2.4.12 Calculation of the body condition index ... 22
2.4.13 Modeling of the effect of stocking on growth parameters ... 23
2.5 Results ... 23
2.5.1 Population genomics ... 24
2.5.2 Back-calculation and growth models ... 24
2.5.3 Growth parameters estimations and comparisons ... 24
2.5.4 Body condition index ... 24
2.5.5 Modeling the effect of stocking on growth parameters... 25
2.6 Discussion ... 26
2.6.1 Direct impact: combined factors to foster a larger growth ... 26
2.6.2 Genetic predisposition: growing large at all cost? ... 27
2.6.3 Impacts of hybridization on growth ... 28
2.6.4 Stocking large ecotypes: a suboptimal strategy? ... 28
2.6.5 Study limitations ... 29 2.7 Conclusions ... 29 2.8 Acknowledgements ... 30 2.9 Tables ... 31 2.10 Figures ... 39 2.11 Appendices ... 43
Chapitre 2. The role of ecotype-environment interactions in intraspecific trophic niche partitioning subsequent to stocking ... 44
3.1 Résumé ... 44 3.2 Abstract ... 45 3.3 Introduction ... 46 3.4 Methods ... 48 3.4.1 Study design ... 48 3.4.2 Stocking history ... 48 3.4.3 Sampling ... 49 3.4.4 Fish processing ... 49
3.4.5 Genomic data and genotyping ... 50
3.4.6 Markers quality and filtering ... 50
3.4.7 Individual genetic group assignment ... 51
3.4.8 Stable isotopes ratios quantifications ... 51
3.4.9 Stable isotope analysis ... 52
3.4.10 Genotype-phenotype association ... 53
3.5 Results ... 55
3.5.1 Population genomics and genetic groups assignment ... 55
3.5.2 Stable isotope analysis ... 55
3.5.3 Trophic niche size ... 56
3.5.4 Group-specific trophic positions ... 56
3.5.5 Group-specific distance from pelagic prey ... 56
3.5.6 Genotype-phenotype association ... 57
3.5.7 Gene ontology ... 57
3.6 Discussion ... 57
3.6.1 Community as niche partitioning susceptibility factor ... 58
3.6.2 Generalist/specialist competitive interactions ... 60
3.6.3 Contrasting ecotypic variation; a genetic predisposition to competitive interactions? ... 61
3.7 Conclusion ... 62
3.8 Acknowledgments ... 62
vi
3.10 Figures ... 69
Chapitre 3. Deciphering the lifelong realised thermal niche of lake trout (Salvelinus namaycush) through high-resolution otolith δ18O thermometry ... 75
4.1 Résumé ... 75
4.2 Abstract ... 76
4.3 Introduction ... 77
4.4 Methods ... 80
4.4.1 Fish sampling and processing ... 80
4.4.2 Genetic assignment of individual fish ... 80
4.4.3 Preparation of otoliths and ageing of fish... 81
4.4.4 SIMS otolith δ18O analytical methods ... 81
4.4.5 Quantification of the water δ18O isotopes ... 83
4.4.6 Calculation of experienced temperatures ... 83
4.4.7 Statistical analyses ... 84
4.5 Results ... 85
4.5.1 SIMS otolith δ18O ... 85
4.5.2 Thermal habitats of young-of-the-year and juvenile lake trout ... 86
4.5.3 Adult thermal habitats ... 87
4.6 Discussion ... 88
4.6.1 Assessment of the young-of-the-year thermal habitats ... 88
4.6.2 The onset of an ontogenetic thermal migration ... 90
4.6.3 Adult temperature preference: evidence for genetic × environment interactions? ... 91
4.7 Conclusions ... 92
4.8 Acknowledgments ... 93
4.9 Tables ... 94
4.10 Figures ... 98
Conclusion générale ... 103
5.1 L’importance des variations phénotypiques et génétiques; les écotypes ... 104
5.2 Hybridation intraspécifique ? ... 107
5.3 Le travail à postériori – recours aux traceurs biologiques ... 109
5.4 Perspectives ... 110
5.4.1 Aide à la gestion ... 111
5.4.2 Perspectives de recherches ... 112
vii
Liste des figures
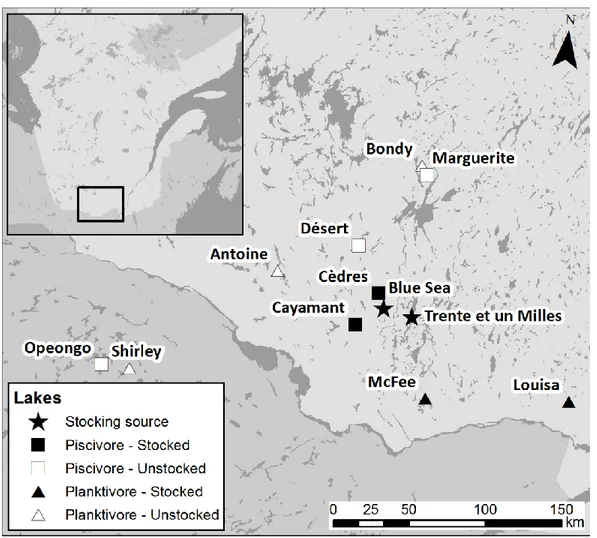
Figure 2.1. Lake Trout sampling locations with stocking source lakes (solid stars). Unstocked
(open symbols) and stocked lakes (solid symbols) had either piscivorous ecotype (square) or planktivorous ecotype (triangle) Lake Trout populations ……….…...………..39
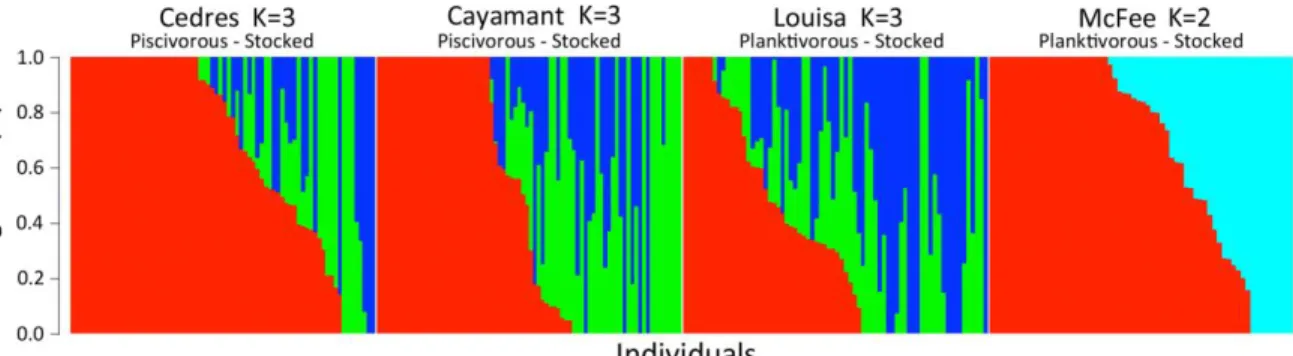
Figure 2.2. Admixture vertical plots for each stocked population. Vertical bars represent an
individual and each different color corresponds to its assignment to one of the clusters (genetic ancestry): proportion of local ancestry (red), Blue Sea Lake (blue), Lake Trente et Un Milles (green) and Blue Sea in McFee Lake (aqua) ………...………...………40
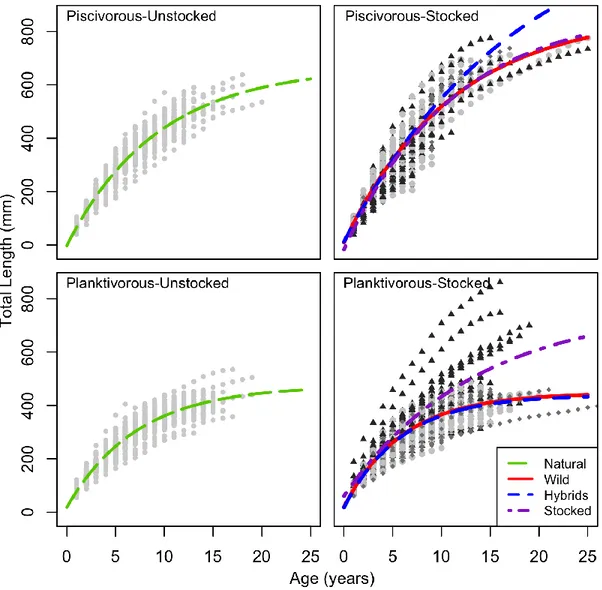
Figure 2.3. Individual growth curves by genetic origin within pooled unstocked and stocked
populations of both ecotypes. Length-at-age of natural and local (light gray circles), hybrid (dark gray diamond) and stocked (black triangles) Lake Trout. Curves are global Von
Bertalanffy growth models by genetic origin ………...……….41
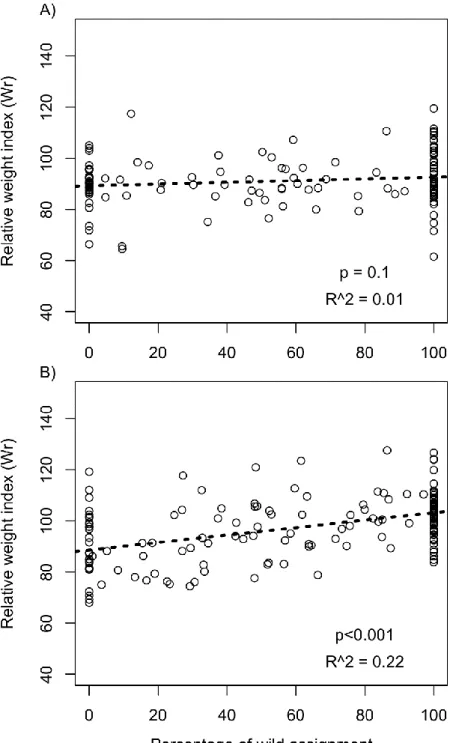
Figure 2.4. Relative weight condition index (Wr) as a function of percentage of local
assignment for (A) piscivorous and (B) planktivorous populations………... 42
Figure 3.1. Map of studied lakes, symbols are representing either piscivorous (triangle) and
planktivorous (circle) ecotypes of stocked (open symbols) and wild (filled symbols)
populations. ……….69
Figure 3.2. Distribution of the square root of standardized ellipse area (SEA) among the three
genetic origins (local, hybrid, stocked) within stocked populations and wild populations.
Letters are representing significant differences from post-hoc least-square mean contrast…… 70
Figure 3.3. Distribution of trophic position and distance from pelagic preys of wild
populations and three genetic groups (pure stocked, pure local, hybrid) within stocked populations of piscivorous (A, B) and planktivorous (C, D) ecotypes, note that axis scales differ among graphics ………..………71
Figure 3.4. Redundancy analysis (RDA) of the McFee and Louisa lakes showing position of
Lake Trout according to a PCA of life history metrics (asymptotic length (Linf), early life growth rate (omega), relative weight condition index (Wr) and δ13C and δ15N stable isotope
ratios) related to the selected axis of a PCA of SNP genotypes illustrated by blue arrows ……72
Figure 3.S.1 Trophic metrics (i.e., trophic position and pelagic distance) for each stocked
populations, genetic origin of fish is illustrated by the color of points ……….73
Figure 4.1. Difference between the occupied temperature at the end of the first growing
season and at time of hatching (otolith core) of local (blue symbols) and hybrid (green symbols) young-of-the-year from lakes Louisa (circle symbols) and McFee (triangle symbols). Black dashed line is a linear regression (ΔTend of season = -0.87 * Thatching + 9.45, p = 0.002, adjR2 = 0.40)………..………98
viii
Figure 4.2. The estimated thermal habitat of Lake Trout for the first to the sixth growing
season, capital letters indicate significant differences in post-hoc pairwise comparisons ……..99
Figure 4.3. The lifelong thermal habitat of trout from each genetic origin in both Louisa and
McFee lakes. Different colors within each box represent a different fish (n=30)……….100
Figure 4.4. Linear regression (average T °C = 0.01 * TL + 2.83, p < 0.0001, R2adj = 0.33) of
lifetime average estimated temperature (°C) in function of total length at capture (mm) for lake trout of local (pink), hybrid (cyan) and stocked (blue) genetic origin within Louisa (circle
symbol) and McFee (triangle symbol) lakes ………101
Figure 4.S1. Realized temperatures in function of back-calculated total lengths of local (blue
symbols) and hybrid (green symbols) juvenile Lake Trout of lakes Louisa (circle symbols) and McFee (triangle symbols). Black continuous line is a global smooth spline encompassing all the data ………102
ix
Liste des tableaux
Table 2.1. Study design and key information for each lake including latitude/longitude, the
year of most recent stocking, lake area, average annual air temperature and design treatment groups. ………31
Table 2.2. Estimates of Von Bertalanffy growth model parameters and standard error (SE) of
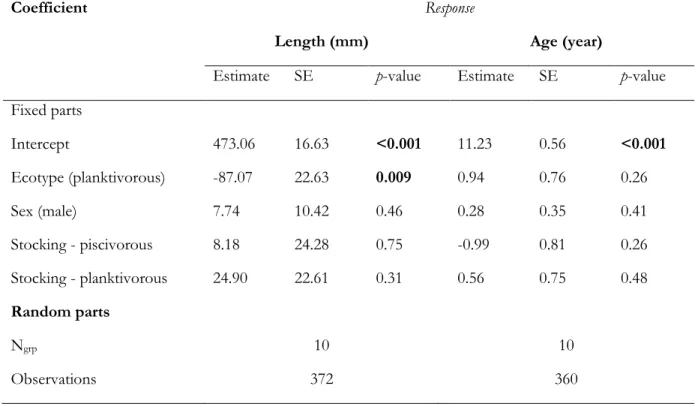
asymptotic length (Linf), growth coefficient (K) and length-at-age 0 (t0) for the number of fish captured (n), average total length (mm) and mean age (year) for each population type.
Unstocked lake populations are shaded.………32
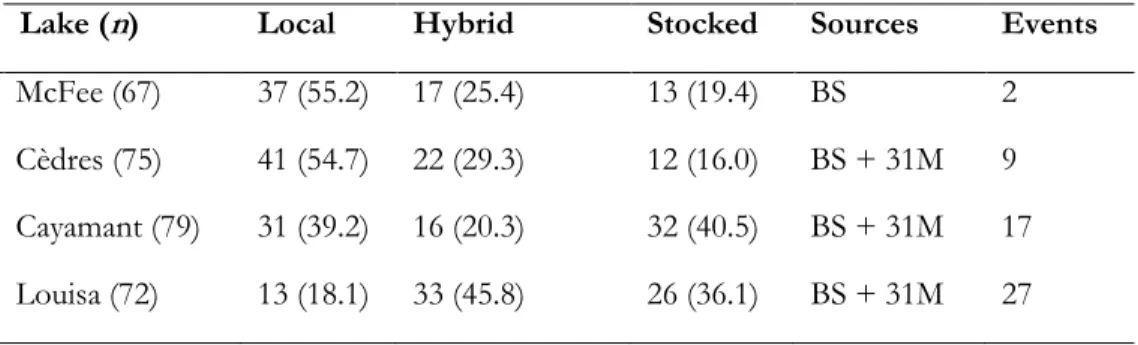
Table 2.3. Linear mixed effect models for the response variables of total length (mm) and
estimated age (year). Columns present the estimates of differences (positive or negative) of group response variables with the intercept (piscivorous ecotype), standard error and p-values of the factor. p-values in bold are significantly different. The two-terms coefficients (separated by hyphens) represent the nested factors. ……….33
Table 2.4. Number of fish assigned to each genetic origin (percentage of within-population
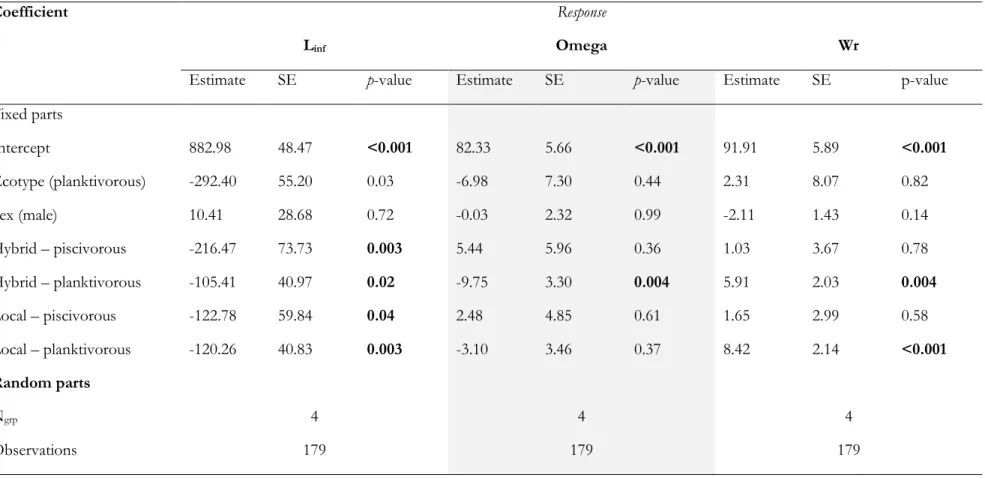
individuals), source of stocking (BS: Blue Sea Lake, 31M: Lake Trente et Un Milles) and the number of stocking events since 1900. Hybrids were individuals with ADMIXTURE local assignment (Q values) ranging from 10% to 90%. ………34
Table 2.5. Linear mixed effect models for response variables Linf, Omega (ω) and Wr. Columns present the differences (positive or negative) of group response variables with the model intercept (piscivorous ecotype), standard error (SE) and p-values of the factor. p-values in bold indicate significant differences (p < 0.05). The hyphen-separated coefficients represent nested factors. ……….35
Table 2.S1. Lake Trout stocking history of studied lake. Table include year of the stocking
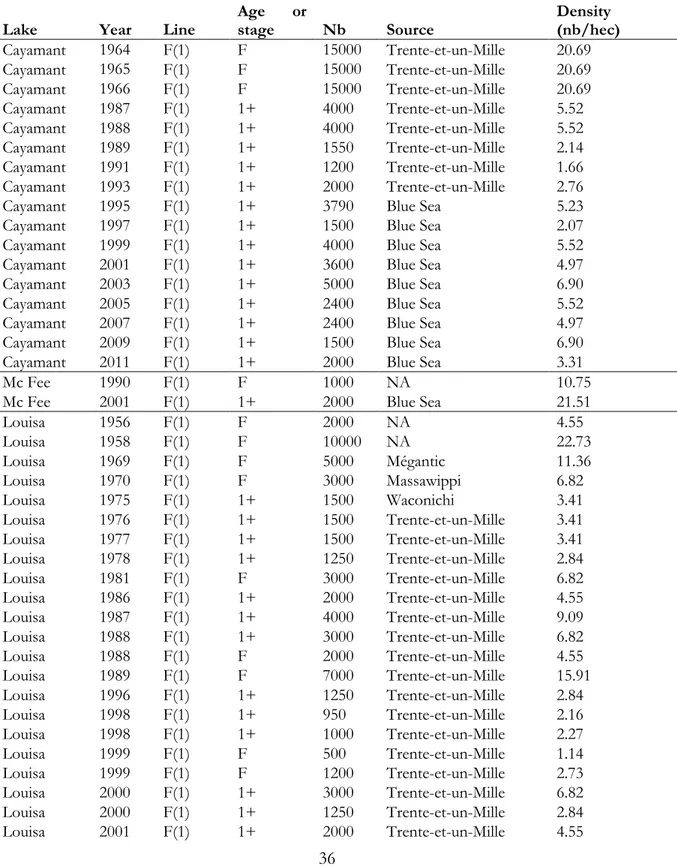
event, line of fish used, age or stage at stocking (1+: 1 year old or F; fry), number of fish stocked, source population of stocking, density (number of fish/area of lake (ha)) and age of the survivals at sampling. ……….36
Table 2.S2. Parameters values for every module used for genotyping and loci filtering in the
study ………38
Table 3.1. Study design and key information for each lake, including the year that each lake
was stocked for the last time, lake area, and average annual air temperature and design groups.64
Table 3.2. Mean and standard deviation (SD) of stable isotope ratios of each genetic group
(local, hybrid, stocked and wild) within lakes, number of fish by groups, convex hull total area (TA) and 95% standard ellipse area (SEA) of the group niches ………65
x
Table 3.3. Linear mixed effect model for standard ellipse area (SEA). Columns present the
estimates of differences (positive or negative) of group response variables with the intercept (piscivorous ecotype), standard error and p-values of the factor. Significant p-values are in bold. The two-terms coefficients (separated by hyphens) represent the nested factors. Random part section presents the numbers of tested groups and observations. ……….66
Table 3.4. Linear mixed effect models for the response variables trophic position and distance
of pelagic prey. Columns present the estimates of differences (positive or negative) of group response variables with the intercept (piscivorous ecotype), standard error and p-values of the factor. Significant p-values are in bold. The two-terms coefficients (separated by hyphens) represent the nested factors. Random part section presents the numbers of tested groups and observations. ………67
Table 3.5. BLAST hit sequences of genes putatively associated with life history metrics in the
RDA. Statistical significance of the alignment is represented by the E-value. Gene names and principal known functions are listed according to UniProt database and cited literature. ……...68
Table 3.S.1. Mean and standard deviation (SD) of stable isotope ratios of every pelagic
zooplankton preys captured within lakes, species and average number of individuals by analyses ……….69
Table 4.1. Lake Trout average total length (mm) and age (year) and their standard deviation
(SD) for every group of genetic origins for both lakes. ………94
Table 4.2. Linear mixed-effect model for response variable of the occupied temperature
during the first growing season. Columns present the estimated differences (positive or
negative) of group response variables with the model intercept, standard error (SE), degrees of freedom and p-values of the factor. p-values in bold indicate significant differences (p < 0.05) .95
Table 4.3. Linear mixed-effect model of juvenile occupied temperature (response variable).
Columns present the estimated differences (positive or negative) of factor response variables with the model intercept, standard error (SE), degrees of freedom and p-values for the factor. p-values in bold indicate significant differences (p < 0.05).………96
Table 4.4. Linear mixed-effect model of temperature occupied by adults (response variable).
Columns present the estimated differences (positive or negative) of factor response variables with the model intercept, standard error (SE), degrees of freedom and p-values for the factor. p-values in bold indicate significant differences (p < 0.05). The random parts show the number of tested groups and experimental units (Ngrp) and total observations. ……….97
xi
Roads? Where we're going, we don't need roads. - Dr. Emmett Brown
xii
Remerciements
Lorsque je considère les années de travail derrière ce document, je ne peux m’empêcher de porter mes premiers remerciements sincères et chaleureux vers mon directeur de thèse, Louis Bernatchez. Merci pour ta présence, mais aussi pour la liberté et la confiance que tu m’as accordée. Merci d’avoir laissé ce jeune écologiste que j’étais entrer dans un domaine dont il ne soupçonnait pas la complexité et la richesse. Merci aussi à Pascal Sirois, mon codirecteur, d’avoir fait en sorte que ce projet voit le jour. Merci d’avoir nourri mes réflexions par tes judicieux conseils. Merci également à mon comité de thèse, Julie Turgeon et Jean-Pierre Tremblay, pour les nombreuses contributions scientifiques et personnelles.
Mon passage au laboratoire Bernatchez fut ponctué de riches rencontres, une salutation spéciale à Charles Perrier, Anne-Marie Dion-Côté, Clément Rougeux, Anne-Laure Ferchaud et Justine Létourneau pour avoir été de si plaisants collègues de bureaux, nos discussions et nos rires furent précieux. Merci à Guillaume Côté, Cecilia Hernandez, Éric Normandeau, Simon Bernatchez, Jean-Sébastien Moore, Gratien Adoumandjali, Martin Laporte et Jérémy Le Luyer, vous tous qui avez contribué de près ou de loin à cette thèse.
Un merci sincère à tous mes collaborateurs du ministère des Forêts, de la Faune et des Parcs et de l’Ontario Ministry of Natural Ressources and Forestry; Isabel Thibault, Martin Arvisais, Véronique Leclerc, Louise Nadon, Julie Deschêsne, Daniel Hatin, Chris Wilson, Nigel Lester, Steve Sandstrom et Dustin Boczek. Vos contributions ont été précieuses et importantes. Votre accueil et votre collaboration ont été indéfectibles. Un merci spécial à tout le personnel de la station de recherche Harkness, ce haut-lieu de la recherche sur le touladi, au cœur du parc Algonquin. Mon séjour y fut agréable grâce à vous. Merci également à Michael Wiendenbeck du German Research Center for Geosciences, sa collaboration fut primordiale dans la mise à bien du 3e chapitre et il s’est avéré un collaborateur hors pair. Mon seul regret est de ne pas avoir pu
passer plus de temps avec chacun d’entre vous.
Afin de garder la tête froide, ces années de travail furent agrémentées de périodes de détente et d’activités sociales. Merci au club de triathlon du Rouge et Or de l’Université Laval et à tous
xiii
mes partenaires d’entraînement. Nous nous sommes arraché le cœur ensemble autant sur la piste qu’en piscine, et ce fut toujours grisant. Merci également à tous mes amis de la Vitrine éclatée d’improvisation de Québec. Vous êtes des gens merveilleux, des personnes intelligentes et vives d’esprit. Vous me faites rire et je suis choyé de vous compter parmi mes plus proches amis.
Finalement, un merci spécial à ma famille et mes amis; Maman, Papa, Florence, Simon, mes grands-parents, mes oncles et mes tantes et cousins, cousines. Merci d’avoir été là, de m’avoir écouté et soutenu et d’avoir participé à faire de moi la personne que je suis. Merci à Jennifer, mon amour, mon amie, ma compagne depuis toutes ces années. Tu es mon point d’ancrage, ma confidente et ma relectrice, même si parfois, tout ça te dépasse un peu. Nous avons entamé ensemble le plus beau des projets, notre famille. Nous avons la chance de côtoyer chaque jour nos deux adorables garçons, Jacob et Raphaël et j’en remercie la vie constamment. Je vous aime tous profondément.
Je terminerai ces remerciements avec une pensée pour tous ces scientifiques que j’ai rencontrés, qui ont été des modèles et qui m’ont ouvert à cette curiosité et cette passion qui nous anime. Votre contribution est anonyme, mais primordiale. Je vous en conjure, ne sous-estimez jamais l’importance que votre passion aura sur tous ces jeunes esprits qui vous regarde et vous écoute.
xiv
Avant-Propos
Cette thèse est rédigée par insertion d’articles. Elle est constituée de cinq sections, incluant son introduction et sa conclusion générale qui sont rédigés en français. Les trois chapitres qui constituent le corps de la thèse sont rédigés en anglais, dans un format approprié à la publication d’articles scientifiques. Au moment du dépôt de cette thèse;
Le chapitre 1 est publié sous la référence suivante : Morissette, O., P. Sirois, N. P. Lester, C.
C. Wilson, and L. Bernatchez. 2018. Supplementation stocking of Lake Trout (Salvelinus namaycush) in small boreal lakes: ecotypes influence on growth and condition. PLoS ONE 13.
Le chapitre 2 est en révision sous la référence suivante : Morissette, O., Sirois, P., Wilson,
C.C., Laporte, M. and Bernatchez L. The role of ecotype-environment interactions in intraspecific trophic niche partitioning subsequent to stocking. Ecological applications
Le chapitre 3 est en révision sous la référence suivante : Morissette, O., Bernatchez L.,
Wiendenbeck, M. and Sirois, P., Deciphering the lifelong realised thermal niche of lake trout (Salvelinus namaycush) through high-resolution otolith δ18O thermometry. Freshwater Biology
OM, LB et PS ont conçus le projet de thèse. OM a développé les idées de recherche, coordonné la prise de données, effectué le travail de laboratoire et conduit les analyses. ML a apporté de l’aide aux analyses génotype-phénotype (chapitre 2) tandis que CCW et NPL ont fournis leur vision critique et de l’aide sur les analyses des données de croissance (chapitre 1). MW a coordonné et réalisé les analyses en spectrométrie de masse à ionisation secondaire (chapitre 3). OM a rédigé chacun des chapitres sous la supervision du directeur de thèse LB et du codirecteur PS. Tous les coauteurs ont fourni commentaires et suggestions au fil de la rédaction.
1
Introduction
1.1 L’exploitation des stocks de poissons, le grand bouleversement
1.1.1 La situation des pêcheries à toutes échelles
Afin de répondre à la demande mondiale, l’exploitation des ressources halieutiques n’a pas connu de diminution de croissance au cours du dernier siècle (McIntyre et al. 2016). Les grandes pêcheries ont d’ailleurs connu leurs plus importantes augmentations au cours des dernières décennies, avec une croissance annuelle moyenne estimée à 3,2 % pour la période de 1960-2009 (FAO 2012). Cette croissance s’accompagne bien sûr d’une pression grandissante sur les populations exploitées par ces pêches (Pauly et al. 2002). En résultante, plusieurs grands stocks de poissons ont connu un déclin massif au cours du 20e siècle (Roughgarden and Smith
1996, Cook et al. 1997). Concrètement, en 2015, c’est 93 % des pêcheries mondiales qui sont classées comme pleinement exploitées ou surexploitées (FAO 2018). Les stocks de poissons exploités par la pêche sportive ne font pas exception à cette tendance (Post et al. 2002). Au Québec, comme partout au Canada, la pêche sportive est une activité à haute valeur économique et patrimoniale. La mise en place de mesures visant à conserver et soutenir les stocks de poissons « sportifs » apparait donc comme une priorité pour le soutien de cette industrie. Ce constat a stimulé la volonté publique de mettre en place des mesures de gestion et d’aménagement afin de stabiliser ou d’augmenter les stocks de poissons sportifs exploités.
1.1.2 L’aménagement comme outil de mitigation
On définit l’aménagement des stocks de poissons comme l’utilisation d’informations (écologiques, économiques, politiques et socioculturelles) afin de guider les décisions, desquelles résultent des actions (les mesures de gestions) permettant d’atteindre les objectifs établis pour une population, ou un groupe de populations, données (Krueger and Decker 1999). Ces mesures peuvent s’appliquer au niveau des usagers (imposition de limites de tailles, saison de pêche et restriction des engins), de l’habitat (gestion des macrophytes, création d’habitats de reproduction) et des populations (ensemencement de proies, reproduction assistée et ensemencement de soutien) (Hayes et al. 1999, Krueger and Decker 1999). La gestion des stocks de poissons implique généralement la modification anthropique de l’habitat ou des populations. Bien que l’objectif poursuivi par l’aménagement soit l’augmentation de
2
l’effectif de la population, il ne peut être atteint en négligeant la valeur intrinsèque des populations ou de la communauté déjà en place. Ainsi, il est primordial de savoir intégrer à la gestion, et par le fait même aux aménagements, une dimension conversationniste afin de soutenir l’exploitation tout en maintenant la diversité biologique inhérente aux ressources naturelles (Frankham 2010).
1.1.3 La biologie intégrative ou avoir plusieurs cordes à son arc
Les dernières années ont marqué un tournant important dans plusieurs domaines de pointe en science (p. ex., géo et biochimie, télémétrie, génétique). Le perfectionnement de ces techniques, jadis très onéreuses, a permis la démocratisation de celle-ci, notamment par le développement de versions miniaturisées, à haut débit et présentant un coût par échantillon de plus en plus faible (Goodwin et al. 2016). Citons notamment l’avènement du séquençage de nouvelle génération (SNG) qui a tend à faire augmenter continuellement les domaines d’application de la génomique. Notamment, l’approche de génotypage par séquençage (GBS) permet de séquencer des milliers de marqueurs génétiques (polymorphismes nucléotidiques simples, SNP) de manière aléatoire sur l’ensemble du génome de n’importe quelle espèce vivante (Davey et al. 2011). Cette technologie n’étant plus cantonnée aux espèces dites modèles, les secteurs appliqués (tel que la gestion des ressources fauniques) emboitent le pas et entrent dans l’ère de la génomique (Shafer et al. 2016). Ce nouvel outil, s’étendant maintenant à plusieurs domaines d’expertise, a ouvert la porte à la biologie intégrative. On définit la biologie intégrative comme la combinaison de plusieurs disciplines complémentaires afin d’étudier les systèmes biologiques complexes (Liu 2005). La gestion des stocks de poissons sportifs est appelée à être raffinée par l’apport de la biologie intégrative.
1.2 Le soutien anthropogénique des populations
1.2.1 Les ensemencements au Québec
Le soutien artificiel des stocks de poissons exploités par l’ensemencement vise à répondre aux besoins des utilisateurs de ces populations (Kerr and Grant 2000). Au Québec, on reconnait deux grands types d’ensemencement : 1) les ensemencements de conservation et 2) les ensemencements de mise en valeur (MFFP, 2016). Ils visent respectivement à augmenter l’effectif d’une population sévèrement réduite, menacée ou éteinte et à augmenter
3
artificiellement l’offre de pêche existante. Ce dernier objectif peut être rempli par l’introduction de nouvelles espèces plus recherchées, le soutien des populations ou le dépôt de poissons destinés à une exploitation à court terme (MFFP, 2016). Étant une sous-classe des ensemencements de mise en valeur, les ensemencements de soutien ont pour but « d’augmenter ou de maintenir une population déjà apte à se reproduire, mais dont l’habitat ou la pression de pêche trop forte empêche la population de s’accroitre et de se maintenir à un niveau suffisant pour satisfaire la pêche sportive » (MFFP, 2016). Bien que les ensemencements de soutien se révèlent un outil d’aménagement efficace, de récentes études mettent en garde contre d’éventuels impacts génétiques ou écologiques (Araki et al. 2009, Allendorf et al. 2010, Christie et al. 2016).
1.2.2 Les impacts de l’ensemencement de soutien, la génétique
Considérant que l’augmentation et/ou le maintien des populations sont les objectifs poursuivis par les ensemencements de soutien, la reproduction entre les individus ensemencés et locaux est quasi inévitable (voire souhaitée). Dans ce contexte, les hybrides résultants de ces évènements de reproduction conservent généralement leur capacité à se reproduire, ce qui peut mener au phénomène d’hybridation introgressive. On décrit l’introgression (ou hybridation introgressive) comme le transfert d’allèles d’un pool génique vers un autre par les rétrocroisements répétés (Harrison and Larson 2014). Dans le cas de l’ensemencement, l’introgression provient du flux de gènes non locaux des individus de la population ensemencée vers les populations naturelles ensemencées (Randi 2008, Fraser et al. 2010). Ce flux de gènes a déjà été identifié comme un facteur de modification de la diversité génétique intrapopulationnelle, mais aussi comme un agent de modification de la structure génétique interpopulationnelle, soit à l’échelle du paysage (Laikre et al. 2010a, Valiquette et al. 2014). Parmi les conséquences déjà identifiées de l’introgression, citons une débâcle des complexes de gènes coadaptés (Huff et al. 2011), ce qui peut mener à la perte des adaptations locales de la population (Allendorf et al. 2001, Laikre et al. 2010a, Lamaze et al. 2013). De court à moyen terme, ces impacts génétiques peuvent se traduire en perte de productivité de la population ensemencée, voir même à l’extinction des populations sauvages (Muhlfeld et al. 2009, Vandersteen et al. 2012).
4
1.2.3 L’hybridation introgressive dans les petites populations, le sauvetage génétique
Les conséquences de l’hybridation introgressive ont donc généralement été considérées comme négatives pour les populations naturelles. Cette généralisation considère toutefois presque uniquement l’impact de l’introgression suite à l’ensemencement de lignées domestiques (Harbicht et al. 2014b, Bolstad et al. 2017). Cependant, l’utilisation de reproducteurs de lignées sauvages ou locales a été démontrée comme une mesure de mitigation des effets délétères de l’introgression (Gow et al. 2011). Particulièrement dans les petites populations isolées ou de faible effectif, l’introduction d’allèles exogènes peut avoir un effet bénéfique en suppléant aux allèles fixés par la dérive génétique et en contrecarrant la dépression de consanguinité (Harbicht et al. 2014a). Dans ce cas, l’ensemencement de soutien pourrait être envisagé comme un outil de sauvetage génétique, une pratique de plus en plus fréquemment utilisée en génétique de la conservation (Pimm et al. 2006, Frankham 2015). Bien que la connaissance des impacts génétiques des ensemencements de soutien se raffine grandement depuis les 20 dernières années, il persiste encore beaucoup de doutes sur les impacts écologiques des ensemencements et de l’hybridation introgressive (Vandersteen et al. 2012).
1.2.4 Les impacts de l’ensemencement de soutien; l’écologie
La première conséquence de l’ensemencement au niveau écologique est bien sûr l’augmentation démographique du stock de poisson visé par l’ensemencement. Cet ajout d’individus vient augmenter de façon soudaine l’effectif en place. Dans certains cas, l’établissement de phénomènes dépendant de la densité (p. ex. compétition pour les ressources, diminution de la condition, diminution de la croissance) est probable suite aux ensemencements. Lorsqu’introduits dans une population naturelle, les poissons ensemencés sont également de potentiels compétiteurs aux individus locaux, en plus d’avoir un impact sur l’intégrité écologique du milieu (Lamaze et al. 2012). L’introduction d’individus provenant d’un milieu exogène peut avoir des répercussions sur la structure du réseau trophique (Vander Zanden et al. 1999, McKenna et al. 2013), l’introduction de maladies (Currens et al. 1997) et la productivité de la population, notamment en modulant le succès reproducteur (Fleming et al. 2000, McGinnity et al. 2003, Muhlfeld et al. 2009). Les causes de ces impacts viennent majoritairement du fait que les individus ensemencemés peuvent être très différents de leurs
5
congénères locaux (Fraser et al. 2010). La divergence entre les individus ensemencés et locaux s’exprime au niveau du taux de croissance et de la taille (Tymchuk et al. 2006).
Chez les poissons, la croissance est un processus complexe, résultant d’une interaction génotype-environnement impliquant plusieurs facteurs tels que la température de l’eau, la disponibilité des proies et la densité de population (Gardiner and Shackley 1991, Crisp 1993). Des études antérieures ont montré que la taille à l’âge pouvait avoir un impact sur la survie (Post and Evans 1989, Sogard 1997), le succès reproducteur (Koops et al. 2004) et la compétitivité (Persson 1985, Byström and García-Berthou 1999) des poissons. Le taux de croissance est un des trois « taux vital » (avec le recrutement et la mortalité) qui déterminent la productivité des populations de poissons (Hutchings 2001). Cependant, l’effet sur le taux de croissance de l’hybridation introgressive découlant des ensemencements de soutien a rarement été testé en populations naturelles (Weber and Fausch 2003, McDermid et al. 2010b).
1.3 Le concept de niche écologique
1.3.1 La niche écologique : définition
La compréhension des impacts écologiques inhérents au soutien artificiel des populations de poissons doit passer par la délimitation des éléments essentiels à la conclusion du cycle de vie de l’espèce ciblée. En d’autres mots, cette compréhension passe par la caractérisation et la définition de leur niche écologique. Bien que différentes définitions de la niche écologique soient disponibles, la vision de celle-ci comme un hypervolume s’impose. Au sein de ces travaux désormais devenus classiques, Hutchinson (1957) définit la niche écologique en fonction des variables environnementales qui la compose. Ainsi, considérons deux variables x1 et x2, dont les valeurs limites influencent la capacité d’une espèce donnée S1 de survivre et se reproduire « indéfiniment ». L’espace délimité par les coordonnées (x1’, x1’’ et x2’, x2’’) représente les conditions soutenant la survie de l’espèce. Ajoutons une variable supplémentaire x3 afin d’obtenir un volume, puis une variable x4 et ainsi de suite (xn). La niche écologique représente donc l’hypervolume de n dimensions, où n est le nombre de variables xi utilisées dans la définition des conditions. Ces variables composants la niche écologique peuvent être de différents ordres; habitats, ressources alimentaires, conditions environnementales ou pollution.
6
1.3.2 Mesures des niches écologiques
La théorie des niches écologiques stipule ainsi plusieurs variables descriptives pouvant être calculées, telle que l’étalement des niches (niche breadth), leur taille (niche size) ou leur largeur (niche width) (Van Valen 1965, Willson 1969, Colwell and Futuyma 1971). L’analyse de ces variables, accompagner des mesures de chevauchement (niche overlap) entre des groupes donnés (p. ex., espèces, écotypes ou sous-populations) permet la compréhension ou la prédiction des relations compétitives en place dans la communauté (Hurlbert 1978). Ainsi, un chevauchement élevé des niches peut représenter une situation de cohabitation, ou une situation de compétition importante, qui pourrait résulter en une exclusion compétitive d’une espèce ou d’un sous-groupe dans l’espèce. Au cours des dernières décennies, l’analyse des isotopes stables s’impose comme une norme dans l’analyse de la niche écologique (Post 2002, Layman et al. 2007, Layman et al. 2012).
1.3.3. Analyse des isotopes stables
L’analyse de la niche trophique des organismes aquatiques se base généralement sur la quantification des ratios des isotopes stables du carbone et de l’azote. En somme, l’approche repose sur le fait que les ratios de composition en isotopes légers ou lourds, dénotés par le symbole delta (δ), peuvent être reliés à certains évènements passés vécus par l’organisme. En effet, lors d’une réaction chimique, les isotopes légers seront impliqués préférentiellement du réactif vers le produit, produisant un débalancement des ratios d’isotopes dans les tissus de l’organisme comparativement aux ratios naturels. Ce débalancement se fait selon un taux connu; le facteur de fractionnement (α). La quantification des isotopes du carbone (δ 13C)
renseigne sur la source de carbone de la diète. Puisque les ratios de δ 13C changent peu entre les
proies et les consommateurs. Il est possible de différencier entre une source de carbone pélagique ou littoral, notamment parce que le δ 13C à la base du réseau trophique littoral,
allochtone puisqu’originaire majoritairement des plantes terrestres et transporté par ruissellement, est plus enrichi en 13C (δ 13C moins négatif) que la base du réseau trophique
pélagique, autochtone et provenant de la photosynthèse des microalgues pélagiques (France and Steedman 1996). Pour l’azote, les organismes consommateurs (p.ex. les prédateurs) subissent un enrichissement progressif en 15N (l’isotope léger) comparativement à leurs proies
(Vander Zanden and Rasmussen 2001, Buchheister and Latour 2010). En connaissant le taux de fractionnement (α) de ces isotopes et le ratio du 15N d’un consommateur secondaire et de
7
la base du réseau trophique, il est possible d’estimer la position trophique d’un organisme (Vander Zanden and Rasmussen 1999, Post 2002, Anderson and Cabana 2007). Puisque l’intégration des isotopes se fait sur une période de temps relativement longue (sur quelques mois), la technique permet d’avoir une vue d’ensemble de la consommation d’un organisme, au contraire de l’analyse des contenus stomacaux qui offre plutôt une vision instantanée (sur quelques jours). La quantification des isotopes stables chez les poissons est un outil puissant de description et de suivi des ressources trophiques utilisées par une population et donc de description de la niche trophique utilisée.
1.4 Modèle d’étude, le touladi
1.4.1 Description et biologie
Le touladi (Salvelinus namaycush) est un salmonidé des régions boréales et arctiques nord-américaines. Il habite les lacs oligotrophes et profonds, généralement isolé. Sauf quelques rares exceptions, il ne fréquente pas les rivières ni les milieux d’eaux salées. La répartition du touladi est considérée comme ayant été fortement influencée par les cycles glaciaires du Pléistocène. Incidemment, il existe une grande similarité entre la distribution de l’espèce et la couverture de la glaciation du Wisconsinien (Lindsey 1964). Suite à cette glaciation, la recolonisation du Québec et de l’Ontario a été majoritairement faite à partir des refuges atlantiques et du Mississippi (Wilson and Hebert 1998). Les populations de touladis sont majoritairement des reliques glaciaires, isolées et distribuées sur le territoire nord-américain. Le touladi est une espèce longévive qui peut atteindre une taille et un âge considérable (7 – 15 ans, max. 50 ans). Certains spécimens dépassent couramment 50 cm et pèse plus de 22 kg, le plus gros touladi capturé en Amérique du Nord mesurait 126 cm et pesait 46.3 kg (Scott and Crossman 1974). Le touladi fréquente les zones profondes et froides des lacs et possède un métabolisme lent, démontrant une croissance optimum en conditions de faibles températures (MacLean et al. 1990). Classé benthopélagique, le touladi est un prédateur opportuniste et généraliste, s’alimentant généralement de poissons-fourrages pélagiques. En période estivale, les touladis adultes se regroupent dans la couche d’eau froide et bien oxygénée (i.e. l’hypolimnion), ne faisant que de brèves excursions au-dessus de la thermocline pour se nourrir. Cependant, il existe peu d’informations sur l’histoire de vie des touladis juvéniles en milieu sauvage. Les quelques écrits disponibles sur le sujet se basent sur des observations sporadiques (Martin and Olver 1980b). Particulièrement, les informations disponibles sur l’écologie des touladis
8
juvéniles sont rares avant 3 ou 4 ans, les engins de pêche traditionnelle étant mal adaptés à la capture de touladi de petite taille (Elrod et al. 1996). L’utilisation de robots submersibles a réussi à documenter les habitats utilisés par les touladis juvéniles (> 300 mm) de 2 ans et plus (Davis et al. 1997). Les conclusions générales montrent que les juvéniles fréquente le fond des lacs durant le jour et migrent vers les habitats peu profonds durant la nuit pour s’alimenter et se soutirer à la prédation par les adultes.
1.4.2 Variabilité des formes et des stratégies de vie
La structure génétique moderne des populations de touladis souligne l’influence d’une combinaison de facteurs écologiques et historiques (Ihssen et al. 1988, Wilson and Hebert 1998); la colonisation de petits lacs isolés et les probables goulots d’étranglement démographiques suivant la déglaciation ayant favorisé une faible diversité génétique intrapopulationnelle (Avise et al. 1984). L’absence de migration et d’échange génétique entre les populations a mené à l’établissement de variations phénotypiques considérables entre les populations sauvages (Muir et al. 2015). Ce fait est bien illustré par les 30 différents noms communs et 15 noms scientifiques qui ont historiquement été associés au touladi (Martin and Olver 1980b). Ainsi, il est possible de recenser des variations, entre autres au niveau des couleurs (Wilson and Mandrak 2004), des motifs de mouchetures (Wilson, données non publiées) et de la morphologie (p. ex. caeca pyloriques, forme de la tête) des individus de touladi sur l’ensemble de sa distribution (Martin and Olver 1980b, Muir et al. 2015). Les populations des Grands Lacs nord-américains abritent différents morphotypes sympatriques très différenciés au niveau de leurs traits d’histoire de vie et de leurs niches écologiques (Zimmerman et al. 2007, Eshenroder 2008). Même si elles sont établies depuis environ 10 000 ans, les populations boréales de touladi démontrent des adaptations aux conditions locales des milieux qu’elles occupent (Martin and Olver 1980b, Wilson and Mandrak 2004).
1.4.3 Écotypes en petits lacs boréaux
Au sein des petits lacs boréaux (< 2000 km2), les populations de touladis peuvent exploiter une
variété de niches écologiques différentes, principalement reliées aux conditions environnementales locales et aux communautés d’organismes présents. Ainsi, Rasmussen et coll. (1990) ont décrit trois classes de lacs à touladis, dépendamment de la présence ou l’absence de certaines espèces de proies. Ces populations exhibent des différences importantes
9
au niveau des traits d’histoire de vie, de la diète, du temps de maturation, de la structure d’âge et de la distribution spatiale (Martin and Olver 1980a, Shuter et al. 1998, Wilson and Mandrak 2004, Mackenzie-Grieve and Post 2006, McDermid et al. 2010a). Cette variabilité a été résumée par la classification des populations de touladis en deux écotypes; les touladis ichtyophages et planctophages. Les touladis ichtyophages sont caractérisés par leur grande taille (> 600 mm), leur croissance rapide et leur maturité tardive. Au contraire, les populations planctophages démontrent une plus petite taille (environ 400 mm), une croissance plus lente et une maturation hâtive (Houde and Scrosati 2003, Bernatchez et al. 2016). Bien que ces écotypes se révèlent sensiblement différents autant au niveau de leurs histoires évolutives que de leur écologie, ils sont considérés comme une seule et même unité au niveau de la supplémentation des populations et du soutien de la pêche sportive.
1.4.4 La pêche sportive au touladi
Comme les autres salmonidés, le touladi exhibe certains caractères typiques (grande taille, combativité, chair savoureuse) qui en font une espèce d’intérêt pour les pêcheurs récréatifs. Sur toute son aire de distribution, le touladi fait l’objet d’une pêche sportive d’une ampleur considérable. Tel que mentionné précédemment, la pêche sportive est une activité récréotouristique importante pour l’économie du Québec. Toutes espèces confondues, les retombées directes de l’activité représentent près d’un milliard de dollars annuellement. Pour les régions impliquées, une portion non négligeable de ces revenus (environ 90 M$) sont attribuables à la pêche au touladi. C’est près de 70 000 pêcheurs qui consacrent annuellement plus de 625 000 jours à la pêche au touladi (MFFP, 2017). La récolte annuelle se chiffre à environ 400 tonnes, ce qui représente 380 000 touladis conservés, dont on estime qu’autant sont remis à l’eau. Les adaptations du touladi assurent son succès dans les régions boréales (longévité, maturité sexuelle tardive, croissance lente), mais le rendent particulièrement vulnérable aux impacts négatifs de la surexploitation (Wilson and Mandrak 2004).
Les prélèvements par la pêche sportive viennent couramment à outrepasser la capacité de croissance des populations. Il fut estimé que 63 % des stocks des touladis du sud du Québec étaient surexploités (Ministère du Développement Durable de l'Environnement de la Faune et des Parcs 2014). Les ensemencements de soutien se font majoritairement à partir de souches sauvages, le matériel sexuel étant prélevé dans les lacs sources, sur les sites de reproduction.
10
Les jeunes sont ensuite élevés en pisciculture avant d’être ensemencés entre les stades alevin ou juvénile (1 an). La majorité des populations sources sont de l’écotype ichtytophage, peu importe la population cible. Pour ces stocks affaiblis, l’apport des ensemencements est sans contredit un facteur majeur d’augmentation de la qualité de la pêche. Cette pratique est conséquente avec la longue tradition de compensation des déclins de salmonidés par l’ensemencement (Hindar et al. 1991, Hansen et al. 2001). Considérant l’importance de l’ensemencement dans la gestion des stocks de touladis, il convient d’en connaitre les implications et les conséquences. D’autant plus que les grandes tendances du déclin observées pour les pêcheries récréatives (Post et al. 2002, Molony et al. 2003) suggèrent que les gestionnaires pourraient recourir aux ensemencements de manière toujours plus fréquente. L’étude de l’impact de l’ensemencement s’impose donc dans un objectif d’adapter les méthodes d’ensemencements aux réalités de l’espèce, mais aussi d’en venir à des pratiques d’aménagement alliant conservation et exploitation durable.
1.5 Définitions des objectifs et organisations du projet
L’objectif du projet de recherche de cette thèse vise à déterminer, par le biais d’une approche de biologie intégrative, les impacts écologiques et génomiques des ensemencements de soutien comme outil de gestion de la pêche sportive au touladi. Cette thèse vise à mieux comprendre les conséquences de l’interaction entre l’histoire évolutive et l’hybridation introgressive sur la niche écologique utilisée par les touladis suite aux ensemencements de soutien. D’un point de vue appliqué, ce projet permettra de raffiner et d’optimiser les mesures de gestion des populations exploitées de touladi, particulièrement en ce qui a trait à l’ensemencement. Spécifiquement, le projet tirera ses conclusions de trois grandes approches expérimentales combinant plusieurs disciplines scientifiques (otolithométrie, génomique, isotopes stables et chimie des otolithes), qui seront détaillées en trois chapitres distincts.
Le premier objectif spécifique, faisant l’objet du premier chapitre, est d’analyser les conséquences des ensemencements de soutien sur la croissance et la condition des touladis. Spécifiquement, nous avons testé si l’adaptation locale (écotype) des populations sources et cibles de l’ensemencement avait un effet sur les impacts observés. La variation des composantes biodémographiques potentiellement liés au succès reproducteur (taille, taux de croissance et indices de condition) a été reliée aux génotypes individuels, découlant de
11
l’introgression conséquente aux ensemencements de soutien. Ce chapitre visait à s’interroger sur l’impact des ensemencements, mais aussi à évaluer leur effet à long terme comme outil de gestion en conservation.
Le deuxième objectif spécifique (chapitre 2) est d’observer les impacts des ensemencements de soutien sur l’utilisation des niches trophiques au sein des populations de touladis. Spécifiquement, nous avons quantifié et comparé les niches trophiques des touladis à l’aide des ratios des isotopes stables du carbone (δ 13C) et de l’azote (δ 15N) au sein de populations de
touladis sauvages et ensemencées. Ceci a permis de comprendre les conséquences trophiques des ensemencements, variables entre les différentes populations. Nous avons aussi exploré la structure génétique influençant les caractères biodémographiques et l’utilisation de la niche trophique. Finalement, nous avons identifié une série de marqueurs génétiques potentiellement sous sélection locale au sein des populations ensemencées d’écotype planctophage.
Le troisième objectif (chapitre 3) concerne la description de l’utilisation des habitats thermiques du touladi en réponse aux ensemencements. Nous avons effectué la reconstruction de l’habitat thermique utilisé par la quantification des isotopes stables d’oxygène (δ18O) à l’aide
de la spectrométrie de masse à ionisation secondaire (SIMS) sur des touladis pour lequel nous avons déjà nombre d’informations complémentaires (âge, croissance, origine génétique et position trophique). Ainsi, nous avons comparé les profils d’utilisation des habitats thermiques des touladis durant la période des 10 premières années de vie des différentes origines génétiques au sein des populations planctophages ensemencées. Ce chapitre s’est aussi intéressé à clarifier les facteurs influençant le choix de l’habitat thermique et à mieux documenter l’utilisation d’habitat chez les jeunes touladis.
Finalement, une conclusion générale propose un retour sur les principaux résultats obtenus dans ces trois chapitres ainsi que leurs implications théoriques et pratiques. Enfin, certaines perspectives de recherche sont abordées en complément à ces travaux.
12
Chapitre 1. Supplementation stocking of Lake Trout (
Salvelinus
namaycush
) in small boreal lakes: ecotypes influence on growth
and condition
2.1 Résumé
Les ensemencements de soutien sont un outil de gestion couramment utilisé chez les populations de poissons exploitées par la pêche sportive. Cependant, les potentielles conséquences pouvant en découler représentent une menace à la conservation des populations sauvages. Dans cet article, nous avons combiné des techniques de génomique (génotypage par séquençage) et l’étude des composantes biodémographiques individuelles (croissance et condition) afin de documenter les effets de l’ensemencement de soutien sur des touladis des petits lacs boréaux. Chez les deux écotypes communs aux petits lacs boréaux, les tailles moyennes des poissons ensemencés étaient significativement plus grandes. Au sein des populations d’écotype planctophage, la plupart des individus ensemencés démontraient une taille similaire aux poissons locaux, sauf 20 % démontrant une taille totale plutôt typique des poissons de l’écotype ichtyophage. Nous avons observé une corrélation positive entre l’indice de condition et le pourcentage d’appartenance génétique au groupe local. Ce patron était uniquement observé chez les populations d’écotype planctophage. Ces résultats permettent de conclure que les interactions et l’hybridation entre les deux différents écotypes peuvent conduire à des impacts négatifs délétères pour la population ensemencée, tout en étant un facteur de risque pour la dépression hybride. Ces résultats sont discutés dans un contexte de gestion des ensemencements de soutien au touladi.
13
2.2 Abstract
Supplementation stocking is a commonly used management tool to sustain exploited fish populations. Possible negative consequences of supplementation on local stocks are a concern for the conservation of wild fish populations. However, the direct impacts of supplementation on life history traits of local populations have rarely been investigated. In addition, intraspecific hybridization between contrasting ecotypes (planktivorous and piscivorous) has seldom been considered in supplementation plans. Here, we combined genetic (genotype-by-sequencing analysis) and life history traits to document the effects of supplementation on maximum length, growth rates, body condition and genetic admixture in stocked populations of two Lake Trout ecotypes from small boreal lakes in Quebec and Ontario, Canada. In both ecotypes, the length of stocked individuals was greater than local individuals and, in planktivorous-stocked populations; most stocked fish exhibited a planktivorous-like growth while 20% of fish exhibited piscivorous-like growth. The body condition index was positively related to the proportion of local genetic background, but this pattern was only observed in stocked planktivorous populations. We conclude that interactions and hybridization between different ecotypes is a risk factor for deleterious impacts and possible outbreeding depression. We discuss the implications of these findings for supplementation stockings.
14
2.3 Introduction
The voluntary introduction of exogenous animals and plants is one of the most frequent anthropogenic perturbations of wild populations (Laikre et al. 2010a). Deliberate releases of exogenous fish commonly have the goal of increasing the abundance of a threatened population, increasing potential fish harvest or introducing new species (Cowx 1994). For decades, the stocking of lakes with fish reared in hatcheries has been an important management approach, both in North America and Europe (Pister 2001, Araki et al. 2008). Stocking practices are diverse and are classified according to a variety of terminologies (e.g., put-and-take, conservation or fishery enhancements) generally based on the specific objectives of the stocking program (Utter and Epifanio 2002, Aprahamian et al. 2003). Among them, supplementation stocking (or fishery enhancement) aims to compensate for low productivity or a reduction in the abundance of populations that have been either (over-) exploited by recreational fisheries or perturbed by anthropogenic disturbances (Post et al. 2002).
Supplementation contributes to the maintenance of economically and socially important fish populations—largely salmonids in North America—targeted by angling activities (Aprahamian et al. 2003, Araki et al. 2008). Although supplementation stocking is an effective management strategy in some circumstances, the potential of direct and indirect negative impacts on wild populations remains hotly debated (Araki et al. 2009, Kitada et al. 2009, Muhlfeld et al. 2009, Harbicht et al. 2014b). The short- and long-term consequences of this approach on native fish populations are not fully understood, and there is a sustained interest to better predict the ecological, genetic and evolutionary impacts of stocked fish introduced into natural systems (Einum and Fleming 2001, Gompert and Buerkle 2016).
A main concern regarding supplementation stocking is the ecological and genetic interactions between stocked and local individuals (Utter and Epifanio 2002). Depending on the species, enhancement of top-predator demographics can destabilize local food webs (Eby et al. 2006). Furthermore, the addition of stocked individuals may induce deleterious density-dependent phenomena (e.g., reduced growth, decrease of reproductive success) in local populations (Hunt et al. 2014) or increase the risk of disease transmission (Naish et al. 2008). Intraspecific phenotypic and/or genotypic differences can develop rapidly between introduced hatchery-reared fish and local stocks through inadvertent or deliberate selection (Christie et al. 2012,
15
Hutchings 2014, Christie et al. 2016) and/or epigenetic modifications (Le Luyer et al. 2017). Differences between hatcheries and natural water bodies in terms of environmental conditions and selection pressure may favor the survival of atypical individuals, the emergence of maladapted predator avoidance or agonistic behavior (Reisenbichler and Rubin 1999) that could directly alter natural ecological processes (MacLean et al. 1981, Weber and Fausch 2003). Introgressive hybridization between local and hatchery-reared individuals can also have genetic impacts on local populations (Muhlfeld et al. 2009, Glover et al. 2012, Lamaze et al. 2012, Vandersteen et al. 2012). The consequences of introgression are generally negative and include a decreased effective population size (Ryman et al. 1995, Laikre et al. 2010a), alteration of genetic integrity (Allendorf et al. 2001), changes in gene expression (Lamaze et al. 2013), loss of local adaptations and a reduction of fitness (Araki et al. 2009, Muhlfeld et al. 2009, Laikre et al. 2010a, Bourret et al. 2011). However, supplementation with native broodstocks or with stocks sharing a high similarity with the recipient populations has demonstrated few or no deleterious effects from introgressive hybridization (Waples 1991, Einum and Fleming 2001, Gow et al. 2011). After several generations, local selection may purge foreign genes from the wild populations (Harbicht et al. 2014b, Valiquette et al. 2014, Létourneau et al. 2017).
Compared to the plethora of studies documenting genetic changes subsequent to supplementation (Waples 1991, Glover et al. 2012), few studies have documented the impact of introgressive hybridization on the life history traits of local populations (e.g., growth, survival and reproduction) (Vandersteen et al. 2012, Lamaze et al. 2013). Growth of domesticated and wild fish has often been compared within controlled and semi-controlled systems (Tymchuk et al. 2006, Araki et al. 2008), but fewer studies have compared the growth of supplemented fish and their hybrids in natural settings (Weber and Fausch 2003, McDermid et al. 2010b). Growth in fish is a complex process that involves gene × environment interactions influenced by multiple exogenous factors, including water temperature, prey availability and population density. Thus, growth is best studied in a natural setting (Gardiner and Shackley 1991, Crisp 1993). Modification of growth can be of prime importance as growth rates and length-at-age influence fish survival (Post and Evans 1989, Sogard 1997), reproductive success (Koops et al. 2004) and competitive capacity (Persson 1985, Byström and García-Berthou 1999). Growth rate is thus one of the three vital rates (along with recruitment
16
and mortality) linked to the productivity of fish populations and can be viewed in some cases as a proxy for reproductive success (Hutchings 2001).
Lake Trout (Salvelinus namaycush) is a large (mean: 400 – 500 mm), long-lived (up to 45 years) and late maturing (with intermittent spawning) salmonid found in deep and cold freshwater lakes in North America. It is one of the most sought-after species by recreational anglers. The species’ natural distribution matches closely the limits of Pleistocene glaciation, and numerous isolated populations are scattered throughout the Boreal Shield ecozone (Martin and Olver 1980a). Across its native range, Lake Trout exhibits marked variations in life history (Muir et al. 2015). Notoriously, three Lake Trout ecotypes (i.e., lean, siscowet and humper) have been shown to differ in terms of diet, size, morphology and ecology within the Laurentian Great Lakes, Great Slave Lake (Zimmerman et al. 2009) and Mistassini Lake (Zimmerman et al. 2007). Even in smaller lakes and at a smaller geographic scale, populations can exploit a variety of divergent ecological niches, primarily attributed to local environmental conditions and the available prey community. For instance, Rasmussen et al. (1990) described three classes of small lakes (e.g., excluding large North American lakes) that host Lake Trout populations, classified according to the presence/absence of different prey types. These categories reflected important differences in local conditions that translated into marked differences in Lake Trout life history including growth rate, diet, age at maturity, age structure and spatial distribution (Martin and Olver 1980a, Shuter et al. 1998, Wilson and Mandrak 2004, Mackenzie-Grieve and Post 2006, McDermid et al. 2010a). The various life histories exhibited among Lake Trout populations can be summarized into two common ecotypes (e.g., planktivorous or piscivorous) typical of small boreal lakes. Ecotypes reflect the combined influence of environmental conditions, niche availability and genetics (McDermid et al. 2010a, Bernatchez et al. 2016). The planktivorous ecotype is characterized by low growth rates, early maturation (~ 6 years) and a shorter maximum length of fish (< 450 mm), whereas piscivorous ecotypes exhibit high growth rates, late maturation (> 9 years) and a larger (> 600 mm) maximum length of fish (Houde and Scrosati 2003, Bernatchez et al. 2016). Some particular lakes can host both ecotypes living in sympatry, but the vast majority host a single allopatric ecotype.
The stocking of Lake Trout has been used for population supplementation for over a century (Kerr and Lasenby 2001). In Quebec, Canada, 46% of lakes in the southern portion of the
17
province that harbor a Lake Trout population exploited for angling have been stocked at least once since 1928 (Ministère du Développement Durable de l'Environnement de la Faune et des Parcs 2013). Stocking in Quebec lakes has been documented since 1900; recorded information includes the source populations, the number of stocking events, the numbers of stocked individuals and the life stages at stocking. These records demonstrate that the ecotypes of source and recipient populations have never been considered in stocking practices. Supplementation in Quebec always uses captive-reared broodstock from wild breeders that originate from allopatric Lake Trout populations of the piscivorous ecotype. This stocking approach has been used even when the recipient populations were allopatric populations of a planktivorous ecotype. In the most detailed study of the genetic impacts of stocking on wild populations of Lake Trout in boreal lakes, Valiquette et al. (2014) showed that stocking increased intra-lake genetic diversity, but also decreased inter-lake genetic distance among stocked populations (i.e., genetic homogenization). They also observed a positive relationship between the number of stocking events and the proportion of admixed individuals. Evans et al. (1991, 1991) also reviewed other impacts of stocking on Lake Trout populations. However, to our knowledge, the impact of stocking on fish growth and condition involving different ecotypes has never been documented.
This study aims to determine the impacts of Lake Trout ecotype on the genetic and phenotypic effects of supplementation stocking. Specifically, we assess whether stocking a piscivorous ecotype into recipient populations of piscivorous and planktivorous ecotypes has direct or indirect effects on fish growth. We compare individual Von Bertalanffy growth model parameters of fish having local, stocked and hybrid genetic origins. We also test the hypothesis that direct (i.e., growth of stocked individuals) and indirect effects (due to hybridization) are more important when stocking involves an ecotype different from that of the recipient population (here, a planktivorous ecotype). Ultimately, we aim to evaluate outcomes of supplementation stocking to propose strategies that could minimize potential negative impacts.
2.4 Methods
2.4.1 Study design
This study is based on a hierarchical design with two factors: ecotypes of populations (levels: piscivorous and planktivorous) and stocking history (levels: stocked and unstocked) using lakes