Tout ce que nous avons à décider, c'est ce que nous devons faire du temps qui nous est imparti.
Je tiens en premier lieu à remercier le Pr Christel Lutz d’avoir accepté de présider mon jury de thèse, mais aussi de savoir si bien faire les gâteaux et de nous en faire régulièrement profiter. Je remercie aussi vivement les Dr Hai-Tao He et Alain Trautmann d’avoir accepter d’être les rapporteurs de ma thèse.
Je remercie spécialement mon directeur de thèse, le Dr Denis Hudrisier, qui plus que tout autre m’a guidée au cours de ces années. Tu as orienté mon travail et l’as valorisé, c’est toi qui m’as donné les clefs de la réussite et je ne t’en remercierai jamais assez. J’apprécie ton calme, ta disponibilité, tes conseils judicieux, ta capacité à écouter l’avis des autres et à les laisser faire leurs propres choix. Je n’ai pas choisi de me spécialiser en immunologie dès le DEUG pour rien, et je suis particulièrement fière d’être ton premier padawan.
Merci au Dr Etienne Joly de m’avoir accueillie dans son équipe et de m’avoir permis d’effectuer ma thèse dans d’excellentes conditions. Merci d’avoir eu confiance en moi, de m’avoir permis de gérer mon travail en toute liberté, mais aussi d’avoir pris le temps de répondre à chacune de mes questions. Merci aussi pour ton enthousiasme et ton énergie, merci pour les sorties d’équipe, pour ta participation au concours de cartes postales et pour ta collection de tee-shirts… tous ces détails qui font de notre équipe ce qu’elle est.
Merci Julie de m’avoir prise sous ton aile et de toujours avoir été un exemple pour moi de ce que doit être une thésarde brillante. Merci de m’avoir donné tous ces trucs de labo, d’avoir partagé avec moi tes protocoles et ton expérience. Merci de m’avoir montré comment exploiter toute la capacité volumique des septiboxes, de m’avoir fait découvrir le plaisir de Yahoo People pendant les centris, de m’avoir prouvé que se goinfrer de frites (de chips, gâteaux, cacahuètes, sucre, etc) ne fait pas forcément grossir…
Merci à Sandrine pour ta bonne humeur et ton humour décalé, pour ton écoute et tes conseils avisés (la trentaine ça assagit !), mais surtout pour m’avoir rassurée à chaque fois que j’ai paniqué. Je ne suis pas prête d’oublier notre semaine de congré à La Plagne : la crosiflette, la bière au Saloon (à ne jamais réitérer), ton suicide avorté au milieu du brouillard,...
Merci à Lara pour son sourire quotidien, son calme infaillible, sa douceur. Et bien sûr pour son active participation à notre émission Radio-IPBS.
Merci à Christine pour sa force, sa joie de vivre, son expérience. Tu as beaucoup apporté à l’équipe, et partager ton bureau a été un véritable plaisir.
Merci à Eddy pour sa gentillesse et sa disponibilité. Qui aurait cru que je serais un jour capable de faire une PCR de A à Z sans me tromper ? Et merci aussi à Emilie… un accueil toujours parfait, n’est-ce pas chérie !
Merci aux filles de chez Cuvillier : Elisabeth, Isabelle, Audrey, Claire, Leyre… merci de m’avoir écoutée et soutenue chaque fois que je suis venue grogner dans votre bureau, merci aussi pour votre gentillesse et de votre bonne humeur.
Merci à Claire et Dania, vous n’auriez pas du déménager 2 étages plus bas !
Merci à tous les soutiens de l’IPBS : Corinne, Bruno, l’équipe Lutz, l’équipe Parini, Amine, …
Je tiens aussi à remercier ceux qui m’ont donné le goût de la recherche : le Dr B. Francès, le Dr A. Magnan, le Dr D. Vervloet, l’équipe du Dr J.M. Zajac et celle du Dr Y. Rivière.
Je veux particulièrement remercier ma famille de m’avoir soutenue pendant ces longues, très longues années d’études. Un soutien financier évident, mais surtout un vrai soutien moral. Je remercie mes parents de croire en moi et d’avoir toujours été persuadés que je pourrai « tout faire »… à trop les écouter on finit par y croire !
Merci à ma sœur Marine, toujours à l’écoute, toujours calme (ou presque), toujours capable de me calmer en tout cas ! Merci… et si je ne sais pas par où commencer, ce n’est pas grave puisque toutes les deux on se comprend, pas besoin de mot !
Merci à Tido, Renaud, Kiki, Claude et Charlotte d’être venus me soutenir pour cette occasion. Merci à Fred, Yves, Charlotte, Bertrand, Fabrice, Max, et autres cousin(e)s en pagaille, pour les week-ends régénérateurs de l’Ascension à Luchapt.
Enfin, une pensée spéciale à ma petite Moune qui me manque, que j’aurais voulu avoir à mes côtés aujourd’hui.
Je remercie bien sûr Carine, des années d’une amitié si forte ne se résument pas en quelques lignes… merci d’avoir avalé ces kilomètres à mes côtés pour ne rater aucun concert dans un rayon de 300 bornes, merci pour les plâtrées de pâtes du dimanche matin, merci pour toutes ces nuits dans la Golf parce qu’on ne va pas aller à l’hôtel quand même, merci de m’avoir fait
découvrir les joies du curry et du roller, merci pour cet incroyable voyage à Cuba (Viñalès ?), merci d’avoir passé des heures à m’aider à choisir des bottes, un ionisateur d’air ou encore ma nouvelle lessive, merci pour les soirées DVD et tes goûts cinématographiques improbables (Lake Tahoe : plus jamais !), merci à ta famille de m’avoir accueillie comme l’une des leurs… Merci à ma meilleure amie pour son soutien indispensable de tous les jours… voilà !
Je remercie aussi Florence pour le grain de folie qu’elle apportait au labo, puis pour l’amitié qu’elle m’a offerte…
Merci Aurélie pour toutes nos soirées pizzas, pubs, Grey’s, concerts,…
Merci à mes collègues thésardes qui, parce qu’elles savent ce que c’est, ont toujours été un vrai soutien : ma petite Claire de Paris, Karima, ma grande Claire de Grenoble (le couscous de Khalil était inoubliable).
Merci Agnès, Madame Caribou, qui a su rester notre mamie Agnès même à 5000 km !
Merci aux vieux amis, qui sont restés des amis malgré les distances : Pierre, Bruno C et Bruno L, Anne-Cécile, Thomas, Francesco, Sophie,…
Merci à mes colocataires du Killarney à qui j’en fait voir de toutes les couleurs depuis que j’ai commencé la rédaction de cette thèse : Damien, Jérôme, Pierre, Mary, Fabio, Fred, et bien sûr Roger !
Merci à toutes mes maisons d’adoption : le Killarney, le Bikini, le Café Pop, la SDF, la Cale Sèche,…
Merci à tous les petits groupes de rock de France et de Navarre qui m’ont fait courir les routes ces 4 dernières années et m’ont permis découvrir ces bourgades qui font le charme de notre Sud-Ouest (Carcenac, Caraman, Gratentour, Ax ou encore Luxey)… spéciale dédicace aux Beautés Vulgaires qui n’ont pas quitté l’autoradio de ma Golf depuis ce fameux soir de septembre 2006 !
Table des Matières
Résumé 7
Abstract 8
Liste des Abréviations 9
Liste des Illustrations 11
Avant-propos
13Introduction
14Partie 1 : Eléments de la Réponse Immunitaire Adaptative 15
I- Les acteurs cellulaires et moléculaires de la réponse immunitaire adaptative 15
1. Principes généraux de la réponse adaptative 15
2- Le récepteur à l’antigène des lymphocytes T 17
3- Le récepteur à l’antigène des lymphocytes B 18
II- Contacts cellulaires dans la réponse adaptative 20
1- La réponse T 20
a- La synapse immunologique des lymphocytes T 20
b- L’activation du lymphocyte T 23
c- Induction de la réponse T CD4+ 25
d- Induction de la réponse T CD8+ 26
2- La réponse B ou réponse immunitaire humorale 26
a- Induction de la réponse B 26
b- La synapse Immunologique des lymphocytes B 28
c- L’activation des lymphocytes B 29
Partie 2 : La Trogocytose 30
I- Historique et définition 30
II- La trogocytose est réalisée par un grand nombre de types cellulaires 32
1- La trogocytose réalisée par les lymphocytes T 32
2- La trogocytose réalisée par les lymphocytes B 35
3- La trogocytose réalisée par les cellules NK 35
4- La trogocytose réalisée par les lymphocytes non conventionnels 36
5- La trogocytose réalisée par les cellules non-lymphocytaires 37
III- La trogocytose : capture de matériel membranaire 38
1- Transfert sélectif de composants membranaires 38
2- Devenir des molécules capturées 39
3- Quel est le mécanisme de transfert intercellulaire ? 40
a- Induction de la réponse immune 45
b- Contrôle négatif de la réponse immune 46
c- Optimisation de la réponse et du répertoire immuns 47
d- Maintien de l’activation lymphocytaire 47
e. Nouvelles propriétés physiologiques 48
f- Dissémination de pathogènes 48
g- Capture de molécules pathologiques 50
h- Rôle immuno-thérapeutique 50
i- La trogocytose : un outil en immunologie 51
Résultats
53Partie 1 : Transfert de Glycoconjugués par Trogocytose :
Comparaison avec la Capture de Sondes Lipidiques ou de Protéines Biotinylées 54
I- Contexte - Hypothèse de travail 55
II- Manuscrit 56
III- Résumé des travaux - Discussion 83
Partie 2 : Etude du Transfert Sélectif des Composants Membranaires par Trogocytose 85
I- Introduction 86
II- Matériel et Méthodes 88
III- Résultats préliminaires 94
1- Les HEK-FcγRII permettent de mettre en œuvre des essais de trogocytose redirigée 94 2- Localisation des protéines fluorescentes transfectées dans les cellules HEK-FcγRII 95
3- Transfert sélectif de certaines protéines par trogocytose 97
4- Prise en compte de l’efficacité de transfection des plasmides 99
IV- Poursuite des travaux et autres perspectives 100
Partie 3 : La Capture de Membrane Plasmique par Trogocytose est un Phénomène Actif
dans les Lymphocytes T, mais pas dans les Lymphocytes B 103
I- Contexte - Hypothèse de Travail 104
II- Manuscrit 105
III- Résumé des travaux - Discussion 114
Conclusions Générales
117Références 121
Résumé
La communication cellulaire, fondamentale à la mise en place des réponses immunitaires de l’organisme, a lieu via l’échange de facteurs solubles et la transmission de signaux intracellulaires, conséquences d’interactions ligand-récepteur bien connues. Ces dernières années, un nouveau mode de communication a été découvert, mettant en jeu l’échange de fragments de membrane entre cellules en contact. Ce processus, nommé trogocytose, que nous avons initialement décrit chez les lymphocytes T, est rapide et très efficace, puisque jusqu’à 10% des protéines et lipides membranaires présents sur les cellules cibles sont capturés et exprimés à la surface du lymphocyte. Cependant, il existe une spécificité de passage : tous les composants membranaires ne sont pas capturés avec la même efficacité. Bien que les mécanismes et les rôles physiologiques de la trogocytose soient encore mal définis, elle présente un intérêt majeur en tant qu’outil immunologique, notamment pour identifier les lymphocytes spécifiques d’un antigène dans une population hétérogène.
Mon travail de thèse s’est orienté sur deux axes principaux : identifier des critères conditionnant l’efficacité de passage d’une molécule par trogocytose et mener une étude comparative des mécanismes de la trogocytose entre les lymphocytes T et les lymphocytes B. Les travaux sur la sélectivité de passage des molécules par trogocytose ont été divisés en deux études complémentaires. Tout d’abord, nous avons montré que les glycoconjugués des membranes des cellules cibles étaient capturés par les lymphocytes T et B par trogocytose avec une efficacité comparable aux protéines ou aux lipides. L’étude de la sélectivité de transfert a alors été complétée par une approche plus fine de criblage de protéines étiquetées à la GFP. Nos résultats préliminaires confirment l’existence d’une sélectivité de passage et identifient des protéines candidates, dont l’étude permettra de comprendre les bases du transfert sélectif et donc de mieux appréhender le ou les mécanismes de la trogocytose.
Enfin, une partie majeure de mon travail a consisté à comparer les caractéristiques de la trogocytose effectuée par les lymphocytes T et B. En utilisant des inhibiteurs de différentes voies d’activation lymphocytaire, nous avons déterminé que si la trogocytose est un phénomène actif, dépendant du cytosquelette d’actine et de la transduction du signal dans les lymphocytes T, c’est un phénomène passif dans les lymphocytes B, qui a lieu en présence de tous les inhibiteurs testés, et même à 4°C. Cette différence fondamentale, intrinsèque au type cellulaire, est une première étape vers la compréhension du phénomène de trogocytose dans son ensemble.
Abstract
The cellular communication, fundamental to immune responses establishment in the body, takes place through soluble factors exchange and intracellular signals transmission, consequences of well-known ligand-receptor interactions. Recently, a new mode of communication has been discovered, involving the exchange of plasma membrane fragments between cells in contact. This process, called trogocytose, which we originally described in T cells, occurs rapidly and efficiently since, after one hour, up to 10% of membrane proteins and lipids from the target cells can be detected on the lymphocyte surface. However, the transfer is selective : all membrane components are not captured with the same efficiency. Although mechanisms and physiological roles of the trogocytosis are not well defined yet, it has a major interest as immunological tool, mostly to identify antigen-specific lymphocytes in a heterogeneous cell population.
My thesis work has focused on two main areas: first to identify the criteria that determine the selectivity of transfer for a molecule during trogocytosis and second to compare the mechanisms of trogocytosis in T and B lymphocytes.
Concerning selectivity of molecules transfer by trogocytosis, the work was divided in two parts: first, we showed that glycoconjugates were captured from the target cells with the same efficiency as proteins or lipids during trogocytosis by T and B cells. In a second study, we are currently working to define the criteria of transfer selectivity of membrane components by following the transfer of proteins tagged with GFP. Our initial results confirm that there is a selectivity of transfer and identify candidate proteins, whose study will enable us to understand the factors determining the transfer of molecules, and thus to advance our understanding of the mechanism(s) of trogocytosis.
Finally, a major part of my work involved comparing the mechanisms of the trogocytosis process by T cells and B cells. Using a large panel of inhibitors of various cellular activities, we determined that trogocytosis is an active phenomenon in T cells, dependent on actin cytoskeleton and signal transduction, and that it is a passive phenomenon in B cells, that can takes place in the presence of all the inhibitors we tested and even at 4 ° C. This fundamental difference, intrinsic to the cell type, is a first step towards understanding the phenomenon of trogocytosis as a whole.
Liste des Abréviations
Ac Anticorps
Ag Antigène
ATP Adénosine TriPhosphaste BCR B Cell Réceptor
BSA Bovine Serum Albumin CD Cluster de Différenciation CD40-L CD40-Ligand
CFP Cyan Fluorescent Protein
CMH Complexe Majeur d’Histocompatibilité CMV CytoMégalo Virus
CPA Cellule Présentatrice d’Antigène CTL Cytotoxic T-Lymphocyte
CTLA-4 Cytotoxic T-Lymphocyte Antigen 4
CMTMR 5-(et-6)-(((4-ChloroMethyl)benzoyl)amino)TetraMethylRhodamine CFSE Carboxy-Fluorescein diacetate, Succinimidyl Ester
cSMAC central SupraMolecular Activation Cluster DAF Deacy-Accelerating Factor
DAPI 4',6' Di Amidino-2-Phényl Indole DAG DiAcylGlycérol
DC Dendritic Cell
DMEM Dulbecco's Modified Eagle's Medium DN T reg Double-Négative T regulatory cells DRM Detergent-Resistant membranes EBV Epstein-Barr Virus
EDTA Ethylene-Diamine-Tetraacetic Acid ELISA Enzyme Linked Immuno-Sorbent Assay
FcγRII Récepteur de type II à la Fraction Constante des immunoglobulines G418 Nom générique de la Généticine
GAP43 Growth Associated Protein 43 GFP Green Fluorescent Protein
GM1 Mono-sialo-tetrahexosyl-ganglioside
Grp1 Recepteur Général aux Phosphoinositides Isoforme 1 GTPase Guanosine TriPhosphatase
HA Hémagglutinine
Hck Hematopoietic cell kinase HLA Human Leukocyte Antigen
HTLV-1 Human T- Lymphotropic Virus - type 1 HEK Human Endothelial Kidney
HEL Hen Egg Lysozyme
ICAM-1 Inter-Cellular Adhesion Molecule 1 IFNγ Interferon gamma
Ig Immunoglobuline
IL-2 Interleukine 2
ITAM Immunoreceptor Tyrosine-based Activation Motif ITIM Immunoreceptor Tyrosine-based Inhibition Motif
IEL Intra-Epithelial Lymphocyte IP3 Inositol TriPhosphate IT Index de Trogocytose
KIR Killer cell Immunoglobulin-like Receptor LAT Linker for Activation of T cell
Lck Leukocyte specific protein tyrosine kinase LFA-1 Leukocyte Function-associated Antigen-1 LPS LipoPolySaccharide
L Th Lymphocyte T helper ManLev N-levulinoylmannosamine MeCP2 Methyl CpG Binding Protein 2 NK Natural Killer cells
NLS Nuclear Localisation Signal
OVA Ovalbumine
PBMC Peripheral Blood Mononuclear Cells PBS Phosphate Buffer Saline
pCMH Complexe Peptide/CMH PDGF Platelet-Derived Growth Factor P-GP P-GlycoProtéine
PHA PhytoHémAgglutinine Pi3K/Pi4,5K Phosphoinositide-3/4,5 kinase PiP2/3 Phosphatidyl inositol bi/triPhosphate PKC Protéine Kinase C
PLCγ PhosphoLipase C γ
pSMAC peripheral SupraMolecular Activation Cluster PVR PolioVirus Receptor
PX Phox homology
Rae-1 Retinoic acid early-1 protein RE Réticulum Endoplasmique SEM Scanning Electron Microscope SH2 Src Homology 2 domain SHP-1 Src Homology Phosphatase-1 SiaLev N-levulinoyl sialic acid SVF Sérum de Veau Fœtal TCR T Cell Receptor
TL Thymus Leukemia
TRAP Assay Trogocytosis Analysis Protocol Assay T reg Lymphocyte T régulateur
VEGF Vascular Endothelial Growth Factor VIH Virus de l’Immunodéficience Humaine VSV Virus de la Stomatite Vésiculaire
WT Wild Type
Liste des Illustrations
Illustration 1 Représentations schématiques et structures tridimensionnelles des molécules de CMH de classe I et II - p16
Illustration 2 Représentation schématique et structure tridimensionnelle du TCR - p18 Illustration 3 Représentation schématique et structure tridimensionnelle du BCR - p19 Illustration 4 Morphologie de la synapse immunologique - p20
Illustration 5 Représentation des différentes phases de mise en place de la synapse immunologique - p21 Illustration 6 Synapse immunologique multifocale - p22
Illustration 7 Transduction du signal dans un lymphocyte T - p24
Illustration 8 Interactions nécessaires à l’activation d’un lymphocyte T CD4+ naïf - p25 Illustration 9 Interactions nécessaires à la mise en place de la collaboration T-B - p27 Illustration 10 Phénomène de déploiement et de contraction des lymphocytes B - p28
Illustration 11 Acquisition de molécules de CMH de classe I par les lymphocytes T CD8+ - p31 Illustration 12 Capture de membrane par trogocytose par un lymphocyte T sur une CPA - p34
Illustration 13 Topologie potentielle des molécules capturées par trogocytose et exprimées à la surface des lymphocytes T - p40
Illustration 14 Capture de fragments cellulaires par phagocytose par Naegleria fowleri - p41 Illustration 15 Sécrétion d’exosomes par les CPAs - p42
Illustration 16 Observation de ponts membranaires lors du détachement d’un CTL de sa cible - p43 Illustration 17 Etablissement de nanotubes dans une culture de cellules T - p44
Illustration 18 Les protéines tranférées par trogocytose sont localisées dans des structures de membrane spécifiques à la surface de la cellule effectrice - p44
Illustration 19 Localisation théorique du produit de certaines des constructions plasmidiques utilisées - p86 Illustration 20 Principe de la trogocytose redirigée - p87
Tableau 1 Liste des constructions plasmidiques codant pour les protéines fluorescentes utilisées dans ce travail - p89-91
Figure 1 Les lymphocytes T CD8+ capturent efficacement le FcγRII par trogocytose redirigée - p95 Figure 2 Localisation des différentes protéines fluorescentes dans les cellules HEK - p96
Figure 3 Capture de différentes protéines fluorescentes par des cellules B par trogocytose redirigée - p98
Figure 4 Courbes de l’efficacité de capture de la protéine FcRγ-GFP par les lymphocytes T en fonction de son intensité d’expression dans les cellules cibles - p100
Avant-Propos
Le système immunitaire assure la défense de l’organisme contre les éléments étrangers, ou « non-soi », qui franchissent les barrières naturelles du corps. La réponse immunitaire est divisée en deux composantes : l’immunité innée et l’immunité adaptative.
L’immunité innée joue un rôle essentiel dans la défense précoce de l’organisme en permettant la reconnaissance du non-soi par un système constitué de protéines solubles actives et de récepteurs cellulaires relativement invariants. Elle implique un grand nombre de cellules comme les cellules inflammatoires résidentes (neutrophiles, mastocytes, macrophages), les cellules endothéliales, les monocytes, les cellules dendritiques, les cellules natural killer (NK), ainsi que des sous-populations de lymphocytes (cellules B-1, NKT et Tγδ), les basophiles et les éosinophiles.
L’immunité adaptative est caractérisée par l’expansion et la différenciation de lymphocytes spécifiques d’un antigène donné. Elle est plus longue à se mettre en place et constitue la deuxième ligne de défense de l’organisme. Plus spécifique, elle permet d’éliminer le non-soi plus efficacement que l’immunité innée. La réponse adaptative présente deux composantes : la réponse cellulaire, basée sur l’action des lymphocytes T qui coordonnent l’action des cellules immunes et détruisent les cellules infectées ou cancéreuses, et la réponse humorale, basée sur la production d’immunoglobulines par les plasmocytes.
Lors de la réponse immunitaire, une communication cellulaire importante est établie grâce aux nombreuses interactions qui ont lieu entre les différents types cellulaires mis en jeu et qui s’accompagnent de divers transferts intercellulaires d’informations et de molécules. Ma thèse a été l’occasion d’étudier plus finement l’un de ces processus de transfert de molécules, la trogocytose, en travaillant chez les lymphocytes T et B à l’identification des molécules capturées, aux différences de mécanismes intercellulaires, ainsi qu’aux conséquences pathologiques de ce phénomène.
Partie 1 :
Eléments de la Réponse Immunitaire Adaptative
I- Les Acteurs Cellulaires et Moléculaires
de la Réponse Immunitaire Adaptative
1. Principes Généraux de la Réponse AdaptativeLa réponse immunitaire adaptative repose sur l’existence de lymphocytes T et B porteurs de récepteurs capables de reconnaître des fragments de pathogènes, les antigènes, qui leur sont, le plus souvent, présentés par des cellules dites présentatrices d’antigènes (CPAs). Dans le cas des lymphocytes T, la présentation par une CPA est obligatoire et met en jeu principalement les cellules dendritiques (DCs), qui sont les cellules les plus à même de présenter l’antigène aux lymphocytes T de façon efficace (1). Les antigènes sont présentés aux lymphocytes T à la surface des CPAs sous forme de peptides associés aux molécules du complexe majeur d’histocompatibilité (CMH). Les co-récepteurs CD4 ou CD8 interagissent avec le CMH, de telle sorte que les lymphocytes T CD4+ reconnaissent des peptides antigéniques associés à des molécules du CMH de classe II, tandis que les lymphocytes T CD8+ reconnaissent ceux associés à des molécules de classe I.
Les molécules du CMH de classe I et II classiques ont toutes la propriété commune de lier des peptides antigéniques, mais diffèrent en de nombreux autres points :
* Les molécules de CMH de classe I sont présentes à la surface de toutes les cellules nucléées de l’organisme, à l’exception de certains sites immuno-privilégiés comme le système nerveux central. Elles sont composées d'une chaîne alpha et d'une chaîne β2−microglobuline qui s’associent en formant une poche pouvant contenir un peptide de 9 acides aminés, issu de la dégradation de protéines intracellulaires (Illustration 1). La présentation de peptides endogènes par les molécules de CMH de classe I conduit à l’activation spécifique des lymphocytes T CD8+. De plus, les CPAs ont la capacité de présenter des antigènes exogènes associés à des molécules de CMH de classe I, selon un
processus spécialisé appelé cross-presentation (2) qui conduit aussi à l’activation des lymphocytes T CD8+ (3).
* Les molécules de CMH de classe II sont uniquement présentes à la surface des CPAs. Elles sont composées d'une chaîne α et d'une chaîne β, associées de façon à former une cavité pouvant contenir un peptide d’une vingtaine d’acides aminés, issu de la dégradation de protéines extracellulaires (Illustration 1). La présentation de peptides exogènes par les molécules de CMH de classe II conduit à l’activation spécifique des lymphocytes T CD4+ (4, 5).
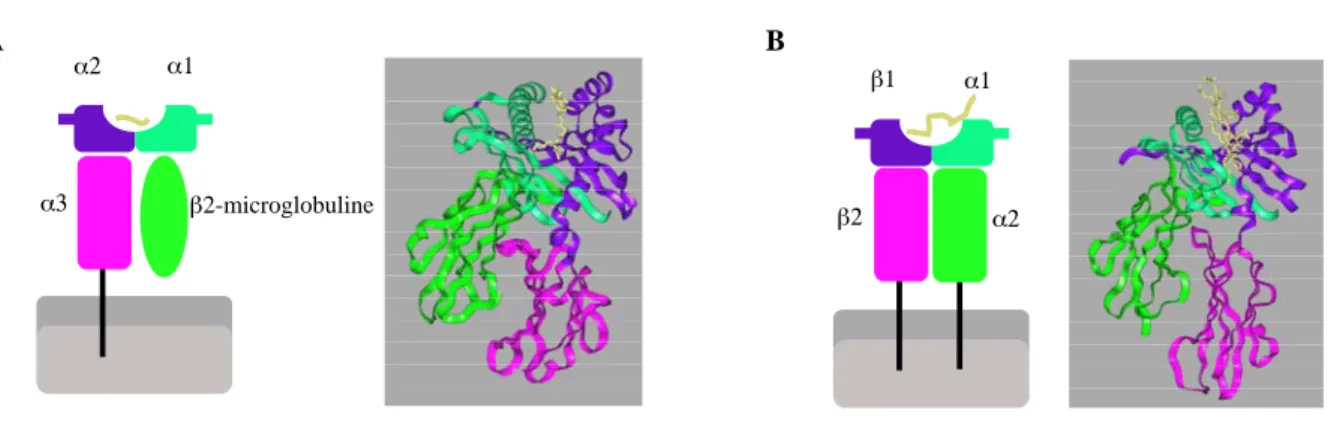
Illustration 1 : Représentations schématiques et structures tridimensionnelles des molécules de CMH de classe I et II
D’après J. Coadwell, The Principles of Protein Structure, 1997.
A- Molécule de CMH de classe I humaine, HLA-B27, composée d’une chaîne α (domaine α1 : turquoise, domaine α2 : violet, domaine α3 : rose) et d’une molécule β2-microglobuline (vert). α1 et α2 forment une poche pouvant contenir un peptide de 8 à 10 acides aminés (jaune). B- Molécule de CMH de classe II humaine, HLA-DR1, composée d’une chaîne α (domaine α1 :
turquoise, domaine α2 : vert) et d’une chaîne β (domaine β1 : violet, domaine β2 : rose). α1 et β1 forment une poche pouvant contenir un peptide de 12 à 25 acides aminés (jaune).
Les DCs, au stade immature, sont présentes dans la majorité des épithéliums et dans la plupart des organes. Ce sont les cellules sentinelles de l’immunité, elles reconnaissent les pathogènes ou leurs fragments par l’intermédiaire des récepteurs de l’immunité innée, les Pattern Recognizing Receptors (PRR), qui se lient à des motifs antigéniques très conservés, les PAMPs (Pathogen Associated Molecular Pattern). Les DCs capturent le pathogène par phagocytose, endocytose ou pinocytose, ou peuvent également être infectées ; elles s’activent alors et migrent vers les organes lymphoïdes secondaires en même temps qu’elles perdent leur activité de capture d’antigènes au profit de leur activité présentatrice d’antigène. Elles augmentent ainsi l’expression à leur surface de molécules de CMH ainsi que de molécules de
α1 α3 β2-microglobuline α2 α1 β2 α2 β1 A B
co-stimulation des lymphocytes, et dégradent en peptides antigéniques les composants des pathogènes qu’elles ont capturés ou qu’elles expriment après avoir été infectées. A leur arrivée dans le ganglion, les DCs expriment un grand nombre de molécules de CMH associées à des peptides antigéniques, de molécules co-stimulation de la famille des B7 et de molécules d’adhérence (LFA-1) : ce sont des DCs matures, prêtes à activer les lymphocytes T naïfs.
Contrairement aux lymphocytes T, les lymphocytes B ne semblent pas nécessiter de façon obligatoire une présentation de l’antigène par une CPA. En effet, ils s’activent au contact d’antigènes à l’état natif (non maturés) solubles, adsorbés ou ancrés à une membrane cellulaire. Bien que la littérature soit encore controversée quant à l’identité des CPAs pouvant être mises en jeu, il semblerait que des macrophages, des DCs et surtout des cellules folliculaires dendritiques puissent être impliqués (6).
Chaque lymphocyte est spécialisé dans la réponse à un antigène ou à un nombre très limité d’antigènes proches. Cette spécificité, qui existe avant même la rencontre avec l’antigène, est due à la présence à la surface du lymphocyte d’un récepteur spécifique à l’antigène, le TCR (T Cell Receptor) sur les lymphocytes T et le BCR (B Cell Receptor) sur les lymphocytes B. Ces récepteurs bipolaires sont composés d’une partie constante, commune à tous les lymphocytes d’un type donné, et d’une partie variable qui entre en contact avec l’antigène et qui est propre à chaque lymphocyte. La capacité de l’organisme à répondre à l’ensemble des antigènes auxquels il est confronté repose sur l’existence d’un répertoire très étendu de récepteurs lymphocytaires, portant chacun une spécificité donnée, issue de la recombinaison aléatoire des segments d’ADN génomique codants pour leurs parties variables.
Les lymphocytes ayant reconnu l’antigène passent d’un état naïf à un état activé et s’équipent des fonctions effectrices nécessaires à l’élimination du pathogène.
2- Le Récepteur à l’Antigène des Lymphocytes T
La reconnaissance spécifique de l’antigène par des lymphocytes T se fait via son TCR, récepteur à développement extracellulaire, constitué de deux chaînes, α et β, associées à deux complexes multicaténaires, les CD3 (composés de deux chaînes ε, deux ζ, une δ et une γ)
essentiellement intracellulaires. Ces chaînes contiennent, dans leur région cytoplasmique, un ou plusieurs motifs de 14 à 16 acides aminés appelés Immunoreceptor Tyrosine-based Activation Motif (ITAM) (Illustration 2). Ces régions (une sur chaque chaîne ε, δ et γ, et trois pour chaque chaîne ζ) sont responsables de la transduction du signal dans les lymphocytes T en induisant, après l’engagement du TCR, une cascade de phosphorylations aboutissant à l’activation de la cellule.
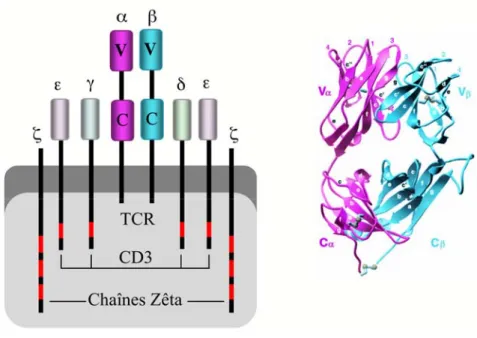
Illustration 2 : Représentation schématique et structure tridimensionnelle du TCR
D’après Garcia et al., Science, 1996 (7).
Le complexe TCR est composé de deux chaînes ζ, de deux complexes CD3 multicaténaires (chaînes ε/δ
et ε/γ) et d’une molécule principale, constituée d’une chaîne α (rose) et d’une chaîne β (bleue),
elles-mêmes divisées en un domaine constant C et un domaine variable V. Les segments rouges sur les queues
cytoplasmiques des chaînes CD3 et ζ représentent les séquences ITAMs.
3- Le Récepteur à l’Antigène des Lymphocytes B
La reconnaissance spécifique de l’antigène par les lymphocytes B a lieu par l’intermédiaire des BCRs, c’est-à-dire d’immunoglobulines (Igs) dans leur forme membranaire (IgM). Ce sont aussi des molécules bipolaires composées de quatre chaînes polypeptidiques, comprenant deux chaînes légères identiques et de deux chaînes lourdes identiques (Illustration 3). Chacune de ces chaînes est composée d’une région variable, déterminant la spécificité du récepteur pour l’antigène, et d’une région constante, déterminant
les propriétés fonctionnelles de l’immunoglobuline. Le BCR reconnaît l’antigène dans son état natif, c’est-à-dire non dégradé par une CPA, sous forme soluble ou lié à une membrane. Chaque BCR fonctionnel, qui est une protéine ne possédant pas de queue cytoplasmique donc pas de fonction intrinsèque de signalisation, est associé à un hétérodimère de protéines de la superfamille des immunoglobulines : Igα et Igβ. Ces protéines sont, elles aussi, transmembranaires et portent, dans leur queue cytoplasmique, les motifs ITAMs responsables de la signalisation par le BCR. L’interaction BCR/Antigène provoque l’internalisation du BCR et la mise en place d’une cascade de phosporylations conduisant à l’activation du lymphocyte B.
Illustration 3 : Représentation schématique et structure tridimensionnelle du BCR
D’après Abbas et al., Cellular and molecular immunology, 2003.
Le BCR est composé de deux chaînes Igα, de deux chaînes Igβ et d’une IgM, elle-même constituée de deux chaînes lourdes (jaune et bleue) et de deux chaînes légères (bordeaux). Les chaînes lourdes et légères de l’Ig sont chacune constituées d’un domaine variable V et de trois ou quatre domaines constants C. Les segments rouges sur les queues cytoplasmiques des chaînes Igα et β représentent les séquences ITAMs.
II- Contacts Cellulaires dans la Réponse Adaptative
1- La Réponse Ta- La Synapse Immunologique des Lymphocytes T
Dans les organes lymphoïdes secondaires, les lymphocytes T scannent la surface des CPAs afin d’y analyser les peptides présentés. Lorsqu’ils reconnaissent le complexe peptide/CMH (pCMH) dont ils sont spécifiques, l’interaction se stabilise et il se forme alors une zone étroite de contact et d’échange entre les deux cellules, qui réorganisent leur membrane plasmique et leur cytosquelette sous-jacent (Illustration 4). Cette interaction a été comparée pour la première fois à une synapse neurologique par Norcross, qui a alors proposé le terme de « synapse immunologique » (8). Bien qu’évoqué dès 1984, ce concept n’a été largement étudié et relié à l’activation lymphocytaire que depuis la fin des années 90 (9-11).
Illustration 4 : Morphologie de la synapse immunologique
D’après les travaux de O. Schwartz, Institut Pasteur, Paris.
Images de microscopie électronique à balayage d’une synapse immunologique entre un lymphocyte (jaune) et une cellule dendritique (bleue à gauche, verte à droite).
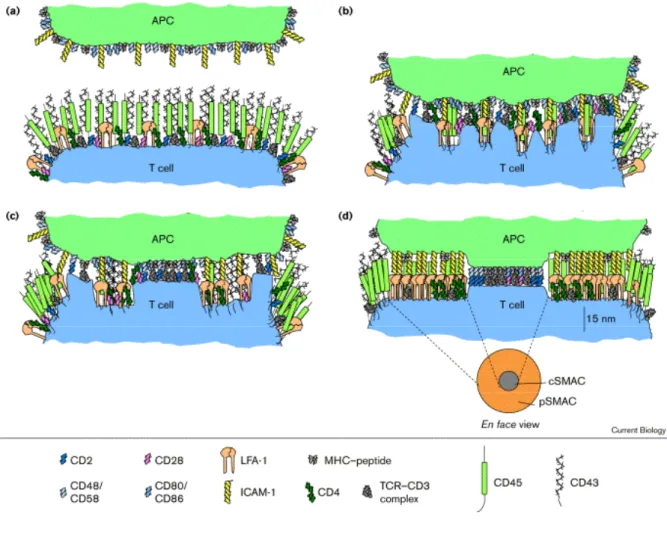
La synapse immunologique stable, telle qu’elle est la plus souvent décrite, est une structure issue de la ré-organisation des micro-domaines membranaires et du cytosquelette du lymphocyte T et de la CPA (Illustration 5) (12). Les complexes TCR/pCMH ainsi que les molécules de co-stimulation (CD80-CD86/CD28, CD80-CD86/CTLA-4,…) s’accumulent au
centre de la synapse, dans une zone appelée c-SMAC (Center of SupraMolecular Activation Cluster), qui est bordée d’un anneau de molécules d’adhérence (LFA-1/ICAM-1, CD2/CD48-CD59), le pSMAC (Peripheral SupraMolecular Activation Cluster). Cette structure exclut des molécules à fort encombrement stérique telles que CD43 ou CD45 de la zone de contact avec les CPAs (13-15).
Illustration 5 : Représentation des différentes phases de mise en place d’une synapse immunologique
D’après Delon & Germain, Current Biology, 2000 (9).
Représentation de la distribution des protéines membranaires aux quatre stades de la formation de la synapse immunologique. (a) Stade de pré-contact : la distribution protéique est homogène. (b) Engagement du TCR : apparition de clusters de protéines. (c) Active réorganisation du cytosquelette : mise en place du pSMAC. (d) Synapse mature : le pSMAC et le cSMAC sont bien définis après 30minutes de contact lymphocyte T / CPA.
Cependant, la synapse immunologique, telle qu’elle est schématisée dans l’Illustration 5, avec une structure concentrique en « œil-de-bœuf », est rarement observée en conditions physiologiques. En effet, dans les travaux utilisant des DCs comme CPAs et des concentrations normales de peptide, les synapses présentent des structures multifocales, c’est-à-dire plusieurs zones d’appositions qui correspondraient à plusieurs îlots de signalisation indépendants (« microsynapses ») (Illustration 6) (16).
Illustration 6 : Synapse immunologique multifocale
D’après Bismuth & Trautmann, Médecine Sciences, 2006 (17). Cliché de Graça Raposo.
Image en microscopie électronique d’une synapse immunologique formée entre un lymphocyte T naïf murin et une DC splénique autologue, en présence de l’antigène. Chaque zone d’apposition serrée pourrait agir comme une « microsynapse », très éloignée du modèle de synapse concentrique en « bull eye » observé avec des CPAs non conventionnelles.
Il est important de noter que les DCs ont aussi la capacité de former des synapses immunologiques avec des lymphocytes T naïfs polyclonaux en absence d’antigène exogène, et même en absence d’expression de molécules du CMH (18). Le contact DC/cellule T induit aussi la réorganisation du cytosquelette des deux types cellulaires, une polarisation des molécules CD3 et CD8 ou CD4 du lymphocyte à la synapse, ainsi qu’une signalisation lymphocytaire calcium-dépendante. Cette interaction antigène-indépendante, qui pourrait être qualifiée de synapse immature, est essentielle au maintien de la survie du répertoire de lymphocytes T naïfs in vitro, et probablement aussi in vivo.
La mise en place d’une synapse immunologique s'accompagne d'une polarisation de l'appareil sécrétoire du lymphocyte T vers la CPA qui facilite la transmission efficace du signal d’activation aux lymphocytes T (19). La stabilité de la synapse, d’immature à mature, dure de quelques minutes à plusieurs heures. Finalement, le déclenchement de la mitose et l’augmentation de l’expression de CTLA-4, provoquée par l’activation cellulaire, contribuent à la destructuration de la synapse et l’arrêt du signal d’activation (10, 11, 20-23) .
b- L’Activation du Lymphocyte T
L’activation du lymphocyte T est un terme général qui regroupe les événements de signalisation menant à la survie de la cellule, à sa prolifération, au réarrangement de son cytosquelette, à l’augmentation de son métabolisme et à la variation de son profil d’expression génique. Elle nécessite l’enregistrement de deux signaux distincts et synergiques : l’engagement du TCR et l’engagement des molécules de co-stimulation.
L’engagement du TCR entraîne, en premier lieu, sa translocation dans des micro-domaines membranaires riches en cholestérol et sphingolipides et sensibles au tritonX-100, appelés DRMs (detergent-resistant membranes), ce qui déclenche la phosphorylation des motifs ITAMs présents sur les chaînes CD3 et ζ (24-26). Cette phosphorylation provoque le recrutement d’un ensemble d’enzymes (kinases, GTPases, phosphatases) et de molécules adaptatrices dans les DRMs qui forme un signalosome au niveau des domaines intra-cytoplasmiques du TCR (Illustration 7) (27, 28).
Les premières enzymes recrutées sont les Src-kinases Fyn et Lck qui entraînent la translocation des co-récepteurs CD4 ou CD8 au voisinage du TCR. Fyn et Lck sont ensuite activées par CD45, une phosphatase membranaire, et phosphorylent les motifs ITAMS du complexe TCR. Ceci provoque le recrutement de la protéine ZAP-70 (Zeta-cahin-Associated Protein Kinase of 70 Kda), qui phosphoryle à son tour la protéine adaptatrice LAT (Linker for Activation of T cells). LAT est associée aux micro-domaines membranaires et devient une plateforme pour les protéines de signalisation PLCγ (Phospholipase C γ) et Pi3K (Phospho-inositol-3 Kinase).
La PLCγ activée hydrolyse le Pi4,5P (Phospho-inositol-4,5 Phosphate) membranaire en deux messagers seconds, l’IP3 (Inositol 1,4,5 triPhosphate) et le DAG (DiAcylGlycérol), qui provoquent une cascade de phosphorylations et entraînent la libération de deux facteurs de transcription NF-AT et NF-κB. Ces deux facteurs, alors transloqués dans le noyau, déclenchent l’expression de différents gènes impliqués dans l’activation du lymphocyte (synthèse d’IL-2,…). La Pi3K phosphoryle le phosphatidylinositol membranaire générant du PIP2 (phosphatidyl-inositol-diphosphate) et du PIP3 (phosphatidyl-inositol-triphosphate) qui participeront au recrutement de AKT à la membrane, protéine impliquée dans les modifications du cytosquelette d’actine.
Illustration 7 : Transduction du signal dans un lymphocyte T
D’après BD Bioscience.
Représentation schématique des premières étapes d’activation d’un lymphocyte T après l’engagement du TCR. Les étoiles rouges représentent les points de phosphorylation.
La cascade de signalisation des lymphocytes T est aujourd’hui bien connue, et il existe de nombreux inhibiteurs de chaque étape. Par exemple, le PP2 est un inhibiteur des Src-kinases, la wortmaninne un inhibiteur de la Pi3K, le nocodazole empêche la polymérisation des microtubules, la cytochalasine D celle du cytosquelette d’actine et la latrunculine B provoque la dépolymérisation des filaments d’actine.
Cellule T Fyn CD45 CD4/CD8 Zap-70 α β ε γ δ ε CPA CMH Classe I/II CD28 Lck LAT PLCγ1
MAPK Remodelage du cytosquelette NF-AT, PKC, Ras Transcription Régulation
ζ ζ
L’engagement du TCR, pour déclencher l’activation d’un lymphocyte T naïf, doit être accompagné de signaux de co-stimulation, c’est-à-dire de l’interaction entre le CD28 exprimé à la surface de la cellule T et les membres de la famille B7, exprimés par les CPAs. Ce deuxième signal potentialise l’interaction entre la CPA et le lymphocyte, et conduit à l’activation de ce dernier. En absence de ces co-interactions, la cellule T est anergisée. Il existe de nombreuses protéines co-stimulatrices et co-inhibitrices : c’est la sommation de ces signaux et le passage d’un seuil qui déclenche ou non le deuxième signal (29).
L’activation de la cellule T naïve induit l’expression à sa surface de nombreuses molécules impliquées dans le maintien et la régulation du signal de co-stimulation conduisant à l’expansion clonale et à la différenciation du lymphocyte. On peut citer l’exemple de l’expression de la molécule CD40-Ligand (CD40L) qui se lie au CD40, exprimé par la CPA, et provoque simultanément l’activation du lymphocyte et de la CPA.
c- Induction de la Réponse T CD4+
Après avoir reçu le signal d’engagement du TCR, le signal de co-stimulation, et le signal CD40/CD40L, le lymphocyte naïf se différencie en lymphocyte effecteur, Th1 ou Th2 (T helper), capable de produire des cytokines et de réguler la réponse immune (Illustration 8).
Illustration 8 : Interactions nécessaires à l’activation d’un lymphocyte T CD4+ naïf D’après W. Paul, Fundamental Immunology, 2003.
Représentation schématique des interactions entrant en jeu lors de l’activation d’un lymphocyte T CD4+
La décision de la différenciation en Th1 ou Th2 est multifactorielle et dépend du contexte cytokinique, des molécules de co-stimulation exprimées par la CPA et de la concentration de pCMH. Les Th1 et les Th2 se différencient par le type de cytokines qu’ils sécrètent : si la production de Th1 conduit à une immunité de type cellulaire, la production de Th2 engendre plutôt une immunité de type humorale.
d- Induction de la Réponse T CD8+
En fonction de l’environnement lors de leur rencontre avec une CPA activée dans un organe lymphoïde secondaire, les lymphocytes T CD8+ naïfs peuvent avoir différents devenirs.
Lorsque la CPA activée est suffisante à l’activation du lymphocyte T CD8+, on parle de réponse CD8 indépendante des CD4. Il faut que la CPA possède une très forte activité de co-stimulation intrinsèque pour induire la production d’IL-2 par les T CD8+ et provoquer la prolifération et la différenciation de ces derniers.
Toutefois les CPAs ne restent pas toujours suffisamment activées et apportent parfois un signal de co-stimulation insuffisant. En l’absence d’un lymphocyte T CD4+ de même spécificité et activé, la cellule T CD8+ naïve est anergisée.
Par contre, si la CPA reste en contact avec une cellule T CD4+, son état d’activation élevée est maintenu et elle délivre aux cellules T CD8+ un signal de co-stimulation efficace. A la suite de cette interaction, le T CD8+ naïf se différencie en lymphocyte T cytotoxique (CTL), capable de produire des cytokines et exprimant la perforine et les granzymes.
2- La Réponse B ou Réponse Immunitaire Humorale
a- Induction de la Réponse B
L’activation d’un lymphocyte B et sa différenciation en plasmocyte requièrent la rencontre dans un organe lymphoïde secondaire d’une cellule B naïve, de son antigène sous forme membranaire et le plus souvent d’un lymphocyte Th2. La caractéristique des lymphocytes B est leur capacité à internaliser particulièrement efficacement des complexes
BCR/Antigène, à les apprêter en peptides antigéniques et à les présenter à leur surface associés à des molécules de CMH de classe II en vue de la mise en place d’une collaboration T-B (30-32).
Dans de rares cas, par exemple si l’antigène est répété ou particulièrement immunogène (LPS,…), l’interaction d’une cellule B naïve avec son antigène suffit à la différenciation du lymphocyte B en plasmocyte. Le déclenchement du signal d’activation résulte alors de l’interaction entre l’antigène et le BCR assisté par CD19 et CD21. On parle d’antigènes thymo-indépendants.
Cependant, le plus souvent, les antigènes sont thymo-dépendants et la présence d’un lymphocyte Th2 est requise. Dans ce cas, les lymphocytes B, qui ont interagi avec l’antigène par l’intermédiaire de leur BCR, expriment des molécules de CD40 ainsi que de CMH de classe II associées à des peptides antigéniques. Ces complexes pCMH sont reconnus par un lymphocyte T CD4+ et l’interaction entre les CD40L de la cellule T et les CD40 du lymphocyte B constitue le signal de co-stimulation (Illustration 9). Le lymphocyte B se différencie alors en effecteur capable de secréter des immunoglobulines, de subir la commutation isotypique et la maturation d’affinité.
Illustration 9 : Interactions nécessaires à la mise en place de la collaboration T-B
D’après W. Paul, Fundamental Immunology, 2003.
Représentation schématique des interactions entre un lymphocyte B activé et un lymphocyte T CD4+
b- La Synapse Immunologique des Lymphocytes B
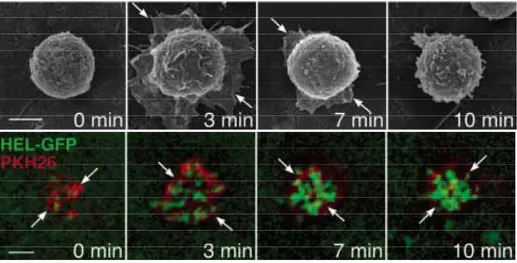
Lors de l’interaction spécifique d’un BCR avec son antigène, le lymphocyte B a une réponse en deux phases : la phase de « déploiement » et la phase de « contraction » (Illustration 10). Pendant la première phase, la cellule B se déploie de façon à interagir avec la plus grande surface possible sur la cellule cible. Les antigènes insérés dans la membrane de la cible se regroupent alors en clusters de 0,5 à 1 µm. Puis a lieu la phase de contraction, où le lymphocyte se rétracte en ramenant tous les clusters d’antigènes à la zone de contact (30).
Illustration 10 : Phénomène de déploiement et de contraction des lymphocytes B
D’après Fleire et al., Science, 2006 (30).
Images en microscopie électronique (SEM) en haut et microscopie de fluorescence en bas, la barre
d’échelle correspond à 2µm.
Des lymphocytes B MD4, marqués au PKH26, sont co-cultivés avec des cellules cibles Cos-7 exprimant l’antigène membranaire Hen Egg Lysosyme (HEL) étiqueté à la GFP. Les flèches blanches indiquent les limites de la membrane du lymphocyte B.
Cette étape, dépendante de l’interaction avec l’antigène, est concomitante avec la formation de la synapse immunologique, qui est très similaire à la synapse décrite pour les cellules T (33). La structure est caractérisée par une accumulation centrale de complexes BCR/Antigène au niveau de la membrane et de PLCγ2 au niveau cytoplasmique : c’est le cSMAC. Il est entouré du pSMAC, un anneau de molécules d’adhésion (LFA-1/ICAM-1), de CD22 et de GM1 (gangliosides associées aux Src-kinases), alors que CD45 et SHP1 sont exclus de la zone de contact. L’efficacité des phases de déploiement et de contraction, inhibées par un traitement au PP2, latrunculine A ou cytochalasine D, joue un rôle dans la
quantité d’antigènes accumulés, capturés et présentés aux cellules T, et détermine donc le niveau d’activation de la cellule B.
c- L’Activation des Lymphocytes B
La liaison de l’antigène au BCR provoque sa translocation dans des DRMs, indépendamment de toute signalisation (34), ce qui déclenche deux événements majeurs de l’activation du lymphocyte. D’une part des Src-kinases (Fyn, Lck, Blk,…) sont recrutées pour phosphoryler les ITAMs des sous-unités Igα et Igβ, qui recrutent à leur tour des adaptateurs et des enzymes à domaines SH2, dont la kinase Syk. Ces événements permettent d’amorcer une cascade de phosphorylations conduisant à la translocation dans le noyau de facteurs de transcription impliqués dans la survie, le développement et les fonctions du lymphocyte B. D’autre part, les complexes BCR/Antigène sont internalisés dans des puits à clathrine (35) (mais ceci reste controversé (36)), dirigés vers la voie endocytique où les peptides sont protéolysés par les enzymes lysosomales afin d’être présentés associés aux molécules de CMH de classe II en surface du lymphocyte. De façon intéressante, il a été montré que la signalisation et l’internalisation sont deux événements qui s’excluent mutuellement, et si environ 10% des Igs sont phosphorylées et retenues en surface, le reste des complexes Antigène/BCR est internalisé pour la collaboration T-B (37).
Toutes les étapes de la réponse immunitaire adaptative sont déclenchées par l’établissement d’interactions très spécifiques entre les cellules. Ces contacts peuvent être directs, par l’intermédiaire de la synapse immunologique ou à distance par la sécrétion de cytokines et chimiokines ou la synthèse de vésicules. Il y a quelques années, un autre mode de communication entre les cellules du système immunitaire a été identifié : ce sont les échanges intercellulaires de molécules membranaires.
Partie 2 :
La Trogocytose
I- Historique – Définition
Les premières descriptions de transfert intercellulaire de molécules membranaires remontent aux années 70, lorsque des protéines spécifiques d’un type de cellule immunitaire ont été détectées à la surface d’un autre type cellulaire. Les premiers cas ont été exposés par les groupes de Sprent, Cone et Marchalonis qui ont observé la présence d’immunoglobulines sur des lymphocytes T (38). Ils ont alors démontré, dans un modèle de réaction allogénique, que ces immunoglobulines provenaient de lymphocytes B et que leur spécificité était dirigée contre les molécules du CMH allogénique. Pour expliquer ces résultats, ces auteurs ont proposé que les Igs, générées au cours de la réaction allogénique par des lymphocytes B alloréactifs contaminants injectés à l’hôte en même temps que les cellules T, pouvaient avoir été co-capturées avec le CMH par les lymphocytes T alloréactifs. Parallèlement, les travaux de Sprent, Bona et Lee ont démontré le transfert d’antigènes et du récepteur au fragment constant des Igs (FcR) des macrophages vers les lymphocytes T (39-41). Enfin, c’est au début des années 80 que l’équipe de Singer et Fitch a pu démontrer la capture de molécules du CMH sur les cellules hôtes par les lymphocytes T lors de réactions allogéniques (42-44). Cependant, ces observations n’ont alors pas été plus approfondies, probablement à cause de l’absence d’outils technologiques adaptés.
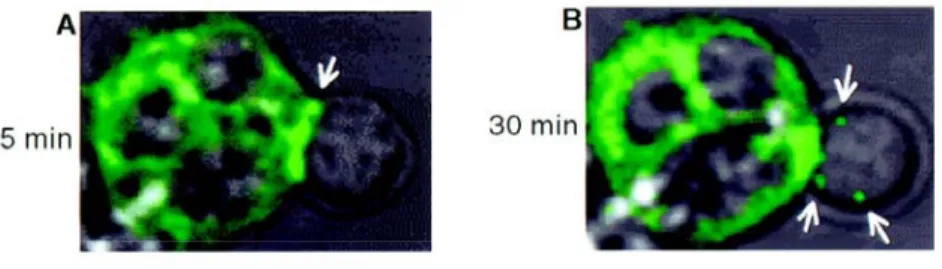
Ainsi, l’étude des transferts intercellulaires a été écartée pendant près de 20 ans et ce n’est qu’à partir de la fin des années 90 que les travaux sur le sujet ont repris. Le groupe de Mannie a alors montré que la capture de complexes pCMH était déclenchée lors de leur reconnaissance par le TCR (44). Une avancée déterminante a alors été réalisée lorsque Huang et ses collaborateurs ont étudié ce mécanisme en utilisant des CPAs exprimant des molécules du CMH étiquetées avec de la GFP (45). Ces auteurs ont pu mettre en évidence que lors de l’interaction TCR/pCMH, les CTLs capturent le complexe pCMH transmembranaire et l’internalisent avec le TCR (Illustration 11). De plus, une partie des complexes pCMH
capturés est retrouvée intacte à la surface des CTLs et peut y jouer des rôles biologiques de sensibilisation de ces cellules à la lyse fratricide par des CTLs de même spécificité.
Illustration 11 : Acquisition de molécules de CMH de classe I par les lymphocytes T CD8+ D’après Huang et al., Science, 1999 (45).
Images de microscopie confocale (Fluo-View, Olympus).
Des lymphocytes T CD8+ transgéniques 2C non marqués sont co-cultivés avec des cellules RMA-S
exprimant des molécules de CMH de classe I Ld fusionnées à la GFP et pré-incubées avec du peptide
QL9. Après 5 minutes de co-culture, les lymphocytes interagissent avec leurs cibles. Après 30 minutes, des patchs de GFP sont détectés à la surface des cellules non marquées, représentant le transfert des molécules de CMH des cibles vers les lymphocytes.
A la suite des travaux de Huang, de nombreuses autres études ont porté sur les mécanismes de capture du CMH, les facteurs déclenchants, l’identité des molécules potentiellement co-transférées sur les lymphocytes T ou sur d’autres populations cellulaires, ainsi que sur les conséquences fonctionnelles de ce processus (pour revues : (46-52)). Ainsi, peu après les travaux de Huang, différentes équipes ont montré que, durant le contact spécifique TCR/pCMH, les lymphocytes T CD8+ capturent différentes molécules initialement présentes en surface des CPAs, comme les complexes pCMH eux-mêmes, mais aussi des molécules de co-stimulation (B7, CD82, ox40-L) ou des molécules d’adhésion (ICAM-1) (53, 54). De même, il a été montré que les lymphocytes T activés peuvent capturer des déterminants membranaires endothéliaux lors de la migration trans-endothéliale (55).
Le phénomène a par ailleurs été étudié sur le plan mécanistique, notamment afin de comprendre comment des molécules transmembranaires pouvaient être transférées des CPAs aux lymphocytes T. Compte tenu de la faible affinité des interactions pCMH/TCR mais de l’interaction stable et dynamique des lymphocytes avec leurs cellules cibles, il a été proposé que la capture de complexes pCMH pouvait être due plutôt à la capture de fragments de membrane qu’à l’extraction des complexes de la membrane cellulaire. Cette hypothèse prévoit ainsi que des composants membranaires présents dans la membrane des cellules cibles devraient être capturés de façon concomitante et avec les mêmes caractéristiques que les
complexes pCMH. Ceci a été démontré en suivant la capture par les CTLs de lipides fluorescents ou de protéines biotinylées présents sur les cellules cibles (56). Ces expériences ont permis de montrer que ce phénomène de transfert moléculaire était un processus actif, rapide et unidirectionnel. Il a été baptisé « trogocytose », en référence au mot de grec ancien trogo qui signifie « grignoter » (57). C’est un processus très efficace et, en 30 minutes, jusqu’à 10% des molécules initialement présentes à la surface de la cible sont capturées par le lymphocyte (56). La trogocytose, aussi appelée stripping (58), snatching (59), shaving (60) ou trapping (61), a maintenant été décrite in vitro et parfois in vivo, pour différents types de cellules immunitaires : lymphocytes T CD4+, T CD8+, B, γδ et NK (62-64), monocytes (60, 65) et DCs (66-68). De plus, des mécanismes similaires pourraient être mis en jeu lors de processus d’interactions cellulaires hors du système immunitaire. Il convient de souligner que de nombreuses questions touchant à l’identité des molécules capturées, leur devenir, la mécanistique fine du processus, la structure des édifices transportés ainsi que leur véhicule, et surtout les conséquences physio-pathologiques de l’acquisition de molécules nouvelles par les lymphocytes restent encore à élucider.
II- La Trogocytose est Réalisée par un Grand Nombre de
Type Cellulaires
La trogocytose, telle qu’elle a été initialement définie c’est-à-dire comme un « processus de transfert moléculaire intercellulaire, rapide, actif et unidirectionnel, déclenché par les récepteurs à l’antigène », a été décrite à partir d’études effectuées sur les lymphocytes T CD8+ (57). Cependant, des variations ont été mises en évidence entre les différents types cellulaires identifiés comme étant capables de réaliser la trogocytose, tant au niveau des facteurs déclenchants et des mécanismes moléculaires que des conséquences physiologiques.
1- La Trogocytose Réalisée par les Lymphocytes T
La capture de membrane et de complexes pCMH par trogocytose réalisée par les lymphocytes T est la mieux décrite dans la littérature. D’abord détectée chez les T CD8+ elle a rapidement été mise en évidence chez les T CD4+ (64). L’étude de la capture de molécules membranaires par les cellules T a été décrite comme un phénomène, rapide, unidirectionnel et
dépendant du TCR (45, 46, 56, 69, 70). Sur la base d’expériences utilisant des inhibiteurs de la signalisation ou d’anticorps (Acs) bloquants, il a été proposé qu’une signalisation était requise pour la réalisation de la trogocytose. En effet, le traitement par un Ac anti-CD8, qui empêche l’engagement de la molécule CD8 (donc la signalisation) sans empêcher la liaison pCMH/TCR, ainsi que le traitement par un inhibiteur des Src-kinases, le PP2, inhibent efficacement la trogocytose (56). De plus, la trogocytose est dépendante du remodelage du cytosquelette, et inhibée par le traitement des lymphocytes T à la latrunculine (71). En outre, l’efficacité de la trogocytose est proportionnelle à l’état d’activation lymphocytaire, les lymphocytes T naïfs étant bien moins efficaces que les lymphocytes T activés (70), et il existe une forte corrélation entre la stimulation du CTL par l’utilisation de ligands mutés et l’efficacité de trogocytose. Enfin, il a aussi été montré que l’efficacité de capture dépend de la concentration de peptide antigénique utilisée pour pulser les cibles, donc de la quantité de complexes pCMH. Ces résultats suggèrent que c’est l’activation du lymphocyte qui provoque la capture de membrane et pas uniquement l’engagement du TCR.
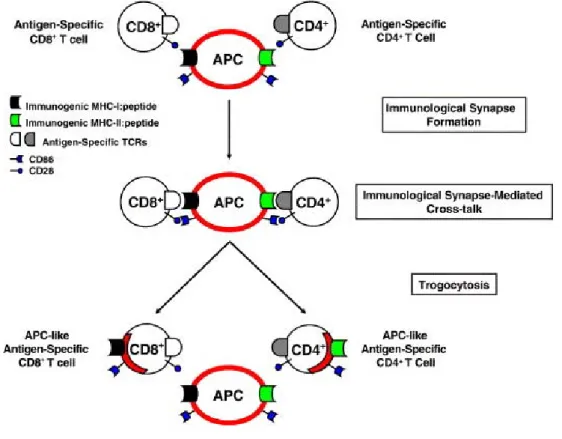
Par trogocytose, les lymphocytes T CD4+ et CD8+ capturent, entre autres, des molécules de CMH, des molécules de co-stimulation et des molécules d’adhésion sur les CPAs. L’expression de ce panel de protéines pourrait conférer de nouvelles propriétés, encore mal définies, aux lymphocytes. Cependant, il semble que selon le contexte environnemental, les lymphocytes T ayant capturé du matériel membranaire par trogocytose contribuent à la régulation de la réponse immune (cf. Illustration 12, Partie 2.III.4 et pour revue :(49)).
Illustration 12 : Capture de membrane par trogocytose par un lymphocyte T sur une CPA
D’après Caumartin et al., Transplant Immunology, 2006 (48).
Représentation schématique d’une interaction spécifique entre une CPA et un lymphocyte T CD8+ ou
CD4+, suivie de la dissociation des conjugués. Le lymphocyte a capturé des fragments de membrane sur
la CPA et les exprime à sa surface.
De plus, il est intéressant de noter que les lymphocytes T activés sont capables de capturer des fragments de membrane sur des CPAs en absence d’antigène, et même en absence de stimulation du TCR (59, 72, 73). Cette trogocytose « antigène-indépendante » a été initialement démontrée par Hwang et al. par l’identification de CD28 comme étant une molécule capable de déclencher la capture de son ligand membranaire CD80 par les T CD4+ et les T CD8+ (70). De même, l’engagement de CD8αα déclenche la capture de son ligand, la molécule TL (Thymic Leukemia) par les lymphocytes T CD8αα (59). De façon plus large, et en utilisant une approche dite de trogocytose redirigée, nous avons montré que différentes molécules présentes à la surface des lymphocytes T étaient capables de déclencher la trogocytose lorsqu’elles étaient stimulées par des anticorps spécifiques : il s’agit non seulement du TCR mais également des co-récepteurs CD4 ou CD8, des molécules de costimulation CD2, CD27 et CD28 et enfin des molécules du CMH de classe I (cf. Annexe 1).
2- La Trogocytose Réalisée par les Lymphocytes B
Après la reconnaissance d’un antigène, le lymphocyte B forme une synapse et acquiert l’antigène afin de l’apprêter et de le présenter à sa surface associé à des molécules de CMH de classe II. Ce phénomène a été mis en évidence il y a près de 30 ans grâce aux études sur la collaboration T-B (31). Il a été montré que des antigènes membranaires ou solubles et adsorbés à la surface de CPAs pouvaient être reconnus par les lymphocytes B et subir un processus de capture, maturation et présentation, suggérant que les lymphocytes B pouvaient également réaliser la trogocytose. Aujourd’hui, il est bien démontré que les lymphocytes B capturent des fragments de membrane, en même temps que l’antigène entier, sur leur cible de façon unidirectionnelle, proportionnellement à la quantité d’antigène sur la cible et à son affinité pour le BCR (32, 74). Contrairement aux lymphocytes T, il n’existait pas, avant ce travail de thèse, de données sur le rôle de la signalisation dans la réalisation de la trogocytose par les lymphocytes B. Néanmoins, certains travaux réalisés précédemment par notre équipe nous avaient indiqué certaines différences entre les lymphocytes T et B. Par exemple, l’état d’activation des lymphocytes B (naïfs ou blastés) n’entraîne pas de changement notable dans l’efficacité de la trogocytose (résultats non montrés) ; ou encore la trogocytose redirigée déclenchée chez les lymphocytes B n’est pas inhibée par un traitement à la latrunculine B, contrairement à la trogocytose T (cf. Annexe 1). Il est intéressant de noter qu’en utilisant la trogocytose redirigée, nous avons pu montrer que, en plus du BCR, les molécules du CMH de classe I et II pouvaient déclencher la trogocytose. La capture d’antigènes membranaires par les lymphocytes B et leur présentation aux lymphocytes T est certainement, à ce jour, le rôle le plus évident joué par la trogocytose dans le système immunitaire.
3- La Trogocytose Réalisée par les Cellules NK
La trogocytose a aussi été particulièrement bien documentée pour les cellules NK. Ces cellules représentent 5 à 16 % de la population totale des lymphocytes et sont les médiateurs de l’immunité anti-tumorale et anti-virale naturelle. Les NKs ont la propriété de lyser, en particulier, les cellules qui n’expriment pas, ou peu, de molécules de CMH de classe I. L’activation des cellules NK est médiée par l’intégration de signaux envoyés par des récepteurs activateurs ou inhibiteurs comme NKG2, Ly49 ou KIR, qui possèdent des séquences ITAMs ou ITIMs (Immunoreceptor Tyrosine-based Inhibition Motif)
cytoplasmiques (pour revue : (75)). Au cours de la formation de la synapse immunologique inhibitrice (impliquant les récepteurs inhibiteurs), la cellule NK capture des molécules de CMH de classe I in vitro et in vivo par trogocytose, de façon ATP-dépendante (Adénosine TriPhosphate-dépendant) (76-78). Plus récemment, un transfert de récepteurs inhibiteurs, ainsi que de matériel membranaire, a été décrit des NKs vers la cible (79). Il faut noter que le traitement par un inhibiteur du cytosquelette inhibe le transfert vers les cibles, mais pas la capture par les NKs, mettant en évidence des mécanismes différents par rapport aux lymphocytes T (79). Les transferts trans-synaptiques de matériel membranaire au cours des synapses cytotoxiques (médiées par les récepteurs activateurs) ont également été décrits et sont contrôlés par l’ATP, le Ca2+, les Src-kinases, la PKC (Protéine Kinase C) et le réarrangement du cytosquelette (80). De plus, l’équipe de Roda-Navarro a mis en évidence le transfert de récepteurs activateurs des NKs vers les cellules cibles (81). La trogocytose est donc bidirectionnelle dans les cellules NK, que ce soit au niveau des synapses inhibitrices ou des synapses cytotoxiques.
4- La Trogocytose Réalisée par les Lymphocytes Non Conventionnels
Les lymphocytes Tγδ expriment à leur surface un TCR constitué d'un hétérodimère γδ associé à CD3. Chez l'homme et chez la souris, les lymphocytes Tγδ circulants sont quantitativement minoritaires par rapport aux lymphocytes Tαβ. Ce sont des cellules cytotoxiques et/ou régulatrices qui interviennent aussi bien dans l'élimination de cellules infectées par un pathogène intracellulaire que dans la défense anti-tumorale. Il a été mis en évidence que les cellules γδ capturent des fragments de membrane sur les cellules tumorales, comme les Daudi ou les THP-1, en particulier en présence de phospho-antigènes stimulateurs (82). La trogocytose réalisée par les lymphocytes Tγδ requiert l’interaction entre le TCR et l’antigène et la mise en place d’une synapse immunologique. De plus elle est dépendante du cytosquelette d’actine ainsi que de la signalisation par les Src-kinases.
Les lymphocytes T intra-épithéliaux (IEL) sont des lymphocytes présents dans les muqueuses, essentiellement intestinales. Ils ont un TCR CD8αα qui interagit avec la molécule de CMH de classe I non classique TL avec la même affinité que les TCR CD8αα et CD8αβ avec les molécules de CMH de classe I classique. Lors de cette interaction, un