D
D
O
O
C
C
T
T
O
O
R
R
A
A
T
T
D
D
Délivré pa Discipline ou spécia M. Michel SAMSON C M. Jean-Sébastien ANNICOTTEM. Thierry NOEL Pro M. Jean-François ARNAL P
M. Laurent ALRIC Pro Bernard PIPY Directeu Mme Marie-Denise LINAS
Ecole doctor Unité Directeur(s Rapporteu Présentée
Titre : Rôle central des Mon implication de la Dectine-1, R
T
T
H
H
È
È
S
S
E
E
En vue de l'obtention duD
D
E
E
L
L
’
’
U
U
N
N
I
I
V
V
E
E
R
R
S
S
I
I
T
T
É
É
D
D
E
E
T
T
O
O
U
U
é par l'Université Toulouse III - Paul Sabatier pécialité : IMMUNOLOGIE ET MALADIES INFECJURY
Chargé de Recherche INSERM, Rennes - RAP TTE Chargé de Recherche INSERM, Montpellie Professeur des Universités, Bordeaux - EXAMI AL Professeur des Universités, Toulouse - EXAM
Professeur de Médecine, Toulouse - EXAMINA teur de Recherche INSERM, Toulouse - EXAMI AS Maitre de Conférences, Toulouse - MEMBR
ctorale : BIOLOGIE-SANTE-BIOTECHNOLOGIE nité de recherche : UMR-MD3 EA2405 ur(s) de Thèse : Mme M.D. LINAS, M. B. PIPY
eurs : M. M.SAMSON, M. J-S. ANNICOTTE
ntée et soutenue par Amandine GALES
Le 9 Octobre 2009
Monocytes/Macrophages dans la défense a e la polarisation M2 et des marqueurs asso 1, Récepteur Mannose et Interleukine-10
U
U
L
L
O
O
U
U
S
S
E
E
FECTIEUSES RAPPORTEUR ellier - RAPPORTEUR AMINATEUR XAMINATEUR INATEURM. AMINATEUR BRE INVITE GIES IPY se anti-infectieuse; ssociés 10Ce travail de thèse a été réalisé au sein du Laboratoire UMR MD3-EA2405
Polarisation des Macrophages, Récepteurs Nucléaires, dans les Pathologies Inflammatoires et Infectieuses
dirigé par le Docteur Bernard Pipy.
Je tiens à adresser ma profonde reconnaissance à
Monsieur le Docteur Michel Samson
qui a accepté de juger cette thèse en qualité de rapporteur. Je le remercie pour l’intérêt qu’il a porté à ce travail et lui suis reconnaissante d’avoir pu bénéficier de ses conseils qui ont contribué à l’amélioration de ce manuscrit. Je suis particulièrement honorée de sa présence dans ce jury de soutenance. Je lui exprime ici ma plus haute considération.
Monsieur le Docteur Jean-Sébastien Annicotte
pour avoir accepté d’être rapporteur de cette thèse. Je le remercie pour l’intérêt et la considération qu’il a porté à ces travaux. Je lui adresse mes sincères remerciements ainsi que ma profonde gratitude.
Monsieur le Professeur Thierry Noel
qui me fait l’honneur de siéger à ce jury de soutenance de thèse. Qu’il soit assuré de ma sincère reconnaissance et de tous mes remerciements.
Monsieur le Professeur Jean-François Arnal
pour l’honneur qu’il me fait en acceptant d'examiner ce travail et de siéger parmi les membres de ce jury de thèse. Je tiens à l’assurer de mon profond respect et de mes sincères remerciements.
Monsieur le Professeur Laurent Alric
pour l’intérêt qu’il a porté à ce travail de thèse. Je lui suis particulièrement reconnaissante pour sa confiance ainsi que ses précieux conseils ayant contribué à l’amélioration de ce manuscrit. Qu’il soit assuré de ma profonde reconnaissance.
Madame le Docteur Marie-Denise Linas
qui a codirigé cette thèse en y apportant conseils et soutien. Je lui suis reconnaissante pour la confiance qu’elle m’a témoignée et l’expérience dont elle m’a fait bénéficier. Je lui adresse mes sincères remerciements ainsi que mon plus profond respect.
Monsieur le Docteur Bernard Pipy
pour avoir dirigé ce travail de thèse. Je le remercie particulièrement pour la confiance qu’il m’a accordée durant ces quatre années. Entre autres qualités, peu de personnes « racontent » comme lui la science. Je me souviendrai de l’énergie et de la motivation communicative qui se dégagent de ce laboratoire. Cette énergie a définitivement marqué ma thèse tout comme le plaisir et l’honneur d’avoir travaillé au sein de cette équipe, la « PiPyAR Team ». Qu’il trouve ici le témoignage de ma profonde reconnaissance.
« Le voyage n’est jamais celui qu’on attend. (…) Nos chemins nous mènent toujours ailleurs. Certains s’agaceront de cette indocilité. Les autres savent, (…) que c’est un autre nom pour le sel de vivre. »
Aujourd’hui il me reste une belle expérience et des amitiés nouées à ma besace, ça valait donc vraiment la peine.
Je souhaite remercier….
…ceux qui ont initié ma marche dans ce laboratoire …
Patricia Balard pour son passage de flambeau. Merci pour la qualité de ton travail qui reste pour moi une référence. Sois assurée de mon amitié. Je garde en mémoire toutes nos expériences partagées professionnelles et personnelles.
Céline Lagane-Gouzou qui est épanouie dans sa nouvelle orientation professionnelle. Merci pour les années partagées au labo, elles ne s’effacent pas.
Hélène Authier, avec qui j’ai entamé mon parcours au laboratoire et
Agnès Coste avec qui je clôture cette étape qu’est mon doctorat. Je salue leur complicité toujours présente au fil des années. Je les remercie pour leur rôle dans ces passages déterminants.
Valérie Bans pour sa disponibilité, son travail et sa franchise. Je te remercie pour ton soutien et ton amitié.
Gérald Chêne pour sa personnalité généreuse. Merci pour les discussions scientifiques enrichissantes que nous avons partagées, je te souhaite une bonne route. Merci pour ton soutien et tes conseils. Jean-Frédéric Boyer, avec qui j’ai traversé l’année particulière de DEA. Je te remercie pour ton amitié et ton intégrité.
…ceux qui ont partagé un « bon » bout de mon chemin de thèse et qui aujourd’hui croise souvent ma route avec amitié…
Annabelle Conduché qui sait sortir des sentiers battus. Merci pour ta colère salutaire. Je te suis extrêmement reconnaissante pour ta disponibilité… Et bien sûr pour tout le travail et l’enthousiasme partagés. Merci aujourd’hui pour notre amitié.
Laurence Perez pour son envie de rentrer dans le monde de la recherche. Merci pour ton expérience médicale et ta grande pédagogie.
Guillaume Martin-Blondel pour le travail abattu avec l’envie de faire avancer la recherche. Merci pour ta confiance.
…ceux qui ont croisé ma route et l’ont toujours agrémenté …
…de conseils, d’expériences, de sollicitude et d’encouragements. Un grand merci à José Bernad, Jean-Claude Lepert, Georges Carrera et Maryse Béraud. Merci pour votre générosité au quotidien, malgré de petites anicroches soyez certains de ma reconnaissance. Merci également à Pierre Frisch, pour son attention. Merci à Claudine Orfila et Bruno Faucon pour leur sympathie.
…de sourires, de générosité, de conseils et de beaucoup de soutien. Mille merci à Gisèle Llanes et Nadège Carrie. Merci également à Nadège Greif, Ismahane Touil et Saliha Mimar avec qui j’ai toujours partagé de bons moments.
…de coups de main, de chaleur et de compétences au sein d’Ambiotis.
Merci à Marc Dubourdeau pour m’avoir ouvert les portes de 2i-Pharma, merci pour ta générosité humaine, ton expérience et ta pertinence scientifique.
Merci à CharlotteGuignépour ton cœur gros comme ça. Merci pour ton expérience et les manips partagées avec entrain. Sois assurée de mon amitié. Un grand merci pour ta disponibilité et ton écoute.
Merci àVincentBaillifqui m’a accueilli dans son cercle et dans son monde de chimie avec douceur et générosité.
Merci à nouveau à Gérald qui a émigré vers Ambiotis en faisant suivre son amitié.
…d’expériences, de partage des tâches et de sourires.
Merci àAntoine Berrypour sa motivation, son expérience, sa confiance et sa sympathie. Des travaux restent en suspend, j’espère qu’ils se poursuivront ! Merci également à Françoise Benoit-Vical, Xavier Iriart et Patrice Njamnang Soh pour votre soutien et votre attention.
Madame Marie-Hélène Bessières et Sophie Cassaingpour leur accueil et leur expérience. Merci à Jean-Claude Rives, Sandrine Chalmeton pour leurs conseils techniques ainsi qu’aux équipes de Mycologie et de Biologie Moléculaire du service de Parasitologie.
Un grand mercià Philippe Batignepour les tâches longues et difficiles partagées avec le sourire.
…ceux qui arrivent sur ce chemin avec leurs motivations et leurs challenges …
Merci à David Olagnier pour son dynamisme, sa confiance et son envie d’avancer dans cet univers de la recherche. Merci pour ne pas oublier que les plus grandes richesses sont humaines, merci pour ton amitié et ces moments importants de ta vie que tu m’as permis de partager. Merci pour ta générosité. Que ta route soit belle jeune Jedi.
Merci à Bertrand Calippe pour ton précieux réconfort et tes conseils de jeune docteur. Merci pour ta compréhension. Je te souhaite beaucoup de réussite dans tes nouveaux challenges dans ce laboratoire.
Merci à Lise Lefevre, nous avons partagé une belle année de travail, bonne continuation sur ce chemin riche et sinueux !
Je remercie également Monsieur le Professeur Jean-François Magnavalpour son accueil dans le service de Parasitologie-Mycologie. Son talent de transmission et son engagement ont définitivement marqué mon passage dans ce service.
Je remercie chaleureusement Monsieur le Professeur Alexis Valentin pour m’avoir accueilli dans son équipe de recherche et d’enseignement de la Faculté de Pharmacie durant mon année en tant qu’ATER. Cette expérience a été pour moi très enrichissante. Je le remercie pour sa confiance dans mon travail scientifique et pédagogique. Merci à toute l’équipe pour leur accueil.
Je tiens également à remercier et assurer ma reconnaissance à Monsieur le Professeur Pierre-Emmanuel Gleizes qui m’a accueillie au sein de l’équipe pédagogique de Biologie Cellulaire de l’université Paul Sabatier en tant qu’ATER. Un grand merci pour cette année riche en enseignements. Je remercie à travers lui toute l’équipe formidable et dynamique dans son devoir de transmettre le goût de la connaissance.
Un grand Merci à Monsieur le Professeur Claude Caratero et à Madame le Professeur Monique Courtade-Saïdi qui m’ont ouvert les portes du laboratoire d’Histologie-Embryologie au cours de mes 3 premières années de thèse. J’y ai trouvé de nombreuses connaissances et le goût d’enseigner. Je les remercie chaleureusement de la confiance qu’ils m’ont renouvelée au fil des années, qu’ils trouvent ici le témoignage de ma profonde reconnaissance.
…et merci à tous les étudiants stagiaires avec qui j’ai eu le plaisir de faire un bout de chemin. Je les remercie tous pour leur enthousiasme et leur travail.
Enfin je souhaite remercier tous les miens, qui ont implanté en moi cette force qui surgit du bonheur cultivé. Il est finalement plus facile d’écrire sur les macrophages que de témoigner en quelques lignes de toute l’attention, l’affection et l’amour pour mes proches. Je les remercie pour leur présence, leur confiance et toutes ces choses que ces mots ne disent pas.
Je souhaite remercier particulièrement,
Mon père et à ma mère qui me soutiennent toujours et m’entourent. Vous êtes mes racines et ma destination de prédilection, où l’on sait que l’air est doux. Vous m’avez transmis la persévérance, la volonté et le goût de la vie. Vous me transmettez encore toutes les valeurs qui donnent de la richesse à l’existence. Merci.
Frédéric, mon sel, formidable exhausteur des arômes de la vie! Merci pour notre promenade, nous avançons ensemble au fil des années. Merci de veiller à l’équilibre délicat entre le soutien et le respect de l’indépendance, je sais les exigences que cela demande. Merci pour ta confiance en moi et en l’avenir. Merci.
Ainsi je dédie cette thèse à…
…à mes grand-pères et à mon père, des hommes de caractère, de convictions, des hommes généreux et grandir dans leur sillage ne peut que sculpter la personnalité et apprendre l’humilité.
…à mes grand-mères et à ma mère, des femmes de caractère (aussi !) et de douceur, indépendantes et battantes, des femmes qui ont toujours su nous donner sans nous retenir.
…à mes oncles et mes tantes, qui donnent un sens pour moi à la famille, je les sais là et généreux de leur affection et de leur temps. Merci pour votre soutien constant. Merci.
…à Cécile, Emilie, Simon, Nicolas, Sandra, Olivier, Damien et Isabelle… nos liens me rassurent pour avancer dans la vie, nos chemins sont toujours liés, merci à vous pour votre affection inconditionnelle, tous les bons moments et les souvenirs heureux passés et à venir.
…à Monique, Denis, Sandrine, Natacha, Jean-Pierre, Luc et Fabrice, pour vos bras grands ouverts, votre compréhension. Ma famille s’est ainsi agrandie avec vous, je suis consciente de ma chance, je vous remercie pour votre soutien sans faille.
…aux nouveaux venus à qui je souhaite tous les bonheurs du monde, Samuel, Matthias, Basile & Gaétan…
…à Frédéric, que l’on garde notre petite bulle...
…et enfin à mes doigts de la main, mes amis de toujours (me semble-t-il !!!), il est des personnes que les distances, les sinuosités de la vie n’éloignent pas et que la complicité rend précieuses. Erika, Emilie, Gilles, Rudy & Pascal, je vous embrasse.
Je vous remercie à tous pour votre patience et votre compréhension lorsque le temps pour vous m’a manqué durant cette thèse, je pense que vous savez que vous pouvez compter sur moi.
Tendrement, Amandine
1
Table des illustrations ... 4
Table des abbréviations ... 5
INTRODUCTION GENERALE ... 7
PARTIE 1 : REVUE BIBLIOGRAPHIQUE ... 11
1 Monocytes et Macrophages, une population hétérogène ... 12
1.1 Les monocytes/macrophages ... 12
1.1.1 Monocytes et Macrophages, cellules du système des phagocytes mononucléés ... 12
1.1.1.1 Définition & caractéristiques ... 12
1.1.1.2 Hétérogénéité des monocytes humains ... 13
1.1.1.3 Hétérogénéité des monocytes de souris ... 14
1.1.1.4 Des monocytes aux macrophages ... 15
1.1.2 Récepteurs membranaires et propriétés fonctionnelles des monocytes - macrophages... 17
1.1.2.1 Les pattern-recognition receptors ... 17
1.1.2.1.1 La collaboration entre les récepteurs ... 18
1.1.2.1.2 Les récepteurs « Toll-Like » ou TLRs ... 18
1.1.2.1.3 Les récepteurs lectine de type-C ou RLC ... 19
1.1.2.1.4 Les récepteurs éboueurs ou « scavenger ». ... 20
1.1.2.2 La phagocytose ... 20
1.1.2.3 Les intermédiaires réactifs de l’oxygène et de l’azote ... 22
1.1.2.3.1 Les intermédiaires réactifs de l’oxygène ... 22
1.1.2.3.2 Les intermédiaires réactifs de l’azote ... 22
1.1.2.4 Les eicosanoïdes ... 23
1.1.2.4.1 Les prostaglandines ... 24
1.1.2.4.2 Les leucotriènes ... 25
1.1.2.4.3 Les lipoxines, résolvines et les protectines ... 26
1.1.2.5 Chemokines et cytokines ... 27
1.1.2.5.1 Les chemokines ... 27
1.1.2.5.2 Les cytokines ... 28
1.1.3 Polarisation des monocytes/macrophages ... 29
1.1.3.1 Nomenclature des phagocytes mononucléés ... 29
1.1.3.2 Les macrophages M1 ... 30
1.1.3.3 Les macrophages M2 ... 33
1.1.3.3.1 Les macrophages M2 « producteurs d’IL-10 » ... 34
1.1.3.3.2 L’activation alternative des macrophages par l’IL-4 et l’IL-13 ... 35
1.1.3.3.3 Interaction entre les voies de l’IL-4 et l’IL-13 et les récepteurs nucléaires ... 37
1.2 Rôle des récepteurs nucléaires PPARs ... 38
2
1.2.1.1.1 Structure des PPARs ... 38
1.2.1.1.2 Hétérodimérisation avec RXR et reconnaissance de séquences cibles ... 39
1.2.1.1.3 Les ligands des PPARs ... 40
1.2.1.2 Mécanismes de régulation des gènes ... 40
1.2.1.2.1 Mécanismes de transcription des gènes ... 40
1.2.1.2.2 Mécanismes de répression des gènes ... 41
1.2.2 Biologie des PPARs ... 43
1.2.2.1 Biologie de PPARγ : ligands et cibles ... 43
1.2.2.2 Biologie de PPARα : ligands et cibles ... 44
1.2.2.3 Biologie de PPARβ/δ : ligands et cibles ... 44
1.2.3 Les PPARs dans l’inflammation et les maladies métaboliques : focus sur les monocytes/macrophages ... 45
2 Monocytes et Macrophages dans la réponse à l’infection ... 49
2.1 Monocytes/Macrophages & VHC ... 50
2.1.1 Le virus de l’hépatite C ... 50
2.1.1.1 Evolution de la pathologie ... 50
2.1.1.2 Description du virus ... 50
2.1.1.3 Le cycle de réplication ... 51
2.1.1.4 Les modèles d’étude ... 52
2.1.1.5 Les voies d’entrée du virus ... 52
2.1.1.6 La phase aigue de l’infection ... 53
2.1.1.7 Traitement actuel et perspectives thérapeutiques ... 54
2.1.2 Modulation des monocytes/macrophages lors de l’infection primaire au VHC. ... 55
2.1.2.1 Monocytes/macrophages dans la pathogénicité du VHC ... 55
2.1.2.2 Les PRRs, cibles préférentielles dans la stratégie d’échappement du VHC. ... 57
2.1.2.2.1 Le VHC cible les voies de signalisation du TLR3, de RIG-1 et de l’IFN ainsi que l'expression et la fonctionnalité des produits ISG. ... 57
2.1.2.2.2 La protéine Core cible les macrophages et module leur production de cytokines. ... 58
2.1.2.3 Les conséquences de l’inflammation due aux macrophages : fibrose, cirrhose et cancer .... 60
2.1.2.4 L’IL-10 : cytokine déterminante dans l’évolution de l’infection virale ... 61
2.1.2.5 Les facteurs dus à l’hôte dans l’immunopathogénicité de l’infection primaire au VHC. ... 62
2.1.3 PPARs et VHC ... 62
2.2 Monocytes/Macrophages & Candida albicans ... 64
2.2.1 Candida albicans ... 64
2.2.1.1 Multiplication et morphologies de C.albicans ... 64
2.2.1.2 La paroi de C. albicans ... 65
2.2.1.3 Ecologie et épidémiologie de C. albicans ... 66
2.2.1.3.1 Candidoses superficielles ... 67
2.2.1.3.2 Candidoses systémiques ... 67
3
2.2.1.4.2 L’adhérence aux surfaces ... 68
2.2.1.4.3 La sécrétion d’enzymes hydrolytiques ... 68
2.2.1.4.4 La modulation de la réponse immune ... 68
2.2.2 Facteurs prédisposant aux candidoses orales et du tractus gastro-intestinal ... 69
2.2.2.1 L’immunosuppression ... 69
2.2.2.2 Les dysfonctionnements métaboliques ... 70
2.2.3 La prise en charge thérapeutique des candidoses ... 70
2.2.3.1 Cibles des principaux antifongiques ... 70
2.2.3.1.1 L’ergostérol membranaire ... 71
2.2.3.1.2 La paroi cellulaire fongique ... 71
2.2.3.1.3 Le métabolisme pyrimidique ... 72
2.2.3.2 Immunodéficience et antifongiques ... 72
2.2.4 Les récepteurs PRR des macrophages dans la réponse à Candida albicans ... 73
2.2.4.1 La reconnaissance de C.albicans ... 73
2.2.4.2 Internalisation et élimination de C.albicans ... 75
2.2.5 PPARs et Candida albicans ... 77
PARTIE 2 : TRAVAUX DE RECHERCHE ... 78
1 Article 1 : Low interleukin-10 production by monocytes of patients with a self-limiting hepatitis C virus infection. ... 79
1.1 Introduction ... 79
1.2 Conclusion ... 87
2 Article 2 : PPARγ controls Dectin-1 expression required in host antifungal defense against Candida albicans. ... 88
2.1 Introduction ... 88
2.2 Conclusion ... 114
3 Résultats complémentaires... 115
DISCUSSION GENERALE ET PERSPECTIVES ... 130
4
Figure 1. Spectre d’activation des macrophages. (D’après D.Mosser, 2008)………. 8
Figure 2. Origine et différenciation des monocytes-macrophages. ... 13
Figure 3. Les espèces réactives de l'oxygène et l'azote. (D'après A.Favier, 2003) ... 23
Figure 4. Principales voies du métabolisme de l'acide arachidonique (AA). ... 24
Figure 5. Le système des chémokines dans les diverses formes d'activation et de la polarisation des macrophages. (A. Mantovani, 2004) ... 28
Figure 6. Caractéristiques des macrophages M1 ... 30
Figure 7. Caractéristiques des macrophages M2. ... 33
Figure 8. Structures des récepteurs nucléaires PPARs. (C.K. Glass, 2006) ... 39
Figure 9. Mécanismes potentiels de l'inflammation induite dans un contexte d'obésité, implication des macrophages. (D'après S.E. Shoelson, 2007)……….. 46
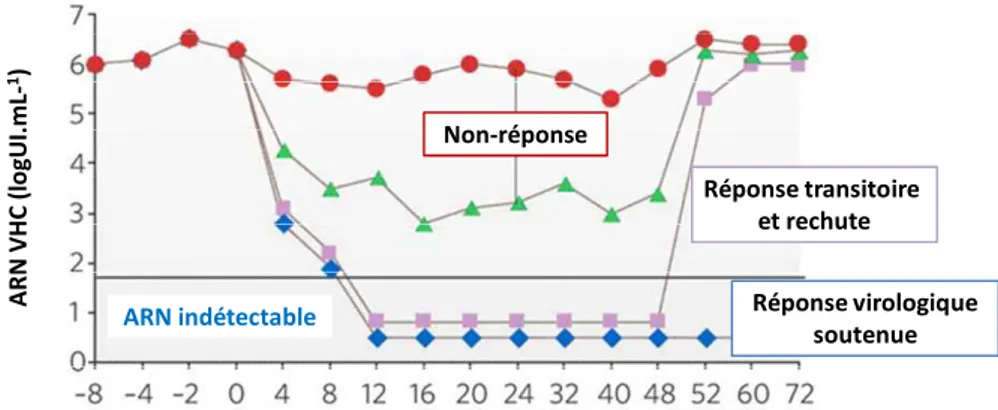
Figure 10. Réponses au traitement contre le virus de l'hépatite C. (J.J. Feld, 2005) ... 54
Figure 11. Interactions entre le système immunitaire inné et adaptatif: les macrophages jouent un rôle critique dans l'orientation de la réponse antivirale. ... 56
Figure 12. Dérégulation de la réponse antivirale par les protéines du virus de l'hépatite C. ... 59
Figure 13. Dimorphisme de C.albicans, modification de l'exposition des résidus β-glucanes selon la morphologie. (D'après H.S. Goodridge, 2009) ... 65
Figure 14. Constituants de la paroi de C.albicans. (D'après R.D. Cummings et M.G. Netea, 2008)... 66
Figure 15. Cibles des principaux antifongiques. (D’après E. Dannaoui, 2007) ... 72
Figure 16. Positionnement des monocytes-macrophages dans le spectre d'activation favorisant la résolution ou la persistance de l'infection. ... 132
Figure 17. Hypothèse quant à l’implication de la polarisation M2 dans la résolution des infections et sa modulation par les ligands de PPARγ ... 138
5 Abbréviation
5-LO 5-lypoxygénase AA Acide arachidonique AGPI Acides gras polyinsaturés
AMPc Adénosine 3’, 5’ monophosphate cyclique ATL Alanine aminotransférase
C.albicans Candida albicans
CARD9 Caspase recruitmant domain9 CARDIF CARD adaptor inducing IFNβ
CMH Complexe majeur d’histocompatibilité COX Cyclo-oxygénase
cPLA2 Phospholipase A2 cytisolique CR3 Complement Receptor 3
CRD Carbohydrate Recognition Domain CRP C-reactive protein
DBD DNA Binding Domain
DC-SIGN Dendritic Cell-Specific ICAM (intercellular adhesion molecule)-Grabbing Nonintegrin
DHA Acide docosahexaénoïque EPA Acide eicosapentaénoïque
FLAP Five lipoxygenase-activating protein
GM-CSF Granulocyte Macrophage-colony stimulating factor GR-1 Granulocyte antigen-1
HDAC Histones désacétylase
HETE Acide hydroxyeicosatetraenoïque HODE Acide hydroxyoctadécadienoïque
IFN-γ Interféron-γ IL Interleukine
IRAK IL-1 receptor-associated kinase IRF-3 IFN regulatory factor 3
IROs Intermédiaires réactifs de l’oxygène IRS Insulin Receptor Substrate
ISG Interferon stimulated genes
ITAM Immuno-receptor Tyrosine-based Activation Motif Jak Janus kinases
LBD Ligand-Binding Domain LDL Low-density lipoprtein LPS Lipopolisaccharides
6
LX Lipoxine
MAP kinases Mitogen-Activated Protein kinases M-CSF ou CSF-1 Macrophage-colony stimulating factor
MyD88 Myeloïd differentiation factor 88
NADPH oxydase Nicotinamide adenine dinucléotide phosphate oxydase N-CoR Nuclear-receptor co-repressor
NF-κB Nuclear Factor-κB NOS NO synthase
PAMPs Pathogen associated molecular patterns PDGF Platelet-derived growth factor
PG Prostaglandine
PI3K Phosphoinositide 3-Kinase PLA2 Phospholipase A2
PLCγ Phospholipase Cγ
PPAR Peroxisome Proliferator-Activated Receptor PPRE Peroxisome Proliferator Responsive Element Protéines NS Protéines non structurales
PRRs Pattern-recognition receptors PS Phosphatidylsérine
RCPGs Récepteurs à sept segments transmembranaires couplés aux protéines G RFcγ Récepteurs au fragment Fcγ
RIG-1 Retinoic acid-inducible gene-1 RLC Récepteurs lectines de type-C RM Récepteur Mannose
RXR Retinoids X Receptor
SIGNR1 Specific ICAM-3-grabbing nonintegrin-related-1
SMRT Silencing mediator of retinoic acid and thyroid-hormon receptor STAT Signal transducer and activator of transcription
SUMO Small ubiquitin-like modifier Syk Spleen tyrosine kinase TGF-β Transforming growth factor-β
Th T helper ou T auxiliaire TIR Toll/IL-1 receptor TLRs Récepteurs Toll-like TNF-α Tumor Necrosis Factor-α
TRAF TNF receptor associated protein
TRIF TIR domain containing adaptor inducing interferon-beta
TX Thromboxane
VEGF Vascular endothelial growth factor VHC Virus de l’hépatite C
7
8
Historiquement, les macrophages sont décrits comme acteurs clés de la réponse immunitaire innée. Elie Metchnikoff fut un pionnier dans la caractérisation des macrophages en tant que cellules effectrices de la réponse immunitaire avec la description de la phagocytose [1].
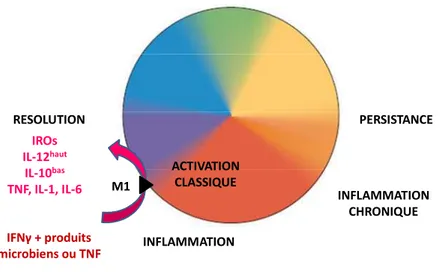
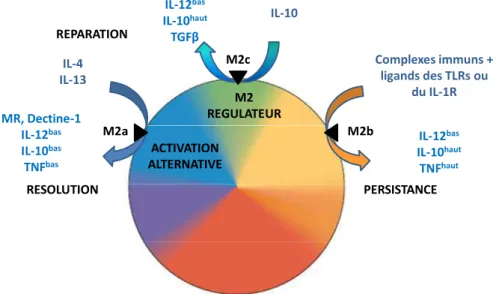
Aujourd’hui les macrophages ne correspondent plus à cette seule notion de macrophages « éboueurs ». Les fonctions fondamentales des macrophages sont abordées comme des fonctions nécessaires au retour à l’homéostasie à l’échelle du tissu et de l’organisme. Ainsi les macrophages peuvent être classifiés selon un spectre, un continuum de fonctions. Les trois objectifs fondamentaux étant la défense de l’hôte, la réparation et la régulation de l’immunité [2,3] (Figure 1). Schématiquement, la défense de l’hôte est décrite comme une réponse inflammatoire pour l’élimination de pathogènes intracellulaires associée à une activation « classique » des macrophages. L’activation classique des macrophages est induite par des produits microbiens comme les lipopolysaccharides dans un environnement de cytokines Th1 (Interféron (IFN)-γ, Tumor Necrosis Factor (TNF)-α). Après la résolution de l’infection, l’arrêt de l’inflammation est obligatoire. La persistance de l’inflammation engendrant des dommages tissulaires, le développement des mécanismes anti-inflammatoires est nécessaire à la survie de l’hôte. Les cytokines Th2 permettent alors la mise en place d’une polarisation M2 qui d’une part inhibe, régule la réponse M1, mais également favorise la réparation. Ainsi, un équilibre est nécessaire entre les polarisations M1 et M2 afin de permettre la séquence bénéfique « stress, inflammation, résolution, réparation ». De plus la polarisation M2 s’est avérée constituer une population effectrice dans certaines circonstances. Cette activation, essentiellement engendrée par les cytokines Th2, interleukine (IL)-4 et IL-13 est appelée « activation alternative » [4]. Cette polarisation est notamment nécessaire au contrôle des infections par des parasites, les helminthes en particulier, mais également les infections fongiques dans un contexte d’immunodépression [5]. Ainsi, les macrophages sont classés en différents sous-types, couvrant un large spectre d’activation compris entre les extrêmes de polarisations M1 et M2 dont l’adéquation en fonction du pathogène est corrélée à la persistance ou à la résolution de l’infection.
INFLAMMATION REPARATION REGULATION M2 Activation Alternative M1 Activation Classique
Figure 1. Spectre d'activation des macrophages. (D'après D.Mosser, 2008)
9
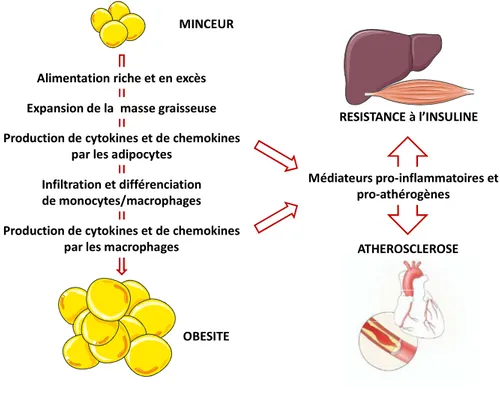
Lors de l’interaction macrophage-pathogène, la polarisation des macrophages est associée à l’expression d’un panel spécifique de récepteurs membranaires qui conditionnent leurs capacités à reconnaitre et à éliminer les agents infectieux. Les motifs structuraux conservés des pathogènes influent également sur la polarisation des macrophages. Ceci peut éventuellement constituer une stratégie d’échappement du pathogène, de nombreuses protéines virales possédant ainsi des propriétés immunomodulatrices. Mais l’interaction macrophage-pathogène n’est pas le seul facteur de cette réponse. Des facteurs intrinsèques comme le statut physiologique de l’hôte influencent considérablement la réponse des macrophages. En effet, métabolisme et inflammation sont étroitement liés. Les récepteurs nucléaires et en particulier PPARγ (Peroxisome Proliferator-Activated Receptor γ) constituent un modulateur critique de l’activation alternative M2 des macrophages [6] mais également du métabolisme lipidique et du glucose [7]. PPARγ régule l’expression de gènes codant pour des récepteurs membranaires impliqués à la fois dans le transport des lipides et la capture d’agents pathogènes comme le récepteur CD36, qui permet la capture des lipides oxydés et la reconnaissance de Plasmodium falciparum [8,9]. L’axe cytokine Th2 / PPARγ / récepteur de surface des macrophages apparait aujourd’hui essentiel dans la réponse alternative des macrophages de type 2 et constitue un lien direct pour l’étude de l’implication des macrophages dans la résolution des infections associées aux dysrégulations métaboliques.
Ainsi, la caractérisation fonctionnelle des monocytes et des macrophages, chez l’homme comme chez la souris, semble déterminer la compréhension de la physiopathologie de l’inflammation. Durant cette thèse nous nous sommes attachés à définir et comprendre l’implication de la polarisation M2 des monocytes et des macrophages dans l’évolution de l’infection.
Nous avons alors abordé cette question sous deux aspects.
D’une part, nous avons caractérisé les monocytes circulants d’individus ayant guéris spontanément de l’hépatite C par rapport à des monocytes de sujets présentant une hépatite chronique ou étant atteints d’hépatite chronique répondeurs sous traitement ou enfin de sujets donneurs sains. Ainsi nous avons étudié les caractéristiques phénotypiques et fonctionnelles de ces monocytes. Les monocytes de sujets éliminant le virus de l’hépatite C (VHC) spontanément constituent un élément intéressant dans l’étude du rôle de la polarisation M2 des monocytes face à une infection virale. D’autre part, nous avons travaillé sur deux modèles murins de candidoses digestives à Candida
albicans (C.albicans), des animaux dont le gène du récepteur lectine Dectine-1 est spécifiquement
invalidé dans les phagocytes et un modèle de diabète de type 2 induit par un régime hyperlipidique. Le diabète constitue un facteur prédisposant au développement de candidoses de la sphère digestive [10]. L’hyperglycémie ne semble pas être la seule cause de cette susceptibilité, les macrophages pourraient être également impliqués. Les mécanismes qui conduisent à une diminution des fonctions
10
immunes chez les sujets diabétiques pourraient impliquer la modulation de l’expression de récepteurs lectine de type C des macrophages, dont Dectine-1, pour la reconnaissance des motifs glucidiques de la paroi de C.albicans et des fonctions qui leurs sont associées. Parallèlement, des travaux réalisés au laboratoire mettent en évidence l’implication du récepteur PPARγ via l’utilisation de thiazolidinédiones, ligands synthétiques du récepteur nucléaire, dans la résolution de candidoses digestives chez des souris immunocompétentes et immunodéprimées [5].
Ainsi nous avons étudié l’implication du récepteur aux β-glucanes, constituants de la paroi de
C.albicans, Dectine-1, lors de candidoses digestives et son implication dans la réponse aux ligands de
PPARγ dans ces deux modèles.
Ce mémoire se compose de trois parties.
La première partie correspond à une revue bibliographique présentant les monocytes et les macrophages, de l’Homme et de la souris, leurs différentes polarisations et l’importance des récepteurs nucléaires dans ce processus. Nous ferons également état des monocytes et des macrophages face au VHC et à C.albicans.
La seconde partie de ce manuscrit est composé de travaux de recherche sous forme de deux articles et de résultats complémentaires.
La dernière partie de cette thèse présente une discussion des résultats obtenus et permet une synthèse de l’implication de la polarisation des monocytes et des macrophages dans le devenir d’une infection. Cette partie met également en perspective les enjeux de notre recherche.
11
12
1 Monocytes et Macrophages, une population hétérogène
1.1 Les monocytes/macrophages
1.1.1 Monocytes et Macrophages, cellules du système des phagocytes mononucléés
1.1.1.1 Définition & caractéristiques
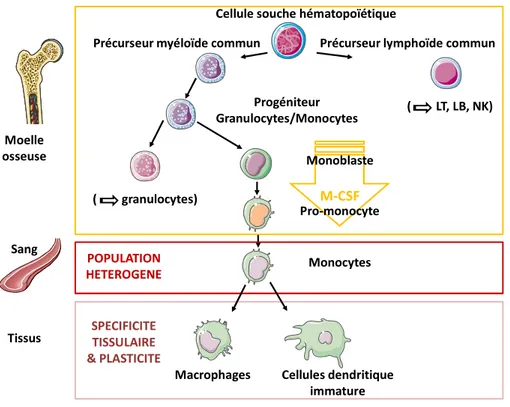
Les monocytes et macrophages appartiennent au système des phagocytes mononucléés. Ce système comprend plus largement les cellules dendritiques et les cellules progénitrices dont ils sont issus [11,12]. Le développement des monocytes a lieu dans la moelle osseuse. Brièvement, des cellules souches hématopoïétiques pluripotentes se différencient en des précurseurs myéloïdes ou lymphoïdes. Le précurseur myéloïde est commun aux granulocytes et aux monocytes. Les étapes de différenciation des monocytes sont essentiellement dépendantes du facteur de croissance M-CSF (Macrophage-colony stimulating factor ou CSF-1). Les monocytes, macrophages, cellules dendritiques et leurs précurseurs partagent d’ailleurs le récepteur au M-CSF (CSF-1R) comme caractéristique [13]. Granulocytes et monocytes vont alors sortir de la moelle osseuse pour aller dans la circulation sanguine [13]. Les monocytes représentent environ 10% des leucocytes du sang circulant de l’homme et 4% des leucocytes du sang circulant de la souris [13]. Ils constituent une population de morphologie hétérogène et présentent une grande variabilité dans l’expression de leurs antigènes de surface. Les monocytes circulent dans le sang durant 1 à 3 jours avant de migrer dans les tissus [13,14]. Ainsi, les monocytes circulants sont les précurseurs de l’ensemble des macrophages résidents retrouvés dans les différents tissus de l’organisme, ainsi que des cellules spécialisées comme les cellules dendritiques myéloïdes (distinctes des cellules dendritiques lymphoïdes) [15]. Plusieurs facteurs de croissance et cytokines sont nécessaires au contrôle du développement et à l’homéostasie des macrophages et des cellules dendritiques [13,16]. Le développement des macrophages dans les tissus à partir de monocytes fut décrit dès 1939, dans des travaux d’Ebert et Florey. Les étapes permettant l’obtention de macrophages différenciés à partir de progéniteurs de moelle osseuse sont résumées dans la figure 2.
Ainsi, les monocytes, en tant que réservoir réactif et les macrophages en tant d’effecteurs immédiats, représentent, chez les mammifères, des acteurs clé de l’inflammation, qui est essentielle pour la réponse innée aux pathogènes. Mais ces cellules sont aussi impliquées dans la pathogénèse des maladies inflammatoires chroniques. Les monocytes-macrophages constituent, une population cellulaire capable de réagir dès la rencontre d’un pathogène dans les tissus. Cette ligne de défense de l’organisme permet de résoudre de nombreuses infections et constitue un lien fondamental avec l’immunité adaptative.
13
M-CSF
Cellule souche hématopoïétique
Précurseur lymphoïde commun Précurseur myéloïde commun
Progéniteur Granulocytes/Monocytes
Monoblaste
Pro-monocyte
Macrophages Cellules dendritique immature Monocytes Moelle osseuse Sang Tissus ( LT, LB, NK) ( granulocytes) POPULATION HETEROGENE SPECIFICITE TISSULAIRE & PLASTICITE
Figure 2. Origine et différenciation des monocytes-macrophages.
1.1.1.2 Hétérogénéité des monocytes humains
Les premiers travaux sur les monocytes humains ont permis de rendre compte de l’hétérogénéité tout d’abord morphologique des monocytes. En effet ces études reposaient sur des techniques de centrifugation et d’élutriation permettant une séparation des cellules sur des critères morphologiques. Ainsi, il a été observé des variations de taille, de densité (ou granulosité) ainsi que de morphologie nucléaire. Ces trois critères ont constitué les premiers constats d’une hétérogénéité de la population monocytaire [17]. Deux populations sont alors distinguées. Une première, majoritaire, correspond aux monocytes «regular». Ces monocytes présentent une forte capacité de phagocytose et une importante activité myeloperoxydase. Une seconde, minoritaire, constituée de « petits » monocytes, est initialement caractérisée comme ayant une capacité importante à produire de l’IL-1. Rapidement, en plus de cette hétérogénéité morphologique, les monocytes ont été caractérisés grâce à l’expression des récepteurs au fragment Fcγ (RFcγ) suite à la reconnaissance d’érythrocytes couplés à des immunoglobulines G [17,18] et d’autres antigènes de surfaces avec l’utilisation d’anticorps monoclonaux. Les travaux de Ziegler-Heitbrock et al. permettent de corréler les deux populations « morphologiques » à l’expression du CD16 (RFcγIII) [19]. De plus, les monocytes sont identifiés comme des cellules positives pour l’expression du co-récepteur aux
14
lipopolysaccharides (LPS), le marqueur CD14 (CD14+). Ainsi, deux sous-populations sont définies sur l’expression différentielle de CD16 et CD14.
La première sous-population dite « classique » correspond aux critères initialement attribués aux monocytes «regular». Elle correspond aux monocytes présentant un faible taux d’expression du marqueur CD16 mais une expression importante du marqueur CD14 (CD14haut CD16-). Elle représente plus de 80% des monocytes circulants chez un sujet sain. Cette sous-population « classique » présente une forte capacité de phagocytose et de production de cytokines pro-inflammatoires (Tumor Necrosis Factor (TNF)-α et interleukine (IL)-6 et IL-1). Cette sous-population exprime fortement le récepteur aux chemokines CCR2 mais faiblement le CX3CR1 [15,17].
La deuxième sous-population est caractérisée par la co-expression des deux marqueurs CD14 et CD16 (CD14+ CD16+), elle représente environ 10% des monocytes circulants. Contrairement à la population majoritaire, les monocytes CD14+ CD16+ expriment faiblement CCR2 mais fortement CX3CR1 [13,15,17]. Ces monocytes CD14+CD16+ furent encore subdivisés en deux populations distinctes par leur fonctionnalité et leur expression des RFcγ I CD64 et RFcγ II CD32 [17]. Ainsi la population CD16+ CD32+ CD64+ présente de fortes capacités de phagocytose et de production de cytokines pro-inflammatoires en réponse aux LPS. Cette population CD64+ a également une importante capacité à produire des espèces réactives de l’oxygène [20]. Cette sous-population de part son niveau d’expression élevé des molécules du complexe majeur d’histocompatibilité (CMH) de classe II ainsi que du CD32 (FcγRII) pourrait être un précurseur préférentiel des macrophages résidents avec lesquels elle partage ces caractéristiques. Cette sous population représenterait également celle des précurseurs circulants des cellules dendritiques migratoires [15,21]. A l’opposé les monocytes CD16+ CD32- CD64- expriment un niveau très bas de CD14 (CD14dimCD16+). Ces monocytes sont peu phagocytaires et ne produisent pas de TNF-α ou d’IL-1 en réponse aux LPS [22]. La fonction de cette sous-population minoritaire est encore inconnue mais elle peut être en forte expansion dans le sang de patients en choc septique [23].
1.1.1.3 Hétérogénéité des monocytes de souris
Comme expliqué précédemment, une étape clé dans la caractérisation des cellules du système des phagocytes mononucléés est l’arrivée des anticorps monoclonaux. Il émergea un marqueur critique des cellules de ce système chez la souris, le marqueur F4/80. F4/80 appartient à la famille des EGF-TM7. Ce marqueur est largement exprimé par la majorité des macrophages tissulaires résidents (macrophages retrouvés dans la rate, la microglie du système nerveux central, les cellules de Kupffer du foie ou encore les cellules de Langerhans au niveau de la peau) [24]. Des travaux récents
15
suggèrent un rôle de ce marqueur dans l’induction de lymphocytes T CD8+ régulateurs et dans la tolérance périphérique [25]. D’une manière générale, cette molécule constitue donc un marqueur des cellules du système des phagocytes mononucléés chez la souris et a permis d’établir une origine commune à ces cellules [24,26]. Les monocytes murins expriment le marqueur F4/80 mais dans une moindre mesure par rapport aux macrophages résidents [27]. Ainsi les monocytes de souris sont caractérisés par l’expression des marqueurs F4/80, CD11b et CSF-1R. De manière comparable à la population monocytaire humaine, les monocytes de souris sont subdivisés en deux sous-populations distinctes basées sur les niveaux d’expression de deux marqueurs de surface CCR2 et CX3CR1. On
retrouve donc une population « résidente » CCR2- CX3CR1 haut
caractérisée par un recrutement dépendant de CX3CR1 et une population dite « inflammatoire » du fait de l’expression du récepteur à
la chemokine CCL2 (correspondant à MCP1) favorisant le recrutement sur les sites inflammatoires. Cette population est donc CCR2+ mais également CX3CR1bas. Un marqueur additionnel est associé aux monocytes positifs aux CCR2, le marqueur Ly6C correspondant à un épitope de GR-1 (granulocyte antigen-1). Cette population CCR2+ CD62L+ CX3CR1bas Ly6C+ est assimilée à la population de monocytes « classique » humaine. Parallèlement la population CCR2- Ly6C- est corrélée à la population CD14+ CD16+ humaine [28,29]. Ces monocytes Ly6C- CX3CR1haut auraient un rôle de patrouilleurs dans les vaisseaux sanguins et assureraient l’élimination des lipides oxydés, des cellules mortes mais seraient alors aussi impliqués dans la pathogenèse de l’athérosclérose. Cependant ces monocytes patrouilleurs seraient très réactifs en cas de dommages tissulaires et l’extravasation vers le tissu lésé serait réalisée très rapidement [13].
Ces correspondances entre sous-populations murines et humaines qui sont encore actuellement étudiées, sont importantes afin d’appuyer la relevance de l’étude des populations monocytaires, leurs caractéristiques fonctionnelles chez la souris pour mieux comprendre les phénomènes humains.
1.1.1.4 Des monocytes aux macrophages
Les macrophages, disséminés dans l’ensemble de l’organisme, se distinguent des monocytes par une plus grande taille et le développement considérable de l’appareil vacuolaire (vésicules d’endocytose, endosomes, lysosomes, phagosomes, phagolysosomes). Les propriétés fondamentales des macrophages sont leur mobilité, leur pouvoir de phagocytose lié à la présentation antigénique et leur capacité sécrétrice. Cette capacité sécrétrice est multiple: fractions du complément, cytokines, facteurs hématopoïétiques, prostaglandines, radicaux libres… De plus les macrophages tissulaires ont un important rôle dans le maintien de l’homéostasie tissulaire via la clairance des cellules sénescentes ainsi que dans le remodelage et la réparation de tissus lésés après un épisode
16
inflammatoire. A l’état non activé, résidant, les macrophages expriment un large éventail de gènes qui leur confère une spécialisation fonctionnelle en fonction de leur localisation dans les différents tissus de l’organisme. En effet les ostéoclastes, par exemple, ont un rôle de remodelage du tissu osseux, les macrophages alvéolaires vont exprimer fortement les récepteurs de reconnaissance des motifs conservés des microorganismes afin d’éliminer les particules, microorganismes….des poumons. Il est intéressant de noter que les macrophages de la muqueuse intestinale, très nombreux, présentent la particularité d’avoir une capacité de phagocytose élevée, ainsi qu’une grande activité bactéricide sans pour autant produire beaucoup de cytokines pro-inflammatoires. Cette particularité de phénotype fonctionnel semble être due aux signaux produits par les cellules stromales de la muqueuse intestinale, soulignant ainsi l’importance du microenvironnement sur la différenciation des macrophages tissulaires.
De manière générale, les signaux responsables des caractéristiques phénotypiques que les macrophages acquièrent spécifiquement dans les tissus sont des molécules excrétées ou exprimées par les cellules de l’environnement et des composés de la matrice extracellulaire. Les molécules d’adhésion exprimées localement contrôlent la migration à travers l’endothélium, du compartiment sanguin vers l’interstitium et l’épithélium. Il s’agit principalement de molécules d’adhésion (intégrines, molécules appartenant à la famille des immunoglobulines, sélectines, etc.), de cytokines comme le Transforming Growth Factor (TGF)-β, de chemokines ou de facteurs de croissance. La question d’un recrutement ciblé de monocytes en fonction du profil des macrophages retrouvés dans le tissu reste posée.
Actuellement, l’origine des macrophages comme dérivant uniquement des monocytes sanguins est complétée par l’hypothèse d’une prolifération locale durant les périodes d’équilibre en dehors de conditions inflammatoires. En effet, une approche de transplantation de moelle osseuse marquée a permis l’étude de l’origine des macrophages tissulaires. L’utilisation de cette technique a cependant soulevé une critique quant au fait d’irradier les animaux et de créer ainsi des niches de prolifération dues uniquement à ce traumatisme. Cela dit, des études publiées en 1998 sur l’observation de la reconstitution des populations de macrophages tissulaires après une greffe de moelle dont les cellules expriment lacZ montrent, qu’alors que la majorité des précurseurs de la moelle osseuse et des macrophages de la rate, sont semblables à celles du donneur après un mois, seulement 61% des macrophages alvéolaires et hépatiques sont remplacés par ces cellules marquées un an après la transplantation. L’hypothèse d’un faible renouvellement de la population des macrophages tissulaires est soulignée par les auteurs [30,31]. Néanmoins ces résultats contribuent à l’émergence de l’hypothèse selon laquelle tous les macrophages tissulaires ne sont pas remplacés uniquement à
17
partir de monocytes issus du compartiment sanguin durant les périodes d’homéostasie. Il y aurait également une part importante de prolifération locale. Parallèlement, dans un contexte infectieux, inflammatoire, le recrutement de monocytes semble toujours constituer la source majeure de renouvellement de la population résidente de macrophages tissulaires [15,24,32].
Une autre question relative à l’hétérogénéité des monocytes reste en suspend et doit mériter toute notre attention à savoir si le phénotype, l’expression de différents marqueurs, ont une valeur prédictive quant à l’évolution d’une infection ou sur la réponse à un traitement. Nous aborderons cette question dans nos travaux sur les monocytes de patients face au virus de l’hépatite C.
1.1.2 Récepteurs membranaires et propriétés fonctionnelles des monocytes - macrophages
Les macrophages reconnaissent les pathogènes via de nombreux récepteurs de surface, endosomals ou encore cytoplasmiques qui interagissent avec des structures microbiennes conservées telles que des composants des parois ou des acides nucléiques. Cette reconnaissance entraîne l’activation des fonctions effectrices des macrophages ainsi que la production de cytokines, de chemokines et d’autres médiateurs nécessaires à la coordination de la réponse inflammatoire. La qualité de l’interaction récepteurs/pathogènes doit être optimale pour le déclenchement des fonctions effectrices adaptées. De cette première étape dépend également la coordination des réponses immunes innées et adaptatives afin d’obtenir la clairance du pathogène tout en limitant la réponse inflammatoire dans sa toxicité et les dommages tissulaires associés.
1.1.2.1 Les pattern-recognition receptors
La réponse immunitaire innée repose sur la reconnaissance de motifs moléculaires conservés, spécifiquement associés aux microorganismes, nommés PAMPs (pathogen associated molecular patterns). Ces motifs, qui ne sont donc pas exprimés par les cellules de mammifères, correspondent par exemple aux glucanes ou aux mannanes rencontrés dans la paroi des champignons, aux lipopolysaccharides exprimés par les bactéries Gram négatives ou encore aux fragments de peptidoglycanes et à l’acide teichoïque associés à la paroi cellulaire des bactéries Gram positives. La reconnaissance des PAMPs par les phagocytes se fait par un ensemble de récepteurs, les PRRs (pattern-recognition receptors). Les PRRs regroupent plusieurs familles de récepteurs notamment les Récepteurs Toll-like (TLRs), les récepteurs lectines de type-C (RLC), les récepteurs scavengers. De manière générale, les différents sous-types de monocytes et de macrophages peuvent être caractérisés par le répertoire d’expression des PRRs reconnaissant les microorganismes, les cellules apoptotiques et diverses particules. L’ensemble de ces récepteurs membranaires intervient dans la
18
phagocytose des agents pathogènes et/ou déclenche des voies de signalisation qui vont orienter la réponse fonctionnelle des monocytes - macrophages et leur activation.
1.1.2.1.1 La collaboration entre les récepteurs
La collaboration de récepteurs caractérise le processus selon lequel plusieurs récepteurs d’une même cellule, engagés par un même pathogène, interagissent et définissent une réponse inflammatoire. La collaboration des PRRs permet donc, non seulement de définir le type cellulaire activé, comme les macrophages, mais également l’ampleur de la réponse inflammatoire liée notamment à la production de cytokines et de chemokines [33]. TLRs et récepteurs lectines de type-C peuvent ainsi collaborer pour la modulation des fonctions des macrophages en réponse à un pathogène.
1.1.2.1.2 Les récepteurs « Toll-Like » ou TLRs
Les TLRs reconnaissent des PAMPs et regroupent plus de 12 protéines différentes. Ainsi le TLR2 reconnait les lipopeptides, les lipoarabinomannanes, les lipomannanes, les acides lipoteichoïques, les lipoprotéines, les glycoprotéines et les peptidoglycanes. Il lie les résidus glucidiques modifiés par des lipides des parois des champignons ainsi que la protéine de capside core du virus de l’hépatite C (VHC). Le TLR4 lie les LPS de la paroi des bactéries Gram négatives. D’autres TLRs reconnaissent les acides nucléiques, le TLR3 reconnait les ARN double brin, les TLR7/8 les ARN simple brin qui sont présents dans le cycle de vie de virus tel que le VHC. Les protéines constituent également des ligands pour certains TLRs.
Après leur engagement, les TLRs initient la voie de signalisation grâce à leur domaine TIR (Toll/IL-1 receptor) intracytoplasmique [34]. L’ensemble des TLRs, sauf le TLR3, recrutent via l’interaction avec les domaines TIR des molécules adaptatrices nécessaires à la signalisation dont MyD88 (myeloïd differentiation factor 88), IRAK (IL-1 receptor-associated kinase) aboutissant à l’activation du facteur de transcription NF-κB (Nuclear Factor-κB) et des MAP (Mitogen-Activated Protein) kinases. La réponse inflammatoire déclenchée par les TLRs dépend des TLRs engagés et des molécules adaptatrices recrutées.
La liaison TLR2/lipoprotéines bactériennes déclenche la production de TNF-α par les macrophages via l’activation de NF-κB [35]. Les LPS induisent en se liant au TLR4 l’activation de NF-κB mais aussi du facteur de transcription IRF3 (interferon regulatory factor-3) aboutissant à la production d’interférons de type I [36,37].
19
Une réponse excessive aux ligands des TLRs est contrôlée par un phénomène de tolérance. Ainsi la stimulation des TLRs avec un ligand donné induit la production de TNF-α, une nouvelle stimulation avec le même ligand induit alors une baisse de cette production, c’est l’homotolérance. La stimulation d’autres TLRs avec un ligand de nature différente du premier induit également la diminution de la production de TNF-α, ce mécanisme est appelé hétérotolérance des TLRS [38].
1.1.2.1.3 Les récepteurs lectine de type-C ou RLC
Les RLC sont une superfamille de récepteurs possédant un ou plusieurs domaines lectine de type-C (CTLDs). Les récepteurs lectine sont divisés en plusieurs groupes. Bien qu’initialement décrits comme ayant une activité dépendante du calcium Ca2+, de nombreux RLC ne nécessitent pas de calcium pour fonctionner [39]. De nombreux récepteurs lectine extra-cellulaires notamment le Récepteur Mannose (RM, MRC1 ou CD206) ou Dectine-1 sont particulièrement impliqués dans la défense antifongique [39].
Le RM possède huit domaines lectine CTLDs extracellulaires, un domaine composé de répétitions de molécules de fibronectine de type II, un domaine riche en cystéines et une courte queue cytoplasmique. Ce récepteur est un récepteur transmembranaire mais en absence d’activation la majorité du pool de RM semble être associée à la voie d’endocytose. Son activité est médiée par les domaines CTLDs 4-8 qui reconnaissent les résidus mannose, fucose ou N-acétylglucosamine terminaux [40]. Les réponses cellulaires induites par la liaison de ligands notamment fongiques semblent dépendre de l’activation de NF-κB qui conditionnent la production de nombreuses cytokines telles que l’IL-12, l’IL-6, l’IL-1β, l’IL-8 ou le GM-CSF (Granulocyte Macrophage-colony stimulating factor).
Le récepteur Dectine-1 possède un seul domaine de reconnaissance des carbohydrates (CRD Carbohydrate Recognition Domain) et reconnait essentiellement les résidus β 1-3 glucanes retrouvés dans la paroi des levures comme Candida albicans (C.albicans). Sa partie intracellulaire présente un motif ITAM (Immuno-receptor Tyrosine-based Activation Motif), capable de transduire un signal. La voie de signalisation en aval de Dectine-1 implique Syk et CARD9 (spleen tyrosine kinase et caspase recruitmant domain9) [41,42]. La production de chemokines et de cytokines telle que le TNF-α en réponse au zymosan et à C.albicans semble dépendre d’une collaboration avec les TLRs notamment le TLR2.
20 1.1.2.1.4 Les récepteurs éboueurs ou « scavenger ».
Le terme récepteur scavenger englobe un ensemble de récepteurs reconnaissant des composés anioniques, exprimés par les macrophages et certaines cellules endothéliales. Ces récepteurs jouent un rôle dans la phagocytose et l’élimination des cellules apoptotiques. Les récepteurs scavenger sont divisés en récepteurs scavenger de classe A et de classe B dont SR-B1 et CD36. Le récepteur CD36 contribue à l'homéostasie des lipoprotéines et est impliqué dans la clairance des cellules apoptiques. Ce récepteur CD36 est également impliqué dans la réponse aux pathogènes comme Plasmodium
falciparum en reconnaissant une protéine parasitaire exprimée par les érythrocytes parasités.
1.1.2.2 La phagocytose
La phagocytose est une fonction clé des macrophages. Cette fonction permet l’élimination de microorganismes pathogènes ainsi que des cellules sénescentes, des débris cellulaires, elle est donc nécessaire pour les défenses anti-infectieuses et l’homéostasie tissulaire.
En effet c’est un processus nécessaire à l’organogenèse, le remodelage et l’homéostasie tissulaire avec la phagocytose de cellules et des débris apoptotiques. Les cellules sénescentes disparaissent selon un processus d’apoptose. Ces corps apoptotiques sont phagocytés par des macrophages mais également par des phagocytes non professionnels comme les cellules épithéliales [43]. Ce processus n’est pas accompagné de la sécrétion de médiateurs pro-inflammatoires mais est associé à la production de TGF- β due à la reconnaissance des résidus phosphatidyl sérine par des récepteurs spécifiques à la surface des macrophages [44]. Cette forme de phagocytose ne provoque donc pas d’inflammation.
La phagocytose en tant que processus immunitaire est une fonction caractéristique des phagocytes professionnels que sont les macrophages, les cellules dendritiques et les neutrophiles. Cette fonction correspond à la capture, l’élimination des pathogènes et est associée à la présentation antigénique [43]. Le processus de phagocytose diffère entre les macrophages/cellules dendritiques et les neutrophiles même si l’on retrouve de nombreuses caractéristiques communes [45]. Les monocytes ont également des capacités de phagocytose mais inférieures à celles des macrophages en raison de la différence du panel et du niveau d’expression de leurs récepteurs de surface.
La phagocytose est déclenchée par la reconnaissance et la liaison de récepteurs de surface du phagocyte à un antigène. Cette liaison peut être réalisée soit via la reconnaissance des opsonines à la surface de l’agent pathogène soit directement via la reconnaissance des motifs moléculaires conservés de la paroi des pathogènes, les PAMPs. Ces deux types de reconnaissances sont réalisés
21
respectivement par des récepteurs aux opsonines et par des récepteurs aux PAMPs tels que les PRRs Dectine-1, Récepteur Mannose…
L’étendue de l’interface pathogène/membrane plasmique pour la phagocytose est discutée et deux modèles de phagocytose sont proposés. Le premier mécanisme est appelé « zipper » et propose que l’allongement des pseudopodes de part et d’autre de la particule à ingérer soit conditionné et restreint par des interactions pathogènes / récepteurs du phagocyte. Le second mécanisme est le « trigger », il est basé sur un modèle de tout-ou-rien où la première interaction initie la formation de la totalité du phagosome [46].
Dans tous les cas, la liaison et le « clustering », ou regroupement, de récepteurs déclenchent le réarrangement du réseau d’actine par une cascade de signaux due à l’activation de kinases. Ceci induit la formation d’une invagination de la membrane plasmique. La fermeture du phagosome nécessite la fusion avec de nombreuses vésicules issues d’organelles cellulaires (endosomes et réticulum endoplasmique). Cette étape correspond à une exocytose « focalisée ». Ensuite la seconde étape correspond à la maturation du phagosome. Ce processus dynamique est toujours lié à la fusion (et à la génération) de vésicules endosomiales et lysosomiales. Ces interactions permettent l’acquisition de la machinerie nécessaire à l’activité microbicide correspondant aux ATPases (ATPase vacuolaire) permettant l’acidification du phagosome et au complexe NADPH oxydase (nicotinamide adenine dinucléotide phosphate oxydase)[45,47].
Dans les macrophages, la maturation des phagosomes est liée à son acidification et le phagosome tardif, ou phagolysosome, a un pH proche de 5. De plus, cette acidité est un élément essentiel pour un fonctionnement optimal des protéases et des hydrolases lysosomiales nécessaires à l’élimination du pathogène. Ce phénomène d’acidification est différent dans les neutrophiles, cette différence est attribuée à une activité plus importante de la NADPH oxydase dans les neutrophiles par rapport aux macrophages car l’activité oxydase altère le pH des phagolysosomes par plusieurs mécanismes indépendants.
La dernière étape du processus de phagocytose est l’apprêtement des peptides pour la présentation des antigènes à la surface des phagocytes. Les peptides issus de la dégradation de la particule internalisée sont chargés sur les molécules du CMH de classe II, permettant d’activer les lymphocytes CD4+ [47].
22
1.1.2.3 Les intermédiaires réactifs de l’oxygène et de l’azote
1.1.2.3.1 Les intermédiaires réactifs de l’oxygène
La phagocytose est couplée à l’hyperactivité oxydative c’est-à-dire la production d’espèces réactives de l’oxygène toxiques pour les micro-organismes en entraînant la peroxydation lipidique ainsi que l’oxydation des protéines et des acides nucléiques. Ces espèces réactives de l’oxygène sont produites au niveau des membranes suite à l’activation du complexe de la NADPH oxydase. Le complexe NADPH oxydase est sous forme latente non fonctionnelle dans les phagocytes non activés. Elle est composée de sous-unités membranaires (p21phox, gp91phox, Rap) et cytoplasmiques (p67phox, p40phox et p47phox et Rac). Suite à l’activation du monocyte/macrophage, la NADPH oxydase s’assemble à la membrane plasmique ou à la membrane des phagosomes. Ce complexe oxydase utilise alors l’oxygène moléculaire pour produire une grande quantité d’anion superoxyde (O2
.-). L’anion superoxyde est un agent oxydant mais constitue surtout un substrat pour la génération de peroxydes d’hydrogènes (H2O2) qui lui-même est un substrat pour la production de puissants
oxydants (HOCl) par une réaction catalysée par une myeloperoxydase. Au sein du phagosome, l’activation de la NADPH oxydase et l’action des superoxydes dismutases et des peroxydases aboutissent alors à la production de peroxydes d’hydrogènes (H2O2), de radicaux hydroxyles (OH
.
) et toujours d’anions superoxydes et correspondent au « burst oxydatif » ou «hyperactivité oxydative» (Figure 3).
Les phagocytes mononucléés produisent des espèces réactives de l’oxygène mais il faut distinguer les capacités de production des monocytes et des macrophages. Les monocytes sont de forts producteurs d’intermédiaires réactifs de l’oxygène (IROs) via des activités importantes de la NADPH oxydase et de la myeloperoxydase. Des études des capacités de production d’IROs par des monocytes maintenus en culture, montrent que ces conditions, qui reflètent les changements lors de la maturation des monocytes circulants en macrophages résidents, entrainent une diminution de la capacité de production des IROs corrélée à une diminution de la fonction cytotoxique des macrophages vis-à-vis de cellules tumorales [48-50]. Il apparait que cette diminution de la production des IROs par les macrophages serait due en partie à la diminution de l’expression de la myeloperoxydase dans le macrophage par rapport au monocyte [51].
1.1.2.3.2 Les intermédiaires réactifs de l’azote
Une autre espèce radicalaire, le monoxyde d’azote (NO.) constitue comme l’anion superoxyde un précurseur à des espèces très réactives comme les peroxynitrites (ONOO-). Le monoxyde d’azote est produit par des NO synthases (NOS) exprimées soit de manière constitutive, activées transitoirement
23
par des mécanismes dépendants du calcium (NOS1 ou NOS neuronale et NOS3 ou NOS endothéliale) soit inductible par des signaux cytokiniques (iNOS ou NOS2). Au niveau des monocytes/macrophages, la production d’oxyde nitrique est conditionnée par l’induction de la NOS2.
Le NO. est généré à partir de la L-arginine (Figure 3). Le métabolisme de l’arginine dans les macrophages est au centre d’une balance entre l’activité NO synthase et l’activité arginase générant respectivement des intermédiaires réactifs de l’azote ou la production de métabolites impliqués dans la réparation tissulaire. L’activation maximale de la NOS2 est retrouvée dans les macrophages de souris et d’Homme. Le déclenchement de la formation du monoxyde d’azote par les monocytes est plus complexe et implique habituellement l’interconnexion du CD23 (FcεRII) membranaire. L'engagement du CD23 à la surface des monocytes stimule la NOS2, conduisant à la production de TNF-α qui agit alors comme facteur autocrine d'amplification de production du NO. [52].
O2 oxygène H2O2 péroxyde d’hydrogène O2
.-anion superoxyde NO
.
monoxyde d’azote HOCl ONOO peroxynitrite OH.
radical hydroxyle Arginine SOD MYELOPEROXYDASES Cl -OXYDATION DES PROTEINES PEROXYDATION LIPIDIQUE OXYDATION DE L’ADN NITRATION DES PROTEINES NADPHox OXYDASES Fe2+ Fe3+ NOSFigure 3. Les espèces réactives de l'oxygène et l'azote. (D'après A.Favier, 2003)
1.1.2.4 Les eicosanoïdes
Les monocytes/macrophages ont la capacité de générer des médiateurs lipidiques de l’inflammation, les eicosanoïdes. Les eicosanoïdes sont générés à partir des acides gras polyinsaturés à 20 atomes de carbone. L’acide arachidonique (C20 :4 ω6) est le précurseur majeur des eicosanoïdes dans les cellules de mammifères. Au cours d’un processus inflammatoire, cet acide gras est libéré des
24
phospholipides membranaires, après activation d’une phospholipase A2 (PLA2). L’acide archidonique ainsi libéré est ensuite métabolisé par deux voies principales, la voie des cyclo-oxygénases responsable de la synthèse à partir de plusieurs synthases des prostanoïdes et la voie des lipoxygènases permettant la synthèse des leucotriènes et des acides gras hydroxylés [53] (Figure 4). Les eicosanoïdes produits en réponse à un stimulus peuvent agir comme signaux autocrines [54,55] ou par voie intracellulaire [56].
PROSTAGLANDINES (PGA2, PGE2, PGD2, PGF2α) AA AG P-X PROSTACYCLINES (PGI2, 6 céto-PGF1α) THROMBOXANES (TXA2, TXB2) LEUCOTRIENES (LTB4, LTC4, LTD4, LTE4) ACIDES EICOSATETRAENOIQUES (HPETEs, HETEs) LIPOXINES
Acide Arachidonique (AA)
PLA2 LIPOXYGENASES (5-, 12- et 15-LO) CYCLO-OXYGENASES (COX-1 et COX-2) Phospholipides membranaires
Figure 4. Principales voies du métabolisme de l'acide arachidonique (AA).
1.1.2.4.1 Les prostaglandines
Les prostaglandines sont des molécules produites par de nombreux types cellulaires notamment par les monocytes/macrophages. Les prostaglandines peuvent agir en tant que messager autocrine via des récepteurs à sept segments transmembranaires couplés aux protéines G (RCPGs). Elles modulent le taux d’AMPc (Adénosine 3’, 5’ monophosphate cyclique) ou le flux calcique [54,57] dans les cellules. Enfin elles peuvent agir comme modulateurs de l’expression génique. Les monocytes/macrophages produisent des prostanglandines suite à un signal infectieux (par exemple déclenché au cours de la phagocytose de bactéries ou de levures comme Candida albicans), ou un signal inflammatoire. Le contrôle du relargage de l’acide arachidonique des membranes cellulaires est largement dû à l’activité de la phospholipase A2 cytosolique (cPLA2). Le facteur limitant la synthèse des prostaglandines est l’absence de PLA2. La cPLA2 calcium dépendante constitue