1
Biochimie Structurale
TD destinés aux étudiants en L2
Préparé par Dr. ADIDA-CHERIF H Maitre de conférences classe B Département de Biologie
2 Chapitre IV : LES PEPTIDES
1. Définition
Un peptide est une molécule constituée d'acides aminés enchaînés par un lien peptidique. La réaction d’un groupe COOH d’un acide aminé avec un groupe NH2 d’un autre acide aminé donne un amide. La liaison formée est une liaison peptidique, cette liaison, une fois formée, est très stable.
2. Les chaînes peptidiques et leur nomenclature
• Les chaînes peptidiques sont vectorisées : les liaisons peptidiques attachent les acides aminés dans un ordre spécifique.
• Les aminoacides engagés dans une chaîne peptidique sont appelés résidus. Leur nom est celui de l'aminoacide auquel on ajoute le suffixe « yl ».
• Les deux aminoacides aux extrémités de la chaîne sont appelés : N-terminal pour celui qui a sa fonction aminée libre et C-terminal pour celui qui a sa fonction COOH libre.
• On numérote les aminoacides en écrivant l'enchaînement de gauche à droite à partir de l'extrémité N-terminal.
Objectifs
Maitriser la structure d’un peptide
Connaitre la nomenclature d’un peptide
Connaitre les différentes méthodes de détermination de la structure d'un peptide : méthodes chimique et enzymatique.
3 3. Classification des peptides
On distingue trois types de peptides :
3.1. Peptide formé d'une seule chaîne (monocaténaire) et linéaire
3.2. Peptide formé d'une seule chaîne (monocaténaire) et cyclique
Une liaison covalente (pont S-S) intra-chaines est présente et réalisée par l’oxydation de deux fonctions thiol de deux cystéines.
3.3. Peptide formé de plusieurs chaînes (polycaténaire)
Une liaison covalente (pont S-S) inter-chaines est présente et réalisée par l’oxydation de deux fonctions thiol de deux cystéines appartenant à deux chaines peptidiques différentes.
4. Détermination de la structure d'un peptide
La détermination de la structure primaire d'un peptide est conduite en deux étapes : Détermination de la composition en aminoacides.
Détermination de l'ordre des enchaînements des résidus. 4.1. Hydrolyse chimique complète
C’est une hydrolyse acide à chaud (HCl 6 N à 105° pendant 24 à 72 heures) pour séparer et déterminer les différents types d’acides aminés constitutifs des polypeptides.
L’hydrolyse acide coupe les liaisons peptidiques, détruit le tryptophane (Trp) et ne distingue pas entre (l’acide aspartique « Asp » et l’Asparagine « Asn ») et (l’acide glutamique « Glu » et Glutamine « Gln ») avec libération d’ammoniac. Signalons qu’à l’inverse, l’hydrolyse alcaline par chauffage conduit à la destruction de tous les AA excepté le Trp.
4 4.2. Hydrolyse chimique spécifique
Certains réactifs hydrolysent une liaison peptidique avec une spécificité sur un des aminoacides participant à la liaison. Il s’agit de :
4.2.1. Bromure de cyanogène (BrCN) : hydrolyse la liaison peptidique du côté carboxyle de la méthionine.
4.2.2. Le 2-nitro-5-thiocyanobenzoate (NTCB) : hydrolyse la liaison peptidique du côté amine de la cystéine.
4.2.3. Détermination de l’AA N-terminal d’un peptide :
Méthode de SANGER au DNFB (2,4 dinitro- fluorobenzène)
Le DNFB se fixe sur l’acide aminé N-terminal, qui porte une fonction NH2 libre.
Après hydrolyse au HCl, tous les AA sont libres, et l’acide aminé N-terminal est sous forme de DNP-AA (dinitrophényl-AA).
Méthode au chlorure de dansyle (dansylation)
Le chlorure de dansyle forme avec l’acide aminé N-terminal un dérivé dansylé qui se libère après hydrolyse sous forme de Dansyl-AA très fluorescent.
Méthode d’EDMAN au PITC (phénylisothiocyanate)
Le phénylisothicyanate (PITC) réagit avec la fonction aminée N-terminal pour donner un complexe qui, après action d’un acide dans des conditions douces libère une phénylthihydantoine (PTH-AA).
La réaction est renouvelée avec le reste du peptide : le PITC détache successivement chaque AA, à partir de l’extrémité N-terminal, c’est une méthode soustractive qui permet la détermination d’une séquence en AA d’un peptide ayant jusqu’à 20 AA.
5 4.2.4. Détermination du C-terminal d’un peptide
L’hydrazinolyse
L’hydrazine à 100 °C permet de rompre les liaisons peptidiques ; tous les résidus sont transformés en hydrazides sauf le résidu C-terminal reste sous forme d’AA libre.
6 4.3. Hydrolyse enzymatique
L'hydrolyse des liaisons peptidiques peut être réalisée par des enzymes protéolytiques (protéases ou encore peptidases)
4.3.1. Exopeptidase
L’enzyme n’hydrolyse que la 1er
liaison peptidique (aminopeptidase), ou la dernière liaison peptidique (carboxypeptidase) en libérant l’aminoacide terminal.
4.3.2. Endopeptidase
L'enzyme hydrolyse des liaisons peptidiques internes entre deux aminoacides i, (i+1). Il peut être spécifique du résidu en position i ou (i+1).
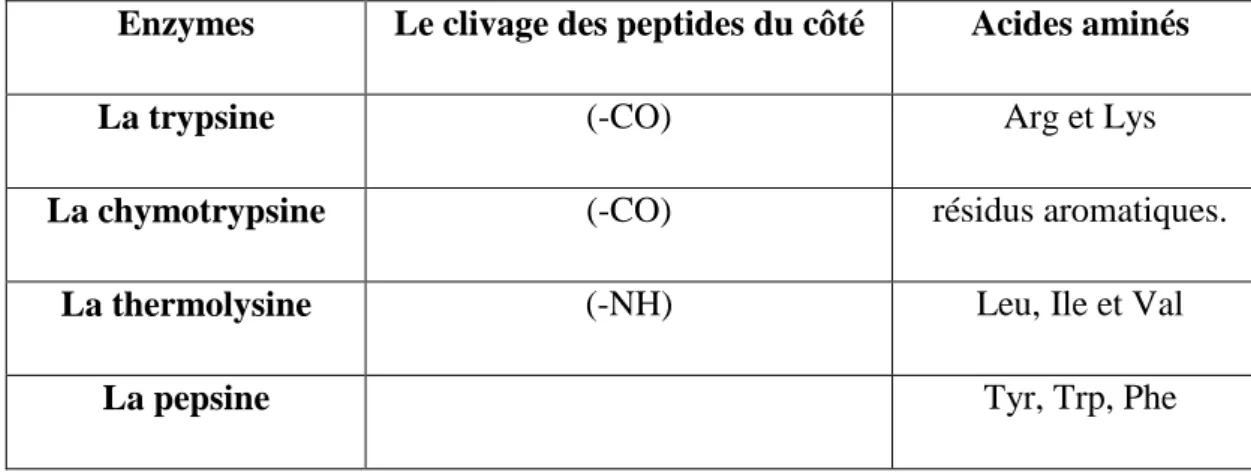
L'hydrolyse d'un peptide par une endopeptidase donnera plusieurs fragments peptidiques. Tableau N°04: Liste des principaux endopeptidases.
Enzymes Le clivage des peptides du côté Acides aminés
La trypsine (-CO) Arg et Lys
La chymotrypsine (-CO) résidus aromatiques.
La thermolysine (-NH) Leu, Ile et Val
La pepsine Tyr, Trp, Phe
7
EXERCICES
Exercice N°01
Donner les noms des peptides suivants : 1. Lys-Met-Ala-Gly.
2. Val-Ser-Gly. Exercice N°02
1- Écrire la formule développée plane du tétrapeptide: Asp-Gly- Glu-Arg. 2- Quelle est l’enzyme qui peut libérer l’Arg de ce peptide ?
Exercice N°03
Soit le pentapeptide suivant: Lys-Val-His-Glu-Met. 1. Écrire la formule chimique développée de ce peptide.
2. Étudier la variation de sa charge nette en fonction du pH et en déduire la valeur de son pH isoélectrique.
Données: pK des différents groupements ionisables.
pK1 pK2 pKR Histidine 1.82 9.17 6.00 Acide glutamique 2.19 9.67 4.25 Lysine 3.18 8.95 10.53 Methionine 2.28 9.21 Valine 2.32 9.62 Exercice N°04
Donner les résultats des traitements suivants :
Val-Leu-Asp-Arg + Thermolysine ………...…………..……… Leu-Phe-Arg-Lys-Met + Trypsine ………..…………..……… Met-Val-Trp-Tyr+ chymotrypsine ……….…………..……… Val-Phe-Trp-Asp-Pro + PITC + HCl ………..……… Phe-Val-Met-Arg-Leu + DNFB + HCl ………..……… Val-Leu-Arg-Asp + Dansylation + HCl ……….……… Val-Leu-Asp-Arg + action de Sanger+HCl ………..……….
8 Exercice N°05: Choisissez la bonne réponse
1. L'étude d'un pentapeptide donne les résultats suivants :
- Une hydrolyse acide (HCl 6N, 110° C, 48h) donne la composition suivante : Ala, Arg, Cys, Lys, Ser
- L'action de la trypsine donne un tripeptide et un dipeptide - L'action du DNFB sur le tripeptide donne le DNP-Ser
Parmi les séquences primaires suivantes, laquelle est compatible avec les séquences ci-dessous :
a. Ser-Arg-Cys-Lys-Ala b. Ser-Ala-Arg-Cys-Lys c. Ser-Lys-Ala-Arg-Cys Exercice N°06
Après hydrolyse trypsique de la protéine L7 de la grande sous-unité ribosomale d’Escerichia coli, on a isolé un oligopeptide P, dont la composition en acides aminés est : Lys1, Asx1, Thr1, Glx1, Val1, Leu1, Ile1, Phe1. La charge nette de P est (-1) à pH 6,5. Après action du chlorure de dansyl sur P, puis hydrolyse acide, on identifie la dansylthréonine. La carboxypeptidase détache successivement de P : Lys, Leu, Ile et Val. Quand P est hydrolysé par la chymotrypsine on obtient notamment un oligopeptide P’ dont la composition brute en acides aminés est : Asx1, Val1, Leu1, Ile1.
Quelle est la séquence de P ? Exercice N° 07
Soit un nanopeptide sujet à plusieurs analyses visant la détermination de sa séquence en acides aminés. A la lumière des résultats suivants, déduire la séquence du polypeptide. - Hydrolyse acide: (Ala2 , Arg , Lys2 , Met, Phe, Ser2);
- Digestion à la carboxypeptidase A: Ala;
- Digestion à la trypsine: (Ala, Arg), (Lys, Phe, Ser), (Lys), (Ala, Met, Ser) - Traitement au bromure de cyanogène: (Ala, Arg, Lys2 , Met, Phe, Ser), (Ala, Ser) - Digestion à la thermolysine: (Ala), (Ala, Arg, Ser), (Lys2 , Met, Phe, Ser)
9
CORRIGÉS
Exercice N°01 1. Lys-Met-Ala-Gly Lysyl-methionyl-alanyl-glycine 2. Val-Ser-Gly. Valyl-seryl-glycine Exercice N°021. La structure tétrapeptide: Asp-Gly- Glu-Arg H2N-CH-CO-NH-CH-CO-NH-CH-CO-NH-CH-COOH
CH2 H (CH2)2 (CH2)3
COOH COOH NH C=NH2
NH2
3- L’enzyme qui peut libérer l’Arg de ce peptide: c’est la Carboxypeptidase
Carboxypeptidase : c’est une exopeptidase qui catalyse le clivage (de façon séquentielle) des LP à partir de l’extrémité C-terminale.
Exercice N°03
1. La formule chimique développée de peptide:
2. Ordre de dissociation du pH le plus faible au pH le plus fort :
COOH de Met (pK1) > COOH radical de Glu (pK2) > NH radical de His (pK3) > NH2 de Lys
(pK4) > NH2 radical de Lys (pK5).
Le pHi du pentapeptide est la moyenne des pK qui entoure la forme à charge nette égale à
zéro, soit la moyenne de pK3 et pK4. Donc pHi= (6+8.95)/2=7.48
Exercice N°04
Les résultats des traitements suivants :
Val-Leu-Asp-Arg + Thermolysine Val+ Leu-Asp-Arg + Thermolysine Leu-Phe-Arg-Lys-Met + Trypsine Leu-Phe-Arg + Lys + Met + Trypsine Met-Val-Trp-Tyr+ chymotrypsine Met-Val-Trp + Tyr + chymotrypsine
10 Phe-Val-Met-Arg-Leu + DNFB + HCl DNP- Phe + Val-Met-Arg-Leu
Val-Leu-Arg-Asp + Dansylation + HCl Dansyl-Val+ Leu-Arg-Asp Val-Leu-Asp-Arg + action de Sanger+HCl DNP- Val+ Leu-Asp-Arg Exercice N°05
- L’hydrolyse acide : aboutit à un hydrolysat contenant les aminoacides : Ala, Arg, Cys, Lys, Ser
- La trypsine : endopeptidase catalyse le clivage des LP du côté (-CO) de Lys et Arg.
Dans la possibilité « b », on peut avoir un tripeptide (Ser-Ala-Arg) et un dipeptide (Cys-Lys) par l’action de trypsine.
- Le DNFB : se fixe sur l’extrémité N-terminal d’un peptide et détache, après hydrolyse acide, l’acide aminé N-terminal sous forme de DNP-acide aminé.
- L'action du DNFB sur le tripeptide donne le DNP-Ser : donc la Ser c’est me N-terminal de peptide.
- La séquence compatible pour le peptide c’est la séquence « b » : Ser-Ala-Arg-Cys-Lys. Exercice N°06
Pendant la détermination de la séquence primaire des peptides, l'hydrolyse acide totale à chaud peut provoquer:
* la rupture de toutes les liaisons peptidiques
* Trp est dégradé (sa présence peut être révélée par dosage de l'absorption à 280nm)
* Asn et Gln perdent leurs amines de leurs groupements amides; on distingue alors Asp et Glu c'est la dernière action du HCl qui nous intéresse dans cet exercice: car Asx et Glx dans la composition du peptide sont des données qui laissent penser que ces 2 AA ne peuvent pas être connus au début: "est-ce qu'il s'agit de Asn et Gln ou bien de Asp et Glu", mais la phrase citée « la charge nette de P est (-1) à pH 6.5 », nous permet de savoir que le peptide aura dans sa composition des acides aminés extrêmement acides (Asp et Glu) qui lui confèrent cette charge -1.
Trypsine + L7 P (Lys1, Asx1, Thr1, Glx1, Val1, Leu1, Ile1, Phe1) - La trypsine : endopeptidase catalyse le clivage des LP du côté (-CO) de Lys. Charge nette de p à pH 6,5 = -1
11 - Le chlorure de dansyl forme avec l’aminoacide N-terminal un dérivé dansylé qui se libère après hydrolyse sous forme de Dansyl-aa très fluorescent. On en conclu que :
Thréonine est l’acide aminé N-terminal dans la séquence de P. Carboxypeptidase + P Lys, Leu, Ile et Val
- Carboxypeptidase : exopeptidase qui catalyse le clivage (de façon séquentielle) des LP à partir de l’extrémité C-terminale. On déduit que la séquence C-terminale de P est :
P = ………..Val-Ile-Leu-Lys
Chymotrypsine + P P’ (Asx1, Val1, Leu1, Ile1)
- La chymotrypsine endopeptidase catalyse le clivage des LP du côté (-CO) des résidus aromatiques (Phe) : donc
Phe---/Asx-Val-Ile-Leu
chymotrypsine
Puisque Thr est l’acide aminé N-terminal, et puisque la charge nette de P est-1, donc Asx et Glx ne peuvent être que Glu et Asp (confirmé par l’étude de distribution de charges à pH 6,5). P s’écrit :
(+1) NH+3 Thr - Glu - Phe - Asp - Val - Ile - Leu – Lys (+1) NH+3 et (-1) COO- (-1) COO- (-1) COO-
Exercice N°07
Nanopeptide : ce constitue par 9 acides aminés
- Hydrolyse acide: (Ala2 , Arg , Lys2 , Met, Phe, Ser2) ça donne 9 acides aminés donc aucun AA n’est détruit pas l’hydrolyse.
- Digestion à la carboxypeptidase A: c’est une exopeptidase qui catalyse le clivage (de façon séquentielle) des liaisons peptidiques à partir de l’extrémité C-terminale. Donc C-terminal = Ala. - Digestion à la trypsine: c’est une endopeptidase catalyse le clivage des liaisons peptidiques du côté (-CO) de : Arg et Lys. Ça donne :
a. (Ala, Arg), b. (Lys, Phe, Ser)
12 c. (Lys),
d. (Ala,Met,Ser).
Puisque le C terminal est un Ala donc on peut savoir le fragment qui vient à la fin du peptide C’est a ou d.
Mais puisque le ne contient pas d’Arg ni la lysine donc c’est le fragment -terminald C L’ordre de chaque peptide doit changer en sort que la Lys ou Arg sera le C-terminal.
a. (Ala- Arg), b. (Phe, Ser)-Lys), c. (Lys),
d. (Ser, Met -Ala)
De plus, la digestion à la trypsine indique qu'une Lys est situé du côté C-terminal de Lys ou Arg (libération d'une lysine avec la trypsine). Donc le fragment « C « est soit le 2eme soit le 3eme.
- Traitement au bromure de cyanogène donne deux peptides (Ala, Arg, Lys2 , Met, Phe, Ser), (Ala, Ser).
- Le bromure de cyanogène (BrCN) : hydrolyse la liaison peptidique du côté carboxyle de la méthionine. Donc cet acide aminé est le 1er de la chaine d.→(Met-Ser-Ala).
- Digestion à la thermolysine donne : (Ala), (Ala, Arg, Ser), (Lys2 , Met, Phe, Ser).
Ala+ Met,Ser+ 2Lys,1Ser,1Arg,1Ala,1Phe
La thermolysine coupe du côté N-terminal de résidus hydrophobes…donc avant Ala ou Met dans ce peptide.
Le Ala libéré tout seul est celui du d qui est le C-terminal
On tenant compte de ces deux fragments et les 4 qu’on avait au début on peut déduire l’ordre final :
Met, Ser + 2Lys,1Ser,1Arg,1Ala,1Phe
On peut donc déduire la position des résidus hydrophobes des deux fragments obtenus: Ala-(Arg, Ser) Phe-(Lys, Lys,)-Met-Ser +Ala
Avec cette dernière information et considérant la digestion à la trypsine, on peut conclure que la séquence du peptide est:
Ala-Arg-(Ser , Phe)-Lys-Lys-Met-Ser-Ala Ou bien
13 (Ser et Phe ) on peut pas savoir qui vient avant l’autre donc il faut les écrire entre ( ) séparé par une virgule.