Développement de matériaux à activité anti-biofilm de Candida albicans
Texte intégral
(2)
(3) Thèse réalisée au Laboratoire de Chimie et Microbiologie de l’Eau (LCME, UMR CNRS 6008). Equipe de Microbiologie de l’Eau IBMIG Université de Poitiers PBS, 1 rue Georges Bonnet 86022 Poitiers cedex. COFINANCEMENT.
(4)
(5) REMERCIEMENTS Ce projet pluridisciplinaire n’aurait pu aboutir sans l’aide de tous ces acteurs. La liste des remerciements est longue et ma reconnaissance énorme !. J’aimerai tout d’abord remercier les professeurs Bernard Legube et Jacques Frères, nos deux directeurs de laboratoire successifs, pour m’avoir accueillie dans leur laboratoire et pour m’avoir fait confiance en m’autorisant à mener ce projet de thèse passionnant. Je souhaite ensuite remercier Yann Héchard, notre directeur d’équipe pour son encadrement et sa volonté perpétuelle de faire évoluer et de dynamiser l’équipe. Un énorme merci, également au professeur Marie-Hélène Rodier, chef du service de parasitologie du CHU de Poitiers, pour m’avoir accueillie dans son service durant ma première année de thèse. Merci de m’avoir partagé ta vision médicale du projet.. J’aimerai remercier chaleureusement mes deux directeurs de thèse, Christine Imbert et Jean-Marc Berjeaud pour leur accompagnement, leur aide, leur écoute durant ces trois années. Merci de m’avoir fait profiter de votre expérience au jour le jour. Jean-Marc, je tiens à t’exprimer toute ma gratitude d’avoir toujours été là et de m’avoir prêté ton épaule, dans les moments les plus difficiles. Ton optimisme perpétuel et ta confiance ont été un vrai moteur. Quel bonheur de travailler dans ces conditions… que je vais certainement longtemps regretter.. Je ne serai jamais assez reconnaissante à l’égard de Frédéric Turpin, de chez Biocydex ; mon référent chimiste au quotidien. Merci pour tes réponses et tes explications, merci pour les nombreuses solutions que tu nous as permis de trouver, et bien entendu merci pour les cyclodextrines et leur synthèse..
(6) Merci également à Mme Claire-Marie Pradier de m’avoir accueillie au Laboratoire de Réactivité de Surface sur Paris, le temps d’une semaine d’initiation. Mille mercis également à Vincent Humblot, pour m’avoir formée à la technique de greffage sur plaques d’or et à leur analyse. Merci également d’avoir mené l’ensemble des analyses PM-IRRAS et XPS des surfaces fonctionnalisées. Le tout dans la joie et la bonne humeur. Merci également à Sébastien Papot et Thibaut Legigan du laboratoire synthèse et réactivité des substances naturelles (UMR 6514) pour la synthèse des différentes molécules dérivées du carvacrol. Merci également à Anne Cantereau, pour son assistance et pour la réalisation des photos de microscopie confocale.. Merci à Marie-Claude Martin pour sa présence essentielle au laboratoire. Merci de m’avoir permis de travailler dans de bonnes conditions : dans un laboratoire, avec une blouse et de la vaisselle propres... indispensables en microbiologie. Merci à Nathalie Ranger et Karine Demangeau pour leur aide pratique et logistique. Merci également à Estelle Cateau, l’étudiante en thèse me précédant pour son aide pratique à mon arrivée à l’hôpital, milieu qui ne m’était pas du tout familier. Merci également à toute l’équipe de techniciennes du service de parasitologie du CHU de Poitiers : Gyslaine, Michelle, Dominique et Marylène pour votre présence et votre aide qui m’ont été très précieuses durant ma première année de thèse. J’ai vraiment adoré discuter avec vous… Merci également à mes stagiaires Romain, Gilles, Anderson et Etienne, de m’avoir aidée à avancer dans mes travaux et à améliorer ma pédagogie..
(7) Enfin, merci à l’ensemble de mes collègues de tous les jours: chercheurs, thésards, post-docs, personnel Iatos de passage ou non… J’espère ne pas en oublier !! Adrienne alias Didi : ma coloc de bureau pendant deux ans, Charles, Christian, Christophe, Clémence J, Clémence L, Daniel, Emerancienne, Emilie F, Emilie P, Jean-Fabrice, Joelle J, Julien, Maïté, Matthieu, Mohamad, Nasma, Nadjet, Nawel, Nicolas, Renaud, Sadat, Taoufik, Thomas, Vanessa ainsi que l’ensemble des stagiaires qui sont passés par le laboratoire et l’ont animé.. Enfin « The last but not the least », merci à mes parents Odile et Hamza et à mes frères et sœur Safia, Ibrahim et Bilel pour m’avoir toujours encouragée et pour m’avoir donné tous les moyens d’arriver à terme de ce rêve d’enfant..
(8)
(9) Abstract Development of new materials that display anti-biofilm properties against Candida albicans Nosocomial infections associated to catheters are a real public health problem. Candida yeasts ranks fourth among the most frequently isolated microorganisms, responsible for infections. These hospital-acquired infections are often linked to the presence of a biofilm that is difficult to eradicate. As a consequence, the development of prevention strategies that avoid biofilm formation by inhibiting microorganism adherence is an interesting approach. Conception of functionalized surfaces with active molecules is an expanding research area. After demonstrating that common catheter materials do not inhibit C.albicans biofilm formation, different materials were coated with anidulafungin (ANF) or with thymol (THY) to study their anti-biofilm activity. This approach has been limited, as it depended on the nature of the material for ANF and was impossible to achieve for THY. The third part of the project consisted of developing functionalized gold surfaces with a cyclodextrin (RAMEB) that is able to immobilize ANF or THY through the formation of inclusion complexes. C.albicans adherence on these new surfaces was inhibited by more than 60% for the two molecules. The mode of action of the loaded surfaces was anti-adhesive for ANF and fungicidal for THY. The last part of the research study consisted of functionalizing gold surfaces by covalent bonding. The grafting of a synthetic molecule: an Ester of Carvacrol (EsC) enabled an inhibition of at least 80% of the number of viable and culturable adherent yeast cells on these surfaces through a fungicidal mechanism. Functionalized gold surfaces with cyclodextrins or EsC produced some interesting preliminary results that should be transposed to common catheter materials..
(10) Keywords : Adherence, Anidulafungin, Biofilm, Carvacrol, Cyclodextrins, Candida yeasts, Surface Functionalization, Thymol..
(11) Sommaire. SOMMAIRE LISTE DES ABRÉVIATIONS..................................................................................................................... 1 LISTE DES FIGURES ................................................................................................................................ 3 LISTE DES TABLEAUX ............................................................................................................................. 8 INTRODUCTION GENERALE ..................................................................................................................... 9 PARTIE 1 : ETUDE BIBLIOGRAPHIQUE ............................................................................................... 15. Chapitre I : Infections nosocomiales associées aux Dispositifs Médicaux Implantés ............................. 16 I.. Intérêt thérapeutique des cathéters ................................................................................................ 18. II.. Cathéters en chiffres .................................................................................................................. 19. III.. Microorganismes colonisateurs des cathéters à l’origine d’infections ........................................ .................................................................................................................................................. 19. IV.. Difficultés thérapeutiques actuelles associées aux infections liées aux cathéters ................... 21. IV.1. Limites du diagnostic et du traitement.................................................................................... 21. IV.2. Problématiques liées à la diversité des cathéters ................................................................... 22. IV.2.a.. Cathéters urinaires versus cathéters intra-vasculaires ...................................................... 23. IV.2.b.. Cathéters sur le court terme versus cathéter sur le long terme ......................................... 23. IV.2.c.. Cathéters tunnelisés versus cathéters non tunnelisés ....................................................... 24. IV.2.d.. Nombre de lumières du cathéter ...................................................................................... 24. IV.2.e.. Variété de matériaux constitutifs des cathéters ................................................................ 25. IV.2.f.. Influence du site d’insertion sur les taux d’infection........................................................ 25. IV.3 V.. Autres facteurs d’influence ..................................................................................................... 26 Conséquences des infections fongiques liées aux cathéters ..................................................... 26. Chapitre II: Biofilms de Candida albicans ............................................................................................... 29 I.. Présentation de Candida albicans ................................................................................................. 29. II.. Biofilms de Candida albicans ................................................................................................... 33. II.1. Définition d’un biofilm ........................................................................................................... 33. II.2. Etapes successives de la formation des biofilms .................................................................... 33. II.2.a.. Phase précoce d’adhérence ................................................................................................ 34. II.2.b.. Phase intermédiaire de croissance du biofilm ................................................................... 36. II.2.c.. Phase de maturation ........................................................................................................... 36. II.2.d.. Phase finale de dissémination............................................................................................ 36. II.3. Architecture des biofilms ........................................................................................................ 37. II.4. Régulation de la croissance des biofilms................................................................................ 39. II.4.a.. Facteurs environnementaux ............................................................................................... 39.
(12) Sommaire II.4.b.. Régulation génétique ......................................................................................................... 39. II.4.c.. Communication intercellulaire : « quorum sensing » ........................................................ 40. II.5. Intérêt de la croissance sous la forme de biofilms.................................................................. 40. II.5.a.. Protection des microorganismes du biofilm ...................................................................... 40. II.5.b.. Résistance aux agents antifongiques ................................................................................. 41. II.5.c.. Stratégie pour la dissémination de microorganismes pathogènes ...................................... 42. III.. Adhérence de Candida albicans ............................................................................................... 43. III.1. Facteurs non spécifiques influençant l’adhérence ................................................................. 44. III.1.a.. Hydrophobie cellulaire ..................................................................................................... 44. III.1.b.. Facteurs liés à la surface du matériau .............................................................................. 44. III.1.c.. Influence du film de conditionnement protéique se formant sur les surfaces .................. 45. III.2. Facteurs spécifiques : les adhésines ....................................................................................... 46. Chapitre III : Les stratégies actuelles de prévention des infections liées aux cathéters .......................... 48 I.. Bonnes pratiques hospitalières ...................................................................................................... 48. II.. Thérapie « verrou » ou stratégie « lock » .................................................................................. 49. III.. Conception de matériaux antimicrobiens ................................................................................. 50. III.1. Optimisation des caractéristiques physico-chimiques des matériaux .................................... 50. III.2. Matériaux permettant une libération de la substance active .................................................. 52. III.2.a.. Cathéters antimicrobiens commercialisés ........................................................................ 54. III.2.b.. Approche en développement à base d’hydrogel antimicrobien ....................................... 60. III.3. Fonctionnalisation de surface par greffages covalents .......................................................... 61. III.4. Autres conceptions innovantes de surfaces antimicrobiennes ................................................ 62. Chapitre IV : Les molécules d’intérêt du projet ........................................................................................ 65 I.. L’anidulafungine : l’agent antifongique modèle .......................................................................... 65 I.1. Structure chimique & synthèse de l’anidulafungine ................................................................... 65. I.2. Indications thérapeutiques et spectre d’action ........................................................................... 66. I.3. Mécanisme d’action .................................................................................................................... 67 I.3.a.. Composition de la paroi de Candida albicans ................................................................... 68. I.3.b.. Importance du (1,3) β D-glucane ....................................................................................... 69. I.3.c.. Ciblage de la (1,3) β D-glucane synthase .......................................................................... 70. I.3.d.. Conséquences délétères sur la cellule de l’inhibition de la synthèse du 1,3-β-D-glucane . 71. I.4. Résistances associées aux échinocandines ................................................................................. 72. II.. Deux terpènes naturels : le thymol et le carvacrol .................................................................... 73. II.1. Composants d’huiles essentielles ........................................................................................... 73. II.2. Différents mécanismes d’action possibles .............................................................................. 74. II.2.a.. Déstabilisation des membranes fongiques ......................................................................... 75. II.2.b.. Inhibition d’H+ ATPases .................................................................................................. 75. II.2.c.. Inhibition de la synthèse de l’ergostérol ............................................................................ 76.
(13) Sommaire II.2.d.. Inhibition de la filamentation de Candida albicans .......................................................... 76. II.2.e.. Autres mécanismes d’action potentiels ............................................................................. 76. III.. Les molécules hôtes : les cyclodextrines ................................................................................... 77. III.1. Nomenclature ......................................................................................................................... 77. III.1.a.. Cyclodextrines naturelles ................................................................................................. 77. III.1.b.. Cyclodextrines dérivées ................................................................................................... 79. III.2. Capacité des cyclodextrines à former des complexes d’inclusion .......................................... 80. III.2.a.. Mécanismes de formation des complexes d’inclusion ..................................................... 80. III.2.b.. Intérêts de la complexation .............................................................................................. 81. III.3. Considérations réglementaires & sécuritaires ....................................................................... 82. PARTIE 2 : MATERIELS ET MÉTHODES .............................................................................................. 85. CHAPITRE I : Analyses préliminaires...................................................................................................... 86 I.. Milieux de culture, réactifs et matériels ........................................................................................ 86. II.. Dosage de l’anidulafungine, du thymol et du carvacrol par HPLC......................................... 87. II.1. Paramètres de l’étude HPLC ................................................................................................. 87. II.2. Tracé des courbes d’étalonnage ............................................................................................. 87. II.2.a.. Anidulafungine .................................................................................................................. 87. II.2.b.. Thymol et Carvacrol.......................................................................................................... 88. III.. Etude de la Concentration minimale Inhibitrice (CMI) des différentes molécules d’intérêt .. 88. III.1. CMI de l’anidulafungine ........................................................................................................ 89. III.1.a.. Microorganismes de l’étude ............................................................................................. 89. III.1.b.. Préparation des suspensions microbiennes ...................................................................... 89. III.1.c.. Réalisation de la gamme de dilutions de l’anidulafungine ............................................... 90. III.2. CMI du thymol et du carvacrol............................................................................................... 91. III.3. CMI des cyclodextrines .......................................................................................................... 92. IV.. III.3.a.. Cyclodextrines sélectionnées ........................................................................................... 92. III.3.b.. Gamme de dilutions en cyclodextrines ............................................................................ 92. Etude de l’activité anti-biofilm des différentes molécules d’intérêt ......................................... 93. Chapitre II : Croissance de biofilms de Candida ...................................................................................... 96 I.. Croissance de biofilms en statique ................................................................................................. 96 I.1. I.2. II.. Croissance de biofilms sur sections de cathéters en silicone 100% ........................................... 96 I.1.a.. Préparation des sections de cathéters ................................................................................. 96. I.1.b.. Croissance des biofilms...................................................................................................... 96. Croissance de biofilms sur des matériaux usuels des cathéters .................................................. 97 I.2.a.. Surfaces de croissance........................................................................................................ 97. I.2.b.. Croissance des biofilms...................................................................................................... 98. I.2.c.. Nettoyage et recyclage des coupons ................................................................................... 98. Influence de différents paramètres environnementaux sur la croissance de biofilms ............ 98.
(14) Sommaire II.1. Influence de l’inoculum sur la croissance de biofilms............................................................ 98. II.2. Plan d’expériences ................................................................................................................. 99. III.. Essais préliminaires de la croissance de biofilms de C. albicans sous flux ........................... 102. III.1. Montage du système ............................................................................................................. 102. III.2. Observation en microscopie confocale................................................................................. 104. Chapitre III : Matériaux antifongiques par imprégnation ..................................................................... 105 I.. Activité anti-biofilm de microplaques de polystyrène imprégnées d’anidulafungine ou de thymol ....................................................................................................................................................... 105. II.. Activité anti-biofilm de sections de cathéters en silicone imprégnés d’anidulafungine ........ 106. III.. Activité anti-biofilm de disques imprégnés d’anidulafungine ................................................ 107. Chapitre IV : Etude de la complexation des molécules d’intérêt à des cyclodextrines .......................... 108 I.. Solubilisation des molécules d’intérêt par différentes cyclodextrines ........................................ 108. II.. Diagrammes de solubilité de phases ........................................................................................ 109. III.. Etude des activités antifongiques (CMI) et anti-biofilms de l’ANF, du THY et du CAR. complexées aux cyclodextrines sélectionnées ..................................................................................... 110 III.1. Complexation des molécules ................................................................................................ 110. III.2. Etude de la CMI ................................................................................................................... 111. III.3. Etude de l’activité anti-biofilm ............................................................................................. 111. Chapitre V : Fonctionnalisation de plaques d’or .................................................................................... 112 I.. Etapes communes aux différentes stratégies de greffage sur plaques d’or ................................ 112 I.1. Nettoyage et préparation des plaques d’or ............................................................................... 112. I.2. Formation de monocouches auto-assemblées de thiols ............................................................ 112. I.3. Vérification des différentes étapes de fonctionnalisation par PM-IRRAS et XPS ..................... 113 I.3.a.. Conditions d’analyses au PM-IRRAS .............................................................................. 114. I.3.b.. Conditions expérimentales pour l’analyse XPS ............................................................... 114. I.4. Etude de l’adhérence C. albicans sur des plaques d’or ............................................................ 115 I.4.a.. Adhérence des levures...................................................................................................... 115. I.4.b.. Dénombrement sur milieu gélosé ..................................................................................... 115. I.4.c.. Microscopie confocale ..................................................................................................... 116. II.. Greffage covalent au MUA d’une cyclodextrine aminée (RAMEB-NH2) complexée au thymol. ou à l’anidulafungine .......................................................................................................................... 117 II.1. Greffage de la RAMEB-NH2 au thiol MUA .......................................................................... 117. II.2. Complexation de l’Anidulafungine ou du thymol à la RAMEB fixée à la plaque d’or ......... 119. III.. Fonctionnalisation par estérification du thymol..................................................................... 120. IV.. Fonctionnalisation par greffage covalent d’un « ester de Carvacrol » aminé....................... 120. PARTIE 3 : RESULTATS & DISCUSSION ............................................................................................. 123.
(15) Sommaire Chapitre I : Croissance de biofilms de Candida ..................................................................................... 124 I.. Croissance de biofilms de Candida sur des sections de cathéters .............................................. 124. II.. Croissance de biofilms sur les matériaux les plus usuels des cathéters ................................. 126. III.. Etude de l’influence de paramètres environnementaux sur la croissance des biofilms ........ 128. III.1. Influence de l’inoculum sur la croissance de biofilms.......................................................... 128. III.2. Influence de différents paramètres environnementaux sur la croissance de biofilms .......... 129. IV.. Premiers essais de croissance de biofilms sous flux ............................................................... 132. Chapitre II : Conception de matériaux antifongiques par imprégnation ............................................... 140 I.. Imprégnation de microplaques avec de l’anidulafungine ou du thymol .................................... 140 I.1. Imprégnation d’anidulafungine ................................................................................................ 141. I.2. Imprégnation de thymol ............................................................................................................ 144. II.. Imprégnation de sections de cathéter avec de l’anidulafungine ............................................ 146. III.. Matériaux usuels des cathéters imprégnés d’anidulafungine ................................................ 147. Chapitre III : Immobilisation de molécules antifongiques par formation de complexes d’inclusion avec des cyclodextrines ..................................................................................................................................... 150 I.. Publication.................................................................................................................................... 150. II.. Résultats complémentaires ...................................................................................................... 182. II.1. A propos des essais de solubilisation ................................................................................... 182. II.2. Diagrammes de solubilité de phases .................................................................................... 184. II.3. Etude de l’activité antifongique des molécules complexées ou non ..................................... 192. II.3.a.. CMI des cyclodextrines ................................................................................................... 192. II.3.b.. CMI de l’anidulafungine ................................................................................................. 192. II.3.c.. CMI du thymol et du carvacrol........................................................................................ 194. II.4. Etude de l’activité anti-biofilm des molécules complexées ou non....................................... 194. II.4.a.. Activité anti-biofilm des cyclodextrines .......................................................................... 194. II.4.b.. Activité anti-biofilm de l’anidulafungine ........................................................................ 195. II.4.c.. Activité anti-biofilm du thymol et du carvacrol .............................................................. 196. II.5. Importance des séries de sonication lors de la complexation de l’anidulafungine ou du thymol. aux plaques d’or fonctionnalisées avec la RAMEB ........................................................................... 197. Chapitre IV : Matériaux fonctionnalisés par greffage covalent ............................................................. 200 I.. Estérification du Thymol.............................................................................................................. 200. II.. Greffage d’un Ester de Cavracrol ........................................................................................... 200. II.1. Caractérisation des surfaces fonctionnalisées par spectroscopies PM-IRRAS et XPS ........ 203. II.2. Adhérence de C .albicans sur les plaques fonctionnalisées avec l’EsC ................................ 207. PARTIE 4 : CONCLUSION & PERSPECTIVES ................................................................................... 217 RÉFÉRENCES BIBLIOGRAPHIQUES ................................................................................................... 231.
(16) Sommaire ANNEXE ....................................................................................................................................................... 251 Compte rendu du plan d’expériences ....................................................................................................... 252.
(17) Liste des abréviations. LISTE DES ABRÉVIATIONS Als. Agglutinin like sequence. ANF. Anidulafungine. ANOVA. ANlysis Of VAriance. ATCC. American Type Culture Collection. Au. Or. CAR. Carvacrol. CD. Cyclodextrine. CDC. Center for Disease Control (and prevention). CMI. Concentration Minimale Inhibitrice. CoNS. Coagulase Negative Staphylococci. CVC. Cathéter Veineux Central. DMF. DiMéthylFormamide. DMIs. Dispositifs Médicaux Implantés. DMSO. DiMéthylSulfOxide. Eap1. Enhanced adhesion to polystyrene 1. EDC. N-(3-Diméthylaminopropyl)-N’-éthylcarbodiimide hydrochloride. EsC. Ester de Carvacrol. EtC. Ether de Carvacrol. FDA. Food and Drug Administration. Glc. Glucose. GNB. Gram Negative Bacilli. GPI-CWPs. Glycosyl-Phosphatidyl-Inositol Cell Wall Proteins. GRAS. Generally Regarded As Safe. HP-β-CD. Hydroxypropyl-β-Cyclodextrine. HPLC. High Performance Liquid Chromatography. Hwp1p. Hyphal wall protein 1. IHEM. Institut d’Hygiène et d’Epidémiologie-Mycologie. IP. Iodure de Propidium. MUA. 11-Mercapto-Undecanoic-Acid. NaCl. Chlorure de Sodium. PBS. Phosphate Buffered Saline. Développement de matériaux à activité anti-biofilm de Candida albicans. Page 1.
(18) Liste des abréviations. PEG. PolyÉthylène Glycol. PET. PolyÉthylèneTéréphtalate. PMMA. Polyéthyl-méthacrylate de Méthyle. PM-IRRAS. Polarisation Modulation-Infrared Reflection Absorption Spectroscopy. PP. Poly-Propylène. PTFE. PolyTétraFluoroÉthylène (Téflon). PVC. PolyVinylChloride. RAMEB. RAndomly MEthylated-β-Cyclodextrine. Re. Reynolds. RMN. Résonance Magnétique Nucléaire. Sabouraud GC. Sabouraud Glucose Chloramphénicol. SAMs. Self-Assembled Monolayers. SVF. Sérum de Veau Fœtal. TFA. TriFluoroAcétique. THY. Thymol. UFC. Unité Formant Colonie. XPS. X-Ray Photoelectron Spectroscopy. UHMW. Ultra High Molecular Weight. UV. Ultra-Violet. WASP. Whitley Automatic Spiral Plater. XTT. 2,3-Bis-(2-methoxy-4-nitro-5-sulfophenyl)-2H-tetrazolium-5carboxanilide salt. YNB. Yeast Nitrogen Base. Développement de matériaux à activité anti-biofilm de Candida albicans. Page 2.
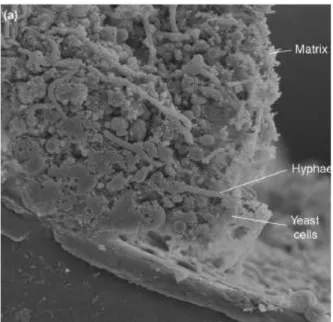
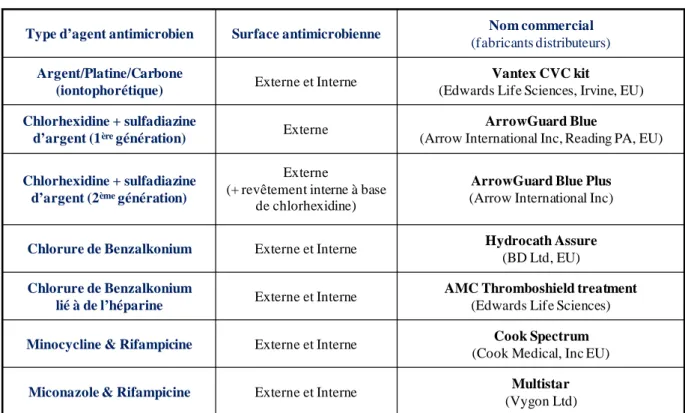
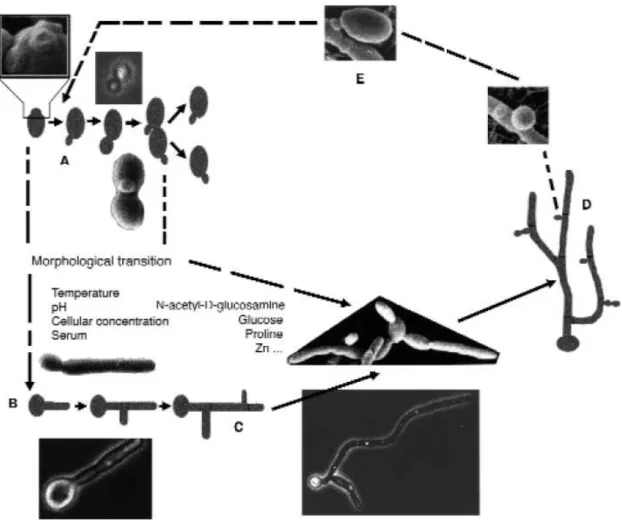
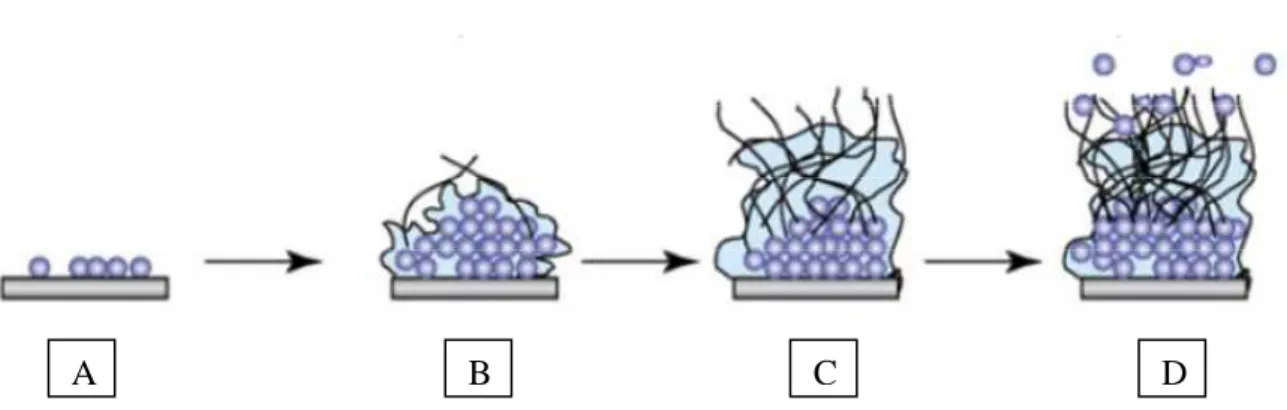
(19) Liste des figures. LISTE DES FIGURES Figure 1 : Principaux organismes pathogènes colonisateurs de dispositifs médicaux implantés (CoNS = Coagulase-Negative staphylococci ; GNB = Gram-negative bacilli) (Lynch and Robertson, 2008). ............................................................................................................................................................... 20 Figure 2 : Photo d’un Cathéter Veineux Central à deux lumières (Donlan, 2008). ...................... 25 Figure 3 : Microscopie électronique à balayage de biofilms d’une section d’un cathéter vasculaire contenant un biofilm de C. albicans. Le cathéter provient d’un système de modélisation de CVCs chez un rat (grossissement x 50) (Nett and Andes, 2006). ............................................................................ 28 Figure 4 : Observation en microscopie électronique à balayage de blastospores et d’hyphes de C. albicans (Garcia-Sanchez et al., 2004).................................................................................................. 30 Figure 5 : Schéma comparatif des principales formes morphologiques de C. albicans : les blastospores, les hyphes et les « pseudo-hyphes » (Berman and Sudbery, 2002). ................................ 31 Figure 6 : Cycle dimorphique de C. albicans et paramètres environnementaux d’influence (Molero et al., 1998). .............................................................................................................................................. 32 Figure 7 : Principales étapes de la formation d’un biofilm de C. albicans (Blankenship and Mitchell, 2006)...................................................................................................................................................... 34 Figure 8 : Observation en microscopie électronique des étapes de formation d’un biofilm. ............... 35 Figure 9 : Section transversale d’un biofilm de C. albicans à l’intérieur de la lumière d’un cathéter vasculaire implanté chez un rat (épaisseur supérieure à 200µM ; Grossissement x 1000) (Nett and Andes, 2006). ....................................................................................................................... 37 Figure 10 : Les deux molécules de quorum sensing isolées chez C. albicans : le farnésol (A) et le tyrosol (B )(Hogan, 2006). .................................................................................................................... 40 Figure 11 : Les différents types d’interactions mises en jeu dans l’adhérence en fonction de la distance qui sépare le microorganisme de la surface (Gottenbos, 2001). ............................................ 43 Figure 12 : Organisation commune en domaines des adhésines fongiques (Verstrepen and Klis, 2006). ............................................................................................................................................................... 46 Figure 13 : Immobilisation de molécules actives (Goddard and Hotchkiss, 2007).............................. 53. Développement de matériaux à activité anti-biofilm de Candida albicans. Page 3.
(20) Liste des figures Figure 14 : Schéma des différentes étapes de la fonctionnalisation d’une surface par greffage covalent (Goddard and Hotchkiss, 2007). ........................................................................................................... 62 Figure 15 : Structure chimique de l’anidulafungine (l’encart orangé représente la chaine lipidique secondaire alkoxytriphényl spécifique à l’ANF)(Saliba, 2010). ........................................................... 66 Figure 16 : Spectre d’action de l’anidulafungine sur les espèces de Candida spp et d’Aspergillus spp (d’après (Quindos and Eraso, 2008)..................................................................................................... 67 Figure 17 : Photographie en microscopie électronique de la paroi de C. albicans. Structure multicouches mise en évidence par microscopie immuno-électronique. Les différentes couches ont des densités en électrons variables (Chaffin, 2008). ................................................................................... 68 Figure 18 : Représentation schématique de la structure de la paroi de C. albicans (Kriznik et al., 2005)...................................................................................................................................................... 69 Figure 19 : Organisation des différents composants pariétaux fongiques (Odds et al., 2003) ............ 70 Figure 20 : Représentation schématique du complexe de la (1,3) β-D- glucane synthase et de quelques protéines impliquées dans la voie de régulation chez Saccharomyces cerevisiae (organisme modèle). La sous-unité Fks2 ne serait pas présente chez C. albicans (Denning, 2003)....................................... 70 Figure 21 : Photographies en microscopie électronique de cellules de C. albicans, suite à un traitement d’une heure par l’anidulafungine (CMI ou 4xCMI ; CMI = 0,015 mg/L) suivi d’une phase de repos de 8h en comparaison avec un témoin sans anidulafungine (0 x CMI) (Nguyen et al., 2009). ............................................................................................................................................................... 72 Figure 22 : Structures chimiques du thymol et du carvacrol (Bakkali et al., 2008). ............................ 74 Figure 23 : Impact d’une incubation de 24h en présence de thymol (2 x CMI de 125 mg/L) sur la croissance de biofilms de C. albicans. Photographies en microscopie électronique à balayage (grossissement x 1250) (Braga et al., 2008).......................................................................................... 76 Figure 24 : Structure, organisation et principales caractéristiques des CDs originelles (Brewster and Loftsson, 2007). ..................................................................................................................................... 78 Figure 25 : CDs parents et exemples des CDs dérivées les plus connues (Singh et al., 2002). ........... 80 Figure 26 : Amélioration des propriétés de pénétration des molécules grâce aux CDs (Challa et al., 2005)...................................................................................................................................................... 82 Figure 27 : Installation du réacteur CDC pour la production de biofilms sous flux. ........................ 103 Développement de matériaux à activité anti-biofilm de Candida albicans. Page 4.
(21) Liste des figures Figure 28 : Répartition des gammes de concentrations pour la réalisation des diagrammes de solubilité de phases. ............................................................................................................................ 109 Figure 29 : Schématisation du greffage du thiol MUA sur des plaques d’or (d’après (Humblot et al., 2009)). ................................................................................................................................................. 113 Figure 30 : Structure de la RAMEB-NH2. .......................................................................................... 118 Figure 31 : Plaque d’or fonctionnalisée avec le thiol MUA et la RAMEB (d’après (Humblot et al., 2009)). ................................................................................................................................................. 118 Figure 32 : Organisation finale des plaques d’or fonctionnalisées avec l’ANF ou le THY complexé à la RAMEB............................................................................................................................................ 119 Figure 33 : Estérification du thymol sur la plaque d’or. .................................................................... 120 Figure 34 : Ester de carvacrol aminé (A), Ether de carvacrol aminé (B) et dérivé phenylé aminé (C). ............................................................................................................................................................. 121 Figure 35 : Croissance de biofilms de différentes souches de Candida spp sur des sections de 5mm de cathéters en silicone 100% (n= 10) (évaluée par la méthode au XTT). .............................................. 125 Figure 36 : Croissance de biofilms de C. albicans ATCC 3153 sur différents matériaux usuels des cathéters (n=12) (évaluation par la méthode au XTT). ...................................................................... 126 Figure 37 : Influence de l’inoculum sur la croissance de biofilms de C. albicans ATCC 3153 de 24 ou 48 h dans des microplaques de 96 puits (Méthode au XTT) (n=10). .................................................. 129 Figure 38 : Organisation du réacteur CDC. ...................................................................................... 132 Figure 39 : Comparaison de la croissance de biofilms de C. albicans sur des disques en élastomère de silicone, sous flux dans le réacteur CDC ou dans des plaques de 24 puits statiques ou agitées (n = 12). ............................................................................................................................................................. 134 Figure 40 : Comparaison de la croissance des biofilms de C. albicans ADM Gfp sur disques en élastomère de silicone et en PVC dans le réacteur CDC (Méthode au XTT (A), (n=6 pour le silicone et n=3 pour le PVC) et microscopie confocale grossissement x 40 (B). ................................................. 136 Figure 41 : Activité anti-biofilm de C. albicans ATTC 3153, de microplaques en polystyrène imprégnées d’anidulafungine pendant 1h ou 17h à différentes concentrations et après lavage des puits. Plaques analysées immédiatement ou après 1 mois de conservation (Pourcentages d’inhibition après quantification par la méthode au XTT) (n = 30) ....................................................................... 141 Développement de matériaux à activité anti-biofilm de Candida albicans. Page 5.
(22) Liste des figures Figure 42 : Activité anti-biofilm de C. albicans ATTC 3153, de microplaques imprégnées de thymol pendant 1h ou 24h à différentes concentrations sans lavage des puits (Pourcentages d’inhibition après quantification par la méthode au XTT) (n = 30) ................................................................................. 144 Figure 43 : Activité anti-biofilm de Candida spp, de sections de cathéters en silicone 100% imprégnés d’anidulafungine pendant 17h. Lavage des disques après imprégnation et analyse immédiate de l’activité (Pourcentages d’inhibition après quantification par la méthode au XTT)( n = 10). ........... 146 Figure 44 : Activité anti-biofilm de C. albicans ATCC 3153 de différents matériaux imprégnés d’anidulafungine pendant 17h. Lavage des disques après imprégnation. Etude de l’activité antibiofilm immédiatement après imprégnation (Pourcentages d’inhibition après quantification par la méthode au XTT) (n= 4). ..................................................................................................................... 148 Figure 45 : Solubilisation du thymol et du carvacrol en présence de RAMEB et d’HP-β-CD. (Rapport initial CD/Terpène =2), avec une concentration de travail en terpène de 10mM. ............................. 183 Figure 46 : Représentations graphiques des différents profils de diagrammes de solubilité de phases (Brewster and Loftsson, 2007). ........................................................................................................... 185 Figure 47 : Diagrammes de solubilité de phases de l’ANF(A), du THY (B) et du CAR (C) en présence d’HP-β-CD (Concentration de la molécule solubilisée (mM) en fonction de la concentration en HP-βCD (mM)). ........................................................................................................................................... 187 Figure 48 : Diagrammes de solubilité de phases de l’ANF(A), du THY (B) et du CAR (C) en présence de RAMEB (Concentration de la molécule solubilisée (mM) en fonction de la concentration en RAMEB (mM))..................................................................................................................................... 188 Figure 49 : Diagrammes de solubilité de phases de l’ANF(A), du THY (B) et du CAR (C) en présence d’HP-β-CD (Ratio molaire (HP-β-CD/molécule solubilisée) en fonction de la concentration en HP-βCD (mM)). ........................................................................................................................................... 189 Figure 50 : Diagrammes de solubilité de phases de l’ANF(A), du THY (B) et du CAR (C) en présence de RAMEB (Ratio molaire (RAMEB/molécule) solubilisée en fonction de la concentration en RAMEB (mM)). .................................................................................................................................................. 190 Figure 51 : Impact des séries de sonication au cours de la complexation de l’ANF et du THY à la RAMEB fixée aux plaques d’or, sur l’activité des plaques fonctionnalisées sur C. albicans ATCC 3153 (Rapport (THY / RAMEB)= 20 ; Rapport (ANF / RAMEB)=1,5). ..................................................... 198 Développement de matériaux à activité anti-biofilm de Candida albicans. Page 6.
(23) Liste des figures Figure 52 : Présentation des différentes composantes de la molécule d’Ester de Carvacrol (EsC-NH2). ............................................................................................................................................................. 201 Figure 53 : Spectres PM-IRRAS comparatifs de plaques d’or fonctionnalisées avec l’Ester de Carvacrol (EsC) et témoin MUA. ........................................................................................................ 204 Figure 54 : Spectres XPS général de plaques d’or fonctionnalisées avec l’Ester de Carvacrol (EsC) et avec le MUA (témoin).......................................................................................................................... 205 Figure 55 : Spectres XPS haute résolution pour le carbone (A), l’Oxygène (B) et l’Azote (C) de plaques d’or fonctionnalisées avec l’EsC ou le MUA témoin. ............................................................ 206 Figure 56 : Observation en microscopie confocale de l’adhérence de C. albicans ATCC 3153 sur des plaques d’or fonctionnalisées avec l’EsC (Au-MUA-NH-EsC) (Grossissement x 20, double coloration Syto9 / IP). ........................................................................................................................................... 208 Figure 57 : Ester de carvacrol aminé (A), Ether de carvacrol aminé (B) et dérivé phenylé aminé (C). ............................................................................................................................................................. 210 Figure 58 : Observation en microscopie confocale de l’adhérence de C. albicans ATCC 3153 sur des plaques d’or fonctionnalisées avec les molécules Phe et EtC (Grossissement x 20, Double coloration Syto9 / IP). ........................................................................................................................................... 211 Figure 59 : Observation en microscopie confocale de l’adhérence de C. albicans ATCC 3153 sur des plaques d’or fonctionnalisées avec la molécule EsC : Analyse sur une nouvelle plaque fonctionnalisée et sur une plaque déjà utilisée (Grossissement x 20, double coloration Syto9 / IP). .......................... 214 Figure 60 : Calculs des coefficients du modèle polynomial et du test de Student pour la souche C. albicans ATCC 3153 ............................................................................................................................ 259 Figure 61 : Calculs des coefficients du modèle polynomial et du test de Student pour la souche C. albicans ADM Gfp ............................................................................................................................... 260. Développement de matériaux à activité anti-biofilm de Candida albicans. Page 7.
(24) Liste des tableaux. LISTE DES TABLEAUX Tableau 1 : Principaux CVCs antimicrobiens commercialisés au Royaume-Uni et aux Etats-Unis d’après (Casey et al., 2008). ................................................................................................................. 55 Tableau 2 : Références et origines des souches de levures étudiées. ................................................... 89 Tableau 3 : Matrice expérimentale du plan d’expériences. ................................................................ 100 Tableau 4 : Synthèse des concentrations en ANF ayant conduit à une inhibition supérieure à 90% de la croissance de biofilm de C. albicans ATCC 3153 sur des microplaques de polystyrène imprégnées. ............................................................................................................................................................. 142 Tableau 5 : CMIs de l’ANF obtenues expérimentalement pour les différentes souches de Candida spp et CMI de l’ANF complexée à la RAMEB ou à l’HP-β-CD. ............................................................... 193 Tableau 6 : Concentrations en ANF seule ou complexée aux CDs à partir desquelles, l’inhibition de la croissance de biofilms de plusieurs souches de Candida spp est supérieure à 85%. .......................... 195 Tableau 7 : Comparaison des pourcentages théoriques et expérimentaux des atomes de C, O, N et S. ............................................................................................................................................................. 205 Tableau 8 : Synthèse des observations de microscopie confocale de l’adhérence de C. albicans ATCC 3153 sur des plaques d’or fonctionnalisées avec l’EsC, le Phe ou l’Etc en comparaison avec le témoin MUA (Coloration kit de viabilité baclight®) ...................................................................................... 212 Tableau 9 : Synthèse des observations de microscopie confocale de l’adhérence de C. albicans ATCC 3153 sur des plaques d’or fonctionnalisées avec l’EsC : étude initiale ou répétition sur une plaque déjà étudiée, en comparaison avec le témoin MUA (Coloration kit de viabilité baclight®). ............. 215. Développement de matériaux à activité anti-biofilm de Candida albicans. Page 8.
(25) INTRODUCTION GENERALE. Développement de matériaux à activité anti-biofilm de Candida albicans. Page 9.
(26) Introduction générale. L’utilisation en routine de dispositifs médicaux implantés, notamment de cathéters, a connu un accroissement considérable depuis quelques décennies. Ces outils thérapeutiques jouent un rôle essentiel en assurant la survie et en améliorant le quotidien de millions de patients. Ces corps étrangers, dès leur insertion dans l’organisme, sont des substrats idéaux pour le développement de biofilms pouvant être à l’origine d’infections. Or, les malades qui ont le plus besoin de ces cathéters sont souvent immunodéprimés et présentent donc un terrain infectieux favorable. La majorité des infections nosocomiales, contractées à l’hôpital, liées aux cathéters, sont associées à la présence d’un biofilm. En effet, les microorganismes ont une tendance naturelle à se rassembler sous la forme de communautés denses et structurées, ancrées sur une surface et recouvertes d’une matrice extracellulaire. Les cellules des biofilms peuvent à tout moment, se disséminer et être à l’origine d’une septicémie mortelle. L’ « union faisant la force », ce mode de croissance confère aux microorganismes un certain degré de protection et de résistance aux thérapies médicamenteuses actuelles. Au cours de ces trente dernières années, l’incidence chez l’Homme des infections fongiques notamment à Candida, a augmenté de manière significative si bien qu’elles sont devenues aujourd’hui un vrai problème clinique et économique. Les infections à Candida présentent le taux de mortalité brut le plus élevé (> 40%) parmi toutes les infections vasculaires liées aux cathéters (Chandra et al., 2001). Ces levures sont capables d’adhérer et de former des biofilms sur la plupart des matériaux des cathéters. Une fois les biofilms formés, les cathéters sont souvent difficiles à traiter et leur retrait est en général nécessaire ; ce qui peut parfois rendre la situation du patient critique. Ces dernières années, les efforts de recherche en matière de prévention se sont beaucoup focalisés sur la conception de matériaux antimicrobiens. Pour atteindre cet objectif, plusieurs stratégies de modification peuvent être adoptées. Il est possible d’agir sur les caractéristiques physico-chimiques intrinsèques du matériau.. Développement de matériaux à activité anti-biofilm de Candida albicans. Page 10.
(27) Introduction générale. Des surfaces permettant une libération progressive de molécules actives peuvent également être conçues. Le chargement de la surface en principe actif peut alors se faire via un processus d’imprégnation, via une interaction ligand / récepteur ou par inclusion directement dans la matrice du matériau au cours de sa fabrication. Des agents actifs peuvent enfin être liés de manière covalente grâce à des chimies de greffage spécifiques. Les avancées technologiques ont conduit à la commercialisation et à l’utilisation de plus en plus répandue de cathéters antimicrobiens à base d’antibiotiques, d’agents microbicides ou d’antiseptiques (e.g Arrow Gard Blue®, Cook Spectrum®).. Le développement d’approches de prévention de la colonisation des dispositifs médicaux par des champignons et en particulier par des levures, a été peu étudié en comparaison avec les approches portant sur les bactéries. C’est ce constat qui a motivé, en partie, la réalisation de ce projet qui a pour objectif de mettre au point des matériaux antiCandida appliqués à la prévention des infections associées à la présence d’un cathéter. Il s’agissait de réaliser et d’étudier l’efficacité de ces nouveaux matériaux sur la croissance des biofilms d’un organisme modèle, C. albicans. Trois composés antifongiques ont été sélectionnés pour rendre les surfaces antibiofilm. Tout d’abord, un agent antifongique récent, reconnu pour son efficacité, l’anidulafungine (ANF) qui nous a été fourni par Pfizer, l’industriel partenaire du projet. Cette molécule appartient à la classe des échinocandines et inhibe la synthèse du 1,3 β-D-glucane, une cible pariétale spécifique aux levures. Ensuite, deux terpènes, le thymol (THY) et le carvacrol (CAR) aux propriétés antibactériennes, antiseptiques et même antifongiques qui agissent en déstabilisant la membrane du microorganisme cible. Ces deux composés phénoliques s’inscrivent dans la volonté actuelle d’exploiter au mieux les propriétés de composés naturels.. Développement de matériaux à activité anti-biofilm de Candida albicans. Page 11.
(28) Introduction générale. Objectifs de l’étude. La première partie de ce travail a porté sur l’évaluation de la capacité de Candida à former des biofilms sur les matériaux usuels des cathéters. Un plan d’expériences a ensuite été réalisé afin d’évaluer l’influence de plusieurs paramètres environnementaux sur la croissance des biofilms de Candida. La production de biofilms sous flux dans le réacteur CDC a également été initiée.. Les approches expérimentales de fonctionnalisation de surfaces mises au point et développées au cours de ce projet ont été de trois sortes. La première stratégie, dite d’imprégnation, a consisté à adapter aux trois molécules de l’étude, la technique de conception de surfaces antimicrobiennes la plus courante. Plusieurs matériaux ont été immergés dans des solutions d’ANF ou de THY et la croissance de biofilms de Candida sur ces surfaces a été ensuite été étudiée. La persistance de l’activité de ces matériaux imprégnés a également été analysée. La seconde stratégie a reposé sur la complexation entre la cavité hydrophobe de cyclodextrines (CD) et des molécules peu solubles dans l’eau, en prenant pour modèles l’ANF et les deux terpènes. La formation de complexes d’inclusion se traduit par une meilleure solubilisation des molécules et, probablement, par une meilleure stabilité et une diminution de la volatilité des terpènes. Deux hypothèses sont associées à cette stratégie. Tout d’abord, lorsque les surfaces fonctionnalisées seront immergées dans des milieux aqueux comme le sang, l’ANF et les terpènes vont présenter une plus grande affinité pour la CD que pour le milieu externe.. Développement de matériaux à activité anti-biofilm de Candida albicans. Page 12.
(29) Introduction générale. Ensuite, le(s) récepteur(s) pariétal (aux) de C. albicans pour l’ANF ou les terpènes aura plus d’affinité pour ces molécules que pour la CD qui les héberge, permettant ainsi la libération contrôlée et progressive de ces principes actifs uniquement en présence de C. albicans, et donc l’action prolongée de ces surfaces contre les levures. Il s’agissait ici de mettre au point un prototype sur des plaques d’or et d’en étudier l’efficacité antifongique. Cette partie des travaux a été réalisée en plusieurs étapes : la sélection de deux CDs candidates, la confirmation de la formation des complexes d’inclusion par établissement des diagrammes de solubilité de phases, la vérification des activités antifongiques et anti-biofilm des molécules complexées, la fonctionnalisation des plaques d’or avec une CD adaptée à la chimie de greffage, la caractérisation des surfaces fonctionnalisées. par. spectroscopies. PM-IRRAS. (« Polarisation. Modulation-Infrared. Reflection Absorption Spectroscopy ») et XPS (« X-Ray Photoelectron Spectroscopy ») et enfin l’étude de l’adhérence de C .albicans sur ces surfaces par dénombrement des cellules cultivables adhérées et par microscopie confocale. L’immobilisation covalente sur plaques d’or du THY ou d’un « Ester de Carvacrol » (EsC) a enfin été testée. L’adhérence de C. albicans sur ces surfaces fonctionnalisées a été étudiée par dénombrement et par microscopie confocale. L’EsC, spécifiquement synthétisé pour le projet, associe le CAR à une structure originale via une liaison ester clivable par les estérases des levures, permettant au CAR d’être libéré pour agir.. Développement de matériaux à activité anti-biofilm de Candida albicans. Page 13.
(30) Introduction générale. Développement de matériaux à activité anti-biofilm de Candida albicans. Page 14.
(31) PARTIE 1 : ETUDE BIBLIOGRAPHIQUE. Développement de matériaux à activité anti-biofilm de Candida albicans. Page 15.
(32) Etude bibliographique : Infections nosocomiales associées aux dispositifs médicaux implantés. CHAPITRE I : INFECTIONS NOSOCOMIALES ASSOCIEES AUX DISPOSITIFS MEDICAUX IMPLANTES Les infections liées à des Dispositifs Médicaux Implantés (DMIs) ont été rapportées dès le XIVème siècle (e.g premières prothèses dentaires) (Tamilvanan et al., 2008). L’insertion temporaire ou permanente de DMIs est devenue essentielle dans la thérapeutique médicale moderne (Nava-Ortiz et al., 2010). Environ un citoyen sur cinq aux Etats-Unis sera porteur d’un DMI au cours de sa vie (Wesenberg-Ward et al., 2005). De nombreux DMIs peuvent être utilisés comme : -. les différentes sortes de cathéters urinaires ou vasculaires (Ramage et al., 2001),. -. les stents (Ramage et al., 2001),. -. les prothèses (vocales, de genou, les valves cardiaques…) (Ramage et al., 2001),. -. les implants (lentilles, mammaires, dentaires…) (Ramage et al., 2001),. -. les nombreux dispositifs urologiques et intra-utérins (Donlan, 2001b, Kumar and Prasad, 2006),. -. les tubes endo-trachéaux (Donlan, 2001b, Ramage et al., 2006),. -. ou les pacemakers (Ramage et al., 2001)…. Les DMIs sont une aide précieuse pour améliorer certaines fonctionnalités altérées, pour remplacer des structures anatomiques et même pour maintenir en vie plus longtemps des patients immunodéprimés présentant un risque infectieux élevé (Kumamoto and Vinces, 2005, Trautner and Darouiche, 2004a). La médecine moderne permet désormais de soigner des patients atteints de maladies qui étaient auparavant considérées comme incurables (Trautner and Darouiche, 2004a).. Développement de matériaux à activité anti-biofilm de Candida albicans. Page 16.
(33) Etude bibliographique : Infections nosocomiales associées aux dispositifs médicaux implantés. Cette évolution de la thérapeutique est associée à l’émergence et à la multiplication de cas cliniques d’immunosuppression liés par exemple : -. à l’expansion du SIDA (Eschenauer et al., 2007, Sabol and Gumbo, 2008),. -. à l’introduction de thérapies immunosuppressives et agressives (chimiothérapie, radiothérapie,. aux. transplantations. d’organes. ou. de. cellules. souches. hématopoïétiques) (Eschenauer et al., 2007, Sable et al., 2008), -. à l’utilisation d’antibiotiques à très large spectre qui peuvent éliminer la flore normale protectrice (i.e intestinale ou vaginale) (Baillie and Douglas, 1998, Pierce et al., 2008),. -. à la mise au point de la nutrition parentérale (Pierce et al., 2008, Ramage et al., 2009),. -. à la naissance de grands prématurés (Pierce et al., 2008). -. ou au développement de procédures chirurgicales de plus en plus invasives associées à des durées d’hospitalisation plus longues (Baillie and Douglas, 1998).. D’autres facteurs de prédisposition viennent s’ajouter à cette liste comme le diabète ou le vieillissement de la population (Ramage et al., 2001). La multiplication des infections dites nosocomiales a été concomitante à l’augmentation de l’utilisation de DMIs (Ramage et al., 2009). Plus de la moitié des infections nosocomiales seraient associées à la présence d’un DMI (Kojic and Darouiche, 2004, Kumamoto and Vinces, 2005). Une infection nosocomiale se définit comme une infection locale ou systémique qui apparait dans les quarante huit heures après l’admission du patient à l’hôpital et qui est le fruit de complications liées à la présence de pathogènes non présents lors de son entrée (Zingg et al., 2008). Etant donnée la très grande diversité des DMIs aussi bien en termes de fonctionnalités que de composition, nous allons focaliser cet exposé bibliographique sur un type particulier de DMI : les cathéters, qui sont un modèle de recherche au laboratoire (Cateau et al., 2008).. Développement de matériaux à activité anti-biofilm de Candida albicans. Page 17.
(34) Etude bibliographique : Infections nosocomiales associées aux dispositifs médicaux implantés. I.. Intérêt thérapeutique des cathéters. Les cathéters urinaires sont utilisés principalement pour mesurer la production d’urine pendant une intervention, pour éviter la rétention urinaire et contrôler l’incontinence urinaire (Donlan and Costerton, 2002). Les cathéters urinaires sont fabriqués principalement à partir d’élastomères de silicone ou de latex (Tenke et al., 2004).. Il existe différents types de cathéters intra-vasculaires : les cathéters périphériques (artériels et veineux) et les Cathéters Veineux Centraux (CVCs) (Raad et al., 2007). Lorsque l’accès veineux périphérique n’est pas possible, l’utilisation d’un CVC est requise (Merrer et al., 2006). Les cathéters intra-vasculaires sont utilisés : -. pour délivrer en continu des fluides (Donlan and Costerton, 2002), des produits sanguins (Donlan and Costerton, 2002), une médication (Edgeworth, 2009), une nutrition parentérale (Theaker, 2005),. -. pour infuser des cellules souches (Stevens et al., 2011),. -. pour mesurer en continu des paramètres hémodynamiques (pression artérielle) (Stevens et al., 2011),. -. ou pour fournir un accès veineux dans le cadre d’une hémodialyse (Donlan, 2008).. Une variété de matériaux polymériques, principalement le chlorure de polyvinyle (PVC), le PolyÉthylène Téréphtalate (PET), le PolyPropylène (PP), le téflon (PTFE), le polyuréthane et le silicone sont utilisés pour la fabrication de cathéters intra-vasculaires (Krishna et al., 2005, Polderman and Girbes, 2002). Le silicone et le polyuréthane sont les deux biomatériaux les plus utilisés pour ce type de cathéter (Amerasekera et al., 2009, Tal and Ni, 2008).. Développement de matériaux à activité anti-biofilm de Candida albicans. Page 18.
(35) Etude bibliographique : Infections nosocomiales associées aux dispositifs médicaux implantés. II. Cathéters en chiffres. Plusieurs millions de cathéters sont utilisés annuellement aux Etats-Unis (Kumamoto and Vinces, 2005). Il est estimé qu’entre 250 000 et 500 000 infections liées aux cathéters apparaissent chaque année aux Etats-Unis (Falk, 2008).. Trente pour cent des cathéters urinaires sont sujets à une infection (Kojic and Darouiche, 2004). Les infections urinaires sont la cause la plus courante d’infections nosocomiales (~ 40%) et 80% d’entre elles sont liées aux cathéters (Ha and Cho, 2006). Entre 30 et 80% des patients hospitalisés recevraient un cathéter intravasculaire périphérique pendant leur séjour à l’hôpital (Zingg and Pittet, 2009). Les données chiffrées sur les infections liées à ce type de cathéters ne sont pas connues (Edgeworth, 2009). Les CVCs présentent le risque infectieux le plus élevé de tous les DMIs (Donlan and Costerton, 2002). Un CVC sur vingt est infecté (Roe et al., 2008). Il est reconnu qu’un patient avec un CVC présente trois fois plus de risques de développer une septicémie qu’un patient sans CVC (Masuoka, 2004). Ces cathéters seraient responsables de 90% des infections du sang liées aux cathéters (Adal and Farr, 1996).. III. Microorganismes colonisateurs des cathéters à l’origine d’infections. Les bactéries comme les champignons peuvent provoquer une infection liée à des cathéters (Zimmerli and Sendi, 2011) (Figure 1).. Développement de matériaux à activité anti-biofilm de Candida albicans. Page 19.
Figure


Documents relatifs
Frequent occurrence of C. albicans at peri-implantitis sites, 7 inside port reservoirs of totally implantable vascular access devices, 1 and other titanium implants justifies
The effects of microscopic energy deposition in hot, dense plasmas and radiation transport in plasmas, on the interaction of ion beams with plane metal targets are investigated in
In these figures, the intensity plots along the ordinate are shown in arbitrary units, which are also normalized to unity either for the oscillator strengths or for the
Dans leur étude, ils se sont intéressés au standard de vie en Suisse dans une étude comparative avec d’autres pays européens (Allemagne, Autriche et Slovénie), ainsi
5.8.1 Évaluation avec les métriques : taux de reconnaissance et F-mesure Pour évaluer la performance de notre approche DCR-OL, les métriques d’évaluation uti- lisées dans
Conceptual framework of climate-smart reforestation: reforestation management contributes to the adaptation of society to climate variations (1) and climate change mitigation (2),
Verbal MWEs (VMWEs) are multiword expressions whose canonical form (see below) is such that: (i) its syntactic head is a
VERONIQUE Labeille, Le silence dans le roman: un élément de monstration Loxias, 18 mis en ligne le 04 septembre 2007.. Il ne voudrait pas léguer à sa progéniture ce mur honteux du