UNIVERSITÉ MOHAMMED V – AGDAL
FACULTÉ DES SCIENCES
Rabat
N° d’ordre 2381
THÈSE DE DOCTORAT Présentée par
Nom et Prénom : CAIDI
CAIDI
CAIDI Hayat
CAIDI
Hayat
Hayat
Hayat
Discipline : Biologie
Spécialité : Virologie –Biologie moléculaire
Titre :
SÉROLOGIE ET CARACTÉRISATION MOLÉCULAIRE DES SOUCHES
SÉROLOGIE ET CARACTÉRISATION MOLÉCULAIRE DES SOUCHES
SÉROLOGIE ET CARACTÉRISATION MOLÉCULAIRE DES SOUCHES
SÉROLOGIE ET CARACTÉRISATION MOLÉCULAIRE DES SOUCHES
DE LA RUBÉOLE AU MAROC ET IDENTIFICATION DU
DE LA RUBÉOLE AU MAROC ET IDENTIFICATION DU
DE LA RUBÉOLE AU MAROC ET IDENTIFICATION DU
DE LA RUBÉOLE AU MAROC ET IDENTIFICATION DU NOUVEAU
NOUVEAU
NOUVEAU
NOUVEAU
GÉNOTYPE 1g EN AFRIQUE.
GÉNOTYPE 1g EN AFRIQUE.
GÉNOTYPE 1g EN AFRIQUE.
GÉNOTYPE 1g EN AFRIQUE.
Soutenue le 10 septembre 2007Devant le jury Président :
Pr Abdelaziz BENJOUAD, Faculté des Sciences Rabat Examinateurs :
Pr Abdelkarim FILALI-MALTOUF, Faculté des Sciences Rabat Pr Rajae EL AOUAD, Faculté de Médecine/Directeur INH, Rabat Pr Saïd AMZAZI, Faculté des Sciences Rabat
Pr Abdelaziz SOUKRI, Faculté des Sciences Ain Chock, Casablanca
Pr Bachir KISSI, Laboratoire National de Contrôle de Médicaments Vétérinaires IAV Hassan II Rabat.
Je dédie cette thèse
À mon père, À ma mère
À mes frères et mes sœurs
AVANT PROPOS
Le présent travail a été réalisé au sein de l’UFR de Biochimie Immunologie (UFR SV99/07), dirigée par le Professeur Abdelaziz Benjouad dans le cadre d’une collaboration entre le laboratoire de Biochimie Immunologie (Pr Benjouad Aziz), le laboratoire d’Immunologie Virologie à l’Institut National d’Hygiène (Pr Rajae El Aouad) et, le laboratoire spécialisé Rougeole/ Rubéole du Centre de Contrôle et de Prévention des maladies CDC- Atlanta (Dr J. Icenogle).
Je remercie infiniment Pr Abdelaziz Benjouad d’avoir accepter d’encadrer ce travail, pour les discussions scientifiques enrichissantes et ses encouragements, ses précieuses connaissances dans le domaine, l’immensité de son savoir, la rigueur de son raisonnement, ses conseils et orientation m’ont été d’un grand aide pour mener a bien ce travail.
Qu’il trouve ici l’expression de ma respectueuse gratitude et ma vive reconnaissance. Je remercie énormément mon Directeur de thèse, le Professeur Rajae El Aouad, Directeur de l’Institut National d’Hygiènes pour l’intérêt qu’elle a accordé pour cette thèse. Pr R. El Aouad a suivi mes travaux avec intérêt constant et une confiance imperturbable en leurs réussites. Son savoir et ses talents multiples m’ont profondément inspiré tout au long de mon travail.
Qu’elle trouve ici l’expression de tout mon respect, le témoignage de ma sincère gratitude et l’expression de ma très grande considération.
J’exprime mes profonds remerciements au Dr Joseph Icenogle de m’avoir permis de réaliser ce travail au sein de son laboratoire (CDC Atlanta), de m’avoir fait profité de ses connaissances théorique et expérimental, pour ses conseils précieux et pour m’avoir fait confiance tout le long de cette thèse en me laissant orienter ce travail selon mes aspirations. J’exprime toute ma reconnaissance et mes remerciements les plus vifs.
Je tiens à remercier très sincèrement et tout particulièrement les membres du jury qui ont eu l’amabilité d’accepter cette tâche toujours quelque peu contraignante. Le travail présenté n’aurait pas abouti sans leur aide.
A mes rapporteurs qui ont du lire et relire la thèse pour établir un rapport critique, j’exprime toute ma reconnaissance et mes remerciements les plus vifs.
Je tiens à remercier Dr S. Smit du NICD (National Institute for Communicable Diseases, Johannesburg, Afrique du Sud, et Dr S.D.K Sempala, Uganda Virus Institute, Kampala, Ouganda, et aux autorités des Camps des Réfugiés, de l’Etat New Hampshire, USA pour leur collaboration.
Je tiens à remercier, également Dr William Bellini, Directeur du département Rougeole/Rubéole NCID CDC Atlanta.
Je tiens à remercier Dr Mark Papania, Dr Susan Reef, Dr John Glasser NIP/ CDC Atlanta, de m’avoir aidé dans l’analyse statistique des données épidémiologiques.
Je tiens à remercier également Mme Emily. S Alberathy, Dr Chen Min-Hsin, Dr Raydel Mair, Mme Yvonne Villamaro, Mme Qi Zheng, Dr Hong Son, CDC Atlanta pour leur aide et leur soutien et pour l’atmosphère plus qu’agréable qu’elles ont contribué à maintenir au sein du département tout au long de ce travail.
Je remercie beaucoup mes collègues du Département d’Immunologie Virologie qui, de près comme de loin m’ont aidé et encouragé aux moments opportuns. Je remercie également mes amies et particulièrement Dr Amal Alla et Dr Samira Senouci, Dr Amina Hançali pour leur amitié et leur soutien qu’elles n’ont cessé d’apporter tout au long de ce travail.
PUBLICATIONS
Hayat Caidi, Emily S. Abernathy, Abdelaziz Benjouad, Sheilagh Smit, S.D.K Sempala, Rajae El Aouad and Joseph Icenogle. Phylogenetic analysis of rubella viruses found in Morocco, Uganda Ivory Coast and South Africa from 2001 to 2004. Journal of Clinical Virology, Manuscript Number: JCV-S-06-00221. (Accepted- January
2007).
Hayat Caidi, Sharon Bloom, Mustapha Azilmaat, Abdelaziz Benjouad, Susan Reef and Rajae El Aouad. Rubella Seroprevalence among women 15-39 years of age,
Morocco, 2002. EASTERN MEDITERRANEAN HEALTH JOURNAL Date: 20 August 2006, EMHJ.8/314. R4/27/8, Manuscript No.: 06/434. In press (Accepted- December
2006).
Hayat. Caidi, Amal Alla, Emily S Abernathy, Abdelaziz Benjouad and Rajae El Aouad. Genomic analysis of Rubella viruses circulating in Morocco during measles
outbreaks 2005-2006. Soumis. Journal of Clinical Virology, Manuscript Number: JCV-S-06-00234. (Marsh 2007).
H. Caidi, Fares, A. Alla, A. Laskri, A.Benjouad, A and El Aouad R. Avidity assay for
distinguishing between primary and secondary immune response to Rubella infection in pregnant women in Morocco. Soumis, EASTERN MEDITERRANEAN HEALTH JOURNAL, 19 February 2007 EMHJ.9/316, R4/27/9, Manuscript No.: 06/481.
COMMUNICATIONS INTERNATIONALES
Hayat Caidi, Emily Abernathy, Min-Hsin Chen, Hong Sun, Qi Zheng, Shigetaka Katow and Joseph Icenogle. Characterization of a new Genotype 1g in Uganda and
Ivory Coast.
Rubella and CRS Elimination in the Unites States of America. November 12th 2004, CDC, Atlanta. USA.
Hayat Caidi, Emily Abernathy, Min-Hsin Chen, Hong Sun, Qi Zheng, Shigetaka Katow and Joseph Icenogle. Alternative RT-PCR from C region for rubella virus
detection.
Seminar for New Algorithm for rubella virus diagnosis. Koger Royal Center, CDC Atlanta, USA May 24 2005.
Hayat Caidi, Amal Alla and Rajae El Aouad. Rubella and Measles genotypes in
Morocco. Intercountry Meeting on Measles/Rubella Control Elimination EMRO, WHO. Amman Jordan, Intercontinental Hotel, 27-29 November 2006.
RÉSUMÉ
Afin de déterminer la susceptibilité de la rubéole chez les femmes en âge de procréer, au Maroc, 967 échantillons sont testés pour les IgG spécifiques. Ainsi, 83,5% des femmes sont séropositives. En prenant en considération le facteur milieu, aucune différence statistiquement significative (p=0,87) n’est observé, entre le milieu urbain (85,0%) et le milieu rural (81,5%).
L’infection par le virus indique un grand risque pour le syndrome de la rubéole congénitale (SRC) au Maroc. Seules des stratégies de vaccination, conduites et bien ciblées, sur les enfants et sur les femmes en âge de procréer, permettront d’atteindre les objectifs d’élimination du SRC.
Pour différencier entre une infection primaire susceptible d’infecter le fœtus et une réinfection, un test d’avidité (IA) des IgG est effectué sur 100 femmes enceintes ayant une suspicion d’infection. Ainsi, 52% des femmes sont positives en IgM et IgG, 76,9% d’entre elles présentent un IA faible (< à30%), 7,6% un IA modéré (30 à 50 %) et 15,4% un IA élevé (> à 50). Le test de l’avidité des IgG, révélant des valeurs prédicatives plus élevées que le test IgM EIA, est recommandé en tant qu’analyse complémentaire de routine.
L’analyse moléculaire des souches de la rubéole circulant, au Maroc, de 2001 à 2005, montre que le génotype 1E, associé à la transmission épidémique du virus, est reconnu comme génotype international. Les souches ougandaises et ivoiriennes se regroupent parmi le génotype 1g alors que la souche originaire de l’Afrique du Sud se regroupe avec les souches du génotype 2B. Ces données permettront de combler les lacunes concernant l’étude épidémiologique moléculaire du virus de la rubéole dans le continent africain.
La caractérisation moléculaire du nouveau génotype 1g, réalisée pour la première fois, est effectuée par séquençage de la région (3186 nucléotides) codant pour les protéines structurales SP-ORFs (C-E2-E1). La comparaison est faite avec le virus originaire d’Israël, pour confirmer l’usage des souches du génotype 1g.
Mots- clés : Virus de la rubéole, SRC, Analyse génétique, test d’avidité, femmes en âge
TABLE DES MATIÈRES
INTRODUCTION
CHAPITRE I :
REVUE BIBLIOGRAPHIQUE………1Généralités……….………2
I- Le virus de la rubéole……...2
I-1 Structure du virus………2
I-2 Génome du virus………...3
I-3 Réplication du génome………...4
I-4 Protéines du virus………...6
I-4-1 Protéine C……….……….6
I-4-2 Protéines d’enveloppe………..……….7
II-MALADIE……….8
II-1 Historique……….8
II- 2 Manifestations cliniques………...9
II-3 Épidémiologie………...10
II-4 Transmission ………...11
II-5 Immunité……….12
II-5-1 Immunité à médiation cellulaire……….13
II-5-2 Immunité humorale………...14
II-6 Vaccination….………...15
II-6-1 Séroconversion selon les vaccins………16
II-6-2 Persistance des anticorps………. ………...16
II-6-3 Protection conférée par un faible taux d'anticorps ………16
II-6-4 Réinfection selon les vaccins utilisés ……….17
II-6-5 Vaccination rubéoleuse au Maroc ………...17
II-6-6 Effets de la revaccination………...19
II-6-7 Pharmacovigilance des vaccins………..…...19
II-7 Syndrome de la Rubéole Congénitale………...20
II-7-2 Apparition du SRC chez le fœtus infecté.………..21
II-7-3 Réinfection et le syndrome de la rubéole congénitale ………..22
III- Surveillance de la rubéole………...22
III-1 La rubéole en Afrique………...23
III-2 Estimation de la charge de morbidité due au SRC…...24
III-2-1 Enquêtes sérologiques………...24
III-2-2 Enquêtes sérologiques de la population stratifiée sur l’âge………..24
III-2- 3 Enquêtes sérologiques chez les femmes en âge de procréer.………...25
III-3 Stratégies de contrôle………..26
III-3-1 Stratégies préconisées……….………...26
III-3-2 Stratégie de l’élimination de la rubéole au Maroc………...28
IV- Diagnostic biologique de la rubéole……… 28
IV-1 Diagnostic sérologique………...28
IV-1-1 Diagnostic indirect ………...31
IV-1-2 Les IgM spécifiques………...31
IV-1-3 Mesure de l'avidité des IgG spécifiques………32
IV-2 Isolement et identification du virus ………..33
IV-3 Test d'Immuno-Fluoresence (IF) ………...35
IV-4 Détection du virus par la réaction RT-PCR………...35
IV-5 Séquençage et analyse des séquences………...36
CHAPITRE II : MATERIELS ET METHODES………44
I-Étude du statut immunitaire chez les femmes en âge de procréer……..………….45
I- 1 Population étudiée………..45
I-2 Prélèvements………45
I-3 Test sérologique………...46
II- Mesure de l’avidité des IgG………...46
II-1 Population étudiée………...46
II-3 Test sérologique……….47
II-4 Détermination de la dilution optimale d avidité des IgG anti-rubéole………..47
II-5 Interprétation………...48
III- Analyse moléculaire des souches de la rubéole au Maroc, Ouganda, Côte d’Ivoire et en Afrique du Sud……….48
III- 1 Prélèvements.……….………...49
III- 2 Inoculation et passage sur culture cellulaire Vero et Vero /Slam………...50
III-3 Test d'Immunofluorescence ……….52
III-4 Diagnostic moléculaire par RT-PCR………53
III-4-1 Extraction du génome viral………...53
III-4-2 Transcription inverse et amplification génique du gène de la glycoprotéine E1……….. …………...54
III-4-3 Amplification des protéines de structure C-E2-E1………56
III-4-4 Révélation des produits d’amplification………...57
III-5 Séquençage du virus de la rubéole………...57
III-5-1 Souches marocaines et la souche d’Afrique du sud...57
III-5-2 Amplification des protéines de structure SP-ORF………58
III-5-3 Logiciels Bioinformatiques………...59
IV- Séquençage de tout le génome (9762 nts) du virus de la rubéole : souche vaccinale HPV77………..61
IV-1 Amorces pour séquencer la protéine non structurale NSP-ORF ………62
IV-2 Amorces pour séquencer la région structurale C-E2-E1………...64
CHAPITRE III: RESULTATS ET DISCUSSION………...65
I-Séroprévalence du virus de la rubéole chez les femmes en âge de procréer au Maroc………...66
II- Mesure de l’avidité des IgG……….68
III- Immunofluorescence (IF)………69
IV-Analyse moléculaire ………71
IV-2 Analyse des souches Africaines………76 V- Détection du virus de la rubéole par amplification génétique des protéines de structure C-E2-E1………78 V-1 Analyse de l’alignement des séquences peptidiques des souches du génotype 1g…79 V-2 Analyses phylogénétiques ……….82 VI- Génotypage du génome entier du virus de la rubéole : souche vaccinale HPV77………...90
Discussion
………..94I- Séroprévalence de la rubéole chez les femmes en âge de procréer au Maroc……94 A- Séroprévalence du virus de la rubéole chez les femmes en âge de procréer………..95 B- Choix de la stratégie vaccinale………...96 II- Analyse de l’avidité des IgG chez les femmes enceintes ………...102 III- Caractérisation moléculaires du virus de la rubéole au Maroc et identification du nouveau génotype en Afrique ……….104 Conclusion générale………...111 Références Bibliographiques
LISTE DES ABRÉVIATIONS
AA : Acide Aminé
ADN : Acide Désoxyribonucléique Ala : Alanine
Arg : Arginine
ARN : Acide Ribonucléique
ARNm : Acide Ribonucléique Messager Asp : Aspartate
BET : Bromure d’Ethidium
CMH : Complexe Majeur d’Histocompatibilité CPA : Cellules Présentatrice d’Antigène CTL : Lymphocyte T Cytotoxique Cys : Cystéine
DEA : Diethylamine
DELM : Direction d’Epidémiologie et de Lutte contre les Maladies. DMEM : Dulbecco’s’ Medium Essential Media
DO : Densité Optique ECP : Effet Cytopathogène EIA: Enzymatic Immuno Assay
ELISA : Enzyme Linked Immunosorbent Assay GCG: Genetics Computer Group
Gln: Glutamine Glu: Glutamate Gly: Glycine IF: Immunofluorescence. IgG : Immunoglobuline G IgM : Immunoglobuline M
IRC : Infection par la Rubéole Congénitale Lys : Lysine
NSP : Protéine Non Structurale
OMS : Organisation Mondiale de la Santé ORF : Open Reading Frame
PBS : Phosphate Buffer Saline PCR : Polymérase Chaîne Réaction PEV : Programme Elargi de Vaccination PNI : Programme National d’Immunisation. ROR : Rougeole Oreillon Rubéole
RPM : Rotation Par Minute RR : Rougeole Rubéole RT : Transcription Reverse Ser : Serine
SLAM : Signaling Lymphocytes Activation Molecule SRC : Syndrome de la Rubéole Congénitale
SVF : Sérum de Veau Fœtal.
VAERS: Vaccine Adverse Events Reporting System VR: Virus de la Rubéole
Thr : Thréonine Try : Tryptophane
INTRODUCTION
La rubéole est une infection virale bénigne survenant généralement dans l’enfance. Cependant, lorsque l’infection survient chez une femme enceinte, au cours des premiers mois de la grossesse, le risque de malformations congénitales est important (Cutts et al., 1997).
Plus de 29 000 cas sont déclarés par l’Organisation Mondiale de la Santé (OMS) qui vise une éradication en 2010 (OMS, 2007). Grâce à la politique de vaccination, la maladie devient, de plus en plus rare, dans les pays occidentaux. Elle a, cependant, presque disparu aux Etats-Unis, depuis 2002.
Au Maroc, l’épidémiologie de la rubéole reste, par ailleurs, mal connue, puisque la maladie est à déclaration non obligatoire. Des études, très limitées et conduites à l’échelle régionale (Rabat et Meknès), ont concerné la séroprévalence des anticorps IgG chez les femmes enceintes et les femmes en âge de procréer.
Une susceptibilité de 14,8% à 33,5%, (Nejmi et al., 1972 ; Nejmi et al., 2000) a été rapportée. Mais, en l’absence de données épidémiologiques de la maladie, il est difficile de savoir si ceci reflète une augmentation de la réceptivité qui peut être liée aux changements démographiques ou à une variation cyclique de l’incidence. L’incidence de la rubéole varie en fonction de l’âge et de la zone géographique (Six et al., 2003).
Cependant, le programme de vaccination ne prend pas en considération les femmes en âge de procréer. La diminution de l’incidence de la maladie et du nombre des cas de SRC, au Maroc, ne serait possible que si la circulation du virus est interrompue par une vaccination de masse des femmes en âge de procréer et des petites filles en âge de scolarisation et par une vaccination systématique des enfants par le vaccin combiné RR ou ROR. Les femmes enceintes, durant la campagne de vaccination de masse, ne pourront être vaccinées, qu’après leur accouchement, avec ou sans sérologie préalable. La décision de commencer la vaccination des femmes en âge de procréer peut être précédée par des études sérologiques qui peuvent déterminer l'ampleur de la susceptibilité
de l’infection chez les femmes et permettre d’évaluer l’incidence des cas de SRC (Cutts et al., 1997 ; Vynnycky et al., 1996).
En 1988, l’OMS avait lancé l’initiative de l’élimination de la rougeole et le contrôle de la rubéole, d’ici 2010. Dans le but de réduire le nombre des cas de rougeole et d’adhérer à l’initiative de l’élimination de la rougeole et du contrôle de la rubéole lancée alors par l’OMS, le PNI (Programme National d’Immunisation) a introduit, en octobre 2003, une deuxième dose du vaccin combiné (Rougeole Rubéole), chez les enfants en âge de scolarisation. En procurant, certes, un faible coût et une simplification de la gestion du programme, cette vaccination reste, cependant, d’efficacité incertaine, puisqu’elle n’inclut pas les femmes en âge de procréer qui représente le groupe à risque pour l’infection.
L’immunisation induite par une infection naturelle ou par une vaccination entraîne l’apparition d’une immunité qui semble persister durant toute la vie (Plotkin et al., 1999). Toutefois, cette immunité est relative et non absolue. Le risque de réinfection et de virémie dépend du niveau d’anticorps sériques (Robinson et al., 1995).
Actuellement, il existe des moyens de diagnostic efficaces, le seul problème étant de les utiliser correctement. En fait, beaucoup de notions fausses entraînent des conclusions inexactes. En effet, un titre d’anticorps faible ne signifie pas systématiquement que le sujet n’est pas protégé et un titre d’anticorps élevé n’est pas synonyme d’une primo-infection (Icenogle et al., 2003).
C’est ainsi, qu’il a été démontré que seul le test d’avidité peut aider à situer le moment de l’infection et résoudre le problème d’interprétation, surtout chez la femme enceinte (Grangeot, 2005). Généralement, une avidité faible correspondrait à une primo infection récente et une avidité forte correspondrait soit à une réinfection soit à une infection ancienne (Picone et al., 2005).
La mesure de l’avidité des IgG de la rubéole est plus sensible que le test IgM, pour la détection différentielle entre une infection primaire et une réinfection. Par conséquent, il est plus approprié que l'analyse d'avidité des IgG du virus de la rubéole soit employée comme une analyse complémentaire dans le cas de diagnostic d’une rubéole chez une
femme enceinte en présence de signes cliniques (Rasool et al., 2005). L'utilisation des deux analyses est reconnue comme avantageuse, et, serait, alors, préconisée, dans le cas où le sérum est positif en IgM (Hofmann et al., 2005).
L’épidémiologie moléculaire est un outil important dans l’analyse comparative des séquences nucléotidiques de la maladie. Elle est appliquée à l’étude de la dissémination de la maladie dans une population donnée.
L’épidémiologie moléculaire contribue aussi à évaluer les campagnes de vaccination de masse, en comparant les séquences nucléotidiques des génotypes ayant circulé avant et après la vaccination. La surveillance de la maladie permettra alors de classer les souches en tant que souches endémiques ou importées.
Les études génétiques du virus de la rubéole sont réalisées, pour la plupart, par le séquençage de la totalité ou de certaines portions de la région codant la protéine d’enveloppe E1. L’épidémiologie moléculaire mondiale de la rubéole confirme que les virus du génotype I (clade 1) ont une grande homogénéité, avec une possibilité d’évolution, alors que les virus du génotype II (clade 2), ayant une très grande variation génétique, circulent largement dans le continent asiatique (Zheng et al., 2003 b).
Grouper les virus des génotypes du virus de la rubéole s’avère être très délicat, en raison du pourcentage élevé en GC qui rend alors l’analyse difficile.
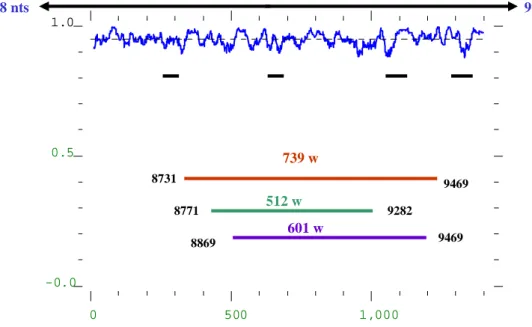
En effet, la région nucléotidique, précédemment utilisée (601 nts), n’était pas suffisante pour différencier entre les deux génotypes. Cependant, la région combinée 739 nts (601 et 512) a donné des groupements appropriés pour le nouveau génotype (Caidi et al., in press).
Il serait alors évident, pour un diagnostic moléculaire de routine, soit, de se limiter, au séquençage de la région 739 nts du gène E1 et de confirmer l’usage du nouveau génotype par le séquençage de la région codant pour les protéines de structure C-E2-E1 soit, au séquençage d’autres régions dans le génome. Ce qui conduit, à penser à séquencer tout le génome du virus, lorsque les résultats du séquençage des différentes régions du génome donnent des résultats discordants.
Ainsi, lors de l’identification des nouveaux génotypes du virus de la rubéole, au lieu d’essayer, à chaque fois qu’un nouveau génotype apparaît, de choisir un fragment d’un gène ou d’un autre, il serait donc préférable de séquencer tout le génome.
OBJECTIFS
Pour documenter la rubéole au Maroc, une étude de la séroprévalence des anticorps IgG anti-rubéole chez les femmes en âge de procréer, est réalisée. Le but du travail consiste, à déterminer le statut immunitaire chez les femmes en âge de procréer, d’estimer le nombre de cas de Syndrome de la Rubéole Congénitale (SRC), en appliquant des modèles mathématiques et de proposer une stratégie de vaccination dans le pays.
L’importance de la rubéole, du point de vue santé publique, tient à ses effets tératogènes chez la femme enceinte. Beaucoup de notions fausses entraînent des conclusions inexactes.
L'un des principaux objectifs est de soulever l’importance du test d’avidité afin de mieux résoudre le problème d’interprétation, chez la femme enceinte, puisque, la détection des IgM, seule, ne peut différencier entre une infection primaire et une réinfection. Par conséquent, il est plus approprié que l'analyse d'avidité des IgG du virus de la rubéole soit employée comme une analyse complémentaire dans le cas de diagnostic d’une rubéole chez une femme enceinte en présence de signes cliniques.
L'utilisation des deux analyses (IgM et avidité) est reconnue comme avantageuse, et, serait, alors, préconisée, dans le cas où le sérum est positif en IgM.
L’épidémiologie moléculaire, outil important dans l’analyse comparative des séquences nucléotidiques du virus et appliquée à l’étude de la dissémination de la maladie, contribue à évaluer les campagnes de vaccination de masse, en comparant les séquences nucléotidiques des génotypes ayant circulé avant et après la vaccination. La surveillance de la maladie permettra alors de classer les souches en tant que souches endémiques ou importées.
Le but du travail, consiste à la première caractérisation moléculaire des souches de la rubéole endémiques qui circulent au Maroc, en Ouganda, en Côte d’Ivoire et en Afrique du Sud. Ce travail permet de combler les lacunes de l’épidémiologie moléculaire du virus de la rubéole dans le continent Africain.
REVUE BIBLIOGRAPHIQUE
REVUE BIBLIOGRAPHIQUE
REVUE BIBLIOGRAPHIQUE
REVUE BIBLIOGRAPHIQUE
GÉNÉRALITÉS
I- VIRUS DE LA RUBÉOLE
La rubéole est une maladie virale aiguë éruptive de l’enfant et du jeune adulte, c’est la rubéole acquise. Elle est souvent asymptomatique et peut passer inaperçue. La gravité de la rubéole repose sur la transmission du virus au fœtus, lorsque l’infection survient, en début de grossesse. Elle est, alors, à l’origine de la rubéole et du syndrome de la rubéole congénitale (SRC) (Didier Ingrand, 2003). L’homme est le seul réservoir connu du virus. Le virus de la rubéole est transmis par voie respiratoire et sa réplication se fait dans la muqueuse du nasopharynx et dans les ganglions lymphatiques locaux. La période d’incubation dure entre 14 à 23 jours et, le virus est présent, dans la gorge, une semaine avant et jusqu'à deux semaines après le début de l'éruption (Benenson, 1990 ; Gerson, 1995).
I-1 STRUCTURE DU VIRUS
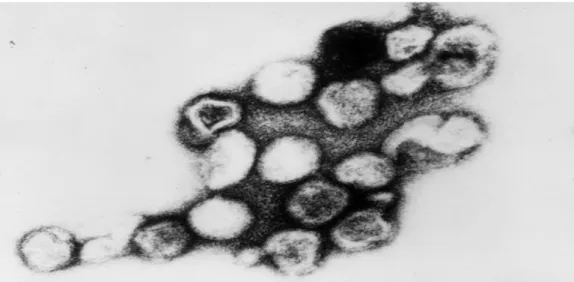
Le virus rubéoleux appartient à la famille des Togaviridae et au genre Rubivirus dont il n’existe qu’un sérotype. Comme tous les Togaviridae, le virus de la rubéole est un virus à enveloppe, dont le diamètre total est de 60 à 70 nm. Il est constitué d’un noyau central ou core entouré d’une enveloppe porteuse de spicules d’hémagglutinine de 5 nm de long. La capside, ayant un diamètre de 40 nm et étant de forme icosaédrique (Figure 1), renferme un ARN génomique linéaire de polarité positive. La structure du virion de la rubéole n'a pas été déterminée, car la structure cristallographique du virus, en dépit de ce qui a été fait pour d’autres virus comme le cas des Alphavirus, n’a pas été déterminée (Zheng et
Figure 1a : Structure du virus de la rubéole (microscopie électronique Gx100000)
Figure 1b : Structure du virus de la rubéole (schématique).
I-2 GÉNOME
Le génome des Togaviridae est linéaire, simple brin, de polarité positive et de taille comprise entre 10 à 12 kilobases (9672 nts). Il contient deux cadres ouverts de lecture (Open Reading Frame, ORFs). L’extrémité 5’ est méthylée et l’extrémité 3’ est polyadénylée. La région proximale 5’ (42-6388) code pour la polyprotéine p200,
Capsid protein RNA
précurseur de la protéine non structurale NSPs-ORF p150 et p90 (Figure 2) (Cooray et
al., 2006).
Figure 2 : Organisation du génome du virus de la rubéole
La région proximale 3’ (6509-9700 nts) code pour les protéines structurales SP-ORFs, la protéine de capside C et les deux glycoprotéines E1 (57Kb) et E2 (42-47 Kb). Les
Togaviridae utilisent une stratégie subgénomique, pour synthétiser les protéines virales.
L’ARN subgénomique code pour la protéine de capside C et les protéines El et E2. Après glycosylation (gE1 et gE2), les protéines E1 et E2 hérisseront de spicules l'enveloppe lipidique émanant des membranes cellulaires (Ramanuja et al., 2001).
L'utilisation des anticorps monoclonaux a révélé des épitopes de neutralisation localisés dans les protéines El et E2, alors que l’activité hémagglutinante est portée par la seule glycoprotéine E1. Toutefois, le virus de la rubéole n'exprime qu'un seul sérotype et deux génotypes (ou clades), ce qui explique sa faible variabilité génomique. Cependant, l’une des caractéristiques significatives du génome du virus de la rubéole est son contenu élevé en GC (70%), comparativement à d’autres virus à ARN (Didier lngrand, 2003).
I-3 REPLICATION DU GÉNOME
Au sein de la cellule, le virus synthétise ses protéines virales et amplifie son génome. L'acide nucléique viral comprend l'information nécessaire à la synthèse des composants structuraux et non structuraux. Cette synthèse est entièrement réalisée par la machinerie
habituelle de la cellule. Le virus de la rubéole requiert, pour sa réplication, une ARN polymérase ARN dépendante. L'ARN des virus est transcrit directement par les ribosomes cellulaires, pour donner des protéines dont l'ARN polymérase ARN dépendante et des protéines de structure (Huraux et al., 2003).
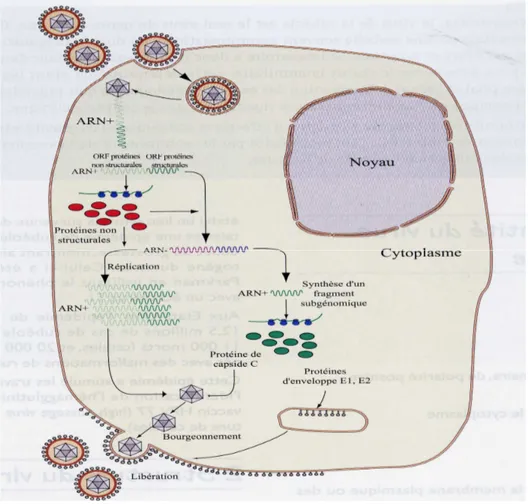
Le cycle de multiplication du virus se décompose en quatre étapes (Figure 3) qui sont l’attachement du virus à la membrane cellulaire, la pénétration du virion à l’intérieur de la cellule, la réplication du virion et, enfin, la libération des virions.
Figure 3 : Cycle de réplication du virus de la rubéole (Bienvenu et Delecroix, 2004)
Pour les virus enveloppés, l’entrée dans la cellule nécessite une étape d’attachement suivie d’une étape de fusion avec la membrane cellulaire permettant de libérer le génome infectieux dans le cytoplasme (Anne-Lise et Delecroix 2004). La pénétration du virus se
fait par fusion/lyse. Ainsi, le virus fusionne sa membrane avec la membrane de la cellule hôte et expulse à l'intérieur du cytoplasme cellulaire sa capside (décapsidation partielle). La traduction de l’ARN (+) contenu dans le virus va permettre une réplication particulière, la traduction des protéines non structurales (polymérases) et la formation du brin ARN (–) qui servira comme matrice à l’ARN subgénomique et à la transcription en ARN (+) (Anne-Lise and Delecroix, 2004 ; Lokman et al., 2006). La libération du virus se fait par bourgeonnement cytoplasmique, la membrane cellulaire se remaniant, les protéines virales s'y insèrent.
I-4 PROTÉINES DU VIRUS I-4-1 PROTÉINE C
L’analyse de la séquence peptidique de la région N terminale de la protéine C montre qu’elle est hydrophile, riche en résidus proline et arginine et qu’elle interagit avec l’ARN (Frey, 1994). La protéine C joue un rôle important dans la réplication du virus, sa phosphorylation modifiant la multiplication du virus (Lokman et al., 2006).
La région principale dans la protéine C est située dans les résidus amino acides 28 à 56 qui contient le résidu Ser 46 qui semble jouer un rôle dans la régulation de la phosphorylation de la protéine de capside. L’importance de la phosphorylation de la capside, dans la réplication du virus, a été démontrée en utilisant des mutants à capside déphosphorylée. L’effet cytopathique, suite à la déphosphorylation, est moindre (Law et al., 2003).
La protéine C contient aussi deux résidus de Cystéine (Cys-152 et Cys-197) responsables de la dimérisation de la protéine. Cependant, la mutation de Cys-152 en Ser-152 empêche la dimérisation de la protéine, sans pour autant altérer les autres fonctions de la protéine (Jia-Yee et al., 1996).
I-4-2 PROTÉINES D’ENVELOPPE
La glycoprotéine E1 du VR porte les déterminants impliqués dans la fonction de l’hémagglutination (Waxham et Wolinsky, 1985). L’hémagglutinine est présente sur l’enveloppe virale sous forme de spicules. C’est par son intermédiaire que se fait la réaction entre le virus et les récepteurs cellulaires, ce qui permet la fixation et la pénétration du virus. Les anticorps anti-hémagglutinines ont une action neutralisante et protectrice et peuvent être mis en évidence par une réaction d’inhibition de l’hémagglutination. Les deux glycoprotéines E1 et E2 forment un hétéro dimère où la protéine E1 est la plus exposée et la plus immuno-dominante en tant que réponse humorale induite par le virus (Frey et al., 1998).
Par l’utilisation d’anticorps monoclonaux, l’implication de différents sites de la séquence E1 a été mise en évidence, dans la fusion membranaire (Ala-81, Tyr-109) et dans la neutralisation du virus (Asp-209, Pro-239), le domaine antigénique étant situé dans la séquence peptidique Met-177, Pro-207 (Figure 3).
Le rôle de la glycoprotéine E2 reste encore mal connu. Cependant, la réponse immunitaire humorale est connue pour être induite par la protéine E2 (Shigetaka et al., 1997). Par ailleurs, bien que le rôle biologique de la glycoprotéine E2 ne soit pas bien défini, des épitopes spécifiques et, probablement, au moins un domaine neutralisant, lui ont été attribués (Cordoba et al., 2000 a ; Law et al., 2001). Cependant, le hétérodimère E2 /E1 semble jouer un rôle dans la réplication virale. De ce fait, la mutation de la Cys 470 et de la Leu471, dans le domaine transmembranaire de la protéine E1, en altérant la formation du complexe E2 /E, altère, par conséquent, la réplication du virus (Jiansheng and Shirley, 1999)
II- MALADIE
II-1 HISTORIQUEC’est à la suite d’une épidémie de rubéole qui a touché, en 1940, plusieurs milliers de personnes en Australie, qu’un ophtalmologiste Norman Gregg, en 1941, fut attiré par l’apparition inhabituelle d’un grand nombre de cataractes congénitales. En contactant d’autres ophtalmologistes australiens, 78 cas, auparavant très rares, ont alors été recensés. L’examen desdits cataractes montre alors que toutes les couches du cristallin étaient atteintes, à l’exception de la couche la plus externe, signifiant une atteinte précoce, lors du développement. L’interrogatoire, effectué auprès des mères des enfants atteints, a permis de faire le lien entre les cataractes et l’épidémie de la rubéole survenue quelques mois plus tôt.
Ce n’est, qu’en 1962, que le test de neutralisation a été développé et que le virus de la rubéole a été isolé sur cultures cellulaires (Robert-Gnasia, 2004). En 1964, une grande épidémie, survenue aux États-Unis, a causé plus de 12.5 millions de rubéole post natale, entraînant des malformations chez 20 000 enfants et 11 000 cas de morts fœtales. L’hémagglutinine (E1) ne fut identifiée qu’en 1965. À partir de 1969, la première souche vaccinale (souche HPV77) a donc été développée aux États-Unis.
II-2 MANIFESTATIONS CLINIQUES
La primo-infection rubéoleuse débute, après une période d'incubation silencieuse de 16 à 18 jours, par une éruption maculopapuleuse.
D'emblée généralisée et d'évolution fugace (2 à 3 jours), non prurigineuse et constituée de petits éléments roses pâles, elle s'accompagne, généralement, d'une fièvre modérée (+38-+38,5°C) et de multiples adénopathies mobiles, non douloureuses, en particulier, cervicales postérieures (Guérin, 2000 ; Ingrand, 2003).
Ces manifestations, spontanément résolutives, en quelques jours, entraînent une immunité durable qui n'empêche pas, cependant, la survenue de réinfections exogènes asymptomatiques. L’éruption commence, d’abord, au niveau du visage, pour s’étendre, rapidement, au reste du corps. Elle est morbiliforme (petites lésions maculopapuleuses, d’un rose plus clair que dans le cas de la rougeole), le premier jour, pour devenir scarlatiniforme, le deuxième jour, essentiellement au niveau du visage. La coalescence des lésions entraîne la formation d’un érythème diffus (Ray, 1993).
Cette description, commune, ne doit pas faire oublier que 50 % des primo-infections rubéoleuses n'ont pas d'expression clinique, et que, l'éruption, lorsqu'elle est présente, peut revêtir de très nombreux aspects non spécifiques (polymorphe, purpurique, scarlatiniforme, morbiliforme) (Merrer et al., 1999). De ce fait, seul le diagnostic virologique et, en particulier, sa composante sérologique, apportera les preuves de l'infection rubéoleuse.
À l'exception de la rubéole congénitale, les complications de la rubéole sont limitées et, lorsqu’elles existent, elles se retrouvent, plus fréquemment, présentes chez l'adulte que chez l'enfant (Ingrand, 2003).
L’arthrite, complication fréquente de la maladie et, plus particulièrement, chez les femmes, guérit, habituellement, sans séquelles. D’autres complications plus graves telles que l’hémorragie secondaire à une thrombocytopénie ou une vasculite (1 cas sur 3000) ou encore une encéphalite (1 cas sur 5000) sont très rares (Gershon, 1995).
Cependant, la maladie reste sans gravité particulière, chez les personnes ayant une déficience congénitale ou acquise. L’infection entraînerait l’apparition d’une immunité de type cellulaire et l’apparition de plusieurs types d’anticorps sériques tels que les IgG et les IgM (Chernesky et al., 1995).
II-3 ÉPIDÉMIOLOGIE DE LA MALADIE
La rubéole est une maladie infectieuse, certes, bénigne chez l’enfant mais, gravissime chez la femme enceinte, en raison du risque élevé d’embryofoetopathie.
La progression de la maladie, dans une population non vaccinée, entraîne une augmentation de l’incidence et une diminution du nombre de sujets susceptibles. L’incidence varie en fonction de l’âge et de la zone géographique (Six et al., 2003). Dans les pays tropicaux, l’infection survient à un âge plus précoce, avec des variations régionales importantes. Dans les pays en développement, 45 % des femmes en âge de procréer sont réceptives au virus. En France, 5% (30 000 à 50 000) des femmes n’ont pas d’anticorps et sont susceptibles de développer une primo-infection. En l’absence d’un programme de vaccination, la rubéole se présente comme une infection fréquente touchant les enfants de 3 à 15 ans (50 % des infections rubéoliques ont lieu avant 10 ans et 80 % avant l’âge de 15 ans) (Bolognese, 1993).
La rubéole sévit de façon endémique avec une recrudescence saisonnière (fin hiver-début printemps) et des épidémies apparaissent tous les 6 à 9 ans. Actuellement, du fait d’une vaccination massive des enfants, la rubéole évolue par poussées épidémiques hiverno-printanières, en touchant surtout les adolescents et les adultes jeunes ; les enfants non vaccinés, constituent alors ainsi un risque pour les femmes enceintes.
La morbidité de la rubéole est difficile à estimer car, d’une part, la maladie est souvent inapparente et ne donne pas forcément lieu à une consultation médicale et, d’autre part, la difficulté du diagnostic clinique n’évalue pas à juste titre le nombre de cas survenus. En France, dans les années 1980-1990, le nombre annuel de cas cliniques s’élevait entre 300 et 500 000 (Bouvet, 1986). Au Canada, des taux d’incidence de 2 cas pour 100 000 habitants, au cours des 12 dernières années, de 30 cas pour les 2 dernières années et de,
L’importation des cas de rubéole et l’immigration d’individus ayant une réceptivité à la rubéole et provenant de régions qui n’ont pas de programme de vaccination sont des problèmes importants pour les pays dotés du programme d’immunisation contre la rubéole (Charbonneau and De Wals, 1997).
Au Maroc, l’épidémiologie de la rubéole reste mal connue, puisque la maladie est à déclaration non obligatoire. Cependant, des études très restreintes, à l’échelle régionale (Rabat et Meknès), concernant la séroprévalence des anticorps IgG chez les femmes enceintes et les femmes en âge de procréer, ont montré une susceptibilité variant de 14,8% à 33,5%, (Nejmi et al., 1972 ; Nejmi et al., 2000). En l’absence de données épidémiologiques de la maladie, il est difficile de savoir si ceci reflète une augmentation ancienne de la réceptivité qui peut être liée aux changements démographiques, ou à une variation cyclique de l’incidence.
II-4 TRANSMISSION
Le virus se propage, par l’intermédiaire de contacts interhumains directs et uniquement par voir respiratoire. Après pénétration et lors d’une virémie transitoire, le virus diffuse vers les ganglions lymphatiques régionaux où s’effectue la multiplication virale. Sept à neuf jours après l’infection, les virus, présents dans la circulation sanguine, sont acheminés vers les différents tissus. La virémie maximale est atteinte entre le 10ème et le 17ème jour, pour se terminer au moment de l'éruption maculopapuleuse qui, survient, en général, entre le 16 ème et le 18 ème jour, après l’infection. Pendant ce temps, le virus est excrété, massivement dans les secrétions nasopharyngées où il est présent, pendant les deux semaines qui cernent l'éruption. De ce fait, la personne infectée est contagieuse 7 jours avant à 7 jours après l’éruption. L'homme, étant le seul réservoir connu, la transmission interhumaine se fait alors directement par inhalation de particules infectantes (Ingrand, 2003).
Dans le cas de l’infection de la femme enceinte, au cours de la virémie, le virus infecte le placenta et peut se transmettre au fœtus. Bien que la majorité des transmissions est observée au cours d'une primo-infection rubéoleuse chez la femme enceinte, de très rares
cas de transmission de la mère à l’enfant ont été décrites, suite à des réinfections maternelles (Robinson et al., 1994 ; Ingrand, 2003).
II-5 IMMUNITÉ
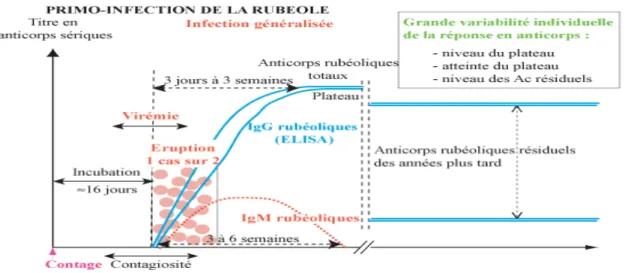
Une infection par le virus de la rubéole ou par le virus atténué vaccinal entraîne l’apparition d’une immunité qui persisterait durant toute la vie (Plotkin et al., 1999). Toutefois, cette immunité est relative et non absolue. En cas d’exposition, une personne immunisée peut se réinfecter, ce qui se traduit par une multiplication du virus au niveau des voies respiratoires supérieures et, plus rarement, par une virémie. La plupart des réinfections sont asymptomatiques. Le risque d’une réinfection et d’une virémie dépend du niveau d’anticorps sériques (Robinson et al., 1995).
Figure 4 : Diagramme de l’évolution du taux sérique des anticorps IgG et IgM en cas d’infection
Le risque de la réinfection est d’autant plus faible que le niveau d’anticorps est élevé. Ce risque est plus faible chez les personnes immunisées par le virus sauvage que par une souche atténuée d’un vaccin. Le niveau des anticorps sériques diminue avec le temps et peut atteindre des concentrations plus faibles que la limite de sensibilité des tests de dépistage de l’immunité (Figure 4). La qualité de la réponse immunitaire et la persistance des anticorps varient en fonction de la souche vaccinale. Ainsi, dix années après la vaccination, une séronégativité est apparue chez 7% des individus ayant été vacciné avec la souche HPV-77, chez 3% à qui il a été administré la souche Cendehill et chez 1% ayant reçu la souche RA27/3 (Plotkin et al., 1999).
Le risque d’infection fœtale et du SRC est excessivement faible, lorsqu’une mère immunisée est exposée durant le premier trimestre de la grossesse. Il semble, toutefois, que le risque est élevé lorsque l’immunité est induite par une vaccination, vaccination d’autant plus effectuée à un jeune âge avec un vaccin immunogène et lorsque le niveau d’anticorps est bas. Il reste, cependant, impossible d’établir de façon précise le risque d’une réinfection, en fonction du taux d’anticorps sériques (Robinson et al., 1995 ; Plotkin et al., 1999).
II-5-1 IMMUNITÉ À MÉDIATION CELLULAIRE
La réponse cellulaire apparaît indispensable à l’élimination de l’infection. Elle fait intervenir des lymphocytes T cytotoxiques et des lymphocytes T auxiliaires CD4+ (Th). La souche vaccinale RA27/3 déclenche des réactions immunitaires humorales et cellulaires identiques à celles observées après une infection naturelle. La production des IgM, des IgG, et des IgA est alors activée. Cependant, la quantité des anticorps, suite à ces réponses, est légèrement inférieure à celle émise lors d’une infection naturelle. Après la vaccination, les anticorps IgM apparaissent dans le sang et persistent, pendant deux mois, avant que les IgG n’apparaissent (Plotkin et al., 1998).
Bien que la prolifération des lymphoblastes, des cellules T cytotoxique et de la sécrétion de cytokine est évidente, elle reste, cependant, de courte durée et peu concluante. Les peptides comportant la protéine de la capside C du VR et, plus particulièrement, la
séquence immuno dominante allant de l’acide aminé en position C255 jusqu'à l’acide aminé en position C280, sont présentes, à la surface des cellules représentant l’antigène (CPAg), avec les molécules du complexe majeur d’histocompatibilité (CMH classe II) (Fields, 1996). Quant à la protéine E2, elle peut également contenir des épitopes susceptibles d’être efficacement présentés par les molécules du CMH. De plus, un peptide de 82 acides aminés de la protéine E1 semble être l'inducteur le plus actif de la réponse proliférative des cellules lymphocytes CD4+ (Mitchell, 1999). Comme dans toutes les infections virales, les CD8+ interviennent majoritairement pour l’élimination des cellules infectées, du fait de la présence de la molécule CMH II sur toutes les cellules de l’organisme. En effet, les CD8+ sont détectées dans le sang, au moment de l’éruption. Cette réaction immunitaire s'est avéré être HLA/A2 liée (Toyoda, 1999).
La souche vaccinale atténuée RA27/3 conserve plusieurs épitopes immuno dominants sur chacune des trois protéines structurales virales, spécifiquement. Les résidus 275-285 et 402-422 sont préservés sur la glycoprotéine de l'enveloppe E1, les résidus 54-72 sur la glycoprotéine de l'enveloppe E2 et les résidus 14-29 sur la protéine de la capside (Toyoda, 1999).
II-5-2 IMMUNITÉ HUMORALE
Les lymphocytes B, activés par les lymphocytes T auxiliaires (Th) spécifiques des protéines virales, prolifèrent et secrètent des anticorps qui neutralisent les particules virales ou participent, par des mécanismes de cytotoxicité dépendant des anticorps, à la lyse des cellules infectées. Les anticorps sont détectés juste après le début de l’éruption cutanée (Fields, 1996).
Le pic des IgM est atteint entre le 10 ème et le 17ème jour puis, le déclin est observé, au moment de l’éruption maculopapuleuse. Les anticorps du sérum s’attachent rapidement à l’hémagglutinine, protéine de surface. Cette réaction sert en tant que principe de base pour le test de l’inhibition d’hémagglutination (IHA), réaction à la fois aisée et sensible, représentant l’essai sérologique le plus utilisé pour le diagnostic de la rubéole (Gold, 1996).
La molécule E1, joue un rôle déterminant dans le processus de l’immunité humorale, par l’intermédiaire de plusieurs sites impliqués dans l'attachement du virus à la membrane de la cellule hôte (Fields, 1996). La molécule E2, quant à elle, bien que, encore mal étudiée, a pu être liée à l’infection du VR, puisque une fraction de la glycoprotéine E2 a été isolée (Schwarzer, 1997). Des épitopes E2, cachés sous la protéine E1, dans le complexe dimère E1-E2, et non facilement accessibles par le système immunitaire, ont été mis en évidence (Soldani et al., 1990 ; Shigetaka et al., 1997).
La plupart des infections par le virus de la rubéole induisent une immunité à long terme. Cependant, peu d'informations sont disponibles, en ce qui concerne la quantité d'anticorps produite in vivo, en réponse à chacune des protéines structurales du virus, après infection ou après vaccination. Ainsi, les deux glycoprotéines E1 et E2 induisent une immunité à vie. La glycoprotéine E1 reste la principale région extérieure contenant des épitopes identifiés dans la neutralisation et l’hémagglutination des anticorps d’inhibition, propriétés faisant de cette protéine un candidat majeur dans les vaccins synthétiques (Bosma et al., 1996 ; Cordoba et al., 2000 b).
II-6 VACCINATION
L’objectif principal de la vaccination est de prévenir l’infection rubéoleuse pendant la grossesse. Les souches vaccinales RA 27/3, HPV/77 et Cendehill ont été développées, après l’isolement du virus rubéoleux sur cultures cellulaires, vers la fin des années 1960. Seul le vaccin utilisant la souche atténuée RA27/3 est sélectionné, en raison de son immunogénicité. Il est administré soit, sous forme vaccin trivalent (ROR) puisque combiné avec le vaccin de la rougeole et celui des oreillons (ROR VAX ®), soit, sous forme vaccin monovalent (RUDI VAX ®). L'immunogénicité des deux vaccins est identique, six semaines, après la vaccination.
Le vaccin trivalent ROR contient la souche Edmonston 749D, pour le virus de la rougeole, la souche Wistar RA27/3M, pour le virus de la rubéole et la souche Jeryll
Lynn, pour le virus des oreillons. Les taux de séroconversion et les taux d’anticorps,
après administration vaccinale, sont comparables à ceux observés pour le ROR VAX®. Actuellement, en dehors du Japon, la souche RA27/3 est la seule utilisée pour la
préparation des vaccins rubéoleux qu’il soit sous forme monovalente ou combinée (Best, 1991).
II-6-1 SÉROCONVERSION SELON LES VACCINS
Lors d’une infection naturelle, le taux des anticorps contre la rubéole, est de quatre à huit fois plus élevé, lorsqu’ils résultent d’une vaccination (Bakshi et Cooper, 1990).
De toutes les souches vaccinales, la souche RA 27/3M est la plus immunogène. Les essais cliniques montrent une séroconversion dans 95% à 100 % des cas et de 56 % et 96 % des cas, après une vaccination, respectivement avec la souche RA 27/3M et la souche Cendehill. Suite à une vaccination avec la souche atténuée HPV-77, le taux de séroconversion est de 90 % chez les adultes et de 97 % chez les enfants (Best, 1991).
II-6-2 PERSISTANCE DES ANTICORPS
L’administration du vaccin contenant la souche RA 27/3M montre une sérologie négative dans 1% des cas, après une période s’échelonnant entre 10 à 21 ans et dans 4% des cas après 14 ans alors qu’un taux d’anticorps faible a été décelé dans 5% des cas, après 10 à 21 ans (Best, 1991) et six à 16 ans (Vaccine Safety, 1994).
Cependant, une sérologie négative a été révélée, chez les personnes immunisées, 10 à 21 ans après l’administration, dans 7% des cas, lorsque le vaccin comportait la souche HPV-77 et dans 3% des cas, lors d’une vaccination avec la souche Cendehill (Best, 1991).
II-6-3 PROTECTION CONFERÉE PAR UN FAIBLE TAUX D'ANTICORPS
La protection contre la rubéole, conférée par un taux d'anticorps faible, n'est, cependant, pas bien connue (Vaccine Safety, 1991). La réinfection est peu fréquente, lors d’une immunité acquise par la maladie ou lorsque les titres d'anticorps sont supérieurs à 15 UI.mL-1, après la vaccination. Par ailleurs, la réinfection est plus fréquente chez les individus vaccinés et ayant des d’anticorps titres faibles inférieurs à 15 UI.mL-1 (O’Shea et al., 1983). Les taux d'anticorps, évalués par les tests actuellement disponibles, sont des
ayant un taux d'anticorps inférieur à 15 UI.mL-1, en hémolyse radiale, est une pratique courante (Best, 1991).
II-6-4 RÉINFECTION SELON LES VACCINS
Les premières études sur les vaccins ont montré l’évidence que la réinfection se produisait chez 50 % des personnes vaccinées avec la souche HPV-77 et la souche Cendehill, chez 67 % des personnes vaccinées avec la souche atténuée Cendehill, chez 47% des individus vaccinés avec la souche HPV-77, chez 7% des vaccinées avec la souche RA 27/3 (Fogel, 1978) et chez 10% (5/102) de jeunes filles, durant la quatrième année, après l’administration du vaccin comportant la souche RA 27/3 (Cusi, 1993). Le phénomène de la réinfection et ses conséquences sérologiques ont été évalués, de façon extensive, au cours des épidémies et/ou au moment des épreuves cliniques, sur des volontaires déjà immunisés, avec de fortes doses de virus atténués administrés par voie nasale ou en sous-cutanée. En effet, lors d’une réinfection, tandis que les IgG augmentent de façon importante, les IgM augmentent peu ou pas du tout, alors que lors d’une primo-infection, les IgM présentent une augmentation considérable (Miller et al., 1990).
La réinfection par le virus de la rubéole est possible et, se produit, le plus souvent chez les personnes qui acquièrent leur immunité après la vaccination plutôt que chez les individus qui font la maladie naturellement. L'investigation des individus exposés à des cas de rubéole, durant les épidémies, montrent une réinfection chez 50 % des personnes vaccinées et, seulement, chez 5 % de celles qui ont fait l'infection naturellement (Miller, 1990).
La réinfection est habituellement asymptomatique (Bakshi et al., 1990) et s'accompagne rarement d'une virémie (Morgan-Capner, 1989).
II-6-5 VACCINATION RUBÉOLIQUE AU MAROC
Les efforts du programme de vaccination, contre la rubéole, au Maroc, sont, actuellement, concentrés, sur la mise en application du plan national, pour l’élimination de la rougeole, le contrôle de la rubéole et de la rubéole congénitale. Le calendrier vaccinal contre la rubéole, au Maroc, est différent, selon qu’il s’agisse du secteur public
ou du secteur privé, en ce sens que, le vaccin ROR est disponible dans le secteur privé, depuis 1989.
En 1987, le ministère de la santé a procédé à une restructuration du Programme Elargi de Vaccination (PEV) et le renomma Programme National d’Immunisation (PNI). Les objectifs du PNI furent alors d’atteindre une couverture vaccinale uniforme supérieure ou égale à 95%, selon le lieu de résidence (urbain ou rural) et selon la localisation (national, région, province/préfecture, circonscription sanitaire, secteur et localité) de toutes les maladies cibles de la vaccination, puis, d’obtenir avec les autres pays de la région, la certification de l’éradication de la poliomyélite, en 2008 et de l’éliminer de la rougeole et du contrôler la rubéole, en 2010.
Dans le but de réduire le nombre des cas de rougeole et d’adhérer à l’initiative de l’élimination de la rougeole et du contrôle de la rubéole lancée par l’OMS, le PNI a introduit, dès octobre 2003, une deuxième dose du vaccin combiné (Rougeole - Rubéole), chez les enfants à l’âge de 6 ans (âge de la rentrée scolaire) (Tableau 1). Ainsi, une couverture vaccinale, supérieure à 90%, a été réalisée, aussi bien pour la première dose que pour la deuxième dose vaccinale (PNI, 2005).
âge de l’enfant Vaccins
à la naissance BCG + VPO (zéro) + HB1
6 semaines DTC1 + VPO1 + HB2
10 semaines DTC 2 + VPO2
14 semaines DTC 3 + VPO3
9 mois VAR + HB3
18 mois DTC + VPO (premier rappel)
6 ans (rentrée scolaire) RR (vaccin contre la rougeole et la
rubéole)
Tableau 1 : Calendrier national de vaccination dans le secteur public au Maroc (BCG :
Bacille Calmette Guérin, DTC : Diphtérie Tétanos Coqueluche, VPO : Vaccin Polio Oral, HB: Hépatite B, RR : Rougeole Rubéole, VAR : Vaccin Anti Rougeole)
II-6-6 EFFETS DE LA REVACCINATION
La revaccination des sujets qui n'ont pas développé d’anticorps, après une première vaccination (échec primaire), a permis d'induire une séroconversion dans 70% à 80% des cas (MMWR, 1985). En effet, la revaccination, chez les enfants, provoque une élévation significative du titre des anticorps, tandis que, chez les adultes séronégatifs ayant été déjà vaccinés, durant l'enfance, la revaccination provoque une séroconversion, dans pratiquement, tous les cas (Cote et al., 1993). Aucun effet indésirable n’a, par ailleurs, été mentionné, après une revaccination.
II-6-7 PHARMACOVIGILANCE DES VACCINS DE LA RUBÉOLE
Aux États-Unis, une surveillance a été établie, en 1978, sous l'égide du CDC (Centers for Diseases Control), appelée système de contrôle des réactions secondaires aux vaccinations (Monitoring system of adverse events following immunization, MSAEFI). En 1986, un programme national d'indemnisation des accidents vaccinaux a contribué à améliorer les connaissances sur les accidents post-vaccinaux (Evans, 1995 ; Glezen, 1996). En 1990, un nouveau système de déclaration des réactions vaccinales (VAERS)
(Vaccine adverse events reporting system), permettant à toute personne de faire une
déclaration d'effets secondaires, a été instauré. Ainsi, il a été mis, à la disposition des médecins, des formulaires de déclaration contenant une liste des événements qui devraient être systématiquement rapportés. Malgré cet ensemble de mesures, le système VAERS n'était guère plus performant (Rosenthal et Chen, 1995).
En dehors des effets indésirables habituels (fièvre, éruption cutanée, œdème au point d'injection), des effets spécifiques ont été décrits, sans, toutefois, remettre en cause les stratégies vaccinales. Des effets secondaires, comme des réactions imputables à certains vaccins, peuvent, lorsqu’ils sont graves, entraîner une contre-indication, s'ils surviennent sur des sujets à risque bien identifiés. De telles réactions ont été à l'origine du retrait du vaccin incriminé ou d'une modification de la stratégie vaccinale, entraînant, même une modification du calendrier vaccinal, sans que leur imputabilité au vaccin ait été démontrée.
Par ailleurs, une association, entre la vaccination antirubéolique et l'apparition des symptômes articulaires, chez l'enfant et chez l'adulte, a été mise en évidence. Ainsi, des cas d'arthrite chronique, associés à la vaccination contre la rubéole et soumis au Programme Américain d'Indemnisation des Accidents Vaccinaux, ont été rapportés (Weibel et Benor, 1996).
Une relation cause à effet a alors été retenue entre certains cas, avec un délai d'apparition compris entre une à six semaines, après la vaccination. Dans une étude prospective randomisée, menée, durant une année, sur 546 femmes vaccinées avec la souche RA27/3, il a été observé une augmentation significative des cas de manifestations articulaires aiguës (30% versus 20% dans le groupe placebo) et une augmentation faible des manifestations chroniques (Jonville-Bera et al., 1997). Toutefois, une relation cause à effet a montré, l'absence de l’augmentation du risque d’arthropathies chroniques ou de pathologies neurologiques, au moins un an, après la vaccination. Une éventuelle augmentation des cas du syndrome de Guillain Barré, après une campagne de vaccination de masse contre la rougeole/rubéole, n’a pas été identifiée (Das et al., 1997).
II-7 LE SYNDROME DE LA RUBÉOLE CONGÉNITALE
La rubéole est une maladie infectieuse due à un virus à ARN, bénigne dans sa forme acquise, mais, dont la gravité réside dans l'atteinte fœtale, lorsque l’infection survient chez une femme enceinte au cours du premier trimestre de la grossesse. Le lien, entre l'augmentation de la fréquence des cataractes congénitales et l'épidémie de la rubéole maternelle survenue en Australie en 1940, a été établi en 1941. D'autres atteintes oculaires, des anomalies auditives, neurologiques et/ou encore cardiaques, ont été, également, par la suite, rapportées.
Ainsi, deux types d’infections sont à distinguer. Il s’agit d’une part, de l’infection rubéoleuse congénitale (IRC) qui affecte le fœtus, avec ou sans manifestations cliniques de l’embryon et, d’autre part, du syndrome de la rubéole congénitale (SRC) qui, dans ce cas, affecte l’embryon du fœtus infecté.
II-7-1 INFECTION DU FOETUS
Lorsque la mère contracte la rubéole, le fœtus, lui-même, est infecté dans une proportion qui varie selon la période de la grossesse. Au Royaume-Uni, 95% des femmes, ayant eu une rubéole confirmée durant la grossesse, ont présenté une éruption alors que 5% sont restées asymptomatiques. Par ailleurs, 4% d’entre elles ont eu un avortement spontané et 54 % ont vu leur grossesse interrompue (Miller et al., 1990).
Les tests sérologiques, effectués chez les mères et chez les nouveaux-nés, montrent que les fœtus étaient infectés à 80%, à 67%, et à 25%, lorsque l’infection rubéoleuse, chez les mères, survenait, durant la grossesse, respectivement, durant les 12 premières semaines, autour de la 13ème semaine et, enfin, entre la 23ème semaine et la 26ème semaine (Miller et al., 1982).
II-7-2 APPARITION DU SRC CHEZ LE FOETUS INFECTÉ
Il est important de retenir qu'une infection fœtale sans séquelle est possible quel que soit le moment où elle se produit (CDC, 1990). Après une infection in utero, le virus peut persister, chez l'enfant, durant des mois voire même des années, après la naissance. Les mécanismes par lesquels le virus cause des malformations congénitales et des anomalies d'apparition tardive sont encore mal compris (Frey et al., 1997).
Les anomalies, les plus fréquemment, rencontrées chez les nouveaux-nés sont, par ordre décroissant, la perte d'audition, la déficience intellectuelle, les malformations cardiaques et les pathologies oculaires (Frey et al., 1997). L'infection fœtale serait associée, de façon constante, à des anomalies congénitales (cardiaques ou auditives), si elle survient dans les dix premières semaines de la grossesse. Par ailleurs, la fréquence de ces manifestations diminue, après dix semaines, bien que, plus du tiers des enfants, présente un problème de surdité en tant que seule manifestation clinique. Cependant, le nouveau-né pourrait ne présenter aucune anomalie apparente, si l'infection se produit après la 16ème semaine de la grossesse (Miller et al., 1982).
Même si la majorité des enfants infectés in utero sont normaux à la naissance, il se peut que, plusieurs d’entre eux présentent, plus tard, une ou plusieurs manifestations associées
à l'embryopathie rubéolique. Ainsi, des enfants, nés sans déficit auditif, deviennent sourds, à l'âge de 7 ans. Vingt pour cent des individus nés avec un SRC ont un diabète, après l'âge de 35 ans, 5% ont des problèmes thyroïdiens et 10% ont des problèmes visuels comme le glaucome (Dudgeon, 1986).
II-7-3 RÉINFECTION ET SYNDROME DE LA RUBÉOLE CONGÉNITALE
Il a été longtemps considéré qu'une réinfection, chez une femme enceinte, ne représentait aucun risque pour le fœtus. Or, des cas de SRC, chez des nouveaux-nés présentant toutes les caractéristiques d'un SRC, ont été rapportés (Robinson et al., 1994) alors que la mère avait eu antérieurement plusieurs tests de dépistage sérologiques démontrant la présence des anticorps (Robinson et al., 1994).
Il apparaît alors qu’il n'est pas nécessaire que la mère soit symptomatique, pour que le fœtus soit infecté (Das et al., 1990).
De plus, la virémie étant rare, après une réinfection, entraîne encore plus rarement des anomalies chez le fœtus (Robinson et al., 1994). Les dommages cellulaires générés par le virus dans les tissus fœtaux infectés sont encore mal connus. En effet, le virus est peu lytique in vitro, comme en témoigne l'absence de l’effet cytopathogène (ECP), en microscopie optique, sur des cellules permissives à sa multiplication. Par ailleurs, in vivo, une faible réaction inflammatoire (infiltrats de quelques lymphocytes) et un défaut de vascularisation, à l'origine des manifestations cliniques, sont observés. Celles-ci pourraient être aggravées par un effet viral direct sur la mitose cellulaire dont le temps de réalisation est allongé.
III- SURVEILLANCE DE LA RUBÉOLE
La surveillance de la rubéole constitue une priorité pour les pays ayant décidé d’éradiquer cette maladie. Cette décision est généralement associée à l’éradication de la rougeole, puisque rubéole et rougeole sont des maladies éruptives, élément clé de leur éradication. Au milieu des années 1990, les programmes de vaccination contre la rubéole ont fait l’objet d’un intérêt grandissant.