OATAO is an open access repository that collects the work of Toulouse researchers and makes it freely available over the web where possible
Any correspondence concerning this service should be sent
This is an author’s version published in: http://oatao.univ-toulouse.fr/ 25575
To cite this version:
Cavalerie, Robin . Le diaphragme du Chien et du Chat :
contributions d'une étude anatomique. Thèse d'exercice, Médecine
vétérinaire, Ecole Nationale Vétérinaire de Toulouse – ENVT, 2019, 157 p.
ANNEE 2019 THESE : 2019 – TOU 3 – 4018
LE DIAPHRAGME DU CHIEN ET DU CHAT :
CONTRIBUTION D’UNE ETUDE
ANATOMIQUE COMPARATIVE
_________________
THESE
pour obtenir le grade de DOCTEUR VETERINAIRE
DIPLOME D’ETAT
présentée et soutenue publiquement devant l’Université Paul-Sabatier de Toulouse
par
CAVALERIE Robin
Né, le 05 octobre 1994 à Figeac (46)Directeur de thèse : M. Giovanni MOGICATO
___________
JURY PRESIDENT :
Mme Isabelle BERRY Professeur à l’Université Paul-Sabatier de TOULOUSE
ASSESSEURS :
M. Giovanni MOGICATO Professeur à l’École Nationale Vétérinaire de TOULOUSE
Mme Alexandra DEVIERS Maitre de conférences à l’École Nationale Vétérinaire de TOULOUSE MEMBRE INVITE :
Mme Géraldine JOURDAN Praticien hospitalier à l’École Nationale Vétérinaire de TOULOUSE
REMERCIEMENTS
AUX MEMBRES DU JURYA MADAME LE PROFESSEUR ISABELLE BERRY
Professeur des Universités Paul Sabatier de Toulouse, Praticien hospitalier, Biophysique, Imagerie Médicale Qui m’a fait l’honneur d’accepter de présider le jury de cette thèse, Hommages respectueux.
A MONSIEUR LE PROFESSEUR GIOVANNI MOGICATO
Professeur à l’École Nationale Vétérinaire de TOULOUSE, Anatomie, Imagerie Médicale Qui m’a accompagné, soutenu et aidé durant toute mes études et dans l’élaboration de ce travail, Pour sa gentillesse, ses conseils, sa disponibilité et son écoute Remerciements très chaleureux.
A MADAME LE DOCTEUR ALEXANDRA DEVIERS
Maître de conférence à l’École Nationale Vétérinaire de TOULOUSE Anatomie, Imagerie Médicale Qui a très aimablement accepté de faire partie de mon jury de thèse, Sincères remerciements.
A MADAME LE DOCTEUR GERALDINE JOURDAN
Praticien hospitalier à l’École Nationale Vétérinaire de TOULOUSE Anesthésie, Réanimation Qui a été d’un grand soutien et une source d’inspiration, Pour sa bienveillance, son attention et son altruisme.
A MONSIEUR LE PROFESSEUR PATRICK VERWEARDE
Professeur à l’École Nationale Vétérinaire d’ALFORT Urgence, Réanimation, Soins intensifs Qui est en grande partie à l’origine de cette thèse, Pour sa détermination, son humour et son amabilité Pensées respectueuses
TABLE DES MATIERES
LISTE DES FIGURES ... 1 LISTE DES TABLEAUX ... 5 LISTE DES ABREVIATIONS ... 7 INTRODUCTION... 9 PARTIE I : SYNTHESE BIBLIOGRAPHIQUE ... 11 Développement du diaphragme ...11 Généralités sur l’embryogénèse ... 11 Formation des cavités cœlomiques ... 12 Formation des cavités pleurales et péricardique ... 15 Séparation des cavités pleurales et péritonéales ... 16 Anatomie descriptive du diaphragme ...20 Généralités ... 20 Constitution et conformation ... 21 La partie lombaire ... 23 Le centre tendineux ... 26 La bande charnue périphérique... 27 Rapports ... 29 Une cloison fenêstrée ... 30 Rapports sur la face thoracique ... 31 Rapports sur la face abdominale ... 32 Vascularisation ... 34 Chez le chat ... 34 Chez le chien ... 35 Étude récente chez la souris ... 37 Innervation ... 38 Rôles physiologiques du diaphragme ...41 Séparation des cavités ... 41 Activité musculaire du diaphragme ... 41 Unité motrice et types de fibre musculaire ... 41 L’innervation motrice et sensitive ... 44 Conséquences structurelles et physiques de la contraction ... 46 Modifications anatomiques... 46 Modifications des pressions ... 47 Répercussions sur la cage thoracique ... 49 Tensions engendrées lors de la contraction ... 51 Activités respiratoires ... 54 Ventilation ... 54 Toux et autres processus de dégagement des voies aériennes ... 55 Activités non respiratoires ... 57 Déglutition ... 57 Vomissement ... 58 Reflux gastro-œsophagiens ... 60Affections du diaphragme ...62 Affections congénitales... 62 Hernie pleuro-péritonéale ... 62 Physiopathologie ... 62 Épidémiologie ... 62 Signes cliniques ... 62 Diagnostic ... 64 Traitement ... 65 Pronostic ... 65 Hernie péritonéo-péricardique ... 65 Physiopathologie ... 65 Épidémiologie ... 66 Signes cliniques ... 67 Diagnostic ... 67 Traitement ... 70 Pronostic ... 71 La hernie diaphragmatique acquise ... 71 Physiopathologie ... 71 Signes cliniques... 74 Diagnostic ... 74 Traitement ... 76 Pronostic ... 78 PARTIE II : ETUDE EXPERIMENTALE ... 81 Objectifs ...81 Matériel et méthode ...82 Population étudiée ... 82 Protocole de dissection ... 83 Mesures macroscopiques ... 85 Support de mesures ... 85 Outil de mesures ... 86 Nature des mesures ... 86 Surfaces ... 86 Longueur « colonne tendineuse – extrémité » (LCE) ... 88 Répétition des mesures ... 89 Traitement des données ... 89 Paramètres et variables considérées ... 89 Lignes conductrices du traitement des données ... 90 Modalités des tests statistiques menés ... 92 Résultats ...93 Description de la population ... 93 Influence de l’opérateur ... 95 Corrélation entre le poids, les ratios et la surface diaphragmatique totale ... 96 Influence de la face diaphragmatique sur les variables anatomiques du diaphragme ... 98 Influence des facteurs individuels sur les variables anatomiques du diaphragme ... 99 Influence de la race ... 99 Influence du poids ... 103 Influence de la note d’état corporel ... 109 Influence du sexe ... 111 Influence du statut reproducteur : entier/stérilisé ... 113 Influence de l’âge ... 115 Variations interspécifiques de l’anatomie du diaphragme : étude comparative entre le chien et le chat ... 115 Comparaison interspécifique générale ... 115 Comparaison interspécifique au sein du même type racial ... 118
Discussion ... 121 Protocole expérimental ... 121 Prélèvement du diaphragme ... 121 Support de mesures et mesures ... 121 Facteurs individuels ... 122 Variables anatomiques ... 123 Expression des variables sous forme de ratio ... 123 L’épaisseur tissulaire... 125 Échantillon de l’étude ... 125 Résultats ... 126 Corrélation du poids et de la surface totale du diaphragme... 126 Faces diaphragmatiques ... 127 Influence des facteurs individuels ... 128 Le type racial ... 128 Le poids ... 131 La note d’état corporel ... 132 Sexe, statut reproducteur, âge ... 132 Organisation anatomique du diaphragme chez les carnivores domestiques ... 133 CONCLUSION ... 139 REFERENCES ... 143
A .
LISTE DES FIGURES
FIGURE 1 :COUPE TRANSVERSALE D’UN EMBRYON EN DEBUT D’ORGANOGENESE (1) (MCGEADYETAL.,2017) ... 12
FIGURE 2:COUPE TRANSVERSALE D’UN EMBRYON EN DEBUT D’ORGANOGENESE (2)(MCGEADYETAL.,2017) ... 13
FIGURE 3:SCHEMA DE DIVISION DES SOMITES EN COUPE TRANSVERSALE (LANGMANETAL.,2001) ... 14
FIGURE 4 :EMBRYON EN VUE LATERALE GAUCHE APRES REMANIEMENTS DES CAVITES (MCGEADYETAL.,2017) ... 15
FIGURE 5:COUPES TRANSVERSALES SEQUENTIELLES D'EMBRYONS ET FORMATION DU DIAPHRAGME (MCGEADYETAL., 2017) ... 17
FIGURE 6:IMMUNOHISTOCHIMIE CIBLANT PAX3 SUR LE DIAPHRAGME D’EMBRYON DE SOURIS A DIFFERENTS AGES (CLUGSTON ET AL.,2007)... 19
FIGURE 7:SCHEMA D'UNE VUE LATERALE DU THORAX AVEC SILHOUETTE DIAPHRAGMATIQUE (EN ROUGE) D'UN CHIEN EN INSPIRATION (POINTILLES) ET EXPIRATION (TRAIT PLEIN)(DYCE ET AL.,2010) ... 21
FIGURE 8:PHOTOGRAPHIE DE LA FACE CRANIALE D’UN DIAPHRAGME DE CHIEN EN PLACE (DYCEETAL.,2010) ... 22
FIGURE 9:SCHEMA DE LA FACE CAUDALE D’UNE DIAPHRAGME DE CHIEN (EVANSETAL.,2010) ... 22
FIGURE 10:SCHEMA DE LA FACE CRANIALE DU DIAPHRAGME DE CHIEN :PARS LUMBALIS ET MUSCLES ADJACENTS (EVANS ET AL.,2013) ... 24
FIGURE 11:REGION DU HIATUS ŒSOPHAGIEN DU DIAPHRAGME D'UN CHIEN EN VUE CRANIALE (RUBERTEPARISETAL., 1995) ... 25
FIGURE 12:ORGANISATION DES FIBRES TENDINEUSES DU CENTRE TENDINEUX DU DIAPHRAGME CHEZ L'HOMME (BLAIR,1923) ... 27
FIGURE 13:INSERTION DES FIBRES MUSCULAIRES DE LA BANDE CHARNUE PERIPHERIQUE SUR LA FACE INTERNE DE LA CAGE THORACIQUE D'UN CHAT... 28
FIGURE 14:COUPE MEDIANE DU THORAX DE CHAT –RAPPORTS ORGANIQUES (RUBERTEPARISETAL.,1995) ... 29
FIGURE 15:SECTION DORSALE DU TRONC D'UN CHIEN AU NIVEAU DE LA BASE DU CŒUR -RAPPORTS ORGANIQUES (DYCEETAL.,2010) ... 30
FIGURE 16:SCHEMA DE L'ANGLE COSTO-DIAPHRAGMATIQUE (SCHÜNKE,2005) ... 31
FIGURE 17:RELATIONS ANATOMIQUES ENTRE LE FOIE ET LE DIAPHRAGME DU CHIEN (RUBERTEPARISETAL.,1995) ... 32
FIGURE 18:SCHEMA DU RESEAU ARTERIEL DU DIAPHRAGME DU CHAT EN VUE CRANIALE (BISCOEETAL.,1963) ... 35
FIGURE 19:SCHEMA DE LA VASCULARISATION DE L’HEMI-COUPOLE DIAPHRAGMATIQUE GAUCHE CHEZ UN CHIEN (COMTOIS ET AL.,1987) ... 36
FIGURE 20:RESEAU ARTERIEL DU DIAPHRAGME DE SOURIS REVELE PAR FLUORESCENCE ASSOCIEE AU GENE XLACZ4(STUELSATZETAL.,2012)... 37
FIGURE 21:CARTOGRAPHIE DE L'INNERVATION DU DIAPHRAGME EN FONCTION DE L’ORIGINE MEDULLAIRE CHEZ LE CHIEN (A) ET LE CHAT (B) SELON SAN’T AMBROGIO ET DE TROYER ... 39
FIGURE 22:TRAJET DU NERF PHRENIQUE DROIT AU NIVEAU DU MEDIASTIN CAUDAL D'UN CHIEN ... 40
FIGURE 23:TYPES D'UNITE MOTRICES (A)-SUPERFICIE DE LA SECTION TRANSVERSALE (B)-FORCE MAXIMALE DES FIBRES (C)(FOGARTY ET AL.,2018) ... 43
FIGURE 24:RECRUTEMENT DES UNITES MOTRICES ET FORCE GENEREE EN FONCTION DU PROCESSUS MOTEUR AU NIVEAU DES VOIES RESPIRATOIRES (FOGARTY ET AL.,2018) ... 44
FIGURE 25:STIMULATION ELECTRIQUE DE LA PARTIE LOMBAIRE ET DE LA BANDE CHARNUE PERIPHERIQUE - SUIVI MONITORING DE LA PRESSION ABDOMINALE, DU VOLUME PULMONAIRE ET DES CIRCONFERENCES
ABDOMINALE CRANIALE ET THORACIQUE CAUDALE (DE TROYER ET AL.,1981) ... 49
FIGURE 26:SECTION DORSALE DU TRONC D'UN CHIEN AU NIVEAU DE LA BASE DU CŒUR -SURFACES D'APPOSITION (IMAGE ORIGINALE :DYCEETAL.,2010) ... 50
FIGURE 27:MODELISATION DE L’AMPLITUDE RELATIVE ET DE LA DIRECTION DES VECTEURS DE TENSION SUR LA SURFACE DIAPHRAGMATIQUE LORS DE RESPIRATION SPONTANEE (BORIEK ET AL.,2005) ... 52
FIGURE 28:ENREGISTREMENT MONITORING ELECTROMYOGRAPHIQUE, BAROMETRIQUE ABDOMINAL ET THORACIQUE ET FLUX D’AIR DANS LA SONDE ENDOTRACHEALE DURANT UN EPISODE DE TOUX CHEZ UN CHIEN (KOBAYASHI ET AL.,1992) ... 56
FIGURE 29:ENREGISTREMENT MONITORING ELECTROMYOGRAPHIQUE, MORPHOMETRIQUE ET BAROMETRIQUE ABDOMINAL DURANT UN EPISODE DE VOMISSEMENT CHEZ UN CHIEN (ABEETAL.,1993) ... 59
FIGURE 30:ENREGISTREMENT MONITORING ELECTROMYOGRAPHIQUE, BAROMETRIQUE ŒSOPHAGIEN ET DE SUIVI DE PH DURANT UN EPISODE DE REFLUX GASTRO-ŒSOPHAGIEN SPONTANE CHEZ UN CHIEN (MARTINETAL.,1992)61
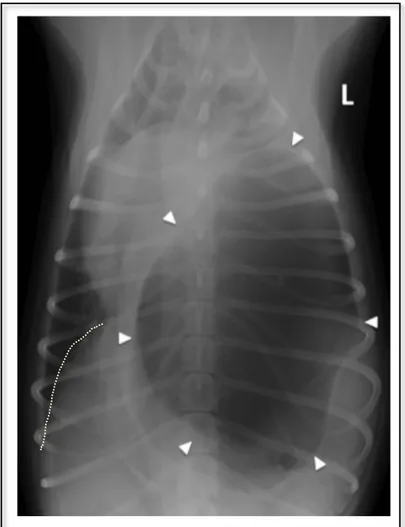
FIGURE 31:RADIOGRAPHIE THORACIQUE D'UN PROFIL GAUCHE D'UN CHIEN CAVALIER KING CHARLES MALE ENTIER DE 10 SEMAINES ATTEINT D’HERNIE PLEURO-PERITONEALE AU NIVEAU DU PILIER GAUCHE (ROSSANESE ET AL.,2018) ... 63
FIGURE 32:RADIOGRAPHIE THORACIQUE DE FACE D'UN CHIEN CAVALIER KING CHARLES MALE ENTIER DE 10
SEMAINES ATTEINT D’HERNIE PLEURO-PERITONEALE AU NIVEAU DU PILIER GAUCHE (ROSSANESEETAL.,2018) ... 64
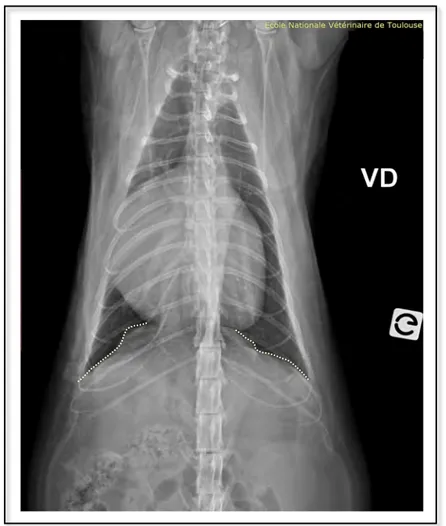
FIGURE 33:RADIOGRAPHIE THORACIQUE DE FACE D'UN CHAT EUROPEEN MALE CASTRE DE 5 ANS ATTEINT D’UNE HERNIE PERITONEO-PERICARDIQUE (SERVICE D’IMAGERIE DE L’ENVT) ... 68
FIGURE 34:RADIOGRAPHIE THORACIQUE D’UN PROFIL GAUCHE D'UN CHAT DE 5 ANS ATTEINT D’UNE HERNIE PERITONEO-PERICARDIQUE (SERVICE D’IMAGERIE DE L’ENVT) ... 69
FIGURE 35:SCHEMA DES TROIS TYPES DE DECHIRURES LORS DE HERNIE DIAPHRAGMATIQUE ACQUISE ... 72 FIGURE 36:RADIO DE PROFIL D'UN CHAT MALE CASTRE DE 3 ANS ATTEINT D'UNE HERNIE DIAPHRAGMATIQUE
ACQUISE TRAUMATIQUE (SERVICE D’IMAGERIE DE L’ENVT) ... 75
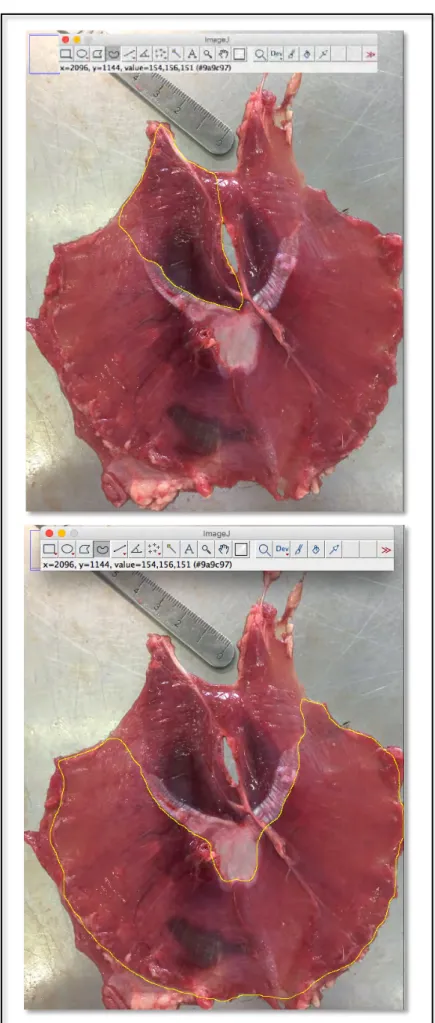
FIGURE 37:BLOC FINAL DE DISSECTION DU DIAPHRAGME (CHEZ UN CHIEN)–VUE LATERALE GAUCHE ... 84 FIGURE 38:PHOTOGRAPHIE SUPPORT DE MESURES FINAL (DIAPHRAGME DE CHAT – FACE THORACIQUE) ... 85 FIGURE 39:METHODE DE DETOURAGE DU PILIER DROIT ET DE LA BANDE CHARNUE PERIPHERIQUE SUR LA FACE
THORACIQUE DU DIAPHRAGME D'UN CHAT ... 87 FIGURE 40:DISTANCE ENTRE LA COLONNE TENDINEUSE DROITE ET L’EXTREMITE EN REGARD ... 88 FIGURE 41:CHRONOLOGIE D'ETUDE D'EVENTUELS FACTEURS-CARACTERES IMPLIQUES DANS L'ANATOMIE DU
DIAPHRAGME ET VARIABLES ANATOMIQUES ... 91 FIGURE 42:VISUALISATION DES DONNEES SOUS FORME DE BOX PLOT : EXEMPLE THEORIQUE ... 92 FIGURE 43:CONTRIBUTION DE LA DIFFERENCE NATURELLE ENTRE INDIVIDUS ET DE L’OPERATEUR A LA VARIANCE DE LA SURFACE DU PILIER GAUCHE (PLG) CHEZ DEUX CHIENS ET UN CHAT ... 95 FIGURE 44:REPRESENTATION GRAPHIQUE DE LA SURFACE DIAPHRAGMATIQUE TOTALE EN FONCTION DU POIDS DE L'INDIVIDU... 96
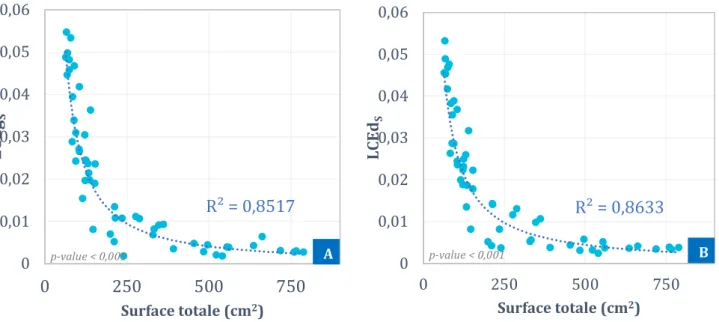
FIGURE 45:LCEGS(A) ET LCEDS(B) EN FONCTION DE LA SURFACE TOTALE DU DIAPHRAGME ... 97
FIGURE 46:COMPARAISON DE CT%S(A),M%S(B),BCP%S(C) ET PL%S(D) EN FONCTION DU TYPE RACIAL CHEZ LES CHIENS ... 101
FIGURE 47:COMPARAISON DE CT%S(A),M%S(B) EN FONCTION DU TYPE RACIAL CHEZ LES CHATS ... 102
FIGURE 48:BCP%S(A),BCP%M(B),PL%S(C),PL%M(D) EN FONCTION DU POIDS CHEZ LES CHIENS ... 104
FIGURE 49:M%S(A),CT%S(B), PL%S(C),PL%M(D),BCP%S(E),BCP%M(F) EN FONCTION DU POIDS CHEZ LES CHATS ... 106
FIGURE 50:PLG%PL(A) ET PLD%PL(B) EN FONCTION DU POIDS CHEZ LES CHIENS BRACHYCEPHALES ... 107
FIGURE 51:M%S(A),CT%S(B),BCP%M(C),BCP%S(D),PL%M(E),PL%S(F) EN FONCTION DU POIDS CHEZ LES CHATS NON BRACHYCEPHALES ... 108
FIGURE 52:M%S(A) ET CT%S(B) EN FONCTION DE LA NOTE D’ETAT CORPORELLE CHEZ LES CHIENS... 110
FIGURE 53:COMPARAISON DE M%S(A),CT%S(B),BCP%S(C) ENTRE LES CHIEN ET LES CHATS ... 117
FIGURE 54:COMPARAISON DE M%S(A),CT%S(B),BCP%S(C) ENTRE LES CHIENS ET LES CHATS NON BRACHYCEPHALES ... 120
FIGURE 55:FACE ABDOMINALE D'UN DIAPHRAGME DE CHAT AVEC LE LIGAMENT FALCIFORME EN PLACE... 123
FIGURE 56:LCEG (A) ET LCED (B) EN FONCTION DE LA SURFACE DIAPHRAGMATIQUE TOTALE ... 124
FIGURE 57:MESURE DU RATIO CRANIO-FACIAL CHEZ TROIS CHIENS BRACHYCEPHALES (PACKERETAL.,2015) ... 129
FIGURE 58:CARTOGRAPHIE DE L'ORGANISATION ANATOMIQUE MOYENNE DU DIAPHRAGME CHEZ LE CHIEN ET LE CHAT ... 134
FIGURE 59:MODELISATION DU GRADIENT DE RESISTIVITE TRANSVERSALE DE LA BANDE CHARNUE PERIPHERIQUE CHEZ LE CHAT ET LE CHIEN ... 137
LISTE DES TABLEAUX
TABLEAU 1:DESCRIPTION DE LA POPULATION ETUDIEE ... 94 TABLEAU 2:VALEURS OBTENUES A L’ISSUE DU TEST DE CORRELATION DE PEARSON ENTRE LA SURFACE
DIAPHRAGMATIQUE TOTALE ET LES VARIABLES ANATOMIQUES CHEZ LE CHIEN ET LE CHAT... 97
TABLEAU 3:COMPARAISON DES VARIABLES ANATOMIQUES EN FONCTION DE LA FACE DIAPHRAGMATIQUE ... 98 TABLEAU 4:COMPARAISON DES VARIABLES ANATOMIQUES EN FONCTION DU TYPE RACIAL CHEZ LES CHIENS ... 100 TABLEAU 5:COMPARAISON DES VARIABLES ANATOMIQUES EN FONCTION DU TYPE RACIAL CHEZ LES CHATS .... 102 TABLEAU 6:VALEURS OBTENUES A L’ISSUE DU TEST DE CORRELATION DE PEARSON ENTRE LE POIDS ET LES
VARIABLES ANATOMIQUES CHEZ LES CHIENS ET CHATS ... 103 TABLEAU 7:VALEURS OBTENUES A L’ISSUE DU TEST DE CORRELATION DE PEARSON ENTRE LE POIDS ET LES
VARIABLES ANATOMIQUES CHEZ LES CHIENS ET LES CHATS BRACHYCEPHALES (A) ET NON
BRACHYCEPHALES (B) ... 107
TABLEAU 8:VALEURS OBTENUES A L’ISSUE DU TEST DE CORRELATION DE PEARSON ENTRE LE POIDS ET LES VARIABLES ANATOMIQUES CHEZ LES CHATS NON BRACHYCEPHALES (INDIVIDU DE 6,3 KG ECARTE) ... 109 TABLEAU 9:VALEURS OBTENUES A L’ISSUE DU TEST DE CORRELATION DE PEARSON ENTRE LA NOTE D'ETAT
CORPOREL ET LES VARIABLES ANATOMIQUES CHEZ LE CHIEN ET LE CHAT ... 109 TABLEAU 10:VALEURS OBTENUES A L’ISSUE DU TEST DE CORRELATION DE PEARSON ENTRE LA NOTE D’ETAT
CORPOREL ET LES VARIABLES ANATOMIQUES CHEZ LES CHIENS ET LES CHATS BRACHYCEPHALES (A) ET NON BRACHYCEPHALES (B) ... 110
TABLEAU 11:COMPARAISON DES VARIABLES ANATOMIQUES EN FONCTION DU SEXE CHEZ LE CHIEN ... 111
TABLEAU 12:COMPARAISON DES VARIABLES ANATOMIQUES EN FONCTION DU SEXE CHEZ LE CHAT ... 112 TABLEAU 13:COMPARAISON DES VARIABLES ANATOMIQUES EN FONCTION DU STATUT REPRODUCTEUR CHEZ LE
CHIEN ... 113 TABLEAU 14:COMPARAISON DES VARIABLES ANATOMIQUES EN FONCTION DU STATUT REPRODUCTEUR CHEZ LE
CHAT ... 114 TABLEAU 15:VALEURS OBTENUES A L’ISSUE DU TEST DE CORRELATION DE PEARSON ENTRE L’AGE ET LES
VARIABLES ANATOMIQUES CHEZ LE CHIEN ET LE CHAT ... 115
TABLEAU 16:COMPARAISON DES VARIABLES ANATOMIQUES ENTRE LE CHIEN ET LE CHAT ... 116
TABLEAU 17:COMPARAISON DES VARIABLES ANATOMIQUES ENTRE LES CHIENS ET CHATS BRACHYCEPHALES . 118 TABLEAU 18:COMPARAISON DES VARIABLES ANATOMIQUES ENTRE LES CHIENS ET CHATS NON BRACHYCEPHALES
... 119
B.
LISTE DES ABREVIATIONS
- BCP bande charnue périphérique - BCP%S surface de la bande charnue périphérique divisée par la surface totale - BCP%M surface de la bande charnue périphérique divisée par la surface musculaire totale - CT%S surface du centre tendineux divisée par la surface totale - JMT jonction entre le muscle et le centre tendineux - LCE distance entre la pointe de la colonne tendineuse et l’extrémité en regard - LCEgS distance entre la pointe de la colonne tendineuse gauche et l’extrémité divisée par la surface totale diaphragmatique - LCEdS distance entre la pointe de la colonne tendineuse droite et l’extrémité divisée par la surface totale diaphragmatique - M%S surface de la partie musculaire divisée par la surface totale - NEC note d’état corporel - Pab pression intra-abdominale - Pdi pression transdiaphragmatique - Pth pression intra-thoracique - PL pars lumbalis - PL%S surface de la pars lumbalis divisée par la surface totale - PL%M surface de la pars lumbalis divisée par la surface musculaire - PLd portion droite de pars lumbalis = pilier droit - PLd%PL proportion du pilier droit dans la pars lumbalis - PLg portion gauche de pars lumbalis = pilier gauche - PLg%PL proportion du pilier gauche dans la pars lumbalis - SORB syndrome obstructif des races brachycéphales - Unité motrice Fint unité motrice de type « fast/fatigue-intermediate » - Unité motrice FF unité motrice de type « fast/fatigable » - Unité motrice FR unité motrice de type « fast/fatigue-resistant » - Unité motrice S unité motrice de type « slow/fatigue-resistant »
C.
INTRODUCTION
L’ensemble des amniotes disposent d’un système respiratoire permettant un flux d’air aspiré par expansion de la cavité corporelle. Le principal facteur déterminant est l’expansion de la cage thoracique par les muscles intercostaux. Bien que certains tétrapodes aient développé des muscles accessoires aidant (oiseaux, crocodiliens) ou remplaçant (tortues) le mouvement costal comme mécanisme d’inspiration, seuls les mammifères possèdent un diaphragme (PERRY ET AL., 2010).
L’organisation anatomique générale de cet organe ainsi que ses composants vasculaires et nerveux sont décrits chez les carnivores domestiques. Séparant la cavité thoracique de la cavité abdominale, il est composé d’une partie musculaire organisée autour d’un centre tendineux lui conférant une activité contractile nécessaire à ses fonctions. Connu principalement pour son implication dans la physiologie respiratoire, le diaphragme prend part aussi dans d’autres mécanismes des sphères digestive et respiratoire. Une synthèse bibliographique des connaissances anatomiques, physiologiques et pathologiques du diaphragme composera la première partie de ce manuscrit.
Malgré le fait que le diaphragme fasse l’objet de nombreuses recherches, avec pour beaucoup d’entre elles, le chien ou la souris comme sujets d’étude, peu d’éléments de différence au sein des individus de l’espèce canine ou féline, ont déjà été investigués. En effet, certains organes, comme les voies aériennes supérieures, adoptent une conformation différente selon le caractère brachycéphale ou non de l’animal (PACKER ET AL., 2015). Mais encore, le chien gériatrique dispose d’une masse musculaire moindre que le
jeune (BELLOWS ET AL., 2015). C’est pourquoi le premier axe de cette étude expérimentale consiste
à évaluer l’influence de plusieurs caractères individuels sur l’organisation anatomique du diaphragme chez le chien et le chat. D’autre part, la comparaison de la conformation
anatomique du diaphragme entre l’espèce canine et féline n’a jamais été menée. C’est donc la deuxième problématique à laquelle ce manuscrit va s’employer à répondre.
Enfin, des différences objectivées au sein d’une des deux espèces de carnivores domestiques ou entre celles-ci feront l’objet d’une discussion à la lumière des données bibliographiques.
D.
PARTIE I : SYNTHESE BIBLIOGRAPHIQUE
Développement du diaphragme
Afin de comprendre la formation du diaphragme lors de la genèse d’un nouvel individu, il est essentiel de l’intégrer dans le développement des cavités corporelles qu’il sépare. Généralités sur l’embryogénèse Le développement d’un nouvel individu mammifère débute par la fécondation d’un ovocyte par un spermatozoïde. Une succession d’étapes, donnant naissance à des états spécifiques, définissent l’embryogénèse. La première, en continuité avec la fécondation, est caractérisée par des mitoses consécutives lui conférant le nom de segmentation (ou clivage). Les cellules, formées par segmentation holoblastiques chez les mammifères, se nomment blastomères. Leur organisation en sphère compactée et d’aspect bosselé est appelée morula. Les cellules superficielles sont à l’origine du trophoblaste (qui formera le chorion placentaire) chez l’Homme et la souris mais dégénèrent chez les autres mammifères (FLETCHER ET AL., 2010). Les
plus profondes sont impliquées dans la suite de l’embryogénèse.
La seconde, gastrulation, permet la formation des trois feuillets embryonnaires (ectoderme, mésoderme et endoderme) et des plis céphaliques, caudal et latéraux, par des mouvements cellulaires importants.
La dernière, la plus longue, est l’organogénèse qui permet à l’embryon d’acquérir sa maturité. Les organes vont se former par différentiation cellulaire à partir des trois types de feuillets primitifs. Par exemple, une sous-étape appelée neurulation donne naissance à l’ébauche du système nerveux central à partir de l’ectoderme.
Formation des cavités cœlomiques
A la fin de la gastrulation, le mésoderme (ou mésoblaste) est divisé en trois régions distinctes de part et d’autre de la ligne médiane : le mésoblaste para-axial (prolifération de cellules à proximité de la ligne médiane), le mésoblaste latéral (fine lame cellulaire) et le mésoblaste intermédiaire (jonction entre les deux premiers). Des lacunes, correspondant à des espaces intercellulaires, se forment au niveau des portions gauche et droite du mésoblaste latéral (figure 1) (MCGEADY ET AL., 2017).
La coalescence des lacunes vient séparer le mésoblaste latéral en deux parties par une cavité, nommée cavité cœlomique gauche et droite (ou cœlome interne). La couche de mésoderme latéral la plus externe (somatique) forme le somatopleure en association avec l’ectoderme. La plus interne (splanchnique), en continuité avec le mésenchyme tapissant la vésicule vitelline, prend le nom de splanchnopleure (Figure 2). Chacune des cavités cœlomiques s’étend vers le pôle crânial pour y fusionner en avant des plaques neurales. Figure 1 : Coupe transversale d’un embryon en début d’organogénèse (1) (MCGEADY ET AL., 2017) Mésoblaste para-axial Gouttière neurale Ectoderme Mésoderme
latéral Chorde Endoderme
Lacunes
Mésoderme intermédiaire
En parallèle, le mésoblaste para-axial s’organise crânio-caudalement en segments, les somitomères, qui en se creusant deviennent des somites. En région céphalique, les somitomères sont à l’origine du mésenchyme céphalique en association avec le neuromère. On en compte 42 à 44 paires chez l’Homme (LANGMAN ET AL., 2001). Chaque somite se
différencie en trois régions (Figure 3). Les cellules de la paroi médiale migrent autour du tube neural et forment le sclérotome, à l’origine des vertèbres, des côtes et de l’os sous-chondral du crâne. Les cellules latérales se regroupent en dermatome, précurseur du derme. Enfin, les cellules intermédiaires prennent le nom de myotome qui donnera naissance à tous les éléments musculaires du métamère concerné (FLETCHER ET AL., 2010).
Somite Gouttière neurale Mésoderme intermédiaire
Cœlome intra-embryonnaire Aortes dorsales Splanchnopleure Somatopleure Mésoderme somatique Mésoderme splanchnique Figure 2 : Coupe transversale d’un embryon en début d’organogénèse (2) (MCGEADY ET AL., 2017)
A ce stade, la structure générale de l’embryon subit de larges remaniements. Les plis limitants latéraux divisent la cavité cœlomique en un cœlome intra-embryonnaire (ou interne), précurseur des cavités péricardique, pleurales et péritonéale, et en un cœlome extra-embryonnaire (ou externe). Initialement continus au niveau de l’ombilic, ils se séparent rapidement. La région convexe du cœlome interne en forme de fer à cheval occupe une position ventrale par rapport aux tube digestif et cœur primitif ; elle donnera naissance à la cavité péricardique. Le reste de la cavité cœlomique deviendra la cavité péritonéale, reliée à la partie crâniale par les canaux péricardo-péritonéaux gauche et droit (Figure 4) (MCGEADY ET AL., 2017).
Figure 3 : Schéma de division des somites en coupe transversale (LANGMAN ET AL., 2001) Tube neural Sclérotome Dermatome Myotome
D’un point de vue histologique, les cellules de la somatopleure se différencient en cellules mésothéliales qui auront pour rôle de tapisser les cavités corporelles en formant le feuillet pariétal des séreuses. De la même manière, la splanchnopleure formera le feuillet viscéral (LANGMAN ET AL., 2001).
Formation des cavités pleurales et péricardique
Les ébauches de poumons et de cœur sont bordées par les segments gauche et droit du cœlome interne crânial. Des plis mésodermiques, appelés plis pleuro-péricardiques se développent dans le sens latéro-médial de part et d’autre de l’embryon. Ils contiennent les veines cardinales communes et les nerfs phréniques gauche et droit (constituant l’innervation du diaphragme). Lorsque les plis gauche et droit se rencontrent, ils compartimentent le cœlome crânial en deux cavités pleurales dorsales et une cavité péricardique ventrale. Cœur Cerveau Tube digestif crânial Stomodeum Cavité péricardique Septum transversum Canal péricardo-péritonéal gauche Aortes dorsales Cavité péritonéale Figure 4 : Embryon en vue latérale gauche après remaniements des cavités (MCGEADY ET AL., 2017)
Une communication entre les cavités pleurales et le cœlome intra-embryonnaire caudal persiste grâce aux canaux pleuro-péritonéaux gauche et droit. Les poumons se développant, ils éloignent l’un de l’autre le bord latéral de chaque cavité pleurale et rapprochent leur bord médial. Le cœur est initialement suspendu par le mésocarde dorsal et ancré au mésocarde ventral. L’atrophie de ces derniers, associée aux plis pleuro-péricardiques, isole la cavité péricardique. Une fusion des couches cellulaires internes de la paroi thoracique et des cellules des plis pleuro-péricardiques forment la couche fibreuse du péricarde. Les nerfs phréniques gauche et droit s’y logent de part et d’autre du cœur. Enfin, cette couche fixe ce dernier au diaphragme chez les carnivores domestiques et prend le nom de ligament phrénico-péricardique (LANGMAN ET AL., 2001; MCGEADY ET AL., 2017).
Séparation des cavités pleurales et péritonéales
Comme cité précédemment, les canaux pleuro-péritonéaux, se situant de part et d’autre du tube digestif crânial, permettent une communication majeure entre les cavités péritonéale et pleurales. La première phase de développement du diaphragme est l’organisation d’une épaisse lame cellulaire mésoblastique en arrière du cœur (CLUGSTON ET AL., 2007). Elle forme une cloison transversale partielle nommée septum transversum,
appréciable sur la figure 4 en vue latérale et sur la figure 5 en coupe transversale (LANGMAN ET
AL., 2001; MCGEADY ET AL., 2017).
Par la suite, un pli pleuro-péritonéal se développe dans chaque angle dorso-latéral des canaux pleuro-péritonéaux et s’étend en direction ventro-médiale (Figure 5-B). Chacun finit par fusionner dorsalement avec le pli mésothélial suspendant l’œsophage, le méso-œsophage et ventralement avec le septum transversum (Figure 5-C). Cette structure prend le nom de membrane pleuro-péritonéale (LANGMAN ET AL., 2001; MCGEADY ET AL., 2017).
A : Formation des plis pleuro-péritonéaux ; B :Migration des plis pleuro-péritonéaux ; C : Membrane pleuro-péritonéale et premiers myocytes périphériques
A
B
Figure 5 : Coupes transversales séquentielles d'embryons et formation du diaphragme (MCGEADY ET AL., 2017) Œsophage Veine cave caudale Paroi thoracique Septum transversum Myoblastes (bourrelet musculaire) Aorte Veine cave caudale Paroi thoracique Septum transversum Œsophage Canaux pleuro-péritonéaux Aorte Canaux pleuro-péritonéaux Méso-œsophage Œsophage Plis pleuro-péritonéaux Aorte Veine cave caudale Paroi thoracique Septum transversumC
La dernière étape est la mise en place de la musculature diaphragmatique. Plus détaillée en partie II.2 (page 21), elle se compose d’une bande charnue périphérique (BCP) et d’une partie lombaire (PL). Différentes hypothèses, concernant la formation de la portion musculaire, subsistent dans la littérature.
La première, soutient une origine mésodermique commune aux muscles de la paroi thoracique et de la BCP du diaphragme. Un bourrelet musculaire se forme sur la périphérie de la membrane pleuro-péritonéale et du septum transversum (Figure 5-C). Les
myoblastes qui le composent, proviendraient de somites cervicaux et thoraco-abdominaux. Par migration cellulaire, les feuillets du diaphragme primitif sont colonisés par les myoblastes de façon centripète. Quant à l’origine de la partie lombaire, elle est supposée mésodermique et plus précisément du méso-œsophage. Dans l’étude de Troyer
et al. (1981), une stimulation électrique indépendante de la BCP résulte en une
augmentation du volume de la cage thoracique alors qu’une diminution est relevée lors de stimulation de la PL. Le diaphragme était déjà perçu comme deux muscles d’origine embryonnaire différente (DE TROYER ET AL., 1981; MCGEADY ET AL., 2017).
La seconde, se base sur des techniques de marquage protéique par immunohistochimie et de génie génétique chez la souris. Plusieurs protéines sont connues pour leur rôle primordial dans la migration des cellules précurseurs des muscles et issues des somites. L’une d’entre elle est codée par le gène c-met (BLADT ET AL., 1995 ; BIRCHMEIER
ET AL., 2000). L’inactivation de ce dernier chez des souris provoque un développement normal de la musculature axiale mais est responsable d’une agénésie de la portion musculaire du diaphragme. La première hypothèse paraît donc erronée. Cette deuxième théorie soutient une colonisation du diaphragme primitif par des myoblastes migrant vers les plis pleuro-péritonéaux.
Ces cellules subiraient une multiplication intense en directions dorsale, latérale et ventrale une fois les plis atteints. Ainsi, à l’inverse de l’hypothèse exposée précédemment, la partie lombaire du diaphragme aurait la même origine cellulaire que la bande charnue périphérique. En parallèle, les branches nerveuses du nerf phrénique croîtraient en direction des plis pleuro-péritonéaux puis développeraient nombres de ramifications afin d’innerver les nouvelles cellules musculaires différenciées (BABIUK ET AL., 2003; CLUGSTON ET AL., 2007).
La figure 6 illustre ce processus par l’utilisation d’immunohistochimie ciblant la protéine Pax3 exprimée par les cellules musculaires précurseurs et les cellules nerveuses du nerf phrénique. Il est possible d’apprécier la progression synchrone de la différenciation musculaire sur l’ensemble de la surface diaphragmatique et de l’innervation des myocytes nouvellement produits. Quant à l’origine des cellules musculaires, plusieurs études s’accordent sur l’implication des somites C3 à C5 (ALLAN ET AL., 1997; DIETRICH ET AL., 1999 ; BABIUK ET AL., 2003). Figure 6 : Immunohistochimie ciblant Pax3 sur le diaphragme d’embryon de souris à différents âges (CLUGSTON ET AL., 2007)
A
B
C
A : 15 jours ; B : 15,5 jours ; C : 17 jours. Les tissus nerveux et musculaire apparaissent respectivement noir et grisAnatomie descriptive du diaphragme
GénéralitésLe diaphragme est une fine organisation musculo-aponévrotique dont la principale finalité anatomique est de séparer la cavité thoracique de la cavité abdominale. Il comprend deux faces : la face crâniale, ou thoracique, (Figure 8) et la face caudale, ou abdominale (Figure 9) (DYCE ET AL., 2010). Sa surface est analogue à la conformation volumique
du thorax. En effet, les carnivores domestiques ornent un thorax aplati latéro-latéralement. Par conséquent, le diaphragme est plus étendu selon l’axe dorso-ventral, contrairement à celui de l’Homme (BARONE, 2000).
Il est d’aspect convexe sur toute sa face crâniale et inversement lorsqu’il est observé caudalement (DYCE ET AL., 2010). En vue de face (crâniale ou caudale), il dessine une
coupole dont le diamètre est dépendant de celui du thorax. En vue latérale, il adopte une forme de dôme dont la silhouette générale évolue selon le cycle respiratoire. Sa base est oblique et suit un plan délimité par les premières vertèbres lombaires en portion dorsale et le processus xiphoïde du sternum en portion ventrale. La courbure du diaphragme n’est pas totalement uniforme ; sa convexité est plus marquée au niveau de l’hémi-coupole droite de par la présence de la masse hépatique sur la face caudale. Cette forme est maintenue majoritairement par la dépression pleurale exerçant un effet « aspiration » sur sa face crâniale. En effet, lors de thoracotomie rompant la pression pleurale négative, le diaphragme s’affaisse considérablement. Seul le sommet de la convexité est maintenu en place par la veine cave caudale. Les organes abdominaux participent de manière plus modérée au maintien de la silhouette générale du diaphragme en exerçant une pression sur sa face caudale. Une laparotomie n’est pas responsable de perte de la voussure diaphragmatique. Le sommet de la courbure peut atteindre le plan transversal passant par l’extrémité ventrale de la partie osseuse de la sixième paire de côtes chez les carnivores, voire de la cinquième chez l’Homme (Figure 7). Par conséquent, la cavité thoracique possède un volume inférieur à celui délimité par l’ensemble de la cage
thoracique. Certains organes abdominaux, comme le foie, peuvent donc être recouverts dans la grande majorité de leur volume par la charpente thoracique (BARONE, 2000).
Constitution et conformation
Le diaphragme est une structure musculaire adoptant une constitution digastrique : il possède deux masses musculaires reliées par une structure tendineuse. Le premier groupe de fibres musculaires prend origine dans la région sous-lombaire, lui donnant le nom de pars lumbalis ou partie lombaire. Le second est organisé en adéquation avec la forme de la cage thoracique et rayonne sur son bord interne : c’est la bande charnue périphérique. Cette dernière peut elle-même être divisée en deux parties selon le lieu d’attache des fibres musculaires : la pars costalis, ou partie costale, constituée par les myocytes ayant comme terminaison l’arc costal et la pars sternalis, ou partie sternale, qui regroupe ceux dont le sternum reçoit les terminaisons. Enfin, des faisceaux fibreux inter-gastriques relient la bande charnue périphérique et la partie lombaire : c’est le centre tendineux (centrum tendineum) (BARONE, 2000). Les figures 8 et 9 illustrent l’organisation générale du diaphragme.
Figure 7 : Schéma d'une vue latérale du thorax avec silhouette diaphragmatique (en rouge) d'un chien en inspiration (pointillés) et expiration (trait plein) (DYCE ET AL., 2010)
Aorte Œsophage Veine cave caudale Pilier gauche Pilier droit Centre tendineux Pars costalis droite Pars sternalis Pars lumbalis Figure 9 : Schéma de la face caudale d’une diaphragme de chien (EVANS ET AL., 2010) Pars costalis gauche Aorte Œsophage Foramen de la veine cave caudale Pilier droit Pilier gauche Attache médiastin caudal Centre tendineux Pars costalis gauche Pars sternalis Pars lumbalis Figure 8 : Photographie de la face crâniale d’un diaphragme de chien en place (DYCE ET AL., 2010) Pars costalis droite
La partie lombaire
Nommée plus rarement partie crurale, la partie lombaire est très développée en épaisseur chez les carnivores domestiques. Elle débute sur la face ventrale des vertèbres lombaires L3 à L4 par un puissant système tendineux qui se divise en deux parties distinctes (gauche et droite) (KÖNIG ET AL., 2004). Chaque partie est elle-même divisée en une
longue portion attachée ventralement au corps de la quatrième vertèbre lombaire et une courte insérée sur la face ventrale de la troisième vertèbre lombaire. Un épais bloc musculaire se propage ensuite à partir de chacun des tendons : ce sont les piliers (ou
crura) gauche (crus sinistrum) et droit (crus dextrum) (BARONE, 2000). En vue latérale, l’axe des
piliers est presque parallèle au rachis ; en vue de face, les piliers adoptent une forme triangulaire (EVANS ET AL., 2013).
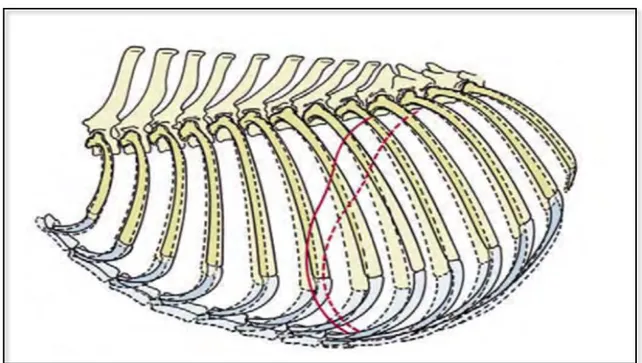
Le pilier droit est toujours plus large et plus long que le gauche (BARONE, 2000). Chez les
carnivores domestiques, il est théoriquement divisé en quatre parties (dorsale, ventrale, latérale et intermédiaire) difficilement discernables en pratique (KÖNIG ET AL., 2004). La portion
latérale s’unit à la partie costale de la bande charnue périphérique limitant l’extension de la colonne droite du centre tendineux et délimite l’arcade lombo-costale droite (arcus
lumbocostalis) (BARONE, 2000). Une petite zone triangulaire aponévrotique subsiste entre le
bord latéral du pilier droit et l’extrémité dorsale de la bande charnue périphérique. Elle s’attache sur la dernière côte ainsi que sur la face ventrale du muscle rétracteur de celle-ci (retractor costae) (EVANS ET AL., 2013).
Le pilier gauche est divisé en une portion latérale et intermédiaire ; la première est associée à la paroi costale et la deuxième au centre tendineux (KÖNIG ET AL., 2004). Une arcade
lombo-costale est aussi délimitée par la partie latérale du pilier gauche et le bord dorsal de la bande charnue périphérique. Des fibres musculaires provenant de la portion latérale du pilier gauche peuvent subsister au niveau du triangle aponévrotique résiduel (EVANS ET AL., 2013).
Les autres fibres des piliers rayonnent crânio-ventralement vers le centre tendineux. La figure 10 est une vue schématique de la face caudale du diaphragme de chien sur laquelle les éléments formateurs des piliers sont représentés. Aucune différence anatomique n’est rapportée entre le chien et le chat. 1 2 3 4 5 6 7
8 9 10 11 12 13 14 15 16 17 1. Quatrième vertèbre lombaire 2. Partie longue du tendon du pilier gauche 3. Troisième vertèbre lombaire 4. Partie courte du tendon du pilier gauche 5. Partie latérale du pilier gauche 6. Triangle aponévrotique gauche 7. Partie intermédiaire du pilier gauche 8. Hiatus œsophagien 9. Muscle transversus abdominis 10. Muscle psoas minor 11. Muscle quadratus lumborum 12. Muscle retractor costae 13. Hiatus aortique 14. Arcade lombo-costale droite 15. Partie latérale du pilier droit 16. Partie intermédiaire du pilier droit 17. Partie ventrale du pilier droit Figure 10 : Schéma de la face crâniale du diaphragme de chien : Pars lumbalis et muscles adjacents (EVANS ET AL., 2013)
Le système tendineux de la partie lombaire est organisé autour de l’aorte, à laquelle il ménage une gaine fibreuse et inextensible latéralisée à droite : le hiatus aortique. Ce dernier permet aussi le passage des veines azygos, hémi-azygos et du conduit thoracique lymphatique (EVANS ET AL., 2013). Dorsalement à la jonction entre les piliers et le
centre tendineux, les fibres musculaires délimitent le hiatus œsophagien laissant traverser l’œsophage et les troncs vagaux dorsal et ventral (Figure 11) (BARONE, 2000; EVANS ET AL., 2013) . L’œsophage prend attache au diaphragme par l’intermédiaire du ligament phréno-oesophagien formé par le fascia endothoracique et le fascia transversalis de l’abdomen. Chez le chat, l’extrémité distale du ligament est caudale à la jonction entre l’œsophage et l’estomac alors qu’elle est plus crâniale chez le chien. Enfin, l’attache de la membrane sur l’œsophage est plus superficielle chez le chat en comparaison avec le chien (BREMNER ET AL., 1970 ; BAYOUD ET AL., 2017). 4. Partie intermédiaire du pilier droit 5. Partie ventrale du pilier droit 8. Partie intermédiaire du pilier gauche 13. Hiatus œsophagien 14. Œsophage 15. Muqueuse 16. Tunique musculaire 17. Tronc vagal dorsal 18. Tronc vagal ventral 22. Attache du médiastin caudal Figure 11 : Région du hiatus œsophagien du diaphragme d'un chien en vue crâniale (RUBERTE PARIS ET AL., 1995)
Le centre tendineux
Aussi appelé centrum tendineum ou centre phrénique, le centre tendineux (CT) est une structure aponévrotique fine formant une continuité entre la bande charnue périphérique et la partie lombaire (BARONE, 2000). Il se compose d’une base triangulaire à
partir de laquelle s’étendent deux colonnes en forme de langue (ou folioles) dans les directions dorso-latérales gauche et droite. Deux couches de fibres peuvent être discernées à l’observation macroscopique : la couche abdominale et la couche thoracique.
Il se compose principalement des fibres tendineuses rayonnant des piliers (en grande partie de leur portion intermédiaire) vers la bande charnue périphérique mais aussi de fibres obliques ou entrecroisées, dans des directions variées. Les fibres des folioles sont globalement orthogonales au grand axe de la colonne et proviennent des arcades musculaires lombo-costales (BARONE, 2000). En 1923, D.M Blair a décrit avec grande
précision l’organisation des fibres tendineuses du centre phrénique diaphragmatique chez l’Homme (Figure 12) (BLAIR, 1923). Ses planches de dessin sont en accord avec le peu de
données concernant le centre tendineux disponibles en anatomie vétérinaire.
Sur une vue abdominale, la troisième ouverture appelée foramen de la veine cave caudale, se loge au niveau de la base du centre tendineux, latéralisée à droite et ventrale à la jonction pars lumbalis – centrum tendineum. Elle laisse traverser le vaisseau qui porte son nom (EVANS ET AL., 2013). Les fibres délimitant le foramen de la veine cave caudale suivent
une organisation concentrique. Une étude de 1989 s’est intéressée à l’architecture des fibres musculaires du diaphragme canin et félin. Elle rapporte une surface occupée par le centre tendineux d’environ 10% de la surface totale du diaphragme (n=4) chez le chat et 21% (n=3) chez le chien (GORDON ET AL., 1989).
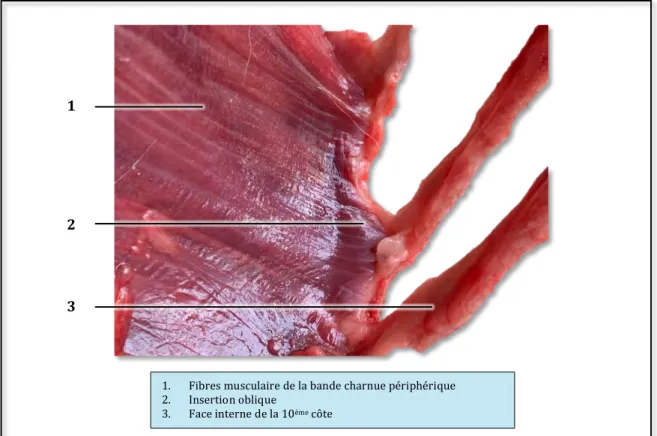
La bande charnue périphérique
La partie costale ou pars costalis peut être divisée en deux parties ; chacune de part et d’autre de la pars sternalis (Figures 8 et 9). Elle est constituée de faisceaux musculaires rayonnant à partir de la cage thoracique vers le centre tendineux. L’insertion des fibres sur toute la circonférence de la cage thoracique est organisée en dentelures obliques (Figure 13). Figure 12 : Organisation des fibres tendineuses du centre tendineux du diaphragme chez l'Homme (BLAIR, 1923)
B
1 2 34 3 4 1 2 A 1. Colonne tendineuse droite 2. Foramen de la veine cave caudale 3. Base triangulaire 4. Colonne tendineuse gauche B A : Face thoracique ; B : Face abdominale
La partie la plus caudale s’insère à mi-longueur de la face interne de la treizième côte environ. Sur les côtes qui précèdent, l’insertion se fait de plus en plus près de la jonction chondro-costale puis sur la portion cartilagineuse. Sur les insertions les plus caudales, les fibres musculaires se disposent en regard des festons du muscle transverse de l’abdomen (transversus abdominus). Enfin, il est rapporté que certaines fibres musculaires de la partie costale droite peuvent s’étendre jusqu’à l’aspect dorsal du
foramen de la veine cave (BARONE, 2000; EVANS ET AL., 2013).
La partie sternale ou pars sternalis est constituée de faisceaux musculaires rayonnant du sternum vers la base du centre tendineux. L’insertion se fait majoritairement sur la face dorsale du processus xiphoïde du sternum. Certaines fibres prennent naissance sur le fascia transversalis du muscle transverse de l’abdomen et sur la partie cartilagineuse de la huitième côte (BARONE, 2000; EVANS ET AL., 2013).
Figure 13 : Insertion des fibres musculaires de la bande charnue périphérique sur la face interne de la cage thoracique d'un chat
1. Fibres musculaire de la bande charnue périphérique 2. Insertion oblique
3. Face interne de la 10ème côte
1 2 3
Rapports
De par son rôle de cloison, le diaphragme entretient des rapports étroits et nombreux avec diverses structures abdominales et thoraciques. Les figures 14 et 15 sont des coupes anatomiques, réalisées respectivement chez un chat et un chien, qui illustrent parfaitement la proximité dans la topographie des organes que sépare le diaphragme. Il est tout de même important de rappeler que les contacts du diaphragme avec ses organes voisins peuvent varier entre espèces, entre individus de la même espèce, et chez un même individu (en fonction des mouvements, du cycle respiratoire…). 9. Apex cardiaque 14. Aorte 16. Lobe pulmonaire accessoire 17. Œsophage 22. Processus xiphoïde Figure 14 : Coupe médiane du thorax de chat – Rapports organiques (RUBERTE PARIS ET AL., 1995) 34. Bande charnue périphérique 35. Pilier droit diaphragmatique 36. Foie 37. Estomac Seules les légendes des organes en rapport avec le diaphragme sont explicitées
Une cloison fenêstrée Comme expliqué précédemment, le diaphragme autorise le passage de structures au travers de ses trois ouvertures : - Hiatus aortique : aorte, veine azygos, veine hémi-azygos et conduit thoracique lymphatique
- Hiatus œsophagien (Figure 11) : œsophage, tronc vagal dorsal et crânial - Foramen de la veine cave caudale : veine cave caudale
La partie lombaire, habillant le bord dorsal du diaphragme ventralement aux muscles psoas et aux premières vertèbres lombaires, est en contact direct avec le péritoine et la plèvre. Les troncs sympathiques traversent le diaphragme dorsalement à l’arcade lombo-costale de chaque côté et chacune d’entre elles livre passage aux muscles psoas (BARONE, 2000). Lobe pulmonaire caudal gauche Médiastin caudal Récessus costo-diaphragmatique Lobe pulmonaire caudal droit Lobe pulmonaire accessoire Foie Diaphragme Figure 15 : Section dorsale du tronc d'un chien au niveau de la base du cœur - Rapports organiques (DYCE ET AL., 2010)
Rapports sur la face thoracique
La face thoracique est presque entièrement recouverte par le fascia endothoracique et le feuillet pariétal de la plèvre. Cette dernière est beaucoup plus adhérente au niveau du centre tendineux en comparaison avec la partie musculaire du diaphragme. La face caudale des lobes pulmonaires caudaux et du lobe accessoire du poumon droit épouse la forme de la coupole diaphragmatique. Le médiastin s’insère sur le diaphragme selon une ligne irrégulière superposable au plan médian de la portion dorsale du diaphragme à l’œsophage et latéralisée à gauche ventralement à l’œsophage. Le péricarde se prolonge caudalement à l’apex cardiaque par le ligament phrénico-péricardique (phrenicopericardiacum), contenu dans le médiastin caudal. Le dôme diaphragmatique se projette en profondeur dans la cavité thoracique et l’insertion de certaines de ses fibres musculaires de la pars costalis se fait selon une direction très oblique. C’est pourquoi, un espace est formé bilatéralement entre la plèvre viscérale et la plèvre pariétale au niveau de l’angle costo-diaphragmatique: ce sont les récessus costo-diaphragmatiques ou costo-phréniques (Figure 16) (BARONE, 2000; EVANS ET AL., 2013).
Récessus costo-diaphragmatique Muscle intercostal externe Muscle intercostal interne Muscle intercostal intime Diaphragme Fascia endothoracique
Plèvre pariétale
Foie Plèvre viscérale Figure 16 : Schéma de l'angle costo-diaphragmatique (SCHÜNKE, 2005) Poumon
De la même manière, au niveau des arcades lombo-costales, les récessus lombo-diaphragmatiques sont des zones dépourvues de parenchyme pulmonaire. Au cours des mouvements respiratoires, ces récessus diminuent par expansion pulmonaire lors de l’inspiration et augmentent lors de l’expiration. Ils ne sont jamais entièrement comblés par le tissu pulmonaire (BARONE, 2000; EVANS ET AL., 2013).
Rapports sur la face abdominale
La face abdominale est dans sa quasi-totalité tapissée par le péritoine grâce au
fascia transversalis. Le foie est l’organe abdominal entretenant le plus de rapports avec le
diaphragme. En effet, l’hémi-coupole droite accueille la masse hépatique et donne à sa face diaphragmatique la forme convexe connue. Le contact très étroit entre les deux organes est permis par un ensemble de ligaments détaillés ci-après (figure 17) (BARONE, 2000).
2. Lobe latéral gauche du foie 3. Lobe médial gauche du foie 4. Lobe latéral droit du foie 5. Lobe médial droit du foie 12. Ligament coronaire du foie 13. Ligament triangulaire gauche 14. Ligament triangulaire droit 15. Ligament falciforme du foie 31. Bande charnue périphérique costale 32. Centre tendineux 33. Veine phrénique crâniale Figure 17 : Relations anatomiques entre le foie et le diaphragme du chien (RUBERTE PARIS ET AL., 1995)
Le ligament coronaire (coronarium hepatis) est le principal moyen de fixation du foie au diaphragme ; il loge aussi la veine cave caudale. Cette dernière est très adhérente au diaphragme et est en continuité tissulaire avec le foie. En résulte donc un moyen d’union supplémentaire. Le péritoine recouvre le ligament coronaire mais une zone en est dénuée au niveau du bord dorsal de la veine cave caudale : on l’appelle area nuda. A ce niveau, le foie est en contact direct avec le diaphragme. Cette particularité est beaucoup plus large chez l’Homme que chez les carnivores domestiques, chez qui elle ne mesure que quelques centimètres (EVANS ET AL., 2013). Les feuillets du péritoine du ligament coronaire
sont en continuité avec ceux des autres ligaments hépatiques. Le ligament falciforme (falciforme hepatis) est un vestige du mésentère ventral et s’étend du voisinage de l’ombilic au foramen de la veine cave caudale. Il est divisé en deux parties : la partie crâniale unissant le foie (au niveau du ligament rond du foie) au sillon de la veine cave caudale sur le diaphragme et la partie caudale, souvent incomplète, relie le foie à l’ombilic. Ce ligament subsiste sous la forme d’une lame séreuse entourée d’un dépôt de graisse qui peut s’avérer considérable avec l’embonpoint. Le ligament triangulaire droit (triangulare dextrum) est un repli de péritoine qui s'étend du pilier diaphragmatique droit à la partie dorsale du lobe hépatique latéral droit. En partie médiale, il se confond avec le feuillet péritonéal droit du ligament coronaire, ce qui y limite l’area nuda. Il est généralement plus long que large.
Le ligament triangulaire gauche (triangulare sinitrum) prend attache sur le diaphragme, à gauche du hiatus œsophagien, ainsi que sur la partie crânio-dorsale gauche du foie. Son bord latéral est libre alors que le feuillet péritonéal gauche du ligament coronaire est rattaché au bord médial du foie (BARONE, 2000; EVANS ET AL., 2013).
Enfin, le fundus gastrique et l’aspect crânial de la rate peuvent venir se loger caudalement à l’hémi-coupole gauche.
Vascularisation
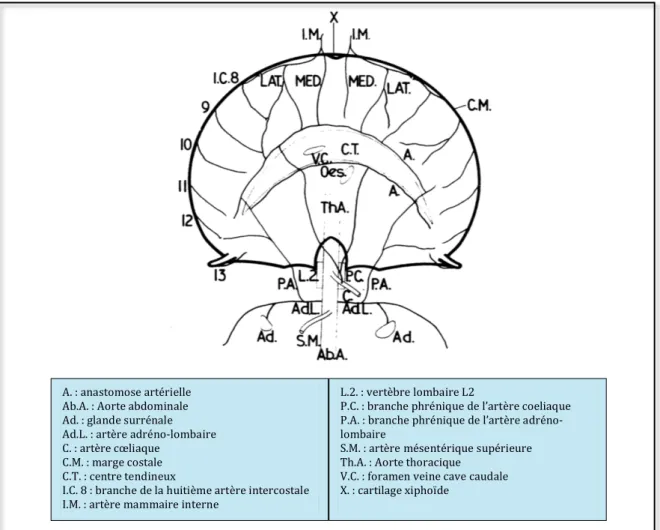
D’anciennes publications décrivent la vascularisation diaphragmatique chez les carnivores domestiques et seront le support des parties II.4.1 et II.4.2. Celle de la souris a fait l’objet de recherches utilisant de nouvelles techniques en génétique et sera évoquée en partie II.4.3. Chez le chat Une seule étude, datant d’après 1950, traite de la vascularisation du diaphragme du chat en utilisant une technique d’injection rétrograde de sulfate de baryum dans l’aorte abdominale (BISCOE ET AL., 1963). La première source de sang hématosé est le tronc cœliaque (collatérale de l’aorte) par l’intermédiaire des deux artères phréniques irriguant chacune un pilier et poursuivant leur trajet vers le bord ventral du centre tendineux. Les artères intercostales permettent la vascularisation de la bande charnue périphérique en y pénétrant sur la face thoracique pour les quatre premières branches et sur la face abdominale pour les deux dernières. Elles concourent toutes médialement vers le centre tendineux. L’artère sous-clavière donne naissance aux deux artères mammaires internes (ou thoraciques internes) qui pénètrent dans le diaphragme au niveau de la pars sternalis. Elles se divisent chacune en une portion médiale et latérale qui migrent vers le bord ventral du centre tendineux. Chez certains chats, on note l’implication d’une branche provenant de l’artère adréno-lombaire bilatéralement. Elle va être responsable de l’irrigation du secteur lombaire, par lequel elle y pénètre et de la partie costale la plus dorsale. Exceptionnellement, des ramifications de l’artère gastrique gauche et de l’artère hépatique sont impliquées dans l’apport sanguin artériel du diaphragme chez le chat (Figure 18).
Concernant le réseau veineux, peu de détails sont disponibles mais il semblerait que des veines parcourent le même trajet que les artères intercostales et mammaires internes. Deux grosses veines sont décrites de part et d’autre des colonnes tendineuses. Elles s’anastomosent ventralement aux piliers pour finir leur course dans la veine cave caudale (BISCOE ET AL., 1963). Chez le chien
Une technique d’injection de colorants via les trois grandes origines du sang artériel du diaphragme, décrites précédemment, a été utilisée chez le chien par Comtois
et al. en 1987 (Figure 19). L’origine des deux artères phréniques varient parmi les chiens,
Figure 18 : Schéma du réseau artériel du diaphragme du chat en vue crâniale (BISCOE ET AL., 1963) A. : anastomose artérielle Ab.A. : Aorte abdominale Ad. : glande surrénale Ad.L. : artère adréno-lombaire C. : artère cœliaque C.M. : marge costale C.T. : centre tendineux I.C. 8 : branche de la huitième artère intercostale I.M. : artère mammaire interne L.2. : vertèbre lombaire L2 P.C. : branche phrénique de l’artère coeliaque P.A. : branche phrénique de l’artère adréno-lombaire S.M. : artère mésentérique supérieure Th.A. : Aorte thoracique V.C. : foramen veine cave caudale X. : cartilage xiphoïde
la majorité étant les artères abdominales supérieures et moins fréquemment l’aorte abdominale ou le tronc cœliaque. Elles sont toutefois semblables, dans leur organisation, à celles du chat : elles pénètrent dans la pars lumbalis et progressent sur le bord latéral de la base du centre tendineux, après l’avoir traversé au niveau de la jonction base-colonne, pour y dessiner le cercle artériel interne. Des artères, dîtes phréniques accessoires, peuvent être présentes chez certains chiens. Elles sont originaires d’artères abdominales plus caudales à celles donnant naissance aux artères phréniques principales. Elles sont comparables dans leur trajet aux rameaux des artères adréno-lombaires chez le chat. La partie lombaire reçoit le même apport sanguin artériel que celui décrit chez le chat. Figure 19 : Schéma de la vascularisation de l’hémi-coupole diaphragmatique gauche chez un chien (COMTOIS ET AL., 1987) Artère mammaire interne gauche Aorte thoracique Centre tendineux 8ème artère intercostale Artères intercostales (9ème – 13ème) Pilier gauche Aorte abdominale Tronc cœliaque
Artère mésentérique crâniale Artère phrénique gauche
Artère abdominale supérieure
Cercle artériel interne
Arcade costo-phrénique
La pars costalis reçoit des afférences artérielles par les ramifications des artères intercostales qui s’anastomosent avec les vaisseaux du cercle artériel interne. Ce sont les arcades costophréniques. D’autres sont formées dans la partie lombaire par anastomose des artères phréniques accessoires avec les branches des artères intercostales les plus caudales et les artères phréniques principales. Le réseau veineux est globalement superposable à celui des artères de la même façon que chez le chat (COMTOIS ET AL., 1987). Étude récente chez la souris En 2012, une étude de Stuelsatz et al a établi une cartographie du réseau artériel, capillaire et veineux du diaphragme de souris. La modification de gènes spécifiquement exprimés dans les cellules musculaires lisses des artères et dans les cellules endothéliales des capillaires permet de révéler le territoire qu’elles occupent par fluorescence (Figure 20). Le réseau artériel est ainsi détecté grâce à la fluorescence associée au gène XLacZ4. L’arborisation artérielle fait état de trois sources de sang oxygéné et concorde avec les observations macroscopiques chez le chat et le chien. Figure 20 : Réseau artériel du diaphragme de souris révélé par fluorescence associée au gène XLacZ4 (STUELSATZ ET AL., 2012) Astérisques rouges : division des artères phréniques ; flèches pleines oranges : branches des artères mammaires internes ou thoraciques internes ; flèches pleines rouges : artères phréniques ; doubles flèches oranges : artères intercostales
L’avantage de cette technique d’étude est la mise en évidence de plus petits réseaux d’anastomoses artérielles dont le dessin macroscopique était déjà décrit dans les plus vieilles études chez les carnivores domestiques. Concernant le réseau veineux, deux veines phréniques sont macroscopiquement visibles sous forme de deux arcades au niveau des jonctions musculo-tendineuses gauche et droite. Elles se rejoignent ensuite ventralement à la pars lumbalis pour finalement se jeter dans la veine cave caudale. Des veines accessoires issues de chaque côté de la pars costalis migrent médialement vers la veine phrénique correspondante (STUELSATZ ET AL., 2012). Innervation
Les premières recherches réalisées chez le chat reposaient sur une section de racine nerveuse cervicale et la mesure concomitante de l’activité électrique du muscle diaphragmatique par électromyographie. Ainsi s’en déduisait la localisation médullaire des corps cellulaires des nerfs phréniques. Les branches nerveuses innervant la bande charnue périphérique proviennent majoritairement du segment médullaire cervical C5 et plus modérément de C4. Celles responsables de l’innervation de la pars lumbalis ont pour origine principale le segment C5 et secondairement le segment C6 (SANT’AMBROGIO ET AL., 1963). Une
autre étude rapporte une innervation de la bande charnue périphérique ventrale par C5 et du reste du diaphragme par C6 (FOURNIER ET AL., 1988). Chez le chien, la stimulation électrique des racines nerveuses du nerf phrénique a permis d’identifier les segments médullaires C5 à C7 comme à l’origine de l‘innervation diaphragmatique. La répartition de chaque zone du diaphragme, quant à elle, est assez controversée dans la littérature : l’étude la plus ancienne de Landau et al. (1962) rapporte une innervation de la pars sternalis et de la portion médiale de la pars lumbalis par des branches phréniques issues de C5, de l’ensemble du diaphragme excepté la pars sternalis par C6 et d’une petite zone dorso-latérale au centre tendineux par C7 (LANDAU ET AL., 1962).
L’équipe de Troyer et al. (1982) a montré que C5 et C6 étaient responsables de l’innervation de la bande charnue périphérique et que la partie lombaire recevaient des fibres nerveuses de C6 et C7. La figure 21 schématise la répartition des segments médullaires dans l’innervation du diaphragme chez le chat et le chien respectivement selon San’t Ambrogio et De Troyer.
D’un point de vue macroscopique, chaque hémi-coupole est innervée par son nerf phrénique qui pénètre dans la cavité thoracique ventralement à l’artère sous-clavière pour se loger dans le médiastin. Le nerf gauche poursuit son trajet dans une fine couche tissulaire de plèvre sur toute la longueur du médiastin. En revanche, le droit longe l’aspect latéral de la veine cave caudale (Figure 22). Tous deux se divisent crânialement au diaphragme en trois branches principales : la branche ventrale responsable de l’innervation de la pars sternalis, une branche latérale irradiant vers la pars sternalis ainsi qu’une branche dorsale destinée à la partie lombaire. Le nerf phrénique est responsable de l’innervation motrice et sensitive du diaphragme qui sera abordée plus en détail dans la partie III.2.2 (page 44) (LANDAU ET AL., 1962 ; AZANZA ET AL., 1986; EVANS ET AL., 2013).
C5-C6 C6-C7 C5-C6 C4-C5 Figure 21 : Cartographie de l'innervation du diaphragme en fonction de l’origine médullaire chez le chien (A) et le chat (B) selon San’t Ambrogio et De Troyer A B
Enfin, l’hypothèse de l’unique source d’innervation du diaphragme, qu’est le nerf phrénique, s’est vue être remise en question. L’expérience de Wilson est pionnière sur le sujet : le diaphragme de chats, ayant subi une névrotomie d’un des deux nerfs phréniques deux cm en avant de la coupole, a révélé la persistance de tissu nerveux, par imprégnation argentique, au niveau des piliers et de la bande charnue périphérique. Ceci soutient l’hypothèse de fibres nerveuses accessoires empruntant le trajet du nerf phrénique sur sa portion terminale (A. S. WILSON, 1970). Ce sont généralement des rameaux des nerfs intercostaux (OGAWA, 1959 ; EVANS ET AL., 2010). 7 8 9 10 1 2 3 4 5 6 1. Cœur 2. Veine cave caudale 3. Nerf phrénique droit 4. Lobe accessoire du poumon droit 5. Centre tendineux 6. Bande charnue périphérique 7. Lobe pulmonaire crânial droit 8. Lobe pulmonaire médial droit 9. Lobe pulmonaire caudal droit 10. Face externe de la 10ème côte
Crânial Caudal Ventral