HAL Id: dumas-01738459
https://dumas.ccsd.cnrs.fr/dumas-01738459
Submitted on 20 Mar 2018HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires
To cite this version:
Sylvie Ferlat. Place du macrophage dans l’immunité naturelle. Sciences pharmaceutiques. 1997. �dumas-01738459�
AVERTISSEMENT
Ce document est le fruit d'un long travail approuvé par le
jury de soutenance et mis à disposition de l'ensemble de la
communauté universitaire élargie.
Il n’a pas été réévalué depuis la date de soutenance.
Il est soumis à la propriété intellectuelle de l'auteur. Ceci
implique une obligation de citation et de référencement
lors de l’utilisation de ce document.
D’autre part, toute contrefaçon, plagiat, reproduction illicite
encourt une poursuite pénale.
Contact au SID de Grenoble :
bump-theses@univ-grenoble-alpes.fr
LIENS
LIENS
Code de la Propriété Intellectuelle. articles L 122. 4
D 115 018928 6
~'-'.1..12i1~~n~,
TECHNOLOGIE ET MEDECINE
UFR DE PHARMACIE
N° d'ordre
·t-o
~if.
Année 1997PLACE DU MACROPHAGE
DANS L'IMMUNITE NATURELLE
THESE
Présentée à l'UNIVERSITE JOSEPH FOURIER GRENOBLE Pour obtenir le grade de : DOCTEUR EN PHARMACIE Par:
FERLAT SYLVIE Cette thèse sera soutenue publiquement le : 07 juillet 1997.
COMPOSITION DU JURY - Pr A. FA VIER
- Pr E. DROUET -DrD. VIDAL
UFR DE PHARMACIE
N° d'ordre Année 1997
PLACE DU MACROPHAGE
DANS L'IMMUNITE NATURELLE
THESE
Présentée à l'UNIVERSITE JOSEPH FOURIER GRENOBLE Pour obtenir le grade de : DOCTEUR EN PHARMACIE Par:
FERLAT SYLVIE Cette thèse sera soutenue publiquement le : 07 juillet 1997.
COMPOSITION DU JURY - Pr A. FAVIER
- Pr E. DROUET -DrD. VIDAL
Je remercie le professeur E. DROUET d'avoir accepté de siéger dans ce jury. Que ce travail lui exprime ma profonde gratitude pour le temps qu'il m'a accordé en acceptant de juger ce travail.
Je remercie Mr le pharmacien en chef, D. VIDAL, chef de l'unité de microbiologie au C.R.S.S.A., d'avoir accepté de siéger dans ce jury. Je le remercie également pour son accueil dans son laboratoire à deux reprises, pour l'intérêt qu'il a porté à ce travail et les facilités qu'il m'a accordées pour l'accomplir. J'ai pu apprécier ses qualités humaines et sa grande disponibilité. Je le remercie de la confiance qu'il m'a accordée.
Je remercie tout particulièrement le Professeur A. FA VIER qui a joué un rôle déterminant dans le cheminement de mon cursus universitaire. Il m'a en effet, offert la possibilité de préparer un D.E.A. au sein de son laboratoire. IL a encadré mon travail et a guidé mes premiers pas dans le monde de la recherche. Puis il a dirigé ma thèse de sciences et aujourd'hui, sans lui, ce travail de synthèse, dont il me fait l'honneur de présider le jury, ne serait certainement pas achevé!
Il m'a enseigné la rigueur scientifique, l'art et toute la difficulté de réfléchir, afin de poser de nouveaux postulats avant tous travaux expérimentaux, et que tout résultat, quel qu'il soit, apporte un enseignement.
Malgré un emploi du temps chargé, il m'a toujours accordé de son temps si compté. Il m'a écoutée et si souvent conseillée. Lorsque je rentrai dans son bureau, "démoralisée" par mes résultats, j'en ressortais toujours "le moral remonté à bîoc" avec de nouvelles manips en tête. J'ai toujours admiré le fait qu'il ait toujours une longueur d'avance dans la bibliographie de mon sujet, et en biochimie C, les sujets sont nombreux!
Au cours de ces années, j'ai pu bénéficier de ses compétences scientifiques, elles furent pour moi, un guide, une référence. J'ai également pu apprécier sa disponibilité, sa gentillesse, son éternel optimisme et ses qualités humaines. Il m'a acceptée "en bloc" avec mon caractère (sans commentaires) et mon entêtement. Je le remercie pour toute la confiance qu'il m'a accordée tout au long de ces années.
Je tiens à remercier Mme Chantal BOTTEX-GAUTHIER qui a également encadré mon travail de thèse de sciences. A ses côtés, j'ai pu apprécier tant ses compétences scientifiques, la richesse de son enseignement, son dynamisme, la valeur d'un travail d'équipe, que ses qualités humaines. Elle a lu et relu les moutures successives de ma thèse de sciences, corrigeant inlassablement mes innombrables erreurs rédactionnelles. Aujourd'hui, ce travail est également le fruit de son enseignement, j'espère qu'il sera à la hauteur de ses espérances. En souvenir des manips non stop 7H-20H, des nombreux moments passés dans le couloir, à fonder de nouvelles hypothèses, à tenter d'expliquer le pourquoi du comment des derniers résultats, à déjà songer aux manips à venir .. ., histoire de repartir le baume au coeur, plein d'énergie. Pour ses conseils si précieux. Que ce travail soit le témoignage de toute mon amitié.
Qu'il me soit permis d'exprimer toute ma reconnaissance aux professeurs P. POTIER, A. FA VIER et aux docteurs Françoise PICOT, Chantal BOTTEX-GAUTHIER et D. VIDAL, pour leur dévouement, leur soutien et leur aide précieuse dans la recherche de contrats, afin de me permettre de poursuivre un travail de recherche.
Je remercie Hervé pour sa présence, son aide et son inlassable soutien. En souvenir des innombrables heures passées "le nez dans l'encyclopédie", à échafauder de nouveaux plans de manips, à refaire le monde. Qu'il trouve dans ce travail le témoignage de tout mon amour.
Je ne me lasserai jamais de l'écouter m'expliquer les trous noirs, la théorie des catastrophes, le chaos, ... sans parler de la théorie des coïncidences et de la distorsion du temps.
Les conceptions actuelles des processus d'infection, tant au niveau clinique qu'expérimentai, se fondent sur la notion d'interactions hôte-agent pathogène. Lors de la confrontation de l'organisme avec un agent pathogène, l'ultime résultante, bénéfique ou délétère, dépend d'une part, des facteurs synthétisés à la fois par l'agent pathogène et l'hôte, et d'autre part, du passé immunitaire de ce dernier.
Le macrophage représente la cellule pivot de l'immunité naturelle, assumant un rôle fondamental au sein des divers mécanismes concourant au maintien de l'intégrité de l'organisme. Il intervient en effet, à trois niveaux : En tant que cellule douée de propriétés toxiques pour les micro-organismes, par l'intermédiaire des nombreux dérivés chimiques et protéiques qu'il synthétise, indépendamment des caractères antigéniques de l'agent invasif. De part la nature des cytokines qu'il libère, il contribue non seulement à l'instauration d'une réponse inflammatoire et à la coopération avec les cellules T à l'origine de la réponse spécifique; mais également à la régulation par entre autre, la libération de l'IL-10, du processus inflammatoire potentiellement néfaste s'il demeure incontrôlé. Enfin, il est capable d'assumer la fonction de cellule présentatrice de l'antigène. Immunités naturelle et spécifique, longtemps supposées fonctionner indépendamment, s'avèrent être intriquées et se réguler mutuellement. Ceci laisse supposer toute la complexité des mécanismes induits lors de la confrontation de l'organisme avec un agent pathogène. Les diverses fonctions du macrophage témoignent de son rôle déterminant dans la lutte anti-infectieuse et lui confèrent, au sein de l'immunité, le caractère de cellule fondamentale, à la frontière de l'immunité spécifique.
Outre l'arsenal des antibiotiques et autres molécules de synthèse, certes efficaces dans l'éradication de tout élément infectieux, néanmoins à l'origine de l'émergence de germes multirésistants, il semblerait actuellement que la notion de terrain, en l'occurrence le système immunitaire, soit davantage prise en considération. Cette notion s'inscrit parmi les concepts de la médecine traditionneile. La corrélation positive existant entre l'état nutritionnel des individus et leur capacité à résister aux infections est un fait établi de longue date, citons pour exemple, le rôle fondamental des oligo-éléments.
L'immunomodulation (et plus spécifiquement l'immunostimulation) consiste à modifier de façon positive le cours spontané des réactions immunitaires, en augmentant transitoirement les mécanismes non spécifiques, indépendamment de tout processus anamnestiques.
Bien que l'usage des plantes en thérapeutique soit parfois déconsidéré, il est important de souligner que celles-ci jouent également un rôle important dans la thérapeutique que l'on
taxol des écorces d'arbustes Taxus Baccata. La chimie de synthèse a permis de synthétiser
cette molécule ( l'extraction chimique de la molécule aurait en effet, impliqué un abattage trop massif d'une espèce d'arbre déjà peu abondante) et d'élaborer des dérivés chimiquement modifié.
Outre les molécules d'origine végétale, d'autres molécules naturelles, telles que les dérivés de la ruche, gelée royale et propolis, dont l'usage en thérapeutique remonte à plusieurs siècles, semblent présenter des propriétés immunostimulantes intéressantes. Cependant, la littérature scientifique concernant les propriétés biologiques de ces dérivés est très pauvre.
Toutefois, l'évaluation de propriétés immunomodulatrices de molécules d'origine naturelle se heurte à de nombreuses difficultés, dont les principales résident dans l'optimisation et l'intensité de la stimulation. En effet, une activation trop importante ou mal contrôlée du macrophage peut être alors à l'origine de processus pathologiques d'ordre immunologique ou non. En outre, l' immunomodulation fait intervenir des interactions extrêmement complexes. Un grand nombre de mécanismes sont mis en jeu et certaines régulations sont probablement inconnues.
mots clés : Immunité naturelle, macrophage, immunomodulation, molécules naturelles, gelée royale, propolis.
ADP : Adénosine Diphosphate Ag : Antigène
AMPC : Adénosine Monophosphate Cyclique ARN : Acide Ribonucléique
ARNm : Acide Ribonucléique messager ATP Adénosine Triphosphate
BH4 Tétrahydrobioptérine CD : « Cluster of Differentiation »
CMH : Complexe Majeur d'Histocompatibilité Con A : Concanavaline A
CPAg : Cellule Présentatrice de !'Antigène
CSF : Colony Stimulating Factor = facteur stimulant la formation de colonies DAG : Diacylglycérol
DMPO : dimethylpyroline-N-oxide DMSO Diméthyl Sulfoxyde
EDRF Endothelium Derived Relaxing Factor
=
Facteur relaxant issu de l'endothéliumELAM : Endothelial Leukocyte Adhesion Molecule
=
molécule assurant l'adhésion entre les cellules endothéliales et les leucocytesF AD : Flavine Adénine Dinucléotide Fe : Fragment d'anticorps
FITC Isothiocyanate de Fluorescéine FMN Flavine Mononucléotide fonction lymphocytaire
GM-CSF : Facteur Stimulant la formation de Colonies mixtes Granulocytaires et GMPC : Guanosine Monophosphate Cyclique
GSH : Glutathion réduit GSSG : Glutathion oxydé
IL-2R : Interleukin-2 Receptor =récepteur pour l'IL-2 iNOS : NO synthase inductible
IP (voie) : voie intrapéritonéale
IP3 : Phosphatidylinositol 2, 4, 5-triphosphate L-Arg : L-arginine
L-NMMA : N°-monomethyl-L-arginine
LEC AM Leukocyte Cell Adhesion Molecule = molécule d'adhésion entre les leucocytes
LF A : Lymphocyte Function Associated Antigen = antigène associé à la LGL : Large Granular Lymphocyte (Grands lymphocytes à granules) LPS : Lipopolysaccharide
Monocytaires
NAD : Nicotinamide Adénine Dinucléotide
NADP : Nicotinamide Adénine Dinucléotide Phosphate NF-KB : Nuclear Factor- KB =facteur nudéaire KB
NK cellules "Natural Killer" = cellules naturellement tueuses NO Oxyde Nitrique
NOS : NO synthase
NOSc : NO synthase constitutive
PAF : Platelet Acfivating Factor= Facteur activateur des plaquettes PBN : N-ter-butyl-a-phenylnitrone
PG : Prostaglandine
PIP2 : Phosphatidylinositoi 4, 5-Diphosphate PKC : Protéine Kinase C
PLC : Phospholipase C
PMA : Phorbol Myristate Acétate PTK : Protéine Tyrosine Kinase
RIO : Reacfive intermediates of oxygen =dérivés réactifs de l'oxygène RPE : Résonance Paramagnétique Electronique
~ :Transforming Growth Factor
=
facteur de croissance transformant.Th :Lymphocyte T helper
=
lymphocyteT auxiliaireThp : progéniteur de lymphocyteT auxiliaire (lymphocyte T«naïfs»)
TNF :Tumor Necrosis Factor
=
facteur de nécrose tumorale UFC :Unité formant lescoloniesVCAM Vascular Cell Adhesion Molecule
=
molécules d'adhésion des cellules vasculairesIMMUNITE NATURELLE :
ROLE CENTRAL, PIVOT D'UNE CELLULE FONDAMENTALE:
LE MACROPHAGE . ... 7
I LA REPONSE IMMUNE ... 7
II. CELLULES EFFECTRICES DE L'IMMUNITE NATURELLE ... 9
1. Les cellules natural killer (NK) : cellules tueuses naturelles ... 9
1.1. Origine ... 9 1.2. Phénotypes membranaires ... 10 1.3. Fonctions ... 13 1.3.1. Activité anti-infectieuse ... 13 1.3.2. Immunosurveillance ... 15 1.3.3. Production de cytokines ... 16 2. Les polynucléaires ... 17 2.1. origine ... 17
2.2. Marqueurs membranaires des polynucléaires ... 18
2.3. Fonctions ... 19
III - LE MACROPHAGE ... 20
1. Origine ... 20
2. Fonctions ... 22
3. Les marqueurs membranaires du macrophage humain ... 23
4. Activation du macrophage ... 25
4. î. Cytokines inductrices de quelques fonctions du macrophage ... 26
4.2. Théorie des voies d'activation ... 27
4.3. Fonction bactéricide ... 28
4.3.1. Effet "de préactivation" de l'IFNy ... 29
4.3.2. Effet "activateur", "déclencheur" du LPS ... 29
4.4. Mécanismes de la transduction du signal d'activation ... 31
4.4.1. Induction par l'IFNy ... 33
5) LPS et transcription de gènes: ... 38
4.5. Interactions des mécanismes d'activation induits par l'IFNyet le LPS ... 38
4.6. Activation et immunité ... 39
4.7 Evolution des caractéristiques du macrophage au cours de l'activation ... .40
INTERACTION AGENTS BACTERIENS ET IMMUNITE : ROLE FONDAMENTAL DU MACROPHAGE ... 11 • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • 42 I. MECANISMES BACTERICIDES DES MACROPHAGES ACTIVES ... .43
1. Mécanismes bactéricides non oxydatifs . ... 44
2. Mécanismes bactéricides oxydatifs ... 45
Place des espèces radicalaires . ... 45
2.1.1. Synthèse des différentes espèces réactives de I' oxygène ... .45
2.1.2. Maturation cellulaire et production d'espèces réactives de l'oxygène ... .47
2.1.3. La NADPH-oxydase: source de« l'explosion respiratoire» ... .47
2.1.4. Facteurs d'activation du complexe NADPH-oxydase : ... .49
rôle majeur des cytokines ... . 2.1.5. Activation du complexe NADPH-oxydase et seconds messagers ... 51
2.2. Pouvoir microbicide des espèces réactives del' oxygène ... 52
2.3. Le monoxyde d'azote (NO) ... 55
2.3.1. Les NO Synthases ... 57
2.3.2. Régulation de la iNOS ... 60
1) molécules activatrices de la iNOS ... 60
2) Transduction du signal de l'activation de la iNOS ... 62
3) Régulation négative de la NO synthase inductible ... 64
2.4. Pouvoir microbicide du NO ... 68
2.5. Réactivité du NO et de 02°- ... 70
II LE PARADOXE DE L'OXYGENE ... 72
2.1.2. Les protéines ... 77
2.1.3. Les acides nucléiques ... 77
2.2. stress oxydant et cellules immunes ... 77
IV. LES SYSTEMES DE PROTECTION, DE CONTROLE ANTIRARICALAIRE ... 78
1. Les systèmes enzymatiques et non enzymatiques . ... 78
2. Les oligo-éléments ... 79
V. LE MONOXYDE D'AZOTE: UNE MOLECULE AMBIVALENTE: IMPLICATION DANS LE CHOC SEPTIQUE ... 80
VI. METHODES PHYSIQUES APPLIQUEES A LA MESURE DES ESPECES REACTIVES DE L'OXYGENE ET DE L'OXYDE NITRIQUE ... 84
1. I..a chemiluminescence ... 84
2. I..a R.P.E ... 84
VII. ROLE FONDAMENTAL DE L'IMMUNITE NATURELLE DANS LA RESISTANCE AUX INFECTIONS PAR DES AGENTS PATHOGENES A DEVELOPPEMENT INTRACELLULAIRE ... 86
1. L'axe macrophages - cellules NK, via les cytokines TNFa, ... 87
IL-12 et IFNy. VIII DE L'IMMUNITE NATURELLE A L'IMMUNITE SPECIFIQUE ... 92
1. I..a dichotomie lymphocytaire T CD.t' ... 92
1.1. Caractérisation fonctionnelle des sous-populations lymphocytaires T CD4+ Thl et Th2 ... 92
1.2. Immunité naturelle et détermination de l'immunité spécifique ... 97
IMMUNITE NATURELLE ET MOLECULES NATURELLES ... 102
I. MEDECINE TRADITIONNELLE ET PLANTES MEDICINALES ... 104
1.1. Les cellules phagocytaires ... 108
1.1.1. le zinc ... 108
1.1.2. le fer ... 109
1.1.3. le sélénium ... 110
1.1.4. l'iode ... 111
1.2. Les cellules Natural Killer (NK) ... 111
1.2.1. le zinc ... 111 1.2.2. le fer ... 112 1.2.3. le sélenium ... 112 2. Oligo-éléments et infections ... 112 2.1. Lezinc ... 112 2.1.1. Chez l'animal ... 112 2.1.2. chez l'homme ... 113 2.2. Le fer ... 114 2.2.1. Chez l'animal ... 114 2.2.2. Chez l'homme ... 114 2.3. Le selenium: ... 116 2.3.1. Chez l'animal ... 116 2.3.2. Chez l'homme ... 116
III. LES PRODUITS DE LA RUCHE : PROPOLIS ET GELEE ROY ALE : ... 116
1. Organisation sociale des abeilles ... 117
1.1. Les mâles ... 118
1.2. La reine: ... 118
1.3. L'abeille ouvrière ... 118
1.4. A l'origine de la différenciation des castes : Différences entre une larve royale et une larve ouvrière ... 118
2. lA Gelée royale ... 119
2.1. propriétés biologiques de la gelée royale ... 120
2.1.1. propriétés antibiotiques , bactéricides ... 120
2.1.2. propriétés antitumorales ... 120
2.1.3. effets sur l'organisme ... 120
CONCLUSIONS ... 111 . . . e ••••••••••••••••••••••••••••••••••••••••••••• 128
BIBLIOGRAPHIE ... 131 ANNEXE ... e ••••••••••••••••••••••••••••••••••••••••••••••••••••••••••••••••••••••••••• 165
INTRODUCTION
Les conceptions actuelles des processus d'infection, tant au niveau clinique qu' expérimental, se fondent sur la notion d'interactions hôte-agent pathogène. Dans ce type de relation, un des éléments fondamentaux est la présence chez l'hôte de facteurs nutritifs essentiels et de conditions environnementales permettant alors la croissance de l'agent infectieux et éventuellement l'expression de sa virulence. Corollairement, la survie de l'hôte est conditionnée par son aptitude à développer un ensemble de mécanismes de défense non spécifiques de l'agent infectieux, et/ou une réponse immune spécifique.
Le système immunitaire est en quelque sorte le gardien de notre survie dans un environnement polyrnicrobien d'emblée hostile. Il permet à notre organisme de lutter contre les agressions infectieuses et de vivre en harmonie avec le milieu extérieur. Il assure ainsi la survie des organismes vertébrés par l'identification de tout éiément étranger, suivi du déclenchement d'une cascade d'événements fondés sur un ensemble complexe et dynamique d'interactions, entre cellules spécifiques ou non, dont la finalité est la destruction de l'envahisseur. L'ultime résultante, bénéfique ou délétère, dépend d'une part, des facteurs synthétisés à la fois par l'agent pathogène et l'hôte, et d'autre part, du passé immunitaire de ce dernier.
De nombreux travaux scientifiques portant sur l'interaction immunité et agents pathogènes, ont mis en exergue le rôle fondamental, pivot du macrophage, dans les mécanismes de résistance au développement de l'infection. En effet, cette cellule, dont le potentiel sécrétoire est considérable, intervient à plusieurs niveaux dans l'établissement de la réponse immune. Tout d'abord, il agit de concert avec les polynucléaires pour éliminer les agents infectieux en produisant des dérivés toxiques. Ensuite, il peut, en association aux molécules du CMH, présenter les antigènes peptidiques modifiés de l'élément infectieux, aux lymphocytes T auxiliaires (ou Helper) et de ce fait, induire l'activation polyclonale des cellules lymphocytaires à l'origine de la réponse immune spécifique. Enfin, son rôle majeur réside dans sa capacité à sécréter les cytokines pro-inflammatoires (IL-1, TNFa, IL-12) à l'origine de la coopération cellulaire d'une part avec les cellules NK, contribuant ainsi à l'activation et l'amplification des mécanismes non spécifiques de l'immunité naturelle, et d'autre part avec les lymphocytes, permettant de ce fait d'orienter préférentiellement la
réponse immune spécifique vers une réponse de type cellullaire, corollairement à la sélection des clones T CD4+ de type Thl. Ce phénomène a permis d'établir la corrélation et l'intrication des mécanismes respectivement impliqués dans l'immunité naturelle et l'immunité spécifique. Le rôle du macrophage est complexe, ce qui lui attribue le caractère de fascinant. Il participe également dans la régulation, la modulation négative du processu «d'activation» par la production de l'IL-10, cytokine anti-inflammatoire majeure.
Par ailleurs, la corrélation positive existant entre l'état nutritionnel des individus et leur capacité à résister aux infections est certes un fait établi de longue date, soulignant ainsi l'aspect essentiel de la qualité du terrain, en l'occurrence le système immunitaire. Cette qualité dépend entre autre de l'apport de micro-nutriments (oligo-éléments, 10ns, minéraux, ... ), de vitamines, de facteurs divers impliqués directement ou non dans une multitude de réactions métaboliques, dont l'ensemble concourt à l'homéostasie de l'organisme. Très nombreux sont les oligo-éléments, les vitamines et autres molécules qui interviennent dans les mécanismes et dans la compétence du système immunitaire, d'autres, tels les antioxydants assurent un effet de protection. Quelques études épidémiologiques, cliniques ont corroboré cette notion d'interdépendance entre statuts nutritionnel et immunitaire, mettant en exergue l'incapacité à juguler un processus infectieux, conséquence d'un système immunitaire défaillant corollairement à un statut de malnutrition, de carence rencontré chez certaines populations. Les populations principalement affectées sont d'une part, les personnes âgées, notamment en situation d'hospitalisation et d'autre part, les populations des pays en voie de développement où la malnutrition constitue un problème de santé publique majeur.
Si l'on considère l'importance du statut nutritionnel dans l'établissement de la réponse immune, il semble tout à fait légitime de supposer que la thérapeutique dans un contexte de pathologie infectieuse doit s'inscrire selon deux modalités certes intriquées. La première consiste assurément à faire face à une situation d'urgence par la destruction de l'agent pathogène. La seconde, bien que très peu considérée, s'intéresse essentiellement au terrain, à savoir le système immunitaire, et consiste à rétablir, au cours de la phase de convalescence, les équilibres modifiés. L'objectif étant de restaurer une certaine intégrité, fonctionnalité d'un système souvent affaibli, conséquence inéluctable de toute agression infectieuse.
Selon ce même concept, il peut être envisagé une action en amont, c'est-à-dire préalablement à toute interaction avec l'agent pathogène, afin de potentialiser les processus de résistance à l'infection lors d'une confrontation ultérieure avec l'élément infectieux. Il ne s'agit certes pas de vaccinothérapie, en effet, dans ce concept particulier, la résistance à l'infection est fondée exclusivement sur l'apprentissage et la reconnaissance des structures antigéniques spécifiques à chaque micro-organisme. Les mécanismes non spécifiques constituent alors, la cible préférentielle de toutes tentatives de modulation de la qualité de la réponse immune, indépendamment de tous processus anamnestiques.
Les diverses fonctions du macrophage témoignent de son rôle déterminant dans la mise en place des réactions de défense et lui confèrent, au sein de l'immunité, le caractère de cellule fondamentale, à la frontière de l'immunité spécifique.
La stimulation des mécanismes de défense du macrophage, par des substances exogènes peut par conséquent, constituer un élément palliatif, permettant d'augmenter les processus de résistance à l'infection. Ceci peut s'avérer nécessaire dans un contexte de déficit immunitaire transitoire ou dans le cas d'un système immunocompétent, lorsque celui-ci est dépassé par une infection mal contrôlée.
Plusieurs catégories de molécules immunomodulatrices (hormones, dérivés bactériens et fongiques, cytokines), capables d'agir sur les fonctions du macrophage, sont répertoriées dans la littérature. Les molécules d'origine naturelle constituent une catégorie particulière qui s'inscrit dans la pratique de la médecine traditionnelle.
Ainsi, l'utilisation de plantes médicinales, dans le traitement de pathologies diverses ou simplement dans le but de préserver l'équilibre nécessaire à l'organisme en "bonne santé", est documentée dans l'histoire de l'humanité depuis plus de 4000 ans.
Par exemple, les amérindiens du sud utilisaient î'écorce de Cinchona pour iutter contre les accès fébriles de la malaria. Les digitales étaient utilisées par les Egyptiens et les Romains. L'opium était employé par les Grecs et les Arabes, bien avant qu'il ne soit introduit dans les pays de !'Extrême Orient.
De nombreuses plantes sont encore employées dans la thérapeutique de diverses affections, telles que les diarrhées et vomissements, le prurit, la tuberculose, le choléra, le paludisme (Samuelsson et al., 1993).
De nos jours, les principes actifs extraits de plantes recouvrent et occupent une place importante dans l'ensemble des thérapeutiques, auxquelles a recours environ 80% de la population mondiale. De nombreuses molécules antiparasitaires, antibactériennes et antitumorales, ont en outre, une origine naturelle (Oo, 1991).
Certaines plantes, par leur propriétés antioxydantes, contribuent à préserver l'organisme des effets délétères des espèces radicalaires de l'oxygène et de l'azote, produites de façon exagérée, dans certains contextes pathologiques (Goureau et col, 1995), (Rang et al., 1996).
Outre les plantes, d'autres molécules d'origine naturelle présentent des propriétés pharmacologiques intéressantes en médecine humaine.
Depuis des temps immémoriaux, l'homme s'est passionné pour les produits de la ruche - le miel, la propolis et la gelée royale-, et mit en application les bienfaits de ces
produits naturels.
Le miel présente des propriétés antibactériennes, d'où son usage dans le traitement topique des infections de surfaces associées aux ulcères, aux escarres, et aux brûlures (White, 1966).
L'utilisation de la propolis, dans la médecine populaire, remonte également aux temps anciens. Elle assume au sein de la ruche un rôle protecteur contre les micro-organismes.
Les vertus bénéfiques de la gelée royale, en matière de santé, sont connues depuis l'antiquité, basées toutefois sur des observations essentiellement empiriques.
Déjà dans la Grèce antique, la gelée royale était assimilée à l'ambroisie, nourriture qui conférait l'immortalité aux dieux de l'Olympe.
Cette thérapeutique "naturelle", repose pour 1' essentiel, sur des observations empiriques. Elle obtient néanmoins des résultats, là où parfois la "médecine moderne" est tenue en échec, sans qu'aucune explication scientifique ne puisse être avancée (Harper, 1994). Le recours à la médecine traditionnelle s'inscrit dans un certain concept philosophique, établissant des règles d'hygiène de vie du corps et de l'esprit (par exemple, la méthode Kousmine). Dans la médecine traditionnelle chinoise, la vie, la santé et la maladie, sont appréhendées sur la base de la doctrine du "yin et yang" (Chan, 1995).
La médecine traditionnelle repose sur une plus grande individualité du traitement, partant de la considération que psychisme et organes forment un tout. Elle tient compte de l'équilibre de l'individu, son objectif étant d'influer sur le "terrain" de l'organisme et de tendre ultérieurement vers une restauration de l'état d'équilibre, initialement perturbé par la pathologie. La thérapie est donc orientée vers le système immunitaire, dans le but de renforcer les mécanismes de défenses non spécifiques. "Si vis pacem, para bellum ", disaient les Latins.
L'immunomodulation consiste donc à modifier de façon positive le cours spontané
des réactions immunitaires, en augmentant transitoirement les mécanismes non spécifiques, indépendamment de tout processus anamnestiques.
L'intérêt de l'immunostimulation réside dans l'induction d'une résistance accrue de l'organisme à l'encontre des effets préjudiciables d'un agent pathogène.
Dans cette finalité, le macrophage occupant une position stratégique dans l'immunité, semble constituer la cellule cible de choix. Toute modulation des fonctions du macrophage par une substance exogène d'origine naturelle ou non, laisse supposer un retentissement sur l'ensemble du système immunitaire.
La substance exogène, dite "immunostimulante" est susceptible d'interagir avec les macrophages, selon des mécanismes demeurant pour la plupart non élucidés, et d'induire plus particulièrement un "priming" ou "préparation" cellulaire. Cette "préparation" cellulaire confère au macrophage une capacité de réponse accrue envers l'agent pathogène.
Toutefois, la difficulté de l'immunomodulation réside dans l'optimisation et l'intensité de la stimulation. En effet, une activation trop importante ou mal contrôlée du macrophage peut être à l'origine de processus pathologiques d'ordre immunologique ou non. L'immunomodulation fait intervenir des interactions extrêmement complexes. Un grand nombre de mécanismes sont mis en jeu et certaines régulations sont probablement inconnues.
L'homme a, au fil des âges, su déceler dans les plantes et autres produits naturels de son environnement, ceux qui pouvaient le soigner. L'avènement de l'ère de la chimie a supplanté l'usage traditionnel de dérivés naturels en thérapeutique. Néanmoins, il est important de souligner qu'un grand nombre de molécules synthétiques ne sont pas seulement le fruit de l'imagination de chimistes, mais sont issues de molécules naturelles dotées de
propriétés pharmacologiques, que les modifications chimiques ont visé à amplifier ou moduler leurs effets iatrogènes. Par conséquent, médecine et thérapeutique traditionnelles, longtemps pensé être antinomiques, sont en fait complémentaires. Tous les pays du monde possède une pharmacopée qui leur est spécifique. La culture orientale a su conserver une thérapeutique à base de produits naturels aux côtés de produits chimiques. La thérapeutique traditionnelle fondée sur des données pour l'essentiel empiriques, a résisté dans ces contrées, à l'ère du règne de la rigueur de l'esprit scientifique. Mieux encore, des recherches actives sont menées dans ce domaine afin de comprendre les mécanismes d'action de ces molécules. La science et ses progrès permettraient d'une part, d'infirmer ou non les propriétés pharmacologiques de ces molécules, ainsi qu'une meilleure compréhension des mécanismes mis en jeu, et d'autre part, au regard des données scientifiques obtenues, d'entrer par la grande porte dans la liste des thérapeutiques.
L'objectif de ce travail, fut de souligner au regard des données de la littérature scientifique, d'une part, le rôle majeur du macrophage dans l'établissement d'une réponse immune anti-infectieuse efficace, et d'autre part, la complexité, l'intrication des mécanismes connus impliqués, constituant ainsi, des cibles, des voies potentielles dans une éventuelle exploration des propriétés immunomodulatrices de certaines molécules naturelles, telles que la gelée royale et la propolis.
IMMUNITE NATURELLE:
ROLE CENTRAL, PIVOT D'UNE CELLULE FONDAMENTALE
: LE MACROPHAGE.
1 LA REPONSE IMMUNE
L'interaction de l'hôte avec un agent microbien se traduit par la mise en place de réactions immédiates, dites non spécifiques, associées à un état inflammatoire. L'objectif est de s'opposer à la colonisation, la persistance et la multiplication de l'agent invasif.
Les polynucléaires neutrophiles, les cellules natural killer (NK) et les monocytes/macrophages représentent les cellules effectrices de cette première ligne de défense. Recrutés au sein du foyer inflammatoire, les polynucléaires neutrophiles, dont la fonction essentielle est la phagocytose, contribuent à la destruction de l'agent infectieux, grâce à leurs granules, véritables réservoirs d'enzymes, associées à une production locale d'espèces réactives de l'oxygène. Les macrophages, dont le potentiel sécrétoire est considérable, interviennent dans l'élimination de l'agent infectieux, par l'élaboration de dérivés toxiques et de médiateurs protéiques, tels les cytokines, à l'origine d'interactions multiples avec des cellules immunes ou non (cellules endothéliales, hépatocytes). Contrairement aux polynucléaires, dont les fonctions sont essentiellement dirigées directement contre l'élément envahisseur, les macrophages établissent, de plus, un réseau de communications cellulaires qui contribue à l'amplification des mécanismes de défense.
Cette première ligne de défense représente l'immunité non spécifique, ou immunité naturelle"
Un organisme en bonne santé résulte d'un état d'équilibre, perpétuellement remis en cause, entre la capacité de défense non spécifique de l'organisme, c'est-à-dire, -vigilance,
rapidité et efficacité d'intervention du système immunitaire- et la sévérité de l'agression.
Toute rupture de cet équilibre évoluera inéluctablement vers un état pathologique. Les mécanismes mis en oeuvre indépendamment de la nature de l'agresseur (chimiotactisme, activation du complément, phagocytose) peuvent être suffisants pour détruire l'agent pathogène et ainsi stopper le processus invasif.
- l'état immunitaire de l'individu : un organisme affaibli offre une plus grande vulnérabilité aux invasions par des micro-organismes,
- la pathogénicité du micro-organisme : certains agents infectieux ont acquis au cours de leur évolution, des stratagèmes, tels que des variations antigéniques (Trypanosoma brucei),
la capacité à se multiplier à l'intérieur des cellules, des modifications enzymatiques, etc ... (revue: Ojcius et al., 1995), leur permettant ainsi d'échapper à cette première barrière de défense.
Lorsque les mécanismes non spécifiques sont dépassés, deux évolutions sont alors envisageables :
- Dans un cas extrême, le processus infectieux est tel que la réponse immune non spécifique suractivée, évolue vers l'instauration d'un état inflammatoire généralisé pouvant mettre en péril la vie de l'individu.
- Dans un cas beaucoup moins dramatique, la réaction inflammatoire contrôlée et transitoire, permet l'interaction des macrophages avec les cellules lymphocytaires. Le macrophage, par sa capacité à présenter l'antigène aux cellules T auxiliaires CD4+ assure ainsi la mise en place d'une immunité spécifique. Le rôle des lymphocytes T CD4+ est central. Ils interviennent dans l'organisation de la réponse immune en modulant les réponses humorales et cellulaires.
Dans ce dernier cas, les agents pathogènes seront alors confrontés à des mécanismes plus complexes, conséquence de l'activation de lymphocytes spécifiques. La réponse immune spécifique utilise un ensemble de molécules très polymorphiques au sein de l'espèce et de l'individu (produits de classe 1 et II du Complexe Majeur d'Histocompatibilité, des anticorps, des récepteurs des lymphocytes Tet B).
L'activation des lymphocytes T CD4+ par la production de cytokines spécifiques contribue secondairement à une boucle d'amplification de l'activation des macrophages. Cette activation plus sélective leur confère alors un potentiel antimicrobien augmenté.
L'immunité spécifique permet également la mémorisation d'informations relatives à l'agresseur, assurant, lors d'un contact ultérieur avec ce même agresseur, une rapidité et une efficacité supérieure de la réponse immune. L'organisme est de ce fait protégé à long terme. De toutes ces interactions, découle l'histoire immunitaire de l'individu.
Un réseau de communication entre immunité naturelle et spécifique, est ainsi établi par l'intermédiaire des cytokines. Par conséquent, la dichotomie traditionnelle entre immunité
naturelle et immunité spécifique doit être nuancée. On admet actuellement que la réponse immune non spécifique intervient dans la détermination de la nature de la réponse immune spécifique (Romagniani., 1992).
II. CELLULES EFFECTRICES DE L'IMMUNITE NATURELLE.
1. Les cellules natural killer (NK) : cellules tueuses naturelles.
1.1. Origine
Les cellules natural killer (NK) prennent naissance dans les tissus hématopoïétiques, selon une lignée probablement distincte des lignées lymphocytaires Tet B; les caractéristiques morphologiques et phénotypiques de la cellule souche ne sont toutefois pas clairement définies (Lanier et al., 1992). Ces cellules également désignées sous le terme de grands lymphocytes à granules (LGL : Large Granular Lymphocyte) conformément à leur aspect morphologique de lymphocytes de grande taille renfermant des granules cytoplasmiques basophiles, forment une population hétérogène douée de propriétés cytotoxiques. Bien que présentant certaines similitudes morphologique et phénotypique (expression du marqueur CD2) avec les lymphocytes T, la maturation des cellules NK n'est pas dépendante du thymus. En effet, les souris génétiquement modifiées nude et scid, respectivement congénitalement athymiques et déficientes en cellules lymphocytaires T et B fonctionnelles pour la forme homozygote scid, possèdent un grand nombre de cellules NK fonctionnelles (Dorshkind et al., 1985).
Largement réparties dans divers organes, tels que les poumons, le foie, la rate et la cavité péritonéale, les cellules NK sont numériquement plus importantes dans la circulation périphérique où elles représentent, chez l'homme, entre 5 à 10% des lymphocytes (Trinchieri,
1
.2
.
Phéno
types
membrana
ires
.
La caractérisation phénotypique des cellules NK et de toute autre population cellulaire, réalisée par l'élaborationet l'utilisation d'anticorps monoclonaux dirigés contre des antigènes de membrane désignés également sous le terme Classe de Différenciation (CD), a apporté une large contribution à l'identification de ces cellules, et une meilleure compréhension des mécanismes d'interaction cellulaire. Le clonagein vitro,des cellules NK en présence d'IL-2 a permis l'étudeprécise de leurphénotype. De l'analyse de ces marqueurs membranaires spécifiques des cellules NK ou communs avec d'autres populations cellulaires, plusieurs constatations ont pu être rapportées (les antigènes de surface des cellules NK humaines sont rapportés dans letableau 1) :
1.Ces cellules expriment à leur surface certains antigènes caractéristiques du lignage T, tels que l'antigène CD2 (récepteur des globules rouges de mouton) et les chaînesa,~ du
récepteur de l'interleukine-2. Si l'expression de ces récepteurs semble les rattacheràlalignée lymphocytaire T, ces cellules constituent néanmoins une population hétérogène au regard de l'expression de certains antigènes lymphocytaires, tels que CD3 et CDS, respectivement spécifiques de la lignée T et d'une sous-population lymphocytaire T cytotoxique. En ce qui concerne l'expression des antigènes lymphocytaires T CD2, CD3 et CDS, la population hétérogène de cellules NK peut être cependant sommairement réparties en trois catégories correspondantàtrois degrés croissants de maturation lymphocytaire T cytotoxique. Ainsi, la majorité des cellules NK sont CD2+, CDT, CDS-, une faible proportion est CD2+, CD3+, CDS -' enfin environ 30 % de ces cellules expriment l'ensemble des marqueurs de différenciation des lymphocytes T cytotoxiques et sont CD2+, CD3+, CDS+ .Toutefois, l'expression par ces cellules NK de l'antigène CDS, molécule d'adhérence et de signalisation, est restreinteà la forme homodimère de typeaa.En revanche, lamajorité des lymphocytesT CDS+ différenciés dans le thymus, expriment la forme hétérodimère ~. Le tableau résume l'évolution des
marqueurs membranaires au cours de lamaturation des populations cellulaires NK et T.
2. Outre l'hétérogénéitéqui semble caractériser lalignée NK, l'ensemblede ces cellules exprime de façon constante à leur surface les antigènes CD56, CD57 et CD16. L'antigène CD56 reconnu par l'anticorps monoclonal NKH-1 élaboré en 19S3 par Hercend, fut récemment identifié comme étant un isoforme de la molécule d'adhésion N-CAM (Neura l-Cell Adhesion Molecule ).
Les caractéristiques phénotypiques de lacellule souche à l'origine de la lignée NK, n'ont pu être encoreàce jour définies. Certains auteurs ont émis l'hypothèse de l'existence d'une cellule souche commune aux lignées Tet NK et de phénotype cyCD3+ mCD3-, CD4-, CDS-, CD34+, CD56-(cyCD3 : CD3 cytoplasmique, mCD3 : CD3 membranaire). La commutation vers le lignage T ou NK serait corrélée à la nature de signaux perçus, bien que non encore définis. L'évolution vers la lignée lymphocytaire s'accompagne d'une maturation cellulaire acquise dans le thymus, associée à un réarrangement des gènes du récepteur T (TCR :T-Cell Receptor) et à la différenciation phénotypique en cellules CD4+ ou CDS+. La maturation en cellules NK n'implique pas un passage obligatoire par le thymus et semble définie conjointement par l'apparitionde l'antigèneCD56 et laperte de CD34 (Lanieret al., 1992).
3. L'antigène CD16, récepteur de faible affinité pour le fragment Fe des immunoglobulines G (lgG), leur permettent de participer à des réactions immunes dépendantes d'anticorps, de type ADCC (Antibody-Dependent Cell Cytotoxicity). Les cellules NK ont ainsi, la capacité de reconnaître par leurs récepteurs Fe, différentes cellules cibles recouvertes d'IgG et de les détruire. Dans ce contexte particulier de cytotoxicité dépendante d'anticorps,à médiation cellulaire, ces cellules sont dénommées« cellules K».
4. Les cellules NK expriment égalementàleur surface diverses molécules d'adhésion, telles que CDlla/ CD18 (LFAl), CD54 (ICAM-1), contribuant à l'interaction et à la formation de complexes avec lacellule cible (Trinchieri, 1989; Lanier et al. 1992).
Tableau 1:Antigènes de surface des cellules NK humaines.
t::·; ·,,'.·>·:·· ~ CD2 CD7 CD8a CD11a/CD18 (LFA-1) CDllb / CD18 (MAC-1, CR3) CDllc /CD18 (pl50/95, CR4) CD 16 (RFcyIII) CD25, p75 (IL2R a,~ CD45RA CD54 (ICAM-1) CD56 CD57 CD58 (LFA-3) CMH classe I CD54 (ICAM-1); ICAM-2,3 C3bi, Fb, LPS C3bi, Fb IgG IL-2 CDlla (LFA-1)
tableau 2:Evolution des antigènes de surface des cellules NK et T (d'après Lanier et al., 1992).
antigènes NK fœtales NK matures thymocytes
CDl + CD2 + + + cyCD3y,ô,E + + mCD3 + TCR + CD4 + CDS + CD7 + + + CDS a + + + ~ + CD11a/CD18 + + + CD11b/CD18 + + CD16 + + CD45RA + + + CD4SRO + CD56 + + CD57 + IL-2Ra + + -2 ~ + + [
cyCD3 :CD3 cytoplasmique; mCD3 :CD3 membranaire -TCR: récepteurT des lymphocytes(T-cell receptor)
-IL-2Ra; IL-2Rb: chaînes
a
e ~ du récepteur à l'interleukine-2cellules T + + + + + + + + + + + + + + + + +
1.3. Fonctions
1.3 .1. Activité anti-infectieuse
Les cellules NK assurent aux côtés des monocytes, des macrophages et des polynucléaires, la première ligne de défense de l'organisme dans la résistance aux infections bactériennes, virales et parasitaires. La particularité de ces cellules réside dans leur capacité intrinsèque à reconnaître et détruire une cellule infectée ou modifiée. Cette activité cytotoxique spontanée et sélective à l'encontre de cellules cibles, n'est pas restreinte par l'expression à leur surface des antigènes de classe 1 ou II du Complexe Majeur d'Histocompatibilité (CMH), et ne requiert pas de pré-immunisation. L'ensemble de ces caractéristiques les distinguent des lymphocytes T cytotoxiques qui à l'inverse, nécessitent au préalable une reconnaissance des particules antigéniques associées aux molécules de classe 1 du CMH pour accomplir leur fonction lytique (Yokoyama, 1993). Les mécanismes d'interaction et d'activation des cellules NK sont méconnus. Quelques auteurs ont montré que l'expression des antigènes de classe 1 du CMH à la surface de cellules cibles les préserverait de l'activité lytique des cellules NK. Des travaux récents ont permis l'identification d'un récepteur pour les molécules du CMH de classe 1, de nature et de structure différentes selon l'origine murine ou humaine de la cellule NK. L'interaction de ce récepteur nommé respectivement Ly-49 pour l'espèce murine et KIRs (Killer Cell lnhibitory Receptors) chez l'homme, avec l'antigène de classe 1 exprimé à la surface de la cellule cible, est à l'origine d'un rétrocontrôle négatif de l'activité cytotoxique de la cellule NK (Lanier, 1997). Au regard de ces observations, certains auteurs ont suggéré que lymphocytes T cytotoxiques et cellules NK exerçaient un contrôle de l'intégrité cellulaire selon deux mécanismes distincts, l'un basé (pour les lymphocytes T cytotoxiques) sur la reconnaissance d'antigènes étrangers associés aux molécules de classe 1 du CMH, l'autre (pour les cellules NK) à l'inverse, sur l'absence ou l'aberration de l'expression des antigènes de classe I (revue : Y okoyama, 1995). Cette diversité offre ainsi à l'organisme un double contrôle de son intégrité.
L'activité antivirale, in vitro, des cellules NK est largement décrite dans la littérature. Celle-ci implique la reconnaissance de structures antigéniques virales exprimées à la surface des cellules infectées et donc promues au rang de cellules cibles potentielles. Cette reconnaissance met en jeu des récepteurs de surface des cellules NK, permettant leur
du contenu des granules dans l'espace inter-cellulaire. Parmi les nombreuses protéines (telles que les sérine-protéases) ainsi libérées, la plus importante serait une perforine capable de s'insérer par polymérisation dans la membrane de la cellule cible, formant ainsi un pore transmembranaire à l'origine de la lyse cellulaire (Berke, 1995). Les travaux montrant le rôle majeur des cellules NK in vivo, dans la résistance à l'infection virale, reposent pour l'essentiel sur des modèles murin d'infection (à CMV (cytomégalovirus) par exemple), dont la population NK est dans un premier temps neutralisée consécutivement à l'administration d'anticorps monoclonaux à priori électifs, puis ultérieurement rétablie par une immunisation de transfert passive induite par l'injection de cellules NK purifiées (Budowski et al., 1984; 1985).
L'intérêt suscité au cours de ces dernières années pour les mécanismes de l'immunité naturelle impliqués dans la résistance aux infections par des germes à développement intracellulaire, a mis en exergue le rôle immunomodulateur majeur des cellules NK inhérent à leur capacité à synthétiser de l 'IFNy. En effet, la synthèse et la sécrétion d'IFNy par ces cellules activées, joue un rôle déterminant, à l'origine de l'activation des macrophages et de la commutation des clones THl lymphocytaires. L'intrication et les effets coopératifs entre cellules NK, macrophages et lymphocytes THl, certes régulés par un ensemble complexe de cytokines, conditionnent dans ce type d'infection, l'évolution vers la guérison. Le rôle de ces cellules et les mécanismes mis en jeu seront plus amplement décrits au cours du chapitre intitulé« de l'immunité naturelle à l'immunité spécifique».
Par ailleurs, une production d'IFNy a été également décrite dans certains contextes d'infection virale. La sécrétion d'IFNy résulterait de l'activation de cellules NK par une cytokine d'origine macrophagique, l'IL-12, et serait impliquée dans la défense antivirale. Cette production d'!FNy est cependant inhibée par l'IFNa/B bien que celui-ci favorise également l'activité antivirale des cellules NK selon un mécanisme différent, en orientant la réponse NK vers une activité cytotoxique et de blastogenèse (revue : Biron, 1997).
Activation et régulation de la cellule NK dans un contexte d'infection virale (d'après Biron, 1997).
Challenge
virus• r:(
macroohal!eActivation
Migration
cytotoxicité
1blastogénèse
1G
- - •
_I_L-_12__, - - - - •
I
IFNy
1 cellule NK 1.3.2. ImmunosurveillanceFonction
antivirale
?antivirale
1 cellule NK activée 1Outre l'activité anti-microbienne, ces cellules jouent également un rôle non moins déterminant en protégeant notre organisme des mutations génétiques associées à la prolifération cellulaire, par la destruction de certaines lignées de cellules tumorales. De nombreux travaux réalisés in vivo chez l'animal et pour l'essentiel in vitro sur modèle cellulaire convergent, montrant le rôle majeur de ces cellules dans la prévention de la carcinogénèse. Dans ce sens, Seaman et al., 1987 ont en effet montré que la neutralisation in vivo des cellules NK chez le modèle murin, par l'administration d'anticorps monoclonal, était corrélée à une incapacité à contrôler le développement de cellules tumorales; défaillance immunitaire dont l'issue s'est avérée fatale.
L'activité cytotoxique des cellules NK serait similaire à celle des lymphocytes T cytotoxiques. Par conséquent, ces cellules peuvent induire la mort par exocytose granulaire décrite ci-dessus dans un contexte d'infection virale, mais également par apoptose (Cohen,
cibles, selon un ou plusieurs mécanismes non encore élucidés (Berke, 1995). Les cellules NK exercent deux types d'activité cytotoxique complémentaires. Elles agissent de concert avec les polynucléaires neutrophiles et les macrophages par l'élimination rapide de tout élément pathogène, préalablement à l'établissement de la réponse immune spécifique sous la dépendance des lymphocytes Tet B. Dans ce contexte, l'activitécytotoxique est dite naturelle car non restreinte par le CMH. Ces cellules interviennentégalement ultérieurement, au cours de la phase spécifique de la réponse immune, par la reconnaissance suivie de la destruction des cellules cibles alors recouvertes d'anticorps (O'sheal et al., 1992).
Les interférons, l'IL-1 et principalement l'IL-2 constituent des facteurs déterminant, permettant lapotentialisation de l'activitécytotoxique des cellules NK.
L'activité antitumorale des cellules NK est volontairement peu développée dans cette revue bibliographique principalement centrée sur l'immunité naturelle anti-infectieuse et sa modulation par des molécules d'origine naturelle. Dans ce contexte, il semble toutefois important de citer les travaux concernant la modulationin vivo,chez un modèle murin, de l'activité antitumorale des cellules NK par une molécule naturelle douée de propriété antioxydante (Fernades-carlos, 1996).
1.3.3. Production de cytokines
Les cellules NK exercent une activité régulatrice de l'hématopoïèse (Hansson et al., 1988). En effet, laproduction par les cellules NK de cytokines, telles que l'IL-1, l'IL-2 et l'IL-3 et des facteurs de croissances GM-CSF (Granulocyte-Monocyte Colony Stimulating Factor), M-CSF (Monocyte Colony Stimulating Factor) respectivement des colonies granulocytaires et monocytaires, favorisent la croissance des cellules souches de la moelle osseuse. A l'inverse, dans un contexte favorisant la production de ~ (Transforming
Growth Factor~ , ces mêmes cellules sont alors capables de réguler par un rétrocontrôle
négatif, lacroissance des cellules souches hématopoïétiques (Bonavidaet al., 1993).
Les cellules NK activées sécrètent également de l'IFNyet les facteurs nécrosants des tumeursa et~ (TNFa,~ , cytokines pro-inflammatoires majeures impliquées dans les
mécanismes de résistance aux infections, néanmoins à l'originede processus délétères lorsque laréaction inflammatoiredemeure incontrôlée.
2. Les polynucléaires
2.1. origine
Les polynucléaires sont issus d'une cellule souche CFU-GM (Colony Forming Unit -Granulocyte Monocyte) commune à la lignée monocytaire-macrophagique, qui se différencie corollairement à la nature des cytokines libérées, en cellule souche à l'origine de la lignée granulocytaire CFU-G ou de la lignée monocytaire macrophagique CFU-M.
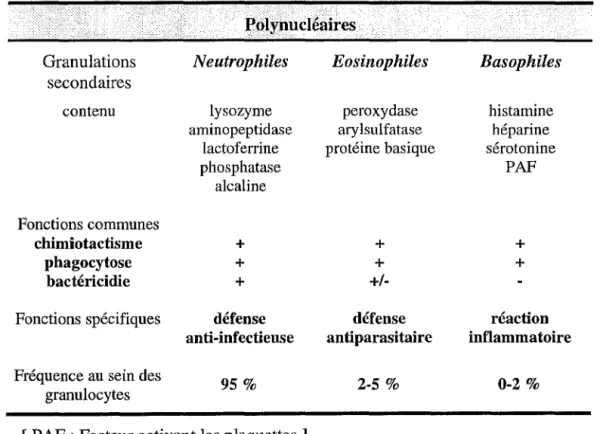
Ces cellules de grandes tailles dont le noyau est polylobé, peuvent être subdivisées en trois catégories conformément à la nature et au contenu de leurs granulations cytoplasmiques. Ces cellules renferment en effet deux types de granulations identifiées par la coloration de May-Grünwald-Giemsa et par la technique de microscopie électronique. Les granules denses communes sont dites primaires et les secondaires spécifiques les différencient donc respectivement en polynucléaires neutrophiles, éosinophiles et enfin, basophiles (tableau 1). Ces granules renferment d'une part, différentes enzymes contribuant à la destruction des micro-organismes préalablement phagocytés et définissent d'autre part, les fonctions spécifiques de chacun des types de polynucléaires.
Ces cellules représentant 60% à 70% des leucocytes du sang, se répartissent dans la circulation périphérique en deux secteurs : un secteur circulant et un secteur marginal renfermant les cellules adhérant aux parois des vaisseaux.
Tableau 1 : Classification des polynucléaires (d'après Genetet, 1994).
Polynucléaires... ·
Granulations Neutrophiles Eosinophiles Basophiles
secondaires
contenu lysozyme peroxydase histamine aminopeptidase ary lsulfatase héparine
lactoferrine protéine basique sérotonine
phosphatase PAF alcaline Fonctions communes chimiotactisme + + + phagocytose + + + bactéricidie +
+/-Fonctions spécifiques défense défense réaction anti-infectieuse antiparasitaire inflammatoire Fréquence au sein des 95 % 2-5 % 0-2 %
granulocytes
[ PAF : Facteur activant les plaquettes ]
2.2. Marqueurs membranaires des polynucléaires.
Les polynucléaires partagent avec les monocytes macrophages un certain nombre de récepteurs membranaires, tels que les récepteurs des composants du complément et les récepteurs de faible et de forte affinité pour le fragment Fe des diverses immunoglobulines (IgG (FcyR), IgE (FcëR)) permettant ainsi l'interaction avec les conjugués antigènes-immunoglobulines spécifiques.
Récepteurs de surface des polynucléaires (d'après Genetet N., 1994).
Récepteurs des lg CD16 (FcyRIII)
CD32 (FcyRII) CD64 (FcyRI ; FcERI :forte affinité) CD23 (FcERII :faible affinité Récepteurs des fractions du
Complément CD11a: LFA-1 (chaînea)
CD11b: CR3 (chaînea) CDllc: CR4 (chaînea) CD18: CR3, CR4, LFA-1 ne~ CD35: CRl
2
.3
.
Fonc
t
ions
Ligancls IgG IgG lgG IgE IgE ICAM C3bi C3dg C3bidistribution cellulaire
granulocytes neutrophiles, éosinophiles neutrophiles activés (IFNy)
basophiles éosinophiles
granulocytes granulocytes granulocytes
granulocytes
Les polynucléaires désignés également sous le terme général « granulocytes » ne sont pas considérés comme des cellules immunocompétentes. En effet, dans un processus infectieux, ces cellules assument seulement un rôle «d'éboueur», phagocytant et détruisant tout élément préalablement identifié comme non soi; propriétés qu'ils partagent avec les monocytes et macrophages. Par ailleurs, la libération de médiateurs chimiotactiques et de dérivés radicalaires de l'oxygène contribueàl'amplification de la réponse inflammatoire s'accompagnant d'une migration de cellules phagocytaires (monocytes, macrophages et polynucléaires) du pool circulant vers le site de l'infection. A l'inverse des macrophages, les polynucléaires ne sont pas impliquésdans l'établissementde laréponse immune spécifique.
Le macrophage occupe une place centrale dans la réponse immune naturelle, par conséquent ce travail est volontairement centré sur l'ensemble des caractéristiques phénotypiques, cellulaires, ainsi que sur les voies et mécanismes d'activation cellulaire, pour lesquelles des chapitres spécifiques leurs seront consacrés. Nous développerons dans la deuxième partie de ce travail, le rôle primordial et complexe de cette cellule si particuière, au cours de l'interaction de l'organisme avec un agent pathogène, et dans l'établissement d'une réponse immune efficace.
III - LE MACROPHAGE
1. Origine
Le macrophage appartient au système des phagocytes mononucléés. Ce système regroupe des populations de macrophages de degré de maturité variable. Ce terme, créé par Van Furth, définit ainsi une fonction et l'appartenance à une même lignée hématopoïétique.
Les monocytes, issus des tissus hématopoïétiques, sont libérés dans la circulation au terme d'une succession d'étapes de prolifération et de différenciation. Les monocytes quittent ensuite rapidement le pool circulant, pour se répartir dans les compartiments tissulaires. Dans une dernière étape de maturation, ils acquièrent, sur place, les caractéristiques morphologiques, cytochimiques et fonctionnelles de la forme macrophagique. La maturation est un processus irréversible.
Les macrophages tissulaires sont répartis aux points stratégiques de l'organisme, susceptibles d'être une porte d'entrée pour les micro-organismes.
Les macrophages tissulaires ne regagnent pas la circulation générale, et semblent donc mourir sur place. Le renouvellement des macrophages tissulaires est assuré pour 95% par l'afflux de monocytes du sang périphérique, les 5% restant, résultent de la multiplication locale de macrophages fraîchement recrutés de la moelle osseuse dans les 24 heures précédentes. Ce turn-over est augmenté lors de réaction inflammatoire (Van Furth et al.,
La répartition des macrophages tissulaires et leur dénomination sont répertoriées dans le tableau suivant: poumons séreuses rate organes lymphoïdes périphériques moelle osseuse reins foie peau
système nerveux central
macrophages alvéolaires macrophages pleuraux, macrophages péritonéaux macrophages spléniques, macrophages de la pulpe rouge
macrophages, cellules dendritiques ostéoclastes macrophages glomérulaires cellule de Kupffer cellules de Langerhans cellules de la microglie
Le processus de maturation, depuis la cellule souche immature jusqu'au macrophage, s'accompagne de modifications constitutionnelles et fonctionnelles, dont les principales caractéristiques sont résumées ci-dessous.
Evolution de certaines caractéristiques des phagocytes mononucléés (d'après Auger et Ross, 1992.
moelle osseuse sang
1
monoblaste promonocyte monocyte
tissus 1 1 macrophage synthèse d'ADN phagocytose lysosomes IgGetMAC-1
Les macrophages matures résidents des tissus présentent des caractéristiques morphologiques, phénotypiques, métaboliques et fonctionnelles, qui peuvent se résumer ainsi:
marqueurs:
macrophages résidentsmorphologiques adhérence faible étalement lent phénotypiques CMH classe II +/-récepteurs transferrine +
CD1 la/CD18, MAC-1, FcyR
-métaboliques
H202, 02°- faible
NO absente
protéases lytiques
-production cytokines faible (TNFa,ILl)
production PGE2 faible
fonctionnels prolifération faible ingestion + bactéricidie faible présentation Ag faible cytotoxicité -immunosuppression
-2. Fonctions
Les fonctions du macrophage, bien que multiples et variées, concourent au maintien de l'homéostasie de l'organisme.
Les différentes populations de macrophages sont impliquées dans de nombreuses fonctions, telles que :
- la détoxification de substances exogènes,
- la destruction de micro-organismes et de cellules tumorales,
Quelques principales fonctions du macrophage (d'après Hamilton, 1987). régulation de l 'hématopoïése régulation des lipides régulation de la prolifération
cellulaire régulation de la coagulation et fibrinolyse
régulation des lymphocytes présentation de l'antigène
;égulation du / /
1
,~
prntootion contre'"métabolisme du fer / _ ... ~ tumeurs
régulation de protection contre les l'inflammation virus, bactéries, parasites
détoxification
3. Les marqueurs membranaires du macrophage humain
La diversité des fonctions du macrophage est associée également à la diversité des phénotypes cellulaires. Cette diversité phénotypique des populations de macrophages a été mise en évidence par des marqueurs membranaires spécifiques ou non, et qui définissent des molécules fonctionnelles connues. Celles-ci interviennent dans l'activation liée ou non à la présentation de l'antigène, l'adhésion et la migration cellulaire. D'autres molécules sont impliquées dans les différentes étapes de la réponse immune. Les principales sont les récepteurs des dérivés du complément, des fractions Fe des immunoglobulines, les produits de classe I et II du CMH (revue : Auger et Ross, 1992), les molécules de co-stimulation CD80 et CD86 (revues: Kaye, 1995; Antoine, 1995) et la molécule CD14 (revue: Schumann, 1992).
Bien qu'aucune molécule de surface exclusivement spécifique des monocytes/macrophages n'ait pu être encore identifiée à ce jour, l' antigène membranaire CD14 est certainement un des marqueurs les plus caractéristiques de cette lignée cellulaire. Cette molécule, ancrée dans la membrane cellulaire par un groupement glycosyl phosphatidylinositol, fortement exprimée chez le macrophage et à un moindre degré chez les polynucléaires, serait un récepteur pour le LPS des bactéries gram (-) sous la forme complexée
impliquée dans l'activation du macrophage par le LPS. En effet, l'utilisation,in vitro, d'anticorps anti-CD14 bloque la production de cytokines pro-inflammatoires induite par le LPS (Dentener et al., 1993; Shumann, 1995). Le LPS serait impliqué dans la régulation de l'expression de ce récepteur (Landmann et al., 1996) Le CD14 jouerait également un rôle important dans l'instauration d'un choc septique. (Glauser, 1996). L'antigène CD14 a pu être identifié sous une forme membranaire (CD14m) et une forme soluble (CD14s) dépourvue de la fraction lipidique et de poids moléculaire inférieur. Le récepteur cellulaire du complexe LPS-LBP-CD14s demeure inconnu. Quant aux mécanismes et voies d'activation induits consécutivement à l'interaction LPS-LBP et CD14, ceux-ci demeurent également non élucidés, toutefois, plusieurs hypothèses ont été émises, celles-ci seront développées au chapitre intitulé:«activation du macrophage».
La recherche de l'expression de ces marqueurs au sem d'un tissu est source d'informations relatives à l'état d'activation des macrophages et leur répartition parmi les autres populations cellulaires présentes.
Nature du récepteur
! (-~ ·... Fcg Feµ Fce CRl CR3 (MAC-1) CR4 CSa Clq '. IL-lR ,IL-2R, IL-4R, IL-lOR TNFR IFNsR GM-CSFR MIF Agonistes
récepteursFe des'Ig. Fe d'IgG
Fe d'IgM
Fonctions
opsonisation, immuno-adhérence Fe d'IgE défense antiparasitaire facteur C3b fixation et phagocytose des facteur C3bi
facteur C3dg facteur C5a facteur Clq
particules opsonisées
IL-1, IL-2, IL-4, IL-10 activation/ régulations de diverses TNF ,~
IFN(a, ~' y)
GM-CSF macrophage inhibitory
fonctions activation / régulations activation/ régulations maturation et différenciation lymphokine inhibantla mobilité
MAF
récepteur du LPS ou LPS-LBP récepteur pour les lectines
récepteur de la transférrine récepteur de l' a2 micro globuline macrophage activating factor
LPS des bactéries gram ( -) glycoprotéines à résidu
mannose ou fucose transf érine
a2M
lymphokine activant les macrophages
phagocytose et activation des mécanismes microbicides fixation membranaire d'agents
microbiens non opsonisés
élimination des protéases en excès dans les sites inflammatoires
Le modèle murin est largement employé dans les études d'interaction hôte-agents pathogènes dans le but d'élucider les mécanismes immunologiques ou non impliqués dans la résistance au processus infectieux. Les caractéristiques phénotypiques membranaires du macrophage murins présentent de grandes similitudes avec celles de macrophages d'origine humaine. Toutefois, un antigène particulier, dénommé F4/80 fut identifié chez le macrophage murin. Cet antigène membranaire exprimé exclusivement par les cellules du système des phagocytes mononucléés, est d'une part, spécifique de l'espèce murine, et d'autre part, un marqueur de maturation cellulaire. La ou les fonctions de cette molécule ne sont pas connue (Austyn et al., 1981).
4. Activation du macrophage
Il nous paraît important de rappeler d'une façon aussi synthétique que possible, quelles sont les fonctions du macrophage dans le cadre d'une stimulation de l'immunité non spécifique. Ce paragraphe constitue une approche, bien que simpliste, de toute la complexité des processus d'activation et de régulation des nombreuses fonctions du macrophage.
L'augmentation sous certaines conditions des activités microbicides et antitumorales sont à l'origine du concept de l'activation du macrophage, établi en 1905 par E. Metchnikoff.
Les nombreuses fonctions du macrophages sont la résultante de multiples voies d'activation. En relation avec notre étude, seront uniquement décrites les voies d'activation de