UNIVERSITÉ DE MONTRÉAL
DEVELOPMENT OF A THERMODYNAMIC DATABASE FOR
NICKEL-CONTAINING OXIDE SYSTEMS FOR SIMULATION OF NICKEL
EXTRACTION FROM LATERITE ORES
VIKTORIA PROSTAKOVA DÉPARTEMENT DE GÉNIE CHIMIQUE ÉCOLE POLYTECHNIQUE DE MONTRÉAL
THÈSE PRÉSENTÉE EN VUE DE L’OBTENTION DU DIPLÔME DE PHILOSOPHIAE DOCTOR
(GÉNIE MÉTALLURGIQUE) OCTOBRE 2013
UNIVERSITÉ DE MONTRÉAL
ÉCOLE POLYTECHNIQUE DE MONTRÉAL
Cette thèse intitulée:
DEVELOPMENT OF A THERMODYNAMIC DATABASE FOR
NICKEL-CONTAINING OXIDE SYSTEMS FOR SIMULATION OF NICKEL
EXTRACTION FROM LATERITE ORES
présentée par : PROSTAKOVA Viktoria
en vue de l’obtention du diplôme de : Philosophiae Doctor a été dûment acceptée par le jury d’examen constitué de : M. BALE Christopher, Ph.D., président
M. DECTEROV Sergei, Chercheur, membre et directeur de recherche M. PELTON Arthur, Ph.D., membre et codirecteur de recherche M. ROBELIN Christian, Chercheur, membre
DEDICATION
“There is no way to peace; peace is the way.”
Mahatma Ghandi
"Self esteem is different from self importance. With Self esteem you become very humble, very loving."
Nirmala Srivastava
ACKNOWLEDGEMENTS
I would like to thank all members of the jury for their time and essential corrections of this thesis. I express deep gratitude to Dr. Sergei A. Decterov, whose guidance and advice were indispensable for the completion of this thesis. I am also grateful to him for the opportunity to participate in Calphad conferences, for his support and generosity he showed in unexpected circumstances.
I am also grateful to Prof. Arthur D. Pelton and Prof. Christopher W. Bale from CRCT for interesting and helpful courses.
I express gratitude to Prof. Eugene Jak and Dr. Jiang Chen from the Pyrometallurgy Research Centre for successful collaboration and financial support.
I would like to thank my husband Denis Shishin for his help in the process of working. Also, I would like to thank Evguenia Sokolenko for assistance with the literature, her kindness and sunny coffee breaks, Jacques Melançon for struggling with my computer and Christian Robelin for correction of the French language.
I thank all colleagues from the Centre for Research in Computational Thermochemistry. I appreciate their kindness.
I thank my family and friends, who are a constant source of inspiration to me. I am thankful to life for the opportunity to be with them and to learn from them. I am thankful to the source of life for the opportunity to grow and learn to love.
RÉSUMÉ
Un vaste programme de recherche collaborative s’est concentré sur le développement d'une base de données thermodynamiques auto-cohérente pour la simulation de l’extraction du nickel à partir de minerais latéritiques. Des systèmes chimiques pertinents pour le traitement de minerais latéritiques ont été étudiés expérimentalement et optimisés thermodynamiquement.
En général, les dépôts de minerais latéritiques sont constitués de mélanges hétérogènes d'oxydes de fer hydratés et de silicates de magnésium hydratés. La base des minerais latéritiques est l’olivine (Fe, Mg)2SiO4, qui contient souvent de faibles quantités de nickel à cause de la
proximité des rayons ioniques de Fe2+, Mg2+ et Ni2+. Les technologies existantes produisant actuellement du nickel dans le monde entier utilisent seulement environ la moitié des gisements de latérites de nickel ; d'autres sources ne sont pas utilisées en raison de la minéralogie complexe. Pour créer des procédés de récupération de Ni à partir de minerais latéritiques qui soient rentables, respectueux de l'environnement et peu coûteux en énergie, il est important de pouvoir effectuer des calculs fiables d’équilibres de phases dans le système multi-composant Al–Ca–Cr– Fe–Mg–Ni–O–Si, où Fe, Al2O3, MgO, NiO et SiO2 sont les principaux constituants des scories et
des phases d'oxydes de la pyrométallurgie du nickel.
Le présent programme de recherche a relevé ce défi. Il visait à développer une base de données thermodynamiques pour les systèmes d'oxydes contenant NiO dans le système multi-composant Al2O3–CaO–FeO–Fe2O3–MgO–NiO–SiO2 (Al–Ca–Fe–Mg–Ni–O–Si) à haute température
d'intérêt pour les procédés pyrométallurgiques du nickel. Le projet a été réalisé grâce aux efforts conjoints de deux groupes de recherche. Le développement de la base de données a été effectué au Centre de Recherche en Calcul Thermochimique, Montréal, Canada par le biais de la modélisation thermodynamique, qui était étroitement liée aux études expérimentales d’équilibres de phases réalisées par nos collègues du Centre de Recherches Pyrométallurgiques (PyroSearch), Brisbane, Australie. Cette approche collaborative a considérablement augmenté l'efficacité de l'ensemble du programme en réduisant le nombre de travaux expérimentaux nécessaires et en fournissant des données expérimentales spécifiques pour la modélisation thermodynamique. Les évaluations thermodynamiques ont permis d’identifier les priorités pour les expériences et de planifier des mesures expérimentales pour fournir des données spécifiques pour la modélisation thermodynamique.
Un examen et une évaluation critique de la littérature publiée antérieurement sur la thermodynamique et les équilibres de phases dans les systèmes contenant NiO ont été réalisés. Les paramètres des modèles ont été optimisés pour reproduire une grande variété de données recueillies dans la littérature, incluant les données d'équilibres de phases, les propriétés thermodynamiques (capacité calorifique, entropie, enthalpie, énergie de Gibbs) et les données de distribution de cations. Cependant, pour plusieurs sous-systèmes d'ordre inférieur, les données manquaient dans la littérature parce que ces sous-systèmes n'ont pas d'importance directe pour les applications pratiques. Lorsqu’il n'y avait pas suffisamment de données pour contraindre les paramètres du modèle ou lorsque des divergences importantes ont été observées dans les données disponibles, un programme expérimental a été proposé à nos collègues du Centre PyroSearch. Un nombre limité de mesures expérimentales ont été prévues à des températures et à des compositions jugées les plus utiles pour la modélisation thermodynamique. De cette façon, la quantité de travail nécessaire pour obtenir une description thermodynamique précise d'un système multi-composant a été significativement réduite.
La procédure expérimentale a impliqué un équilibrage à haute température en atmosphère de gaz contrôlée et une trempe ultra rapide suivie par une microanalyse aux rayons X à l’aide d’une sonde électronique (EPMA) des échantillons trempés. Comme l'analyse a eu lieu après l’équilibrage, les changements de composition pendant l'équilibrage n'ont pas affecté la précision des résultats. Les conodes entre les phases liquides et solides à l’équilibre ont été mesurées directement, fournissant ainsi des données essentielles pour la modélisation thermodynamique ultérieure. L'ensemble des données expérimentales, incluant les nouveaux résultats expérimentaux et les données publiées antérieurement, a été pris en considération lors de la modélisation thermodynamique des phases d'oxydes du système multi-composant Al2O3–CaO–
FeO–Fe2O3–MgO–NiO–SiO2 (Al–Ca–Fe–Mg–Ni–O–Si) à une pression totale de 1 atm et pour
une large gamme de températures et de pressions partielles d'oxygène. La modélisation thermodynamique a été réalisée à l’aide du logiciel thermochimique FactSage et de ses bases de données. Toutes les phases solides et liquides de
4 systèmes binaires: CaO-NiO, MgO-NiO, NiO-SiO2, Al2O3-NiO,
7 systèmes ternaires: CaO-MgO-NiO, CaO-NiO-SiO2, MgO-NiO-SiO2, Al2O3-NiO-SiO2,
5 systèmes quaternaires: CaO-MgO-NiO-SiO2, Al2O3-FeO-Fe2O3-NiO, FeO-Fe2O3-MgO-NiO,
FeO-Fe2O3-NiO-SiO2, CaO-FeO-Fe2O3-NiO,
et 2 systèmes quinaires, Fe-Mg-Ni-O-Si et Ca-Fe-Ni-O-Si, du système chimique multi-composant ont été optimisées dans la présente étude. Les optimisations sont auto-cohérentes et compatibles avec les bases de données existantes FToxid et FSstel du logiciel FactSage. Les modèles utilisés sont basés sur la structure de la solution considérée. Le Modèle Quasichimique Modifié, qui prend en compte l'ordre à courte distance entre les cations seconds voisins, a été utilisé pour la phase de scories (oxyde fondu). Des modèles basés sur le « Compound Energy Formalism » ont été développés pour les solutions solides d’olivine, de spinelle et de pyroxène. Un modèle de mélange aléatoire simple avec une expansion polynômiale de l'énergie de Gibbs en excès a été utilisé pour les solutions solides de monoxyde et de corindon. Un ensemble de fonctions d'énergie de Gibbs auto-cohérentes a été obtenu qui assure la meilleure description possible des propriétés thermodynamiques et des équilibres de phases dans le système chimique considéré. Les données de la littérature sont reproduites dans les limites de l'erreur expérimentale. En utilisant les paramètres du modèle optimisés, des prévisions très utiles des équilibres de phases dans les systèmes multi-composants ont été réalisées.
Les propriétés des solutions de spinelle, de monoxyde, d’olivine et de corindon dans les systèmes chimiques Al–Fe–Ni–O, Al–Mg–Ni–O, Fe–Mg–Ni–O, Ca–Fe–Ni–O et Fe–Mg–Ni–O–Si et de la phase de scories dans le système Ca–Fe–Ni–O–Si ont été prédites uniquement à partir des paramètres des modèles optimisés pour les solutions binaires (ternaires) correspondantes. La comparaison ultérieure avec les données thermodynamiques et d'équilibres de phases disponibles a montré que les modèles ayant un sens physique que nous avons appliqués ont une excellente capacité à prédire les relations de phases dans les systèmes multi-composants. De cette façon, nous avons démontré l'efficacité de l'approche appliquée consistant en un couplage entre les expériences et la modélisation.
La base de données actuelle a été incorporée dans les bases de données existantes de FactSage. Ainsi, la gamme d'applications des bases de données de FactSage a été élargie, et les bases de données existantes ont été mises à jour pour décrire les données expérimentales d’intérêt industriel les plus récentes et les plus précises.
La base de données obtenue couplée à un logiciel de minimisation de l'énergie de Gibbs permet de prédire les équilibres de phases de liquidus et de solidus ainsi que certaines propriétés thermodynamiques dans les conditions (gamme de compositions, de températures et de pressions partielles d'oxygène) les plus utiles pour les opérations métallurgiques et les pratiques d’ingénierie. La base de données est pertinente pour plusieurs types de procédés pyrométallurgiques pour les minérais lattéritiques comme le procédé de ‘’reduction roasting’’ ou le procédé de ‘’electric furnace smelting’’.
ABSTRACT
An extensive collaborative research program was focused on the development of a self-consistent thermodynamic database for simulation of nickel extraction from laterite ores. Chemical systems relevant to laterite ore processing were experimentally investigated and thermodynamically optimized.
In general, laterite ore deposits consist of heterogeneous mixtures of hydrated iron oxides and hydrous magnesium silicates. The basis of the laterite ore is olivine (Fe,Mg)2SiO4, which often
contains small amounts of nickel due to the proximity of ionic radii of Fe2+, Mg2+ and Ni2+. Existing technologies that currently produce nickel worldwide utilize only about half of the nickel laterite deposits; other sources are not utilized due to complex mineralogy. For creation of cost-effective, environmentally-friendly and energy-efficient processes of Ni recovery from laterite ores, it is important to be able to perform reliable calculations of phase equilibria in the Al–Ca–Cr–Fe–Mg–Ni–O–Si system, where Fe, Al2O3, MgO, NiO and SiO2 are the major
components of slags and oxide phases in nickel pyrometallurgy.
The current research program met this challenge. It was aimed to develop a thermodynamic database for NiO-containing oxide systems in the Al2O3–CaO–FeO–Fe2O3–MgO–NiO–SiO2
(Al–Ca–Fe–Mg–Ni–O–Si) multi-component system at high temperature of interest to nickel pyrometallurgical processes.
The project was accomplished by the joint efforts of two research groups. The database development was carried out at the Centre for Research in Computational Thermochemistry, Montreal, Canada by means of thermodynamic modeling, which was closely related to experimental study of phase equilibria performed by our colleagues from the Pyrometallurgy Research Centre (PyroSearch), Brisbane, Australia. This collaborative approach greatly increased the effectiveness of the overall program by reducing the amount of the required experimental work and providing specific experimental data for thermodynamic modeling. Thermodynamic assessments were applied to identify priorities for experiments and experimental measurements were planned to provide specific data for thermodynamic modeling.
A literature review and critical assessment of the previously published thermodynamic and phase equilibrium data on the NiO-containing systems were performed using thermodynamic modeling. The parameters of the models were optimized to fit a large variety of the literature data collected
from the literature, including phase equilibrium data, thermodynamic properties (heat capacity, entropy, enthalpy, Gibbs energy) and cation distribution data. However, for several low-order sub-systems, data were missing in the literature because they are of no direct importance for practical applications. In case there was not enough data to constrain the model parameters, or significant discrepancies in the available data were revealed, an experimental program was suggested to our colleagues from the PyroSearch Centre. A limited number of experimental measurements were planned for temperatures and compositions which were found to be most useful for thermodynamic modeling. In this way, the amount of the work required to obtain an accurate thermodynamic description of a multicomponent system was significantly reduced.
The experimental procedure involved the high-temperature equilibration in controlled gas atmospheres and ultra rapid quenching followed by electron probe X-ray microanalysis (EPMA) of quenched samples. Since the analysis took place after equilibration, the changes in composition during equilibration did not affect the accuracy of the results. Tie-lines between equilibrated liquid and solid phases were measured directly, providing essential data for subsequent thermodynamic modeling.
The whole set of experimental data, including the new experimental results and previously published data, was taken into consideration in thermodynamic modeling of oxide phases in the Al2O3–CaO–FeO–Fe2O3–MgO–NiO–SiO2 (Al–Ca–Fe–Mg–Ni–O–Si) multi-component system at
a total pressure of 1 atm and a wide range of temperatures and oxygen partial pressures. The thermodynamic modeling part was undertaken using the FactSage thermochemical software and its databases. All solid and liquid phases of
4 binary: CaO-NiO, MgO-NiO, NiO-SiO2, Al2O3-NiO,
7 ternary: CaO-MgO-NiO, CaO-NiO-SiO2, MgO-NiO-SiO2, Al2O3-NiO-SiO2, Al2O3
-MgO-NiO, Al2O3-FeO-Fe2O3, FeO-Fe2O3-NiO,
5 quaternary: CaO-MgO-NiO-SiO2, Al2O3-FeO-Fe2O3-NiO, FeO-Fe2O3-MgO-NiO, FeO-Fe2O3
-NiO-SiO2, CaO-FeO-Fe2O3-NiO,
and 2 quinary systems, Fe-Mg-Ni-O-Si and Ca-Fe-Ni-O-Si, of the multi-component chemical system were optimized in the present study. The optimizations are self-consistent and consistent with existing FToxide and FSstel metallic databases of the FactSage software. The applied models are based on the structure of the corresponding solution. The Modified Quasichemical
Model, which takes into consideration second-nearest-neighbor short-range cation ordering, was used for the slag (molten oxide) phase. The models based on the Compound Energy Formalism have been developed for the olivine, spinel and pyroxene solid solutions. A simple random mixing model with a polynomial expansion of the excess Gibbs energy was used for the monoxide and corundum solid solutions. A set of self-consistent Gibbs energy functions was obtained that provides the best possible description of thermodynamic properties and phase equilibria in the chemical system. The literature data are reproduced within experimental error limits. Using optimized model parameters, valuable predictions of phase equilibria in the multicomponent systems have been made.
The properties of the spinel, monoxide, olivine and corundum solutions in the Al–Fe–Ni–O, Al– Mg–Ni–O, Fe–Mg–Ni–O, Ca–Fe–Ni–O and Fe–Mg–Ni–O–Si chemical systems and of slag in the Ca–Fe–Ni–O–Si system have been predicted solely from the optimized model parameters for the corresponding binary (ternary) solutions. The subsequent comparison with available thermodynamic and phase equilibrium data has shown that applied physically meaningful models have excellent ability to predict phase relations in multicomponent systems. In this way, the effectiveness of the applied coupled experimental/modeling approach has been demonstrated. The current database has been incorporated into the existing FactSage databases. By this means, the range of applications of FactSage databases has been expanded, and the existing databases have been updated to describe the most recent and accurate experimental data of interest to industrial operations.
The obtained database along with software for Gibbs energy minimization allows the prediction of liquidus and solidus phase equilibria as well as thermodynamic properties under the conditions, such as range of compositions, temperatures and oxygen partial pressures, which are most useful for metallurgical operations and engineering practice. The database is relevant to various kinds of pyrometallurgical processes for laterite ores, such as reduction roasting as well as electric furnace smelting.
CONDENSÉ
Afin de développer une base de données thermodynamiques multicomposante auto-cohérente pour la simulation de l’extraction du nickel à partir de minerais latéritiques, un vaste programme de recherche a été entrepris, qui combine naturellement des études expérimentales et la modélisation thermodynamique assistée par ordinateur. Des systèmes chimiques pertinents pour le traitement de minerais latéritiques de nickel ont été étudiés expérimentalement et optimisés thermodynamiquement. La modélisation thermodynamique a été réalisée en utilisant le logiciel thermochimique FactSage et ses bases de données [1] développées au Centre de Recherche en Calcul Thermochimique de l’École Polytechnique de Montréal, Canada. Le programme expérimental a été effectué par nos collègues du Centre de Recherches Pyrométallurgiques, Brisbane, Australie [2].
Des expériences et la modélisation thermodynamique ont été étroitement intégrées afin d’accroître l'efficacité de l'ensemble du programme en termes de quantité de travail expérimental requise et la disponibilité des données spécifiques essentielles à la modélisation thermodynamique. Ceci a été réalisé en appliquant les évaluations thermodynamiques pour identifier les expériences prioritaires et en planifiant des mesures expérimentales de façon à fournir des données spécifiques pour la modélisation thermodynamique. Cette approche a augmenté la capacité de prédiction des modèles thermodynamiques appliqués et a permis de caractériser les relations de phases sur une large gamme de compositions, de températures et de pressions partielles d'oxygène ayant une importance directe pour les industries métallurgiques. L'ensemble des données expérimentales, incluant les nouveaux résultats expérimentaux et les données publiées antérieurement, a été pris en considération lors de la modélisation thermodynamique des phases d'oxydes du système multi-composant Al2O3–CaO–FeO–Fe2O3–
MgO–NiO–SiO2 (Al–Ca–Fe–Mg–Ni–O–Si) à une pression totale de 1 atm et pour une large
gamme de températures et de pressions partielles d'oxygène. Toutes les phases solides et liquides de 4 systèmes binaires, 7 systèmes ternaires, 5 systèmes quaternaires et 2 systèmes quinaires du système chimique multi-composant ont été optimisées dans la présente étude.
Les optimisations sont auto-cohérentes et compatibles avec les bases de données existantes FToxid et FSstel du logiciel FactSage. Les modèles utilisés sont basés sur la structure de la solution considérée. Le Modèle Quasichimique Modifié, qui prend en compte l'ordre à courte
distance entre les cations seconds voisins, a été utilisé pour la phase de scories (oxyde fondu). Des modèles basés sur le « Compound Energy Formalism » ont été développés pour les solutions solides d’olivine, de spinelle et de pyroxène. Un modèle de mélange aléatoire simple avec une expansion polynômiale de l'énergie de Gibbs en excès a été utilisé pour les solutions solides de monoxyde et de corindon. Un ensemble de fonctions d'énergie de Gibbs auto-cohérentes a été obtenu qui assure la meilleure description possible des propriétés thermodynamiques et des équilibres de phases dans le système chimique considéré. Les données de la littérature sont reproduites dans les limites de l'erreur expérimentale. En utilisant les paramètres du modèle optimisés, des prédictions très utiles des équilibres de phases dans les systèmes multi-composants ont été réalisées.
La méthodologie de la recherche a impliqué plusieurs étapes décrites en détail ci-dessous :
Revue de la littérature et évaluation critique. Nous avons tout d'abord réalisé un examen et une
évaluation critique de la littérature publiée antérieurement sur la thermodynamique et les équilibres de phases dans les systèmes contenant NiO. Les données thermodynamiques disponibles dans la littérature pour les composants individuels (capacité calorifique, entropie, enthalpie, énergie de Gibbs), ainsi que les mesures d'équilibres de phases, la distribution des cations, etc., ont été analysées pour leur cohérence et leur précision.
Calculs de modèle initiaux. Les paramètres des modèles ont été optimisés afin de reproduire les
données expérimentales recueillies dans la littérature. Les coefficients des modèles ont été déterminés à partir des données expérimentales par une méthode d'essais et d'erreurs.
Etude expérimentale utilisant équilibrage / trempe / EPMA (PyroSearch, Australia). Pour
plusieurs sous-systèmes d'ordre inférieur, les données expérimentales manquaient dans la littérature parce que ces sous-systèmes n'ont pas d'importance directe pour les applications pratiques. Lorsqu'il n'y avait pas suffisamment de données pour contraindre les paramètres du modèle ou lorsque des divergences importantes ont été observées dans les données disponibles, un nombre limité de mesures expérimentales a été prévu pour les températures et les compositions considérées comme les plus utiles pour la modélisation thermodynamique.
Optimisation thermodynamique des systèmes d'ordre inférieur. Les nouvelles données
expérimentales, en association avec les données disponibles dans la littérature, ont été utilisées pour obtenir les descriptions thermodynamiques des systèmes d'ordre inférieur. Pour chaque
phase, un modèle spécifique a été utilisé qui reflète la structure de la phase correspondante le plus adéquatement et les paramètres du modèle ont été optimisés. De cette façon, tous les systèmes d'ordre inférieur ont été optimisés.
Prédiction des relations de phases dans les systèmes multi-composants. Des propriétés
thermodynamiques des phases présentes dans les systèmes multi-composants ont été essentiellement extrapolées à partir des paramètres optimisés dans les systèmes d'ordre inférieur, en utilisant la capacité des modèles à faire des extrapolations de manière thermodynamiquement correcte.
Vérification des modèles par rapport aux données expérimentales disponibles. La capacité de
prédiction des modèles a été vérifiée par rapport aux équilibres de phases multi-composants étudiés expérimentalement.
En utilisant la méthodologie décrite ci-dessus, la quantité de travail nécessaire pour obtenir une description thermodynamique précise d'un système multi-composant a été considérablement réduite.
Les conclusions détaillées pour les systèmes optimisés sont résumées comme suit:
Systèmes CaO
–NiO, MgO
–NiO et NiO
–SiO
2(CHAPTER 5)
Les systèmes binaires (CaO–NiO, MgO–NiO et NiO–SiO2) ont été optimisés, ainsi que les
propriétés de NiO solide et liquide pur. Les fonctions thermodynamiques obtenues sont utilisées dans les optimisations des sous-systèmes ternaires et d'ordre supérieur du système Al–Ca–Fe– Mg–Ni–O–Si.
Les systèmes CaO–NiO et MgO–NiO ont été étudiés par un équilibrage et une trempe ultra rapide suivie d’une microanalyse aux rayons X à l’aide d’une sonde électronique (EPMA) des échantillons trempés pour résoudre les divergences entre les données expérimentales disponibles dans la littérature. La lacune de miscibilité dans la solution solide de monoxyde CaO–NiO a été mesurée entre 1200 et 1600 °C. Les équilibres de phases entre la solution de monoxyde MgO– NiO et Ni ont été étudiés à des pressions partielles d'oxygène fixes comprises entre 10-13.5 et 10-7.5 atm sur la gamme de températures 1000-1300 °C. Ces nouvelles mesures ont résolu les divergences observées entre les données expérimentales antérieures sur les diagrammes de phases, les activités et les chaleurs de mélange.
Les paramètres des modèles thermodynamiques pour les phases d'oxydes ont été optimisés pour reproduire simultanément les résultats expérimentaux de la présente étude et toutes les données de la littérature sur la thermodynamique et les diagrammes de phases pour les systèmes CaO– NiO, MgO–NiO et NiO–SiO2. Un ensemble de fonctions d'énergie de Gibbs auto-cohérentes a
été obtenu qui assure la meilleure description possible des propriétés thermodynamiques et des équilibres de phases dans ces systèmes. Toutes les données disponibles sont reproduites dans les limites de l'erreur expérimentale.
Système MgO–NiO–SiO
2(CHAPTER 6)
Le système MgO–NiO–SiO2 a été étudié en combinant l'évaluation critique des données
expérimentales de la littérature, la modélisation thermodynamique et des mesures expérimentales des équilibres de phases à des compositions choisies. Ces mesures expérimentales, d'une part, peuvent être faites plus précisément et plus efficacement et, d'autre part, fournissent les données les plus importantes pour la modélisation thermodynamique.
En particulier, les conodes olivine / monoxyde, olivine / proto-pyroxène, liquide / olivine et liquide / cristobalite ont été mesurées afin de compléter les données de la littérature et résoudre certaines contradictions. L'étude expérimentale a été réalisée sur toute la gamme de températures 1400-1650 °C en utilisant une technique d'équilibrage et de trempe suivie d'EPMA.
Les paramètres des modèles thermodynamiques pour les phases d'oxydes ont été optimisés pour reproduire simultanément les résultats expérimentaux de la présente étude ainsi que les données thermodynamiques et les diagrammes de phases disponibles dans la littérature pour le système MgO–NiO–SiO2. Un ensemble de fonctions d'énergie de Gibbs auto-cohérentes a été obtenu qui
assure la meilleure description possible des propriétés thermodynamiques et des équilibres de phases dans ce système. Toutes les données disponibles sont reproduites à l’intérieur des incertitudes expérimentales.
Système CaO
–MgO
–NiO
–SiO
2et ses sous-systèmes ternaires
CaO
–NiO
–SiO
2et
CaO
–MgO
–NiO (CHAPTER 7)
Le système quaternaire CaO–MgO–NiO–SiO2 et ses sous-systèmes ternaires contenant NiO
Certains écarts dans les données de la littérature pour le système CaO–NiO–SiO2 ont été mis en
évidence. Pour résoudre les conflits dans les données de la littérature, une nouvelle étude expérimentale a été réalisée dans ce travail. La procédure expérimentale a impliqué un équilibrage et une trempe ultra rapide suivie d’une microanalyse aux rayons X à l’aide d’une sonde électronique (EPMA) des échantillons trempés.
Les conodes entre les oxydes liquides (scories) et les oxydes solides ont été mesurées sur les sections isothermes du diagramme de phases CaO–NiO–SiO2 à des températures comprises entre
1330 et 1500 °C. Les nouvelles données expérimentales ont été comparées aux résultats publiés antérieurement et les divergences ont été clarifiées.
Une optimisation simultanée de toutes les données disponibles dans le système quaternaire CaO– MgO–NiO–SiO2 et dans ses sous-systèmes ternaires CaO–NiO–SiO2 et CaO–MgO–NiO a été
effectuée. Les nouvelles données expérimentales et les résultats expérimentaux publiés antérieurement ont été pris en considération. Les paramètres des modèles optimisés pour les phases d'oxydes reproduisent toutes les données disponibles dans les limites de l'erreur expérimentale. Un ensemble de fonctions d'énergie de Gibbs auto-cohérentes des phases d'oxydes pour les systèmes chimiques a été dérivé.
Système Al
–Fe
–O (CHAPTER 8)
Une optimisation simultanée de toutes les données disponibles dans le système Al-Fe-O à une pression totale de 1 atm a été effectuée. Un ensemble de fonctions d'énergie de Gibbs auto-cohérentes des phases d'oxydes pour le système Al–Fe–O a été dérivé. La description des données de propriétés thermodynamiques et de relations de phases a été obtenue. Les paramètres des modèles optimisés pour les phases d'oxydes reproduisent toutes les données disponibles dans les limites de l'erreur expérimentale.
Système Al
–Ni
–O (CHAPTER 9)
Certains écarts dans les données de la littérature pour la section Al2O3–NiO du système Al–Ni–O
ont été mis en évidence. Pour aider à résoudre les conflits existant dans la littérature, une nouvelle étude expérimentale a été réalisée dans ce travail. La technique expérimentale améliorée inclut un équilibrage et une trempe ultra rapide suivie d’une microanalyse aux rayons X à l’aide d’une sonde électronique (EPMA) des échantillons trempés. La section Al2O3–NiO du
diagramme de phases Al–Ni–O a été mesurée à 1500 et 1600 °C dans l'air. La solubilité de Al2O3
dans NiAl2O4 ainsi que les solubilités mutuelles de α-Al2O3 et NiO ont été mesurées. Ces
mesures expérimentales ont fourni des données supplémentaires pour la modélisation thermodynamique ultérieure.
Une optimisation simultanée de toutes les données disponibles dans le système Al–Ni–O à une pression totale de 1 atm a été réalisée. Les nouvelles données expérimentales et les résultats expérimentaux publiés antérieurement ont été pris en considération. La meilleure description possible des données de propriétés thermodynamiques et de relations de phases a été obtenue. Les paramètres des modèles optimisés pour les phases d'oxydes reproduisent toutes les données disponibles dans les limites de l'erreur expérimentale. Un ensemble de fonctions d'énergie de Gibbs auto-cohérentes des phases d'oxydes dans le système Al–Ni–O a été dérivé.
Système Fe
–Ni
–O (CHAPTER 10)
Certains écarts dans les données de la littérature pour le système Fe–Ni–O ont été mis en évidence. Pour aider à résoudre les conflits existant dans la littérature, une nouvelle étude expérimentale a été réalisée dans ce travail. Les compositions de wüstite / alliage et spinelle / alliage à l’équilibre ont été mesurées à 1200 °C à des pressions partielles d'oxygène log10[P(O2),
atm] = -9 et -10. La technique expérimentale améliorée a inclus une microanalyse aux rayons X à l’aide d’une sonde électronique (EPMA). Ces mesures expérimentales ont fourni des données supplémentaires pour la modélisation thermodynamique ultérieure.
Une optimisation simultanée de toutes les données disponibles dans le système Fe–Ni–O à une pression totale de 1 atm a été effectuée. Les nouvelles données expérimentales et les résultats expérimentaux publiés antérieurement ont été pris en considération. La meilleure description possible des données de propriétés thermodynamiques et de relations de phases a été obtenue. Les paramètres des modèles optimisés pour les phases d'oxydes reproduisent toutes les données disponibles dans les limites de l'erreur expérimentale. Un ensemble de fonctions d'énergie de Gibbs auto-cohérentes des phases d'oxydes du système Fe–Ni–O a été dérivé.
Systèmes Al
–Fe
–Ni
–O, Al
–Mg
–Ni
–O et Fe
–Mg
–Ni
–O (CHAPTER 11)
La base de données thermodynamiques, combinée aux bases de données obtenues antérieurement pour les systèmes Fe–Ni–O, Al–Ni–O, et Mg–Ni–O, s'est avérée être capable de prédire les
propriétés thermodynamiques et les équilibres de phases dans les systèmes chimiques Al–Fe–Ni– O, Al–Mg–Ni–O et Fe–Mg–Ni–O. Les données expérimentales disponibles sont en bon accord avec les prédictions du modèle. L’unique paramètre du modèle optimisé pour la phase liquide reproduit les données de liquidus disponibles pour le système Al–Fe–Ni–O dans les limites de l'erreur expérimentale.
Systèmes Al
–Ni
–O
–Si et Fe
–Ni
–O
–Si (CHAPTER 12)
Nous avons effectué une optimisation simultanée de toutes les données disponibles sur une large gamme de températures et de pressions partielles d'oxygène (de l'air jusqu’à la saturation en métal) dans les systèmes Al–Ni–O–Si et Fe–Ni–O–Si à une pression totale de 1 atm. Les équations de modèles optimisées pour les propriétés thermodynamiques de toutes les phases reproduisent toutes les données disponibles sur la thermodynamique et les équilibres de phases dans les limites de l'erreur expérimentale.
Système Fe
–Mg
–Ni
–O
–Si (CHAPTER 13)
En utilisant l'ensemble des paramètres de modèles optimisés, les prédictions des équilibres de phases dans le système Fe–Mg–Ni–O–Si ont été faites et les paramètres des modèles ont été vérifiés à partir des données disponibles dans la littérature.
Systèmes Ca
–Fe
–Ni
–O et Ca
–Fe
–Ni
–O
–Si (CHAPTER 14)
En utilisant l'ensemble des paramètres de modèles optimisés, les prédictions des équilibres de phases dans les systèmes Ca–Fe–Ni–O et Ca–Fe–Ni–O–Si ont été faites et les paramètres des modèles ont été vérifiés à partir des données disponibles dans la littérature.
La base de données actuelle a été incorporée dans les bases de données existantes de FactSage. Ainsi, la gamme d'applications des bases de données de FactSage a été élargie et les bases de données existantes ont été mises à jour pour décrire les données expérimentales d'intérêt industriel les plus récentes et les plus précises.
La base de données obtenue couplée à un logiciel de minimisation de l'énergie de Gibbs permet de prédire les équilibres de phases de liquidus et de solidus ainsi que certaines propriétés thermodynamiques dans les conditions (gamme de compositions, de températures et de pressions partielles d'oxygène) les plus utiles pour les opérations métallurgiques.
En ce qui concerne les travaux futurs, Cr et Co pourraient être ajoutés dans la base de données ; Cr étant l'un des principaux composants des minerais latéritiques et Co étant l'une des principales impuretés dans le produit final de la transformation de ces minerais. De plus, la base de données pourrait être étendue pour inclure les sulfures afin de pouvoir calculer les équilibres matte/laitier/metal.
TABLE OF CONTENTS
DEDICATION ... III ACKNOWLEDGEMENTS ... IV RÉSUMÉ ... V ABSTRACT ... IX CONDENSÉ ...XII TABLE OF CONTENTS ... XX LIST OF TABLES ... XXVIII LIST OF FIGURES ... XXXI LIST OF SYMBOLS AND ABBREVIATIONS... XLVINTRODUCTION ... 1
CHAPTER 1 OVERVIEW OF LATERITE ORES PROCESSING ... 5
1.1 Laterite ore ... 5
1.2 Caron process ... 8
1.3 Characterization of the ore from the BHP Billiton refinery ... 10
1.4 Goal of the present study ... 12
CHAPTER 2 METHODOLOGY ... 14
CHAPTER 3 EXPERIMENTAL TECHNIQUE ... 16
3.1 General overview of experimental techniques in phase equilibria studies ... 16
3.2 Experimental technique (PyroSearch, Australia) ... 17
3.2.1 Sample and crucible preparation ... 18
3.2.2 Equilibration ... 20
3.2.3 Sample examination ... 22
CHAPTER 4 THERMODYNAMIC MODELING ... 24
4.1 Thermodynamic equilibrium modeling ... 24
4.2 CALPHAD method ... 25
4.3 Thermodynamic optimization ... 26
4.4 FactSage software ... 26
4.4.1 FToxid and FSstel databases ... 28
4.5 Thermodynamic phases and their modeling ... 29
4.5.1 Slag (liquid oxide) modeling ... 30
4.6 Compound Energy Formalism (CEF) ... 37
4.6.1 Spinel modeling ... 38
4.6.2 Olivine modeling ... 42
4.6.3 Pyroxene modeling ... 43
4.6.4 Monoxide and corundum solutions ... 44
4.6.5 Other solutions and stoichiometric compounds ... 45
CHAPTER 5 ARTICLE 1: EXPERIMENTAL STUDY AND THERMODYNAMIC OPTIMIZATION OF THE CaO–NiO, MgO–NiO AND NiO–SiO2 SYSTEMS ... 46
5.1 Introduction ... 47
5.2 Experimental technique and procedure ... 48
5.3 Experimental results ... 50
5.4 Phases and thermodynamic models ... 54
5.4.1 Liquid oxide ... 54
5.4.2 Monoxide ... 55
5.5 Critical evaluation of experimental data and optimization ... 55
5.5.1 Solid and liquid NiO ... 55
5.5.3 MgO–NiO system ... 60 5.5.4 NiO–SiO2 system ... 64
5.6 Conclusions ... 68
CHAPTER 6 ARTICLE 2: EXPERIMENTAL STUDY AND THERMODYNAMIC
MODELING OF THE MgO–NiO–SiO2 SYSTEM ... 74
ABSTRACT ... 74 6.1 Introduction ... 75 6.2 Experimental procedure ... 76 6.2.1 Preparation of oxide mixtures ... 76 6.2.2 High temperature equilibration technique ... 77 6.2.3 Control of temperature ... 77 6.2.4 Analysis technique and representation of systems ... 77 6.2.5 Assessment of achievement of equilibrium ... 79 6.3 Experimental results ... 80 6.4 Phases and thermodynamic models ... 86 6.4.1 Slag (liquid oxide) ... 87 6.4.2 Compound Energy Formalism (CEF) ... 88 6.5 Critical evaluation of experimental data and optimization ... 91 6.5.1 Solid solutions and subsolidus phase equilibria ... 91 6.5.2 Phase equilibria with liquid ... 98 6.5.3 Optimization ... 103 6.6 Conclusion ... 106
CHAPTER 7 THERMODYNAMIC OPTIMIZATION OF THE QUATERNARY CaO–
MgO–NiO–SiO2 OXIDE SYSTEM AND ITS TERNARY SUBSYSTEMS CaO–NiO–SiO2
7.1 Background ... 108 7.2 Experimental ... 110 7.2.1 Preparation of oxide mixtures ... 110 7.2.2 High temperature equilibration technique ... 110 7.2.3 Control of temperature ... 111 7.2.4 Analysis technique and representation of systems ... 111 7.2.5 Assessment of achievement of equilibrium ... 112 7.3 Experimental results ... 112 7.4 Phases and thermodynamic models ... 115 7.5 Slag (liquid oxide) ... 116 7.6 Monoxide (solid oxide) ... 117 7.7 Compound energy formalism (CEF) ... 118 7.7.1 Olivine ... 119 7.7.2 Pyroxenes ... 120 7.7.3 Melilite ... 121 7.8 Critical evaluation of experimental data and optimization ... 121 7.8.1 CaO-NiO-SiO2 system ... 122
7.8.2 CaO–MgO–NiO system ... 130 7.8.3 CaO–MgO–NiO–SiO2 quaternary system ... 131
7.9 Summary of results ... 137 CHAPTER 8 Al–Fe–O THERMODYNAMIC MODELING ... 142
8.1 Background ... 142 8.2 Phases and thermodynamic models ... 142 8.2.1 Slag (liquid oxide) ... 144
8.2.2 Spinel ... 144 8.2.3 Monoxide – AlO1.5–FeO–FeO1.5 ... 148
8.2.4 Corundum – AlO1.5–FeO1.5 ... 149
8.2.5 Metallic solutions and stoichiometric compounds ... 149 8.3 Literature review of experimental data ... 149 8.3.1 FeAl2O4 ... 150
8.3.2 FeAlO3 phase ... 153
8.3.3 Hematite-corundum solid solution ... 154 8.3.4 Phase diagram data ... 154 8.4 Optimization ... 168 8.4.1 Spinel ... 169 8.4.2 Monoxide, corundum ... 170 8.4.3 Liquid ... 171 8.4.4 FeAlO3 phase ... 171 8.5 Summary of results ... 172 CHAPTER 9 Al–Ni–O THERMODYNAMIC MODELING ... 176
9.1 Background ... 176 9.2 Phases and thermodynamic models ... 177 9.2.1 Slag (liquid oxide) ... 177 9.2.2 Spinel ... 178 9.2.3 Monoxide – NiO(AlO1.5) ... 183
9.2.4 Corundum – AlO1.5(NiO) ... 183
9.2.5 Other solutions and stoichiometric compounds ... 184 9.3 Literature review of experimental data and evaluation ... 184
9.4 NiAl2O4 ... 185
9.4.1 Heat capacity and entropy ... 185 9.4.2 Enthalpy of formation ... 186 9.4.3 Gibbs energy ... 188 9.4.4 Cation distribution ... 191 9.4.5 Phase diagram data ... 191 9.5 Optimization ... 193 9.5.1 Spinel ... 193 9.5.2 Corundum and monoxide ... 194 9.5.3 Liquid ... 195 9.6 Summary of results ... 195 CHAPTER 10 Fe–Ni–O MODELING ... 199
10.1 Background ... 199 10.2 Phases and thermodynamic models ... 200 10.2.1 Slag (liquid oxide) ... 201 10.2.2 Spinel ... 201 10.2.3 Monoxide – NiO–FeO–FeO1.5 ... 205
10.2.4 Corundum – FeO1.5(NiO) ... 205
10.2.5 Other solutions and stoichiometric compounds ... 205 10.3 Literature review of experimental data ... 205 10.3.1 NiFe2O4 ... 206
10.3.2 Phase diagram data ... 211 10.4 Optimization ... 228 10.4.1 Spinel ... 228
10.4.2 Monoxide, corundum ... 230 10.4.3 Liquid ... 230 10.5 Summary of results ... 230
CHAPTER 11 THERMODYNAMIC OPTIMIZATION AND PREDICTION OF PHASE
EQUILIBRIA IN THE Al–Fe–Ni–O, Al–Mg–Ni–O AND Fe–Mg–Ni–O SYSTEMS... 234 11.1 Background ... 234 11.2 Phases and thermodynamic models ... 234 11.2.1 Slag (liquid oxide) ... 236 11.2.2 Spinel, monoxide, corundum ... 237 11.2.3 Other solutions and stoichiometric compounds ... 237 11.3 Literature review of experimental data ... 238 11.3.1 Al–Fe–Ni–O system ... 238 11.3.2 Al–Mg–Ni–O system ... 245 11.3.3 Mg–Fe–Ni–O system ... 248 11.4 Optimization ... 254 11.5 Summary of results ... 254 CHAPTER 12 THERMODYNAMIC OPTIMIZATION OF THE Al–Ni–O–Si AND Fe–Ni–O–Si SYSTEMS ... 257
12.1 Background ... 257 12.2 Phases and thermodynamic models ... 257 12.2.1 Slag (liquid oxide) ... 259 12.2.2 Spinel, Monoxide, Corundum ... 259 12.2.3 Olivine ... 260 12.2.4 Mullite ... 260 12.2.5 Other solutions and stoichiometric compounds ... 261
12.3 Fe–Ni–O–Si system ... 261 12.3.1 Literature review ... 261 12.3.2 Optimization ... 285 12.4 Al–Ni–O–Si system ... 287 12.4.1 Literature review ... 287 12.4.2 Optimization ... 289 12.5 Summary of results ... 289
CHAPTER 13 PREDICTION OF PHASE EQUILIBRIA IN THE Fe–Mg–Ni–O–Si SYSTEM ... 290
CHAPTER 14 PREDICTION OF PHASE EQUILIBRIA IN THE Ca–Fe–Ni–O AND Ca–Fe– Ni–O–Si SYSTEMS ... 291
14.1 Ca–Fe–Ni–O system ... 291 14.2 Ca–Fe–Ni–O–Si system ... 292 GENERAL DISCUSSION AND CONCLUSIONS ... 294 LIST OF REFERENCES ... 300
LIST OF TABLES
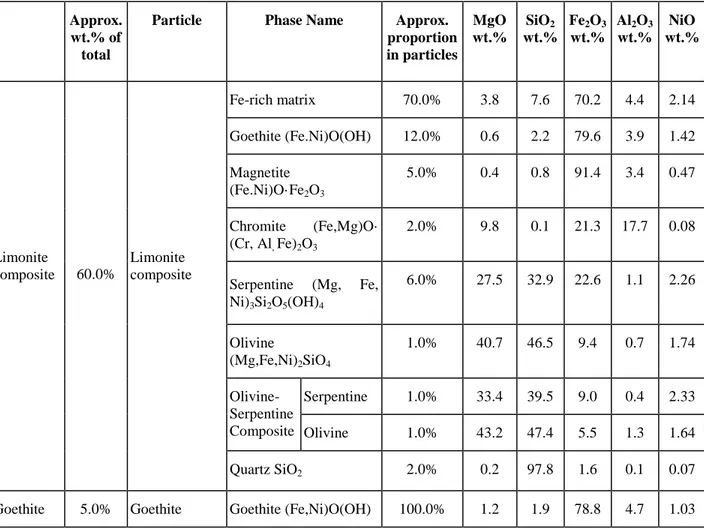
Table 1.1: Summary of major particle and phase average compositions, measured by EPMA, observed in the ore feed sample (wt.%) ... 11 Table 4.1: Stable oxide solutions present in the Al–Ca–Fe–Mg–Ni–O–Si multicomponent system
at ambient pressure ... 29 Table 5.1: Compositions of the monoxide solid solution (Mg,Ni)O in equilibrium with solid Ni
measured at fixed temperatures and oxygen partial pressures ... 52 Table 5.2: Measured miscibility gap in the (Ca,Ni)O monoxide solid solution in air ... 53 Table 5.3 : Optimized properties of stoichiometric compounds and model parameters for the
liquid phase and monoxide solid solution in the CaO–NiO, MgO–NiO and NiO–SiO2
systems (J·mol-1 and J·mol-1·K-1) ... 70 Table 6.1: Measured phase compositions for samples equilibrated for different periods of time in
air at 1570 °C... 79 Table 6.2: Equilibrium phase compositions measured by EPMA in the liquidus region of the
MgO–NiO–SiO2 system for temperatures ranging between 1566 °C and 1650 °C ... 82
Table 6.3: Equilibrium phase compositions measured by EPMA in the subsolidus region of the MgO–NiO–SiO2 system for temperatures ranging between 1400 °C and 1546 °C ... 83
Table 6.4: Stable oxide phases present in the MgO–NiO–SiO2 system at ambient pressure ... 87
Table 6.5: Experimental and calculated eutectic points in the MgO–NiO–SiO2 system ... 102
Table 6.6: Optimized model parameters for the slag, olivine and proto-pyroxene phases in the MgO–NiO–SiO2 system (J·mol-1)* ... 104
Table 7.1: Equilibrium phase compositions measured by EPMA in the system CaO–NiO–SiO2 in
air for temperatures ranging from 1330 to 1500 °C ... 114 Table 7.2: Solution phases and stoichiometric compounds present in the CaO–MgO–NiO–SiO2
system ... 115 Table 7.3: Measured [131] and calculated activities of NiO in the CaO–NiO–SiO2 liquid slag at
Table 7.4: Calculated temperatures of invariant equilibria involving niopside compared to the experimental data of Pretorius and Muan [124] ... 129 Table 7.5: Experimental [124] and calculated solidus and liquidus temperatures for several
compositions on the CaMgSi2O6–CaNiSi2O6 section of the CaO–MgO–NiO–SiO2 phase
diagram ... 134 Table 7.6: Measured [131] and calculated activities of NiO in the CaO–MgO–NiO–SiO2 liquid
slag at 1400 °C ... 135 Table 7.7 : Optimized model parameters for the slag, olivine and pyroxene phases in the CaO– MgO–NiO–SiO2 system and its subsystems CaO–NiO–SiO2 and CaO–MgO–NiO (J·mol-1
and J·mol-1·K-1) ... 139 Table 8.1: Solution phases and stoichiometric compounds present in the Al–Fe–O system ... 143 Table 8.2: Optimized properties of stoichiometric compounds and model parameters for oxide
phases in the Al–Fe–O system (J·mol-1 and J·mol-1·K-1) ... 173 Table 9.1: Solution phases and stoichiometric compounds present in the Al–Ni–O system ... 177 Table 9.2: Optimized properties of stoichiometric compounds and model parameters for oxide
phases in the Al–Ni–O system (J·mol-1 and J·mol-1·K-1) ... 196 Table 10.1: Solution phases and stoichiometric compounds present in the Fe–Ni–O system ... 200 Table 10.2: Optimized properties of stoichiometric compounds and model parameters for oxide
phases in the Fe–Ni–O system (J·mol-1 and J·mol-1·K-1) ... 232 Table 11.1: Solution phases and stoichiometric compounds in the Al–Fe–Ni–O, Al–Mg–Ni–O
and Fe–Mg–Ni–O systems ... 235 Table 11.2 : Optimized model parameters for the liquid phase in the Al–Fe–Ni–O system (J·mol
-1
) ... 255 Table 12.1: Oxide solution phases and stoichiometric compounds in the Al–Ni–O–Si and Fe–Ni– O–Si systems ... 258 Table 12.2: Optimized model parameters for the Al–Ni–O–Si and Fe–Ni–O–Si system (J·mol-1) ... 286
Table 13.1 : Cation distribution in Fe-Mg-Ni olivine at 1000 °C : experimental data of Nord et al. [348] and calculated site occupancies ... 290
LIST OF FIGURES
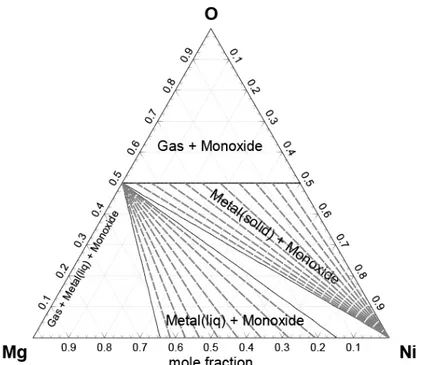
Figure 1.1 : World exporters of unwrought nickel [10] ... 5 Figure 1.2 : World exporters of nickel mattes and other products of nickel metallurgy [10] ... 5 Figure 1.3: Typical tropical laterite profile, along with processing options [11] ... 7 Figure 3.1: Schematic phase diagram illustrating use of the subsolidus equilibration technique
[20] ... 18 Figure 3.2 : Platinum crucible design and suspension [20]... 19 Figure 3.3: Furnace design used in equilibration experiments [20] ... 20 Figure 4.1 : Schematic representation of a silicate chain [30] ... 31 Figure 4.2 : Molar enthalpy and entropy of mixing for a system A-B calculated at 1000 °C with
2
A B
Z =Z = from the Quasichemical model for short-range ordering with AB
Δg =constant=0,-21,-42, and -84 kJ ... 36 Figure 5.1: Calculated isothermal section of the Mg–Ni–O phase diagram at 1200 °C ... 50 Figure 5.2: Typical backscattered SEM micrographs of the equilibrated phases in the MgO–NiO
(I) and CaO–NiO (II) systems. (I) Ni metal (M) and (Mg, Ni)O monoxide (O) at 1300 °C and P(O2) = 10-10 atm; (II) (Ni, Ca)O bunsenite (B) and (Ca, Ni)O lime (L) at 1600 °C in air
... 51 Figure 5.3: Equilibrium oxygen pressure over tie-lines between the monoxide (Mg,Ni)O solid
solution and solid Ni as a function of mole fraction of NiO in monoxide. Points indicate the experimental data obtained in the present study. Solid and dashed lines are calculated from the model parameters optimized in the present study and by Woo et al. [55], respectively .. 53 Figure 5.4: Heat content of solid NiO: experimental points [60, 61] and solid lines optimized in
the present study. The dashed lines were used in the optimization of Woo et al. [55] ... 57 Figure 5.5: Heat capacity of NiO: experimental points [62-67] and solid lines optimized in the
present study. The dashed lines were used in the optimization of Woo et al. [55] ... 57 Figure 5.6: CaO–NiO phase diagram: experimental points [69-72] and calculated lines ... 58
Figure 5.7: Activity of CaO in the monoxide solid solution: experimental points [71, 72] and calculated lines ... 60 Figure 5.8: Activity of NiO in the monoxide solid solution: experimental points [72] and
calculated lines ... 60 Figure 5.9: NiO–MgO phase diagram: experimental points [68] and calculated lines ... 61 Figure 5.10: Enthalpy of mixing for the monoxide solid solution: experimental points [75, 76]
and calculated lines. Error bars for the experimental points of Davies and Navrotsky [76] correspond to one standard deviation. The dash-dot line indicates the assessment of Woo et
al. [55] ... 63
Figure 5.11: Activity of NiO in the monoxide (Mg,Ni)O solid solution: experimental points are from the present study and References [77-87]; calculated lines are based on the optimized model parameters ... 64 Figure 5.12: NiO–SiO2 phase diagram: experimental points [88-94] and calculated lines ... 65
Figure 5.13: Gibbs energies of formation of Ni2SiO4 from pure oxides: results of EMF
measurements [92, 101-105] and calculated lines ... 67 Figure 5.14: Equilibrium partial pressure of oxygen for the reaction 2Ni(s) + SiO2(s) + O2(g) =
Ni2SiO4(s). Points show the results of gas equilibration [106-108] and EMF studies [92,
101-105]. The calculated line corresponds to SiO2 in its stable state ... 68
Figure 6.1: Microstructure of a sample in the MgO–NiO–SiO2 system equilibrated for 72 hours at
1400 °C in air showing that equilibrium is not achieved. Monoxide (M), Pyroxene (P), Tridymite (T) and Voids (V) ... 80 Figure 6.2: Typical backscattered SEM micrographs of samples in the MgO–NiO–SiO2 system
equilibrated in air: (I) Liquid (L) and Cristobalite (C) at 1570 °C; (II) Liquid (L), Olivine (O) and Cristobalite (C) at 1570 °C; (III) Monoxide (M), Olivine (O) and Voids (V) at 1400 °C; (IV) Pyroxene (P), Olivine (O) and Voids (V) at 1400 °C ... 81 Figure 6.3: Isothermal section of the MgO–NiO–SiO2 phase diagram at 1400 °C: experimental
tie-lines measured in this study, literature data [108, 110], and calculated lines (see Table 6.4 for the phase names) ... 92
Figure 6.4: Composition dependence of cation ordering in Mg-Ni olivine: experimental points [111-119] and calculated lines ... 93 Figure 6.5: Temperature dependence of the cation ordering of Ni on M1 sites in the olivine
solutions Mg1.0Ni1.0SiO4 and Mg1.6Ni0.4SiO4: experimental points [111, 113-115, 117-119]
and calculated lines ... 94 Figure 6.6: Partial pressures of oxygen for olivine in equilibrium with nickel and silica:
experimental points [108, 120, 121] and calculated lines ... 96 Figure 6.7: Distribution of Ni between NiXMg1-XO (monoxide) and (NiXMg1-X)2SiO4 (olivine) at
several temperatures: experimental points [87, 122] and calculated lines ... 97 Figure 6.8: Distribution of Ni between NiXMg1-XSiO3 (proto-pyroxene) and (NiXMg1-X)2SiO4
(olivine) at several temperatures: experimental points [87] and calculated lines. Dashed lines are metastable extrapolations into the proto-pyroxene/olivine/SiO2 three-phase region ... 97
Figure 6.9: Isothermal section of the MgO–NiO–SiO2 phase diagram at 1570 °C: tie-lines
measured in the present study, experimental points [93], and calculated lines (see Table 6.4 for the phase names). Temperatures in brackets are the actual temperatures at which experiments of Grutzeck and Muan [93] were made ... 99 Figure 6.10: Isothermal section of the MgO–NiO–SiO2 phase diagram at 1600 °C: tie-lines
measured in the present study, experimental points [93], and calculated lines (see Table 6.4 for the phase names). Temperatures in brackets are the actual temperatures at which experiments of Grutzeck and Muan [93] were made. Phase boundaries calculated using the optimization of Woo et al. [55] are shown by short-dashed lines ... 100 Figure 6.11: Isothermal section of the MgO–NiO–SiO2 phase diagram at 1620 °C: experimental
points [93] and calculated lines (see Table 6.4 for the phase names). Temperatures in brackets are the actual temperatures at which experiments of Grutzeck and Muan [93] were made. Phase boundaries calculated using the optimization of Woo et al. [55] are shown by short-dashed lines ... 101 Figure 6.12: Isothermal section of the MgO–NiO–SiO2 phase diagram at 1650 °C: tie-lines
for the phase names). Temperatures in brackets are the actual temperatures at which experiments of Grutzeck and Muan [93] were made ... 102 Figure 6.13: Phase diagram of the Mg2SiO4–Ni2SiO4 orthosilicate section: experimental points
[89] and calculated lines ... 103 Figure 6.14 : Composition dependence of the cation ordering in Ni proto-pyroxene and Mg-Fe ortho-pyroxene (Opx) at 800 °C... 105 Figure 6.15 : Calculated liquidus projection of the MgO–NiO–SiO2 phase diagram. Temperatures
are in °C, phase names are given in Table 6.4 ... 106 Figure 7.1: Backscattered SEM micrographs typical of the equilibrated CaO–NiO–SiO2 system
(I) Liquid (L), Olivine (O) and Tridymite (T) at 1370 °C in air; (II) Liquid (L) and wollastonite (W) at 1400 °C in air; (III) Liquid (L), Tridymite (T) and Wollastonite (W) at 1390 °C in air ... 113 Figure 7.2: Temperature dependence of the Gibbs energy of formation of niopside CaNiSi2O6
from NiO, SiO2 and CaSiO3: literature data [124, 130] and calculated lines ... 123
Figure 7.3: Isothermal section of the CaO–NiO–SiO2 phase diagram at 1100 °C: literature data
[130] and calculated lines ... 124 Figure 7.4: Isothermal section of the CaO–NiO–SiO2 phase diagram at 1360 °C: literature data
[125], this study experimental results and calculated lines ... 125 Figure 7.5: Isothermal section of the CaO–NiO–SiO2 phase diagram at 1390 °C: literature data
[125], this study experimental results and calculated lines ... 125 Figure 7.6: Isothermal section of the CaO–NiO–SiO2 phase diagram at 1475 °C: literature data
[125] and calculated lines ... 126 Figure 7.7: Isothermal section of the CaO–NiO–SiO2 phase diagram at 1550 °C: literature data
[125] and calculated lines ... 126 Figure 7.8: CaSiO3–NiSiO3 section of the CaO–NiO–SiO2 phase diagram: literature data [124,
Figure 7.9: Calculated liquidus projection of the CaO–NiO–SiO2 system (temperature in °C),
where CaO’ = monoxide rich in CaO, NiO’ = monoxide rich in NiO (other notations are given in Table 7.2). Numbers 1-4 correspond to the phase equilibria given in Table 7.4 ... 130 Figure 7.10: Calculated liquidus projection of the CaO–MgO–NiO phase diagram (temperatures
in °C) ... 131 Figure 7.11: CaMgSi2O6–CaNiSi2O6 section of the CaO–MgO–NiO–SiO2 phase diagram:
experimental data [124] and calculated lines (notations are given in Table 7.2) ... 132 Figure 7.12: Partial pressures of oxygen for clino-pyroxene (cpx) in equilibrium with CaSiO3,
SiO2 and Ni at 1350 °C: experimental data [124] and a calculated line ... 133
Figure 7.13: Calculated liquidus projection of the CaO–MgO–NiO–SiO2 phase diagram at 10
wt.% NiO (temperatures in °C; notations are given in Table 7.2) ... 136 Figure 7.14: Calculated liquidus projection of the CaO–MgO–NiO–SiO2 phase diagram at 20
wt.% NiO (temperatures in °C; notations are given in Table 7.2) ... 136 Figure 7.15: Calculated liquidus projection of the CaO–MgO–NiO–SiO2 phase diagram at 40
wt.% NiO (temperatures in °C; notations are given in Table 7.2) ... 137 Figure 8.1: Cation distribution in stoichiometric FeAl2O4: literature data [136-150] and a
calculated line ... 145 Figure 8.2: Cation distribution in FeAl2O4–Fe3O4 solid solution: literature data [147, 152] and
calculated lines ... 146 Figure 8.3: Al–Fe phase diagram (see Table 8.1 for notations) ... 149 Figure 8.4: Isothermal section of the Al–Fe–O phase diagram in air at 1000 °C and P = 1 atm:
literature data [155] and calculated lines. Dashed lines are calculated tie-lines (see Table 8.1 for notations) ... 150 Figure 8.5: Heat capacity of FeAl2O4 spinel: literature data [156, 157] and calculated lines ... 151
Figure 8.6: Partial pressures of oxygen for the FeAl2O4 + α-Al2O3 + Fe(s,l) assemblage: literature
Figure 8.7: Heat capacity of FeAlO3 phase: literature data of Majzlan et al. [170] and calculated
lines (black – ½ sum of oxides, blue – current database) ... 153 Figure 8.8: Enthalpy of mixing of hematite-corundum solid solution at 25 °C and 702 °C:
literature data of Majzlan et al. [170] for differently prepared samples and calculated lines ... 154 Figure 8.9: Fe3O4–FeAl2O4 section: experimental data [151, 178] indicating spinel miscibility
gap at P(O2) = 10-14-10-28 atm and unspecified partial pressures of oxygen, respectively, and
calculated lines (see Table 8.1 for notations): black solid line – partial pressure of oxygen of 10-14 atm, red solid line – monoxide saturation. ... 155 Figure 8.10: Non-stoichiometry of spinel at various oxygen partial pressures at 1400 °C:
experimental isobars [180], solid lines – calculated diagram at 1 atm total pressure, dashed lines – calculated isobars (see Table 8.1 for notations) ... 156 Figure 8.11: Partial pressures of oxygen for FeAl2O4–Fe3O4 + Wüstite assemblage for different
compositions of the spinel phase: literature data of Lykasov and Kimyashev [179] and Valleh and Raccah [181] and calculated lines ... 157 Figure 8.12: Activity of Fe3O4 in the FeAl2O4–Fe3O4 solution versus its compositions at 1300 °C:
the experimental data of Petric et al. [182] and a calculated line ... 158 Figure 8.13: Al2O3–FeO section at metallic saturation: experimental data [151, 155, 183-190] and
calculated lines (see Table 8.1 for notations) ... 159 Figure 8.14: Partial pressures of oxygen as a function of temperature over phase triangles in the
Al–Fe–O system: literature data [151, 158-165, 169, 187] and calculated lines (see Table 8.1 for notations) ... 160 Figure 8.15: Isothermal section of the Al–Fe–O phase diagram at 1250 °C: experimental data
[155] and calculated lines. Dashed lines are calculated tie-lines (see Table 8.1 for notations) ... 161 Figure 8.16: Isothermal section of the Al–Fe–O phase diagram at 1350 °C: experimental data
[155] and calculated lines. Dashed lines are calculated tie-lines (see Table 8.1 for notations) ... 162
Figure 8.17: P(O2)-x phase diagram at 1280 °C (see Table 8.1 for notations) ... 163
Figure 8.18: P(O2)-x phase diagram at 1370 °C (see Table 8.1 for notations) ... 164
Figure 8.19: P(O2)-x phase diagram at 1500 °C (see Table 8.1 for notations) ... 164
Figure 8.20: Al2O3–Fe2O3 section of the Al–Fe–O phase diagram in air: experimental data [151,
155, 168, 169, 171-177], where dashed lines are smoothed data, and calculated lines (see Table 8.1 for notations) ... 166 Figure 8.21: Al2O3–Fe2O3 section of the Al–Fe–O phase diagram at partial pressure of oxygen of
1 atm: experimental data of Muan and Gee [168] (dashed lines and points, where dashed lines are smoothed data) and calculated lines (see Table 8.1 for notations) ... 167 Figure 8.22: Equilibrium pressures of oxygen over FexO–Al2O3 slag-metal tie-lines at 1400 °C
... 168 Figure 9.1: Cation distribution in stoichiometric NiAl2O4: literature data [197-219] and a
calculated line ... 179 Figure 9.2: Cation distribution in NiAl2O4–α-Al2O3 solid solution: literature data [215, 218] and
calculated lines ... 180 Figure 9.3: Heat capacity of γ-alumina: literature data [220] and a calculated line ... 182 Figure 9.4: Enthalpy of transition of γ- to α-alumina: literature data [220-229] and a calculated
line ... 183 Figure 9.5: Al–Ni phase diagram [194] ... 184 Figure 9.6: Calculated isothermal section of the Al–Ni–O phase diagram at 1100 °C... 185 Figure 9.7: Heat capacity of NiAl2O4: literature data [230-232] and calculated lines ... 186
Figure 9.8: Partial pressures of oxygen for the Ni-alloy(s,l) + spinel + Al2O3 assemblage:
literature data [163, 237-246] and a calculated line ... 189 Figure 9.9: Partial pressures of oxygen for the spinel-Ni-alloy equilibria: literature data [246] and
calculated lines ... 189 Figure 9.10: Partial pressures of oxygen for the NiAl2O4(spinel) + NiO-based monoxide +
Figure 9.11: Calculated Al2O3–NiO section of the Al–Ni–O phase diagram: literature data [90,
177, 196, 199, 218, 246, 248-252] in air, at metallic saturation [241, 242, 246] and results of this study ... 192 Figure 10.1: Cation distribution in stoichiometric NiFe2O4: literature data [40, 153, 212, 214,
256-269] and a calculated line ... 202 Figure 10.2: Cation distribution in NiFe2O4–αFe2O3 solid solution: literature data [270] and a
calculated line ... 203 Figure 10.3: Isothermal section of the Fe–Ni–O phase diagram in air at 1273 K (1000 °C) and 1
atm ... 206 Figure 10.4: Heat capacity of NiFe2O4 spinel: literature data [156, 275-279] and a calculated line
... 207 Figure 10.5: Heat content for NiFe2O4: literature data [273, 274] and a calculated line ... 208
Figure 10.6: Gibbs energy of formation of nickel ferrite NiFe2O4 from oxides NiO and α-Fe2O3:
literature data [238, 240] and a calculated line ... 209 Figure 10.7: Calculated partial pressure of oxygen for the spinel-monoxide(NiO-rich)-alloy
equilibria as function of temperature, along with the experimental data [21, 283-289]. The results of Gries and Kuznetsov are taken from Schneider and Schmalzried [286] ... 210 Figure 10.8 : Non-stoichiometry of spinel at various oxygen partial pressures at 1300 °C :
experimental isobars of O’Bryan et al. [300] and calculated isobars. Black lines – the calculated isothermal section at 1 atm total pressure (See notations in Table 10.1) ... 214 Figure 10.9 : Non-stoichiometry of spinel at various oxygen partial pressures at 1400 °C :
experimental isobars of Shafer [301] and calculated isobars. Black lines – the calculated isothermal section at 1 atm total pressure (See notations in Table 10.1) ... 215 Figure 10.10 : Non-stoichiometry of spinel at various oxygen partial pressures at 1500 °C :
experimental isobars of Shafer [301] and calculated isobars. Black lines – the calculated isothermal section at 1 atm total pressure (See notations in Table 10.1) ... 216
Figure 10.11 : Non-stoichiometry of spinel at various oxygen partial pressures at 1600 °C : experimental isobars of Shafer [301] and calculated isobars. Black lines – the calculated isothermal section at 1 atm (See notations in Table 10.1) ... 217 Figure 10.12 : Non-stoichiometry δ of the Ni-rich monoxide phase (Ni, Fe)1-δO in the temperature
range 1173-1303 K (900-1030 °C): literature data of Schneider and Schmalzried [286] and calculated lines ... 217 Figure 10.13: Log10[P(O2), atm]-X phase diagram of the Fe–Ni–O system at 800 °C: literature
data [21, 285, 288, 299] and calculated lines. See notations in Table 10.1 ... 219 Figure 10.14: Log10[P(O2), atm]-X phase diagram of the Fe–Ni–O system at 900 °C: literature
data [21, 285, 287-290, 293, 295, 296, 299] and calculated lines. See notations in Table 10.1 ... 220 Figure 10.15: Log10[P(O2), atm]-X phase diagram of the Fe–Ni–O system at 1000 °C: literature
data [21, 283-287, 293, 295, 296, 299] and calculated lines. The results of Gries and Kuznetsov are taken from Schneider and Schmalzried [286]. See notations in Table 10.1. The partial pressure of oxygen for the spinel–(NiO-rich) monoxide–alloy equilibrium was estimated by Rhamdhani et al. [21] using the earlier version of the FactSage software. These data are shown by solid violet circles ... 221 Figure 10.16: Log10[P(O2), atm]-X phase diagram of the Fe–Ni–O system at 1100 °C: literature
data [21, 285, 286, 293, 295, 296] and calculated lines. See notations in Table 10.1. The partial pressure of oxygen for the spinel–(NiO-rich) monoxide–alloy equilibrium was estimated by Rhamdhani et al. [21] using the earlier version of the FactSage software. These data are shown by solid violet circles ... 222 Figure 10.17: Log10[P(O2), atm]- X phase diagram of the Fe–Ni–O system at 1200 °C: literature
data [21, 286, 296, 297], experimental results of this study and calculated lines. See notations in Table 10.1. The partial pressure of oxygen for the spinel–(NiO-rich) monoxide– alloy equilibrium was estimated by Rhamdhani et al. [21] using the earlier version of the FactSage software. These data are shown by solid violet circles ... 223 Figure 10.18: 0.5‘Fe2O3’-NiO section of the Fe–Ni–O phase diagram in air: literature data [21,
Figure 10.19: Distribution of nickel between wüstite and alloy in the temperature range 700-1200 °C: literature data [291-293] and calculated lines ... 224 Figure 10.20: Distribution of nickel between spinel and alloy in the temperature range 900-1000
°C: literature data [291] and calculated lines ... 225 Figure 10.21: Distribution of Ni between alloy and slag phases of the Fe–Ni–O system in the
temperature range 1500-1750 °C: literature data [303-306] and calculated lines ... 226 Figure 10.22: FeIII/FeII ratio in the slag as a function of the composition of the equilibrium
metallic phase: literature data [304] and a calculated line ... 227 Figure 10.23: ‘FeO’–NiO section of the Fe–Ni–O system at metal saturation along with the
literature data of Schenck et al. [307]. See notations in Table 10.1 ... 227 Figure 11.1: Ternary Al–Fe–Ni–O section in air at 1000 °C. See notations in Table 11.1 ... 238 Figure 11.2: Composition dependence of Ni distribution between the tetrahedral and octahedral
sublattices in the NiAlxFe2-xO4 spinel: experimental data [198, 212, 219, 236, 265, 309-311]
for the tetrahedral sublattice and calculated lines ... 239 Figure 11.3: Composition dependence of Fe distribution between the tetrahedral and octahedral
sublattices in the NiAlxFe2-xO4 spinel: experimental data [198, 212, 219, 236, 265, 308-311]
for the tetrahedral sublattice and calculated lines ... 240 Figure 11.4: Composition dependence of Al distribution between the tetrahedral and octahedral
sublattices in the NiAlxFe2-xO4 spinel: experimental data [198, 212, 219, 265, 309-311] for
the tetrahedral sublattice and calculated lines ... 240 Figure 11.5: Enthalpy of mixing for the mixed nickel aluminate-ferrite spinel Ni(FexAl1-x)2O4 at
700 °C: the experimental data of Lilova et al. [236] and a calculated line ... 241 Figure 11.6: Ternary Al–Fe–Ni–O sections in air: (a) 1200 °C; (b) 1300 °C (c) 1400 °C. Solid
lines are calculated phase boundaries, black short-dashed lines are calculated tie-lines, red dashed lines are tie-lines of Rhamdhani et al. [177]. See notations in Table 11.1 ... 242 Figure 11.7: Distribution of Ni between alloy and spinel phases in the three-phase equilibrium
between the liquid alloy, spinel and corundum solutions at 1550 °C: the literature data of Jacob et al. [312] and the calculated line ... 243
Figure 11.8: Oxygen partial pressure for the three-phase equilibrium between the liquid alloy, spinel and corundum solutions at 1550 °C: the literature data of Jacob et al. [312] and the calculated line ... 243 Figure 11.9: Ternary Al–Fe–Ni–O sections at metallic saturation along with the literature data of
Schenck et al. [307]: (a) 1560 °C; (b) 1600 °C (c) 1640 °C. See notations in Table 11.1 ... 244 Figure 11.10: Distribution of Fe between the slag and alloy phases in equilibrium with spinel in
the temperature range 1560-1640 °C: the literature data of Schenck et al. [307] and calculated lines ... 245 Figure 11.11: Ternary Al–Mg–Ni–O section in air at 1000 °C. See notations in Table 11.1 ... 245 Figure 11.12: Composition dependence of Ni distribution between the tetrahedral and octahedral
sublattices in the nickel magnesium aluminate NixMg1-xAl2O4 spinel solution: literature data
[204, 205] for the tetrahedral site and calculated lines ... 246 Figure 11.13: Calculated composition dependence of Al distribution between the tetrahedral and
octahedral sublattices in the nickel magnesium aluminate NixMg1-xAl2O4 spinel solution . 247
Figure 11.14: Calculated composition dependence of Mg distribution between the tetrahedral and octahedral sublattices in the nickel magnesium aluminate NixMg1-xAl2O4 spinel solution . 247
Figure 11.15: Partial pressures of oxygen for the Ni-alloy-spinel-corundum equilibrium in the temperature range 750-1200 °C: experimental data [206, 313] and calculated lines ... 248 Figure 11.16: Composition dependence of Ni distribution between the tetrahedral and octahedral
sublattices in the nickel-magnesium ferrite NixMg1-xFe2O4 spinel solution: experimental data
[40, 262, 314-318] for the tetrahedral sublattice and calculated lines ... 249 Figure 11.17: Composition dependence of Fe distribution between the tetrahedral and octahedral
sublattices in the nickel-magnesium ferrite NixMg1-xFe2O4 spinel solution: experimental data
[40, 262, 266, 314-318] for the tetrahedral sublattice and calculated lines ... 250 Figure 11.18: Composition dependence of Mg distribution between the tetrahedral and octahedral
sublattices in the nickel-magnesium ferrite NixMg1-xFe2O4 spinel solution: experimental data
![Figure 3.1: Schematic phase diagram illustrating use of the subsolidus equilibration technique [20]](https://thumb-eu.123doks.com/thumbv2/123doknet/2344715.34642/74.918.284.628.114.423/figure-schematic-phase-diagram-illustrating-subsolidus-equilibration-technique.webp)
![Figure 3.2 : Platinum crucible design and suspension [20] 3.2.1.2 Temperature and gas atmosphere control](https://thumb-eu.123doks.com/thumbv2/123doknet/2344715.34642/75.918.324.595.103.441/figure-platinum-crucible-design-suspension-temperature-atmosphere-control.webp)


![Figure 5.6: CaO–NiO phase diagram: experimental points [69-72] and calculated lines](https://thumb-eu.123doks.com/thumbv2/123doknet/2344715.34642/114.918.262.739.460.800/figure-cao-phase-diagram-experimental-points-calculated-lines.webp)
![Figure 5.10: Enthalpy of mixing for the monoxide solid solution: experimental points [75, 76] and calculated lines](https://thumb-eu.123doks.com/thumbv2/123doknet/2344715.34642/119.918.227.749.93.461/figure-enthalpy-mixing-monoxide-solution-experimental-points-calculated.webp)
![Figure 5.11: Activity of NiO in the monoxide (Mg,Ni)O solid solution: experimental points are from the present study and References [77-87]; calculated lines are based on the optimized model parameters](https://thumb-eu.123doks.com/thumbv2/123doknet/2344715.34642/120.918.216.757.107.608/activity-monoxide-solution-experimental-references-calculated-optimized-parameters.webp)