c
IN'l'BRACTIOtfS INTRI LBS THYMOCY'l'IS IT LIS
CILLULIS BPITHBL:IALIS DB LA MIDULLA THYM:IQUI.
("Interactions bet"een thymocyt •• and
thymie medullary epi thelial cells. If )
by
~
PATRICB HUGOThi.e soumise • la f acul t6 des Btudes Gradu6e. et de Recherche. comme exigence partielle pour l'obtention du dipl&me de
Docteur en Philosophie
Département de H'decine Bxpérimentale Université McGill
Montréal, Canada
c
c
A Lucile et Laurent, mes parents,
qui m'ont donné le godt de
l'excellence et les ~l~ments
pour y accéder.
Sylvie, ma compagne qui a
"v~cu"
ct
mes cotés ce périple/'en me procuran t tau t le
r~confort et les encouragements
requis pour 1 e réussir.
Roger et Philippe Dupuis qui
m'ont tracé la voie des ~tudes
RESUME
Les contacts lympho-stromaux thymiques, font partie intégrante de la différenciation des lymphocytes T, mais nous ne connaissons pas leur rôle. L' objectif de ce travail est justement de le préciser. Dans le laboratoire, un test in vitro a été développé pour déceler l'adhérence des thymocytes à une lignée cellulaire, E-5, dérivée d'une culture de stroma thymique. Avec ce modèle, nous décrivons un nouveau complexe lympho-stromal incluant les thymocytes
L3T4+ /Ly-2+ de "type cortical" et les cellules
épi thé1iales médullaires. Les thymocytes adhérents apparaissent au jour 16 de l'embryogenèse et le nombre fluctue pendant l'ontogenèse et la leucémogenèse. Au contact des cellules épi théliales médullaires ces thymocytes deviennent réfractaires à la formation sUbséquente de complexes, sont activés et subissent des changements phénotypiques. Tous ces éléments suggèrent que ce nouveau type de complexes lympho-stroma1 participe activement à la transi tion des thymocytes de "type cortical" en thymocytes de "type médullaire".
. . . ---~ .... !r .. _ 1f...,.~,_ ... ,_ .. !o._'b_ ... Il!iIlS ... ::J!IIGIJI . . . _.;;_;;;;A_E ... __ w.,iiiiiiiiii;;;;;;;;;;;;u_;;;;;;;;;;;;:Il ..
===========_='
c
c
iv
ABSTRACT
Direct lympho-stromal interactions constitutes an intrinsic part of T-cell differentiation. However the precise role of cellular complexes is far from clear. The objective of the present work was to gain an insiqht into this question. An in vitro model was previously developed in the
the adherence of thymocytes
laboratory, which detects to a thymie stromal cell line, E-5. \Ising this model, we describe here a novel lympho-stromal interaction involving L3T4+ !Ly-2+ "cortical type" thymocytes and medullary epi thelial celle These adherent thymocytes appear at day 16 of murine gestation and their number vary during ontogenesis and leukemogenesis. After contact wi th epithelial ce Ils , thymocytes become totally refractory to form further complexes, are activated and undergo sorne phenotypic modifications. AlI these resul ts strongly suggest that this novel lympho-stromal interaction takes place in the transition of "cortical type" thymocytes into "medullary type" thymocytes.
importantes ~ l'échelle de la complexi té
ont lieu non pas entre composantes
moléculaires, mais entre cellules. Il est
donc possible que les propriétés
«cogni tives» des cellules ne soient pas la
manifestation directe des facultés
discrimlnatives de quelques protéines, mais
n'expriment ces facul tés que par des voies
fort détournées. Il n'en reste pas moins
que la construction d'un tissu ou la
différenciation d'un organe, phénomènes
macroscopiques, doivent être considérées
comme la résultante intégrée d'interactions
microscopiques mu1 tiples dues ~ des
protéines, et reposant sur leurs propriétés
de reconnaissance stéréospécifique, par
formation spontanée de complexes
non-covalents. C'est sur de telles bases, mais
non sur celle d'une vague «théorie générale des systèmes»,
de comprendre
qu'il nous devient possible
en quel sens, très réel,
l'organisme transcendre en effet, tout en
les observant, les lois physiques pour
n'être plus que poursuite et
accomplissement de son propre objet" Jacques Monod
c
(
vi REMERCIEMBNTS
Le Dr. E.F. Potworowski a dirigé de près mes travaux en me prodiguant de judicieux conseils et en me transmettant le fruit d'une riche expérience, je tiens donc à lui exprimer ma profonde gratitude. De plus, je lui suis redevable pou~ sa grande disponibilité et d'une façon plus générale pour m'avoir intégré au monde de la Recherche.
Je voudrais souligner l'apport du Gorczynski (Ontario Cancer Institute,
docteur Reginal M.
Toronto) qui m'a accueilli dans son laboratoire et m'a initié aux techniques de différenciation in vitro, ainsi que celle du docteur Pierre Bongrand (H8pital Sainte-Marie, Marseille, France) qui a collaboré à l'interprétation de certaines expériences.
J'exprime ma reconnaissance Beauchemin et Francine Rivard avec qui
envers mesdames Claire j'ai eu le plaisir de une assistance technique travailler et qui m'ont donné
remarquable et au surplus, de nombreux encouragements.
Je suis aussi reconnaissant à madame Mary Desy, pour son concours dans l'analyse statistique des résultats et à monsieur Jean Pelerin, pour son aide plus que secourable dans l'utilisation de divers programmes informatiques. Je remercie aussi messieurs Marcel Desrosiers (Institut Armand-Frappier) et Michel St-Onge (Hôpital Hôtel-Dieu) pour leur aide technique lors d'études cytofluorométriques.
Je tiens à remercier les docteurs Suzanne Lemieux et Daniel Oth (Institut Armand-Frappier), messieurs Yves St-Pierre et Jean Gosselin avec lesquels j'ai eu plusieurs discussions conceptuelles stimulantes.
Finalement, j'aimerais remercier le Fonds de Recherche en Santé du Québec (FRSQ) qui m'a témoigné sa confiance, en m'accordant une bourse de formation pour ce stage doctoral.
~ABLE DES MATIERES Résumé.
. . .
·
· · ·
· ·
• i i i Abstract. . . .
.
·
·
· · ·
·
·
iv vi vii xvii • xix Remerciements· · ·
·
· ·
Table des matières
·
·
·
· ·
· .
.
.
Liste des abréviations·
·
· ·
· ·
Liste des schémas
.
·
·
· ·
·
· ·
Liste des tableaux
· .
.
. · · · ·
·
·
• .XX Liste des figures· ·
·
·
·
·
• xxiINTRODUCTION 1 REVUE BIBL:IOGRAPHIQUE . . • • . • 5 6 6 6 CHAPITRE 1.0 1.1 1 • LE LYMPHOCYTE T INTRODUCTION • H:ISTOR:IQUE .
1.2 FONCTIONS ET SOUS-POPULATIONS MATURES DE
LYMPHOCYTES T . . • . • • . . • 7 7 8 9 9 1.2.0 Introduction . • • . . • 1.2.1 Relation marqueur-fonction 1.3 LA RECONNAISSANCE ANTIGEN:IQUE 1.3.0 Introduction . • • . •
1.3.1 Le complexe majeur d'
histocompati-bUi té chez la souris . • . . • . . • 9 1.3.2 Reconnaissance spécifique restreinte
par le MHC 11
1.3.2.0 Concept de la restriction par
le MHC 11
1.3.2.1 Le récepteur antigénique T 13 1.3.2.1.0 Préliminaire • . . • • . . • 13 1.3.2.1.1 Structure protéique . 13 1.3.2.1.2 Structure génique et
diver-s:..té 14
1.3.2.1.3 Structures associées (T3) • • 15 1.3.2.2 Mécanisme de reconnaissance
c
viii 1.3.2.2.0 Uni té fonctionnelle du complexe TCR • • • • • 1. 3.2.2.1 Modèles de reconnaissance duale . .1 • ., ACTIVATION DES LYMPHOCYTES T
1.5
1.4. 0 Activation spécifique par stimula-tion antigénique 1.4.0.0 Participation TCR/T3 1.4.0.1 Participation accessoires . 1.4.0.1.0 L3T4 et Ly-2 du mul timère des molécules 1. 4 • 0 .1. 1 LFA -1 , 2 , 3 • . 1.4.1 Activation non spécifique
1. 4 .1. 0 Activation polyclonale 1.4.1.1 Activation alternative
1.4.2 Cycle cellulaire
RESUME
CHAPITRE 2. LA DIFFERENCIATION INTRATHYMIQUE • •
2 • 0 INTRODUCTION • • • • 2.1 ANATOMIE DU THYMUS • 2.2 2.3 2.1.0 Introduction 2.1.1 2.1.2 Histologie
Composi tion du stroma thymique 2.1.2.0 Les cellules épithéliales
2.1.2.1 Les macrophages et
cellules dendritiques 2.1.2.2 Les fibroblas tes
les
2.1.2.3 Autres enti tés
non-lymphoïdes . . . .
DYNAMIQUE CELLULAIRE DANS LE THYMUS • • • •
2.2.0 Précis sur le compartiment lymphoïde. 2.2.1 Colonisation lymphoïde
2.2.2 Etude dynamique . •
2.2.3 Atrophie thymique associée au
vieillissemen t SOUS-POPULATIONS DE THYMOCYTES • 16 17 18 18 18 19 19 20 23 23 24 25
27
29 29 30 30 30 31 31 33 33 34 34 34 34 35 36 37...
..
-1.3.2.2.0 Uni té fonctionnelle du complexe TCR . • . . . 16 1.3.2.2.1 Modèle de reconnaissance duale • . . 171.4 ACTIVATION DES LYMPHOCYTES T 18
1.4.0 Activation spécifique par
stimula-tion antigénique . . . • . . • • . . 18 1.4.0.0 Participation du multimère TCR/T3 . . • • . . 18 1. 4.0.1 Participation accessoires . des molécules 1.4.0.1.0 L3T4 et Ly-2 1.4.0.1.1 LFA-1,2,3 • . 1.4.1 Activation non spécifique
1.4.1.0 Activation polyclonale 1.4.1.1 Activation alternative 1.4.2 Cycle cellulaire . • . .
. . .
1.5 RESUME. . . • • . • • . • 19 19 20 23 23 24 25 27CHAPITRE 2. LA DIFFERENCIATION INTRATHYMIQUE 29
2.0 INTRODUCTION. . . • 29
2.1 ANATOMIE DU THYMUS . . . • 30
2.1.0 Introduction 30
2.1.1 Histologie . . . . 30
2.1.2 Composition du stroma thymique 31
2.1.2.0 Les cellules épithéliales . 31
2.1.2.1 Les macrophages et les
cellules dendri tiques 33
2.1.2.2 Les fibroblastes 33
2.1.2.3 Autres entités
non-lymphoïdes • • . . • 34
2.2 DYNAMIQUE CELLULAIRE DANS LE THYMUI; • • . . 34 2.2.0 Précis sur le compartiment lymphoïde. 34
2.3
2.2.1 Colonisation lymphoïde . • . • • . • 2.2.2 Etude dynamique . . . .
2.2.3 Atrophie thymique associée au
vieillissement SOUS-POPULATIONS DE THYMOCYTES . 34 35 36 37
c:
2.3.0 2.3.1
ix Introduction
.
. . .
Apparition des diverses sous-populations pendant l'~mbryogenèse37
38 2.3.1.0 Les marqueurs de surface • . . 38 2.3.1.1 L'ontogenèse du récepteur T . . 40 2.3.1.2 Autres considérations. . • . . 40 2.3.2 Phénotype des différente~
sous-populations de thymocytes, chez
l'adulte . • . . • 41
2.3.2.0 Les prothymocytes . • . . . 41 2.3.2.1 Les préthymocytes . . . . • 42 2.3.2.2 Une population intermédiaire
et transitive • 2.3.2.3 Les thymocytes "type cortical" 2.3.2.4 Les thymocytes immatures de de "type 43 44 médullaire" . . . . . . . . 45 2.3.2.5 Quantification et localisation
des différentes
sous-populations de thymocytes • . . 45
2.3.3 Fonction des sous-populations. . . . 47
2.3.3.0 Réponse aux activateurs
polyclonaux . . . 47 2.3.3.1 Fonction d'amplification et 2.4 INDUCTEURS THYMIQUE . de suppression/cytotoxicité DE LA DIFFERENCIATION
INTRA-. INTRA-. INTRA-.
. . . .
.
.
. .
2.4.0 Introduction 48 49 492.4.1 Les facteurs solubles thymiques. 49
2.4.2 Les contacts lympho-stromaux 50
2.4.2.0 Définition. . . . • • 50
2.4.2.1 Participation obligatoire des contacts lympho-stromaux dans
la différenciation des thymocytes . . 2.4.2.2 Identification des lympho-stromaux
. . .
.
complexes. .
. . . .
Sl
S32.4.2.3 R~le des contacts
lympho-stromaux
. .
.
. .
2.5 SEQUENCE DES EVENEMENTS DANS LA
DIFFEREN-2.6
CIATION INTRATHYMIQUE
2.5.0 Introduction . . • . . • • 2.5.1 Prothymocytes en préthymocytes, DN 2.5.2 DN en cellules transi ti ves et en OP • 2 .5.3 DP en SP • • . • . . • . . • . . • • 2.5.4 SP en émigrants • . . • • . •
2.5.5 Débalancement pathologique des sous-populations de thymocytes . • .
RESUME ET CONCLUSION . • . . • . . . .
CHAPITRE 3. LE ROLE DES CONTACTS LYMPHO-STROMAUX DANS LE DEVELOPPEMENT DE LA LEUCEMIE CHRONIQUE LYMPHOBLASTIQUE T 3.0 INTRODUCTION. 3.1 HISTORIQUE. .
.
. .
. .
.
. .
.
. . .
.
.
.
3.2 PHENOMENOLOGIE DE LA LEUCEMOGENESE • 3.2.0 Introduction . • . . • . . • 60 64 64 65 65 66 67 68 69 72 72 72 73 73 3.2.1 Mécanismes inducteurs viraux 733.3
3.2.2 Accélération ou induction virales de
la leucémie . . . 74 3.2.3 Description
miques . . .
des phases
préleucé-SOUS-POPULATIONS DE THYMOCYTES IMPLIQUEE DANS LA LEUCEMOGENESE • . . . .
. . . .
.
.
3.3.0 Cellules cibles • . . . • . • • . • • 3.3.1 Diversité phénotypique des tumeurs 3.3.2 Utilisation des lignées cellulairesprovenant de thymomes, comme outil
75
76 76
77
d'analyse • • . • . . • . . • • . • • 78 3.4 IMPLICATIONS DES CONTACTS LYMPHO-STROMAUX 79 3.4.0 Nécessité de la présence d'un thymus 79 3.4.1 Induction de la leucémie par
incuba tion in vi tro avec des
,
(
MATERIELS 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 3.4.2 Corrélation complexes entre la formation de lympho-stromaux et la leucémoqenèse . • . • • • . • . . 3. 4.2.0 Introduction • • . • • . . 3.4.2.1 Altérations thymus histoloqiques du xi 82 82 82 3.4.2.2 Les cellules nurses thymiques. 83 3.4.2.3 Les autres complexeslympho-épithéliaux . • . • . . . 84 3.4.2.4 L'induction de lymphomes
thymiques par stimulation des
récepteurs viraux . 86 3.5 RESUME ET CONCLUSION. . . 86 ET METHODES
·
·
·
•· · ·
SOURIS· · · · ·
·
· · ·
· · ·
SUSPENSIONS CELLULAIRES·
· · · · · ·
LIGNEES CELLULAIRES· ·
· · · · · ·
·
· ·
TRAITEMENT DES CELLULES·
· · · · ·
·
PREPARATION DES CULTURES PRIMAIRES DE THYMIQUE. · · ·
· ·
·
·
· ·
·
·
·
TEST D'ADHERENCE· · ·
· · ·
· · ·
6.1 Adhérence standard·
·
· ·
·
·
·
6.2 Incubation post-adhérence·
·
·
ENRICHISSEMENT CELLULAIRE· · ·
· ·
·
7.1 Enrichissement des prothymvcytes,· ·
•· ·
·
STROMA·
· ·
· · ·
·
· ·
L3T4- ,·
·
·
·
·
89 90 90 91 92 92 93 93 94 95 Ly-2-·
. . . .
.
.
. . . .
. .
95 7.2 Enrichissement de thymocytes adhérents auxcellules E-5 •
CARACTERISATION DU PHENOTYPE DES CELLULES E-5 • • 95 96 98 98 ETUDES CYTOFLUOROMETRIQUES • . • • • . •
9.1 Marquage des antigènes de surface • • . 9.2 Marquage des thymocytes adhérés: in medias
. .
. .
. . . . .
. .
·
.
.
9.3 Marquage du DNA
9.4 Analyse cytofluorométrique • . . INDUCTION DE DIFFEREllCIATION IN VITRO
• 100 · 100 · 101 • 103
11. 12. TRANSFORMATION LYMPHOBLASTIQUE PRODUCTION DE VIRUS • • • • • •
· . . . .
. . .
· .
. .
. . . .
• 103 • 104 13. INDUCTION OU ACCELERATION DE LA LEUCEMOGENESE . • 10513.1 Induction chez les souris C57BL/Ka . 13.2 Accélération chez les souris AKR
·
·
14. STATISTIQUES. . . . . · · ·
·
·
·
14.1 Test t de Student· · ·
·
·
·
14.2 Test de Mann et Whitney·
·
·
14.3 Test de Scheffe.
· · ·
·
· ·
· ·
·
·
·
·
·
·
·
·
·
·
·
·
·
• 105 • 105 • 106 • 106 · 106 • 106 TRAVAIL EXPERIMENTAL • . . • . • . . • . . . • . . 107 1. INTRODUCTION . • . . . • • . • • . . 1082. CARACTERISATION DU PHENOTYPE DES CELLULES E-5 ET
3.
4.
DES CULTURES PRIMAIRES DE STROMA THYMIQUE
· · · ·
109 ETUDE DYNAMIQUE DES COMPLEXES LYMPHO-E-5· · · ·
111 3.1 Etude cinétique de la formation descomplexes lympho-E-5
· · . · . · · ·
·
· ·
·
111 3.2 Effet de la concentration de thymocytes 113 3.3 Motif d'adhérence des thymocytes à lasurface des cellules E-5 . . . • . 115 3.4 Participation des protéines de surface et
de leurs groupements carbohydrates dans la
formation de complexes cellulaires . • . 115 3.4.1 Implication des protéines de surface 115
3.4.2 Implication des groupements
carbohydrates des protéines de
surface de thymocytes adhérents . . • 118 3.5 Cinétique de la dissociation des complexes
lympho-E-5 • • . • . . • . . • . . . • . . • 120 3.5.1 Incubation post-adhérence inversée • 120 3.5.2 Incubation l' endroi t" post-adhérence
.
. . .
. .
...
3.6 Induction du thymocytescaractère réfractaire des • former des complexes lympho-E-5, subséquent
A
un premier contact • INFLUENCE DES PARAMETRES PHYSIOLOGIQUES L 'ADHERBNCE • . • • • • . . . • • . . •SUR
120
122
it
..
c
-6U*'A " ~ll.~~",~,,",,",~~)tIffiII'_~t-~1~f""""" .. 'M''''~~-'' JJt " k W . , ! d . . .
=
xiii
4.1 Influences génétiques sur le potentiel
d'adhérence des thymocytes • • . . • . . 126 4.1.1 Nécessité d'une relation restreinte
par le complexe majeur
d'histocompa-tibilité . . • . . • . . . . . . 126 4.1.2 Influence des gènes situés à
l'extérieur du complexe majeur
d'histocompatibilité . . . 128 4.2 Variations dans le nombre de thymocytes
formant des complexes lympho-E-5 pendant
l'ontogenèse . . . • . . • . . 130 4.2.1 Apparition des thymocytes adhérents
pendant le développement
embryon-naire . . . . . • . . • . . • . . 130 4.2.2 Variation des thymocytes adhérents
pendant l'ontogenèse post-natale 132 5. IDENTIFICATION DES THYMOCYTES APTES A FORMER DES
COMPLEXES LYMPHO-E-5 . . . . • . . • . . 134 5.1 Caractérisation phénotypique des thymocytes
adhérents . . . . . • . . 134 5.1.1 Participation des préthymocytes dans
5.1.2
5.1.3
les interactions cellulaires avec les cellules E-5
Marquage thymocytes
=in=-__ -=m=e=d=i=a=s __ -=r~e~s des adhérents par fluorescence • . . • Analyse cytof1uorométrique immuno-d'une population adhérents . enrichie en thymocytes 5.1.3.1 Caractérisation de la population globale de 134 138 141 thymocytes adhérents . . . 141 5.1.3.1.1 Analyse phénotypique de la population globale de thymocytes adhérents 142
6.
5.2
5.1.3.1.2 Positionnement de la population globale de thymocytes adhérents dans le cycle cellulaire 5.1.3.2 Caractérisation des différents thymocytes Réponse proliférative adhérents suite à sous-types de adhérents . . . des thymocytes une activation polyclonale
IMPLICATION DES CONTACTS LYMPHO-E-S DANS LA DIFFERENCIATION DES THYMOCYTES
6.1 Induction in vitro de prolifération /
152
152
156
158
différenciation des thymocytes totaux . . . 158 6.2 Induction in vitro de différenciation des
thymocytes adhérents . . 162
6.2.1 Participation des complexes lympho-E-5 dans l'induction d'une réponse des thymocytes adhérents vis-à-vis
les activateurs polyclonaux
. . . . .
163 6.2.2 Localisation des thymocytesadhérents dans le cycle cellulaire
suite à une incubation in vitro . • . 165 6.2.3 Participation des complexes
lympho-E-5 dans l'induction de variations phénotypiques
adhérents . . . .
des thymocytes
169 7. EVALUATION D'UNE RELATION ENTRE L'HABILITE DES
THYMOCYTES A FORMER DES COMPLEXES LYMPHO-E-5 ET
LA LEUCEMOGENESE . . . • . . . • . . 174 7.1 Détermination du potentiel d'adhérence
des thymocytes pendant la
leucémo-génèse . . • . . • • . . . 174 7.1.1 Niveau d'adhérence des thymocytes
pendant la période préleucémique
C
(
7.1.2 Niveau d'adhérence des thymocytes, suite à l'injection d'un virus leucémogène accélérant
.
.
.
. . .
7.1. 3 Généralisation du conceptd'augmentation de la faculté des thymocytes à former des complexes lympho-E-5, pendant la leucémogénèse 7.2 Utilisation de lignées lymphoblastiques dans l'identification du stade de maturation des thymocytes adhérents
8. SYNOPSIS DES RESULTATS
.
. . . .
.
.
. .
.
. .
xv·
175 1aO • 182 · 190 DISCUSSION 1. PRECIS. .
. .
. .
.
. .
.
. . . .
.
.
. .
.
. . .
. .
.
. . .
.
.
193 194 195 195 2. 3.ASPECTS DYNAMIQUES DES COMPLEXES LYMPHO-E-S 2.1 Formation des complexes lympho-E-5 . •
2.2 Oissociation des complexes lympho-E-5 197 2.3 Induction d'un caractère réfractaire. 198 2.4 Scénario dynamique des complexes
lympho-E-5
IDENTIFICATION DU "PHENOTYPE" DES COMPLEXES LYMPHO-E-5 . . . .
3.1 Nature des cellules non-lymphoïdes. 3.2 Phénotype des thymocytes adhérents.
199
200 200 201 3.3 Caractère unique des complexes lympho-E-5 203 4. IMPLICATIONS DES COMPLEXES OP-EPITHELIUM
5.
MEDULLAIRE DANS LA DIFFERENCIATION DES
LYMPHOCYTES T . . . • . . . 205 4.1 Apparition des thymocytes adhérents pendant
l'embryogenèse. . • . . • . . • . . • . . 205 4.2 Situation des complexes OP-épithélium
médullaire pendant l'éducation des
thymocytes envers le soi 206
4.3 Induction de différenciation via les
complexes DP-épithélium médullaire 209 RELATION ENTRE LA LEUCEMOGENESE ET LES COMPLEXES
..
..
..
xvi
5.1 Corrélation entre les thymocytes adhérents
et la leucémogenèse
.
. . .
...
.
.
214 5.2 Participation des complexes OP-épithéliummédullaire dans la leucémogenèse • . • . . 216 5.3 Influence des particules
MuLV dans la propension transformés • adhé~er
virales de type des thymocytes
.
.
. . . . . .
5.4 Lignées transformées: un outil d'analyse!
CONCLUSION
.
.
. . .
. . . . . . .
.
.
.
. . . . . . . .
LISTE DES CO~n~ICATIONS ET PUBLICATIONSREVUE BIBLIOGRAPHIQUE • . . . •
. . . . . . .
.
.
.
. .
.
.
ORIGINALITE DU TRAVAIL PRESENTE217 218 221 224 226 275
,
1c
APC BlO.Br BlO.SM con A CPM CTL DN DNA DP D.S. EB FITC hi HBSS HEPES 3HTdR i 11.-2 IL-2R 10 Ipr 1.TR MCF·
·
·
·
·
·
·
·
:·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
xviiLISTE DES ABREVIATIONS
cellules de présentation antigénique ("antigen presenting cells").
B10. Br / SgSnj .
BlO.SM 70NS/Sn.
concanavaline A.
compte par minute.
lymphocyte T cytotoxique lymphocyte") .
double négative, L3T4-,Ly-2-. acide déoxyribonucléique acid") .
double positive, L3T4t , Ly-2t •
déviation standard.
( "cytotoxic T
("deoxyribonucleic
bromure d'éthidium ("ethidium bromide").
isothiocyanate de fluorescéine ("fluorescein isothiocyanate").
antigène de surface largement exprimé à la surface des cellules ("high expressor").
solution saline balancée ("Hank's balanced salt solution") .
acide N-2-hydroxyéthylpiperazine-N'-2-éthano-sulfonique.
thymidine tritiée.
antigène de surface exprimé de façon intermédiaire à la surface des cellules
("intermediate expressor"). interleukine-2.
récepteur pour 1'11.-2 ("11.-2 receptor").
antigène de surface faiblement exprimé à la surface des cellules ("low expressor").
C57BL/6 Ipr x lpr.
séquence répétitive terminale ("long terminal repeat") •
rétrovirus formant un effet cytopathique sur les cellules de vi&on ("mink cell focus-inducing").
1
MHC PBS PE PRA PI PNA P-TR RadLV RNA rpm SLE SP SVF TeR Th TMF Tslc d'histocompatibilité complex") . complexe majeur histocompatibility tampon phosphate saline") . phycoérythrine. phytohémagglutinine. salin ("phosphate phosphatidylinositol. ( "major bufferagglutinine d'arachide ("peanut agglutinine"). phagocyte thymique ("phagocytic thymie reticulum tt ) •
virus des radioleucoses (ttra~iation leukemia virus") .
acide ribonucléique ("ribonucleic acid"). rotation par minute.
lupus érythémateux systémique ("systemic lupus erythematosus").
simple positive, L3T4- ,Ly-2+/L3T4+ , Ly-2- • sérum de veau foetal.
récepteur antigénique T ("T cell receptor"). lymphocyte T amplificateur ("T helper").
fraction du microenvironnement thymique ("thymie microenvironmental fraction").
lymphocyte T suppresseur
1
cytotoxique.N.B.: Dans plusieurs cas, la nomenclature anglaise a été retenue car elle est reconnue de façon internationale et est d'usage courant.
~ _________ bl_"_._. J_.W~""''''' .~~~~ ______ ~ _,.;y~. 'Z!IIIa.1 L sa: Schéma 1. Schéma 2. Schéma 3. Schéma 4. Schéma 5. Schéma 6. Schéma 7. Schéma 8.
c
xixLISTE DES SCHEMAS
majeur d'histocompatibilité Le complexe
souris (H-2).
.
. .
. . .
.
. .
.
. .
.
. .
chez la 10
Structure génique de la chaine ~ du TeR . . . . 14
Modèle de reconnaissance duale. . 17
Le cycle cellulaire du lymphocyte T . • . . . . 26
Apparition des différentes sous-populations de thymocytes, pendant l'embryogenèse. . . . • . . 38
Mécanismes de sélection dans l'apprentissage du
soi et non-soi 61
Séquence des événements intrathymiques dans la différenciation des lymphocytes T . . 66
Scénario proposé de la dynamique des complexes
...
...
Tableau I. Tableau II. Tableau III. Tableau IV. Tableau V. Tableau VI. Tableau VII.LISTE DES TABLEAUX
Liste des détermination
anticorps utilisés dans du phénotype de cellules la en culture ou de coupes de immunofluorescence indirecte . tissus par 97
Liste des anticorps utilisés dans la détermination du phénotype des thymocytes par étude cytofluorométrique . . . 99
Caractérisation du phénotype des cellules E-5 et des cultures primaires de stroma thymique . 110
Effet d'un traitement des thymocytes à la tunicamycine ou à la trypsine sur leur niveau d'adhérence • . . . • . • . 119
Influence de la gravité et de la température sur la cinétique de dissociation des complexes lympho-E-5 . . . 123
Influence des gènes compris dans le complexe majeur d'histocompatibilité sur le potentiel d'adhérence des thymocytes . . . . . 127
Influence des gènes situés à l'extérieur du complexe majeur d'histocompatibilité sur le potentiel d'adhérence des thymocytes . . 129
Tableau VIII. Caractérisation in medias res du phénotype des
Tableau IX.
thymocytes adhérés à la surface des cellules E-5 . • • . . . 139
Evaluation du potentiel d'adhérence de cellules dérivant de différents types de leucémie . . 181
c
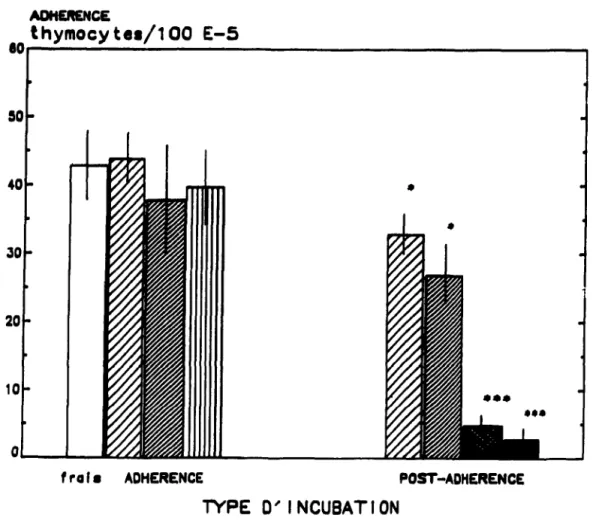
Figure 1. Figure 2. Figure 3. Figure 4. Figure 5. Figure 6. ) Figure 7. Figure 8. Figure 9. Figure 10. Figure 11. ~- ,... ... "'.--.... w-I, ... ""·_~_ ... j_ .i .... ~_Jl __ • _ _ _ ... "_.,_ ... -._114""._ _ _ _ xxi LISTE DES FIGURESReprésentations graphiques employées lors . 102 d'études cytofluorométriques Etude cinétique de la lympho-E-5 . formation de complexes . . . 112
Effet de la concentration des thymocytes sur le niveau d'adhérence . . . . . . . 114
Evaluation du motif d'adhérence des thymocytes à
la surface des cellules E-5 . . . • . . . . 116
Etude cinétique de la dissociation des complexes lympho-E-5 . . . • . . . . . . 121
Potentiel d'adhérence des thymocytes suite à la formation d'un premier complexe lympho-E-5 . 125
Apparition du potentiel d'adhérence des thymocytes pendant l'embryogenèse • . . . . 131
Potentiel d'adhérence des thymocytes au cours du vieillissement . • . . . • . . . . 133
Enrichissement des préthymocytes, L3T4-, Ly-2-et analyse de
graphie. .
la pureté par cytofluoro-. cytofluoro-. cytofluoro-. cytofluoro-. 136
Participation des préthymocytes, L3T4-, Ly-2-, dans la formation de complexes lympho-E-5 . 137
Marquage des thymocytes adhérents in medias res avec l'anti-Thy-1.2 . . . . 140
Figure 12. Figure 13. Figure 14. Figure 15. Figure 16. Figure 17. Figure 18. Figure 19. Figure 20. Figure 21. Figure 22.
Caractérisation phénotypique de la population globale de thymocytes adhérents . . . 143
Analyse du positionnement des thymocytes adhérents dans le cycle cellulaire . . • . . 153
Caractérisation phénotypique des différents sous-types de thymocytes adhérents . . . 154
Réponse proliférative des thymocytes adhérents suite à une induction polyclonale . 157
Réponse à la con A des thymocytes totaux incubés pendant 24 heures, dans différentes condi tions . . . . • . . 160
Réponse à la PHA des thymocytes totaux incubés pendant 24 heures, dans différentes conditions . . . • . . . 161
Réponse proliférative des thymocytes adhérents après une incubation in vitro de 48 heures . 164
Réponse proliférative des thymocytes totaux dprès une incubation in vitro de 48 heures . 166
Evaluation du positionnement des thymocytes adhérents dans le cycle cellulaire, après une incuba tion in vi tro . . . 167
Caractérisation phénotypique des thymocytes adhérents, après une incubation in vitro . . 170
Evaluation du potentiel d'adhérence pendant la période pré leucémique "spontanée" chez les souris AKR. . . 176
Figure 2;'. Figure 24. Figure 25.
c
Comparaison de leucémogénèse AKR . • • l'adhérence spontanée,.
. .
.
.
obtenue chez.
. .
.
xxiii pendant la les souris . • . • 177Evaluation de l'effet des virus leucémogènes accélérant sur le potentiel d'adhérence des thymocytes de souris ARR- • • • • • • • • • • 179
Caractérisation phénotypique des lignées lymphoblastiques Ti-6 et RDM4 • • • 184
,
(
2 INTRODUCTION
Le système immunitaire représente la pierre augulaire de l' homéostasie organique. Ce système qui forme en quelque sorte un réseau douanier, repose entre autre sur l'action des lymphocytes T démontrant la faculté de reconnaltre le "soi" du "non-soi" , leur conférant la capacité de rejeter, voire détruire, tous corps étrangers et même dans certains cas, des ""ellules du "soi" se comportant de façon anarchique. Notre compréhension du système immunitaire s • est accrue largement, depuis que de nombreux mécanismes sous-jacents à la reconnaissance dite antigénique, ont été dévoilés. Actuellement, ce sont les mécanismes de différenciation des lymphocytes qui font obstacle à une compréhension globale.
Depuis longtemps, l'on admet que la différenciation des lymphocytes T se déroule dans le thymus. Al' origine, l'on croyait que la participation de cet organe dans le processus ontogénique, s'effectuait par la seule sécrétion de su~stances
solubles. Maintenant, les contacts survenant entre les thymocytes (lymphocytes du thymus) et les cellules du stroma thymique sont de plus en plus désignés comme étant à la base de la différenciation des lymphocytes T. Il est reconnu que le thymus génère di vel'ses sous-popula tions de lymphocytes T. Il est donc concevable que cette hétérogénéité soit le reflet de l'existence de différents types de complexes lympho-stromaux. En d'autres termes, i l s'agit d'associer chacun des complexes lympho-stromal avec une étape distincte de la différenciation des lymphocytes T, voire une lignée distincte. Cependant, très peu d'informations sont disponibles concernant d'une part, tant
~es sous-populations lymphoïdes que stromales, impliquées dans de tels complexes lympho-stromaux et d'autre part, la fonction de ceux-ci.
Cet ouvrage porte justement sur l'identification d'un type particulier de ces complexes et sur l'évaluation de sa participation dans la différenciation des lymphocytes
T.
Dansla revue bibliographique, le premier chapitre sera consacr' aux différents aspects de la physiologie des lymphocytes T, tels que: les diverses sous-populations matures, leurs fonctions respectives, les mécanismes de reconnaissance antigénique et le mode d'activation des lymphocytes T, permettant l'élaboration d'une réponse immunitaire et ce, afin de bien cerner les enjeux de la diff'renciation des lymphocytes T.
Le deuxième chapitre portera sur le contexte dans lequel se déroule la différenciation des lymphocytes T, en détaillant la morphologie du thymus et ses composantes. Ensuite, les étapes de l'ontogénie des lymphocytes T seront traçées, tant chez l'embryon que chez l'adulte. Dans le but de circonscrire le plus précisément possible chacun des micro-environnements dans lequel prend place la différenciation, chacune des sous-populations majeures de thymocytes seront décrites et localisées. Dans un but similaire, les différents complexes lympho-stromaux seront identifiés et situés, et les arguments étoffant l'hypothèse de leur participation dans le processus global de la différenciation, seront aussi présentés.
L'utilisation de modèles pathologiques est une approche de choix, dans l'analyse d'un système physiologique. A cet égard, le développement d'une leucémie lymphoblastique T chronique représente sans contredit l'une des pathologies des plus sévères, altérant la différenciation des lymphocytes T dans le thymus; par le fait qu'elle perturbe totalement l'équilibre thymique au profit d'une voie distincte de "différenciation". Conséquemment, la description des étapes de la leucémogenèse et des éléments en cause, sera faite dans le troisième chapitre. Cela permettra de réaliser un objectif doublei cel~i
d'effectuer un parallèle avec la participati~n des complexes lympho-stromaux tant dans la différenciation des lymphocytes que dans leucémogenèse, et d'obtenir des informations quant au rôle de ces complexes dans cette pathogenèse.
,
(
Finalement, nous présenterons des indications expérimentales permettant de caractériser un type défini de complexe lympho-stromal. A cet effet, nous décrirons les règles dynamiques régissant la formation de ces complexes et mettons en évidence les thymocytes qui y sont associés. Nous étudierons aussi la participation de ces complexes dans l'ontogénie des lymphocytes T et dans la leucémogenèse.
...
..ï'
!
6
CHAPITi~B 1
C.
LB LYMPHOCYTE Tc
1.0 INTRODUCTION
Ce travail porte sur la participation des complexes lympho-stromaux dans la différenciation intrathymique des lymphocytes
T.
Dans cette perspective, ce chapitre vise particuli'rement A décrire certains aspects de la physiologie du lymphocyte T, afin de circonscrire les assises du contexte in toto des événements intrathymiques. A cet effet, nous présentons les différentes sous-populations de lymphocytes T, leurs fonctions respectives, ainsi que le mécanisme de reconnaissance antigénique qui confère au lymphocyte T, toute sa finalité d'action. Nous serons, ainsi, à même d'identifier les desseins de la différenciation intrathymique.1.1 HISTORIQUE
La notion d'immunité et de protection a posteriori d'une
i~fection n'est pas nouvelle. En fait, elle se perd dans la nuit des temps. Thucydides, un historien grecque, mentionnait 450 ans avant J.C. que la peste bubonique semblait épargner les individus qui avaient déjà été frappés par cette affection. Toutefois, cette notion d'immunité faisait encore l'objet de débats enflammés à la fin du dix-neuvième siècle. En effet, en 1896, Lister évoquait la possibilité que la réaction inflammatoire soit anormale et préjudiciable à l'hate (rapporté par Silverstein, 1984). A cette époque, persistait une autre polémique célèbre concernant l'attribution de cette fonction immunitaire. En fait, l'on admettait que certaines substances présentes dans les humeurs étaient responsables de l'immunité (Koch, 1878; Ehrlich, 1891), tandis que Metchnikoff suggérait en 1893 que des cellules accomplissaient cette tache. Les lymphocytes, cellules pressenties pour effectuer un tel rale, avaient été décrits par Virchow en 1859. Il est intéressant de mentionner que ces cellules avaient été identifiées initialement par Hewson en 1777, soit avant l'avènement de la théorie cellulaire par Schwann, en 1839.
•
..
Plus pris de nou., le concept de cellule. iJllDlunitaires pris réellement racine vers la fin des ann'e. quarante, alors qu 'émergea la notion de cellules tueuses ("ki1ler ce1l") 6tay'e ensuite par les travaux de Govearts (1960). Toutefois, la provenance de ces cellules tueuses demeurait floue. Certains indices permettaient de pointer le thymus, puisque cet organe était identifi6 comme jouant un rale dans la réponse immunitaire (Hi11er, 1961) et qu'il était reconnu comme un site de production de lymphocytes (Prenant, 1894; Schooley et Kelley, 1961). Cependant, il subsistait une ombre au tableau: les lymphocytes résidant dans le thymus (thymocytes) étaient considérés comme n'ayant aucune" relation avec les "grands lymphocytes sanguins" (Bimes, 1962). Par surcro!t, l'origine de ces thymocytes était toute aussi floue. A cette époque l'on croyait, à tort, que la division des cellules épithéliales thymiques menait à l'apparition des thymocytes, comme en fait foi les travaux de Ackerman et Knouff (1964). En 1963, l'on a réussi à caractériser les cellules produites dans le thymus (ultérieurement nommées lymphocytes T, par Roitt et collaborateurs, 1969) par la présence d'un marqueur "spécifique" à leur surface: lee,
aujourd'hui appelé Thy-1 (Reif et Allan, 1963). Par la suite, l'implication de ces lymphocytes dans la réponse immunitaire a été formellement démontrée par Miller (1965) et subséquemment, par Hetcalf (1966) • Depuis, la participation de ces lymphocytes T a été révélée dans plusieurs réactions immunitaires dont: le rejet d'allogreffes et la cytotoxicité à médiation cellulaire (Brunner et collaborateurs, 1966, 1968); la réaction du greffon contre l'hate (Elkins, 1971); la lyse de cellules tumorales, ou infectées par un virus (Gorczynski et Norbury, 1974; Zinkernagel et Doherty, 1975) ; la défense contre certains microorganismes (North, 1973) et la réponse d'hypersensibilité de tys:-e retard6 (Bianchi et collaborateurs, 1981).1.2 FONCTIONS ET SOUS-POPULATIONS MATURES DE LYMPHOCYTES T
·n
1. 2.0 Introductionc
-8
de l~phocytes T matures afin de connattre le produit de la différenciation intrathymique. Néanmoins, la description de ces sous-populations de lymphocytes T ne faisant pas l'objet principal de cette thèse, nous nous restreindrons aux sous-populations majeures. Ainsi, nous omettons volontairement certaines sous-populations de lymphocytes T, tels que les LAK ("lymphokine activated killer"), les Tdh (liT delayed hypersen-sitivity") et les TIL ("tumor infiltrating lymphocyte"). Spécifions qu'à moins qu'il n'en soit fait mention dans le texte, la nomenclature utilisée pour identifier les antigènes de surface fera référence aux travaux réalisés chez la souris.
1.2.1 Relation marqueur-fonction
P1usieurs fonctions sont attribuables aux lymphocytes T. Cependant, i l est admis qu'un lymphocyte T ne peut, à lui seul, effectuer toutes ces fonctions. L'on convient donc de l'existence de différentes sous-populations.
années soixante, l'on avait identifié
Dès la fin des diverses sous-populations au sein des lymphocytes T périphériques et ce, à l'aide de marqueurs de surface appelés Ly-A, Ly-B et Ly-C (Boyse et c01laborateurs, 1968: Boyse et collaborateurs, 1971). En ce qui a trait aux fonctions T, elles sont maintenant regroupées sous deux chapi teaux précis en l'occurrence, l'amplification et la suppression / cytotoxicité (Cantor, 1984; Adkins et collaborateurs, 1987; von Boehmer, 1988). Les deux sous-populations de lymphocytes T matures qui effectuent ces fonctions sont appelées respectivement, Th (liT helper") et Tslc (T suppresseur 1 cvtotoxique). Elles se caractérisent par l'expression mutuellement exclusive de marqueurs de surface, notamment le L3T41 et les Ly-2,3. Ainsi, les lymphocytes Th démontrent le phénotype L3T4+, Ly-2,3-, tandis que les Tslc sont L3T4-, Ly-2,3+ (respectivement CD4+CD8- et CD4-CD8+, chez l'humain) (Swain et collaborateurs, 1984). Pour les besoins de
1 Formellement désigné Ly-4 suite • un congr's tenu au National Health Institute (RIR) (Morse III et collaborateurs, 1987). Toutefois, la dénomination d'usage sera conservée, soit L3T4.
cet ouvrage, nous considérons que la dernière population eDt homogène car elle ne peut être subdivisée par aucun marqueur, l l'exception de l'expression de la molécule I-J (Habu et Okumura, 1984: Murphy, 1987).
1.3 LA RECONNAISSANCE ANTIGENIQUE 1.3.0 Introduction
L'eff~cacité des lymphocytes T (tout comme celle des
lymphocytes B) réside sur leur faculté Je reconnattre un antigène et d'élaborer une réponse dit~ "spécifique". Cela représente donc une deuxième caractéristique intrisèque à la physiologie du lymphocyte T (la première étant leur fonction), elle aussi façonnée pendant la différenciation intrathymique.
1.3.1 Le complexe majeur d'histocompatibilité chez la souris
C'est à Hirshorn et Bach (1963), de collaborateurs (1964) que revient le crédit
même qu'à Bain et d'avoir démontré qu'une population lymphocytaire pouvait s'activer au contact de cellules sanguines provenant d'un autre individu, mais pas l celles d'un jumeau homozygotique. Le tout suggérait fortement la présence d'une identité génétique, propre à chacun des individus. Maintenant, ce phénomène est bien connu et le système qénique (MHC) responsable de cette carte d'identité, a été caractérisé chez plusieurs espèces, dont le rat (système RTl), la souris (système H-2) et l'humain (système HLA) (revu par GOnther et Stark, 1979: Steinmetz et Hood, 1983: Kindt et Robinson, 1984; Sachs, 1984). De façon à bien saisir la spécificité conférée par les molécules du MHC dans le mécanisme de reconnaissance antigénique, il est approprié de décrire brièvement en quoi consiste le MHC.
. La portion génique codant pour les molécules du MHC se retrcuve sur le chromosome 17 et consiste en quatre régions distinctes: K, I, S et D. La région l se subdivise en huit
c
AtS 'fil_A 1 " '
10 loci: A~3, A~2, A~l, Aœ, B~l, B~2, Bœ et B~3 (sch6ma 1) .2
Chacun de ces loci démontre une caractérisation haplotypique a été de souris congéniques (Klein,
expression allèlique et la faite chez plusieurs souches 1982) . Ces allèles sont constituées à leur tour de déterminants publics (partagés par tous) et privés (représentés seulement par un allèle en particulier). L'assemblage linéaire de ces déterminants publics et privés, procure aux molécules du MHC un très grand polymorphisme. Retenons que les régions K et D codent pour les molécules de la classe l, tandis que la région l (à ne pas confondre avec la classe I ! ) code pour les molécules de la classe II. Cette distinction. comme nous le verrons plus loin, est très importante car ces classes de molécules jouent des rôles distincts dans la reconnaissance antigénique (voir la section 1.3.2.0).
Pour les molécules de la classe l, le produit de ces gènes s'exprime sur la majorité des cellules nucléées, tandis que celui de la classe II ne se retrouve qu'à la surface de certaines cellules, dont les lymphocytes B, les macrophages, les cellules dendritiques (Sachs, 1984), les cellules du stroma thymique (voir la section 2.1.2) et d'une façon plus épisodique, sur les lymphocytes T activés (Scharrow et collaborateurs, 1981).
Les molécules du MHC démontrent aussi, à l'intérieur d'une mime classe, une similarité structurelle. Ainsi, les molécules de la classe l sont toutes constituées d'une chaine lourde
z Schéma 1. Le complexe majeur d'histocompatibilité chez la souris (H-2)
classe l classe I I classe I I I classe
K l S D
•
A~3 A~2 A~1 Aa E~1 E~2 Ea E~3La région TL comprenant les loci Qa-l, Oa-2, Qa-3 et Tla n'est pas représentée.
l
glycosylée (=45Kd) associée à une chaine légère invariable (non glycosylée et qui n'est pas codée par le MHC): la
~2-microglobuline (~zm). Les molécules de la classe II quant à elles, sont formées de deux chaines glycosylées: une lourde a
(=35Kd) et une légère ~ (=25Kd) (Kindt et Robinson, 1984).
1.3.2 Reconnaissance spécifique restreinte par le MHC 1.3.2.0 Concept de la restriction par le MHC
L'idée voulant que les lymphocytes T devaient, d'une façon ou d'une autre, être en mesure de faire la distinction du "soi" et du "non-soi" via la reconnaissance des molécules du MHC, a été lancée au début des années soixante-dix (Jerne, 1971). Des travaux pionniers ont ensuite permis l'identification du mécanisme d'action sous-jacent, à la reconnaissance dirigée. En fait, il a été démontré que les lymphocytes T requéraient la présence d'un appariement au niveau de l'expression des antigènes codés par le MHC, afin de pouvoir lyser une cellule-cible (Zinkernagel et Doherty, 1975, 1979). La démonstration d'un tel phénomène de collaboration syngénique donna lieu au concept de réaction restreinte par le MHC ("MHe-restriction"). Ce phénomène a été confirmé plus tard par l'emploi d'une technologie de pointe: la transfection génique. L'équipe de Hood (Orn et collaborateurs, 1982) a ainsi démontré que des fibroblastes d'une souche A, infectés par un virus X, pouvaient être lysés par un clone cytotoxique (CTL: "cytotoxic T lymphocyte") de souche B et spécifique au virus X, si et seulement si les fibroblastes avaient été transfectés avec le gène codant pour les molécules de la classe I de cette dernière (B). Il s'avère que les deux sous-populations de lymphocytes T (Th et Ts/c) agissent dans un contexte de restriction par le MHC. Mais, i l existe une différence notable entre ces deux sous-populations.
antigènes associés
En effet, alors que les Th reconnaissent les aux molécules de la classe II du MHC, les Tslc ~econnaissent les antigènes associés aux molécules de la classe l du MHC (Swain, 1983: Sprent et collaborateurs, 1986: Sprent et Webb, 1987). Le processus par lequel s'effectue cette reconnaissance dichotomique n'a été dévoilé que
(
(
1;a r6celUlent. Ainsi, il a été démontré qu'il fallait absolument proc6der l la co-transfection des gènes du TeR (liT ce11 receptor": voir la section suivante) et du Ly-2, afin de conf'rer une nouvelle spécificité (restreinte par la classe l du MHC) au sein d'un clone Th L3T4 + , Ly- 2- (ini tialemen t restreint par la classe II du HHC) (Gabert et collaborateurs, 1987). Il faut souligner au passage que la fonction de ce clone n'a pas été modifiée par la transfection du gène et que la reconnaissance des molécules de la classe l a entra!né une sécrétion d'interleukine-2 (IL-2). D'autre part, l'affinité de l'antigène Ly-2 pour les molécules de la classe l a été démontrée en employant un modèle de membranes artificielles (Goldstein et Hescher, 1987). Par surcrott, une expérience semblable de transfection a permis de montrer que la molécule CD4 se lie de façon spécifique aux molécules de la classe II (Doyle et Strominger, 1987). Le tout démontre que 1 'uniqu~
présence des antigènes de surface L3T4 et Ly-2 ne confère pas, à elle seule, la fonction du lymphocyte T tel que démontré par l'existence de clones cytotoxiques L3T4+, Ly-2- (Pierres et collaborateurs, 1984). Ces molécules participent plutôt à la spécificité d'action des sous-populations. Plusieurs approches ont aussi permis de montrer cet état. de fait, tout en démontrant que les molécules accessoires (ainsi désignées car elles participent à la reconnaissance antigénique, sans en être les responsables) jouent un raIe dans l'activation des lymphocytes T (voir la section 1.4.0.1)
R.écemment, le dogme de la réaction restreinte par le MHC a été ébranlé par Werdelin (1987). D' après ce dernier, la restriction par le MHC ne représenterait pas une nature intrinsèque aux lymphocytes T: elle serait acquise lors de l' acti vation antigénique initiale. L'on peut donc considérer qu'une telle restriction par le MHC existe et que le mode d'induction s'opère, soit à l'activation, soit lors de la différenciation des lymphocytes T. Nous privilégierons cette dernière éventualité.
1.3.2.1 Le récepteur antiaéniaue T 1.3.2.1.0 Préliminaire
Comme nous venons de l'évoquer, le rôle ultime du système immuni taire se résume en peu de mots: discriminer le "soi" du "non-soi"! De plus, la reconnaissance antigénique s'effectue dans un contexte restreint par le MHC. Toutefois, un élément crucial manque à ce plan d'ensemble: l'identification d'une structure membranaire conférant une quelconque spécificité aux lymphocytes T, vis-à-vis un antigène particulier.
Il Y a fort longtemps qu'une telle structure a été admise et identifiée pour les lymphocytes
B,
l'immunoglobuline de surface (Ehrlich, 1900; Snell et Gell, 1965). Toutefois, pour les lymphocytes T, la présence d'un tel récepteur était fortement p~essentie à leur surface, mais son existence n'avait pas encore été démontrée au début des années quatre-vingt. D'autant plus, que l'on croyait que ce récepteur pouvait vraisemblablement être codé par les gènes d'immunoglobulines. Cette hypothèse était cependant réfutée par certains chercheurs(Mill~r et collaborateurs, 1983; Marrack et Kappler, 1983).
Finalement, les structures prot~ique et génique du dit
récepteur antigénique T (TeR) ont été caractérisées.
1.3.2.1.1 Structure protéique
La structure protéique du
TeR
est maintenant bien définie (revue par Marrack et Kappler, 1986a, 1987; Allison et Lanier, 1987). Ce récepteur est constitué de deux chaines protéiques glycosylées, alpha (a,:::::40Kd) et bêta (13,:::::45Kd) (hétérodimère), reliées entre elles par un lien disulfure (S-S). Il existe aussi deux autres chaines appelées gamma (Y,21Kd) et delta(~,28Kd) qui se retrouvent à la surface des lymphocytes T, mais
jamais simultanément avec les chaines a et 13 (Brenner et
collaborateurs, 1986). Aucun rôle défini n'a encore été
assigné à l'hétérodimère Y6, porté par la sous-population mineure de lymphocytes T périphériques L3T4- Ly-2- (Lanier et collaborateurs, 1986b). A l'opposé, celui de l'hétérodimère aj3 est assez bien défini (voir la section 1.3.2.2) •
(
)(
! ~, . . . _ ..._---_._-._-_._---_
...
,---14
1.3.2.1.2 Structur. génique . t div.rsit'
La .tructur. prot6ique du TCR .'e.t .vérée Itre total.m.nt
diff6r.nte de celle des immunoglobulines, il n'en demeure pa •
• oin. qu'un. r •••• mbl.nc. manife.te .xi.t. entre ces deux type.
de molécule.: l.ur .tructure génique.
Bn effet, il •• t bien
reconnu que 1.. immunoglobuline. démontrent
une très grande
diversité
qui
leur
e.t
attribué.. par
le. différ.nte.
po.sibilit6. d. réarrangements génique. (Tonegawa, 1983).
Or,
la caractéri.ation des gènes codant pour l' hétérodimère
a.1S,a
permis de démontrer que la di ver.i
tl.du TCR étai t aussi générée
par
un m6cani.m. de
réarrangement génique,
impliquant la
délétion de certaines portions de gènes (Fujimoto et Yamagishi,
1987) •
Al' inst.r des gènes d'immunoglobulines,
1.structure
génique native "ger.line" de la cha1ne
IS(schéma
2) 3est
con.tituée de
22régions variables, 14 régions de jonction, 2
régions de diversité et
2régions constantes (Steinmetz et
ne.bic,
1986;
Marr.ck
et
Kappler,
1986b;
Chou
et
collaborateurs, 1987).
Lors
du réarrangement qui s'effectue
dans le thymus (voir la section 2.3.2), la recombinase utilise
un segment de chacune de ces régions afin de former la chatne
ISremodelée.
Mentionnons qu'une structure génique semblable
existe pour la chatne
a.,contenant au moins
50régions
V, 50régions J
et une
région
c.
Mais contrairement
Ala chat ne
IS,il n'y a p.s de région D (revue par Marrack et Kappler. 1987;
Wilson et collaborateurs, 1988c).
Cette utilisation sélective
des divers segments géniques
se répercute nécessairement par
l'existence de chatnes distinctes
àla surface des lymphocytes
T. Il faut spécifier qu'un
lymphocyte T donné, n'exprimera
qu'un seul
type de chalnes
a.et
IS
àsa surface, puisque le
réarrangement génique
exclut irréversiblement les portions
inutilisées (Kronenberg
et collaborateurs, 1986). Il est donc
3
Schéma
2.Structure génique de la cha1ne
ISdu TCR.
V. l---V.
22
na
1
J.11--J.17
Caln.2
J. 21--JD 27
C.2
-II-possible d. développer d.s anticorps dirigés spécifiquement contre un seul type de r6arrangement.
font les anticorps KJ-16.133, F23.1,
C'est exactement ce que F23.2 et KJ23a qui ne reconnaissent que les chalnes ~, utilisant respectivement les portions Vp8.l,8.2, Vp8, Vo8.2 et Vo17a (Haskins et collaborateurs, 1984; Behlke et collaborateurs, 1987; Kappler et collaborateurs, 1987b). C'est donc dire que la détection antigénique effectuée avec l'un de ces anticorps, ne déterminera pas le pourcentage de cellules exprimant la chaine
ts
du TeR, mais bel et bien celles ayant réarrangé leur gène ~,en employant un segment génique défini.
Bn somme, toutes les possibilités réarrangements conjoints des chaines Œ et une diversité qui se situe au-delà de 107
offertes par les
~, concèdent au TCR (Marrack et Kappler, 1987). Contrairement aux immunoglobUlines, aucune diversité supplémentaire n'est accordée par l' appari tion de mutations somatiques ponctuelles (Chien et collaborateurs, 1984).
1.3.2.1.3 Structures associées (T3)
A la surface des lymphocytes T matures, les chaines Πet ~
du TeR sont toujours intimement associées à un complexe protéique invariable, le T34 (CD3 chez l'humain). En effet,
les chaines a et ~ du TCR ne peuvent s'exprimer qu'en présence du complexe T3 (Saito et Germain, 1987b). Celui-ci est formé de quatre chaines distinctes: deux glycosylées, gamma (-r,=25Kd), delta (6,=20Kd) et deux non glycosylées, epsilon (e,
=25Kd, reconnu par l'anticorps 145-2C11) et zita (Z=16Kd) (Allison et Lanier, 1985; Pessano et collaborateurs, 1985; Leo et collaborateurs, 1987; Weissman et collaborateurs, 1988). Nous pouvons donc considérer que l'association du T3 avec le TCR forme un complexe mul timèrique.
4 Formellement désigné Ly-[T3] suite à un congrès tenu au
National Health Institute (NIR) (Morse et collaborateurs, 1987), mais la dénomination d'usage, T3, sera conservée.
c
c
16 1.3.2.2 Mécanisme de reconnaissance dual antiqine/MBC 1.3.2.2.0 Unité fonctionnelle du complexe TCR
Le TCR représente la structure de reconnaissance antigénique. Cela a été démontré en créant sur pièce, une spécificité antigénique par la transfection concomitante de gènes œ et ~ choisis (Dembic et collaborateurs, 1986: Saito et collaborateurs, 1987). De plus, il a été établi que la spécificité du TCR repose sur un mécanisme de reconnaissance duale impliquant d'une part, la structure antigénique et d'autre part, une molécule du MHC (Yague et collaborateurs, 1985). Il appert que la cha!ne ~ permet à elle seule de concéder la spécificité envers le MHC (Saito et Germain, 1987a). Par exemple, la portion Vo17a reconna!t la molécule I-Ek du MHC (Kappler et collaborateurs, 1987b). Toutes ces expériences ont
cha1nes œ et ~.
permis d'exhiber une certaine indépendance des Globalement, mentionnons qu'il existe un certain consensus quant à l'attribution des fonctions respectives des cha1nes œ et~. Ainsi, dans un contexte stérique de reconnaissance, la cha!ne ~ identifie les molécules du MHC, tandis que la cha!ne œ ou ~ stipule la spécificité antigénique (Wilson et collaborateurs, 1988ci Saito et Germain, 1987bi Engel et Hedrick, 1988). Cependant, la présence conjointe des cha1nes œ et ~ est absolument requise dans le processus de reconnaissance (Saito et collaborateurs, 1987). La participation des deux sous-unités du TCR est donc complémentaire et interdépendante.
Les protéines constituant le complexe T3 sont toutes invariables (section 1.3.2.1.3), donc ne participent vraisemblablement pas à la reconnaissance antigénique, à proprement dit. Malgré tout, la fonction du TCR est tributaire de la présence de ce complexe. En effet, n'oublions pas que la reconnaissance antigénique n'a de finalité que la signalisation d'un évenement interactif externe. Or, cette transduction s'opère justement par le T3 (voir la section 1.4.0.0).
1.3.2.2.1 Mod.l. de reconnaissance duale
Encore aujourd'hui, le mécanisme de reconnaissance constitue un sujet de vives controverses. Toutefois, le débat
~ été tranché en faveur de l'existence d'un récepteur unique. Une polémique réside cependant q\ant au modèle de reconnaissance: liaison duale (MHC + antigène) versus la liaison intégrale (MRC/antigène; formant un nouveau déterminant antigénique). Nous avons mentionné dans la section précédente que les chaines œ et
P
démontraient des spécificité~ propres(œ- =antigène/
P-
=MRC). Cet état de fait devrait accréditer le modèle de liaison duale (schéma 3).5 Récemment, une étude est eff~ctivement venue confirmer cette hypothèse, en co-transfectant deux gènes (a etP)
provenant de clones T, démontrant des spécificités distinctes. Les cellules co-transfectées ont alors affiché une spécificité antigénique hybride (Saito et Germain, 1987a). La structure associative des molécules du MHC avec l'antigène a aussi été explorée. Effectivement, la cristallographie aux rayons-X a permis de démontrer la configuration tridimensionnelle du complexe formé5 Schéma 3. Modèle de reconnaissance duale.