ÉTUDES
DES RÔLES PRO-INFLAMMATOIRES ET
PROLIFÉRA TIFS
DES PROTÉINES SlOOA8 ET SlOOA9
Thèse présentée
à la Faculté des études supérieures de l'Université Laval
dans le cadre du programme de doctorat en microbiologie-immunologie pour l' obtention du grade de Philosophiae Doctor (Ph.D.)
DÉPARTEMENT DE BIOLOGIE MÉDICALE F ACUL TÉ DE MÉDECINE
UNIVERSITÉ LA V AL QUÉBEC
2008
Résumé
La migration des neutrophiles est une étape importante de la réponse de l 'hôte à un pathogène qui requiert l'intervention de différents facteurs chimiotactiques telles les chimiokines. Depuis quelques années, diverses études portant sur la régulation du processus migratoires des leucocytes ont révélé que les protéines anti-microbiennes agissent également en facteurs chimiotactiques. Les protéines SI 00A8 et SI 00A9 sont des protéines anti-microbiennes qui inhibent la liaison des bactéries aux épithéliums et la croissance des pathogènes. Leur présence dans les serums de patients atteints de maladies inflammatoires telles l'arthrite rhumatoïde et la mucoviscidose a suscité l'intérêt de diverses équipes de recherche. L'étude de leurs fonctions pro-inflammatoires par différents modèles murins d'inflammation suggère fortement qu'elles participent au recrutement des neutrophiles au si te inflammatoire. Cependant, peu d'études ont porté sur l'importance des protéines S100A8 et SI 00A9 dans le cadre d'une infection. Afin de mieux cerner les rôles des protéines SI 00A8 et SI 00A9, leur importance dans l'infection à S. pneumoniae a été évaluée. L'étude des fonctions des protéines SI 00A8 et SI 00A9 dans les infections à S. pneumoniae a permis de démontrer que les protéines SI 00A8 et SI 00A9 sont également importantes pour le recrutement des neutrophiles et des monocytes en réponse à une infection pulmonaire puisque le pré-traitement des souris infectées avec S. pneumoniae par des anticorps anti-S 1 00A8 et anti-S 1 00A9 neutralisants diminue de 70% et 800/0 la migration des neutrophiles et des monocytes dans les alvéoles.
La présence des protéines SI 00A8 et SI 00A9 a également éte observée dans des maladies non-inflammatoires comme les leucémies myéloïdes chroniques. Pour caractériser plus précisement leurs fonctions, le rôle potentiel des protéines SI 00A8 et SI 00A9 dans l 'hématopoïèse normale et pathologique a été étudié. Les protéines SI 00A8 et SI 00A9 induisent la prolifération des cellules leucémiques mais également des cellules mononuclées normales de la luoelle osseuse. De plus, en combinaison avec d'autres cytokines, elles dirigent également l 'hématopoïèse vers la myélopoïese ce qui suggère que ces protéines sont des facteurs de croissance hématopoïétique.
Ces résultats contribuent à une meilleure cOlnpréhension des rôles joués par les protéines S 100A8 et S 100A9 dans le recrutelnent des neutrophiles et dans le procesus inflamnlatoire
et soulignent également une nouvelle fonction des protéines SI 00 dans l 'hématopoïèse. De plus, ils concourent à élucider l'importance des protéines anti-microbiennes dans la réponse innée.
Abstract
Neutrophil recruitment is an important step ln innate immunity. This process requIres chemotactic factors such as chemokines which direct the neutrophil to the inflammatory site. Studies of the regulation of this process also revealed anti-microbial proteins as chemotactic factor. The anti-microbial proteins SI 00A8 and SI 00A9 are present at high concentration in sera from patients suffering from inflammatory disorders such as rheumatoid arthritis and cystic fibrosis. Studies on these SI 00 proteins using murine models of inflammation strongly suggest their importance in the recruitment of neutrophil. However, few studies have investigated their involvement in neutrophil recruitment during infection. To further characterize the functions of SI 00A8 and SI OOA9, their roles in a murine model of pneumoccocal pneumonia were evaluated. In this model, SI 00A8 and S100A9 played an important role in neutrophil and monocyte migration as passive immunisation against these proteins led to 700/0 and 80% decreases of neutrophil and monocyte recruitment respectively. In order to further investigate the functions of SI 00A8 and SI 00A9, we also evaluated the effects of these proteins in pathological and normal hematopoiesis as they are also present in sera of patient suffering from acute and chronic myeloid leukemia. SI 00A8 and SI 00A9 induced the proliferation of leukemia cells as weIl as normal bone marrow lTIononuclear cells. Moreover, in combination with other cytokines, S100A8 and SI 00A9 promotedmyelopoiesis suggesting a role for these proteins as growth factors in the hematopoietic process.
These results contribute to a better understanding of the functions of SI 00A8 and SI 00A9 during the inflammatory processes and highlight new functions for these proteins in hematopoiesis. These results also help to elucidate the participation of anti-microbial proteins in innate immune response.
Avant-propos
Je remercie mon directeur de thèse, Dr Philippe Tessier, de m'avoir accueilli dans son laboratoire de recherche et encadré avec un optimisme à toute épreuve. J'ai beaucoup apprécié la liberté d'action et de décision dont j'ai été gratifiée. Il a su m'aider à clarifier certaines idées, à en abandonner d'autres et m'apprendre à argumenter solidement les débats que nous avions. J'ai grandement apprécié de travailler sur des techniques multiples et variées. Je le remercie également de m'avoir permis d'assister à des congrès d'envergure internationale. Je lui suis reconnaissante de m'avoir prodigué ses conseils ainsi que son soutien dans les différentes démarches professionnelles que j'ai effectuées.
Je remercie également les personnes de l'équipe du Dr Tessier passées et présentes mes collègues, Karen Vandal, Pascal Rouleau, Nadia Anceriz, Nathalie Pagé, Alma Posvandzic qui m'ont aidé au cours de mes années doctorales. La participation de Nadia Anceriz au projet sur la pneumonie fut grandement appréciée. Merci également aux équipes de recherche avec lesquelles j'ai travaillé pour leur disponibilité et leur patience.
Le service technique de l'animalerie et Julie-Christine Levesque m'ont été d'une grande aide de part leur savoir faire dans les différents protocoles mis en place au cours de ma thèse. Je leur en suis reconnaissante.
Je remercie également les étudiants et amis du Centre de recherche en infectiologie. Ce fut un plaisir de vous cotoyer dans et hors du laboratoire. Pour n'oublier personne, je remercie tous ceux qui ont participé de près ou de loin au bon déroulement de mes études doctorales.
De plus, je tiens également à remercier les Docteurs Paul H. Naccache, Denis Girard et Sylvain G. Bourgoin d'avoir accepté de participer au jury de cette thèse.
C'est à mes parents ainsi que mes amis d'outre-atlantique qui même à des milliers de kilolnètres m'ont toujours soutenu dans mes démarches et dans Ines projets que j'adresse toute 1110n affection et ma reconnaissance. Mes plus grands remercielnents sont adressés à mon conjoint David, qui a su me soutenir, ll1'encourager dans les moments difficiles et aussi faire preuve d'une grande patience. Je lui dédie cette thèse et tout Inon amour.
Contribution dans les articles
La thèse sera présentée sous forme de thèse par article. Ma contribution ainsi que celle des co-auteurs sera indiquée pour chaque article.
Article 1 (chapitre 1):
Marie-Astrid Raquil, Nadia Anceriz, Pascal Rouleau, Philippe A. Tessier. Blockade of antimicrobial proteins Si OOA8 and Si OOA9 inhibits phagocyte migration to the alveoli in streptococcal pneumonia. Accepté dans Journal of Immunology
J'ai organisé et réalisé les différentes expériences de ce projet. Nadia Anceriz, Pascal Rouleau et le Dr Philippe Tessier m'ont aidé à prélever et préparer les différents homogénats et les fluides biologiques. J'ai effectué les analyses et écrit l'article. Le Dr Philippe Tessier a corrigé l'article et fait les changements nécessaires.
Article 2 (chapitre II):
Marie-Astrid Raquil, Pascal Rouleau, Karen Vandal, Frédéric Barabé, Caroline Gilbert, Philippe A Tessier. Si OOA8 and Si OOA9 stimulate the proliferation of myeloid leukemia cells and direct helnatopoiesis through the myeloid lineage. Manuscrit en préparation.
Karen Vandal et Pascal Rouleau ont débuté ce projet en 2002 en réalisant les cultures en milieux semi-solides et les doses-réponses sur les patients atteints de leucémie. J'ai par la suite pris en charge le projet et effectué les expériences sur les différents échantillons de patients, les lignées leucémiques ainsi que les expériences ex vivo et analysé les résultats obtenus. J'ai reçu également des conseils avisés du Dr Frédéric Barabé ainsi que du Dr Caroline Gilbert qui m'ont permis de mener à bien ce projet. J'ai rédigé l'article et le Dr Philppe Tessier y a apporté les corrections nécessaires.
Chapitre de livre (Annexe 1) dans le livre "Phenotypic and functional changes of neutrophils activated by recently identified modulators":
Nadia Anceriz, Marie-Astrid Raquil, and Philippe A Tessier. The proinflamlnatory filnctions o.f SI OOA8, S100A9, and S1 OOA 12
Le travail bibliographique nécessaire à cet article de revue a été partagé entre Nadia Anceriz et moi. Nadia Anceriz s'est occupée de la présentation générale du document sous la supervision du Dr Philippe Tessier. Le Dr Philippe Tessier a ensuite effectué les modifications nécessaires.
Table des matières
Résumé ... ii
Abstract ... iv
Avant-propos ... v
Contribution dans les articles ... vi
Table des matières ... viii
Liste des tableaux ... 12
Liste des figures ... 13
Liste des abréviations ... 15
Introduction ... 19
1 Le neutrophile et sa migration au site inflammatoire ... 21
1.1 La description du neutrophile ... 21
1.1.1 Les stratégies anti -microbiennes du neutrophile ... 23
1.1.1.1 La phagocytose ... 23
1.1.1.2 Les mécanismes microbicides dépendant de l'oxygène ... 24
1.1.1.3 Les mécanismes microbicides indépendant de l'oxygène ... 25
1.1.1.3.1 Les protéines anti -microbiennes ... 25
1.1.1.3.2 Les protéases neutres ... 26
1.1.1.3.3 Les "neutrophil extracellular traps" ou NETs ... 26
1.1.2 Les pathologies associées aux neutrophiles ... 27
1.2 La migration du neutrophile au site inflammatoire ... 28
1.2.1 La migration trans-endothéliale du neutrophile ... 29
1.2.1.1 Les molécules d'adhésion ... 29
1.2.1.2 Les facteurs chimiotactiques ... 31
1.2.1.2.1 Les facteurs chimiotactiques classiques ... 32
1.2.1.2.2 Les chimiokines ... 32
1.2.1.2.3 La formation du gradient chimiotactique ... 34
1.2.1.3 Les anti-microbiens chimiotactiques ... 35
2 Les protéines anti -lnicrobiennes et chimiotactiques SI 00A8 et SI 00A9 ... 37
2.1 La famille des protéines S 1 00 ... 37
2.1.1 Le locus des protéines S 1 00 ... 37
2.1.2 La structure des protéines S100 ... 37
2.1.3 L'expression et les fonctions des protéines S100 ... 39
2.2 Les "myeloid-related proteins" S 100A8 et S100A9 ... 41
2.2.1 L'expression des protéines S100A8 et S100A9 ... 41
2.2.1.1 Au cours du développement embryonnaire ... 41
2.2.1.2 Au cours de la myélopoïèse ... 42
2.2.1.3 L'expression des protéines SI OOA8 et SI 00A9 dans les autres types cellulaires ... 43
2.2.2 Structure et particularités des protéines SI 00A8 et SI 00A9 ... 44
2.2.3 Homologies des protéines SI 00A8 et SI 00A9 humaines et rnurines ... 47
2.3 Les fonctions intracellulaires des protéines SI 00A8 et SI 00A9 ... 47
2.3.1 La différenciation ... 47
2.3.3 L'activation de la NADPH oxydase ... 49
2.3.4 La réorganisation du cytosquelette ... 50
2.4 La présence des protéines SI 00A8 et SI 00A9 dans les pathologies ... 51
2.5 La translocation des protéines SI 00A8 et SI 00A9 du cytosol vers la membrane53 2.6 La sécrétion des protéines SI 00A8 et SI 00A9 ... 53
2.7 Les récepteurs et ligands des protéines SI 00A8 et SI 00A9 ... 54
2.8 Les fonctions extracellulaires des protéines SI 00A8 et SI 00A9 ... 55
2.8.1 Les fonctions anti-microbiennes des protéines SI 00A8 et SI 00A9 ... 55
2.8.2 Les fonctions pro-inflammatoires des protéines SI 00A8 et SI 00A9 ... 56
2.8.2.1 La présence des protéines au site inflammatoire ... 56
2.8.2.2 La stimulation de l'endothélium et des cellules immunitaires ... 57
2.8.2.3 Les activités chimiotactiques des protéines SI 00A8 et SI 00A9 ... 58
2.8.2.4 L'amplification de l'inflammation par les protéines SI 00A8 et SI 00A9 59 2.8.2.5 Récapitulatif des activités des protéines SI 00A8 et SI 00A9 dans l'inflammation ... 60
2.8.3 Les autres fonctions des protéines SI 00A8 et SI 00A9 ... 62
2.8.3.1 Les activités pro-apoptotiques et mitogéniques des protéines SI 00A8 et S100A9 62 2.8.3.2 Les activités inhibitrices de métalloprotéases ... 63
2.8.3.3 Les activités métastasiques des protéines S100A8 et S100A9 ... 64
2.9 PROBLÉMATIQUE GÉNÉRALE ... 65
CHAPITRE 1 ... 67
Rôles des protéines SlOOA8 et SlOOA9 dans le recrutement des neutrophiles en réponse à S. pneumoniae ... 67
1 Streptococcus pneumoniae ...... 68
1.1 Descriscription de S. pneumoniae ............ 68
1.2 La colonisation et l'invasion de S. pneumoniae .......... 69
2 La réponse de l 'hôte à S. pneumoniae ... 70
2.1 La reconnaissance de S. pneumoniae ............ 70
2.1.1 Les TLRs ... 70
2.1.2 Le complément ... 71
2.2 L'épithélium alvéolaire et les cellules myéloïdes ... 72
2.2.1 L'épithélium alvéolaire ... 72
2.2.2 Les macrophages alvéolaires ... 72
2.2.3 Le neutrophile ... 73
2.2.3.1 La margination ou séquestration des neutrophiles ... 73
2.2.3.2 L'adhésion ferme des neutrophiles ... 74
2.2.3.3 La migration trans-épithéliale du neutrophile ... 74
3 Les étapes de la réponse à S. pneumoniae ... 75
4 Problématiqlle ... 76
5 Le blocage des activités des protéines S 1 00A8 et SI 00A9 inhibe la migration des phagocytes dans les alvéoles dans la pneumonie à pneumocoques ... 77
5.1 Résumé ... 77
5.2 Abstract ... 79
5.3 Introduction ... 103 5.4 Materials and Inethods ... 103 5.4.1 S. pnelllnoniae infection ... 103
5.4.2 Analyses of leukocytes recruitment and quantification of SI 00A8 and
S 100A9 ... 103
5.4.3 Immunohistochemistry, immunofluorescence and electron microscopy ... 103
5.4.4 Evaluation of neutrophils sequestration in the lung tissue using flow cytometry ... 103
5.4.5 CXCL2, CXCL1, and CCL2 ELISA assays ... 103
5.4.6 Statistical analysis ... 103
5.5 Results ... 103
5.5.1 Secretion of SI 00A8 and SI 00A8/ A9 precedes leukocyte recruitment during S. pne~tmoniae infection ... 103
5.5.2 Blockade of S 100A8 and SI 00A9 activities significantly inhibits neutrophil and macrophage recrui tment in the airspace ... 103
5.6 Discussion ... 103
5.7 References ... 104
CHAPITRE II ... 11 0 Études des rôles des protéines S100A8 et S100A9 dans l'hématopoïèse et les leucémies myéloïdes ... 110
1 L'hématopoïèse ... 111
1.1 La régulation de 1 'hématopoïèse par les facteurs hématopoïétiques ... 113
1.1.1 L'influence des facteurs hématopoïétiques sur la prolifération des HSC et des HPC ... 113
1.1.2 L'influence des facteurs hématopoïétiques sur la différenciation des HSC et des HPC ... 114
1.1.3 L'influence des facteurs hématopoïétiques sur l'apoptose des HSC et HPC ... 116
2 Les leucémies myéloïdes ... 116
2.1 La leucémie Inyéloïde aigüe (LMA) ... 116
2.1.1 Description ... 116
2.1.2 Les cellules de la leucémie myéloïdes aigües ... 119
2.1.3 La prolifération des cellules leucémiques LMA ... 119
2.1.4 L'apoptose des cellules leucémiques LMA ... 120
2.2 La leucélnie myéloïde chronique (LMC) ... 120
2.2.1 Description ... 120
2.2.2 Le chromosome Ph et la protéine BCR-ABL ... 121
2.2.2.1 La protéine BCR-ABL dans les cellules leucémiques LMC ... 121
2.2.2.2 L'insensibilité aux facteurs négatifs ... 121
2.2.2.3 L'hypersensibilité aux facteurs positifs ... 122
2.2.2.4 L'inhibition de l'apoptose ... 122
3 Problématique ... 123
4 Les protéines SI OOA8 et SI 00A9 stimulent la prolifération des cellules leucémiques et dirigent 1 'hématopoïèse vers la Inyélopoïèse ... 124
4.1 Résumé ... 124
4.2 Abstract ... 126
4.3 Introduction ... 142
4.4 Materials and Methods ... 142
4.4.1 Patients ... 142
4.4.3 Purification ofmurine mononuclear cells from normal bone marrow
(BMMC) ... 142
4.4.4 Production of recombinant human and murine SI 00A8 and SI 00A9 proteins ... 142
4.4.5 SI 00 ELISA ... 142
4.4.6 3-(4, 5-dimethylthiazol-2-yl)-2, 5-diphenyltetrazolium bromide (MTT) cell proliferation assays ... 142
4.4.7 CFU assays ... 142
4.4.8 Statistical analysis ... 142
4.5 Results ... 142
4.5.1 SI 00A8/ A9 is present at high concentration in serum of AML and CML patients. . ... 142
4.5.2 S100A8, S100A9, and S100A8/A9 induce the proliferation ofPBMCs from AML and CML patients ... 142
4.5.3 S100A8/A9 concentrations in AML and CML serum are directly correlated with the proliferation of K562 cells ... 142
4.5.4 S100A9 and S100A8/A induce the proliferation or maintenance ofmouse haematopoietic cells from normal bone marrow cells ... 142
4.5.5 SI 00A9 and SI 00A8/A9 but not S 100A8 stimulate the CFU-GM formation from normal bone marrow cells ... 142
4.6 Discussion ... 142
4.7 Références ... 143
5 Discussion ... 151
5.1 Les protéines S 1 00A8 et SI 00A9 dans la migration des neutrophiles aux poumons ... 151
5.2 Les protéines S100A8 et S100A9 dans l'hématopoïèse normale et pathologique . ... ... ... .. 157
Conclusion ... 165
Bibliographie ... 166
Liste des tableaux
Tableau 1: Le contenu des granules du neutrophile ... 22
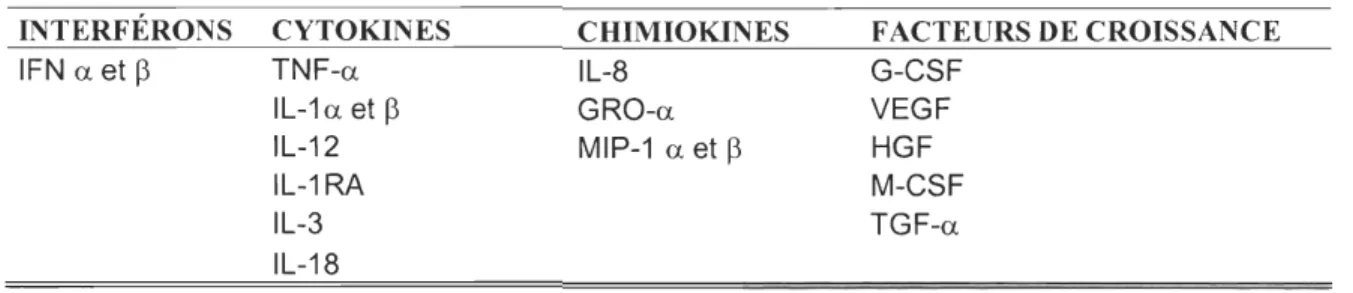
Tableau 2: Exemples de cytokines exprimées par le neutrophile ... 23
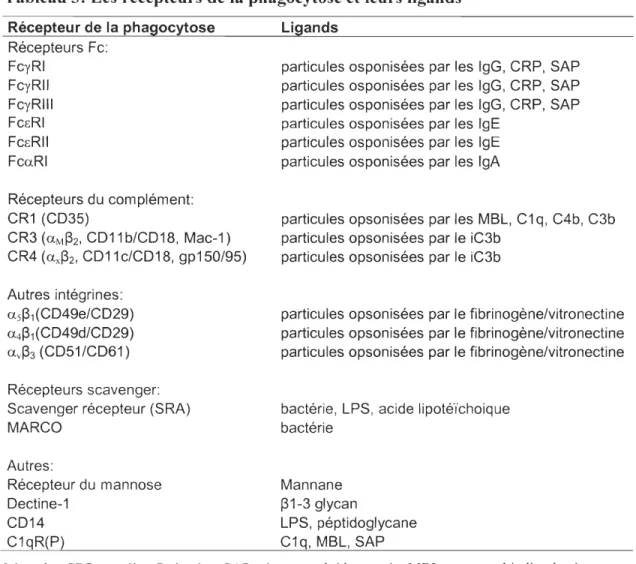
Tableau 3: Les récepteurs de la phagocytose et leurs ligands ... 24
Tableau 4: Les protéines anti-microbiennes du neutrophile ... 26
Tableau 5: Les chimiokines C-C, leur récepteurs et leurs cibles ... 33
Tableau 6: Les chimiokines C-X-C, C-X3-C et C, leurs récepteurs et leurs cibles ... 34
Tableau 7: Les anti-microbiens chimiotactiques et leurs cibles ... 36
Tableau 8: Les fonctions intracellulaires et extracellulaires des protéines SI 00 ... 40 Tableau 9: Les autres nomenclatures des protéines SI 00A8 et SI 00A9 ... 41
Tableau 10: L'induction des protéines SI 00A8 et SI 00A9 par différents stimuli ... 44
Tableau Il: La présence des protéines SI 00A8 et SI 00A9 dans les pathologies ... 52 Tableau 1-1: Les facteurs de virulence de S. pneumoniae ...... 69
Tableau 1-2: Les étapes de la réponse de l'hôte ... 75
Tableau 11-1: Les cytokines et les facteurs de croissance hématopoïétiques ... 114 Tableau 11-2: Les cytokines importantes dans l'hématopoièse et leur redondance ... 115 Tableau 11-3: La classification FAB des leucémies myéloides aïgues ... 118
Liste des figures
Figure 1: Les récepteurs de l'immunité et leurs ligands ... 20 Figure 2 : Schéma de la migration transendothéliale des neutrophiles ... 29 Figure 3 : La structure globale des protéines SI 00 ... 3 8 Figure 4 : Les motifs et les homologies de séquences des protéines SI OOA8 et SI OOA9
humaines et murines ... 46 Figure 5 : Récapitulatif des rôles anti-microbiens et pro-inflammatoires des protéines
S100A8 et S100A9 ... 61 Figure 1-1: Leukocyte recruitment and secretion of SI OOA8, SI 00A9 and SI OOA8/ A9 in
the lung and BAL following S. pneumoniae infection ... 87 Figure 1-2: Localization of S 1 00A8 and S 1 00A9 at 6h and 48h post-infection in S.
pneumoniae infected lung ... 88 Figure 1-3: : Localization of S 1 00A8 and S 1 OOA9 in lung epithelial cells at 6h
post-infection by immunofluorescence ... 89 Figure 1-4 : Effects of SI 00A8 and S 1 00A9 blockade on S. pneumoniae clearance at 24h
and 48h post-infection ... 91 Figure 1-5 : Effects of anti-S 1 00A8 and anti-S 1 00A9 on survival rates ... 92 Figure 1-6: Effects of S 1 00A8 and S 1 OOA9 blockade on the recruitment of leukocyte in
the BAL ... 93
Figure 1-7 : Effects of anti-S 1 00A8 and anti-S 100A9 on neutrophil recruitment into the lung 48h post-infection ... 94 Figure 1-8: Effects of S 100A8 and S 1 00A9 on neutrophil sequestration in the lung
vasculature ... 96 Figure 1-9: Electron mocroscopy analyses of the effects of anti-S 100A8 and anti-S 1 OOA9
on neutrophil recruitment into the lung 48h post-infection ... 97 Figure 1-10: Effects of S 1 00A8 and S 1 OOA9 on levels of CCL-2, CXCL-2 and CXCL-2 in
BAL and lung 48h post-infection ... 99 Figure 2-1 : Le processus hématopoïétique ... 112
Figure 2-2: High concentrations of SI OOA8/ A9 are found in the serum of acute and chronic myeloid leukemia patients ... 142
Figure 2-3 : SI OOA8, SI OOA9 and S 100A8/A9 stimulate the prolifération ofPBMC from AML and CML patients ... 142 Figure 2-4 : SI OOA8, SI OOA9 and SI OOA8/ A9 induce the proliferation of AML and CML
PBMC in semi-solid medium in absence or presence of cytokines ... 142 Figure 2-5 : SI OOA8/ A9 concentration in AML and CML sera is directly correlated with
the proliferation of K562 leukemia cells ... 142 Figure 2-6 : Polyclonal antibodies against SI OOA8 and SI OOA9 inhibit the proliferation of
AML PBMC induced by autologous serum ... 142 Figure 2-7: Murine SI OOA9 and SI OOA8/ A9 induce the proliferation of mononuclear cells from normal C57BL/IO bone marrow ... 142 Figure 2-8 : SI OOA9 and S100A8/A9 induce the proliferation of CFU-GM ... 142 Figure 3-1 : Schéma récapitulatif des rôles des protéines SI OOA8 et SI OOA9 dans
Liste des abréviations
ANS l-anilino-8-naphtalenesulfonate (1-anilinonaphthalene-8-sulfonic acid)
CEACAM-3 Molécule d'adhésion cellulaire associée aux antigènes carcinoembryonnaire (carcinoembryonic antigen-related cell adhésion molécule 3)
CRP DTPA Epo b-FGF Fn FN G-CSF GM-CSF
Protéine C réactive (C reactive protein)
Acide diéthylène triamine pentaacétique
Érythropoïétine (erythropoietin)
Facteur de croissance basique des fibroblastes (Basic fibroblast growth factor)
Fibrinogène
Fibronectine
Facteur de croissance des granulocytes (granulocyte colony stimulating factor)
Facteur de croissance des granulocytes et des macrophages (granulocyte-monocyte colony stimulating factor
HIV Virus d'immunodéficience humain (human immunodeficiency virus)
HGF Facteur de croissance hépatocytaire (hepatocyte growth factor)
HNP Défensines du neutrophile humain (human neutrophil peptide)
HPC Pro géniteur hématopoïétique
HSC Cellule souche hématopoïétique
ICAM-l IFN lOF IRF-3 JAM LIF LPS MAPK MBL M-CSF MIP-l MMP NETs NFKB NOAL PDOF
Molécule d'adhésion inter-cellulaire (intercellular adhesion molecule)
Interféron
Facteur de croissance simili aire à l'insuline (insulin like growth factor)
Facteur 3 de régulation de l'interféron (interferon regulatory factor 3)
Molécules d'adhésion des jonctions (junctional adhesion molecule)
Facteur inhibiteur des leucémies (leukemia inhibitor factor)
Lipopol ysaccharide
Leukotriène B4
Protéine kinase activée par des agents mitogènes (mitogen-activated protein Kinase)
Lectine liant le mannose (mannan binding lectin)
Facteur de croissance des macrophages (macrophage colony stimulating factor)
Protéine inflammatoire des macrophages (macrophage inflammatory
protein- 1)
Métalloprotéase
Piège extracellulaire des neutrophiles (neutrophil extracellular trap)
Facteur nucléaire Kappa B (nuclear factor Kappa B)
Lipocaline associée à la gélatinase neutrophilique (neutrophil gelatinase
associated lipocalin)
PECAM PGRP PI3K PMA PSGL RAGE SAP SDF-l SLPI Sp-A TGF TLR TNF-a TPEN TPO
Molécule d'adhésion des plaquettes et des cellules endothéliales (platelet endothelial cell adhesion-l)
Prostaglandine E2
Protéine de reconnaissance du peptidoglycane (peptidoglycan recognition protein)
Phosphoinositide-3 kinase
Phospholipase A2 cytosolique
Phorbol 12-myristate 13-acetate
Ligand 1 de la glycoprotéine P-sélectine (P-selectin glycoprotein Ligand 1)
Récepteur de produits terminaux hautement glycosylés (receptor of advanced glycation end products)
Protéine amyloïde du sérum (serum amyloide protein)
Facteur dérivé des cellules stromales (stromal derived factor-l)
Inhibiteur de leucoprotéase sécrétoires (secretory leucoprotease protein inhibitor)
Protéine A du surfactant (surfactant protein A)
Facteur de croissance de transformation (transforming growth factor)
Tolllike récepteur
Facteur nécrosant de tumeurs (tumor necrosis factor -a)
N,N,N',N'-Tetrakis(2-pyridyhnethyl) éthylènediamine
VEGF Facteur de crOIssance des endothéliums vasculaires (vascular endothelial growth factor)
Introduction
L'immunité innée se caractérise par la présence de barrières défavorables à l'implantation et la croissance bactérienne telles les mucus et la peau mais aussi par la reconnaissance et une première réponse rapide de l'organisme face à une invasion de pathogènes. Il s'agit d'une réponse non spécifique induite par la reconnaissance d'un Inicro-organisme par des récepteurs prédéterminés dans les cellules germinales. Ces récepteurs ne sont pas spécifiques d'un pathogène, mais plutôt de motifs communs des pathogènes appelés PAMP ou motifs moléculaires associés aux pathogènes et non présents dans l'organisme comme le LPS, la flagelline, l'ADN non méthylé ou les résidus de mannose sur les protéines glycosylées bactériennes. Ces récepteurs sont les récepteurs Toll-like récepteurs (TLR), les récepteurs du mannose, et le récepteur des peptides formylés (FPR). L'activation de ces récepteurs entraîne une réponse rapide de l'organisme par la mise en place du processus inflammatoire (réaction de 1 'hôte) en vue de la destruction du microorganisme (Figure 1). La présence dans les tissus de produits intracellulaires de 1 'hôte dits endogènes peut également être à l'origine de la réponse inflammatoire puisqu'ils représentent une situation de danger pour l'organisme pouvant provenir de la lyse cellulaire à la suite d'une infection par un pathogène ou un signal d'alarme [1-5] (Figure 1).
L'inflammation se caractérise par quatre critères: rougeur, œdème, chaleur et douleur qui sont causés par une vasodilatation et une augmentation de la perméabilité capillaire. Ces phénomènes permettent le recrutement des phagocytes des capillaires vers le site inflammatoire. Le premier leukocyte recruté au site de l'infection/inflammation pour combattre l'invasion d'un pathogène est le neutrophile. Il a pour rôle de limiter ou d'endiguer l'infection et permettrait le recrutement et l'activation d'autres cellules de l'immunité.
NFKB
-Noyau EXOGÈNE GLYCOPHOTEINE [ Bactérie HIV Levure Phase précoce ENDOGÈNE Cellules nécrotiques HSP 60 & HSP70 EXOGÈNE Peptidoglyc.ane LPS*'
_
NFKB_
IRF~3r
RÉPONSE INFLAMMATOIRE NFKB Phase tardive Phase précoce EXOGÈNE Profilin··like proteine Hagelline NFKB.
...
--0défemine·2 Sp-A Hyaluronan Fn,FN HSP 60 & H5P-70 EXOGÈNE LPS Acide lipotéichoïque Taxe! (plante) EXOGÈNE Peptide formylé FPR Membrane plasmique EXOGÈNE ADN double brin
EXOGÈNE Complexe IgG-CpG
Chromatine
I\RN sirnp!0 brin ADN non rr.ethylé
Figure 1: Les récepteurs de l'immunité et leurs ligands.
La liaison de ligands endogènes ou exogènes aux récépteurs de l'immunité innée tels les toll like récépteurs (TLR) , les récépteurs du mannose (MR) et les récépteurs de peptides formylés (FPR) induit la réponse inflammatoire en permettant l'activation, le chimiotactisme et la phagocytose des cellules immunitaires, mais également en stimulant la production de cytokines pro-inflammatoires par l'activation des facteurs nucléaires NFKB et IRF-3. Abréviations: HSP, heat shock protein; Fn, fibrinogène; FN,fibronectine; LPS, lipopolysaccharide: HIV, human immunodeficiency virus; Sp-A, surfactant protein A.
1 Le neutrophile et sa migration au site inflammatoire
1.1 La description du neutrophile
Le neutrophile est produit dans la moelle osseuse à partir de cellules souches et précurseurs hématopoïétiques qui, sous l'effet hiérarchisé de facteurs de croissance tels l'IL-3, le GM-CSF et le G-GM-CSF, se différencient pour former les neutrophiles matures [9]. Il représente le plus abondant des leucocytes présents dans le sang et a un durée de demi-vie de 4 à 10h sous un état inactivé. A son état mature, le neutrophile possède quatre types de granules (azurophiles, spécifiques, gélatinases et sécrétoires) importantes dans sa migration et ses fonctions anti-microbiennes au site inflammatoire. Ces granules possèdent des caractéristiques communes mais diffèrent par leur contenu protéique (Tableau 1). En effet,
les granules azurophiles contiennent des hydrolases acides, de la myélopéroxydase et des antimicrobiens telles les défensines qui contribuent à la destruction des pathogènes dans le phagosome et à moindre échelle dans le milieu extracellulaire puisqu'une exocytose limitée de ces granules a pu être observée apres stimulation des neutrophiles. Les granules spécifiques, riches en protéines antibiotiques telles la lactoferrine et la hCAP-18,
participeraient également aux activités anti-microbiennes du neutrophile. Contrairement aux granules azurophiles et spécifiques, les granules gélatinases sont des réservoirs d'enzymes capable de dégrader la matrice extracellulaire et de récépteurs membranaires requis pour l'extravasation du neutrophile. Les granules sécrétoires sont également riches en récépteurs membranaires tels l'intégrine
f3
2
et les récépteurs des peptides fonnylés nécessaires aux phases précoces de la migration du neutrophile (Tableau 1) [10].En plus de posséder des granules cytoplasmiques et sécrétoires participant à ses fonctions anti-microbiennes et à sa migration, le neutrophile dispose également d'une machinerie enzymatique qui génère des radicaux libres à partir de l'oxygène qui sont délétères aussi bien pour les bactéries que pour les tissus de l'organisme.
-Tableau 1: le contenu des granules du neutrophile Membrane euro CD a V-type. H·~ATPase Matrb: Acfd ~«glycefCphO$phata$e Acid mucopolysaccnaride (l ~-Antilry.p$in (t.~Mannuslda$e
A1.ür-oddl:t'jJCAP31f
Ù1crea$~ng prolefn f)·G!yœrophoophatasë ~·Ghjcuron!dase Calhepsins: O~iensjO$ ElastaSQ SiaJidase UbiqulUnkpfOteln M:émbnut& CO·b Cens a igens CDS CDS? Cytoc., rome b!\sa F· LP-R Ffbron c in~A G-pro tain $ubtmi'l lamio',R 13· .. 1 arrtigen 9 'ct protein 1 5· d proe!n Rap1$ Ra.p2 SCA'~p Throm . o$pondin-R T .f-A UrQ inas6,~type
plasminQgen act!vator~R: VAMP*2 VitrQnQctin· Ft ~ta.trt)( ~~·Mlcrog!ob\,J!in CoUaganasG GeJatinase hCAP»'1B rHslamina.sê Hep.art.\na;s$' laClofenin Lysnzyme NGAL Umklna$e~type .... ,pt;asrrrinogen acllvator omildase SGP:28
Vitamin 817:,h~nding protein
<'t'rh~5 i~~~!~'iatî{)n ls bàSédÙ~l-ur~~tl~~~I~pregU!aHOn in
but has nn~ valboon den'1{>nstnMed by $ubcoUul.:H ~ocaliz.ation
Références: [10, Il]
Gelatinase : ranuJes Membrane
CD11b Cytochrome
Diacy gl oerol..oeacyjatin enzyme
FMLP-R SC ' P
Ure ln se-type p~asmlnôgén
ao iva.tôJMA VA .pw2
, • ypè Hi> -ATPase
Matrix
Acetyltrans1orase·
~~M~cfOglobuHn Ge1atinas'0 Lysozyme
SooratofY v~siot $ .... embrane AI aine phosphatase CR1 Cytochr'am b55a CD11b CD14 CDleb F LP-R SCA P Uro 'nase-.pe
ptsmino > n actr atof4R V~t)tpa H·~ J? s . VAM?~2 CD10, C013~ C04.58 C. q-receptor-DAF" Matfix
Plasma proteios (includtrlg
atbur rt) and. te-tranec in}
to &limultHion withlnfJammatory mediatms ..
lmrnunocylochemistry.
Les fonctions du neutrophile furent longtemps restreintes à la défense anti-microbienne mais, un nombre croissant d'études ont souligné que le neutrophile représente non seulement une cible mais également une source de différentes cytokines, de chimiokines et de facteurs de croissance qui pourraient agir de manière autocrine et/ou paracrine au cours du phénomène inflammatoire [10, Il]. Il produit des médiateurs de l'inflammation tels
l'IL-l, l'IL-8, le MIP-1, le G-CSF et le TNF-a, qui pem1ettent l'auglnentation de
Tableau 2: Exemples de cytokines exprimées par le neutrophile INTERFÉRONS CYTOKINES IFN a et ~ TNF-a IL-1 a et ~ IL-12 IL-1 RA IL-3 IL-18 CHIMIOKINES IL-8 GRO-a MIP-1 a et ~ FACTEURS DE CROISSANCE G-CSF VEGF HGF M-CSF TGF-a
Légende: IFN, interféron; TNF, tumor necrosis factor' G-CSF: granulocyte colony stimulating factor; VEGF vascular endothelial growth factor; HGF, hepatocyte growth factor; M-CSF, macrophage colony stimulating
factor TGF, transforming growth factor.
Références: [12, 13]
1.1.1 Les stratégies anti-microbiennes du neutrophile
Le neutrophile possède un arsenal de mécanismes anti -microbiens afin de contenir et détruire les micro-organismes. Il utilise différents mécanismes telles la phagocytose, la formation de NETs et la libération de radicaux libres et de molécules anti-microbiennes.
1.1.1.1 La phagocytose
La phagocytose se caractérise par la reconnaissance, l'internalisation et la destruction des
Inicrobes par les phagocytes professionnels tels le macrophage et le neutrophile. Il y a plus
d'un siècle, Metchnickoff a été le premier à décrire ce mécanisme. Le phagocyte emmagasine les micro-organislnes dans un compaliiment intracellulaire appelé phagosome. Le phagosome fusionne ensuite avec les granules neutrophiliques et les lysosomes pour former un nouveau compartiment, un phagolysosome dans lequel les micro-organismes sont soumis aux agents anti-microbiens et aux radicaux libres.
Il existe de nOlnbreux récepteurs de la phagocytose (Tableau 3) qui sont différemment exprimés par les leucocytes. Le neutrophile exprime à sa surface de nombreux récepteurs
tels les récepteurs F cy RIlA et CR3 (intégrine CD Il blCD 18) qui participent à la reconnaissance et à l'internalisation des nlicro-organismes. Les micro-organismes enrobés par les ilnmunoglobulines G (IgG) ou par les protéines du conlplément iC3b/C3b se lient à
leurs récepteurs respectifs FcyRIIA et CR3 pour initier les mécanismes d'internalisation et
de d truction des Inicrobe . Bien que les voies de ignalisation intracell ulaires liées à la 23
liaison des microbes opsonisés aux récepteurs des FcyR et CR3 soient différentes, il existe
une coopérativité entre ces deux voies [14]. De plus, chez le neutrophile, l'activation de la
phagocytose amorce les mécanismes microbicides telle la NADPH oxydase ainsi que la
production de médiateurs lipidiques et de cytokines de l'inflammation [15-20].
Tableau 3: Les récepteurs de la phagocytose et leurs ligands Récepteur de la phagocytose Récepteurs Fc: FcyRI FcyR11 FcyR111 FCcRI FCcRl1 FcaRI
Récepteurs du com plément: CR1 (CD35)
CR3 (aM~2, CD11 b/CD18, Mac-1) CR4 (ax~2, CD11 c/CD18, gp150/95) Autres intégrines:
a5~1(CD4ge/CD29) a4~1(CD49d/CD29) av~3 (CD51 /CD61 ) Récepteurs scavenger: Scavenger récepteur (SRA) MARCO Autres: Récepteur du mannose Dectine-1 CD14 C1 qR(P) Ligands
particules osponisées par les IgG, CRP, SAP particules osponisées par les IgG, CRP, SAP particules osponisées par les IgG, CRP, SAP particules osponisées par les IgE
particules osponisées par les IgE particules osponisées par les IgA
particules opsonisées par les MBL, C1 q, C4b, C3b particules opsonisées par le iC3b
particules opsonisées par le iC3b
particules opsonisées par le fibrinogène/vitronectine particules opsonisées par le fibrinogène/vitronectine particules opsonisées par le fibrinogène/vitronectine bactérie, LPS, acide lipotéïchoique
bactérie Mannane ~1-3 glycan
LPS, péptidoglycane C1q, MBL, SAP
Légende: CRP, protéine C réactive; SAP, sérum amyloide protein; MBL : mannan binding lectin. Référence: [21]
1.1.1.2 Les mécanismes microbicides dépendant de l'oxygène
En plus d'ingérer des bactéries par la phagocytose, le neutrophile activé libère des radicaux libres déstabilisant la Inelnbrane bactérienne aussi bien dans les phagolysosolnes que dans le milieu extracellulaire. Ces molécules sont générées par 3 processus: la NADPH
La NADPH oxydase est présente en grande partie dans les phagosomes et à une moindre mesure sur la membrane plasmique. L'activation de la phagocytose entraîne l'activation de la NADPH oxydase [17] qui génère alors des anions superoxyde 02-. La myélopéroxidase et une forme inductible de la NO synthétase (iNOS) utilisent l'anion superoxyde pour produire de l'acide hypochloride HOCL et du peroxynitrite ONOO- ainsi que des produits intermédiaires [22]. Ces radicaux libres sont des agents anti-bactériens très puissants et des déstabilisateurs de molécules tels les lipides, les protéines et les acides nucléiques. De plus, les ions OCL, générés par réaction de l'anion superoxyde et des ions chlorures, joueraient un rôle dans la régulation de la migration des leucocytes au site inflammatoire par l' inactivation des chimiokines.
1.1.1.3 Les mécanismes microbicides indépendant de l'oxygène
1.1.1.3.1 Les protéines anti-microbiennes
De nombreuses molécules anti-microbiennes sont contenues dans le cytoplasme et les granules des neutrophiles et mises en réserve sous forme active ou inactive (Tableau 4). Par exemple, la Bacterial/permeability increasing protein (BPI) et les défensines (HNP), au nombre de 4 chez les neutrophiles, se trouvent dans les granules azurophiles alors que la cathélicidine hCAP-18/LL-37 se trouve dans les granules spécifiques [23-25].
Les peptides anti-microbiens utilisent différents mécanismes pour éviter la dissémination bactérienne. Les défensines et cathélicidines sont des petites protéines cationiques qui s'insèrent et forment des pores dans les membranes bactériennes. La BPI cible plus précisément les bactéries gram négative en se liant au LPS entraînant la neutralisation, l'opsonisation et la destruction des bactéries par phagocytose [26]. D'autres anti-microbiens comme la lactoferrine agissent par la chélation d'ions essentiels comme le fer pour inhiber la croissance bactérienne.
-Les protéines anti-microbiennes du neutrophile
Défensines Élastase (NE)
Cathélicidines Cathépsine G Lactoferrine PGRP NGAL Histone* SLPI Lysozyme Phospholipase PLA2 Protéinase 3 Azurocidine
Légendes: PGRP, Protéine de reconnaissance du peptidoglycane; NGAL, Lipocaline associée à la gélatinase
neutrophilique; SLPI, inhibiteur de leucoprotéase sécrétoire. *, présente dans le noyau
Références: [25,26]
1.1.1.3.2 Les protéases neutres
Les granules neutrophiliques contiennent également des sérines protéases neutres telles l'élastase, la protéinase 3, l'azurocidine et la cathépsine G. Ces protéines exercent des rôles anti-microbiens directs par la lyse des membranes externes des bactéries [27-30], mais agissent également en stimulant l' opsonisation [31, 32] ou par des mécanismes encore inconnus. De plus, elles participeraient à la libération et l'activation de facteurs de croissance au site inflammatoire [30]. La dégranulation des neutrophiles au site d'infection entraîne la présence dans le milieu extracellulaire de ces protéines. Récemment, leur présence dans les "neutrophil extracellular traps" ou NETs a été rapportée.
1.1.1.3.3 Les "neutrophil extracellular traps" ou NETs
En 2004, Brinkmann et coll. ont observé que les neutrophiles activés par l' IL-8 ou le LPS généreraient des réseaux fibreux et globulaires constitués Inajoritairement d'ADN, mais aussi d'histones et de protéines contenues dans les granules azurophiles, spécifiques et tertiaires telles l' élastase, la myéloperoxidase et la cathepsine G [33]. Marttinelli et coll. ont observé que le même phénolnène a également lieu pour les neutrophiles stimulés par les interférons a et y [34]. Les NETs, présents aux sites inflammatoires, peuvent s'associer aussi bien aux bactéries graIn + qu'aux bactéries gram - . La formation de ce réseau ne se produit pas par apoptose ou par nécrose des neutrophiles 111ais par un processus dépendant
de la génération des radicaux libres par la NADPH oxydase après la fusion des compartiments nucléaires et cytoplasmiques et la rupture des membranes [35].
L'existence des NETs a été démontrée in vivo dans des infections à Streptococcus pneumoniae et aux streptocoques du groupe A [36, 37]. Très récemment, des études ont montré la formation des NETs via l'activation des TLR -4 plaquettaires dans un modèle murin d'endotoxémie [38]. Cependant, ces réseaux semblent inefficaces contre les bactéries encapsulées ou sécrétant des ADNases [36, 37]. Au cours d'une infection, les NETs auraient pour rôle de contenir l'invasion bactérienne par la dégradation des facteurs de virulence, de réguler la dissémination bactérienne et de délivrer une grande concentration locale de molécules anti-microbiennes afin d'endiguer l'infection [33].
Tous les mécanismes dépendants et indépendants de l'oxygène précedemment cités agissent de concert en vue de la destruction des micro-organismes.
1.1.2 Les pathologies associées aux neutrophiles
La régulation ainsi que la fonctionnalité du neutrophile sont importantes dans l'homéostasie de l'organisme. En effet, leur présence, leur migration ou leurs fonctions sont associées à certaines maladies inflammatoires telles la goutte [39, 40], l'arthrite rhumatoïde [41], la mucoviscidose [42, 43], la maladie de Kawasaki [44] et les lnaladies inflamlnatoires de l'intestin [45, 46].
Inversement, le manque de neutrophiles observé chez des individus neutropéniques peut entraîner un décès précoce dû à une infection [47]. Il en est de même pour les individus atteints de granulomatose chronique (CGD) qui sont plus sensibles aux infections du fait de mutations dans une enzyme importante pour la production de radicaux libres, la NADPH oxydase, présente entre autre chez le neutrophile [48, 49].
Le neutrophile représente par conséquent un outil puissant pour l'organisme, malS également dangereux puisque la dérégulation des processus de contrôle liés à ces leucocytes aboutit à des domlnages tissulaires importants ou un décès précoce par infection.
1.2 La migration du neutrophile au site inflammatoire
Le neutrophile est le premier leucocyte à être recruté au site d'infection ou d'inflammation en réponse à un pathogène ou à une lésion. Un délai de 1 à 4 heures est nécessaire à son recrutement alors que le recrutement des monocytes et des lymphocytes demande plusieurs heures voire des jours.
Le recrutement des leucocytes de la circulation sanguine est un processus à multiples étapes dirigé par des molécules d'adhésion et régulé par la présence de facteurs chimiotactiques. La migration des monocytes, des lymphocytes, et des neutrophiles requiert les mêmes évènements, mais elle diffère dans la réponse aux facteurs chimiotactiques et dans l'expression des molécules d'adhésion [50].
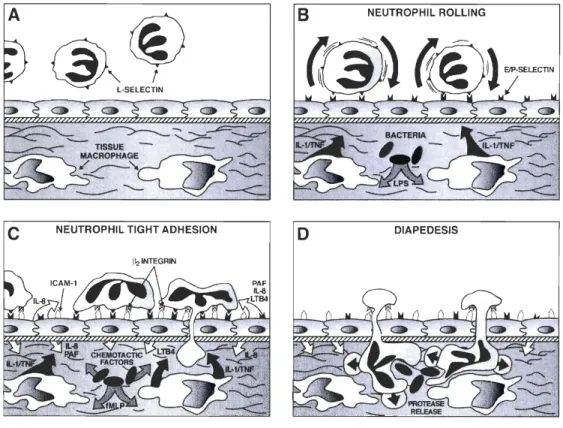
La migration trans-endothéliale est une étape cruciale du recrutement des leucocytes aux sites inflammatoires. Ce phénomène, très étudié au cours des 20 dernières années, est hautement régulé et est caractérisé par 4 étapes: le roulement, l'activation, l'adhésion ferme et l'extravasation ou diapédèse (Figure 2).
B NEUTROPHIL ROLLING
c
NEUTROPHIL TIGHT ADHESIONo
DIAPEDESISI~INTEGRIN
Figure 2 : Schéma de la migration transendothéliale des neutrophiles.
Le neutrophile est capté par les sélectines et roule sur l'endothélium. L'activation du neutrophile pendant le
roulement permet son adhésion ferme sur l'endothélium par l'intermédiaire des intégrines. Il peut alors
traverser l'endothélium vasculaire ( diapédèse) et se rendre au site inflammatoire.
Référence: [50].
1.2.1 La migration trans-endothéliale du neutrophile
1.2.1.1 Les molécules d'adhésionL'attachement du neutrophile à l'endothélium requiert la présence et l' acti vation de
différentes familles de molécules d'adhésion: les sélectines, les intégrines et les molécules
de la famille des immunoglobulines.
Les sélectines sont des glycoprotéines transmembranaires possédant un domaine de type
lectine extracellulaire capable de se lier aux résidus de sucres O-glycanes ou de type lTIucine. Il existe 3 sélectines : la P-sélectine, la L-sélectine et la E-sélectine. La L-sélectine
-est principalement exprimée à la surface des leucocytes alors que la P-sélectine et la E-sélectine sont exprimées à la surface des endothéliums après activation.
Dans des conditions physiologiques, les neutrophiles circulants dans le sang adhèrent avec une faible affinité à l'endothélium non activé par l'intermédiaire de glycoprotéines transmembranaires, les sélectines et le sialyl-Iewis X. Le neutrophile et l'endothélium n'étant pas soumis à un stimulus inflammatoire, l'interaction se rompt et le neutrophile retourne dans la circulation sanguine. En présence d'un pathogène ou d'une lésion dans les tissus, l'endothélium vasculaire proche du site d'infection est activé par des molécules inflammatoires tels le LPS, l'IL-l et le TNF-a [51-54] et présente à sa surface luminale, la P-sélectine provenant des corps intracellulaires de Weibel-Palade. Le neutrophile est alors capté par l'endothélium via l'interaction de haute affinité existant entre la P-sélectine et son ligand, la P-sélectine glycoprotein ligand (PSGL-l) présente à la surface du neutrophile et plus précisément sur ses microvillis [55-57]. De plus, l'activation de l'endothélium augmente l'expression de la E-sélectine à sa surface [58] qui, associée à l'augmentation de la L-sélectine à la surface du neutrophile, entraîne le roulement du neutrophile sur l'endothélium [59-61].
L'arrêt ou l'adhésion ferme des neutrophiles sur l'endothélium est possible grâce aux intégrines. Ce sont des protéines membranaires hétérodimériques composées de chaînes a et ~. Ces molécules sont importantes dans les interactions cellules-cellules, mais également cellules-matrice extracellulaire. Les ~2 intégrines, CD Il a/CD 18 (LF A -1) et CD Il blCD 18 (Mac-l, CR -3) sont importantes pour l'adhésion ferme du neutrophile. L'activation des intégrines survient au cours de l'activation des neutrophiles roulants sur l'endothélium par les facteurs chimiotactiques mentionnés dans la section 1.2.1.2. L' intégrine CD Il blCD 18 activée se lie alors à son ligand ICAM-1, une molécule de la super famille des iInmunoglobulines présente sur l'endothélium. Cette interaction entraîne l'adhésion ferme du neutrophile et amorce son extravasation [62]. De plus, la liaison CD Il blCD 18-ICAM-1 transmet un signal outside-in qui aboutit à la dégranulation des granules tertiaires contenant les gélatinases (metalloprotéases) pour dégrader la lnembrane basale, à des changements nlorphologiques et locomoteurs ainsi qu'à la libération de radicaux libres dans le but de franchir l'endothéliulTI [63].
L'extravasation ou passage du neutrophile à travers l'endothélium est un mécanisme assez peu connu comparativement aux autres étapes d'attachement des neutrophiles à l'endothélium. Ce phénomène serait un processus à multiples étapes dépendant des stimuli et qui aurait lieu à des jonctions tri-cellulaires de l'endothélium in vitro [64] et/ou par transcytose in vivo [65]. Plusieurs molécules pouvant participer à l'extravasation ont été identifiées. La platelet endothelial cell adhesion-l (PECAM-l), une molécule de la famille des immunoglobulines qui est présente sur l'endothélium et qui est très concentrée dans les jonctions latérales cellules-cellules, agit par des intéractions homophiliques [66-68], mais aussi par des interactions hétérophiliques avec CD 177, une glycoprotéine membranaire [69]. La liaison homophilique de PECAM-l entraînerait également l'activation et la mobilisation des intégrines ~ sur les leucocytes comme a6~ 1 qui est le principal récepteur de la laminine des leucocytes, un constituant de la membrane basale [65]. Une deuxième interaction homophilique de CD99, une glycoprotéine transmembranaire a également été demontrée [70]. De plus, des molécules de jonctions endothéliales, junctional adhesion molecule (JAM)-A et JAM-C, sont également requises dans ce processus [71, 72].
1.2.1.2 Les facteurs chimiotactiques
Comme indiqué précédemment, la présence de facteurs chimiotactiques sur les endothéliums active le neutrophile et promeut son adhésion ferme.
Les facteurs chimiotactiques, produits au site d'inflammation par les cellules endothéliales et les cellules environnantes stimulées par des cytokines pro-inflammatoires tels 1 'IL-l et le TNP -u, sont des molécules clés dans le recrutement et l'activation des neutrophiles. Par l'intermédiaire de leurs récepteurs à 7 domaines transmembranaires couplés à des protéines G, ils produisent une cascade d'évènements intracellulaires qui permettent l'activation des intégrines par un signal inside-out ainsi que la polymérisation de l' actine et la motilité cellulaire nécessaire au passage du neutrophile à travers l'endothélium. De plus, la présence des facteurs chüniotactiques du site d'inflamlnation jusqu'à l'endothélium dirige la migration du neutrophile [73].
1.2.1.2.1 Les facteurs chimiotactiques classiques
Il existe deux types de facteurs chimiotactiques classiques: les facteurs chimiotactiques endogènes ie le patelet-activating factor (P AF), le leukotriène B4 (LTB4), les produits dérivés du compléments C5a [74-79] et les facteurs chimiotactiques exogènes tels les
peptides formylés dérivés des bactéries [80]. Ces molécules ont été les premières à être
identifiées comme chimiotactiques. Depuis, une nouvelle famille de molécules
chimiotactiques a été découverte: les chimiokines.
1.2.1.2.2 Les chimiokines
Les chimiokines, présentées dans les tableaux 5 et 6, sont une large famille de cytokines
solubles qui dirigent la migration des leucocytes. Elles participent également à la
régulation du développement des leucocytes ou l'hématopoïèse, l'immunité acqUIse,
l'angiogénèse, la croissance tumorale et l'invasion métastasique [81-86].
Les chimiokines sont des petites protéines de 8-14 KDa riches en acides aminés basiques et contenant des motifs cystéines conservés formant deux ponts disulfures essentiels entre la première et la troisième cystéine et la deuxième et la quatrième cystéine. L'espacement entre la première et la deuxième cystéine dans la séquence amino-acidique permet de les classer en quatre sous-familles: C; C-C, C-X-C, C-X3-C. Les membres de ces sous-familles sont présentés dans les tableaux 5 et 6. Les chimiokines C-X-C sont subdivisées en
deux sous-groupes, ELR+ et ELR-, en fonction de la présence ou de l'absence d'un Il10tif tripeptidique composé de l'acide glutamique, de la leucine et de l'arginine (ELR) dans la
région NH2 terminale. Les chimiokines ELR + sont plus spécifiques des cellules myéloïdes.
Parmi les chimiokines ELR+, CXCL-8 ou IL-8 est un activateur et un facteur chimiotactique puissant important pour le recrutement des neutrophiles au site
Tableau 5: Les chimiokines C-C, leurs récepteurs et leurs cibles Sous-famille c-c Nom de sous-famille CCL-I CCL-2 CCL-3 CCL-4 C L-5 CCL-6 CCL-7 CCL-8 CCL-9 CCL-IO CCL-II CCL-12 CCL-13 CCL-14 CCL-15 CCL-16 CCL-17 CCL-18 CCL-19 CCL-20 CCL-21 CCL-22 CCL-23 CCL-24 CCL-25 CCL-26 CCL-27 CCL-28
Nom commun chez l'humain
1-309 MCP-l, MCAF MIP-Ia MIP-Ib RA TES MCP-3 MCP-2 eotaxin MCP-4 HCC-l, CKbl HCC-2, Lkn-L M IP-5 HCC-4, LEC, Mtn TARC
DC-CKL PARC, MIP-4. AMAC MIP-3b, ELC, ckbll MIP-3a. LARC SLC, 6ckine, ckb9 MDC, STCPI MPIF-l, ckb8-l M PI F -2,eotaxin-2 TECK, ckblS eotaxin-3. M IP-4a
CTACK. ILe Eskrine
MEC Nom commun chez la souris TAC-3 JE MIP-la MIP-Ib RA T S MRP-I M RC MCP-3 Cibles mono. T CCR-8 mono, T, ba 0, K. progeniteur C . R-2 mono, T. K. baso, eosino,
dendritic, HPC CCR-I et-5
mono, T. dendritic. K. progenitor CCR
-5-T, eosino. ba o. K, dendritic. CCR-I,-3,-5 macro mono, T, eo ino. ba o. K. dendritic CCR-I.-2.-3 mono, T. 0 ino, baso, K CCR-3 MRP-2, MIP-lg T CFI T otaxin MCP-5 LCC-I TARC eo ino. T mono. T, eo ino mono, T eo ino mono, HPC mono, T cells. eosino T, neutro T naïve T MIP-3b. ELC T, B, dendritic. NK activé MIP-3a. LARC T B SLC, TCA-4 abcd-I TECK. ckbl6 ALP, skinkine MEC
T B, dendritic, NK activé, macro
progenitor T. eosino dendritic, ostéo effecteur Th2 T mémoire. B. thymocyte immature T CLA+ T cells eosino, plasma blast CCR-3 CCR-2 CCR-2,-3 CCR-l CCR-I,-3 CCR-I CCR-4 CCR-7 CCR-6 CCR-7 CCR-4 CCR-I CCR-3 CCR-9 CCR-3 CCR-IO CCRIO
Légende: mono, monocyte; T : lymphocyte T; CLA, cutaneous lymphocyte associated antigen ; éosino, éosinophile; neutro, neutrophile; dendritic, cellule dendritique, NK, natural killer; ostéo, ostéoclastes; HPC, progéniteur hématopoïétique; macro, macrophage; B, lymphocyte B; baso, basophile.
Tableau 6: Les chimiokines C-X-C, C-X3-C et C, leurs récepteurs et leurs cibles
Nom de sous- Nom commun Sous-famille famille chez la souris Cibles
C-X-C XCL-I MIP-2, KC neutro
X L-2 GROb, MIP-2a KC neutro ex R-2 eXCL-3 GROg, MIP-2b KC neutro C CR-2 CXCL-4 PF-4 PF-4 fibro. ndoth liai CX ,R-3B
CXCL-5 E -7 L1X n utro CXCR-2
CXCL-6 G P-2 Cka-3 n utro ex R-I et-2
CXCL-7 P-2 fibrobla t ex R-2
CXCL- IL- neutro. ba o. T e R-I t -2
CXCL-9 Mig Mig T. progenitor CXeR-3A
CXCL-IO IP-IO IP-IO. GR-2 T
XCR-eXCL-11 [-TAC T CXCR-3
eXCL-12 DF-I SDF-2 mono. R HP CXeR-4 CXCL-13 BLC, BCA-l BLC, BCA-2 B CXCR-5
neutro. K .. dendritic.
CXCL-[4 BRAK. Bolekine mono unknown lungkine.
CXCL-15 WECHE neutro, BM progenitor unknown
CXCL-16 CXCL-16 dendritic CXCR-6
C-X.l-C eX3CLI fractaline neurotactin effecteur T CX3eRI
C XCL-l Lymphotactin. A TAC Lymphotactin B. T. NK. neutra XCR-I
XCL-2 Lymphotactin ~ XCR-I
Légendes: mono, monocyte; T: lymphocyte T; CLA, cutaneous lymphocyte associated antigen ; éosino, éosinophile; neutro, neutrophile; dendritic, cellule dendritique, NK, natural killer; ostéo, ostéoclastes; HPC,
progéniteur hématopoïétique; macro, macrophage; B, lymphocyte B; baso, basophile; fibro, fibroblaste; endo,
cellule endothéliale, BM : moelle osseuse. Références : [84, 92]
1.2.1.2.3 La formation du gradient chimiotactique
Les tissus lésés sécrètent les facteurs chimiotactiques mentionnés précédemment qUI s'immobilisent sur la cellule et la matrice extracellulaire en interagissant avec des glycosaininoglycans chargés négativement tels les héparanes sulfates ou les protéoglycanes [93]. Un gradient se crée alors allant du plus concentré à proximité des tissus lésés vers le plus dilué en approchant de l'endothélium où les facteurs chilniotactiques sont trancytosés
sur la surface luminale [94, 95]. L'endothéliuln activé produit et/ou présente alors à sa
surface des molécules chüniotactiques tels PAF, CXCL-8 ÏJnmobilisées [96] qui vont
héparanes sulfates jouent également un rôle dans la stabilité des chimiokines telles CXCL-8 en évitant leur dégradation protéolytique [97]. Pendant sa migration tissulaire, le neutrophile libère partiellement les granules spécifiques et azurophiles afin de dégrader la membrane basale [98].
Un modèle hiérarchisé de la migration des neutrophiles a été proposé et suggère que le neutrophile suivrait d'abord les chimioattractants intermédiaires tels 1 'IL-8 ou le L TB4 puis,
les chimioattractants dits terminaux tels le fMLP et le C5a pour se rendre au site inflammatoire [99].
Au fur et à mesure que la concentration locale en facteurs chirniotactiques augmente et ce,
jusqu'au site d'infection, le neutrophile met en place ses mécanismes dépendants et indépendants de l'oxygène par la libération complète du contenu des granules spécifiques et azurophiles dans les phagosomes ou dans le milieu extracellulaire [100]. Cette exocytose libère des récepteurs de la matrice extracellulaire ainsi que des enzymes de dégradation de la matrice telles les collagénases et les sérines protéases qui facilitent sa migration [101].
1.2.1.3 Les anti-microbiens chimiotactiques
Un nOlnbre croissant d'études démontre des recoupements fonctionnels entre les protéines anti-microbiennes et les chimiokines, étendant ainsi leurs rôles et leurs importances dans l'immunité.
En effet, les protéines anti-microbiennes du neutrophile i.e. les défensines l et HNP-2, la cathepsine G, l' azurocidine, et la cathélicidine hCAP 18/LL-3 7 exercent des activités chimiotactiques sur différents types cellulaires comme les cellules dendritiques, les cellules T, les neutrophiles et les monocytes, ce qui suggèrent un rôle de ces protéines dans l'amplification de la réponse inflammatoire, mais aussi dans la transition vers l'immunité acquise [102-108]. Dans le tableau 7, sont présentées plus précisélnent les cibles des protéines anti-microbiennes.
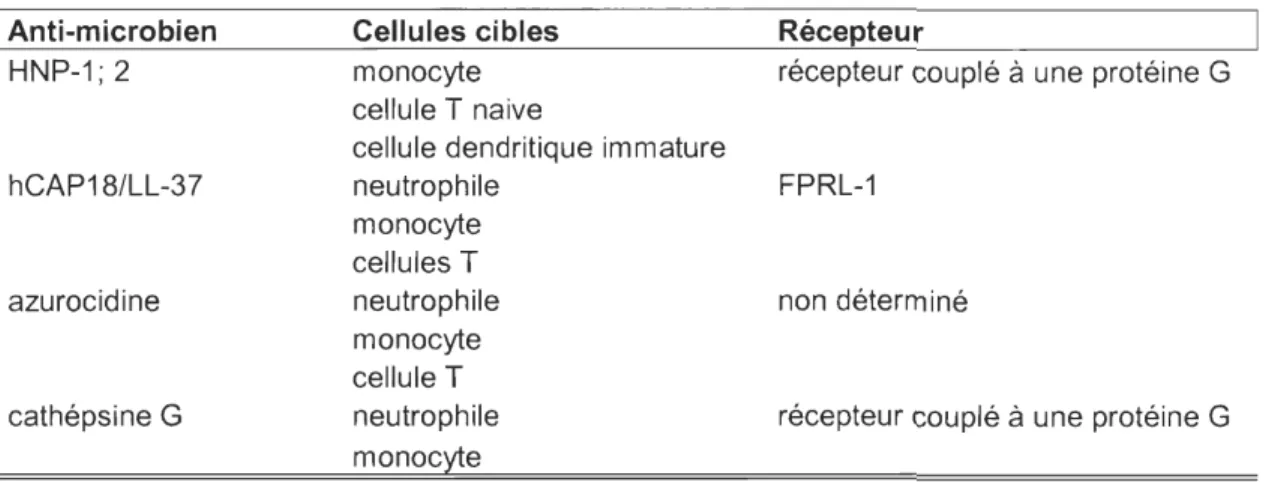
Tableau 7: Les anti-microbiens chimiotactiques et leurs cibles 1 Anti-microbien HNP-1; 2 hCAP18/LL-37 azurocidine cathépsine G Cellules cibles monocyte cellule T naive
cellule dendritique immature neutrophile monocyte cellules T neutrophile monocyte cellule T neutrophile monocyte Récepteur
récepteur couplé à une protéine G
FPRL-1
non déterminé
récepteur couplé à une protéine G
Légende: HNP, Ruman neutrophil protein; FPRL-l Formyl peptide receptor like -1; hCAP18/LL-37 human cathelicidin anti-microbial protein 18.
Références: [103-108]
Les pouvoirs chimiotactiques de ces protéines ont été également démontrés in vivo où elles permettent le recrutement des cellules T CD3+ dans la peau et le recrutement des neutrophiles et des monocytes au site inflammatoire [107] possiblement par l'activation de récepteurs couplés à des protéines G. De plus, la protéine hCAP/LL-37 possède également des pouvoirs adjuvants [109-111].
Une autre classe de défensines, les ~-défensines, non exprimées chez le neutrophile,
possède également des activités chimiotactiques par l'activation du CCR6 sur les cellules dendritiques [112]. Inversement, certaines chimiokines exercent des activités anti-microbiennes. En effet, Cole et coll. et De Yang et coll. ont démontré in vitro que les chimiokines ELR- CXC chimiokines, la chimiokine CCL20 et d'autres chimiokines possèdent des activités anti-microbiennes similaires aux défensines [113, 114].
Il existe une autre famille de protéines anti-microbiennes du neutrophile qui possède des activités chitniotactiques. Il s'agit des protéines S 100A8 et S 1 00A9, Inembre de la famille des protéines SI 00.
2 Les protéines anti-microbiennes et chimiotactiques
SlOOA8 et SlOOA9
2.1 La famille des protéines S100
2.1.1 Le locus des protéines S100
Les membres de la famille des protéines SI 00 sont de petites protéines acides (10-14 KDa) qui furent isolés pour la première fois dans le cerveau humain, il y a environ 40 ans [115]. Elles ont été nommées SI 00 du fait de leur solubilité dans une solution de 100% de sulfate d'ammonium.
La plupart des gènes codant pour les membres de la famille SI 00 se trouve sur la région 1 q21 chez l'homme [116, 117] et 3 f2 chez la souris [118, 119]. Cette région, sensible aux réarrangements [120], est restreinte aux vertébrés et conservée chez le rat et la souris [121] suggérant une apparition récente de cette famille dans l'évolution.
2.1.2 La structure des protéines S100
Les protéines SI 00 ont comme particularité commune deux domaines de liaison au calcium EF -Hand (motif hélice-boucle-hélice) en C-terminal et en N -terminal ayant des affinités différentes pour les ions Ca2+ et séparés par une région charnière. Le EF -hand N-terminal est caractéristique des protéines SI 00 et possède 14 acides aminés au lieu de 12 acides aminés dans le EF -Hand conventionnel. Plus précisément, la structure des protéines SI 00 contient le N-terminal EF-Hand qui comprend l'hélice l, le site de liaison au calcium spécifique des protéines SI 00 et l 'hélice II, séparée par la région charnière flexible du deuxième C-terminal EF -hand conventionnel comprenant l 'hélice III, le site de liaison au calcium conventionnel et l 'hélice IV. Même si ces protéines présentent différents degrés d'homologie allant de 25 à 65% dans leur séquence amino-acidique, cette structure est très conservée.
Une autre particularité des protéines SI 00 est de former des homodimères, des hétérodimères et des oligolnères non covalents, fonnes qui semblent importantes pour leur activité biologique. L'assenlblage des Illon
111ères
s'effectue
par
l'internlédiaire d'unede calcium, la liaison du calcium entraîne des changements conformationnels qui aboutissent à une réorientation de l'hélice III du EF -hand classique. Ceci ouvre la structure des protéines qui exposent alors une région hydrophobe formée par les résidus de la région charnière, de l'hélice III et la boucle de la région C-terminal (figure 3). Cette partie hydrophobe pourrait représenter le site d'interaction avec les protéines cibles.
En plus de lier le calcium via le domaine EF -hand, les protéines SI 00 peuvent également lier le zinc et le cuivre, mais sur un site distinct pouvant leur conférer un rôle dans 1 'homéostasie du zinc et les processus de régulation nécessitant cet ion.
III
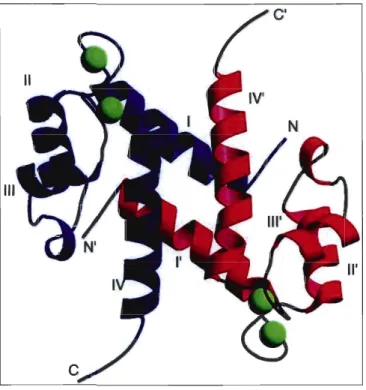
Figure 3 : La structure globale des protéines S100
Les sous-unités des monomères des protéines SI 00 sont présentées en rouge et en bleu. Les sites de liaison EF-hand sont représentés par les molécules de calcium (rond vert).
2.1.3 L'expression et les fonctions des protéines S100
Il existe actuellement 22 protéines SI 00 (présentées dans le tableau 8). Leur expression n'est pas ubiquitaire, mais restreinte à certains tissus ou cellules [123]. Elles sont exprimées au niveau cytoplasmique et/ou nucléaire où elles exercent des fonctions intracellulaires comme la régulation enzymatique, la réorganisation du cytosquelette, la transcription ou l'homéostasie du cuivre et du zinc [123-125].
Bien que les protéines SI 00 ne possèdent pas de peptide signal essentiel pour la sécretion via le réticulum endoplasmique et l'appareil de Golgi, certaines protéines SI 00 comme S100B, S100A1, S100A2, S100A4, SIOOA7, SlOOA8, SlOOA9, SlOOA10, S100A12 et SI OOA 13 sont libérées dans le milieu extracellulaire et interviennent dans la motilité cellulaire, la croissance, la régulation du cycle cellulaire, la sécrétion et la transcription [123-127]. De plus, elles exercent des activités similaires aux chimiokines en permettant la migration des cellules immunitaires comme par exemple le chimiotactisme des éosinophiles [128], des neutrophiles et des lymphocytes T, fonctions observées pour les protéines SI OOA2 et SI OOA 7 (Tableau 8) [124, 125, 129].
Les protéines SI 00 sont associées à de nombreuses pathologies comme les maladies inflammatoires, le cancer et la maladie d'Alzheimer [130-142]. Un possible récepteur à
multiples ligands, RAGE, a été identifié comme pouvant transmettre les signaux de transduction associés aux protéines SI 00 présentes dans le Inilieu extracellulaire. Ce récepteur est un membre de la superfamille des immunoglobulines et son interaction avec certaines protéines SI 00 comme SI OOA 12 entraîne l'activation de NFKB et la production de cytokines pro-inflammatoires [143-145]. RAGE est également associé à de nombreuses pathologies comme le diabète [143, 146], la maladie d'Alzheimer [147, 148], et l'athérosclérose [149] et semblerait jouer un rôle central dans l'inflammation par sa liaison avec SI OOA 12 [144], un membre des "myeloid-related protein" (MRP) de la sous-famille des protéines SI 00.
Tableau 8: Les fonctions intracellulaires et extracellulaires des protéines 8100 Protéines SlOO SlOOB SlOOAI SlOOA2 SlOOA3 SlOOA4 SlOOA5 SlOOA6 S100A7 SlOOA8 SlOOA9 SlOOAIO S100AII SIOOAl2 S100Al3 S10014 S IOOAI5 SlOOP SIOOZ Calbindin D Profilaggrin Trychohyalin Repetin Fonctions intracellulaires
Métaboli me énergétique, régulation du cyto quelette, homéo tasie du calcium, motilité,
photo-tran duction, apopto e, survie, cycle cellulaire
Régulation of cyto quelette métaboli me
'nergétique, homéo ta ie du calcium, contraction mu culaire, photo-tran duction, prolifération
Régulation du cyto quelette, upr ion de tumeurs
Non déterminée
Régulation du cytosquelette, développement métastasique et tumorale
Homéostasie Cycle cellulaire Survie
Maturation des cellules myéloïdes, activation des neutrophiles et des monocytes, régulation du cytosquelette
Maturation des cellules myélo~ides, transport des acides gras, activation des neutrophiles et des monocytes, régulation du cytosquelette Régulation du cytosquelette, activités anti-inflammatoire
Régulation du cytosquelette, inhibition de la croissance cellulaire.
Régulation du cytosquelette, protéine chaperonne Transport de protéines Non déterminée Non déterminée Non déterminée Non déterminée Non déterminée Régulation du cytosquelette Régulation du cytosquelette Régulation du cytosquelette Fonctions extracellulaires
Exten ion de neurite , différenciation myogénique (RAGE indépendante), pla ticité ynaptiqu , proliférati n, apopto e, r 'paration et immunité du cerveau
Exten ion de neurone urvie
Migration d éo inophile , motilité cellulaire,
angiogénè e Non détenninée
Apoptose, extension neuronale, angiogén
Non déterminée Non déterminée
Migration des neutrophiles et des lymphocyte CD4+, anti-microbien
Migration des neutrophiles et des monocytes,
répulsion des neutrophiles, anti-microbien, apoptose,
embryogénèse
Migration des neutrophiles et monocytes, a nti-microbien, nociception, prolifération, apoptose
Coagulation
Non détenninéee
Migration des neutrophiles et monocytes, exten ion des neurites Non déterminée Non determinée Anti-microbien Prolifération/survie (RAGE) Non déterminée Non déterminée Non détel111inée Non déterminée Non déterminée



![Figure 4 : Les motifs et les homologies de séquences des protéines SlOOA8 et SlOOA9 humaines et murines Références: [150, 177, 178, 184, 186]](https://thumb-eu.123doks.com/thumbv2/123doknet/3685051.109248/46.1188.172.1016.159.601/figure-motifs-homologies-séquences-protéines-humaines-murines-références.webp)
