!
UNIVERSITÉ DE PICARDIE JULES VERNE
Faculté de Médecine d’Amiens
THÈSE D’ÉTAT DE DOCTEUR EN MÉDECINE
Spécialité Oncologie option Radiothérapie
Année 2017 - N° 2017-103RÉ-IRRADIATIONS SPINALES PAR
RADIOTHÉRAPIE STÉRÉOTAXIQUE DE TYPE
CYBERKNIFE
TM
RÉSULTATS CLINIQUES ET DOSIMÉTRIQUES
Président du Jury
Membres du Jury
Directrice de Thèse
Monsieur le Professeur Claude KRZISCH
Monsieur le Professeur Bruno CHAUFFERT Monsieur le Professeur Jean-Marc CONSTANS Monsieur le Docteur Michel LEFRANC
Monsieur le Docteur Alexandre COUTTE
Madame le Docteur Marie-Pierre SUNYACH
Madame Jessica SERRAND
Née le 2 Novembre 1987 à Châtenay-Malabry (92)
Présentée et soutenue publiquement le 29 Septembre 2017 !
À mon Maître et Président du Jury :
Monsieur le Professeur Claude KRZISCH
Professeur des Universités - Praticien Hospitalier (Cancérologie, radiothérapie)
Oncopôle
Je vous remercie d’avoir accepté de me former à la radiothérapie. C’est un honneur que vous ayez accepté de juger ce travail et de vous avoir comme Président de Thèse. Veuillez trouver ici le témoignage de ma profonde gratitude, et mes sentiments les plus respectueux.
À mes Maîtres et Membres du Jury :
Monsieur le Professeur Bruno CHAUFFERT
Professeur des Universités - Praticien Hospitalier
Chef du Service d'Oncologie Médicale du CHU d’AMIENS
Je vous remercie pour votre précieux enseignement tout au long de mon cursus, votre investissement auprès de vos internes et de vos patients, ainsi que plus personnellement pour votre bienveillance depuis mes débuts en Oncologie puis Radiothérapie. Vous êtes un exemple.
Monsieur le Professeur Jean-Marc CONSTANS
Professeur des Universités - Praticien Hospitalier (Radiologie et imagerie médicale)
Je vous remercie de me faire l’honneur de juger ce travail. Ce fût un plaisir de passer un semestre dans votre service de radiologie, et d’avoir pu bénéficier de votre expertise en neurologie et neuro-oncologie.
Monsieur le Docteur Michel LEFRANC
Maître de Conférence des Universités - Praticien Hospitalier (Neurochirurgie)
Je vous remercie de me faire l’honneur de juger ce travail. Ce fût un plaisir de bénéficier de vos connaissances notamment lors des RCP de neuro-oncologie qui ont émaillées mon cursus.
Monsieur le Docteur Alexandre COUTTE
Praticien Hospitalier
Service d’Oncologie-Radiothérapie du CHU d’Amiens
Je vous remercie de me faire l’honneur de juger ce travail. J’ai beaucoup appris à vos côtés. Veuillez trouver ici le témoignage de ma profonde gratitude, et mes sentiments les plus respectueux.
À ma Directrice de Thèse :
Madame le Docteur Marie-Pierre SUNYACH
Médecin de Centre de Lutte Contre le Cancer (Cancérologie, radiothérapie)
Centre Léon Bérard à Lyon
Merci de m’avoir fait l’honneur d’accepter de diriger ce travail et de m’avoir aidé à le mener jusqu’au bout. Je te remercie en particulier pour ton investissement, pour ta disponibilité et ta gentillesse. Orlando fut une excellente expérience et j’espère qu’il y en aura d’autres.
Aux les médecins qui m’ont transmis leur amour de la médecine, leurs connaissances et qui ont marqué mon parcours en m’inspirant,
Monsieur le Professeur Joseph B. SHRAGER & Dorothy Monsieur le Docteur Christian CARRIE
Monsieur le Docteur Réda GARIDI Monsieur le Docteur Marc KANAAN
Au Docteur Ronan TANGUY, pour avoir accepté de faire les statistiques et pour ses conseils. À Myriam AYADI, pour son aide précieuse la partie physique de ce travail, ses relectures et sa
disponibilité.
Aux équipes avec lesquelles j’ai travaillé, pour leur gentillesse, leur patience et leur bienveillance
Aux infirmières et aides soignantes du B10, du service d’Oncologie du CHU d’Amiens,
Aux physiciens, dosimétristes et manips radio du CHU d’Amiens ainsi qu’aux supers secrétaires et agents d’accueil du service : Aïcha, Lucile, Vanina, Aurélie, Véro et Gaëlle.
À ma famille,
À Maman, merci d’avoir toujours veillé sur moi et cru en moi. Merci pour ton éducation et
pour m’avoir donné toutes les armes pour réussir dans la vie, pour ta pêche et ton énergie contagieuses, ton écoute et tes conseils toujours avisés lors des grandes décisions. Tu es une maman exceptionnelle.
À Papa, merci pour ta gentillesse, ta sérénité et ta délicatesse. Merci pour toutes tes petites
attentions depuis toujours, et notamment pour avoir sillonné la Picardie pendant 5 ans au gré de mes internats ne serait-ce que pour un déjeuner ou un dîner. Tu es le meilleur papa que l’on puisse avoir.
À mes parents, merci pour votre amour inconditionnel et votre soutien indéfectible, quoi qu’il
arrive. Nous avons de la chance de vous avoir. Je vous aime !
À mon frère et ma sœur : Thomas et Clara. Vous êtes les meilleurs, tout simplement ! À tous
nos délires d’enfants & d’adultes maintenant, à nos retrouvailles qui sont toujours géniales et notre complicité qui ne s’est jamais altérée. À tous les moments que nous avons partagés et à tous ceux à venir. Je suis très fière des adultes que vous êtes devenus (comment ne pas l’être ?) et vous souhaite tout le bonheur du monde avec Pauline et Noé.
À mes grands-parents, mes oncles et mes tantes, mes cousins et mes cousines : merci de
m’avoir toujours soutenue et encouragée. À tous les moments que nous avons passés ensemble et pour cette solidarité familiale qui nous caractérise.
Ma Doudou, à ton sacré caractère qui ne terni pas même passés les 85 ans. Puis-je avoir
ta force et être toujours aussi bavarde à ton âge !
À mamie Louisette et papi Henri, merci pour tout votre amour et vos bons soins depuis
toujours.
À ma Marraine Eveline et à mon Parrain Jean-Claude, vous êtes exceptionnels.
À Nathalie, Maxime et Ludovic, merci pour toutes ces vacances passées ensemble pendant
notre enfance. Vous êtes ma famille.
À mes co-internes,
D’onco, ceux de toujours du B10 : Aline, ma Deb et Juju. Nous nous sommes connu au tout
début et avons chacun tracé notre bout de chemin. Vous êtes de supers docs, je vous kiffe !
Aux plus jeunes, qui ont grossi les effectifs féminins en mode Bruno’s Angels : Aurélie, Mony,
Aline, Diana, Laura, Candice, Léa, Sara, et bien sûr Clémence. À Arnaud, mon collègue de DIU : merci pour ta gentillesse.
À mes co-internes et surtout amis depuis le tout début : Droudou, Hélo, Poussinette, Babar,
Clem : comme quoi, on peut faire de belles rencontres à Laon ! Heureusement que vous étiez là. Ne changez pas !
À mes amis d’Amiens : Lisa, Fanny, Florence, Sophie, Julia, Gen & Jojo, David & Aurore,
Florine, Romain, la Team Gynéco bien sûr : Chacha, Claire et Élo. Merci d’être aussi cools. Je vous souhaite tout le meilleur pour la suite.
À mes amis du Sud,
À Claire, my partner in crime depuis de longues années. « Tout le monde à un meilleur ami à
chaque étape de la vie, mais seulement les chanceux ont le même à toutes les étapes de leur vie ».
Tu es juste géniale, une épaule solide sur laquelle on peut compter et une amie en or. Je te souhaite plein de bonheur !
Mes petites toulousaines : Tiphaine, Magali, Marie, Caro : vous êtes devenues d’admirables
docteurs, et des femmes épanouies. Je vous souhaite tout le bonheur du monde avec vos familles respectives. Marie et Caro : Lalayéla ! Rdv sur le bâteau des chefs ?
À mes amis de longue date : Finou, Émilie & Vince, Florence, Matthieu & Meggie, Julien, Victo. Je vous souhaite tout le meilleur avec vos petites familles respectives. De toute façon nous
nous retrouverons toujours à un moment donné l’été chez nous. Visca Catalunya !
À Ramy, nous serons donc venus à bout de 2 Thèses de médecine, 2 DES, 2 DESC, 3 inter-CHU,
5 DIU, 5 tableaux de gardes & un bon nombre d’astreintes. Merci d’avoir été à mes côtés ! À toutes les aventures partagées ensemble et à celles à venir. Je t’aime.
À tous les patients qui se battent contre cette maladie,
SERMENT D’HIPPOCRATE
Au moment d’être admise à exercer la médecine, je promets et je jure d'être fidèle aux lois de l’honneur et de la probité.
Mon premier souci sera de rétablir, de préserver ou de promouvoir la santé dans tous ces éléments, physique et mentaux, individuels et sociaux.
Je respecterai toutes les personnes, leur autonomie et leur volonté, sans discrimination selon leur état ou leurs convictions. J’interviendrai pour les protéger si elles sont affaiblies, vulnérables ou menacées dans leur intégrité ou leur dignité. Même sous la contrainte, je ne ferai pas usage de mes connaissances contre les lois de l’humanité.
J’informerai les patients des décisions envisagées, de leurs raisons et de leurs conséquences. Je ne tromperai jamais leur confiance et n’exploiterai pas le pouvoir hérité des circonstances pour forcer les consciences.
Je donnerai mes soins à l’indigent et à quiconque me les demandera. Je ne me laisserai pas influencer par la soif du gain ou la recherche de la gloire.
Admise dans l’intimité des personnes, je tairai les secrets qui me seront confiés. Reçue à l’intérieur des maisons, je respecterai les secrets des foyers et me conduite ne servira pas à corrompre les mœurs.
Je ferai tout pour soulager les souffrances. Je ne prolongerai pas abusivement la vie. Je ne provoquerai jamais la mort délibérément.
Je préserverai l’indépendance nécessaire à l’accomplissement de ma mission. Je n’entreprendrai rien qui dépasse mes compétences. Je les entretiendrai et les perfectionnerai pour assurer au mieux les services qui me seront demandés.
J’apporterai mon aide à mes confrères ainsi qu’à leur famille dans l’adversité.
Que les hommes et mes confrères m’accordent leur estime si je suis fidèle à mes promesses. Que je sois déshonorée et méprisée si j’y manque.
TABLE DES MATIERES
TABLE DES MATIERES……….……….2
FIGURES & TABLEAUX………...……...….………..3
ANNEXES………...………....4 ACRONYMES……...………...…………...………...5 RÉSUMÉ………..………...………....6 ABSTRACT……...……….………..…..7 1. INTRODUCTION…...………...……….………...………....8 1.1. Epidémiologie et rationnel 1.2. Intérêt technique de la radiothérapie stéréotaxique 1.3. Données actuelles de la littérature 1.4. Applications cliniques 1.4.1. Préparation du traitement 1.4.1.1. Dose Biologique Equivalente (BED) 1.4.1.2. Dose Équivalente en fractions de 2 Gy (EQD2) 1.4.2. Limites et questions soulevées par les ré-irradiations vertébrales 1.5. Objectifs de l’étude 2. MATÉRIEL ET MÉTHODE………...………14
2.1. Méthodologie 2.2. Critères d’inclusion et d’exclusion 2.3. Données cliniques et de toxicités 2.4. Technique de radiothérapie stéréotaxique 2.5. Données physiques 2.6. Analyse statistique 3. RESULTATS……...……….………18
3.1. Description de la population 3.2. Caractéristiques de la 1ère irradiation 3.3. Caractéristiques de la ré-irradiation par SBRT 3.4. Sommation de doses 3.5. Survie globale 3.6. Survie sans récidive 3.7. Contrôle local 3.8. Contrôle de la douleur 3.9. Contrôle neurologique 3.10. Focus sur les patients ayant bénéficié d’une ré-irradiation avec BED10>120Gy2/2 3.11. Toxicités 4. DISCUSSION………..………..…30
5. CONCLUSION………...……….….…….….36
ANNEXES………...…...…..……….………..…..……37
FIGURES
Figure 1. Limites des traitements en radiothérapie conventionnelle selon le Bone Mets RCT Trial
[1]
Figure 2. Architecture du CyberKnife®
Figure 3. Décompression médullaire par radiochirurgie selon Ryu et al.[2] Figure 4. Survie globale dans la cohorte
Figure 5. Survie sans récidive (SSR) dans la cohorte
Figure 6. Survie sans récidive selon l’histologie : radiorésistante ou non
Figure 7. Survie sans récidive selon la dose délivrée à la tumeur lors de la ré-irradiation exprimée
en BED10
Figure 8. Survie sans récidive selon la dose délivrée à la tumeur en termes de BED10 sommé
après ré-irradiation
Figure 9. Taux de contrôle local dans la cohorte
Figure 10. Score neurologique clinique selon Ryu et al. avant ré-irradiation par SBRT Figure 11. Score neurologique clinique selon Ryu et al. après ré-irradiation par SBRT
TABLEAUX
Tableau 1. Caractéristiques des patients
Tableau 2. Score neurologique clinique selon Ryu et al.[3] Tableau 3. Score neurologique radiologique selon Ryu et al.[3] Tableau 4. Score de SINS selon Fisher et al.[4] dans la cohorte
Tableau 5. Caractéristiques techniques de la 1ère irradiation normofractionnée
Tableau 6. Caractéristiques techniques de la ré-irradiation par SBRT
Tableau 7. Doses cumulées à la tumeur après ré-irradiation spinale par SBRT
Tableau 8. Doses cumulées aux OARs après ré-irradiation spinale par SBRT (α/β= 3)
Tableau 9. Doses cumulées aux OARs après ré-irradiation spinale cervico-thoracique (α/β=2) Tableau 10. Doses cumulées aux OARs après ré-irradiation spinale lombaire (α/β=4)
Tableau 11. Score neurologique selon la cotation OMS post-SBRT Tableau 12. Score neurologique clinique post-SBRT selon Ryu et al.
ANNEXES
Figure 11. Guidelines de contourage des métastases vertébrales selon Ryu et al. [3]
Figure 12. Consensus international pour la délinéation des volumes en stéréotaxie vertébrale [5] Figure 13. Classifications radiologique et neurologique des compressions épidurales selon Ryu et
al. [3]
Tableau 14. Éléments permettant de définir le score de SINS selon Fischer et al.[4]
ACRONYMES
BED : Biological Equivalent Dose
CIM 10 : classification internationale des maladies, 10ème révision
CTCAE : Common Terminology Criteria for Adverse Events CTV : Clinical Target Volume
Dmax : Dose point maximale
DRR : Digitally Reconstructed Radiograph = images numériques reconstruites EBRT : External Beam Radiation Therapy
EQD2 : Dose Équivalente en fractions de 2 Gy
GTV : Gross Tumor Volume Gy : Gray
HDV : Histogramme Dose –Volume MF : Multiple fractions
OAR : Organes à risque
OMS : Organisation Mondiale de la Santé PTV : Planning Target Volume
PRV : Previsional Risk Volume RCC : Renal Cell Carcinoma
SBRT : Stereotactic Body Radiation Therapy SF : Single Fraction
SG : Survie globale
SINS : Spinal Instability Neoplasic Score SRS : Stereotacic Radio Surgery
RÉSUMÉ
Objectif Évaluer les résultats cliniques et dosimétriques en termes de doses maximales (Dmax)
cumulées à la moelle épinière, au canal médullaire et à l’œsophage après ré-irradiation spinale par radiothérapie stéréotaxique (SBRT).
Patients et méthodes Entre juillet 2011 et décembre 2015, les plans de traitement de tous les
patients ré-irradiés au niveau spinal par CyberKnifeTM aux Centres Léon Bérard et Antoine Lacassagne ont été revus par physicien et un radiothérapeute. Les doses biologiques équivalentes (BED) et doses équivalentes en fractions de 2 Gy (EQD2) cumulées à la moelle épinière, au canal
médullaire et à l’œsophage ont été calculées. Les données cliniques et de toxicité ont été recueillies dans le dossier médical informatisé.
Résultats Soixante-cinq patients ont été traités sur 68 vertèbres. Les doses cumulées à la moelle
épinière, au canal médullaire et à l’œsophage étaient de 49.8 Gy2/2 (26.5-63.9 Gy2/2), 50.2
Gy2/2(14.1-84.9 Gy2/2), 58 Gy2/3 (15-94.5 Gy2/3) en termes d’EQD2 et de 99.6 Gy2 (53-127.7 Gy2),
100.4 Gy2 (28.1-169.7 Gy3) et 95.8 Gy3 (25-177.5 Gy3) en termes de BED. La survie sans
récidive médiane était de 19 mois (IC95% 9-28.7). La plus longue survie sans récidive a été obtenue pour une BED10 tumorale> 50 Gy10 (24.1 vs 11 mois, p<0.004) et pour une BED10
sommée>100 Gy10 (23.5 vs 18.3 mois, p<0.049) sans toxicité surajoutée. Avec un suivi médian
de 11.3 mois (1-77 mois), 85.3% des lésions algiques étaient contrôlées, 86.8% des patients adressés pour contrôle neurologique ont été stabilisés et 83.8% des lésions étaient contrôlées sur l’imagerie. Il n’a pas été décrit de myélite radique. L’incidence des fractures vertébrales était de 8.8%.
Conclusion La ré-irradiation par SBRT est une technique sûre et efficace chez des patients
sélectionnés.
ABTRACT
(Communication orale au SRS/SBRT Scientific Meeting – Orlando 2016) Objectives To investigate the clinical efficacy and the dosimetrical caracteristics of spinal SBRTin previously irradiated patients. We provide here an analysis on the cumulative spinal cord and esophageal dose exposure, local tumor control and toxicities.
Method Between July 2011 and December 2015, both a physician and a physicist reviewed the
treatment plans of all the patients treated for spinal metastases after prior radiation with the CybernifeTM in two french institutions. The maximal spinal cord, thecal sac and esophagus doses in terms of equivalent 2-Gy fraction dose (EQD2) and biological equivalent dose (BED) of both
plans were cumulated. Total cumulative doses were calculated on summing the equivalent 2-Gy fraction dose (EQD2).
Results Sixty-five patients were treated for 68 re-irradiations. Median cumulated EQD2 dose to
spinal cord, thecal sac and esophagus were 49.8 Gy2/2(26.5 Gy-63.9 Gy2/2), 50.2 Gy2/2 (14.1-84.9
Gy2/2), 58 Gy2/3 (15-94.5 Gy2/3) and median cumulated BEDs were 99.6 Gy2 (53-127.7 Gy2),
100.4 Gy2 (28.1-169.7 Gy2), 95.8 Gy3 (25-177.5 Gy3). Median survival to recurrence was 19
months (IC95% 9-28,7). Longer survival to recurrence was obtained for BED10 tumor dose> 50
Gy10 (24.1 vs 11 months, p<0.004) and for a cumulated BED10 tumor dose>100 Gy (23.5 vs 18.3
months, p<0.49) without added toxicity. With a median follow-up of 11.3 months (1-77 months), 85.3% of painful lesions were still improved; 83.8% kept local control and 86.8% of patients addressed for neurological challenge had no neurological worsening. There was no case of radiation myelopathy.
Conclusion Re-irradiation with SBRT is a safe therapeutic option in selected patients.
Keywords: re-irradiation, stereotactic body radiotherapy, spinal metastases, oncology,
1. INTRODUCTION
1.1. Épidémiologie et rationnel
La fréquence des métastases osseuse est de 70 à 85% dans séries autopsiques des patients atteints de cancers métastatiques[6], ce qui fait de l’os le 3ème site métastatique en terme d’incidence après le foie et le poumon. Cette incidence varie de 20 à 85% selon l’origine du primitif, les cancers les plus ostéophiles étant typiquement d’origine broncho-pulmonaire, prostatique, rénale, mammaire et thyroïdienne[7][8]. Au total, jusqu’à 40% des patients métastatiques au niveau osseux développeront des métastases vertébrales[9][10] dont 10 à 20% seront symptomatiques[11] avec tableau douloureux, voire mise en jeu du pronostic neurologique pouvant conduire à une paralysie en cas d’épidurite évoluant vers une compression médullaire.
Les innovations thérapeutiques des dernières années avec en particulier l'avènement des thérapies ciblées, ont permis l'augmentation de l’espérance de vie globale dans la plupart des cancers, et ce y compris au stade métastatique[12]. Ceci a pour conséquence une augmentation de l’incidence des métastases vertébrales en territoire irradié[13] pour lesquelles nous sommes confrontés à des difficultés techniques et à un manque de recommandation dans la littérature.
En pratique clinique, il existe typiquement 2 cas de figures :
1.1.1. Métastases vertébrales survenant en territoire déjà irradié chez des patients oligométastatiques
La 1ère situation correspond à l’apparition de localisations métastatiques osseuses à
proximité immédiate de zones irradiées lors de la prise en charge de la tumeur primitive. Par exemple, le traitement d’une lésion de la colonne cervicale ou dorsale haute chez une patiente traitée pour une tumeur du sein avec un antécédent de radiothérapie ganglionnaire comprenant la chaine mammaire interne et l’aire sus claviculaire. Il s'agit souvent dans ce cas de situations oligométastiques, avec nécessité d'obtenir un contrôle local à long terme d’une part pour limiter les risques de complications osseuses et neurologiques et d’autre part pour permettre une augmentation de la survie sans maladie afin de retarder un changement de ligne thérapeutique systémique. La radiothérapie stéréotaxique présente dans ce cas l’intérêt de délivrer une BED10
plus importante qu’une radiothérapie conformationelle classique (RTC3D) et donc potentiellement d’augmenter le contrôle tumoral à long terme.
1.1.2. Radiothérapie vertébrale de rattrapage après échec d’un traitement conventionnel
La 2ème situation est représentée par la radiothérapie de rattrapage après échec d’une
RTC3D. En effet, à ce jour, la radiothérapie conformationnelle est la technique la plus fréquemment utilisée en 1ère intention pour la prise en charge des métastases vertébrales et permet de délivrer 8-30 Gy en 1 à 10 fractions sur les vertèbres pathologiques, incluant l’ensemble de la moelle épinière dans les volumes d’irradiation. Si le contrôle de la douleur est le plus souvent obtenu, les données publiées montrent des résultats peu satisfaisants à long terme, avec un taux de récidive douloureuse de l’ordre 30% à 3 mois et 60% à 12 mois et des durées médianes de contrôles neurologique et local limitées à 3 mois. Ces résultats sont encore moins satisfaisants dans le cas de tumeur primitives dites radiorésistantes telles que les carcinomes rénaux, les mélanomes ou les sarcomes[15].
Figure 1. Limites des traitements en radiothérapie conventionnelle selon le Bone Mets RCT Trial[1]
Dans ce cas, la ré-irradiation est souvent à visée palliative, avec pour objectifs de contrôler les douleurs, prévenir la survenue de fracture pathologique et la mise en jeu du pronostic neurologique. Il est alors nécessaire de recourir à une technique de radiothérapie permettant de délivrer à la fois une dose suffisamment importante pour contrôler la tumeur, tout en respectant les contraintes de dose aux organes à risque, en particulier à la moelle épinière, qui a déjà été totalement irradiée lors du 1er temps.
1.2. Intérêt technique de la radiothérapie stéréotaxique
1.2.1. Principes
La radiothérapie stéréotaxique (SBRT) permet de délivrer des doses ablatives (> 5Gy-24 Gy/fraction) en 1 à 6 fraction(s) sur le volume tumoral d’intérêt, tout en garantissant un haut gradient de dose permettant de préserver les organes à risque (OARs) adjacents au volume cible. Dans le cas du traitement, et à fortiori du re-traitement, de lésions situées à proximités d’OARs tels que la moelle épinière, elle nécessite la combinaison d’une technologie guidée par l’image permettant un contrôle des mouvements intra-fraction, d’un algorithme de planification inverse sophistiqué permettant de délivrer une distribution de dose conformée et d’un contrôle de la position pendant la séance [16].
1.2.2. Le CyberKnife
Le CyberKnife est un appareil dédié à la radiothérapie stéréotaxique qui se compose d’un accélérateur linéaire miniaturisé de haute énergie (6 MV), fixé sur un bras robotisé disposant de 6 degrés de liberté (3 translations et 3 rotations) et de plus de 101 positions permettant chacune 12 incidences pour les faisceaux d’irradiation, soit 1212 incidences possibles. Le CyberKnife est équipé d’un collimateur à cônes fixes dont le diamètre varie de 5 mm à 60 mm. La précision du repositionnement du bras est de l’ordre de 0,2 mm. Le système dispose d’une méthode de suivi permettant un repositionnement du robot en fonction des mouvements de la cible. Ce suivi s’effectue à l’aide de 2 tubes à rayons X, fixés au plafond de chaque côté, avec un angle de 45° par rapport à l’horizontale. Deux détecteurs au silicium amorphe sont intégrés au sol.
À intervalles réguliers, des clichés radiologiques sont pris et une fusion d’image, basée sur des fiduciels ou sur les corps vertébraux eux même en cas d’irradiation spinale, est alors réalisée entre ces clichés et les DRR (Digitally Reconstructed Radiograph). À partir des décalages mesurés, le bras robotisé se déplace permettant un suivi de la cible durant la délivrance du traitement.
1.3. Données actuelles de la littérature
1.3.1. Radiothérapie stéréotaxique vertébrale
D’importantes séries rétrospectives monocentriques ont d’ores déjà démontré l’efficacité de la radiothérapie stéréotaxique dans la prise en charge des métastases rachidiennes avec des taux de contrôle local, de la douleur et neurologique autours de 70-90% à 1 an, à la fois chez des patients recevant un traitement de novo[17][18][19][20] et en post opératoire après une chirurgie [21][22]. Les taux de contrôle restaient satisfaisants autour de 57 à 90% à 1 an y compris en cas de tumeurs primitives dites radiorésistantes avec des schémas normofractionnés[23][24].
Avec un niveau de preuve plus robuste, trois études prospectives portant sur la SBRT vertébrale[25][26][27] ont conclu qu’elle était faisable, efficace, et même indiquée en 1ère ligne thérapeutique chez des patients sélectionnés, oligométastatiques.
Ryu et al.[2] ont même mis en évidence la possibilité de décomprimer la moelle épinière
grâce à la radiochirurgie (traitement par une fraction unique) et ont publié des réductions de volume tumoral épidural de l’ordre de 65%+/- 14% à 2 mois après un traitement par une dose de 14 à 20 Gy sur l’isodose 90%[2], ouvrant la voie à de nouvelles options thérapeutiques.
Figure 2. Architecture du CyberKnife® Table de traitement robotisée (1) ; Bras robotisé (2) ; Accélérateur
1.3.2. Ré-irradiations
Les données dont nous disposons en cas de ré-irradiations sont moins nombreuses et moins robustes. L’accumulation de données venant de plusieurs petites séries évoquant la possibilité d’une récupération médullaire ont néanmoins conduit ces dernières années de plus en plus d’équipes à pratiquer des ré-irradiations chez des patients sélectionnés (Annexes, Tableau 15). Il existe également des publications évoquant l’existence d’une meilleure tolérance de la moelle lorsque les volumes irradiés sont très réduits (Dmax de 22.7 Gy (17.8-30.9) sur un volume de
médian de 97mm3)[28]. Les résultats des quelques séries rétrospectives de ré-irradiations publiées montrent des taux de contrôle très satisfaisants, mais le niveau de preuve est faible du fait des faibles effectifs, du caractère monocentrique des études et du court follow-up[29]. Les réticences à pratiquer un tel traitement sont particulièrement justifiées par la crainte de provoquer une myélite radique, pouvant survenir dans les mois ou les années qui suivent la radiothérapie, irréversible et qui altèrerait de façon majeure la qualité de vie des patients, d’autant que les propositions thérapeutiques pour leur prise en charge sont à ce jour limitées (oxygène hyperbare, corticothérapie, vitamine E, Trental).
1.4. Applications cliniques
1.4.1. Préparation du traitement
Le risque de myélite radique dépend de la dose biologique équivalente (BED) délivrée à la moelle épinière[30][31]. Cette dose prend en compte à la fois la dose totale de radiothérapie et la
Figure 3. Décompression médullaire par radiochirurgie Ryu et al. Cancer 2010 Patiente atteinte d’un
cancer du sein métastatique en T2, avec compression médullaire et radiculalgies. (a) Compression épidurale avec liberté du canal médullaire de 56% initialement. (b) Distribution de dose de la radiochirurgie. Traitement par 16 Gy sur l’isodose 90% (en orange) entourant le CTV (en violet). (c) Décompression épidurale 2 mois après la fin du traitement, avec libération du canal médulaire à 95%. (d) Réponse épidurale stable 2 ans après la fin du traitement. Patiente non déficitaire.
dose par fraction. Le risque de myélite est plus important en cas de ré-irradiation puisque les BED des 2 traitements se cumulent théoriquement[32][33][34] .
Dans le cas particulier des ré-irradiations, il est donc nécessaire de calculer la dose biologique équivalente cumulée (BED cumulée). Les auteurs présentent la dose cumulée soit en BED cumulée soit en dose équivalente en fractions de 2 Gy (EQD2) car l’avantage de l’EQD2 est
qu’elle est facilement compréhensible puisque ce fractionnement est le plus répandu actuellement.
1.4.1.1. Dose Biologique Equivalente (BED)
BED=D (1+d/α/β) (en Gy)
La BED correspond à la dose théorique qui serait nécessaire pour produire le même effet avec un nombre infini de fractions (BED tend vers D quand d tend vers 0).
1.4.1.2. Dose Équivalente en fractions de 2 Gy (EQD2)
EQD2 =D (d+α/β)/ (2+α/β)
L’EQD2 correspond à la dose qui serait nécessaire avec des fractions de 2 Gy pour obtenir
des effets biologiques identiques à ceux obtenus avec une dose D de rayonnements ionisants et des fractions de d Grays.
1.4.2. Limites et questions soulevées par les ré-irradiations vertébrales
Des guidelines concernant les contraintes de dose en cas d’irradiation par SBRT de novo ont été publiées et permettraient de limiter le risque de myélite radique à moins de 5% [35], voire moins de 1% selon certains auteurs[36]. Dans le cas des irradiations en fraction uniques,, les doses proposées par les différents auteurs sont concordantes (Dmax=10 Gy sur 10% de la moelle
en 1 fraction). En cas d’irradiation hypofractionnée, il n’y a en revanche pas de consensus. Dans les services de radiothérapie du Centre Léon Bérard et du Centre Antoine Lacassagne, il a été décidé de suivre les contraintes de Timmermann[35].
En cas de ré-irradiations, les guidelines sont plus rares et encore moins consensuelles.
Nieder et al. ont publié en 2005 un score de risque de myélite radique[14], réactualisé en
2006[37]. Celui-ci est basé sur la BED de chaque traitement, la BED cumulée, et l’intervalle entre les 2 traitements. Ils concluent que des doses cumulées calculées en BED <120 Gy2
(EQD2/2=60 Gy2/2), avec un intervalle entre chaque traitement >6 mois et une BED lors de chaque
traitement <98 Gy2 (EQD2/2<50 Gy) sont acceptables, évoquant la notion de récupération
neurologique médullaire. Ils proposent même de monter la dose à la moelle épinière à 130-150 Gy2 lorsque le volume tumoral est faible et qu’une faible dose compromettrait la probabilité de
contrôle. Rades et al.[38] ont également recommandés une BED cumulée à la moelle épinière <120Gy2 et conclu qu’une telle dose était acceptable sans risque de myélite.
À ce jour dans la littérature, la prescription de la dose des traitements stéréotaxiques est reste extrêmement hétérogène suivant les techniques et les équipes. Le schéma optimal en terme de dose et de fractions, le choix de l’isodose périphérique, de même que la couverture du volume cible ne sont pas consensuels[39].
Étant donnés les challenges soulevés par les ré-irradiations spinales en conditions stéréotaxiques, plus d’études avec un suivi plus long des patients sont nécessaires pour uniformiser les pratiques.
1.5. Objectifs de l’étude
L’objectif principal de cette étude rétrospective s’inscrivant dans le cadre d’une étude des pratiques, était d’évaluer la survenue d’une toxicité (myélite radique, œsophagite) dans une cohorte importante de patients ayant développé des métastases vertébrales à proximité ou l’endroit même d’une précédente irradiation spinale et qui ont été retraités par radiothérapie stéréotaxique à l’aide du CyberKnife TM.
L’objectif secondaire était d’évaluer les résultats cliniques obtenus en termes de contrôle local, de contrôle de la douleur et de contrôle neurologique puis d’évaluer les protocoles de doses prescrits et leur efficacité, afin de définir la supériorité d’un schéma sur un autre.
2. MATÉRIEL ET MÉTHODE 2.1. Méthodologie
Il s’agit d’une étude observationnelle, rétrospective, multicentrique, d’étude des pratiques, dans laquelle ont été étudiés les dossiers de tous les patients pris en charge pour une ré-irradiation spinale par radiothérapie stéréotaxique à l’aide du Cyberknife TM aux Centres Léon Bérard
(Lyon) et Antoine Lacassagne (Nice) depuis la mise en place de la technique dans chacun des centres.!!
Les dossiers des patients ont été exhaustivement identifiés à partir des bases de données Cyberknife TM respectives de chacun des centres, en sélectionnant les patients traités pour une
localisation vertébrale dans un contexte de ré-irradiation spinale (code CIM, N° SIRET : 779924133 00019). !
2.2. Critères d’inclusion et d’exclusion
Les patients inclus devaient : être majeurs, avoir un diagnostic histologique de maladie carcinomateuse métastatique et avoir bénéficié d’un scanner et une IRM confirmant l’existence d’une métastase vertébrale.
Les critères d’exclusion étaient l’impossibilité de réaliser une IRM médullaire pour fusion avant planification de la radiothérapie stéréotaxique et l’impossibilité d’obtenir des données précises concernant les doses de radiothérapie délivrées à la moelle lors d’une des deux séances de radiothérapie.
Les patients pouvaient être ou non traités par une thérapie anticancéreuse systémique, quelle que soit la ligne.
2.3. Données cliniques et de toxicité
Pour chaque patient, les données démographiques, histologiques, date d’apparition de la
tumeur primitive, date d’entrée dans la maladie métastatique, date de début et fin de la radiothérapie stéréotaxique, dose et fractionnement de la radiothérapie, date de récidive locale, date de récidive de la douleur, date de progression neurologique, ainsi que le dernier statut vital connu ont été recueillis.
Une évaluation clinique complète comprenant un examen neurologique et une évaluation
de la douleur était systématiquement réalisée lors de la consultation initiale de radiothérapie, pendant toute la durée du traitement de radiothérapie pour les schémas multi-fractionnés, puis à la fin de la radiothérapie lors de la visite de fin de traitement. Concernant la surveillance à distance de la radiothérapie, les données cliniques lors des consultations oncologiques, de radiothérapie, et de médecine de la douleur ultérieures ont été revues pour chaque patient, permettant d’obtenir un suivi régulier de l’évolution clinique. Lors de ces consultations, chaque patient bénéficiait d’une évaluation de l’EVA, et d’un examen neurologique avec grading selon le score OMS. Pour l’évaluation neurologique, nous avons complété le recueil par l’évaluation du score neurologique clinique selon Ryu et al.[3].
Le contrôle local était défini par l’absence de récidive de compression médullaire ou
l’absence de progression tumorale dans le champ d’irradiation. La durée du contrôle local était évaluée en mois depuis l’initiation de la stéréotaxie jusqu’à la date d’échappement, déterminée selon les critères RECIST sur une IRM T1- T2 avec et sans injection de Gadolinium. Les dossiers
radiologiques ont été analysés conjointement par 2 observateurs de façon à assurer un contrôle de qualité des données recueillies.
Le Spinal Instability Neoplasic Score (SINS) tel que défini par Fischer et al.[4] a été
évalué pour chaque patient. Une fois l’instabilité déterminée, le traitement initial était généralement une procédure de stabilisation chirurgicale ou une cimentation du corps vertébral avant la réalisation de la stéréotaxie.
La récidive a été définie par la réapparition soit d’une douleur, soit de symptômes
neurologiques et/ou d’une progression locale sur l’IRM.
La survie sans récidive était définie comme la durée entre l’initiation de la SBRT et la
première documentation de récidive ou de décès.
La survie globale a été évaluée pour chaque patient.
Les toxicités aigües et tardives en particulier les myélopathies, oesophagites et les
fractures vertébrales ont été systématiquement recherchées et gradées selon l’échelle NCI CTCAE version 4.0 (National Cancer Institute Common Terminology Criteria for Adverse Events).
2.4. Technique de radiothérapie stéréotaxique
Tous les patients ont été traités par CyberKnifeTM (Accuray). Les patients réalisaient un scanner de simulation en décubitus dorsal (épaisseur de coupe de 1 mm), suivi d’une IRM en position de traitement pour fusion (épaisseur de coupe de 1.5mm). Les séquences IRM utilisées étaient des séquences T1 STIR pour visualiser la lésion remplaçant la moelle osseuse, T2 pour visualiser l’atteinte épidurale, et T1 injectées au gadolinium pour visualiser l’atteinte méningée.
Les coupes d’IRM axiales étaient ensuite fusionnées au scanner pour permettre une visualisation de l’extension tumorale paraspinale et épidurale et permettre une délinéation précise de la moelle épinière. La méthode de délinéation respectait les recommandations définies par
Cox et al.[5] pour le contourage des volumes cibles. Toute atteinte paraspinale et épidurale était
incluse dans le CTV. Le PTV était défini par l’ajout d’une marge de 2mm autour du CTV sauf au niveau de la moelle ou le PTV était égal au CTV.
Pour les OARs principaux (œsophage et moelle épnière), un PRV de 2 mm était défini. La contrainte de dose était appliquée sur le PRV comme défini ci-dessus. Au niveau de la moelle épinière, en cas d’épidurite compressive, le PRV était réduit à 1 mm car on considérait que celle ci n’était pas mobile dans le canal médullaire.
Le positionnement correct du patient était assuré par contrôle radiologique et par une image KV pré et intra-fraction, en utilisant les corps vertébraux comme repères anatomiques. Le positionnement adéquat du CTV était vérifié continuellement automatiquement (stratégie X-Sight Spine tracking) pendant le traitement par intervalles de 30-60 secondes selon la stabilité du CTV (contrôles intra-fraction). Dans le cas du CyberKnife il s’agit d’un repositionnement semi-rigide qui utilise 37 points de contrôle au niveau du rachis.
2.5. Données physiques
Pour chaque patient, les plans de traitement de la radiothérapie initiale et de la récidive ont été analysés conjointement par 2 observateurs : un physicien et un radiothérapeute. La nature des informations balistiques et dosimétriques disponibles du premier traitement RTC3D pouvait être de deux types : soit dose totale et fractionnement en format papier +/- quelques coupes transverses + /- HDV pour les traitements les plus anciens, soit dose totale et fractionnement avec images CT + Dicom RTplan, RTstructure et RTdose.
Concernant les ré-irradiations, nous avons désarchivé le plan de traitement réalisé dans Multiplan (AccurayTM). Les plans de traitement étaient effectués par planification inverse (appelé
mode séquentiel dans Multiplan), en techniques multifaisceaux à l’aide des cônes fixes. Les contraintes de dose étaient appliquées aux organes à risques (OARs) en termes de dose point maximale (Dmax).
Pour chaque patient et chaque plan de traitement il a été réalisé un relevé de la dose totale, du nombre de fractions et de l'intervalle de temps entre les irradiations. La dose physique au niveau de la tumeur a été relevée et convertie en termes d’EQD2 et de BED en utilisant un α/β de 10
(EQD2/10 et BED10). Les doses physiques (doses point maximales Dmax) à la moelle vraie, au
canal médullaire et à l’œsophage ont été relevées puis convertis en EQD2 et en BED en utilisant
un α/β de 3 (EQD2/3 et BED3) puis un α/β de 2 pour la moelle épinière cercivo-thoracique
(EQD2/2 et BED2) et de 4 pour la moelle lombaire et la queue de cheval (EQD2/4 et
BED4)[14][40]. Le calcul des doses cumulées des 2 traitements reçues aux OARs en EQD2 et en
BED correspond à la dose ponctuelle maximale après réalisation d'une sommation spatiale. Les doses maximales cumulées au OARs ont été obtenues en additionnant le point max à l’OAR d’un plan avec la dose reçue en ce même point par le précédent plan de traitement. L’étalement n'a pas été pris en compte.
Aucun outil de recalage rigide ou non rigide pour le calcul des sommations de dose n’était disponible au Centre, nous avons donc réalisé une somme algébrique.
2.6. Analyse statistique
Les données qualitatives étaient comparées par test E de Fisher et les données quantitatives par test de Student. Les analyses de survie ont été réalisées pour la cohorte entière par test de Kaplan-Meier et les analyses de sous-groupe par Log-rank pour les sous-groupes de patients selon la dose biologique équivalente reçue (BED10). Les patients ont été censurés à la date de la
dernière visite de suivi ou lors du décès. Les analyses ont été réalisées sur logiciel SPSS v20.0 avec un choix de p-value significatif à 5%.
3. RÉSULTATS
3.1. Description de la population
Entre juillet 2011 et décembre 2015, 65 patients (31 hommes et 34 femmes) ont été traités pour 68 ré-irradiations spinales en conditions stéréotaxiques par CyberknifeTM (Accuray Inc., Sunnyvale, CA) au Centre Léon Bérard et au Centre Antoine Lacassagne et ont été évalués dans cette étude (Tableau 1).
L’âge médian des patients était de 65 ans (range : 39-82). L’indice de Karnosky (KPS) médian était de 80. Quatre-vingt-douze pourcent des patients avaient un KPS>70. Les histologies primitives les plus fréquentes étaient les carcinomes mammaires (27.9%), rénaux (20.6%) et pulmonaires (16.2%). Au moment de la réalisation de la radiothérapie stéréotaxique, la maladie primitive était contrôlée chez 85.3% des patients. Il n’existait pas de métastase viscérale pour 29.4% des patients (n=20), un site métastatique viscéral pour 39.7% des patients (n=27), 2 sites pour 26.5% (n=18), 3 sites pour 4.4% (n=3). Au total, il existait moins de 3 atteintes viscérales associées pour 95.6% des lésions traitées (médiane=1). Les métastases spinales étaient étagées de C2 à L4. Les niveaux d’atteinte vertébrales étaient cervicaux 19.1%, thoraciques 53%, lombaires 27.9%. Une atteinte épidurale existait radiologiquement pour 32 lésions (47.1%).
Dans l’ensemble de la cohorte, les patients étaient essentiellement adressés avec un objectif de contrôle de la douleur. C’était le cas pour 85.3% des lésions (n=58). L’EVA médiane avant la réalisation de la SBRT était de 5 (0-7). Les patients étaient traités majoritairement par antalgiques de palier 3 au moment de la stéréotaxie (70%). Il existait un objectif de contrôle neurologique pour 32.4% des lésions (n=22) du fait de la présence d’une épidurite, de radiculopathies invalidantes voire d’une menace de compression médullaire. Il existait un objectif de contrôle
La moelle épinière vraie avait été contourée sur l’IRM de fusion pour 64.7% des lésions (n=44). Le canal médullaire était contouré sur le scanner dosimétrique pour 77.9% des lésions (n=53). Vingt-deux pourcent des lésions ont bénéficiées d’une chirurgie pré-stéréotaxique de type stabilisation (5.9%) ou laminectomie (16.2%). Neuf pourcent des lésions ont bénéficié d’une vertébroplastie pré-thérapeutique (n=6).
Le délai médian entre le diagnostic de la métastase traitée et la réalisation de la SBRT à ce niveau était de 26.5 mois (0.9-140.0). Le délai médian entre la 1ère radiothérapie et la
ré-irradiation par SBRT était de 22.4 mois (1.4-363.6).
Moyenne Médiane Min Max
Âge (ans)
62,35 65 39 82
KPS
82,42 80 40 100
Délai diagnostic primitif-métastase traitée (mois)
49,8 25 0 353
Délai apparition de la métastase-réalisation de la SBRT (mois)
37,9 26,5 0,9 140,9
EVA avant SBRT
4,24 5 0 7
Délai RTH1-SBRT (mois)
48,69 22,4 1,4 363,6
Nombre d’atteintes viscérales
0 20 (29,4 %) 1 27 (39,7 %) 2 18 (26,5 %) 3 3 (4,4 %) Primitif contrôlé Oui 58 (85,3%) Indication de la stéréotaxie Douleur 67 (81,7 %) Contrôle local 72 (87,8 %) Contrôle neurologique 18 (22 %) Localisation Cervicale 13 (19.1%) Thoracique 35 (51.5%) Lombaire 19 (27.9%) Épidurite Oui 32 (47.1%) Thérapeutique pré-SBRT Stabilisation chirurgicale 4 (5.9%) Laminectomie 11 (16.2%) Cimentoplastie 6 (8.8%)
Contours moelle vraie sur IRM de fusion
Oui 44 (64.7%)
Le score neurologique clinique selon Ryu était classé a pour 50% des patients, b pour 27.9%, c pour 10.3% et d pour 7.4% des patients (Tableau 2).
Score clinique de Ryu Signification n %
a Absence de symptôme 34 50
b Symptôme local mineur 19 27.9
c Paresthésie fonctionnelle 7 10.3
d Paresthésie non fonctionnelle 5 7.4
e Paralysie et/ou incontinence 0 0
Tableau 2. Score clinique selon Ryu et al.[3]
Le score neurologique radiologique selon Ryu, évaluant l’atteinte épidurale était de 0 pour 7.4% des lésions, I pour 8%, II pour 11%, III pour 8% et IV pour 2% (Tableau 3). Le score radiologique de Ryu médian avant la SBRT était de 2 (range : 0-4).
Score radiologique de Ryu Signification n %
0 Spine bone 5 7,4
I Thecal sac impinged 8 11,8
II Thecal sac compressed 11 16,2
III Spinal cord impinged 8 11,8
IV Cord displaced, CSF visible 2 2,9
V Cord displaced, CSF not visible 0 0
Tableau 3. Score radiologique selon Ryu et al.[3]
Le score de SINS, évaluant l’instabilité vertébrale avait une valeur médiane de 9 et était <12 pour 83.9% des lésions et <7 pour 23.9% des lésions (Tableaux 4a et 4b).
Score de SINS n %
Stable (0-6) 16 23.5
Potentiellement instable (6-12) 41 60.4
Instable (>12) 9 13.2
Données manquantes 2 2.9%
Tableau 4a. Score de SINS selon Fisher et al. [4] dans la cohorte
Score de SINS Localisation Jonctionnelle 22 32.4% Rachis mobile 20 29.4 % Rachis Semi-rigide 26 38.2 % Rachis Rigide 0 0 Douleur Oui 53 77.9 % Occasionnelle 6 8.8 %
Tableau 4b. Score de SINS selon Fisher et al. [4] détaillé
3.2. Caractéristiques de la première irradiation
Tous les patients avaient bénéficié d’une précédente irradiation par radiothérapie conformationnelle. La dose médiane délivrée lors de la 1ère irradiation était de 30 Gy
2 (10-66) en
10 fractions (1-33). La dose médiane délivrée à la tumeur était de 42.9 Gy10 (20-85.5) en termes
de BED10 et de 35.8 Gy10 (16.7-71.3) en termes d’EQD2/10. La dose maximale Dmax médiane à la
moelle épinière était de 30 Gy (3-54), au canal médullaire de 30 Gy (0-54), à l’œsophage de 30 Gy (2-66) lors de cette 1ère irradiation. La dose médiane par fraction était de 2 Gy (1.8-3 Gy)
(Tableau 5). Dose totale EQD2/10 (Gy) Dose totale BED10 (Gy) Dmax moelle vraie (Gy) Dmax canal médullaire (Gy) Dmax oesophage (Gy) Nombre de fractions Moyenne 39.48 47.4 28.9 26.64 28.7 14.368 Médiane 35.8 42.9 30 30 30 10 Minimum 16.7 20 3 0 4 1 Maximum 71.3 85.5 54 54 33 33
Tableau 5. Caractéristiques de la 1ère irradiation normofractionnée
Lésion osseuse Lytique 47 69.1 %
Mixte 8 11.8 %
Blastic 9 13.2%
Alignement rachidien Subluxation 1 1.5 %
Déformation de novo 7 10.3 %
Normal 58 85.3 %
Tassement vertébral >50 % 11 16.2 %
<50 % 18 26.5 %
Absence de tassement malgré >50 % d’atteinte de corps vertébral 28 41.2 % Absence de tassement 9 13.2 % Atteinte postéro-latérale Bilatérale 7 10.3 % Unilatérale 38 55.9 % Non 19 27.9 % Score global 9 (3-14)
3.3. Caractéristiques de la ré-irradiation par SBRT
La stéréotaxie a été délivrée à une dose médiane de 28 Gy (8-40 Gy) sur une isodose médiane de 80% (70-80). La stéréotaxie était délivrée en 1 à 7 fractions (médiane=5) (Tableau 6).
L’index de conformité médian était de 1.25 (1.05-1.6).
Les protocoles de dose les plus fréquemment appliqués dans la cohorte pour la ré-irradiation en SBRT étaient 25 Gy en 5 fractions (EQD2/10=31.3 Gy), 35 Gy en 5 fractions
(EQD2/10=49 Gy), 30 Gy en 5 fractions (EQD2/10 =40 Gy) et 27 Gy en 3 fractions (EQD2/10 =42.8
Gy). La conversion des différents schémas de dose par le modèle linéaire quadratique (MLQ) retrouvait une dose médiane délivrée à la tumeur (α/β=10) lors de la ré-irradiation par SBRT de 48 Gy10 (14.4-82.3) en termes de BED10 et de40 Gy10 (12-68.6) en termes d’EQD2/10.
La Dmax médiane à la moelle épinière, au canal médullaire et à l’œsophage lors de la
ré-irradiation était de 10.15 Gy3 (3-30.5), 17.3 Gy3 (4-32) et 17.8 Gy3 (4-33) en 1 à 7 fractions
(médiane=5). Dose totale EQD2/10 (Gy) Dose totale BED10 (Gy) Dmax ME (Gy) Dmax CM (Gy) Dmax oesophage (Gy) Nombre de fractions Moyenne 39.263 47.091 11.748 16.89 17.62 4.433 Médiane 40 48 10.150 17.30 17.85 5 Min 12 14.4 3 4 4 1 Max 68.6 82.3 30.5 32 33 7
Tableau 6. Caractéristiques de la ré-irradiation par SBRT
3.4. Sommation des doses
En terme de dose cumulée après sommation des 2 plans de traitement, la dose médiane cumulée à la tumeur était de 98 Gy10 (40-145) en termes de BED10 et de 82.1 Gy2/10 (33.3-120) en
termes d’EQD2/10. (Tableau 7).
EQD2/ 10 sommé tumeur BED10 sommé tumeur
Moyenne (Gy) 78.443 94.09
Médiane (Gy) 82.100 98
Minimum (Gy) 33.3 40
Maximum (Gy) 120.0 145
Tableau 7. Doses cumulées à la tumeur après ré-irradiation spinale par SBRT
76.7 Gy3 (50-101.3), 83.2 Gy3 (25.3-129.3) et 95.8 Gy3 (25-177.5) en terme de BED3 et de 46.9
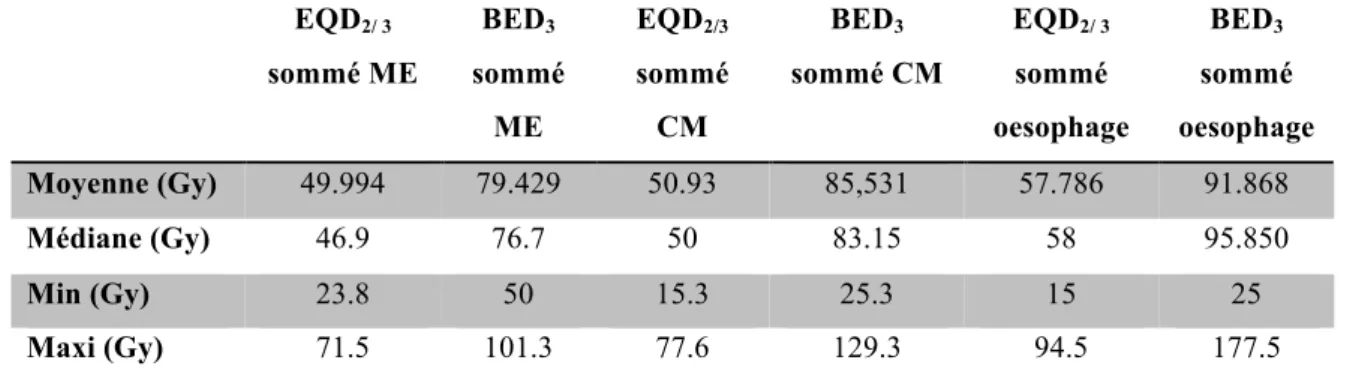
Gy2/3 (23.8-71.5), 50 Gy2/3 (15.3-77.6) et 58 Gy2/3 (15-94.5) en termes d’EQD2/3 (Tableau 8).
EQD2/ 3 sommé ME BED3 sommé ME EQD2/3 sommé CM BED3 sommé CM EQD2/ 3 sommé oesophage BED3 sommé oesophage Moyenne (Gy) 49.994 79.429 50.93 85,531 57.786 91.868 Médiane (Gy) 46.9 76.7 50 83.15 58 95.850 Min (Gy) 23.8 50 15.3 25.3 15 25 Maxi (Gy) 71.5 101.3 77.6 129.3 94.5 177.5
Tableau 8. Doses cumulées aux OARs après ré-irradiation spinale par SBRT (α/β= 3)
En appliquant un α/β= 2 à la moelle cervico-thoracique, la dose médiane cumulée à la moelle épinière vraie et au canal médullaire lors de la ré-irradiation était de 99.6 Gy2 (53-127.7)
et de 100.4 Gy2 (28.1-169.7) en terme de BED2 et de 49.8 Gy2/2 (26.5-63.9), et 50.2 Gy2/2
(14.1-84.9) en termes d’EQD2/2 (Tableau 9).
EQD2/2 sommé ME (Gy2/2) BED2 sommé ME (Gy2) EQD2/2 sommé CM (Gy2/2) BED2 sommé CM (Gy2) Moyenne 49.852 99.689 53.748 107.513 Médiane 49.800 99.6 50,2 100.4 Min 26.5 53 14.1 28.1 Max 63.9 127.7 84.9 169.7
Tableau 9. Doses cumulées aux OARs après ré-irradiation spinale cervico-thoracique (α/β=2)
En appliquant un α/β=4 à la moelle lombaire, la dose médiane cumulée à la moelle épinière vraie et au canal médullaire lors de la ré-irradiation était de 95 Gy4 (53-186.5) et 97.55 Gy4
(28.1-169.7) en terme de BED4 et de 47.5 Gy2/4 (26.5-124.3), et 50.5 Gy2/4 (14.1-84.9) en termes
d’EQD2/4 (Tableau 10).
EQD2/4 sommé ME BED4 sommé ME EQD2/4 sommé CM BED4 sommé CM
Moyenne (Gy) 53.247 102.137 53.6 101.36
Médiane (Gy) 47.5 95 50.5 97.55
Min(Gy) 26.5 53 14.1 28.1
Max (Gy) 124.3 186.5 84.9 169.7
3.5. Survie globale
À la date des dernières nouvelles, 24 (36.9%) des 65 patients étaient décédés. Les taux de survie globale à 1 et 2 ans selon Kaplan-Meier, calculés à partir de la date de la stéréotaxie, étaient de 75% et 52% respectivement. La survie globale médiane était de 27.8 mois (IC 95%=17.7-37.9).
Figure 4. Survie globale dans la cohorte
3.6. Survie sans récidive
Après un suivi médian de 11.3 mois (1-77 mois), 85.3% des lésions algiques étaient contrôlées efficacement, 86.8% des patients adressés pour une menace neurologique ne présentaient pas d’aggravation des symptômes neurologiques et 83.8% des lésions étaient contrôlés localement sur l’imagerie.
À la date des dernières nouvelles, la survie sans récidive (SRR) était de 79.4%. La SSR médiane était de 19 mois (IC95% 9-28.7).
Il existait un meilleur contrôle tumoral pour les tumeurs radiosensibles (seins, poumons, prostate) (22,6 mois - IC95% 21.2-23.9) comparativement aux tumeurs radiorésistantes (carcinomes rénaux, mélanomes) (11 mois, IC 95% 4.9-17.07) (p<0,043 selon le test du Log-Rank).
Figure 6. Survie sans récidive selon l’histologie : radiorésistante ou non
La plus longue survie sans récidive a été obtenue pour une dose délivrée à la tumeur lors de la stéréotaxie de >50 Gy en BED10. La SSR médiane était alors de 24.1 mois versus 11 mois
(IC95% 9.3-28.7, p<0.004 par test de Log Rank).
La BED10 sommé apparaissait également comme un facteur prédictif de contrôle tumoral.
Une plus longue SSR a été obtenue pour une dose cumulée délivrée à la tumeur >100 Gy en termes de BED10 sommé. La SSR médiane était alors de 23.5 mois versus 18.3 mois (IC95%
9.3-28.7, p<0.014 par test de Log Rank). Il n’y avait pas de toxicité surajoutée, en particulier pas de myélite radique.
Figure 8. Survie sans récidive selon la dose délivrée à la tumeur en termes de BED10 sommé après ré-irradiation 3.7. Contrôle local
Au total, 13 des 68 lésions ont présentées un échec radiologique. Les taux de contrôle local à 6 mois et à 12 mois étaient de 94% et 83% respectivement.
Le score radiologique de Ryu post-SBRT était <3 pour 83.8% des lésions.
3.8. Contrôle de la douleur
Quatre-vingt cinq pourcent des patients ont présenté un contrôle de la douleur après stéréotaxie.
3.9. Contrôle neurologique
Quatre vingt-six pourcents des patients adressés avec un objectif de contrôle neurologique ont été contrôlés. La fonction neurologique a pu être évaluée chez chaque patient. Parmi les patients qui présentaient une fonction neurologique normale avant la radiothérapie, tous ont conservé leurs capacités sensitivo-motrices. Le score neurologique clinique selon Ryu post-SBRT était <c pour 86.8% des patients (Tableau 12).
Score clinique post-SBRT selon Ryu n %
a 48 71.6
b 7 10.4
c 4 6
d 6 9
e 2 3
Tableau 12. Score neurologique clinique post-SBRT selon Ryu et al.[3]
Il existait une amélioration significative du score neurologique clinique selon Ryu après SBRT comparativement au même score avant la ré-irradiation. Le score était classé a pour 50% des patients avant SBRT versus 76% après SBRT (p<0.003).
3.10. Focus sur les patients ayant bénéficié d’une BED sommée>120 Gy2 en
cervico-thoracique
Huit lésions cervico-thoraciques (11.7%) ont bénéficié d’une ré-irradiation avec une dose en BED2 sommée >120 Gy2. Il n’y a pas eu de myélite radique ni de fracture vertébrale décrites
au terme du suivi.
Primitif Niveau RTH1 Niveau SBRT EQD2/2 sommée
ME/CM (Gy2/2)
BED2 sommée
ME/CM (Gy2)
Délai (mois) Suivi (mois)
Sein CMI-sus clav D6 NA/81.6 NA/163.2 67 7
Sein CMI-sus clav D4 NA/69 NA/137.9 142 27
Rein D9-D10 D10 NA/67.7 NA/135.4 72 11
Rein D5 D5 NA/72.3 NA/144.7 5 12
Prostate D10-D12 D11 56.7/76.3 113.5/152.7 33 19
Poumon D8 D8 NA/65.8 NA/131.5 15 1
Sein C7 C7 63.9/68.4 127.7/136.8 38 32
Thyroïde D3-D5 D5 62.7/68.5 125.4/137 51 1
Tableau 13. Données techniques des patients ayant bénéficié d’une BED2 sommé> 120 Gy 3.11. Toxicités
3.11.1. Toxicités aigues ( < 6 semaines )
Nous avons recensé 2 oesophagites de grade 1(2.9%) sans autre toxicité de grade >2 dans l’ensemble de la cohorte aux doses prescrites.
3.11.2. Toxicités tardives ( >6 semaines)
Nous n’avons recensé aucun cas de myélopathie radique dans la cohorte au terme de notre suivi avec les doses prescrites.
Six fractures vertébrales post-thérapeutiques ont été notées correspondant à une incidence de 8.8% dans la population.
4. DISCUSSION
La récidive tumorale en territoire irradié proche de la moelle épinière est une situation clinique de plus en plus fréquente et complexe à prendre en charge. Nous devons trouver un
compromis entre le risque de myélopathie radio-induite et les comorbidités inhérentes à l’évolution tumorale vers une épidurite et une compression médullaire.
Cette étude présente à notre connaissance les résultats de la plus importante cohorte française de patients traités pour des ré-irradiations de métastases vertébrales par radiothérapie stéréotaxique et la mieux documentée en terme de précision de recueil de dose aux OARs (Annexes, Tableau 15).
En pratique clinique, le contrôle tumoral est à la fois clinique et radiologique. Concernant l’aspect clinique, dans notre série le taux de contrôle de la douleur était de 86.8% avec un suivi médian de 11.7 mois. Ces résultats sont en accord avec les données de la littérature où les taux de contrôle de la douleur sont autour de 70-85% à 1 an (Tableau 15). Certaines études ont pris le contrôle de la douleur comme critère de jugement principal : Damast et al. [42] ont rapportés un une amélioration significative ou modérée de la douleur chez 46% et 31% des patients,
Milker-Zabel et al.[43] chez 81% des patients et Sterzing et al. [44] ont rapporté une réduction de l’EVA
de 7 à 3 chez les patients traités après 6 mois. Ces résultats correspondent aux nôtres. Néanmoins, il faut souligner l’une des limites de cette étude qui de par son caractère rétrospectif rend l’évaluation de l’EVA discutable.
Sur le plan neurologique, nous retrouvons un maintien des fonction neurologiques chez 86% des patients après ré-irradiation, avec même une amélioration significative du score de Ryu clinique et une efficacité sur les symptômes mineurs de type radiculalgies puisque le score était classé a pour 50% des patients avant SBRT versus 76% après SBRT (p<0.003). Madehavan et
al.[47] qui ont étudié le devenir de 60 patients ré-irradiés pour épidurites progressives ont
rapportés un taux de contrôle ou d’amélioration neurologique de 93% après 1 an de suivi. Ils ont néanmoins décrit l’aggravation de symptômes neurologiques chez 4 patients sur 60 (6,7%), cependant il était également retrouvé chez ces patients une progression radiologique locale pouvant expliquer les symptômes.
Concernant le contrôle local : nos résultats mettent en évidence un taux de contrôle global satisfaisant de 83% à 12 mois. Ces données sont en accord avec celles de la littérature, où les taux de contrôle local s’échelonnent de 63 à 100% après 6 à 21 mois de suivi (Tableau 15).
Dans la plus importante cohorte rétrospective à ce jour (215 patients traités sur 247 lésions), Hashmi et al. ont mis en évidence un taux de contrôle local à 12 mois de 83% après ré-irradiation par SRS (60% des patients - dose médiane : 16.6 Gy - EQD2/10 médian=36.8 Gy) ou
SBRT (40% des patients - dose médiane 24 Gy en 3 fractions - EQD2/10 médian=36 Gy). De
facteur prédictif de contrôle local : à 1 an, le taux de contrôle local était de 90% versus 73% en cas d’hypofractionnement et ce bien que l’EQD2/10 et l’EQD2/10 sommé des 2 modalités de
traitement soient les mêmes (respectivement 36 Gy/66.9 Gy et 36.8 Gy/67.6 Gy). Ce résultat pourrait suggérer que la radiobiologie des doses uniques est plus favorable que celle des schémas hypofractionnés (activation de voies de mort cellulaires différentes, passant notamment par la voie des céramides [41]). Il est également possible que les patients traités en dose unique aient une topographie lésionnelle plus favorable, permettant une meilleure répartition de dose.
Dans la seule étude prospective disponible à ce jour, Garg et al.[27] ont analysés le devenir de 59 patients traités pour 63 métastases rachidiennes. Les doses lors de la ré-irradiation étaient de 30 Gy en 5 fractions ou de 27 Gy en 3 fractions et les contraintes de dose à la moelle épinière étaient de 9-10 Gy au maximum. Avec un suivi médian de 17.6 mois, les auteurs ont rapporté un taux de contrôle local de 76% et un taux de contrôle neurologique de 92% à 1 an.
Nous n’avons pas observé de toxicité majeure, en particulier pas de myélite radique. Dans la littérature, Garg et al.[27] ont mis en évidence la survenue de radiculopathies radiques de grade 3 chez 2 patients (3.3%) traités en L5, qui sont néanmoins restés ambulatoires. En se basant sur l’analyse des récidives, les auteurs ont conclu qu’une chirurgie préalable devait être proposée pour les tumeurs situées à moins de 5 mm de la moelle épinière. Dans leur série de ré-irradiations, Choi et al.[45] retrouvaient un taux de contrôle local de 73% à 12 mois après retraitement par une dose médiane de 20 Gy (10-30 Gy) en 1 à 5 fractions (médiane 2). La dose médiane cumulée à la moelle épinière en EQD2/3 était de 76 Gy3 (32-122 Gy3). Les Dmax à la
moelle épinière (α/β=3) étaient de 10.9, 13.8, 12.5, 12.1, et 12.1 Gy pour des fractions de 1 à 5 séances respectivement. Un cas de myélite radique de grade 4 fut décrit, survenant 6 mois après la fin de la SBRT qui avait délivré 20 Gy en 2 fractions sur l’isodose 80% sur une récidive vertébrale en T5 81 mois après un traitement initial normofractionné ayant délivré 39.6 Gy en fraction de 1.8 Gy de T4 à L1 (EQD2/2 sommé à la moelle épinière = 93.3 Gy2/2 – BED2 sommé =
186.6 Gy2). Hirano et al. [46] ont publié récemment le cas de 3 patients ré-irradiés à 3 reprises
par radiothérapie conformationnelle, Les 2 patients ayant eu 3 irradiations avec une BED2 = 155
Gy au niveau du canal médullaire en dorsal ont un suivi de 167 et 702 jours respectivement, sans myélite. Le 3ème patient avec une BED2 =117 Gy et un suivi de 1644 jours, n’a pas présenté de
myélite non plus. Une étude de Phase II récente sur les ré-irradiations des cancers ORL permettait une dose cumulée à la moelle épinière d’une BED 120 Gy2 sans chimiothérapie
![Figure 1. Limites des traitements en radiothérapie conventionnelle selon le Bone Mets RCT Trial[1]](https://thumb-eu.123doks.com/thumbv2/123doknet/6167806.158346/15.892.214.684.489.829/figure-limites-traitements-radiothérapie-conventionnelle-bone-mets-trial.webp)



![Tableau 2. Score clinique selon Ryu et al.[3]](https://thumb-eu.123doks.com/thumbv2/123doknet/6167806.158346/26.892.108.779.215.353/tableau-score-clinique-ryu-al.webp)