UNIVERSITE DU QUEBEC
Institut National de la Recherche ScientifiqueCentre Institut Armand-Frappier
Étude de l’activité antibactérienne du Pituitary Adenylate
Cyclase-Activating Polypeptide (PACAP)
Par Somia Debbabi
Mémoire présentée pour l’obtention du grade de Maître ès sciences (M.Sc.)
Microbiologie appliquée
Jury d’évaluation
Pr Éric Biron
Examinateur externe Faculté de pharmacie
Université Laval
Examinateur interne Pr Jonathan Perreault
INRS - Institut Armand Frappier
Directeur de recherche Pr Éric Déziel
INRS - Institut Armand Frappier
Codirecteur de recherche Pr David Chatenet
REMERCIEMENTS
Je tiens tout d’abord à exprimer toute ma gratitude à mes parents et mes deux sœurs, vous êtes la source d’amour, de soutien, et de force, qui atténuent le mal de la distance qui nous sépare et me pousse toujours à aller plus loin, merci pour tout ce que vous faites pour moi. Aussi, mon mari, qui a toujours été là pour moi, merci d’avoir fait de cette routine une belle aventure.
Je dois remercier ma fille qui me donne tant d’énergie, d’affection, et de tendresse, tu es la joie de ma vie.
Je veux remercier chaleureusement et infiniment mon directeur de recherche, Éric Déziel qui m’a offert cette opportunité de faire part d’une si belle équipe de travail, merci Éric, pour ta rigueur scientifique, ta disponibilité, ta patience, ta compréhension, et tes qualités humaines, je te suis très reconnaissante.
Mes remerciements s’adressent à mon codirecteur, David Chatenet pour l’aide qu’il m’a apporté tout au long de ce projet, mais aussi pour sa grande disponibilité, sa gentillesse et sa modestie, merci beaucoup David.
Merci aux professeurs Jonathan Perreault et Éric Biron d’avoir accepté de siéger à ce jury de mémoire.
Je souhaite remercier les membres des deux laboratoires que je fréquentais, pour leur aide, et pour l’ambiance agréable le long du projet.
TABLE DES MATIERES
REMERCIEMENTS ... I RÉSUMÉ ... IV ABSTRACT ... V LISTE DES TABLEAUX ... VI LISTE DES FIGURES ... VII LISTE DES ABRÉVIATIONS ... VIII
CHAPITRE 1 : INTRODUCTION ... 1
1.1 LES ANTIBIOTIQUES ... 1
1.2 LES PEPTIDES ANTIMICROBIENS ... 3
1.2.1 Classification des peptides antimicrobiens ... 3
1.2.1.1 Les peptides antimicrobiens cationiques ... 3
1.2.1.2 Les peptides antimicrobiens non cationiques ... 4
1.2.2 Mode d’action ... 5
1.2.3 Mécanismes de résistances aux peptides antimicrobiens ... 10
1.2.3.1 La résistance constitutive... 10
1.2.3.2 La résistance acquise ... 11
1.2.4 Développement clinique des peptides antimicrobiens ... 12
1.2.5 Les magainines... 14
1.3 PITUITARY ADENYLATE CYCLASE-ACTIVATING POLYPEPTIDE (PACAP) ... 15
1.3.1 Structure secondaire du PACAP ... 16
1.3.2 Activité biologique du PACAP ... 17
1.3.3 Passage du PACAP à travers la barrière hémato-encéphalique ... 18
1.3.4 Les récepteurs du PACAP ... 18
1.4 PROBLEMATIQUE : EMERGENCE DE BACTERIES MULTIRESISTANTES AUX ANTIBIOTIQUES DISPONIBLES ... 20
1.5 HYPOTHÈSE ... 21
1.6 OBJECTIFS ... 21
CHAPITRE 2: ARTICLE ... 23
2.3 ABSTRACT ... 25
2.4 ABBREVIATIONS ... 25
2.5 KEYWORDS ... 25
2.6 INTRODUCTION ... 26
2.7 MATERIALSANDMETHODS ... 27
2.7.1 Materials ... 27
2.7.2 Peptide synthesis ... 28
2.7.3 Minimal inhibitory concentration (MIC) measurements ... 28
2.7.4 Membrane and cytoplasmic proteins extraction ... 29
2.7.5 Hemolytic activity ... 30
2.7.6 Circular dichroism analysis ... 30
2.7.7 Molecular dynamic (MD) simulations of membrane-bound PACAP38 and PACAP(9-38) ... 30
2.8 RESULTS AND DISCUSSION ... 31
2.8.1 Antibacterial activity of PACAP38 and PACAP-based derivatives ... 31
2.8.2 Insight into the PACAP38 mode of action ... 35
2.8.3 PACAP(9-38): a potentially selective antimicrobial peptide ... 38
2.8.4 Relationships between the secondary structure and biological activity of PACAP38 and PACAP(9-38) 40 2.9 CONCLUSIONS ... 43
2.10 ACKNOWLEDGMENTS ... 44
RÉSULTATS NON INCLUS DANS L’ARTICLE ... 45
DÉTERMINATION DE LA NATURE DE L’ACTIVITE DU PACAP38 ET DE SES DÉRIVÉS ... 45
CHAPITRE 3: CONCLUSION GÉNÉRALE ET PERSPECTIVES ... 47
RÉSUMÉ
L’émergence des bactéries résistantes aux antibiotiques disponibles et la diminution du nombre de nouveaux agents antimicrobiens continuent d’être des problèmes de santé publique grave et créent un besoin de développer de nouvelles molécules ayant un mode d’action limitant le risque de développer une résistance. L’une des familles de molécules ayant un tel potentiel est celle des peptides antimicrobiens qui sont considérés comme l’un des éléments clés du système immunitaire inné chez les animaux. Il s’agit d’un ensemble
de peptides cationiques et amphiphiles, généralement de 20 à 50 acides aminés, présentant une grande diversité structurale. Ces peptides possèdent un large spectre d’activité antibactérienne et antifongique, voire antivirale. Cette étude s’est intéressée particulièrement au Pituitary Adenylate Cyclase-Activating Polypeptide (PACAP), un
neuropeptides de 38 acides aminés connu pour ses activités neuroprotectrices et qui est également capable d'agir comme un cell penetrating peptide favorisant la translocation de cargos divers. Les objectifs de cette recherche consistaient à démontrer le potentiel antimicrobien du PACAP et ses dérivés structuraux, et de mettre en évidence leurs modes d’action. Ainsi, divers analogues du PACAP à fonction neuroprotectrice active et inactive ont été synthétisés et leur activité inhibitrice contre plusieurs espèces bactériennes a été vérifiée par microdilution afin de déterminer leur concentration minimale inhibitrice (CMI). Une analyse comparative des protéines cytoplasmiques et membranaires extraites des bactéries résistantes ou sensibles, réalisée par MALDI-TOF (Matrix Assisted Laser Desorption Ionization- Time Of Flight), a révélé le site d’action du PACAP, mais aussi a permis de mettre en évidence la métabolisation du PACAP avant la pénétration dans le cytoplasme de certaines bactéries. Ce métabolite (un PACAP tronqué) résultant a été synthétisé et son activité antibactérienne a été confirmée contre le pathogène Burkholderia
cenocepacia J2315. Ce travail a révélé une fonction inattendue pour un neuropeptide et
montre l’importance de poursuivre les recherches visant à concevoir, à partir du PACAP, une molécule pouvant servir de base au développement de nouveaux agents
ABSTRACT
The emergence of bacteria resistant to available antibiotics and the decreasing number of new antimicrobials are concerns for the whole population and create a need to develop new molecules with a mode of action that reduces the risk of resistance development. One of the families of molecules with such potential is that of antimicrobial peptides, which are considered one of the key components of the innate immune system in animals. This is an ensemble of cationic and amphiphilic peptides, composed of 20 to 50 amino acids, with a high structural diversity. These peptides have a wide spectrum of antibacterial, antifungal and even antiviral activity. This study looked specifically at the Pituitary Adenylate Cyclase-Activating Polypeptide (PACAP), a 38 amino acid neuropeptide known for its neuroprotective activities that is also capable of acting as a cell penetrating peptide by promoting translocation of various cargo. The objectives of this research were to demonstrate the antimicrobial potential of PACAP and its structural derivatives and highlight their sites of action. Thus, various PACAP active and inactive analogs were synthesized and their inhibitory activity was verified by microdilution to determine their minimum inhibitory concentration (MIC) against various bacterial species. A comparative analysis of cytoplasmic and membrane proteins extracted from the resistant and susceptible bacteria, performed by MALDI-TOF, elucidated the site of action of PACAP, and allowed to highlight the PACAP metabolization before penetrating into the cytoplasm of certain bacteria. This resulting metabolite was synthesized and its antibacterial activity was confirmed against the pathogen Burkholderia cenocepacia J3215. These results show the importance of continuing work on PACAP which can be the basis for developing new non immunogenic antimicrobial agents
LISTE DES TABLEAUX
Tableau 1 : Tableau récapitulatif des peptides antimicrobiens cationiques classés selon
leur structure ... 4
Tableau 2 : Les peptides antimicrobiens cationiques en développement clinique ... 13 Tableau 3 : Effets physiologiques induits par le PACAP ... 19 Tableau 4 : Minimal inhibitory concentration (MIC) of PACAP and related analogs on
various bacterial strains. ... 33
Tableau 5 : MICa of PACAP and related analogs on homologous bacterial strains. ... 35 Tableau 6 : Mass spectrometry analysis of bacterial compartments following incubation
with PACAP38. ... 37
Tableau 7 : Binding affinity of PACAP38 and PACAP (9-38). ... 38
Tableau 8 : MICa values of PACAP(9-38) against PACAP-sensitive bacteria ... 39
Tableau 9 : CMI* bactéricides et bactériostatiques du PACAP38 et ses dérivés
LISTE DES FIGURES
Figure 1 : Quantités d’antimicrobiens distribuées ou vendues, au Canada, pour
utilisation chez les humains et les animaux selon la population et le poids (2006-2013)..
... 1
Figure 2 : Modes d’action intracellulaires des peptides antimicrobiens sur Escherichia coli ... 6
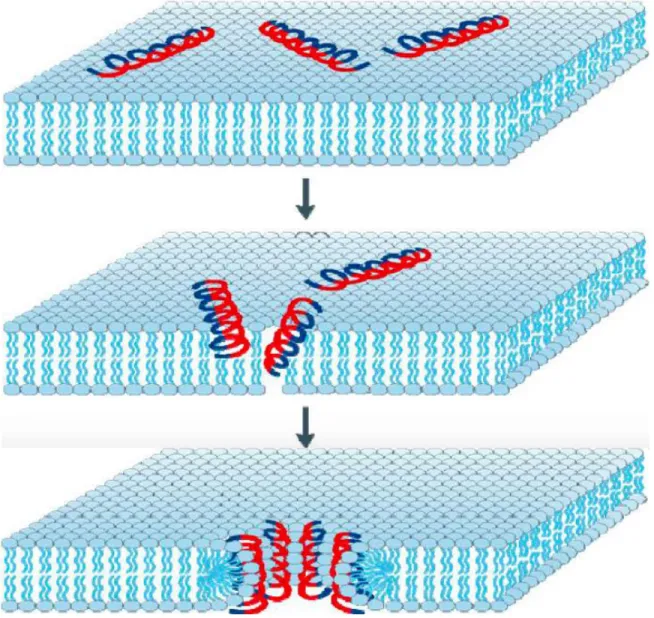
Figure 3 : Modèle illustrant le mécanisme en baril ... 7
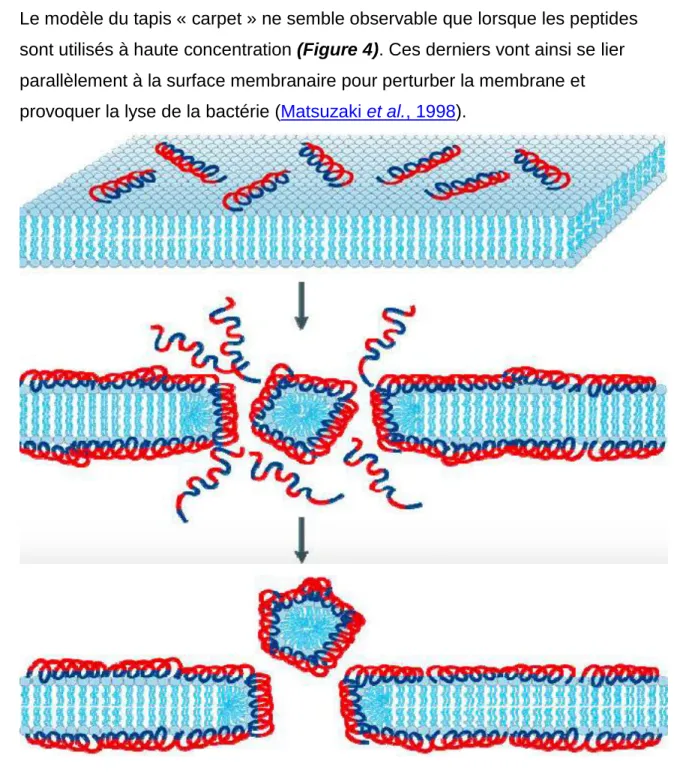
Figure 4 : Modèle d’activité des peptides antimicrobiens en tapis ... 8
Figure 5 : Modèle d’activité des peptides antimicrobiens en pores toroïdaux ... 9
Figure 6 : Représentation en hélice α de la magainine-2 ... 14
Figure 7 : Structure primaire du Pituitary Adenylate Cyclase-Activating Polypeptide.. . 15
Figure 8 : Structure secondaire du PACAP38 . ... 17
Figure 9 : Hemolytic activity of PACAP38 and PACAP(9-38). ... 40
Figure 10 : Circular dichroism analysis of PACAP38 and PACAP(9-38). ... 41
LISTE DES ABRÉVIATIONS
AA Acide Aminé
CMI Concentration Minimale inhibitrice DC Dichroïsme circulaire
FDA Food and Drug Administration
IV Intraveineuse
OMS Organisation Mondiale de la Santé
PACAP38 Pituitary Adenylate Cyclase-Activating Polypeptide à 38 acides aminés PAM Peptides Antimicrobiens
RMN Résonance Magnétique Nucléaire SNC Système Nerveux Central
CHAPITRE 1 : INTRODUCTION
1.1 Les antibiotiques
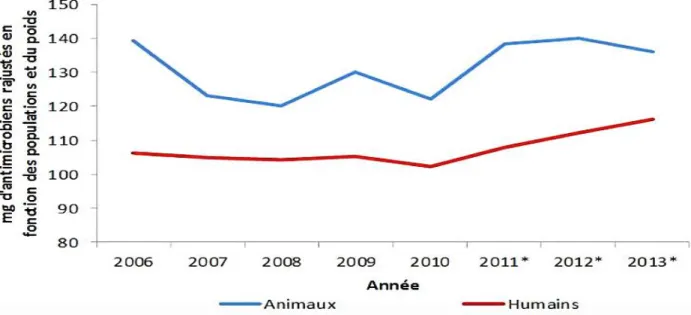
Les antibiotiques sont des composés d’origine naturelle ou synthétique agissant contre les bactéries via plusieurs modes d’action afin de provoquer leur destruction (antibiotiques bactéricides), ou d’inhiber leur multiplication (antibiotiques bactériostatiques). Ces substances ne sont pas exclusives à la thérapie ni à l’être humain, puisque, dans l’alimentation animale, les antibiotiques sont utilisés comme additifs alimentaires. Ils sont alors administrés à faibles doses à titre préventif et servent de facteurs de croissance en modifiant la composition de la microflore intestinale pour une meilleure assimilation des aliments par les animaux et augmentant ainsi leur vitesse de croissance (Viande, science et société-France 2014). La Figure 1 montre la quantité d’antimicrobiens distribuée au Canada en mg, entre les années 2006 et 2013, tout en tenant compte de la population et du poids.
Figure 1 : Quantités d’antimicrobiens distribuées ou vendues, au Canada, pour
utilisation chez les humains et les animaux selon la population et le poids (2006-2013) (Source : Gouvernement du Canada-Rapport 2013)
Plusieurs antibiotiques sont réservés à l’humain qui partage avec l’animal le même environnement et aussi certains antibiotiques. Ainsi, la surconsommation de ces substances et l’arrêt du traitement trop tôt, les ont rendu inefficaces, et ce, suite à l’émergence des bactéries multirésistantes (Organisation mondiale de la santé). Selon la même source (OMS), 8 à 10 millions de cas de tuberculoses apparaissent chaque année, dont 440 000 correspondent à une forme multirésistante causant 150 000 décès (Centre d'analyse stratégique-France 2012). Dans son rapport annuel de 2016, l’agence de la santé publique du Canada rapportait qu’à l’échelle mondiale, des bactéries comme
Staphylococcus aureus, Klebsiella pneumoniae et Escherichia coli démontrent des taux de
résistance allant de 5% à 80% pour les souches testées (Agence de la santé publique du Canada). Au Canada, en 2014, plus de 40% des isolats d’E. coli obtenus à partir des échantillons de poulet présentaient une résistance à la tétracycline, l’ampicilline et la streptomycine (Gouvernement du Canada-Rapport 2013) ) . En effet, l’antibiorésistance est le problème principal lié à la consommation des antibiotiques, mais il n’est pas le seul car l’administration de ces médicaments à des fins curatives peut causer d’autre complications dont la toxicité, ainsi 15% des patients traités aux aminosides sont atteints de vestibulo-toxicité (Fee, 1980) ou encore l’administration des aminoglycosides à de fortes doses peut aboutir à une néphrotoxicité (Smith et al., 1980), On décrit également des pneumopathies alvéolaires liées à la prise des bêta-lactamines (Israël-Biet, 2002), de plus l’administration de ces substances pour soigner une infection peut après un certain temps faciliter la recolonialisation du tube digestif par des bactéries pathogènes (Blaser, 2011). De plus, l’utilisation de ces molécules est accompagnées, dans certains cas, par des épisodes allergiques (Paradis et al., 2009), une étude réalisée en 2009 a fait le lien entre la surconsommation des antibiotiques et le risque de contracter un cancer de la prostate (Tamim et al., 2010).
1.2 Les peptides antimicrobiens
Les peptides antimicrobiens (Jenssen et al., 2006) font partie intégrante du système immunitaire inné des animaux et des végétaux, ils servent à lutter contre les infections qui touchent ces organismes (Andres et al., 2007, Hoffmann et al., 1999). Ces peptides généralement composés de 20 à 50 acides aminés, possèdent souvent un caractère amphiphile (une face hydrophile chargée positivement et une face hydrophobe), qui leur permet de se lier à la membrane bactérienne chargée négativement et de s’y insérer ; en effet, c’est sur ces caractéristiques que repose leur mode d’action principal : l’altération de la perméabilité de la membrane provoquant ainsi une lyse bactérienne (Castro et al., 2005, Guaní-Guerra et al., 2010, Lai et al., 2009, Lemaitre et al., 2007)
1.2.1 Classification des peptides antimicrobiens
Plusieurs classifications ont été établies depuis leur découverte qui remonte au début des années 1920. Aujourd’hui, on compte 2684 peptides dont 2018 sont d’origine animale, 329 d’origine végétale, 266 d’origine bactérienne, 13 provenant des champignons, 8 des protistes, et 4 des archées (The antimicrobial peptide database). Ainsi, une première classification portant sur leur origine a été proposée dans laquelle chaque peptide porte le nom de l’être vivant dont il est originaire, Par exemple, les bactériocines sont issues des bactéries (Cotter et al., 2005), ou encore la bambinine sécrétée par Bombina variegata (amphibien). De nos jours, les peptides antimicrobiens (Jenssen et al.) sont classés selon leur charge globale, peptides cationiques ou non cationiques, et leur structure secondaire (Brogden, 2005).
1.2.1.1 Les peptides antimicrobiens cationiques
Ces derniers sont eux même classés en trois grandes familles en fonction de leur structure primaire et/ou secondaire (Andres et al., 2007), On retrouve ainsi:
Des peptides formants des hélices α comme la Cathélicidine humaine LL-37, un peptide avec une charge nette de +6 qui adopte une structure en hélice α en présence de membrane (Castro et al., 2005),
Des peptides riches en résidus basiques, lysine, arginine, histidine, comme l’histatine (Andres et al., 2007, Diamond et al., 2009),
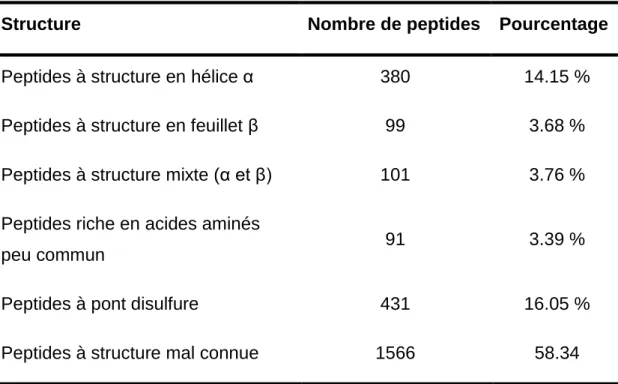
Et des peptides possédant un ou plusieurs ponts disulfures, appelés cycliques telles que les défensines (Wong et al., 2007), Le Tableau 1 dénombre les PAM cationiques classés selon leur structure secondaire.
Tableau 1 : Tableau récapitulatif des peptides antimicrobiens cationiques classés
selon leur structure
(Source: The antimicrobial peptide database-Structure-Wang and Wang, 2004).
1.2.1.2 Les peptides antimicrobiens non cationiques
Ces derniers sont principalement des peptides anioniques. Découverts en 1992 dans le liquide branchoalvéolaire des ovins, ces peptides actifs surtout contre les bactéries à Gram négatif requièrent la présence du zinc pour avoir un bon rendement (Jenssen et al.,
Structure Nombre de peptides Pourcentage
Peptides à structure en hélice α 380 14.15 %
Peptides à structure en feuillet β 99 3.68 %
Peptides à structure mixte (α et β) 101 3.76 %
Peptides riche en acides aminés
peu commun 91 3.39 %
Peptides à pont disulfure 431 16.05 %
un antimicrobien dont les dérivés sont présents dans la sueur humaine en faible concentration (Rieg et al., 2005).
1.2.2
Mode d’action
Secrétés par les cellules épithéliales ou celles du système immunitaire telles que les macrophages et les neutrophiles, les PAM ont un large spectre d’action, agissant ainsi contre les bactéries, les virus enveloppés, les champignons et même des protozoaires (Lai et al., 2009, Powers et al., 2003, Zasloff, 2002). Aujourd’hui, le pouvoir anti-infectieux des PAM a été établi dans certaines pathologies, telles que la maladie de Crohn (Guaní-Guerra et al., 2010), la fibrose kystique (Benincasa et al., 2009), ou encore la dermatite atopique (Schröder et al., 2006), et partiellement démontré pour plusieurs autres maladies.
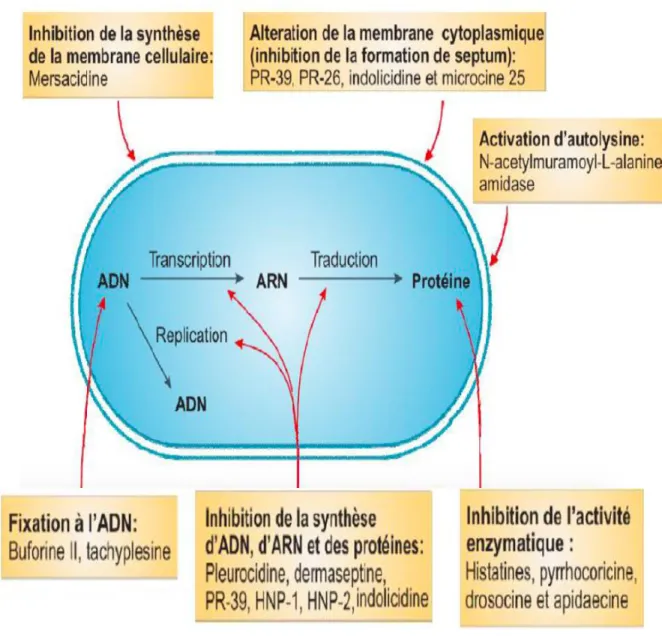
Les PAM agissent selon plusieurs modes d’action. Tout d’abord, ils peuvent être impliqués dans la reconnaissance du soi et du non-soi pour distinguer les cellules hôtes des agents pathogènes. De plus, étant chargés positivement, ils possèdent la caractéristique commune de lier la membrane bactérienne chargée négativement sans altérer les membranes des cellules humaines neutres, ce qui leur permet de cibler seulement les bactéries (Zasloff, 2002). Toutefois, la membrane bactérienne n’étant pas leur unique site d’action (Yeaman et al., 2003), les peptides antimicrobiens, comme par exemple la Buforine, peuvent également agir sur des cibles intracellulaires (Figure 2), agissant ainsi sur la transcription et la réplication de l’ADN d’Escherichia coli (Tossi et al., 2000).
Figure 2 : Modes d’action intracellulaires des peptides antimicrobiens sur Escherichia coli (Source : Bordgen, 2005).
Les peptides antimicrobiens sont capables de se lier à la surface de la membrane bactérienne et d'ainsi induire la lyse membranaire. En fonction de la structure primaire et secondaire des PAM, l’interaction de ces molécules avec la membrane bactérienne peut varier selon quatre modèles.
Le modèle du baril « barrel stave » : est caractérisé par la formation de pores peptidiques transmembranaires qui s’agrandissent et laissent échapper le contenu cytoplasmique provoquant ainsi la mort de la bactérie (Figure 3). Plusieurs peptides, dont l’alaméthicine, agissent selon ce mode (Yeaman et al., 2003).
Le modèle du tapis « carpet » ne semble observable que lorsque les peptides sont utilisés à haute concentration (Figure 4). Ces derniers vont ainsi se lier parallèlement à la surface membranaire pour perturber la membrane et provoquer la lyse de la bactérie (Matsuzaki et al., 1998).
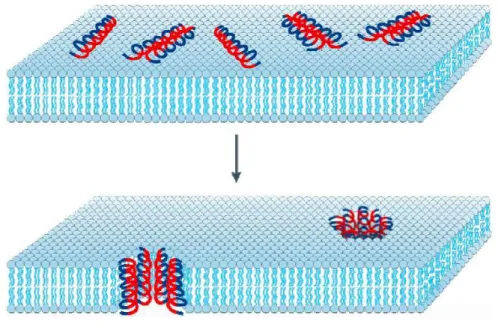
Le modèle de pores toroïdaux est caractérisé par la formation de pores transmembranaires temporaires (Figure 5). Ces derniers sont générés par intercalation des peptides antimicrobiens avec les lipides membranaires provoquant ainsi une lyse bactérienne (Jenssen et al., 2006, Yeaman et al., 2003). Les magainines, par exemple, adoptent ce mode d'action contre les bactéries (Matsuzaki et al., 1998).
Figure 5 : Modèle d’activité des peptides antimicrobiens en pores toroïdaux (Source: Bordgen, 2005).
Le modèle d’agrégat est mal connu par rapport aux autres modèles. Toutefois, il peut expliquer la pénétration des protéines dans le cytoplasme sans avoir à briser la membrane bactérienne (Hale et al., 2007).
Alors que les modèles décrits ci-dessus semblent être les plus impliqués dans l’action des peptides antimicrobiens, ces derniers sont capables de faciliter le recrutement des macrophages au niveau de la membrane bactérienne, provoquant ainsi la phagocytose de la bactérie par un processus d’opsonisation. LL-37 est capable d’agir via ce mécanisme (Nijnik et al., 2009).
1.2.3 Mécanismes de résistances aux peptides antimicrobiens
La découverte révolutionnaire des peptides antimicrobiens a longtemps fait croire que ces molécules pouvaient être des candidats idéals pour de nouvelles thérapies. En effet, la résistance des microorganismes envers ces peptides est peu probable du fait qu’ils font partie de l’immunité innée de l’organisme. De par leur capacité à modifier la réponse inflammatoire locale et à activer les mécanismes d’immunité cellulaire et humorale, les PAM rendent difficile la mise en place de mécanismes de résistance efficaces (Braff et al., 2005). Cependant, une revue datant de 2003 rédigée par Yeaman et ses collaborateurs a cité l’existence d’une résistance bactérienne aux peptides antimicrobiens. Comme dans le cas des antibiotiques classiques, une résistance de type constitutive (passive) et une autre de type inductible (adaptative) ont été caractérisées.
1.2.3.1 La résistance constitutive
Bien que les bases moléculaires de ce type de résistance ne soient pas bien expliquées, les PAM présentent une très faible affinité pour les membranes bactériennes des genres Morganella et Serratia, du fait de la présence de stérols ou de phospholipides peu chargés dans la membrane externe, ou encore du fait de la baisse du potentiel
1.2.3.2 La résistance acquise
Plusieurs mécanismes sont adoptés par les bactéries pour contrer l’action des peptides antimicrobiens à différents niveaux. Par exemple :
La modification de la charge :
Staphylococcus aureus possède un opéron (dlt) comprenant des gènes codant
pour des protéines capables d'ajouter des résidus D-alanine aux acides
téichoïques des peptidoglycanes. Cette modification va estérifier le squelette de l’acide téichoïque entraînant ainsi la réduction de la charge nette négative de la membrane bactérienne(Peschel et al., 1999).
La modification de la fluidité membranaire :
L’augmentation des interactions hydrophobes réduit la fluidité membranaire et donc la sensibilité de la bactérie aux peptides antimicrobiens. À titre d’exemple, la capsule polysaccharidique de Klebsiella pneumoniae lui confère une
résistance à la lactoferricine, en limitant les interactions entre cette glycoprotéine et sa cible membranaire (Campos et al., 2004).
La production d’enzymes protéolytiques :
La sécrétion de protéases et de peptidases par les bactéries représente un autre mécanisme de protection très répandu pour contrer l’action des PAM. Par
exemple, S. aureus secrète une enzyme, l’auréolysine, qui permet la dégradation de la cathélicidine humaine LL37 et donc son inactivation (Sieprawska-Lupa et al., 2004).
Le mécanisme efflux-dépendant :
Ce phénomène, observé par exemple chez Neisseria gonorrhoeae, repose sur un système de pompe à efflux qui entraîne le pompage actif des PAM hors de la bactérie. Ces pompes sont exprimées de façon inductibles en présence des PAM (Shafer et al., 1998, Stumpe et al., 1997).
La modification des cibles intracellulaires :
Plusieurs mécanismes complexes modifiant les cibles intracellulaires ont été observés chez les bactéries résistantes aux PAM. Par exemple la mutation sur le gène gyrB chez E. coli, qui conduit à la résistance de cette dernière à la microcine B17, responsable de l’inhibition de la réplication de l’ADN (del Castillo et al., 2001).
1.2.4 Développement clinique des peptides antimicrobiens
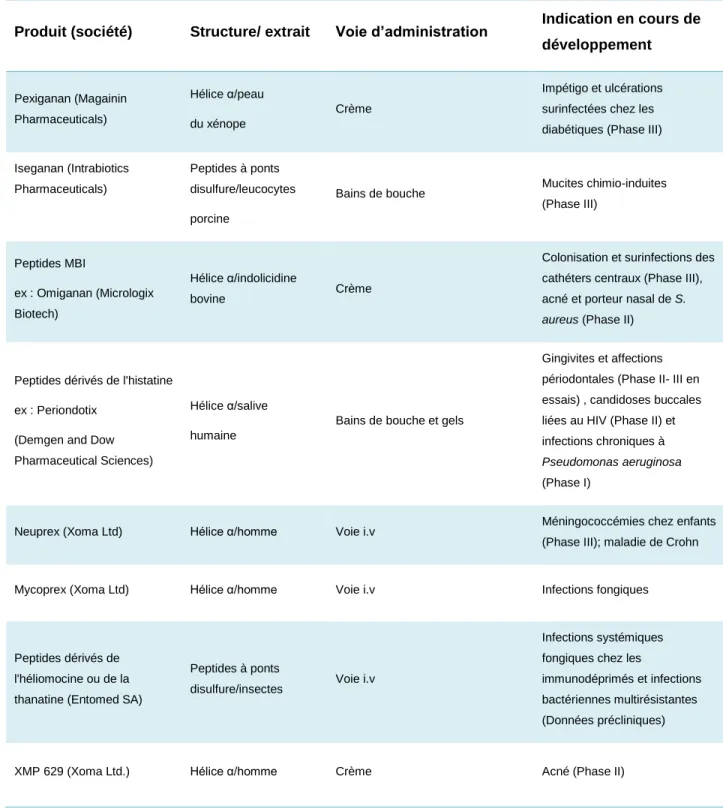
C'est en 1990 qu'a été développé et commercialisé le premier peptide antimicrobien. Ce composé, dérivé des magainines et dénommé Pexiganan, fut introduit dans une crème pour traiter les ulcérations cutanées surinfectées chez les diabétiques (Jacob et al., 1994, Lamb et al., 1998). Après deux études cliniques de phase III, ce traitement s’est malheureusement montré moins efficace que le traitement conventionnel par l'ofloxacine, raison pour laquelle la FDA (Food and Drug Administration) a refusé en 1999 la commercialisation de ce peptide (Lipsky et al., 2008). Cependant, le Locilex ( crème de Pexiganan à 0.8%) a été repris par une autre compagnie et le développement semble continuer (Dipexium pharmaceuticals), Aujourd’hui plusieurs peptides antimicrobiens sont dans les dernières phases de leur développement clinique, principalement sous forme de traitements topiques du fait de leur faible stabilité qui ne leur permet pas d’être pris par voie orale. Le Tableau 2 rassemble les peptides antimicrobiens en cours de développement clinique.
Tableau 2 : Les peptides antimicrobiens cationiques en développement clinique(Source: Andres, 2012)
Produit (société) Structure/ extrait Voie d’administration Indication en cours de développement Pexiganan (Magainin Pharmaceuticals) Hélice α/peau du xénope Crème Impétigo et ulcérations surinfectées chez les diabétiques (Phase III)
Iseganan (Intrabiotics Pharmaceuticals)
Peptides à ponts disulfure/leucocytes porcine
Bains de bouche Mucites chimio-induites (Phase III) Peptides MBI ex : Omiganan (Micrologix Biotech) Hélice α/indolicidine bovine Crème
Colonisation et surinfections des cathéters centraux (Phase III), acné et porteur nasal de S.
aureus (Phase II)
Peptides dérivés de l'histatine ex : Periondotix
(Demgen and Dow Pharmaceutical Sciences)
Hélice α/salive humaine
Bains de bouche et gels
Gingivites et affections périodontales (Phase II- III en essais) , candidoses buccales liées au HIV (Phase II) et infections chroniques à
Pseudomonas aeruginosa
(Phase I)
Neuprex (Xoma Ltd) Hélice α/homme Voie i.v Méningococcémies chez enfants
(Phase III); maladie de Crohn
Mycoprex (Xoma Ltd) Hélice α/homme Voie i.v Infections fongiques
Peptides dérivés de l'héliomocine ou de la thanatine (Entomed SA)
Peptides à ponts
disulfure/insectes Voie i.v
Infections systémiques fongiques chez les
immunodéprimés et infections bactériennes multirésistantes (Données précliniques)
1.2.5 Les magainines
PAM isolés en 1987 à partir d’extraits de la peau de la grenouille (Xenopus laevis) sur la base de leur pouvoir antibactérien observé notamment contre Escherichia coli (Zasloff, 1987). Les magainines 1 et 2 sont des peptides de petite taille, constitués de 23 acides aminés et de faible poids moléculaire (2 KDa), différenciés que par deux résidus situés en position 10 et 22. Toutefois, il existe d’autres magainines possédant entre 21 et 26 acides aminés provenant de la peau ou de l’intestin des amphibiens (Zairi et al., 2009).
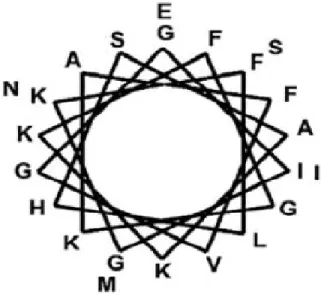
Les magainines appartiennent à la famille des peptides antimicrobiens cationiques à structure en hélice α (Figure 6). En plus de leur pouvoir cicatrisant et anti-inflammatoire (Sai et al., 1995) , ces peptides non hémolytiques possèdent un spectre d’activité étendu, tant contre les bactéries à Gram positif qu’à Gram négatif, les champignons, et mêmes les parasites (Bevins et al., 1990, Zasloff, 1987).
Figure 6 : Représentation en hélice α de la magainine-2 (Source : Gottler et al., 2009).
L’activité des magainines contre les bactéries est très rapide et n’est influencé ni par le pH ni par la température (Zasloff et al., 1988). En effet, ces peptides adoptent le modèle de pores toroïdaux pour perméabiliser la membrane bactérienne (Andres et al., 2007).
1.3 PITUITARY ADENYLATE CYCLASE-ACTIVATING POLYPEPTIDE
(PACAP)
Le Pituitary adenylate cyclase-activating polypeptide (PACAP) est un peptide pleiotropique bioactif qui a été isolé à partir d’hypothalamus ovins, sur la base de sa capacité à stimuler la formation d’adénosine monophosphate cyclique (AMPc) dans les cellules hypophysaires antérieures de rat (Miyata et al., 1989b). Il existe deux isoformes du PACAP, une à 38 acides aminés et une autre à 27 acides aminés. En fait, la biosynthèse du PACAP donne naissance à une forme de 176 acides aminés, cette dernière subit une série de clivages dans des sites caractérisés par la présence de résidus basiques et une amidation pour générer le PACAP38, et de façon similaire se génère le PACAP27 à partir du PACAP38 (Bourgault et al., 2009b, Hosoya et al., 1992, Okazaki et al., 1992) (Figure 7).
Figure 7 : Structure primaire du Pituitary Adenylate Cyclase-Activating Polypeptide. Le site
de clivage interne est représenté par le trait noir (Source : (Bourgault, 2009).
Tout comme le PACAP38, le PACAP27 possède une extrémité C-terminale amide et a aussi été isolé à partir d’extraits d’hypothalamus de moutons. Toutefois, PACAP38 est la forme prédominante du PACAP dans les tissus tandis que PACAP27 n’est présent qu’à 10% en moyenne (Arimura et al., 1991). Ces peptides appartiennent à la superfamille sécrétine/glucagon/Vasoactive intestinal polypeptide (VIP), en raison de leurs similarités
été identifiés chez plusieurs espèces, dont l’homme (Okazaki et al., 1992), le mouton (Miyata et al., 1989a), le poulet (McRORY et al., 1997), ou encore la grenouille (Chartel et al., 1991). L'ensemble des isoformes du PACAP présentent une structure primaire hautement conservée (Sherwood et al., 2000) au cours de l’évolution. En effet, l’extrémité C-terminale n'a subi que très peu de variations alors que le segment N-terminal, impliqué dans les processus de reconnaissance et d'activation, a été totalement préservé au cours du processus évolutif. La préservation de cette structure primaire au cours de l’évolution suggère l’importance du rôle physiologique du PACAP (Bourgault et al., 2009a, Sherwood et al., 2000).
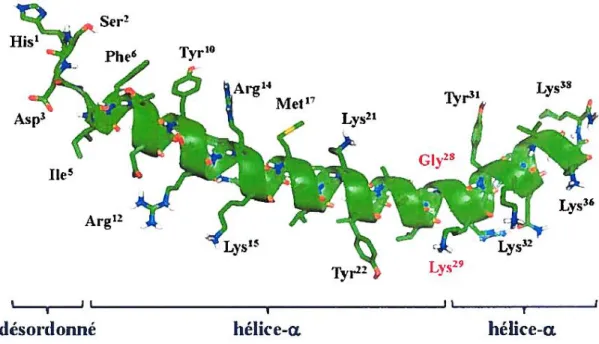
1.3.1 Structure secondaire du PACAP
La structure secondaire du PACAP27 a été caractérisée par dichroïsme circulaire (DC) et résonance magnétique nucléaire (RMN). Ces techniques ont révélé l’existence d’un domaine N-terminal désordonné portant 8 acides aminés, suivi par une région (résidus 9 à 27) relativement bien organisée constituée de 3 domaines : une structure similaire à celle d’un feuillet β retrouvée au niveau de la région 9-12, une structure en hélice α dans les régions 12-20 et 22-25 et un segment désordonné situé dans les régions 21-22 et 25-27 (Inooka et al., 1992). En 1993, Wray et al ont dévoilé la structure secondaire du PACAP38
(Figure 8). Cette étude a ainsi pu mettre en évidence la similarité de structure entre le
PACAP27 et le PACAP38 (Figure 6). En effet, le PACAP38 est composé de huit acides aminés suivis de deux segments en hélice Ser9 à Lys20 et Lys21 à Val26. Le domaine
C-terminal en structure hélicoïdale est rattaché à la région centrale par un connecteur flexible composé des résidus Leu27 et Gly38. En 2007, une étude menée par Sze et ses collègues a
démontré que le PACAP38 adopte une structure amphipathique avec une surface hydrophile et une autre hydrophobe, une caractéristique physico-chimique retrouvée chez les PAM (Sze et al., 2007).
Figure 8 : Structure secondaire du PACAP38 (Source : (Ngoc Duc Doan, 2012).
1.3.2 Activité biologique du PACAP
Etant capable de franchir la barrière hémato-encéphalique (Banks et al., 1993), le PACAP est largement distribué dans le système nerveux central (SNC) ainsi que dans les organes périphériques, dont le pancréas, le système respiratoire, le système reproducteur, cardiovasculaire, et bien d’autres organes périphériques. En accord avec sa distribution, le PACAP est impliqué dans plusieurs fonctions biologiques. Au niveau du SNC, le PACAP peut agir comme une neurohormone, un neurotransmetteur, et un facteur trophique(Bourgault et al., 2009a, Vaudry et al., 2009). Il est aussi capable d’induire des effets physiologiques au niveau de l’hypophyse, des gonades, des glandes endocrines, du système respiratoire, digestif, cardiovasculaire, urinaire et immunitaire (Vaudry et al., 2009). Le Tableau 3 résume les différents effets physiologiques induits par le PACAP.
1.3.3 Passage du PACAP à travers la barrière hémato-encéphalique
La barrière hémato-encéphalique est une barrière physiologique entre lacirculation sanguine et le SNC. Elle est composée de cellules endothéliales qui sont reliées entre elles par des jonctions serrées. C’est un filtre extrêmement sélectif qui protège le cerveau contre les agents pathogènes, les toxines.
PACAP27 et PACAP38 sont capables de traverser cette barrière de façon bidirectionnelle (Banks et al., 1993). Toutefois, il a été démontré que PACAP38 traverse la barrière hémato-encéphalique plus rapidement au niveau de l’hypothalamus et de l’hippocampe comparativement aux autres régions du cerveau (Nonaka et al., 2002).
1.3.4 Les récepteurs du PACAP
Trois récepteurs appartenant à la famille des récepteurs couplés aux protéines G ont été caractérisés pour le PACAP, les récepteurs VPAC1 et VPAC2 possèdent une affinité similaire envers le Vasoactive Intestinal Peptide (VIP) ainsi que les deux formes moléculaires du PACAP, alors que le récepteur PAC1 semble être associé à une
activité biologique du PACAP supérieure à celle du VIP (Bourgault et al., 2009b, Vaudry et al., 2009).
Tableau 3 : Effets physiologiques induits par le PACAP.(Source : (Ngoc Duc Doan, 2012)
Tissus / organes Effets biologiques
Système nerveux central Neurotransmetteur ou neuromodulateur régulant la sécrétion de
neurohormones hypophysiotropes.
Stimulation de la libération d’ocytocine et de vasopressine.
Stimulation de la synthèse de somatostatine, de gonadolibérine (GnRH) et de corticolibérine (CRF).
Stimulation de la sécrétion de la mélatonine.
Anti-apoptotique.
Hypophyse Stimule la libération de :
hormone de croissance (GH).
hormone lutéinisante (LH).
hormone folliculo-stimulante (FSH).
Système reproducteur Stimulation de la sécrétion de testostérone. Stimulation de la sécrétion d’oestradiol.
Implication dans la spermatogénèse.
Stimulation de la synthèse de progestérone.
Stimulation de la maturation d’ovocyte.
Inhibition de l’apoptose folliculaire.
Système respiratoire Relaxation des muscles lisses de la trachée. Bronchodilatation.
Système digestif Foie : stimulation de la libération de glucose.
Pancréas : stimulation de la sécrétion d’insuline et de glucagon.
Duodénum : stimulation de la sécrétion de bicarbonate.
Stimulation de la sécrétion de la salive.
Relaxation des muscles lisses gastriques.
Système cardiovasculaire Vasodilatation (yeux, peau, testicules,...).
Augmentation du débit cardiaque et de la force de contraction ventriculaire.
Système immunitaire Implication dans la réaction inflammatoire. Modulation de la synthèse des cytokines.
Glande thyroïde Stimulation de la sécrétion de thyroxine. Glande surrénales Stimulation de la libération de catécholamines
1.4 PROBLEMATIQUE : EMERGENCE DE BACTÉRIES
MULTIRÉSISTANTES AUX ANTIBIOTIQUES DISPONIBLES
Les maladies infectieuses furent l’une des principales causes de décès chez l’homme jusqu’à la découverte de la pénicilline en 1928, un événement qui a surtout révolutionné le traitement des maladies infectieuses (Van Epps, 2006). C’est ainsi que se sont succédées les découvertes des autres antibiotiques servant aux traitements des maladies d’origines bactériennes. Toutefois, plusieurs bactéries ont muté pour donner naissance à des souches résistantes aux antibiotiques, car l’antibiorésistance est un phénomène naturel qui a été accéléré par la mauvaise utilisation des antibiotiques chez l’homme et chez l’animal. En fait, la résistance aux antibiotiques est à l’origine d’hospitalisations prolongées et entraîne l’augmentation du taux de la mortalité mais aussi des dépenses de santé, ainsi que la charge financière pesant sur les familles et la société. À titre d’exemple, dans l’union européenne, l’OMS estime que les bactéries pharmacorésistantes sont responsables de 25 000 décès par année, avec un coût qui s’élève à plus de 1,5 milliards de dollars (US) ( OMS). De ce fait, ce phénomène constitue l’une des plus graves menaces au niveau mondial qui risque de faire reculer le monde d’une centaine d’années dans le domaine des maladies infectieuses où les traumatismes mineurs et les infections courantes pourraient redevenir mortels.
Il y a donc un besoin pressant de découvrir de nouveaux agents, de nouvelles cibles et des nouveaux modes d’actions différents de ceux adoptés par les antibiotiques présentement disponibles. Une famille de molécules qui est très prometteuse à cet égard est celle des PAM naturels.
1.5 HYPOTHÈSE
Comme mentionné précédemment, le PACAP est un peptide de petite taille (38 acides aminés) et de faible poids moléculaire (4,5 KDa) ; présentant un caractère fortement basique dû à sa richesse en résidus arginine et lysine qui lui confère une charge globale positive de +11. Ce dernier est aussi doté d’une structure hélicoïdale avec une face hydrophile et une autre hydrophobe (caractère amphipathique). Ces caractéristiques, souvent rencontrées chez les peptides antimicrobiens sont essentielles à l’activité antimicrobienne de ces peptides. Puisque le PACAP agit aussi comme un cell penetrating
peptide capable de transloquer plusieurs cargos moléculaires, dont les acides nucléiques
et les petites molécules thérapeutiques, sans altérer l’intégrité de la membrane plasmique des cellules vivantes, nous avons émis l’hypothèse que ce dernier ou des analogues dérivés pourraient agir comme des PAM.
1.6 OBJECTIFS
Afin de valider l’hypothèse énoncée précédemment, trois objectifs ont été établis :
Démontrer que le PACAP38 possède des propriétés antibactériennes, pour ensuite déterminer sa concentration minimale inhibitrice (CMI) contre divers bactéries.
Évaluer des dérivés actifs et inactifs (du point de vue de sa fonction
neuroprotectrice) du PACAP38 en vue d’une conception rationnelle de nouveaux composés.
Finalement, déterminer le mode d’action associé aux activités antibactérienne du PACAP38 ou de ses dérivés.
ARTICLE
Antibacterial Properties of the Pituitary Adenylate
Cyclase-Activating Polypeptide: A New Human
CHAPITRE 2: ARTICLE
Titre
Antibacterial Properties of the Pituitary Adenylate Cyclase-Activating Polypeptide: A New Human Antimicrobial Peptide
Auteurs
Soumaya Debbabi, Marie-Christine Groleau, Myriam Létourneau, Chitra Narayanan, Laura-Lee Gosselin, Jacinthe Gagnon, Nicolas Doucet, Eric Déziel and David Chatenet
Journal
BBA-General Subjects
Etat actuel
2.1
CONTRIBUTIONS A L’ARTICLE
Les résultats obtenus ont mené à la soumission d’un article dans BBA Journal-General Subjects. La majorité du travail a été effectuée par Somia Debbabi à savoir les tests de sensibilité, et la détermination du site d’action du PACAP38, Marie-Christine Groleau a réalisé les tests préliminaires, Myriam Létourneau a synthétisé les différents peptides, le test de liaison a été réalisé par Laura-Lee Gosselin, la dynamique moléculaire a été testée par Chitra Narayanan, et le dichroïsme circulaire a été réalisé par Jacinthe Gagnon. La première version du manuscrit a été rédigée par Somia Debbabi. David Chatenet a révisé et a rédigé la version finale du manuscrit, Eric Déziel a supervisé les travaux et a révisé le manuscrit.
2.2 RÉSUMÉ
Le Pituitary Adenylate Cyclase-Activating Polypeptide (PACAP), un neuropeptide polycationique, amphiphile et hélicoïdal, est bien connu pour son activité neuroprotectrice et ses propriétés de pénétration cellulaire. Dans la présente étude, nous avons évalué la propriété antibactérienne du PACAP38 et ses analogues structuraux contre diverses souches bactériennes. Nous avons ainsi pu mettre en évidence que le PACAP38 et ses analogues peuvent inhiber la croissance de plusieurs bactéries, notamment Escherichia
coli JM109, Bacillus subtilis PY79 et le pathogène Burkholderia cenocepacia J2315.
L'étude du mécanisme d'action a suggéré qu'un métabolite du PACAP, identifié comme le PACAP(9-38), pourrait être responsable de l'action antibactérienne du PACAP38. De manière surprenante, PACAP(9-38), lequel n'induit l'hémolyse d’érythrocytes humaines, présente une spécificité accrue vis-à-vis la souche Burkholderia cenocepacia J2315, par rapport à d'autres bactéries testées. La prédisposition du PACAP(9-38) à adopter des conformations en π-hélice plutôt que des conformations α-hélicoïdale comme PACAP38 pourrait expliquer ce gain de spécificité. Dans l'ensemble, cette étude a révélé une nouvelle fonction pour le PACAP38 et ses dérivés structuraux qui peut être ajoutés à ses activités biologiques pléiotropiques. Cette étude novatrice pourrait donc ouvrir la voie au
2.3 ABSTRACT
The Pituitary Adenylate Cyclase-Activating Polypeptide (PACAP), a polycationic, amphiphilic and helical neuropeptide, is well known for its neuroprotective actions and cell penetrating properties. In the present study, we evaluated the potent antibacterial property of PACAP38 and related analogs against various bacterial strains. Interestingly, PACAP38 and related analogs can inhibit the growth of various bacteria including Escherichia coli JM109, Bacillus subtilis PY79, and the pathogenic Burkholderia cenocepacia J2315. Investigation of the mechanism of action suggested that a PACAP metabolite, identified as PACAP (9-38), might indeed be responsible for the observed PACAP38 antibacterial action. Surprisingly, PACAP (9-38), which does not induce haemolysis, exhibits an increased specificity toward Burkholderia cenocepacia J2315, compared to other tested bacteria. Finally, the predisposition of PACAP(9-38) to adopt a π-helix conformation rather than a α-helical conformation like PACAP38 could explain this gain of specificity. Overall, this study has revealed a new function for PACAP38 and related derivatives that can be added to its pleiotropic biological activities. This innovative study could therefore pave the way toward the development of new therapeutic agents against multiresistant drug bacteria and more particularly the Burkholderia cepacia Complex.
2.4 ABBREVIATIONS
CD: Circular dichroism; DPPC: 1,2-dipalmitoylphosphatidylcholine; PAC1: pituitary adenylate cyclase-activating polypeptide type 1 receptor; PACAP27: 27-amino acid isoform of PACAP; PACAP38: 38-amino acid isoform of PACAP; VIP: vasoactive intestinal peptide; VPAC1: VIP/PACAP type 1 receptor; VPAC2: VIP/PACAP type 2 receptor.
2.5 KEYWORDS
PACAP38, Burkholderia cenocepacia J2315, Antimicrobial peptide, Bacillus subtilis, PACAP(9-38).
2.6 INTRODUCTION
Increased worldwide resistance of pathogenic bacteria to available antibiotics represents a situation of growing concern (Watkins et al., 2016).Based on their broad spectrum of activities and their usually non-immunogenic action, antimicrobial peptides (AMPs), isolated from various species including plants, mammals, insects, and marine invertebrates (Wang et al., 2004),represent promising alternatives to traditional antibiotics. Natural antimicrobial peptides are relatively short polypeptides, fewer than 60 amino acid residues, which generally possess a positive net charge and amphipathic properties upon interaction with membranes (Splith et al., 2011). Based on their structural (linear or helical) and biochemical bases (presence or absence of cysteine or over-representation of proline, arginine, tryptophan and histidine), antimicrobial peptides can be divided into at least five different groups (Rotem et al., 2009). Several companies have intensified their efforts to commercially develop AMPs, many of which are now in clinical trials (Fox, 2013). However, their clinical use in human remains limited to topical applications since AMPs are usually toxic or metabolically unstable when injected into the bloodstream (Midura-Nowaczek et al., 2014). Recently, the discovery of bacteria resistant to colistin, the antibiotic of last resort for many multidrug resistant bacteria was reported (Liu et al., 2016), further prompting the discovery of new treatments to fight a growing number of infections evading the latest generations of antibiotics.
The pituitary adenylate cyclase-activating polypeptide is a 38 amino acid peptide (PACAP38) that belongs to the vasoactive intestinal polypeptide (VIP)-glucagon-growth hormone releasing factor-secretin superfamily (Vaudry et al., 2009). This peptide, well
known for its pleiotropic activities in humans, mediates its biological activities through the activation of three G protein-coupled receptors, named PAC1, VPAC1, and VPAC2 (Vaudry et al., 2009). Notably, PACAP38 and its analogs, mostly synthetic agonists, are currently regarded as promising candidates for the treatment of neurodegenerative disorders and brain trauma (Bourgault et al., 2009a). The recent discovery of intracellular PACAP38 receptors in the brain and the testis as well as the physicochemical characteristics of
evaluate the propensity of PACAP38 to cross the plasma membrane in a receptor-independent manner (Ngoc-Duc Doan et al., 2012). We demonstrated the cell penetrating properties of PACAP38, which led to the development of a potent PACAP38-based cell penetrating peptide, [Arg17]PACAP(11-38), with no cytotoxic effect on various eukaryotic cells including CHO-K1. Based on this unique property, and since most AMPs exhibit similar physicochemical and structural characteristics, we hypothesize that PACAP38 and its related derivatives can exert antimicrobial activities and therefore represent a new template for the development of a new class of innovative AMPs.
In this study, the antibacterial potential of PACAP38 as well as some selected derivatives was tested against various Gram-positive and Gram-negative bacteria. Our results demonstrate the potent antibacterial activity of PACAP38 against various bacterial strains, helping us identify a lead template, i.e. PACAP(9-38), that appears to be specific against Burkholderia cenocepacia, an epidemic pathogen of cystic fibrosis patients.
2.7 MATERIALS AND METHODS
2.7.1 Materials
Fmoc-protected amino acids, Rink-amide AM resin and BOP (benzotriazol-1-yloxy)
tris (dimethylamino) phosphonium hexafluorophosphate) reagent were purchased from
Chem-Impex (Wood Dale, IL, USA). Solvents for solid phase peptide synthesis and purification were obtained from Tekniscience (Terrebonne, QC, CAN) whereas trifluoroacetic acid (TFA) was from PSIG (Montreal, QC, CAN). Na125I was purchased from
Perkin Elmer (Montreal, QC, CAN). Other chemicals as well as cell culture media were obtained from Sigma-Aldrich (Mississauga, ON, CAN) and Fisher Scientific (Nepean, ON, CAN). The culture media were purchased from BD Difco (Mississauga, ON, CAN).
2.7.2 Peptide synthesis
The synthesis of PACAP38 and related analogs have been reported elsewhere (Vaudry et al., 2009). Magainin-2 was synthesized by solid phase peptide chemistry using the Rink-amide AM resins as a solid support and standard Fmoc/tBu chemistry. Couplings of the protected amino acids were mediated by BOP (3 eq) and DIPEA (4.5 eq) in DMF for 1 h. Coupling efficiency was monitored with the qualitative ninhydrin test and a 3 equivalent excess of the protected amino acids based on the original substitution of the resin (0.53 mmol.g-1) was used in most cases. Fmoc removal was achieved with 20% piperidine in
DMF for 20 min. Peptide cleavage was achieved at room temperature using a mixture of TFA/ethanedithiol/phenol/water (92/2.5/3/2.5) for 3 h. The diethyl ether-precipitated crude peptides were purified on a preparative RP-HPLC using a Phenomenex C18 Gemini column
and the collected fractions were analyzed concomitantly by analytical RP-HPLC, performed on a Phenomenex C18 Jupiter column, and MALDI-TOF mass spectrometry using
α-cyano-4-hydroxycinnamic acid as matrix (Voyager DE, Applied Biosystems). Fractions corresponding to the desired product and a purity higher than 95% were finally pooled and lyophilized.
2.7.3 Minimal inhibitory concentration (MIC) measurements
Assays were performed according to the CLSI microdilution method (Wikler, 2006). Briefly, the bacterial strains were inoculated and allowed to reach an OD600 of 0.08-0.13
prior to dilution to 106 CFU/mL in Mueller-Hinton broth (MHB). A bacterial suspension (50
µL) was then added to each wells of a 96-well microplate containing serially diluted peptide solutions (50 µL in MHB) and incubated at 37˚C for 20 h. A well containing sterilized medium was used as a sterility control and another well containing no added peptide served as a growth control. The MIC endpoint, expressed in µg/mL, represents the lowest concentration of PACAP38 or related analogs at which no visible bacterial growth was observed after the incubation time.
2.7.4 Membrane and cytoplasmic proteins extraction
Burkholderia cenocepacia strains J2315 and K56-2 membrane and cytoplasmic
proteins extraction was performed as previously described with some modifications (Chung et al., 2007). Bacteria were grown in 8 mL of Tryptic soy broth (TSB) OD600 of 2 and then
PACAP38 (200 µg/mL) was added to the cultures for 1 h. The treated culture was then centrifuged at 7,000 X g for 15 min at 4°C and the supernatant discarded. The resulting pellet was resuspended in 500 μL cold Tris-HCl (10 mM; pH 8) containing 20% sucrose (w/v), frozen at -20°C and then thawed to facilitate bacterial cells disruption. Following the addition of DNase (50 μg/mL), bacteria were lysed by Fast-Prep 24MPBio using 0.1mm glass beads (4.5 m/s, 60s). The suspension was then centrifuged at 10,000g for 30 min at 4°C and the supernatant, containing the cytoplasmic proteins, recovered and kept at 4°C until use. The beads were then mechanically removed by pipetting and the remaining pellet was ultracentifuged in a sucrose gradient (50% and 70%) at 100,000 X g overnight at 4ºC in order to separate the inner (eluting between 20% and 40% of the sucrose gradient) and outer (eluting between 50% and 70% of the sucrose gradient) bacterial membranes. The resulting membrane fractions were collected in a minimum volume of water and kept at 4°C until use. A similar procedure was used to extract membrane and cytoplasmic proteins from
Bacillus subtilis strains PY79 and 2597 (Gerhardt, 1994). Briefly, Bacillus subtilis strains were grown in 8 mL of Tryptic soy broth (TSB) to an OD600 of 2 and then PACAP38 (200
µg/ml) was added to the cultures for 1 h before centrifuging at 8,000 x g for 10 min at 4ºC; finally, the pellet was washed twice with water. Bacterial cells lysis was then performed by FastPrep and the different protein extracts were isolated as described above, and kept at 4°C until use.
Finally, the presence of PACAP or its metabolites in those different protein extracts was investigated by Matrix-Assisted Laser Desorption/Ionization Time-of-Flight (MALDI-TOF) mass spectrometry using α-cyano-4-hydroxycinnamic acid as the matrix.
2.7.5 Hemolytic activity
Blood from healthy human volunteers was collected into sodium citrate-buffered vacutainers. Red blood cells were pelleted (700g; 10 min), washed three times with 9 volumes of PBS by centrifugation (700g; 10 min), and then resuspended in a volume of PBS. Cell suspensions (1 mL of final suspension) were incubated with different concentrations of peptide, ranging from 10-9 to 10-5 M, for 1 h at 37°C with occasional
mixing by inversion. PBS-incubated red blood cells were considered as negative control and maximum lysis of erythrocytes was obtained by incubating the cells with 0.1 % (v/v) Triton X-100. At the end of the incubation period, cells were pelleted (700 X g, 10 min) and 100 µL of each supernatant was used to evaluate the release of hemoglobin by measuring the absorbance at 545 nm. Results were obtained from 3 independent experiments performed in triplicate.
2.7.6 Circular dichroism analysis
Circular dichroism (Ge et al.) spectra were recorded at room temperature from 189 to 250 nm, using a 1 mm optical path length with a 0.1 nm step, a 1 nm bandwidth, and an integration time of 4 s on a Jasco J-815 Circular Dichroism (Ge et al.) Spectropolarimeter (Easton, MD, USA). Each spectrum represents the mean of three scans corrected for solvent contribution. A digital low-pass filter was used as a smoothing routine. Peptides were dissolved in 20 mM KH2PO4 (pH 7.0) at a final concentration 0.2 mg/mL.
2.7.7 Molecular dynamic (MD) simulations of membrane-bound
PACAP38 and PACAP(9-38)
MD simulations of the DPPC membrane-bound conformations of PACAP38 and PACAP(9-38) peptides were performed to characterize the secondary structural characteristics of the membrane-bound peptides. All simulations were performed under
the GROMOS96 53A6 forcefield (Oostenbrink et al., 2004), while the lipids were described using the modified Berger forcefield parameters (Berger et al., 1997) for use with the GROMOS96 53A6 forcefield. The peptides were aligned parallel to the surface of the lipid bilayer and solvated with SPC water. Chloride ions were added to neutralize the charge of the system. The simulation system consisted of 2x64 DPPC lipids, one peptide (PACAP38 or PACAP(9-38)), and ~ 7000 water molecules. The initial system box size was set to 6.4 nm x 6.4 nm x 9.5 nm. The systems were first energy minimized using the steepest descent method, followed by short equilibration runs before the long MD simulations. Two sets of simulations were performed for each of the two membrane-bound peptide systems (PACAP38 and PACAP(9-38)), corresponding to a total of 4 x 300 ns runs.
The temperature was set to 323 K using the Nose-Hoover thermostat with a coupling constant of 0.5 ps. The pressure was applied semi-isotropically and maintained using the Parinello-Rahman pressure coupling. All bonds and angles were constrained using the LINCS algorithm (Hess et al., 1997) and the particle mesh Ewald (PME)(Darden et al., 1993) method with a grid spacing of 0.16 nm was used for long-range interactions. The α-helical coordinates of micelle-bound PACAP38 (PDB: 2D2P), determined by NMR, were used as the starting conformation of the peptide. The structure of PACAP(9-38) was obtained by truncating PACAP38 to remove the first eight residues. The DPPC coordinates were taken from http://moose.bio.ucalgary.ca. Analysis of secondary structural propensity of the peptides along the simulation trajectory were performed using DSSP (Kabsch et al., 1983)
2.8 RESULTS AND DISCUSSION
2.8.1 Antibacterial activity of PACAP38 and PACAP-based derivatives
The physico-chemical characteristics of PACAP38, i.e. extended α-helix containing 11 basic residues (Vaudry et al., 2009), as well as its cell-penetrating properties (Ngoc-Duc Doan et al., 2012), a characteristic often associated with antimicrobial activity, prompted us to evaluate the propensity of PACAP to exert antibacterial activity. Hence, PACAP38 (1)capacity to inhibit the growth of various bacterial strains. Selected PACAP38 analogs were chosen based on their improved metabolic stability, i.e. N-hexanoyl-PACAP38 (2), [Ala15]
PACAP38 (3), [Ala20]PACAP38, [Ala21]PACAP38 (5), [Ala14,20]PACAP38 (6) (Bourgault et
al., 2008), or their inability to bind and activate PACAP38 cognate receptors, i.e. [Tic6]PACAP38 (7) and [Tic6]PACAP27 (8) (Bourgault et al., 2009a)As shown in Table 1,
compounds 1-8 have a very weak or no antibacterial activity against Pseudomonas
fluorescens (MF37), Pseudomonas aeruginosa (PA14), Burkholderia thailandensis
(ATCC700388), Serratia marcescens (ATCC14756), Bacillus cereus (ATCC11778), and two Staphylococcus aureus strains (ATCC6538 and Newman), all showing a minimal inhibitory concentration (MIC) over 200 μg/mL. In the same assay, the reference AMP Magainin-2, which assumes an amphiphilic helix when bound to acidic phospholipids just like PACAP38 (Gesell et al., 1997), was also unable to inhibit the growth of those strains
(Table 4). Interestingly, we uncovered seven bacteria, including Pseudomonas putida
(KT2440), Escherichia coli (JM109), Burkholderia cenocepacia (J2315), Bacillus circulans
(LSPQ3543), Actinobacillus pleuropneumoniae, Bacillus subtilis (PY79), Bacillus
velezensis, and Bacillus amyloliquefaciens, that are sensitive to PACAP38 and/or its
related analogs (Table 4). Notably, Burkholderia cenocepacia (J2315) and Bacillus subtilis
(PY79) are highly sensitive to PACAP38 and its derivatives, displaying MIC values ranging from 2 to 40 μg/mL.
Table 4 : Minimal inhibitory concentration (MIC) of PACAP and related analogs on various
bacterial strains.
aMinimum inhibitory concentration (MIC) represents the lowest concentration of an antimicrobial that will
inhibit the visible growth of a microorganism after overnight incubation. Concentrations are expressed in µg/ml. Experiments were performed at least in triplicate.
In vivo, PACAP exists in two isoforms of 27 and 38 amino acids that share structural,
physicochemical and biological properties (Vaudry et al., 2009). Both isoforms, containing between 5 and 11 basic residues, adopt an amphipathic helical conformation, starting around their ninth residue(Bourgault et al., 2009b). Removal of the C-terminal domain of compound 7, i.e. [Tic6]PACAP27 (8), produces a PACAP analog that loses the ability to
1 2 3 4 5 6 7 8 9
Pseudomonas putida (KT2440) 113 77 93 56 186 113 33 >160 >200
Pseudomonas fluorescens (MF37) >200 >200 >200 112 >200 >200 >200 >160 >200
Pseudomonas aeruginosa (PA14) >200 >200 >200 112 >200 >200 >200 >160 >200
Escherichia coli (JM109) >200 116 93 28 112 37 >200 >160 165
Burkholderia cenocepacia (J2315) 10 10 9 5 20 8 2 >160 >200
Burkholderia thailandensis (ATCC700388) >200 >200 >200 >200 >200 >200 >200 >160 >200
Serratia marcescens (ATCC14756) >200 >200 >200 >200 >200 >200 >200 >160 >200
Bacillus circulans (LSPQ3543) 94 58 21 47 84 94 6 >160 >200
Bacillus cereus (ATCC11778) >200 >200 >200 >200 >200 >200 >200 >160 >200
Actinobacillus pleuropneumoniae (4074) 7.5 232 112 >200 >200 >200 >200 >160 >200
Bacillus subtilis (PY79) 28 12 5 3 42 3.5 7 >160 154
Bacillus velezensis (LMG9814T) 76 87 33 61 168 52 71 >160 >200
Bacillus amyloliquefaciens (LMG22478) 42 26 10 7 20 9 21 >160 134
Staphylococcus aureus (ATCC6538-P) >200 >200 >200 >200 >200 >200 >200 >160 >200
reduce bacterial growth (MIC > 160 μg/mL). Since both derivatives possess an extended C-terminal helix, the number of positively charged residues decorating PACAP38 and its PACAP27 counterparts, as well as their distribution around the helix, might be an essential trait to exert their antibacterial activity.
An important part of the arsenal of bacterial virulence factors are exoproteases. Proteases are enzymes that can degrade AMPs and therefore alter their biological activity (Frees et al., 2013). Surprisingly, except for Escherichia coli (JM109) strain, no difference was observed between PACAP38 and its metabolically stable derivatives, suggesting that proteases produced by these different bacteria are unable to metabolize these peptides, at least under the tested conditions. Overall, these results support our hypothesis that PACAP38 and related derivatives to inhibit the growth of a number of broadly different bacteria.
We next evaluated the specificity of PACAP activity against additional strains from the same species. While PACAP and its derivatives are highly active against strain J2315 of
Burkholderia cenocepacia, they were inactive against four other strains (Table 5). More
strains of Pseudomonas aeruginosa and Escherichia coli were also evaluated with results mostly in accordance with the previously observed effects (Table 1 and 2). The inability of
1 to kill homologous strains of Bacillus subtilis PY79 and Burkholderia cenocepacia J2315
Table 5 : MICa of PACAP and related analogs on homologous bacterial strains.
aMinimum inhibitory concentration (MIC) represents the lowest concentration of an
antimicrobial that will inhibit the visible growth of a microorganism after overnight incubation. Concentrations are expressed in µg/ml. Experiments were performed at least in triplicate.
2.8.2 Insight into the PACAP38 mode of action
The known cell penetrating properties of 1 as well as its ability to interact with biological membrane prompted us to evaluate its propensity to interact with the bacterial membrane and to penetrate inside bacteria. To do so, 1 was incubated with various bacterial strains for 1h allowing the peptide to enter the cells without inducing bacterial death. The bacterial cells were then fractionated into compartments and the presence of 1 or its metabolites in the outer/inner membranes or the cytoplasmic fraction was investigated by mass spectrometry (Table 6). As previously described, PACAP38 can induce the death of Bacillus subtilis strain PY79 but not of strain 2597 (Tables 4 and 5). Mass spectrometry analyses revealed that 1 is found associated with the bacterial membrane in both strains
1 2 3 4 5 6 7 9
Pseudomonas aeruginosa (ATCC33350-Sero-2)
>200 >200 >200 >200 >200 >200 >200 >200
Escherichia coli ATCC25922 >200 >200 >200 >200 >200 >200 >200 >200
Escherichia coli (O157:H7) >200 >200 >200 168 >200 113 >200 >200
Burkholderia cenocepacia (K56-2) >200 >200 >200 >200 >200 >200 >200 >200
Burkholderia cenocepacia (LMG18829) >200 >200 >200 >200 >200 >200 >200 >200
Burkholderia cenocepacia (LMG19240) >200 >200 >200 >200 >200 >200 >200 >200
Burkholderia cenocepacia (CEP0511
Gvar3b)
>200 >200 >200 >200 >200
>200 >200 >200
metabolite, identified as PACAP(9-38), was only observed associated with the sensitive PY79 strain. Furthermore, a similar pattern was also observed with the Burkholderia
cenocepacia strains. While PACAP38 was observed on the outer membrane and within the
cytoplasm of both Burkholderia cenocepacia strains, PACAP(9-38) was again only present within the cytoplasmic fractions of the sensitive J2315 strain. Hence, presence of the PACAP(9-38) metabolite in the cytoplasm seems to correlate with sensitivity to the inhibitory activity of PACAP38.
Table 6 : Mass spectrometry analysis of bacterial compartments following incubation with
PACAP38.
*Methionine oxidation
Cell fraction Observed mass (Da)
Sequence Calculated mass
(Da)
Bacillus subtilis (PY79)
Membrane 4534.1 HSDGIFTDSYSRYRKQMAVKKYLAAVLGKRYKQRVKNK 4534.3 Cytoplasm 4536.6 3667.9 HSDGIFTDSYSRYRKQMAVKKYLAAVLGKRYKQRVKNK SYSRYRKQMAVKKYLAAVLGKRYKQRVKNK 4534.3 3661.3 Bacillus subtilis (2597) Membrane 4534.1 HSDGIFTDSYSRYRKQMAVKKYLAAVLGKRYKQRVKNK 4534.3 Cytoplasm - - - Burkholderia cenocepacia (J2315) Outer membrane 4533.2 3666.6 HSDGIFTDSYSRYRKQMAVKKYLAAVLGKRYKQRVKNK SYSRYRKQMAVKKYLAAVLGKRYKQRVKNK 4534.3 3661.3 Inner membrane - - - Cytoplasm 4542.3* 3663.3 HSDGIFTDSYSRYRKQMAVKKYLAAVLGKRYKQRVKNK SYSRYRKQMAVKKYLAAVLGKRYKQRVKNK 4534.3 3661.3 Burkholderia cenocepacia (K56-2) Outer membrane 4536.3 3669.2 HSDGIFTDSYSRYRKQMAVKKYLAAVLGKRYKQRVKNK SYSRYRKQMAVKKYLAAVLGKRYKQRVKNK 4534.3 3661.3 Inner membrane - - - Cytoplasm 4543.8* HSDGIFTDSYSRYRKQMAVKKYLAAVLGKRYKQRVKNK 4534.3
2.8.3 PACAP(9-38): a potentially selective antimicrobial peptide
To confirm the bactericidal activity of this PACAP38-derived metabolite, the analog was prepared by solid phase peptide synthesis. The pharmacological profile of this synthetic PACAP(9-38) was evaluated using three CHO cell lines respectively co-expressing the human PAC1, VPAC1 or VPAC2 receptors. As depicted in earlier publications, the N-terminal domain of PACAP plays an essential role for binding affinity and biological activity (Bourgault et al., 2011, Bourgault et al., 2009a, Ngoc-Duc Doan et al., 2011, Vaudry et al., 2009). Hence, compared to the native PACAP38, PACAP(9-38) is characterized by a dramatic reduction of its binding affinity towards all PACAP receptors
(Table 7), much like PACAP(11-38) (Doan et al., 2012).
Table 7 : Binding affinity of PACAP38 and PACAP (9-38).
HPLCa
MSb calc
MSc found
PAC1 VPAC1 VPAC2
IC50(nM)d pIC50 IC50(nM)d pIC50 IC50(nM)d pIC50
PACAP 38 98% 4534.3 4534.9 4.6 (2.7-7.7) 8.34 ± 0.11 3.6 (2.2-5.7) 8.45 ± 0.09 18 (4-78) 7.74 ± 0.28 PACAP (9-38) 98% 3660.1 3660.0 > 10-6 5.87 ± 0.19 > 10-6 5.29 ± 0.37 > 10-6 5.77 ± 0.13
a Percentage of purity determined by HPLC using the eluent system: A = H
2O (0.1% TFA) and B = 60%
CH3CN/40% A with a gradient slope of 1% B/min, at a flow rate of 1 mL/min on a Vydac C18 column.
Detection at 229 nm. b Theorical monoisotopic molecular weight as calculated with ChemDraw Ultra 7.0.1. c m/z value assessed by MALDI-TOF-MS. d IC
50 represents the concentration at 50% binding inhibition.