Effets des acides gras polyinsaturés oméga-3 dans deux modèles
murins de maladie de Parkinson
Mémoire
Katherine Coulombe
Maîtrise en sciences pharmaceutiques Maître ès sciences (M. Sc.)
Québec, Canada
Effets des acides gras polyinsaturés oméga-3 dans deux modèles
murins de maladie de Parkinson
Mémoire
Katherine Coulombe
Sous la direction de :
Frédéric Calon, directeur de recherche
Francesca Cicchetti, codirectrice de recherche
RÉSUMÉ
La maladie de Parkinson (MP) est une maladie neurodégénérative incurable affectant l’intégrité du système dopaminergique des patients. Plusieurs études montrent que le mode de vie ainsi que les habitudes alimentaires influencent l’apparition et la progression de la maladie. Une alimentation riche en acide polyinsaturé oméga-3 (AGPI n-3) montre une protection du système dopaminergique et une diminution de la dégénérescence des neurones présents dans la substance noire (SNpc). L’hypothèse que nous proposons, est qu’une alimentation enrichie en AGPI n-3 permettrait de ralentir la progression de la maladie dans un modèle de souri 6-hydroxydopamine (6-OHDA) ainsi qu’influencer la présence d’agrégats d’alpha-synucléine (αSyn) au cerveau dans un modèle de souris transgénique surexprimant l’αSyn humaine le modèle Thy1-αSyn. Nos résultats présentent une neurorécupération partielle du système dopaminergique avec une alimentation enrichie. Les AGPI n-3 montrent peu d’influence sur les niveaux d’αSyn exprimés. Ils semblent, cependant, moduler les niveaux de différentes protéines synaptiques chez la souris transgénique et permettent d’accroitre la longévité de la vie des souris.
ABSTRACT
Parkinson's disease (PD) is an incurable neurodegenerative disease affecting the integrity of the dopaminergic system of patients. Several studies suggest that lifestyle and eating habits influence the onset and progression of the disease. A diet rich in omega-3 polyunsaturated acid (n-3 PUFA) shows protective effects on the dopaminergic system and a decrease of the neuronal degeneration in the substancia nigra (SNpc). The hypothesis that we propose is that a diet enriched in n-3 PUFA would slow the progression of the disease in a 6-hydroxydopamine (6-OHDA) mice model and influence the presence of alpha-synuclein aggregates (αSyn) in the brain of a transgenic mice overexpressing the human αSyn, Thy1-αSyn mice. Our results show partial neurorecuperation of the dopaminergic system with an enriched diet. The n-3 PUFAs show little influence on the expression of αSyn levels. Altough, they seem to modulate the levels of different synaptic proteins in transgenic mice and increase mice longevity.
TABLE DES MATIÈRES
RESUME --- III ABSTRACT --- IV TABLE DES MATIERES --- V LISTE DES TABLEAUX --- VIII LISTE DES FIGURES --- IX LISTE DES ABREVIATIONS --- X REMERCIEMENTS --- XII AVANT-PROPOS --- XIII
CHAPITRE 1 : INTRODUCTION --- 1
1.1 LA MALADIE DE PARKINSON --- 1
1.2 ÉTIOLOGIE ET FACTEURS DE RISQUES --- 2
1.2.1 FACTEURS ENVIRONNEMENTAUX --- 3
1.2.2 CONSOMMATION DE CAFE, ALCOOL ET TABAC --- 4
1.2.3 ALIMENTATION --- 5
1.2.4 GENETIQUE --- 5
1.3 NEUROPATHOLOGIE --- 7
1.3.1 DEGENERESCENCE DOPAMINERGIQUE --- 7
1.3.2 CORPS DE LEWY, MARQUEURS PATHOLOGIQUES --- 7
1.4 TRAITEMENTS --- 8 1.4.1 TRAITEMENTS PHARMACOLOGIQUES --- 9 1.4.1.1 Traitements dopaminergiques --- 10 1.4.1.2 Amantadine --- 11 1.4.1.3 Agents anticholinergiques --- 12 1.4.1.4 Inhibiteur de monoamine-oxydase B --- 12
1.4.2 STIMULATION CEREBRALE PROFONDE --- 12
1.4.3 TRANSPLANTATION DE CELLULES FŒTALES --- 13
1.5 MODELES ANIMAUX --- 14
1.5.1 MODELE PAR INJECTION DE NEUROTOXINE --- 14
1.5.1.1 Modèle MPTP --- 14
1.5.1.2 Modèle 6-OHDA --- 16
1.5.2 MODELE EXPOSITION AUX PESTICIDES --- 17
1.5.3 MODELES TRANSGENIQUES --- 18
1.5.3.1 Modèle transgénique Thy1-αSyn --- 18
1.5.3.2 LRRK2 --- 20
1.6 ACIDES GRAS POLYINSATURESOMEGA-3(AGPI N-3) --- 21
1.6.1 CARACTERISTIQUES DES ACIDES GRAS POLYINSATURESOMEGA-3 --- 21
1.6.3 MECANISME D’ACTION DES APGI N-3 AU CERVEAU --- 22
1.7 ACIDE GRAS POLYINSATURES OMEGA-3 ET MALADIE DE PARKINSON --- 23
1.7.1 EFFET DES AGPI N-3 SUR LA NEUROTRANSMISSION DOPAMINERGIQUE --- 23
1.7.2 INTERACTIONS ENTRE AGPI N-3 ET LA PROTEINE ΑSYN --- 23
1.8 EFFET PREVENTIFDES AGPI N-3 --- 24
1.8.1 ÉTUDES EPIDEMIOLOGIQUES --- 24
1.8.2 ÉTUDES PRECLINIQUES --- 24
1.8.3 ÉTUDES CLINIQUES --- 25
1.8.4EFFETS NEURORESTAURATEURS --- 26
1.9 PROBLEMATIQUE, OBJECTIFS ET HYPOTHESE --- 27
CHAPITRE 2 : PARTIAL NEURORESCUE EFFECTS OF DHA FOLLOWING A 6-OHDA LESION OF THE MOUSE DOPAMINERGIC SYSTEM --- 30
2.1 RESUME --- 30
2.2 ABSTRACT --- 32
2.3 INTRODUCTION --- 33
2.4 MATERIALS AND METHODS --- 34
2.4.1 ANIMALS --- 34
2.4.2 UNILATERAL 6-OHDA LESION --- 34
2.4.3 DIETS --- 35
2.4.4 BEHAVIORAL MEASURES --- 35
2.4.5 TISSUE PREPARATION --- 36
2.4.6 LIPID EXTRACTION AND GAS CHROMATOGRAPHY --- 36
2.4.7 CATECHOLAMINE QUANTIFICATION --- 37
2.4.8 STRIATAL PROTEIN LEVELS AND WESTERN BLOT ANALYSES --- 37
2.4.9 AUTORADIOGRAPHY --- 38
2.4.10 IMMUNOHISTOCHEMICAL EVALUATION OF THE STRIATAL AND NIGRAL DAERGIC SYSTEM 39 2.4.11 IN SITU HYBRIDIZATION --- 39
2.4.12 QUANTIFICATION OF NIGRAL TH-IMMUOREACTIVE NEURONS AND DAT MRNA EXPRESSING CELLS --- 40
2.4.13 STATISTICAL ANALYSES --- 41
2.5 RESULTS --- 42
2.5.1 ENRICHED N-3PUFA INTAKE DOES NOT IMPROVE MOTOR IMPAIRMENTS IN 6-OHDA LESIONED MICE --- 42
2.5.2 ENRICHED N-3PUFA INTAKE TRANSLATES INTO MEASURABLE ACCUMULATION OF FATTY ACIDS IN CORTICAL BRAIN STRUCTURES --- 42
2.5.3 BENEFICIAL EFFECTS OF ENRICHED N-3PUFA INTAKE ON SEVERAL STRIATAL COMPONENTS OF THE DAERGIC SYSTEM --- 42
2.5.4 ENRICHED N-3PUFA INTAKE DOES NOT IMPACT LEVELS OF STRIATAL NEUROTROPHIC FACTORS, SYNAPTIC PROTEINS OR METABOLIC MARKERS --- 43
2.5.5 EFFECTS OF ENRICHED N-3PUFA INTAKE ON THE NIGRAL DAERGIC SYSTEM: AUGMENTATION OF CELL BODY SIZE --- 43
2.6 DISCUSSION --- 44
CHAPITRE 3 : IMPACT OF DHA INTAKE IN A MOUSE MODEL OF
SYNUCLEINOPATHY --- 58
3.1RESUME --- 58
3.2ABSTRACT --- 60
3.3INTRODUCTION --- 61
3.4MATERIALS AND METHODS --- 63
3.4.1ANIMALS --- 63
3.4.2DIETS --- 63
3.4.3BEHAVIORAL MEASURES --- 64
3.4.4TISSUE PREPARATION --- 65
3.4.5LIPID EXTRACTION AND GAS CHROMATOGRAPHY --- 65
3.4.6HIGH-PERFORMANCE LIQUID CHROMATOGRAPHY (HPLC) --- 66
3.4.7STRIATAL PROTEIN LEVELS AND WESTERN BLOT ANALYSES --- 66
3.4.8AUTORADIOGRAPHY --- 67
3.4.9IMMUNOHISTOCHEMICAL EVALUATION OF NIGRO-STRIATAL DOPAMINERGIC SYSTEM68 3.4.10QUANTIFICATION OF NIGRAL TH-IMMUNOREACTIVE NEURONS --- 68
3.4.11STATISTICAL ANALYSES --- 69
3.5RESULTS --- 69
3.5.1ACCUMULATION OF CEREBRAL DHA LEVELS FOLLOWING EXPOSURE TO HIGH N-3 PUFA DIET --- 69
3.5.2IMPACT OF A DHA ENRICHED DIET ON MICE LONGEVITY --- 69
3.5.3CONFIRMATION OF HUMAN αSYN IN THE THY1-αSYN BRAIN --- 70
3.5.4IMPACT OF DIETARY TREATMENTS ON THE NIGRO-STRIATAL SYSTEM --- 71
3.5.5CHANGES IN SYNAPTIC PROTEINS WITH MICE GENOTYPES --- 71
3.6DISCUSSION --- 71
3.7ACKNOWLEDGMENTS --- 75
CHAPITRE 4 : DISCUSSION --- 84
4.1 RETOUR SUR LES RESULTATS --- 84
4.1.1 EFFET DES AGPI N-3 SUR LE COMPORTEMENT --- 84
4.1.2 ACTION DES AGPI N-3 SUR LE SYSTEME DOPAMINERGIQUE --- 87
4.1.3 EFFET DE AGPI N-3 SUR LES FACTEURS NEUROTROPHIQUES ET LES PROTEINES SYNAPTIQUES --- 89
4.2 INTERPRETATION DES RESULTATS --- 90
4.2.1 IMPACT DES AGPI N-3 SUR LES PROJECTIONS DE NEURONES DOPAMINERGIQUES VERS LE STRIATUM --- 90
4.2.2 UTILISATION CLINIQUE POTENTIELLE DES AGPI N-3 ? --- 92
4.3 PERSPECTIVES --- 92
4.4 CONCLUSION --- 93
BIBLIOGRAPHIE --- 94
LISTE DES TABLEAUX
1.1 Présentation de différentes mutations de gènes impliqués dans le développement de la MP.
1.2 Traitements pharmacologiques contre la MP 1.3 Différents modèles murins de la MP
2.1 Description of dietary treatments. 3.1 Description of dietary treatments. 3.2 Prefrontal cortex fatty acids composite
LISTE DES FIGURES
1.1 Structure de la protéine α-synucléine sous sa forme native 1.2 Structure du DHA
1.3 Représentation les différents temps d’intervention dans la maladie de Parkinson
2.1 Absence of dietary n-3 PUFA effects on behavioral outcomes associated to a 6-OHDA lesion.
2.2 Brain levels of n-3 PUFAs.
2.3 Dietary n-3 PUFA effects on striatal DAergic components
2.4 Dietary n-3 PUFA effects on the striatal DAergic system are not associated with changes in neurotrophic factors, synaptic proteins or metabolic markers.
2.5 Dietary n-3 PUFA effects on the nigral DAergic system 3.1 Impact of n-3 PUFA on motor behavior and longevity
3.2 Impact of n-3 PUFA on human αSyn levels in cerebral tissue 3.3 Impact of n-3 PUFA on the nigro-striatal system
3.4 Impact of n-3 PUFA on synaptic proteins
LISTE DES ABRÉVIATIONS
6-OHDA 6-Hydroxydopamine
αSyn Alpha-synucléine
β -NGF Nerve growth factor β
AGPI Acide gras polyinsaturé
AGPI n-3 Acide gras polyinsaturé oméga-3 AGPI n-6 Acide gras polyinsaturé oméga-6
ANOVA Analyse de variance
BDNF Brain derived neurotrophic factor
C :16 Palmitic acid
C18:0 Stearic acid
C18:1 n-9 Oleic acid
C18:2 n-6 – LA Linoleic acid C20:4 n-6 – ARA Arachidonic acid C22:4 n-6 – DTA Docosatetraenoic acid C22:6 n-3 (DHA); Acide Docosahexaenoique
CO1 Cytochrome oxidase 1
COX-2 Cyclo-Oxygénase -2
cRNA Complementary RNA
Ctrl Control
D2 Dopamine receptor D2
DA Dopamine
DAergic Dopaminergic
DAT Dopamine transporter
DOPAC 3,4-dihydroxyphenylacetic acid
DMSO Diméthyle sulfoxyde
DRO Dérivés réactifs de l’oxygène
EPA Acide eicosapentaénoique
GAP43 Growth-associated protein 43
HPLC Chromatographie en phase liquide à haute performance
HVA Homovanillic acid
IHC Immunohistochemistry
L-DOPA Levodopa
LNA Alpha-linolenic acid
LRRK2 Leucine rich repeat 2
MAO-B Monoamine oxydase B
MP Maladie Parkinson
MPTP 1-méthyl-4-phenyl-1,2,3,6-tetrahydropyridine
MUFA Monounsaturated fatty acid
n-3 PUFA Omega-3 polyunsaturated fatty acid n-6 PUFA Omega-6 polyunsaturated fatty acid
NMDA N-méthyl-D-aspartate
NT3 Neurotrophin-3
Nurr1 Récepteur nucléaire 1
PBS Phosphate buffer saline
PD Parkinson disease
PFA Paraformaldehyde
PSD95 Postsynaptic density protein PUFA Polyunsaturated fatty acid SCP Stimulation cérébrale profonde
SFA Saturated fatty acid
SNpc Substance noire pars compacta
SSC Salt sodium citrate
TDA Transporteur à dopamine
TH Tyrosine hydroxylase
TrKB Tropomyosine de kinase B
VACht Transporteur vésiculaire d’acétylcholine VGLUT1 Vesicular glutamate transporters
REMERCIEMENTS
Pour débuter, je tiens à remercier mon directeur de maîtrise Dr Frédéric Calon ainsi que ma codirectrice Dre Francesca Cicchetti merci de m’avoir accueilli dans vos équipes respectives et d’avoir grandement contribué à ma formation en me permettant de profiter de vos connaissances et vos conseils.
Merci particulier à Isabelle St-Amour de sa présence et de sa patience depuis le tout début de mon arrivée dans le laboratoire comme stagiaire. Merci à Martine Saint-Pierre pour son aide et ses conseils tout au long de mes différents protocoles ainsi que nos multiples conversations.
Merci à Cyntia Tremblay et Vincent Emond pour leurs aides et leurs conseils lors de la réalisation de mes expériences.
Merci à Marie-Thérèse Traversy, Ariane Giguère Rancourt, Milène Vandal, Marine Tournissac, Phillipe Bourrassa, Aurélie Louit, Sarah Paris-Robidas et Olivier Kerdiles pour les multiples discussions au combien agréable !
Un merci bien spécial à mes parents qui ont su me supporter et m’encourager pendant mes années de maîtrise.
AVANT-PROPOS
L’avant-propos suivant résume les travaux effectués pendant la période de mes études de deuxième cycle dans le programme de maîtrise en sciences pharmaceutiques ayant comme objectif de vérifier les effets d’un enrichissement alimentaire en acide gras polyinsaturé oméga-3 dans la progression de la maladie de Parkinson reproduit dans un modèle de souris traité à la 6-hydroxydopamine. L’influence d’une supplémentation en acides gras oméga-3 a également été étudiée dans un modèle de synucléinopathie reproduit avec la souris transgénique Thy1-αSyn.
Le second chapitre présente l’article scientifique, publié dans Journal of Nutritional
Biochemistry, contenant une partie des résultats obtenus au courant de ma
maîtrise montrant l’action bénéfique d’une alimentation supplémentée en acide gras polyinsaturé oméga-3. Malgré l’absence de neurorestauration franche induite par la supplémentation alimentaire, la présence de dopamine mesurée au striatum ainsi que les structures des neurones bénéficient positivement de la présence du DHA ajouté au régime alimentaire des souris. La totalité des manipulations et des analyses post-mortem ont été réalisés par moi. J’ai également contribué à la rédaction de l’article scientifique. Claire Gibras a réalisé les différents tests comportementaux ainsi que la perfusion des animaux. Giulia Cisbani a contribué à la formation des techniques d’analyse des composantes morphologiques des neurones dopaminergiques ainsi qu’à la préparation des figures présentées dans l’article. Martine Saint-Pierre a été d’une aide précieuse pour m’enseigner plusieurs techniques tel que l’hybridation in situ, le marquage en immunohistochimique, le décompte en stéréologie ainsi que le fonctionnement et l’analyse de données de HPLC. Ariane Giguère-Rancourt a effectué le deuxième compte à l’aveugle des neurones TH+. Dr Frédéric Calon et Dre Francesca Cicchetti ont supervisé l’étude ainsi que la rédaction et la correction de l’article scientifique.
Le troisième chapitre présente le complément des résultats obtenus pendant ma maitrise, sous forme d’article scientifique présentement en préparation. Cette deuxième section de résultats montre l’impact d’une alimentation enrichie en acide gras polyinsaturé oméga-3 sur l’expression de l’alpha-synucléine, dans un modèle de souris transgénique surexprimant la forme humaine de la protéine. Les manipulations des animaux comprenant les différents tests comportementaux et la perfusion des souris ont été faites par moi. J’ai également effectué les analyses en biochimie, les marquages en immunohistochimie, l’autoradiographie ainsi que les analyses statistiques. J’ai également contribué à la rédaction de l’article scientifique. La coupe des tissus au microtome et au cryostat a été performée par Anne-Sophie Boulianne sous ma supervision. Dr Vincent Emond a effectué la préparation et le dosage des échantillons par HPLC, les résultats ont été analysés par Olivier Kerdiles. L’élaboration du projet ainsi que la rédaction et la supervision de l’article a été fait par Dr Frédéric Calon et Dre Francesca Cicchetti.
Finalement, le quatrième chapitre fait un retour sur les différents résultats présentés dans ce mémoire, une discussion et des perspectives y sont également abordées.
EFFETS DES ACIDES GRAS POLYINSATURES OMEGA-3
DANS DEUX MODELES MURINS DE MALADIE DE
PARKINSON
CHAPITRE 1 : INTRODUCTION
1.1 La maladie de Parkinson
La maladie de Parkinson (MP) est une maladie du mouvement lié au vieillissement. La principale caractéristique neuropathologique de la maladie est une perte sélective des neurones dopaminergiques situés au niveau de la région de la substance noire pars compact (SNpc) (Dickson, 2012). Cette perte neuronale dans la SNpc a pour conséquence une baisse de la libération de dopamine (DA) au striatum, structure impliqué dans les mouvements volontaires et automatiques acquis. La diminution de cet apport dopaminergique au striatum est la cause de l’apparition des principaux problèmes moteurs de la maladie.
La maladie est caractérisée par des symptômes moteurs spécifiques, tels que des tremblements, de la bradykinésie, de la rigidité ainsi que des troubles de la posture. En conséquence, l’individu souffrant de la MP développe une posture voutée ce qui perturbe le maintien de son équilibre (de Munter et al., 2014; Hoehn and Yahr, 1967; Wirdefeldt et al., 2011). La MP s’exprime également par des symptômes non-moteurs tels que l’anxiété, la dépression, l’hypotension, la constipation, la paresthésie ; une augmentation de la sensibilité tactile, des crampes, des troubles de la faculté olfactive, des troubles du sommeil ainsi que les dermatites séborrhéiques ; dermatose inflammatoire cutanée (Ansari and Johnson, 1975; Burn, 2002; Chaudhuri et al., 2006; 2005; Shiba et al., 2000; Verbaan et al., 2008). En plus d’être omniprésents après le diagnostic de la maladie, ces symptômes sont également considérés comme des symptômes précurseurs dans le développement de la pathologie (Byrne et al., 1994; Chaudhuri and Sauerbier, 2015; Magerkurth et al., 2005). Par exemple, les problèmes olfactifs et la
constipation font leurs apparitions plusieurs années avant l’apparition des symptômes moteurs et le diagnostic (Alves et al., 2008; Berg et al., 2015; Ponsen et al., 2004; Postuma et al., 2015).
L’absence de biomarqueurs permettant l’identification de la MP, donne aux symptômes de la maladie une importance considérable puisque c’est sur ces données qu’est basé le diagnostic clinique (Gelb et al., 1999). Malgré tout, le diagnostic neuropathologique de la MP est confirmé par des analyses post-mortem démontrant la dégénérescence du système dopaminergique du cerveau de l’individu (Wirdefeldt et al., 2011).
1.2 Étiologie et facteurs de risques
La MP est une maladie neurodégénérative qui affecte près de 1 % des personnes âgées de 60 ans et plus, ce qui en fait la deuxième maladie neurodégénerative la plus fréquente après la maladie d’Alzheimer (Nussbaum and C. E. Ellis, 2003). La MP se présente sous deux formes : la forme sporadique et la forme familiale. La forme familiale, liée aux antécédents familiaux, représente moins de 10 % des cas de MP (Agim and Cannon, 2015). La forme sporadique de la maladie est multifactorielle et se développe à la suite d’une accumulation de plusieurs facteurs environnementaux et génétiques. Le nombre d’individus atteints de la maladie augmente avec l’âge, ce qui fait du vieillissement, son principal facteur de risque (de Lau and Breteler, 2006). Encore aujourd’hui, la cause exacte du déclenchement de la pathologie reste un mystère.
Les différents facteurs de risque susceptibles d’influencer le développement de la maladie se divisent en deux groupes : les facteurs de risque génétique et non génétique (Coppedè, 2012; Klein and Westenberger, 2012). L’exposition à différents herbicides et pesticides, la consommation de tabac, d’alcool et de caféine ainsi que certains régimes diététiques sont des exemples des facteurs de risque non génétique pouvant contribuer au développement de la pathogenèse (de Lau and Breteler, 2006; Elbaz and Tranchant, 2007; Le Couteur et al., 1999).
1.2.1 Facteurs environnementaux
Des études épidémiologiques montrent un lien entre la proportion de gens atteints de la MP et leur lieu de résidence ; cette comparaison tend à montrer une augmentation du nombre d’individus souffrant de la MP en région rurale (Cannon and Greenamyre, 2011). Ces études comparant la prévalence de la maladie en milieu rural et urbain suggèrent que l’exposition à des pesticides, herbicides ainsi que certains métaux présents dans les régions rurales serait un facteur de risque de la MP (de Lau and Breteler, 2006). Une association entre le travail en milieu agricole favorisant l’exposition aux métaux lourds et le développement de la MP a également été démontrée (Elbaz and Tranchant, 2007). Les études restent tout de même prudentes, à la vue d’une corrélation faible pouvant être interprétée plutôt comme uniquement une tendance entre l’exposition aux polluants environnementaux et le développement de la MP (Abbott et al., 2003; Dauer and Przedborski, 2003; Wan and Lin, 2016).
Voici deux exemples concrets démontrant un rôle de l’exposition aux pesticides dans le développement pathologique. Le paraquat, un des agents herbicides le plus utilisé dans le monde par son action rapide et non sélectif permettant de détruire les tissus des plantes vertes (Cicchetti et al., 2009). Le paraquat entrerait au niveau du cerveau par des transporteurs d’acides aminés, et agirait, une fois à l’intérieur du cerveau, dans le cytosol cellulaire comme un agent redox, induisant ainsi une toxicité mitochondriale et l’apoptose du neurone dopaminergique (Miller, 2007; Richardson et al., 2005). C’est cette déplétion neuronale qui rend le paraquat intéressant dans le cadre la MP. La molécule neurotoxique dérivée du paraquat, le cyperquat, est chimiquement similaire au MPP+, molécule active provenant du 1-méthyl-4-phényl-1,2,3,6-tétrahydropyridine (MPTP) (Snyder and D'Amato, 1985). Le MPP+, tout comme le paraquat, cause une déplétion massive du système dopaminergique en s’attaquant spécifiquement aux neurones dopaminergiques de la SNpc (Gupta et al., 1984; Seniuk et al., 1990). Dû à son efficacité, cette toxine est fréquemment utilisée dans le cadre de recherche sur la
MP afin de léser le système dopaminergique des animaux pour les utiliser comme modèle animal de la maladie (Dauer and Przedborski, 2003).
La roténone est également une toxine environnementale que l’on retrouve dans les insecticides. La roténone est un élément chimique de la famille des isoflavones et est généralement utilisée comme insecticide à large spectre (Cicchetti et al., 2009). La caractéristique lipophile de la roténone lui permet de traverser la barrière hémato-encéphalique et les membranes cellulaires sans l’assistance de transporteurs (Dauer and Przedborski, 2003). La roténone peut donc facilement et rapidement entrer dans les cellules neuronales se lier et inhiber le complexe 1 mitochondriale, empêchant le bon fonctionnement de la mitochondrie, menant à la mort du neurone (Cannon and Greenamyre, 2011; Ravanel et al., 1984). L’inhibition du complexe 1 de la mitochondrie est un mécanisme rapporté dans la MP (Schapira et al., 1989). La roténone est également utilisée dans le domaine de la recherche sur la MP comme agent neurotoxique dans la production de modèles animaux (Wrangel et al., 2015).
1.2.2 Consommation de café, alcool et tabac
Des études épidémiologiques ont souligné un lien entre la consommation de différentes substances telles que le café, l’alcool et le tabac dans le développement de la MP. Un fumeur aurait selon les résultats de certaines études moins de chance d’être atteint de la MP qu’un non-fumeur (Grandinetti et al., 1994; Kyrozis et al., 2013). Des études précliniques effectuées sur la souris et le singe MPTP auraient montré un effet neuroprotecteur de la cigarette chez les souris (Parain et al., 2003; Quik et al., 2006). Chez le singe une exposition de six mois à une dose de nicotine comparable à celle administrée par un fumeur, favorise le maintient de la tyrosine hydroxylase ainsi que des transporteurs de la DA au niveau du striatum. Des analyses par chromatographie en phase liquide à haute performance (HPLC) permettent également de confirmer que l’exposition à la nicotine conserve davantage le niveau de DA striatale (Quik et al., 2006). Les mêmes observations sont possibles concernant la consommation de caféine
(Ascherio et al., 2001; G. W. Ross et al., 2000). La prise d’alcool montre cependant les résultats inverses (Hernán et al., 2003).
1.2.3 Alimentation
L’alimentation est considérée comme étant un des facteurs de risque de la MP. Plusieurs études ont vérifié les effets bénéfiques d’aliments spécifiques dans la maladie, dans différents contextes. Tel que l’impact de l’alimentation en prévention du développement de la maladie ou dans un objectif curatif. Certains résultats d’étude de population tendent à montrer qu’une alimentation riche en gras totaux augmenterait les risques de développer la maladie (H. Chen et al., 2003). Au contraire, une alimentation qui se compose principalement de fruits, de légumes, de produits céréaliers et d’une faible consommation de viande, diminuerait les risques de développer la MP (Gao et al., 2007). La présence abondante d’agent antioxydant dans l’alimentation diminuerait les effets néfastes du stress oxydatif au cerveau observé dans la maladie (Gao et al., 2007). Les acides gras polyinsaturés oméga-3 (AGPI n-3) sont des éléments qui permettraient de diminuer les risques de développer la MP (Kyrozis et al., 2013; Zhang et al., 2016). Les résultats montrent dans un modèle de souris MPTP qu’une alimentation enrichie en AGPI n-3 permet de protéger les neurones dopaminergiques et les transporteurs de DA de la SNpc et de maintenir le niveau de DA striatale (Bousquet et al., 2008). Bien que plusieurs études tentent de démontrer que la qualité de l’alimentation joue un rôle de premier ordre dans l’incidence de la MP, certains croient plutôt que l’impact de groupes alimentaires spécifiques à une influence modeste sur la MP (Sääksjärvi et al., 2013)
1.2.4 Génétique
Malgré le faible taux de maladie familiale, certains gènes ont été identifiés comme ayant un rôle à jouer dans le développement de la MP. Des mutations autosomales dominantes des gènes SNCA, responsable de la production d’alpha-synucléine (αSyn) ainsi que LRRK2 ou encore des mutations récessives des gènes PARKIN, PINK, DJ-1 sont des acteurs majeurs dans les cas de MP familiale (Kumar et al., 2012; Trinh and Farrer, 2013). Les différents gènes sont plus
Gènes Protéine codée Type de mutation Type de Parkinson
SNCA (PARK1) α-synucléine Autosomale
dominante
Familial
LRRK2 (PARK8) Dardarin Autosomal
dominant
Familial
PINK1 (PARK6) Kinase induction
de PTEN
Autosomal récessive
Familial
Parkin (PARK2) Ubiquitine ligase Autosomal
récessive Familial
DJ-1 (PARK7) Déglycase DJ-1 Autosomal
récessive
Familial
PLA2G6
(PARK14) Enzyme de phospholipase A2 Autosomal récessive Familial
NR4A2 (Nurr1) Récepteur
nucléaire
Autosomal dominante
Familial
UCHL-1 (PARK5) UCHL-1 Autosomal
dominante Familial ATP13A2 (PARK9) ATP13A2 Autosomal récessive Familial
MAPT Tau Autosomal
dominante Sporadique
Tableau 1.1 Présentation de différentes mutations de gènes impliqués dans le développement de la MP. Adapté de (Coppedè, 2012; de Lau and Breteler, 2006; Park et al., 2015; Taymans and Baekelandt, 2014)
En plus des différentes mutations génétiques pouvant mener à la forme familiale de la MP, la susceptibilité génétique pour les formes sporadiques de la MP semble contrôlée par une accumulation de polymorphismes spécifiques (Consortium, 2011; Klein and Westenberger, 2012; Lesage and Brice, 2009; Pankratz and Foroud, 2007). En tout, quatre grandes familles de gènes ont été identifiées comme pouvant être responsable de cette susceptibilité, il s’agirait de gènes impliqués dans le mécanisme de xénobitotiques (CY2D6, NAT2, GSTs), de gènes impliqués dans la neurodégénérescence (monoamine-oxydase B (MAO-B), NOS), de gènes impliqués dans le fonctionnement des neurones dopaminergiques et
finalement des gènes de dérive génétique qui favoriseraient le développement de la MP familiale (Elbaz and Tranchant, 2007).
1.3 Neuropathologie
1.3.1 Dégénérescence dopaminergique
Comme mentionné plus haut, la dégénérescence des neurones dopaminergiques au niveau de la SNpc est responsable de l’apparition des principaux symptômes clinique de la MP (Fearnley and Lees, 1991). En effet, les troubles moteurs s’observent à la suite d’une perte de près de 50-60% des neurones dopaminergiques présents dans la SNpc s’accompagnant d’une diminution de l’ordre de 80-85% de DA au striatum (Bernheimer et al., 1973; Calon et al., 2003a; Riederer and Wuketich, 1976). Les neurones dopaminergiques semblent être une population cellulaire plus vulnérable à la dégénérescence. Différentes hypothèses à cette vulnérabilité ont été posées telles qu’une grande demande en énergie aux mitochondries qui pourrait fragiliser les neurones dopaminergiques, une déficience du métabolisme énergétique, un contrôle inadéquat de redox ou une quantité trop faible de facteurs neurotrophiques (Barzilai and Melamed, 2003; Brichta and Greengard, 2014).
1.3.2 Corps de Lewy, marqueurs pathologiques
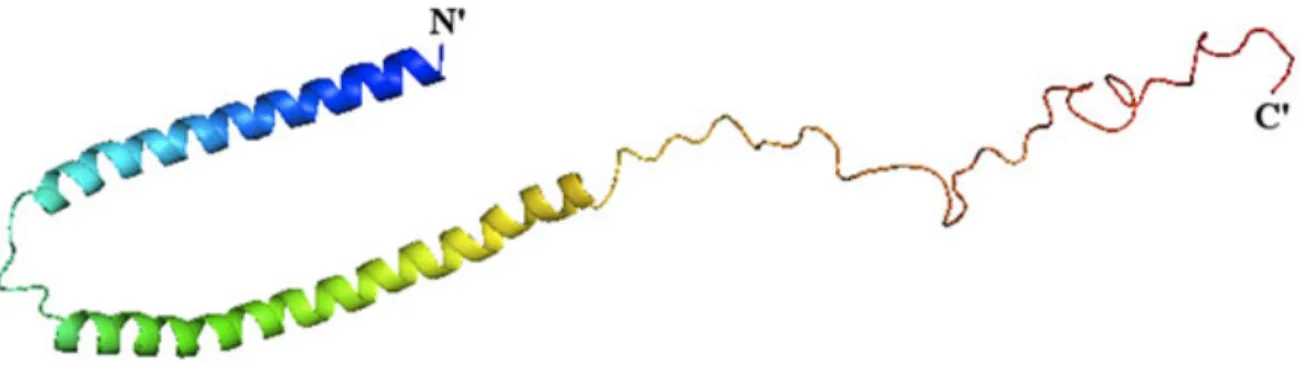
Le principal marqueur neuropathologique de la MP est la présence de corps de Lewy situés au niveau de la SNpc, le locus cœruleus, le noyau basal de Meynert, et l’hypothalamus lors de l’évaluation post-mortem (Gelb et al., 1999). La présence de ce marqueur dans ces différentes structures permet de confirmer le diagnostic préalablement établi par le neurologue basé sur les symptômes moteurs présentés par le patient (Gelb et al., 1999; Gibb and Lees, 1988; Jankovic, 2008). Les corps de Lewy sont décrits en microscopie électronique comme ayant une morphologie s’apparentant à des noyaux denses qui portent en leur tour des fibrilles d’environ 8 à 10 µm de long (Dauer and Przedborski, 2003). Les corps de Lewy sont décrits comme étant des agrégats de protéines insolubles situés principalement dans la région de la SNpc (Braak et al., 2003). La protéine αSyn est une des composantes majeures des corps de Lewy, la structure de l’αSyn est présentée à la figure 1.1.
Son agrégation est causée par un mauvais repliement qui forme des amas insolubles (Shults, 2006). D’autres protéines cytoplasmiques sont également présentes dans les corps de Lewy tels que parkin et ubiquitine qui comme l’αSyn vont s’agréger dans la MP en amas insoluble (Spillantini et al., 1998).
L’impact de la formation de corps de Lewy dans la MP est cependant encore controversé (Tenreiro et al., 2014). Selon certaines hypothèses, la présence de cette agrégation protéique serait la cause de la mort neuronale caractéristique de la maladie ainsi que de la dégénérescence du système dopaminergique (Kalia et al., 2013; Osterberg et al., 2015). À l’opposé, d’autres études suggèrent que la présence de corps de Lewy agirait comme un mécanisme de défense (Kopito, 2000). Cela permettrait de protéger les cellules du cerveau contre les protéines mal repliées propagées dans l’environnement. La formation d’agrégats diminuerait l’action des protéines mal repliées en tant qu’agent oxydatif (Tanaka et al., 2004). Les protéines seraient ainsi capturées sous forme d’agrégat et hors d’état de nuire (Dauer and Przedborski, 2003).
Figure 1.1 : Structure de la protéine alpha-synucléine sous sa forme native. Tiré de (Ritchie and P. J. Thomas, 2012).
1.4 Traitements
Encore aujourd’hui, malgré la prévalence élevée de la maladie chez les personnes âgées, aucun traitement curatif n’est disponible. La médication actuellement disponible permet de contrôler efficacement les déficits moteurs chez le patient,
sans toutefois retarder la progression de la maladie (Katzenschlager, 2014; Rezak, 2007).
La prise de dopaminomimétiques est utilisée pour contrôler les symptômes moteurs mais les produits commercialisés demeurent moins efficaces contre les symptômes dépressifs, la douleur, la constipation et les troubles du sommeil (Lees et al., 2009).
1.4.1 Traitements pharmacologiques
Médicaments Avantages Inconvénients
Lévodopa • Apporte d’importantes
améliorations des symptômes moteurs.
• Complications motrices qui
s’accentuent avec la prise de médication
Antagoniste des récepteurs NMDA
• Amantadine
• Faible effet
anti-parkinsonien
• Diminution des dyskinésies
causées par la prise de levodopa • Désordres cognitifs • Œdème périphérique Agonistes de la dopamine • Bromocriptine • Pramipexole • Ropinirole • Apomorphine • Bonne efficacité
• Retarde les complications
motrices
• Effet neuroprotecteur • Effet anti-dépresseur avec
la prise de Pramipexole • Augmente le risque de somnolence, confusion, hallucination, œdème périphérique, changements comportementaux
• Fibrose de la valve cardiaque
Inhibiteurs de la
monoamine oxydase B
• Sélégiline
• Rasagiline
• Améliore les déficits dans
les stades précoces et avancés de la maladie
• Effet neuroprotecteur
• Efficacité légère
• Possible effets cognitifs
Antocholinergique
• Trihexyphénidyle
• Benztropine
• Effet anti-parkinsonien léger • Limité par les effets
secondaires tels que la nausé, la rétention urinaire, trouble de la vision et de la confusion
Tableau 1.2 Traitements pharmacologiques contre la MP. Adapté de (Schapira et al., 2006)
1.4.1.1 Traitements dopaminergiques
Les traitements visant le remplacement de la DA pour pallier au déficit présent chez les personnes souffrant de la MP sont utilisés depuis les années 1960 (Fahn, 2015). Néanmoins, malgré une efficacité considérable sur les symptômes moteurs de la maladie, ces traitements sont exclusivement symptomatiques et ne permettent pas de renverser la maladie et d’offrir une solution de guérison aux patients (Kearney and Dunsmure, 2011).
Le traitement le plus utilisé pour traiter les problèmes moteurs de la MP est la lévodopa (L-DOPA) (Olanow et al., 2001; Gracies and Olanow, 2002; Hauser, 2008; Salat and Tolosa, 2013). La L-DOPA a la capacité de traverser la barrière hémato-encéphalique et d’être converti en DA par l’action de l’acide L-amine aromatique décarboxylase. L’action de la L-DOPA se fait, principalement, au niveau des récepteurs de la DA D1 et D2 procurant un effet rapide de courte durée du contrôle des symptômes moteurs de la maladie (Mercuri and Bernardi, 2005; Schapira et al., 2006). La prise de L-DOPA est combinée à un inhibiteur décarboxylase telle que la benserazide et la carbidopa, qui permettent de ralentir la dégradation de L-DOPA en DA en périphérie du cerveau. Cela va augmenter la biodisponibilité au cerveau et accroitre le temps de demi-vie de la L-DOPA (Kuoppamäki et al., 2015). Son action ne se limite pas aux récepteurs dopaminergiques, les récepteurs noradrénergiques et sérotoninergiques sont également influencés par la prise de L-DOPA, due à la libération de DA par ces différents types cellulaires (Eskow Jaunarajs et al., 2012; Navailles et al., 2011; 2014). Malgré les bénéfices apportés par la L-DOPA, cette médication est accompagnée d’effets secondaires importants, le développement à long terme de dyskinésies chez près de 40-50 % des utilisateurs après 5 à 7 ans de prise de médication (Bargiotas and Konitsiotis, 2013; Lenderking et al., 2015; Schrag and Quinn, 2000). Le nombre de cas s’accroit davantage avec le temps et après 15 ans approximativement 95 % des personnes traitées avec de la L-DOPA vont développer des dyskinésies (Hely et al., 2005; Huot et al., 2012).
Une autre famille de médicaments ciblant les récepteurs de la DA a été développée. Il s’agit des agonistes de la DA. Bien que légèrement moins efficace dans le contrôle des symptômes moteurs que la L-DOPA, les agonistes de la DA auraient l’avantage de retarder le développement des complications motrices comme les dyskinésies (Montastruc et al., 1989; Stocchi et al., 2015). Leurs actions se fait principalement en ciblant le récepteur dopaminergique D2 ainsi que D3 (Schapira et al., 2006). La prise d’agoniste de la DA tel que le pramipexole permet également d’améliorer certains symptômes non moteurs de la MP comme la dépression (Stocchi et al., 2015). Malgré l’absence de dyskinésies, les agonistes de la DA comportent également des effets secondaires considérables tels qu’une augmentation des troubles de sommeils, ainsi que de la confusion, une augmentation des risques de souffrir d’hallucinations et un possible changement au niveau du comportement (Schapira et al., 2006).
1.4.1.2 Amantadine
L’amantadine, un antagoniste du récepteur N-méthyl-D-aspartate (NMDA), peut être combiné à la prise de L-DOPA dans la MP (Danysz et al., 1997). Son action n’est pas directement reliée au contrôle de symptômes des troubles moteurs de la MP, mais davantage au contrôle des effets secondaires de la L-DOPA (Metman et al., 1999). L’amantadine permet de diminuer les dyskinésies causées par la prise de L-DOPA à long terme (Oertel et al., 2017). L’amantadine permet également d’accroitre l’efficacité de la prise de L-DOPA en favorisant la libération de DA ainsi qu’en stimulant les récepteurs dopaminergiques (Pahwa et al., 2015). Cet antagoniste du récepteur NMDA permet également de réduire le niveau de recapture de la DA en périphérie, optimisant ainsi la disponibilité de DA au cerveau. L’utilisation d’amantadine comme agent de contrôle des dyskinésies est toutefois délicate, due à certains effets secondaires comme des vertiges, de l’insomnie et des nausée (Pahwa et al., 2015). Une limitation de la prise d’amantadine comme traitement contre les dyskinésies est la baisse de son efficacité à la suite d’un usage prolongé (A. Thomas et al., 2004; Wolf et al., 2010).
1.4.1.3 Agents anticholinergiques
Les agents anticholinergiques sont parmi les traitements de première ligne pour traiter les problèmes moteurs liés à la MP. Toutefois, plusieurs effets secondaires influençant les fonctions cognitives et gastriques, limite l’utilisation d’agent anticholinergique aux patients moins âgés souffrant principalement de tremblement au repos (Connolly and Lang, 2014; Rezak, 2007).
1.4.1.4 Inhibiteur de monoamine-oxydase B
Les inhibiteurs de MAO-B sont un autre type de traitement disponible, des enzymes permettant la dégradation de la DA, comme la rasagiline (Chang et al., 2017). Les inhibiteurs de MAO-B ont comme fonction d’arrêter la dégradation de la DA augmentant donc, le niveau de DA dans la région synaptique (Finberg and Rabey, 2016). La prise de cette médication améliore les symptômes moteurs à différent stade de la maladie, en début de la maladie ainsi qu’à un stade plus avancé (Cereda et al., 2017). Les inhibiteurs de monoamine-oxydase possèderaient des effets neuroprotecteurs qui permettraient d’éviter ou de retarder une déplétion massive des neurones dopaminergiques (Stocchi et al., 2015). Malgré une bonne efficacité, le traitement pourrait avoir des conséquences négatives au niveau cognitif, la dépression est un symptôme secondaire associé à ce type de médication(Connolly and Lang, 2014).
1.4.2 Stimulation cérébrale profonde
Chez certains patients, les effets bénéfiques des traitements pharmacologiques comme ceux obtenus avec la L-DOPA se dégradent rapidement. Chez d’autres, des effets secondaires majeurs comme les complications motrices font leurs apparitions après quelques années de traitement. Des méthodes chirurgicales, plus invasives, ont été élaborées pour tenter de contourner ces problèmes. La stimulation cérébrale profonde (SCP) est l’une de ces méthodes (Benabid et al., 2006; Krack et al., 2003).
La chirurgie consiste à implanter une électrode dans le cerveau des patients au niveau de trois structures spécifiques, le noyau sous-thalamique, le globus pallidus interne ainsi que le noyau ventral intermédiaire du thalamus (Poortvliet et al.,
2015). L’approbation pour la chirurgie va être déterminée par une équipe multidisciplinaire qui base leur décision selon les facteurs suivant : l’avancement de la maladie, l’âge, la réponse au traitement de L-DOPA, le présence de problèmes psychiatriques ou cognitifs ou d’autre comorbidités et le résultat de l’analyse par IRM(Munhoz et al., 2016). Malgré les effets bénéfiques importants de la stimulation sur les symptômes moteurs des patients, il faut mentionner qu’il s’avère généralement nécessaire de poursuivre la médication post-chirurgie (Poortvliet et al., 2015). La procédure de stimulation cérébrale permet généralement un ajustement à la baisse de traitement de L-DOPA préalablement administré au patient (Kim et al., 2015).
1.4.3 Transplantation de cellules fœtales
Bien qu’encore au stade expérimental, ce traitement actuellement en phase d’essais cliniques, se veut innovateur en utilisant la greffe ou encore l’injection de solution de cellules foetales par chirurgie stéréotaxique au cerveau de patient Parkinsonien (Stoker et al., 2017; Venkataramana et al., 2012). Cette méthode a pour but de remplacer les neurones dopaminergiques perdus durant la progression de la maladie (Barker, 2014). Les cellules saines injectées permettraient de combler le vide causé par la perte neuronale en plus, de sécréter des facteurs de croissance favorisant la plasticité synaptique, facilitant ainsi la formation de nouvelles connexions pour rétablir les déficits moteurs caractéristiques de la maladie (Barker, 2014). Les greffons ont cependant un temps de survie qui se situe entre 10 et 20 ans avant le début de la dégénérescence des cellules greffées (Kurowska et al., 2011). Deux problèmes sont rapportés avec les approches de transplantation; la présence de complication motrice et surtout la possibilité de retrouver la protéine αSyn dans le greffon. En effet, certaines analyses post-mortem ont montré la présence de la protéine dans le transplant (Kordower et al., 2008; J.-Y. Li et al., 2010). Les corps de Lewy pourraient donc se propager dans le cerveau et s’immiscer dans la greffe.
Bien que des progrès importants aient été faits dans le domaine curatif de la MP, aucun traitement ne permet de guérir de manière définitive la MP. Encore aujourd’hui, seul un contrôle des symptômes moteurs est possible.
1.5 Modèles animaux
Afin d’étudier de nouvelles pistes de traitement pour la MP, il est nécessaire d’avoir recours à des modèles animaux reproduisant de manière la plus fidèle possible les différents aspects de la pathologie (Blesa et al., 2012). Parmi ces modèles, certains utilisent des neurotoxines pour causer une dégénérescence du système dopaminergique, alors que d’autres ont recours à l’utilisation de modèles transgéniques pour reproduire les mutations observées dans les cas de MP familiale (Jackson-Lewis et al., 2012). Bien que les modèles animaux permettent d’observer plusieurs caractéristiques de la maladie, aucun ne reproduit complètement tous les symptômes de la maladie.
1.5.1 Modèle par injection de neurotoxine
1.5.1.1 Modèle MPTPLe MPTP a été connu comme agent neurotoxique à la suite d’une mauvaise de synthèse d’héroïne, résultant à un sous-produit de synthèse, le MPTP, qui a eu pour conséquence, chez les individus qui se l’administraient, le développement des symptômes de la MP (Langston et al., 1983). Dû à ses propriétés, le MPTP est aujourd’hui la substance la plus utilisée pour reproduire les symptômes parkinsoniens dans les modèles animaux. L’injection de MPTP a pour conséquence d’induire une déplétion importante des neurones du système dopaminergique de l’animal (Muthane et al., 1994; Seniuk et al., 1990). Une fois injectée, la molécule MPTP va traverser la barrière hémato-encéphalique pour être métabolisée sous sa forme active, le MPP+, par l’action de la MAO-B situé au niveau des astrocytes (Blesa et al., 2012; Da Prada et al., 1985). C’est sous cette forme que la neurotoxine va être captée spécifiquement par les transporteurs de la DA, exprimés par les neurones dopaminergiques, permettant l’entrée de la neurotoxine dans le neurone (Blesa et al., 2012; Jackson-Lewis et al., 2012). Une fois à l’intérieur de la cellule, le MPP+ inhibe le complexe 1 de la chaine d’électron mitochondrial ce qui cause une augmentation du stress oxydatif et pousse la
cellule à entrer dans son cycle d’apoptose (Ghosh et al., 2010). De manière classique, le MPTP est injecté par voie intrapéritonéale chez l’animal et se rend au cerveau par le transport sanguin. La neurotoxine permet de mimer certaines caractéristiques uniques à la MP comme la perte spécifique de neurones dopaminergiques, l’induction de stress oxydatif, la libération de dérivés réactifs de l’oxygène ainsi que de l’inflammation (Blesa et al., 2012).
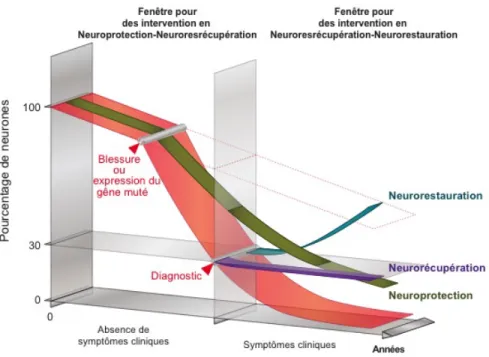
Cependant, malgré la grande similarité retrouvée au cerveau des animaux, le MPTP ne cause pas d’apparition de corps de Lewy, un élément primordial dans le diagnostic post-mortem et l’évolution de la MP (Jackson-Lewis et al., 2012; Przedborski et al., 2001). Malgré une déplétion significative du système dopaminergique, aucun changement moteur clair et reproductible n’est observable chez le modèle murin. On retrouve néanmoins des données contradictoires dans la littérature qui peuvent dépendre des plusieurs protocoles d’administration de MPTP utilisés à diverses doses et sur une période de temps plus ou moins longue (Blesa et al., 2012; Dauer and Przedborski, 2003; Ugrumov et al., 2011). Contrairement aux rongeurs, les primates présentent une dégénérescence massive du système dopaminergique et des symptômes francs suite à une exposition au MPTP (Blesa et al., 2012; Przedborski et al., 2001). Ce modèle est des plus utilisés pour étudier le mécanisme de mort neuronale induit par l’injection de MPTP ainsi que pour vérifier le paradigme de neuroprotection dans le but de trouver un traitement en prévention de la maladie puisque le modèle permet l’administration du traitement avant l’induction de la lésion (Grünblatt et al., 2000). Un inconvénient du modèle MPTP chez la souris est le recouvrement de l’expression de la tyrosine hydroxylase par les neurones dopaminergiques, après une certaine période à la suite de l’injection de MPTP chez l’animal. La régénérescence spontanée des neurones dopaminergiques peut être influencée par l’action des astrocytes qui permet le retour des neurones dopaminergiques, cependant cette récupération spontanée est grandement influencée par l’âge des animaux au moment de la lésion (Episcopo et al., 2013). Cette caractéristique du modèle a pour conséquence de diminuer son utilisation dans des cadres de
traitement plus tardifs, comme en situation de neurorestauration ou de neurorécupération (Mitsumoto et al., 1998). Cette récupération spontanée dans ces deux paradigmes pourrait avoir pour conséquence de biaiser les résultats entre les effets réels des traitements administrés et le recouvrement naturel de l’animal sur une plus longue période de temps après la lésion {Yasuhide:1998tv}.
1.5.1.2 Modèle 6-OHDA
La 6-hydroxydopamine (6-OHDA) a été isolé pour la première fois en 1959 (Blum et al., 2001). Contrairement au MPTP, la molécule de 6-OHDA n’a pas la capacité de traverser la barrière hémato-encéphalique, son administration plus invasive, nécessite une injection stéréotaxique au striatum ou dans la région du circuit de la récompense, pour permettre l’entrée de la molécule au cerveau (Tieu, 2011). La 6-OHDA est capté par les transporteurs de la DA, permettant ainsi son entrée dans les neurones dopaminergiques (Rodriguez-Pallares et al., 2007). La 6-OHDA a une moins grande spécificité aux transporteurs de la DA que le MPP+; elle présente une forte affinité également pour les transporteurs de norépinéphrine pouvant ainsi causer une perte des neurones noradrénergiques (Blesa et al., 2012; Tieu, 2011). L’injection de la 6-OHDA occasionne une perte massive des neurones dopaminergiques, la libération de dérivés réactifs de l’oxygène ainsi que de l’inflammation, de façon plus marquée que dans le modèle MPTP (Cicchetti et al., 2002; Bezard, 2006; Bezard et al., 2013). Tout comme pour le MPTP, aucun corps de Lewy n’est formé à la suite de l’injection de la neurotoxine (Blesa et al., 2012). La présence de déficits moteurs causés par la lésion unilatérale est un avantage du modèle 6-OHDA (Glajch et al., 2012). La neurotoxine va causer une perte de près de 60 % des neurones dopaminergiques présents dans la SNpc ainsi qu’une dégénérescence des projections terminales se situant dans la région du striatum, ayant pour conséquence une réduction massive des concentrations en DA dans cette même région.
L’injection unilatérale de 6-OHDA a pour avantage de pouvoir utiliser l’animal comme étant son propre contrôle, en comparant les deux hémisphères (Blesa et al., 2012). Un second avantage considérable du modèle 6-OHDA est la stabilité de
la lésion, les effets de la lésion progressent pendant 5 à 6 semaines suivant la lésions puis se stabilisent et se maintiennent dans le temps, permettant ainsi l’étude de traitements dans des situations de neurorécupération et de neurorestauration à plus ou moins long terme après la lésion.
1.5.2 Modèle exposition aux pesticides
Certaines substances utilisées dans le milieu agricole comme agent pesticide sont utilisées comme substance neurotoxiques pour obtenir des modèles animaux de la MP, dû à leurs effets dévastateurs sur le système dopaminergique (Cicchetti et al., 2009). La roténone, par exemple, est connue comme une forme de pesticide à large spectre, causant chez un animal des dommages au système dopaminergique par son exposition et menant au développement de la MP. Cette substance est un inhibiteur du complexe 1 de la mitochondrie qui cause l’arrêt du transport de la chaine d’électron (Betarbet et al., 2000; Wrangel et al., 2015). L’injection intrapéritonéale cause une dégénérescence des neurones dans la SNpc ainsi que des déficits moteurs s’apparentant à ceux répertoriés dans la MP (Wrangel et al., 2015). La réponse à la roténone est, cependant, variable chez chacun des animaux chez qui elle est administrée, ce qui induit une forte variation inter-individus de la dénervation du système dopaminergique provoquant un problème de reproductibilité (Cicchetti et al., 2009; Betarbet et al., 2000; Blandini and Armentero, 2012). De plus, des effets toxiques de la substance pour plusieurs organes périphériques comme le cœur, le foie et les intestins sont observés, menant à un haut taux de mortalité chez les animaux lésés (Blandini and Armentero, 2012).
L’herbicide à large spectre le plus utilisé, le paraquat, est également utilisé comment agent neurotoxique (Cicchetti et al., 2009). Il est reconnu pour sa structure similaire à celle du MPP+, la molécule neurotoxique métabolisé par l’entrée du MPTP au cerveau (voir section 1.5.1.1) (Blandini and Armentero, 2012). Le paraquat est injecté par voie intrapéritonéale chez les animaux et provoque une perte sélective d’environ 20-30 % des neurones dopaminergiques, plusieurs injections sont nécessaire pour obtenir une dégénérescence significative (Blandini
and Armentero, 2012). Les injections de la neurotoxine vont induire une diminution de l’activité motrice, une perte des fibres dopaminergiques au striatum dépendante de la dose injectée, ainsi que l’expression et l’agrégation d’αSyn dans la SNpc (Blandini and Armentero, 2012; Manning-Bog et al., 2002).
1.5.3 Modèles transgéniques
Des souris transgéniques sont utilisées pour reproduire les formes familiales de la MP (Blandini and Armentero, 2012). Il est important de rappeler que moins de 5 % des cas de MP sont reliés à ces formes familiales (Lesage and Brice, 2009; de Lau and Breteler, 2006). Il est toutefois d’une grande importance d’approfondir les connaissances sur ces causes génétiques afin de comprendre la pathogénèse de la MP.
1.5.3.1 Modèle transgénique Thy1-αSyn
Ce modèle de souris permet une surexpression au niveau du cerveau de la souris de la protéine αSyn humaine sous sa forme native contrôlé par le promoteur Thy-1 (Chesselet et al., 2012; Fleming et al., 2004). Contrairement aux modèles d’injection de neurotoxines, ce modèle présente une accumulation d’αSyn ainsi que des agrégats insolubles pouvant s’apparenter à la formation de corps de Lewy (Delenclos et al., 2014). Un des grands avantages de ce modèle est la présence de problèmes moteurs dès l’âge de quatre mois au niveau de l’activité volontaire, de la coordination motrice ainsi que de la résistance musculaire (Chesselet et al., 2012). Le modèle de souris Thy1-αSyn présente également un léger trouble olfactif (Fleming et al., 2008), qui est connu comme étant un des symptômes précurseurs du développement de la MP (Doty, 2012). Cependant, le modèle transgénique Thy1-αSyn a comme inconvénient l’absence de perte neuronale notable au niveau de la SNpc (Chesselet et al., 2012). Par conséquent, ce type de souris est davantage considéré comme un modèle de synucléinopathie précoce plutôt qu’un modèle de la MP a proprement dit.
Injection de neurotoxines
Toxine Mode d’injection
Neuropathologie Symptômes Avantage / Inconvénient
6-OHDA Stéréotaxique • Perte d’innervation
dopaminergique au
Mouvement rotatoire à
site d’injection • Absence d’inclusion d’apomorphine lorsqu’injecté unilatéralement. symptômes moteurs • Étude des mécanismes de
mort cellulaire
• Nécessite l’intervention d’une chirurgie stéréotaxique • Absence αSyn MPTP Injection intra-péritonéal • Déplétion du système dopaminergique • Diminution de DA au striatum Peu de symptômes
moteurs chez la souris • Permet d’étudier différentes thérapies contre la MP • Possibilité d’étudier les
mécanismes de perte cellulaire
• Perte neuronale non progressive
• Rare présence d’inclusion • Neurorécuparation spontanée
des neurones à moyen terme après la fin des injections de la neurotoxine. Roténone Injection intra-péritonéal • Perte de neurones dopaminergiques, diminution d’innervation dopaminergique au striatum • Présence de αSyn dans les neurones dopaminergiques
Diminution des
activités motrices • Permet de tester des éléments neuroprotecteurs • Beaucoup de mortalité chez
les animaux Paraquat Injection intra-péritonéal • Diminution de l’immunoréactivité de la tyrosine hydroxylase • Aucune présence d’agrégats mais une augmentation de l’immunoréactivité de αSyn
Déficit moteur incertain • Permet d’étudier des traitements en situation de neuroprotection
• Agis sur d’autre système de neurotransmission du cerveau
Modèle Transgénique
Souris Gène Expression Neuropathologie Symptômes Avantages/Inconvénients
α-synucléine SNCA Au cerveau • Généralement peu
ou pas de perte neuronale observée • Présence
d’agrégation d’αSyn dans les neurones du cerveau Déficits moteurs importants principalement dans le modèle A53T • Étude du rôle de l’agrégation de l’αSyn dans la MP.
• Évaluer l’action d’un traitement sur la synucléinopathie • Pas de mort
neuronale
Tableau 1.3 : Différents modèles murins de la MP. Adapté de (Blesa et al., 2012) et (Y. Lee et al., 2012)
1.5.3.2 LRRK2
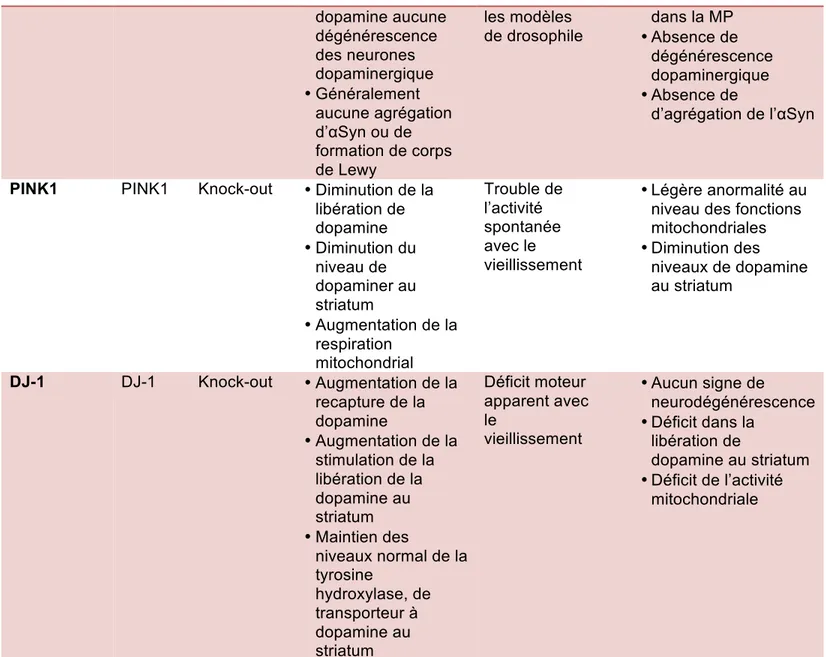
Des mutations au gène LRRK 2 (leucine rich repeat 2) sont connues pour être les mutations les plus communes menant à des cas autosomiques dominants de la maladie (Singleton et al., 2013). Ses polymorphismes associés à la MP sont relativement fréquents (ex : G2019S). Ses mutations génétiques ont donc été exploitées pour la pathogenèse de la MP. Chez les souris LRRK2-G2019S, la modification génétique a pour conséquence de diminuer de 25 % la DA au striatum lorsque les souris atteignent l’âge de 12 mois (Li et al., 2010). Des déficits moteurs
dopamine aucune dégénérescence des neurones dopaminergique • Généralement aucune agrégation d’αSyn ou de formation de corps de Lewy les modèles de drosophile dans la MP • Absence de dégénérescence dopaminergique • Absence de d’agrégation de l’αSyn
PINK1 PINK1 Knock-out • Diminution de la libération de dopamine • Diminution du niveau de dopaminer au striatum • Augmentation de la respiration mitochondrial Trouble de l’activité spontanée avec le vieillissement • Légère anormalité au niveau des fonctions mitochondriales • Diminution des niveaux de dopamine au striatum DJ-1 DJ-1 Knock-out • Augmentation de la recapture de la dopamine • Augmentation de la stimulation de la libération de la dopamine au striatum • Maintien des niveaux normal de la tyrosine hydroxylase, de transporteur à dopamine au striatum Déficit moteur apparent avec le vieillissement • Aucun signe de neurodégénérescence • Déficit dans la libération de dopamine au striatum • Déficit de l’activité mitochondriale
sont également présents dans certains modèles de souris LRRK 2, tels que la LRRK2-R1441G à 12 mois (Bichler et al., 2013).
1.6 Acides gras polyinsaturés oméga-3 (AGPI n-3)
1.6.1 Caractéristiques des acides gras polyinsaturés oméga-3
Les AGPI sont caractérisés par la présence d’une chaîne hydrophobique composée de liaisons doubles carbone-carbone, et comportant au minimum deux liaisons simples et se terminant avec un acide carboxylique, tel qu’illustré dans la figure 2 représentant la structure de l’acide docosahexaénoïque (DHA), un type d’oméga-3 (Das, 2006). Une des caractéristiques des AGPI n-3 est la présence de la première liaison double précédent l’acide carboxylique (Figure 2) (Kaur et al., 2014). Le même principe est applicable chez les AGPI de type oméga-6 (n-6), la première liaison double se trouve niveau du sixième carbone précédent l’acide carboxylique (Kaur et al., 2014)
1.6.2 Composition du cerveau en AGPI
Le cerveau est composé de différents acides gras. Il est possible d’y retrouver des acides gras mono insaturés, principalement sous la forme de palmitate, des oméga-6, principalement par la présence de l’acide arachidonique ainsi que des AGPI n-3, où le DHA est le plus présent, comparativement à l’acide eicosapentaénoïque (EPA) qui est retrouvé qu’en faible trace dans les tissus (Bazan, 2005; Breckenridge et al., 1972; Dyall, 2015; Julien et al., 2006).
Malgré son abondance dans cette région, le processus d’entrée du DHA au cerveau est l’objet de désaccords (Chen et al., 2015). Certaines études montrent que le DHA entre au cerveau par simple diffusion permettant de traverser la barrière hémato-encéphalique (Ouellet et al., 2009; Pélerin et al., 2014). Cette hypothèse a été vérifiée en contexte de compétition en utilisant la technique de perfusion cérébrale in situ avec de l’EPA et du DHA, ce qui a démontré que ces deux AGPI n-3 entraient dans les mêmes proportions au cerveau (Ouellet et al., 2009). Une étude publiée récemment suggère plutôt la présence d’un récepteur situé au niveau de la barrière hémato-encéphalique, qui permettrait l’entrée au
cerveau du DHA présent dans la circulation sanguine (Nguyen et al., 2014). Effectivement, ces travaux publiés par Dr David L. Silver et collaborateurs démontrent que le récepteur Mfsd2a est relié à l’entrée du DHA au cerveau (Nguyen et al., 2014). Une diminution de l’expression de ce récepteur aurait pour conséquence de diminuer l’entrée d’un des AGPI n-3 essentiel au cerveau (Nguyen et al., 2014).
Figure 1.2 : Structure du DHA.
1.6.3 Mécanisme d’action des APGI n-3 au cerveau
Les AGPI n-3 sont essentiels pour la signalisation cellulaire ainsi qu’au bon fonctionnement des cellules (Dyall, 2015). La fluidité des membranes dépend également de l’apport en AGPI n-3 qui se rend au cerveau (Stillwell and Wassall, 2003). En effet, les AGPI n-3 peuvent s’intégrer aux membranes des cellules et ainsi influencer leurs fluidités (Stillwell and Wassall, 2003). Grâce à leurs multiples liaisons simples, la fluidité apportée aux membranes par les AGPI n-3 est plus grande que celle des acides gras saturés ou des molécules de cholestérol qui composent naturellement la membrane cellulaire et qui possèdent une conformation plus rigide que les AGPI (Das, 2006; Haast and Kiliaan, 2015).
Les AGPI n-3, principalement le DHA, possèdent des effets neuroinflammatoires (Laye et al., 2015). L’action du DHA sur les facteurs inflammatoires est principalement due à son action sur l’interleukine- 1β. Le DHA agit en empêchant la sécrétion de peptides impliqués dans l’entrée en apoptose de certains types de cellules (Bazan et al., 2011). L’action du DHA permet également d’inhiber NF-κB et cyclo-oxygénase-2 (COX-2), deux facteurs importants dans la réponse inflammatoire qui provoque l’apoptose des cellules (Bazan et al., 2011; Paterniti et
al., 2014a). Par son impact sur les facteurs inflammatoires, principalement son action sur COX-2, le DHA pourrait être une cible potentielle dans le traitement de la maladie. COX-2 est un facteur inflammatoire important dans le développement de la maladie, tel qu’observé dans le modèle murin MPTP (Teismann, 2012).
1.7 Acide gras polyinsaturés omega-3 et maladie de Parkinson
1.7.1 Effet des AGPI n-3 sur la neurotransmission dopaminergique
L’action des AGPI n-3 s’étend aussi au niveau de la neurotransmission dopaminergique et aux canaux ioniques tel que Ca++, Na+ ainsi que le K+ (Poling et
al., 1996; Bousquet et al., 2011a; Chalon, 2006). C’est d’ailleurs ce qui leur permet d’avoir une influence sur le fonctionnement de la neurotransmission dopaminergique (Tanaka et al., 2012). De plus, les oméga-3 améliorent la plasticité synaptique en augmentant l’expression de protéines synaptiques, la potentialisation neuronale à long terme et la neurogenèse (Tanaka et al., 2012).
1.7.2 Interactions entre AGPI n-3 et la protéine αSyn
L’effet des AGPI n-3 sur la protéine αSyn est encore aujourd’hui un sujet de controverse. Alors que certaines études suggèrent qu’une diète enrichie en AGPI n-3 aurait des effets bénéfiques et permettrait de prévenir l’agrégation de la protéine αSyn, d’autres, au contraire, suggèrent que les AGPI contribueraient à son agrégation (Assayag et al., 2007; Broersen et al., 2006; Sharon et al., 2003a).
Selon certaines études in vitro sur des cellules murines surexprimant l’αSyn, l’enrichissement en DHA du milieu de culture aurait pour conséquence d’accélérer l’oligomérisation et l’agrégation de la protéine αSyn (Sharon et al., 2003a). Cette étude de Sharon et collaborateurs montre également un lien entre l’âge des souris et la cinétique d’agrégation de la protéine αSyn tel que mesuré en quantifiant les agrégats de 85 kDa en immunobuvardage (Sharon et al., 2003a). Le DHA pourrait également favoriser la formation de structure se comparant au corps de Lewy en liant l’histone 70, et ainsi favoriser le développement de la MP (Assayag et al., 2007).
Une autre étude in vitro donne à penser que le DHA libre aurait pour conséquence de modifier la conformation de la protéine αSyn. Effectivement, les résultats d’une étude comparant différents AGPI soutiennent que le DHA, au contraire des autres AGPI n-3, favoriserait la fibrillation et l’agrégation de la protéine αSyn (Broersen et al., 2006). L’augmentation d’hélices α dans le milieu contenant du DHA et de l’acide arachidonique permettrait de suggérer que ces deux composés sont responsables de l’oligomérisation et de la formation d’agrégats insolubles de la protéine. La formation d’hélices α serait une étape intermédiaire à l’agrégation de la protéine αSyn (Broersen et al., 2006). Non seulement le DHA favoriserait l’agrégation de la protéine αSyn, il pourrait également moduler l’expression du gène qui synthétise l’αSyn. Une augmentation du niveau de DHA au cerveau aurait pour conséquence d’augmenter la régulation du gène de production de l’αSyn (Kitajka et al., 2004).
1.8 Effet préventif des AGPI n-3
1.8.1 Études épidémiologiques
Des études épidémiologiques tendent à démontrer qu’une alimentation riche en AGPI n-3 serait associée à une diminution du risque de développer la MP. Par exemple, une étude observe que les gens ayant une alimentation enrichie en AGPI n-3 seraient moins disposés à développer la maladie (de Lau et al., 2005; Calon and Cicchetti, 2009). Cette étude montre qu’une alimentation saine et riche en AGPI permettrait de diminuer les risques de développer la MP, possiblement dus aux effets anti-inflammatoires et à l’action des AGPI n-3 sur les ganglions de la base, une structure impliquée dans le contrôle des mouvements (de Lau et al., 2005; Bousquet et al., 2011a).
1.8.2 Études précliniques
Le DHA par différents mécanismes tels que son action antioxydante est considéré comme agent neuroprotecteur dans plusieurs maladies neurodégénératives, dont la MP (Calon and Cole, 2007). Des études précliniques dans des modèles de souris de la maladie ont été effectuées afin de vérifier les effets neuroprotecteurs d’une alimentation riche en AGPI n-3 principalement avec une supplémentation en