Les effets immédiats d'une séance d'exercice sur
certaines variables locomotrices chez des enfants ayant
une déficience motrice cérébrale
Mémoire
Sophie-Krystale Dufour
Maîtrise en médecine expérimentale – Concentration adaptation-réadaptation
Maître ès sciences (M.Sc.)Québec, Canada
Les effets immédiats d'une séance d'exercice sur
certaines variables locomotrices chez des enfants ayant
une déficience motrice cérébrale
Mémoire
Sophie-Krystale Dufour
Sous la direction de :
Désirée B. Maltais, directrice de recherche
Laurent J. Bouyer, codirecteur de recherche
R
ÉSUMÉLes variables associées à la marche sont typiquement évaluées chez les enfants ayant une déficience motrice cérébrale (DMC) lorsqu’ils sont reposés ou n’ont pas préalablement fait d’exercice. Cela ne reflète pas nécessairement leur réalité quotidienne où la fatigue peut être un enjeu. Deux études ont été menées dans l’objectif d’évaluer les changements locomoteurs immédiats pré- versus post-exercice (modéré ou intense) chez des enfants ayant une DMC légère. L’Étude I (évaluation du membre inférieur plus atteint) rapporte que la fréquence médiane (FM) du tibial antérieur (TA) diminue significativement (>4%) suivant un exercice locomoteur intense, suggérant une fatigue musculaire. Il y a également une augmentation significative de la FM du semi-tendineux (ST) suivant un exercice intense et du triceps sural (TS) suivant un exercice modéré. De plus, une diminution significative de l’amplitude moyenne de l’activation musculaire du ST suivant un exercice modéré et intense, et du TS suivant un exercice intense sont observés. Une association positive entre les changements de coactivation musculaire de la jambe et de la FM du TA post-exercice est également présente. La capacité à maintenir ou augmenter cette coactivation pourrait être un facteur protecteur contre la fatigue musculaire. L’Étude II démontre que la stabilité du patron de la cinématique de marche (SPCM) des membres inférieurs se dégrade significativement suivant un exercice intense. Cette dégradation est particulièrement marquée aux chevilles, suggérant une perte de contrôle optimal du mouvement, possiblement reliée à la fatigue musculaire. Les enfants plus jeunes, moins sédentaires et faisant davantage d’activités physiques vigoureuses démontrent une plus grande SPCM post-exercice à la cheville moins atteinte. Aucun changement de dépense d’énergie métabolique n’a été observé dans les études. En conclusion, les résultats obtenus supportent la pertinence d’évaluer les variables liées à la marche suivant un exercice chez cette population, puisque l’exercice mène à certains changements à la marche.
A
BSTRACTWalking-related variables are typically evaluated in children with cerebral palsy (CP) when they are rested or when they have not previously exercised. This may not necessarily reflect their walking in daily life where fatigue could be an issue. Two studies were carried out to assess immediate locomotor changes pre- versus post-exercise bout (moderate or intense) in children with mild CP. Study I (assessment of the more affected lower limb) found that the tibialis anterior (TA) median frequency (MF) significantly decreased (> 4%) following intense locomotor exercise, suggesting possible muscle fatigue. There was also a significant increase in MF in semitendinosus (ST) following intense exercise and in triceps surae (TS) following moderate exercise. Furthermore, there was a significant decrease in mean amplitude of muscle activation in the ST following moderate and intense exercise and in the TS following intense exercise. A positive association between post-exercise changes in lower leg coactivation and TA MF was also present. The ability to maintain or increase this coactivation may protect against muscle fatigue. Study II showed that lower limbs kinematic pattern stability (KPS) decreased significantly following intense exercise. This decrease was especially marked at the ankles suggesting a loss of optimal ankle movement control, possibly related to muscle fatigue. Younger children, those who are less sedentary and who do more vigorous physical activities demonstrated greater post-exercise KPS at the less affected ankle. No change was found in metabolic energy expenditure in either study. In conclusion, results found support the relevance of assessing walking-related variables during walking following exercise in this population, since exercise leads to certain changes during walking.
A
VANT-
PROPOSJ’aimerais profiter de cet avant-propos pour remercier les personnes qui m’ont accompagnée de près ou de loin dans la réalisation de ce travail. Tout d’abord, j’aimerais remercier ma directrice de recherche, Madame Désirée B. Maltais, qui a été d’un grand support et d’une grande disponibilité. Les discussions fort intéressantes que nous avons eues m’ont appris à penser et réfléchir davantage par moi-même et à avoir confiance en mes décisions et compétences. J’ai beaucoup apprécié sa manière de raisonner et le fait qu’il existe toujours un plan B, C, D, ... et parfois Z! Cela m’a appris à réfléchir aux solutions au lieu d’axer sur le problème. J’aimerais remercier également mes codirecteurs, Monsieur Laurent Bouyer et Madame Hélène Moffet. Ils ont été, tout comme Madame Maltais, d’un grand support dans la supervision de ces années de travail. L’expertise de chacun a permis de rendre ce mémoire pertinent pour la recherche, mais également pour la clinique.
Je remercie le personnel du Centre Interdisciplinaire de Recherche en Réadaptation et Intégration Sociale (CIRRIS) qui m’a accueillie dans leur milieu de travail au cours des dernières années. Un merci particulier à Monsieur Steve Forest au soutien technique pour son aide en laboratoire et pour la résolution des problèmes techniques et à Monsieur Jean Leblond, statisticien, qui m’a aidée à choisir les tests d’analyse statistique adéquats. Merci également à Mesdames Isabelle Argall, Sylvie Racine et Linda Girard qui ont facilité grandement mon travail dans le domaine administratif. Merci à mes collègues et amis qui ont permis de rendre cette aventure encore plus agréable. Rien de tel que la rédaction d’un mémoire dans un Café! J’aimerais faire un remerciement spécial aux physiothérapeutes qui ont participé au recrutement et à tous les enfants et leur famille qui ont participé aux projets de recherche. Sans leur participation précieuse, ce travail n’aurait pu avoir lieu.
Je remercie le CIRRIS, la Chaire de recherche en paralysie cérébrale de l’Université Laval et les Fonds de recherche sur la société et la culture du Québec pour leur soutien financier aux projets de recherche inclus dans ce mémoire. J’aimerais également remercier les organismes subventionnaires pour les bourses d’étude qui m’ont permis
recherche Santé du Québec associés à la Fondation des étoiles, l'Ordre professionnel de la physiothérapie du Québec (OPPQ) et la Fondation de physiothérapie du Canada.
Finalement, je remercie ma famille et amis qui m’ont accompagnée dans ce parcours. Je remercie plus spécialement ma mère qui a su être à l’écoute et qui m’a partagé sa passion d’apprendre. Elle m’a appris que les limites sont plus souvent qu’autrement celles que l’on s’impose et qu’il peut suffire de volonté pour accomplir ce que l’on désire. Je ne peux terminer ces remerciements sans remercier mon mari, Tyson, qui m’a toujours incitée à me dépasser et à avoir de l’ambition. Il m’a accompagnée à travers toutes les étapes de mon parcours universitaire qui fut parsemé de hauts et de bas et m’a encouragée à ne jamais baisser les bras.
Ce mémoire, présenté sous forme de 2 manuscrits rédigés en anglais, contient le résultat de mes travaux de recherche effectués sous la direction de Madame Désirée B. Maltais, et sous la codirection de Monsieur Laurent Bouyer et Madame Hélène Moffet.
Étude I (chapitre 3)
Titre : Locomotor Changes Following an Exercise Bout in Children with Mild Cerebral Palsy
Auteurs : Sophie-Krystale Dufour a, Laurent J. Bouyer a,b, Julien I.A. Voisin a,b,
Hélène Moffet a,b, Chantale Ferland c, Désirée B. Maltais a,b
Affiliations : aCenter for Interdisciplinary Research in Rehabilitation and Social
Integration, Quebec Rehabilitation Institute, Quebec City, Quebec, Canada;
bDepartment of Rehabilitation, Université Laval, Quebec City, Quebec, Canada; cCentre intégré universitaire de santé et de services sociaux (CIUSSS) de la
Capitale-Nationale, Quebec City, Quebec, Canada
Rôles de l’étudiante : Élaboration du protocole de laboratoire, collecte et analyse
des données, analyses statistiques, rédaction du manuscrit sous la supervision des coauteurs.
État de publication : Cet article est en processus de soumission à la revue Pediatric
Exercise Science.
Étude II (chapitre 4)
Titre : An Intense Exercise Bout Results in Walking Pattern Changes that are related to Physical Activity Performance in Children with Mild Cerebral Palsy
Auteurs : Sophie-Krystale Dufour a, Nory Lansing a, Laurent J. Bouyer a,b, Hélène
Moffet a,b, Chantale Ferland c, Désirée B. Maltais a,b
Affiliations : aCenter for Interdisciplinary Research in Rehabilitation and Social
Integration, Quebec Rehabilitation Institute, Quebec City, Quebec, Canada;
bDepartment of Rehabilitation, Université Laval, Quebec City, Quebec, Canada; cCentre intégré universitaire de santé et de services sociaux (CIUSSS) de la
Capitale-Nationale, Quebec City, Quebec, Canada
Rôles de l’étudiante : Élaboration du protocole de laboratoire, collecte et analyse
des données, analyses statistiques, rédaction du manuscrit sous la supervision des coauteurs.
État de publication : Cet article est en processus de soumission à la revue Clinical
Biomechanics.
D
ÉDICACE« Vivez comme si vous deviez mourir demain. Apprenez comme si vous pouviez vivre toujours. »
T
ABLE DES MATIÈRESRésumé ... iii
Abstract ... iv
Avant-propos ... v
Dédicace ... viii
Table des matières ... x
Liste des tableaux ... xiii
Liste des figures ... xiv
Liste des abréviations utilisées ... xv
Liste des annexes ... xvii
Chapitre 1 : Introduction ... 1
1.1 Déficience motrice cérébrale... 2
1.1.1 Définition ... 2
1.1.2 Prévalence ... 3
1.1.3 Processus diagnostique ... 3
1.1.4 Facteurs de risque ... 4
1.1.5 Déficiences primaires ... 5
1.1.6 Systèmes de classification en lien avec la motricité ... 5
1.2 Déficiences secondaires ayant un impact sur la marche ... 10
1.3 Conséquences des déficiences secondaires liées à la marche ... 11
1.3.1 Faible niveau habituel d’activité physique ... 11
1.3.2 Fatigue musculaire ... 13
1.4 Résumé de la problématique ... 18
1.5 Objectifs ... 18
1.5.1 Objectifs spécifiques : Étude I ... 18
1.5.2 Objectifs spécifiques : Étude II ... 19
1.6 Hypothèses ... 19
1.6.1 Hypothèses spécifiques : Étude I ... 19
1.6.2 Hypothèses spécifiques : Étude II ... 20
Chapitre 2 : Méthodologie ... 21
2.1 Participants ... 21
2.1.1 Critères d’inclusion ... 21
2.1.2 Critères d’exclusion ... 21
2.2 Recrutement des participants ... 22
2.3 Considérations éthiques ... 22
2.4 Formation des évaluatrices ... 22
2.5 Tests et mesures ... 23
2.5.1 Caractéristiques personnelles et cliniques des participants... 23
2.5.2 Tests locomoteurs ... 23
2.5.3 Mesures cardio-respiratoires ... 25
2.5.4 Électromyographie de surface (Étude I, chapitre 3) ... 27
2.5.5 Électrogoniométrie (Étude II, chapitre 4) ... 31
2.5.6 Accélérométrie (Étude II, chapitre 4) ... 34
2.6 Devis des études ... 36
2.7 Protocole général d’évaluation en laboratoire ... 39
2.7.1 Protocole d’évaluation spécifique à l’Étude I (chapitre 3) ... 39
2.8 Analyses statistiques ... 40
2.9 Articles découlant des projets de recherche ... 42
Chapitre 3 : Étude I ... 43 3.1 Résumé ... 44 3.2 Abstract ... 45 3.3 Introduction ... 46 3.4 Methods ... 47 3.4.1 Participants ... 47 3.4.2 Protocol ... 48 3.4.3 Locomotor exercise ... 48 3.4.4 Electromyographic variables ... 49 3.4.5 Cardiorespiratory variables ... 50 3.4.6 Statistical analysis ... 51 3.5 Results ... 51
3.5.1 Participant and exercise test characteristics ... 51
3.5.2 The effects of locomotor exercise on electromyographic variables and metabolic energy expenditure ... 52
3.5.3 The relationship between median frequency changes suggestive of muscle fatigue and lower limb antagonist muscle coactivation ... 52
3.6 Discussion ... 53
3.6.1 Clinical relevance ... 55
3.6.2 Strengths and limitations of the study ... 56
3.7 Acknowledgments ... 57
Chapitre 4 : Étude II... 64
4.1 Résumé ... 65 4.2 Abstract ... 66 4.3 Introduction ... 67 4.4 Methods ... 68 4.4.1 Participants ... 68 4.4.2 Protocol ... 68 4.4.3 Kinematic variables ... 69 4.4.4 Cardiorespiratory variables ... 70
4.4.5 Physical activity variables ... 70
4.4.6 Statistics ... 71
4.5 Results ... 72
4.5.1 Pre- and post-exercise differences for kinematic and metabolic energy expenditure ... 72
4.5.2 Association between kinematic and related physical activity factors ... 73
4.6 Discussion ... 73
4.6.1 Effects of exercise on kinematic and cardiorespiratory variables ... 73
4.6.2 Association between kinematic and related-variables of habitual physical activity ... 74
4.6.3 Clinical relevance ... 75
4.6.4 Strengths and limitations of the study ... 75
4.7 Conclusion ... 76
4.8 Acknowledgments ... 77
5.2 Effet de l’exercice sur les variables cinématiques et sur la dépense
d’énergie métabolique (Étude II, chapitre 4)...85
5.3 Association entre la cinématique et les variables reliées à l’activité physique (Étude II, chapitre 4) ... 86
5.4 Forces et limitations des études ... 87
5.4.1 Forces et limitations de l’Étude I (chapitre 3) ... 87
5.4.2 Forces et limitations de l’Étude II (chapitre 4) ... 89
5.5 Avenues futures générales au plan de la recherche ... 90
5.6 Retombées cliniques... 91
5.6.1 Retombées cliniques spécifiques à l’Étude I (chapitre 3) ... 91
5.6.2 Retombées cliniques spécifiques à l’Étude II (chapitre 4) ... 92
Chapitre 6 – Conclusion ... 93
Bibliographie ... 94
L
ISTE DES TABLEAUXChapitre 1
Tableau 1.1 : Résumé des facteurs de risque rencontrés selon la période gestationnelle ...4 Tableau 1.2 : Définitions des termes du système de classification basé sur les anormalités motrices...7 Tableau 1.3 : Définitions des termes du système de classification basé sur la distribution topographique de la spasticité...7 Tableau 1.4 : Critères principaux des différents niveaux du système de classification de la fonction motrice globale (GMFCS) pour les enfants de 6 à 12 ans...8 Tableau 1.5 : Exemples d’activités selon les différents niveaux d’intensité de l’activité...12 Tableau 1.6 : Résumé des études en laboratoire portant sur les mesures de fatigue musculaire...15
Chapitre 2
Tableau 2.1 : Points de repère segmentaires et centre articulaire utilisés pour l’alignement lors de l’installation des électrogoniomètres...33 Tableau 2.2 : Critères d’intensité de l’activité selon les critères d’Evenson...36
Chapitre 4
Table 4.1 : The effect of time on kinematic pattern stability at the hip, knee and ankle, bilaterally...………..………..78
L
ISTE DES FIGURESChapitre 2
Figure 2.1 : Système métabolique portable, vue antérieure...26 Figure 2.2 : Système sans fil de l’électromyographie et système métabolique portable, vue sagittale...28 Figure 2.3 : Courbe obtenue suite à la transformation rapide de Fourier permettant le calcul de la fréquence médiane du signal EMG...30 Figure 2.4 : Réduction de la fréquence médiane du signal EMG suite à un exercice exigeant; avant (a) et après (b) l’exercice exigeant...30 Figure 2.5 : Chevauchement des enveloppes linéaires moyennes de deux muscles antagonistes...31 Figure 2.6 : Système sans fil de l’électrogoniométrie et système métabolique portable, vue sagittale...32 Figure 2.7 : Électrogoniomètres sans fil Biometrics pour la cheville (a) et le genou et la hanche (b)...33 Figure 2.8 : Positionnement de l’accéléromètre GT3X...35 Figure 2.9 : Ordre des tests attribués de manière aléatoire lors des séances de l’Étude I...37 Figure 2.10 : Ordre des tests lors de la séance de l’Étude II...38
Chapitre 3
Figure 3.1 : Boxplots for the median frequency during pre- and post-exercise walks for the four muscle groups………59 Figure 3.2 : Boxplots for the mean amplitude of muscle activation during pre- and post-exercise walks for the four muscle groups...…………....60 Figure 3.3 : Boxplots for the lower limb antagonist muscle coactivation during pre- and post-exercise walks for the thigh and the lower leg...61 Figure 3.4 : Boxplots for the oxygen uptake during steady state of the pre- and post-exercise walks…….……..……….….……62
Chapitre 4
Figure 4.1 : Boxplots for the walking kinematic pattern stability (WKPS) for the four time conditions; early and late stages of the pre-exercise (pre) and post-exercise (post) walks for the more affected ankle (A) and the less affected ankle (B) ………..…...…..…79
L
ISTE DES ABRÉVIATIONS UTILISÉES6MWT Six-minute walk test
10mSRT 10-m shuttle run test
AM-CoA Antagonist muscle coactivation
AP Activité physique
bpm Battements par minute
CIRRIS Centre interdisciplinaire de recherche en réadaptation et intégration sociale
CIUSSS Centre intégré universitaire de santé et de services sociaux
CoA-MA Coactivation des muscles antagonistes
CP Cerebral palsy
DF Droit fémoral
DÉM Dépense d’énergie métabolique
DMC Déficience motrice cérébrale
EMG Électromyographie; electromyography (anglais)
ES Enfants sains
ES Effect size
ÉT Écart-type
FC Fréquence cardiaque
FM Fréquence médiane
GMFCS Gross Motor Function Classification System
HR Heart rate
IC Indice de coactivation
ICC Coefficient de corrélation intra-classe; Intraclass correlation coefficient (anglais)
INT Exercice locomoteur intense; intense locomotor exercise (anglais) LAA-WKPS Less affected ankle walking kinematic pattern stability
MEE Metabolic energy expenditure
mEMG Amplitude moyenne de l’activation musculaire; mean amplitude of
MF Median frequency
MOD Exercice locomoteur modéré; moderate locomotor exercise (anglais) PA Physical activity
RER Ratio expiratoire respiratoire; respiratory exchange ratio (anglais) SD Standard deviation
SENIAM Surface electromyography for the non-invasive assessment of muscles
SKD Sophie-Krystale Dufour
SPCM Stabilité du patron de la cinématique de marche
SPCM-CMA Stabilité du patron de la cinématique de marche de la cheville moins atteinte
ST Semi-tendineux; semitendinosus (anglais)
TA Tibial antérieur; tibial anterior (anglais) TCN-10m Test de course navette sur 10 mètres
TM6M Test de marche de 6 minutes
TS Triceps sural; triceps surae (anglais)
𝑉𝐶̇𝑂2 Élimination du dioxyde de carbone VL Vaste latéral; vastus lateralis (anglais)
VMQ Valeur moyenne quadratique (root mean square)
𝑉̇𝑂2 Consommation d’oxygène; oxygen consumption (anglais)
L
ISTE DES ANNEXESAnnexe A
Certificats d’éthique...103
Annexe B
Feuillets d’information et formulaires de consentement...106
Annexe C
Questionnaire – Données du participant...118
Annexe D
Consignes sur comment porter l’accéléromètre...122
Annexe E
CHAPITRE 1 : INTRODUCTION
La déficience motrice cérébrale1 (DMC) est une des pathologies neurologiques les plus
communes rencontrées en réadaptation physique chez l’enfant2 [Oskoui et al., 2013a].
La capacité à la marche est souvent limitée chez ces enfants et son amélioration représente un objectif important de leur réadaptation [Jahnsen et al., 2003]. Une des conséquences de cette limitation à la marche observée chez ce groupe d’enfants est une réserve métabolique diminuée comparativement à celle des enfants sains3
[Dallmeijer et al., 2011], résultant en une augmentation de la dépense d’énergie métabolique lors de la marche [Dallmeijer et al., 2011, Eken et al., 2016, Rose et al., 1989, Thomas et al., 2009, Unnithan et al., 1996, Waters et al., 1999]. Cela pourrait expliquer, en partie, leur niveau d’activité physique diminué [Maltais et al., 2005a, Maltais et al., 2005b] et la fatigue musculaire rencontrée lors de leurs activités locomotrices quotidiennes [Brunton et al., 2013, Eken et al., 2016]. De plus, le fait que ce niveau d’activité physique soit diminué chez ces enfants pourrait permettre d’éviter ou de réduire l’impact de la fatigue musculaire causée par l’activité [Maltais et al., 2005a].
Les études actuelles qui évaluent les variables reliées à la marche le font dans un contexte où l’enfant ayant une DMC est reposé, et lorsqu’il exécute des tâches non-locomotrices et de courtes durées [Eken et al., 2014, Leunkeu et al., 2010, Moreau et
al., 2016, Moreau et al., 2008, Stackhouse et al., 2005], ou encore, dans un contexte où
l’enfant exécute des tâches locomotrices de courte durée sans avoir fait d’exercice préalable [Bar-On et al., 2014, Bruijn et al., 2013, Gross et al., 2015, Iosa et al., 2012, Iosa et al., 2013, Van Campenhout et al., 2014]. Ces protocoles en laboratoire pourraient ne pas être représentatifs, en termes d’exigence, de la marche réalisée sur une base quotidienne puisque la fatigue, qui peut être un enjeu important et peut
1 Les termes « paralysie cérébrale » et « déficience motrice cérébrale » désignent la même pathologie. Le terme
« déficience motrice cérébrale » (DMC) sera utilisé dans ce mémoire.
2 Le terme « enfant(s) » sera utilisé pour représenter les enfants et les adolescents. Selon l’UNICEF (Fonds des
Nations unies pour l'enfance), l’enfant est défini comme « tout être humain de moins de dix-huit ans ». Une distinction entre les deux groupes sera faite, lorsque nécessaire.
UNICEF. Convention internationale des droits de l'enfant, article 1er. 1990.
3 Afin d’être plus concis, le terme « enfant(s) sain(s) » sera utilisé pour décrire les enfants et adolescents ayant
un développement typique. Dans les manuscrits de langue anglaise, le terme « typically developing children » sera utilisé.
influencer les variables liées à la marche, n’est pas prise en compte. L’évaluation des variables liées à la marche dans un contexte où l’enfant n’est pas reposé, suite à un exercice physique exigeant adapté pour ces enfants, pourrait être pertinente afin de comprendre l’impact de la fatigue musculaire dans un contexte qui pourrait ressembler davantage au quotidien de ces enfants.
Les études qui composent ce mémoire portent donc sur les changements locomoteurs suivant une séance d’exercice (Étude I : exercice modéré et intense; Étude II : exercice intense) et sur les relations entre ces changements locomoteurs (Étude I) et d’autres variables telles l’activité physique, le comportement sédentaire et certains facteurs sociodémographiques reliés à l’activité physique (Étude II) chez des enfants ayant une DMC et marchant de manière autonome.
Dans les prochaines sections de cette introduction, des précisions sont apportées sur la pathologie neurologique retrouvée chez la population cible étudiée dans ce mémoire en faisant un survol des aspects suivants : la définition de la DMC, le processus diagnostique employé, les facteurs de risque qui peuvent mener à la DMC, les déficiences primaires, les systèmes de classification utilisés et les déficiences secondaires ayant un impact sur la marche de ces enfants. Puis, les conséquences de ces déficiences sont explorées, et les objectifs et hypothèses du mémoire sont présentés. Le chapitre 2 présente les outils de mesure et la méthodologie employée de manière plus détaillée. Les chapitres 3 et 4 présentent les études qui ont été effectuées : 1) « Locomotor Changes Following an Exercise Bout in Children with Mild Cerebral
Palsy » et 2) « An Intense Exercise Bout Results in Walking Pattern Changes that are related to Physical Activity Performance in Children with Mild Cerebral Palsy ».
Finalement, le chapitre 5 aborde les discussions des deux études et le chapitre 6 présente la conclusion des travaux de ce mémoire.
1.1 Déficience motrice cérébrale 1.1.1 Définition
progressives se produisant dans l’encéphale pendant le développement du fœtus ou de l’enfant. Les troubles moteurs de la DMC sont souvent accompagnés de troubles de la sensibilité, de la perception, de la cognition, de la communication et du comportement, par de l'épilepsie et par des problèmes musculo-squelettiques secondaires » (traduction libre de Rosembaum et al. (2007)).
1.1.2 Prévalence
Selon une revue systématique récente [Oskoui et al., 2013a] portant sur l’analyse de 49 études, la prévalence globale mondiale de la DMC est de 2,11 par 1000 naissances vivantes. Ce chiffre augmente de façon importante à 59,18 par 1000 naissances vivantes pour les enfants de faible poids à la naissance (1000 à 1499 g) et à 111,80 par 1000 naissances vivantes pour les enfants nés prématurément, avant la 28e semaine
de gestation. Les données québécoises suivent cette tendance mondiale [Oskoui et al., 2013b].
1.1.3 Processus diagnostique
Il n’existe pas de test diagnostique spécifique à la DMC étant donné la variabilité des désordres qui pourraient mener à ce problème de santé [Blair, 2010]. Le diagnostic porte sur le jugement clinique fait par le médecin à partir de plusieurs sources d’informations comme les facteurs de risque présents (voir section 1.1.4), les résultats des tests de neuro-imagerie (l’ultrason, la tomodensitométrie et plus particulièrement, l’imagerie par résonance magnétique [Blair, 2010, Reddihough et al., 2003]) et les résultats des tests cliniques sur le développement moteur et l’intégrité du système nerveux central [Campbell et al., 2012, Sankar et al., 2005]. L’imagerie par résonance magnétique est particulièrement recommandée pour identifier les lésions dans l’encéphale en raison de sa qualité d’image [Blair, 2010, Stanley et al., 2000]. Il demeure tout de même que dans 10 à 20% des enfants ayant une DMC, la résolution actuelle de la neuro-imagerie n’est pas suffisamment puissante pour démontrer les lésions [Blair, 2010]. En raison de l’absence d’un test diagnostique, le diagnostic différentiel est un élément clé dans le processus d’identification de la pathologie [Sankar et al., 2005]. Généralement, les atteintes motrices de la DMC sont apparentes dans les 18 premiers mois de vie [Bax et
1.1.4 Facteurs de risque
Il n’y a pas de causes spécifiques menant à la DMC, mais plutôt une combinaison de facteurs de risque (évènements et/ou éléments nocifs) survenant à un moment crucial, dans le bon ordre chronologique du développement, communément appelés « voie causale » [Reddihough et al., 2003]. Ces facteurs sont divisés selon les différentes périodes gestationnelles soient : prénatale, périnatale et postnatale, en fonction de la vulnérabilité des régions cérébrales en croissance lors de ces phases. Une proportion plus élevée de cas (70-80% des cas) surviennent lors de la période prénatale [Bax et
al., 2006, Reddihough et al., 2003, Sankar et al., 2005]. Voir le tableau 1.1 pour un
résumé des facteurs de risque les plus importants.
Tableau 1.1 : Résumé des facteurs de risque rencontrés selon la période gestationnelle
Période
gestationnelle Facteurs de risque associés
Prénatale
- Infections intra-utérines transmises au fœtus [Bax et al., 2006]; - Maladies maternelles (ex. : thrombophilie) [Blair, 2010];
- Grossesse multiple [Blair, 2010, Pakula et al., 2009]; - Malformations congénitales [Blair, 2010];
- Toxicité à l’alcool [Stanley et al., 2000].
Périnatale
- Prématurité (< 37 semaines) [Nelson, 2008, Pakula et al., 2009]; - Faible poids à la naissance (très petit : < 1500g et extrêmement
petit : < 1000g) [Nelson, 2008, Pakula et al., 2009];
- Complications à la naissance (dystocie, hémorragie, présentation anormale du fœtus) [Reddihough et al., 2003];
- Asphyxie intrapartum [Nelson, 2008]; - Encéphalopathie néonatale [Nelson, 2008].
Postnatale
- Blessures accidentelles (véhicule motorisé, quasi-noyade) et non-accidentelles (coup volontaire) [Reddihough et al., 2003];
- Accident vasculaire cérébral [Reddihough et al., 2003]; - Complications chirurgicales [Reddihough et al., 2003];
1.1.5 Déficiences primaires
Les facteurs de risque, résumés au tableau 1.1, seront prédominants à certaines phases du développement cérébral puisque, selon le stade de développement du système nerveux central, les structures cérébrales seront plus vulnérables à ces évènements ou éléments nocifs [Stanley et al., 2000]. Ces facteurs mèneront à des lésions primaires non progressives du système nerveux central [Blair, 2010].
Lors du premier trimestre, au cours des 20 premières semaines post-conception [Stanley et al., 2000], ce sont davantage les malformations cérébrales qui sont rencontrées et qui sont présentes chez environ 10% des enfants ayant une DMC [Bax
et al., 2006, Garne et al., 2008]. Notons parmi les plus fréquentes la microcéphalie et
l’hydrocéphalie [Garne et al., 2008]. Les enfants ayant une DMC présentent cent fois plus de ces deux déficiences primaires que la population générale [Garne et al., 2008]. Les dommages à la substance blanche de type hypoxie-ischémique touchent pour leur part environ 40% des enfants ayant une DMC [Bax et al., 2006] et apparaissent davantage lors des semaines 23 à 34 post-conception[Bax et al., 2006, Rezaie et al., 2002, Robinson et al., 2009]. La lésion de la substance blanche la plus commune associée à la DMC au cours de cette période est la leucomalacie périventriculaire [Rezaie et al., 2002]. Lors du dernier trimestre de gestation ou chez les enfants nés à terme [Bax et al., 2006], ce sont principalement les atteintes de la substance grise (touchent environ 30% des enfants ayant une DMC [Bax et al., 2006]) qui seront rencontrées telles que des lésions des ganglions de la base et du thalamus, des lésions focales et des lésions para-sagittales. C’est à cette étape du développement que se forment le cortex, le cervelet et les noyaux gris centraux [Stanley et al., 2000].
1.1.6 Systèmes de classification en lien avec la motricité
L’hétérogénéité des désordres liés à la DMC [Bax et al., 2005] et par conséquence, l’hétérogénéité des déficiences, limitations et restrictions, fait en sorte que des systèmes de classification sont nécessaires afin de faciliter la description des différents portraits cliniques possibles [Howard et al., 2005]. Les systèmes de classifications actuellement utilisés en lien avec la motricité chez les enfants ayant une DMC sont décrits ci-dessous. Ceux-ci peuvent être utilisés en complémentarité afin de bien détailler le portrait clinique.
1.1.6.1 En fonction des anormalités motrices
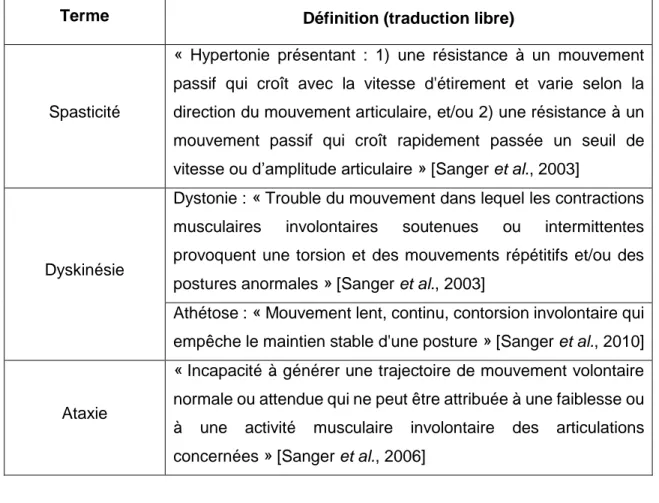
Ce système classe les enfants selon l’anormalité motrice prédominante : la spasticité, la dyskinésie ou l’ataxie [Bax et al., 2005]. De plus, la dyskinésie est sous-divisée en deux sous-catégories : l’athétose et la dystonie. Les définitions des termes se trouvent dans le tableau 1.2 et proviennent de consensus de spécialistes dans le domaine [Sanger et al., 2006, Sanger et al., 2010, Sanger et al., 2003]. La spasticité est l’anormalité motrice ayant la plus grande prévalence, touchant plus de 85% des enfants ayant une DMC [Beckung et al., 2008, Howard et al., 2005]. Bien que les enfants pourraient avoir plus d’un type d’anormalité motrice (anormalité mixte), il n’y a pas d’accord dans les écrits scientifiques sur la pertinence d’utiliser le terme « mixte » comme autre catégorie de classification [Rosenbaum et al., 2007]. Malgré le fait que ce système de classification soit souvent utilisé en clinique, un problème de validité et de fidélité a été noté [Gorter et al., 2004], même chez des évaluateurs expérimentés (taux d’entente de 40% sur le type de déficit moteur) [Blair et al., 1985]. Cette classification repose beaucoup sur le jugement clinique de l’évaluateur. La subjectivité qui se trouve souvent dans l’évaluation de ces anormalités en clinique, et le manque de consensus dans les écrits scientifiques concernant les définitions des termes utilisés, peuvent conduire à ce problème [Sanger et al., 2006].
1.1.6.2 En fonction de la distribution topographique de la spasticité
Pour les enfants ayant de la spasticité, il existe une sous-classification selon la distribution topographique de celle-ci, divisée en trois catégories : la quadriplégie ou tétraplégie, la diplégie et l’hémiplégie (droite ou gauche) [Stanley et al., 2000]. Les définitions des termes sont fournies dans le tableau 1.3 ci-dessous. Comme pour le système basé sur l’anormalité motrice, un problème de validité et fidélité est également noté [Gorter et al., 2004], probablement en raison de l’hétérogénéité des termes utilisés, principalement pour « quadriplégie » et « diplégie » qui sont parfois confondus [Howard
Tableau 1.2 : Définitions des termes du système de classification basé sur les anormalités motrices
Tableau 1.3 : Définitions des termes du système de classification basé sur la distribution topographique de la spasticité
Terme Définition (traduction libre)
Quadriplégie / Tétraplégie
« Atteinte bilatérale impliquant davantage ou de manière égale les membres supérieurs » [Stanley et al., 2000]
Diplégie « Atteinte bilatérale impliquant davantage les membres inférieurs que les membres supérieurs » [Stanley et al., 2000]
Hémiplégie
« Atteinte unilatérale impliquant généralement davantage les membres supérieurs que les membres inférieurs » [Stanley et
al., 2000]
Terme Définition (traduction libre)
Spasticité
« Hypertonie présentant : 1) une résistance à un mouvement passif qui croît avec la vitesse d'étirement et varie selon la direction du mouvement articulaire, et/ou 2) une résistance à un mouvement passif qui croît rapidement passée un seuil de vitesse ou d’amplitude articulaire » [Sanger et al., 2003]
Dyskinésie
Dystonie : « Trouble du mouvement dans lequel les contractions musculaires involontaires soutenues ou intermittentes provoquent une torsion et des mouvements répétitifs et/ou des postures anormales » [Sanger et al., 2003]
Athétose : « Mouvement lent, continu, contorsion involontaire qui empêche le maintien stable d'une posture » [Sanger et al., 2010]
Ataxie
« Incapacité à générer une trajectoire de mouvement volontaire normale ou attendue qui ne peut être attribuée à une faiblesse ou à une activité musculaire involontaire des articulations concernées » [Sanger et al., 2006]
1.1.6.3 En fonction des habiletés motrices fonctionnelles
Le système de classification de la fonction motrice globale (« Gross Motor Function
Classification System »; GMFCS) a été développé afin de tenir compte des limitations
et restrictions reliées aux déplacements. Cette échelle de classification est divisée en cinq niveaux distincts de fonctionnement. Les capacités à maintenir une posture (surtout celles en position assise et debout), à effectuer un transfert, ainsi que la capacité à marcher dans différents environnements sont évaluées suivant des critères spécifiques qui changent selon l’âge de l’enfant. Les critères sont basés sur différentes tranches d’âge : moins de 2 ans, 2 à 4 ans, 4 à 6 ans, 6 à 12 ans et 12 à 18 ans. Ce système de classification a démontré une bonne validité (valeur prédictive positive de 0,74 pour prédire la capacité à la marche à 12 ans chez les enfants de 1 à 2 ans), une excellente fidélité inter-évaluateur (coefficient de généralisabilité = 0,93) et une bonne fidélité test-retest (coefficient de généralisabilité = 0,79) [Palisano et al., 1997b, Wood et al., 2000]. Le tableau 1.4 présente les critères principaux des différents niveaux du GMFCS spécifiques aux enfants d’âge scolaire de 6 à 12 ans.
Tableau 1.4 : Critères principaux des différents niveaux du système de classification de la fonction motrice globale (GMFCS) pour les enfants de 6 à 12 ans [Palisano et al., 1997a]
Niveau au
GMFCS Critères principaux
Niveau I
- Capacité à marcher sans auxiliaire de marche à l’intérieur et l’extérieur; - Capacité à monter/descendre un escalier sans rampe;
- Capacité à courir et sauter, mais la vitesse d’exécution, le maintien de l’équilibre et la coordination des mouvements sont limités.
Niveau II
- Capacité à marcher sans auxiliaire de marche dans la plupart des situations, utilisation possible d’une assistance physique à l’extérieur et d’un équipement de mobilité sur roues pour les longues distances; - Difficultés à marcher sur terrain accidenté, plans inclinés, dans une
foule, dans des espaces confinés ou lors du transport d’un objet; - Capacité à monter/descendre un escalier avec une rampe ou une
Niveau III
- Capacité à marcher avec une aide technique à la marche à l’intérieur et à l’extérieur, utilisation d’un équipement de mobilité sur roues pour les longs déplacements;
- Capacité à monter/descendre un escalier avec une rampe sous la surveillance d’un adulte ou avec une assistance physique.
Niveau IV
- Utilisation d’une assistance physique à la marche ou d’une aide motorisée dans la plupart des situations, utilisation possible d’un déambulateur avec une assise et un soutien du tronc à l’intérieur; - Utilisation d’une aide motorisée pour les déplacements à l’extérieur ou
dans la collectivité, ou déplacement en fauteuil roulant manuel poussé.
Niveau V
- Déplacements en fauteuil roulant manuel poussé par un adulte dans toutes les situations de la vie quotidienne, capacité à utiliser une aide motorisée associée à de multiples adaptations techniques;
- Limitation à maintenir un contrôle postural antigravitaire de la tête et du tronc et limitation du contrôle volontaire des bras et des jambes; - Déplacements possibles au sol à l’intérieur sur de courtes distances
ou déplacements par un adulte qui supporte l’enfant.
Puisque le contexte environnemental et la morphologie changent avec l’âge, certains critères diffèrent pour les niveaux II à IV pour la tranche d’âge scolaire de 12 à 18 ans (les critères principaux pour les niveaux I et V demeurent les mêmes). Parmi les différences les plus importantes [Palisano et al., 1997a], notons pour les enfants de niveau II, que les facteurs environnementaux4 et les préférences personnelles
influencent leurs choix de mode de déplacement. À l’école ou au travail, ces adolescents peuvent, pour des raisons de sécurité, marcher avec une aide technique à la marche. Pour les enfants de niveau III, le choix des méthodes de déplacement dépend de leur capacité physique, des facteurs environnementaux et des facteurs personnels5. À
4 Les facteurs environnementaux constituent l'environnement physique, social et attitudinal dans lequel les gens vivent et
mènent leur vie. Ils peuvent avoir une influence positive ou négative sur la performance de la personne, sur la capacité de la personne, ou sur une fonction organique ou une structure anatomique.
OMS. Classification internationale du fonctionnement, du handicap et de la santé : CIF. Organisation mondiale de la santé (OMS). Genève 2001.
5 Les facteurs personnels représentent le cadre de vie particulier d'une personne, composé de caractéristiques de la
personne qui ne font pas partie d'un problème de santé ou d'un des états de la santé. Il peuvent inclure le sexe, la race, l'âge, les autres problèmes de santé, la condition physique, le mode de vie, les habitudes, etc.
l’école, ils propulsent leur fauteuil roulant manuel ou utilisent une aide motorisée alors qu’à l’extérieur et dans la collectivité, ils sont déplacés en fauteuil roulant ou utilisent une aide motorisée. Quant à ceux de niveau IV, ils utilisent un équipement de mobilité sur roues pour se déplacer dans la plupart des situations.
1.2 Déficiences secondaires ayant un impact sur la marche
La présente section portera principalement sur les enfants marchant sans auxiliaire de marche puisqu’ils représentent plus de la moitié des enfants ayant une DMC [Beckung
et al., 2008, Howard et al., 2005] et constituent le groupe d’enfants étudié dans les
projets de recherche présentés dans ce mémoire. Les déficiences secondaires portant davantage sur l’atteinte à la marche seront donc abordées.
Bien que les déficiences primaires soient non progressives, cela n’est pas toujours le cas pour les déficiences secondaires [Blair, 2010]. Elles seront influencées, entre autres, par le développement du cerveau lors de la petite enfance et par la croissance de l’enfant [Rosenbaum et al., 2007]. Elles pourraient être vues également comme une conséquence directe ou indirecte des déficiences primaires de l’encéphale. Les déficiences secondaires liées à la marche touchent différents systèmes tels que le système neuromusculaire (ex. : perturbation du tonus musculaire, coactivation musculaire), le système musculo-squelettique (ex. : faiblesse musculaire, contractures, déformations squelettiques) et le système cardio-respiratoire (ex. : diminution de la capacité cardio-respiratoire, augmentation de la dépense d’énergie métabolique) qui sont inter-reliés [Unnithan et al., 1996].
Par exemple, une augmentation significative de la coactivation musculaire, correspondant à la contraction simultanée des muscles antagoniste et agoniste, [Unnithan et al., 1996] est plus souvent présente aux membres inférieurs chez les enfants ayant une DMC comparativement aux enfants sains lors de l’exécution d’un mouvement volontaire [Elder et al., 2003, Stackhouse et al., 2005, Unnithan et al., 1996]. Celle-ci peut causer une augmentation de la dépense d’énergie métabolique et peut conduire à une fatigue précoce des groupes musculaires impliqués [Feltham et al.,
des mouvements volontaires pouvant mener également à une augmentation de la dépense d’énergie métabolique [Balaban et al., 2012].
De plus, les enfants ayant une DMC et qui sont ambulants ont une réserve métabolique réduite [Dallmeijer et al., 2011], ils ont donc un désavantage physiologique comparativement aux enfants sains lors d’activités locomotrices. Tel que mentionné au début de l’introduction, ils ont une dépense d’énergie métabolique plus élevée pour réaliser une même activité [Dallmeijer et al., 2011, Eken et al., 2016, Rose et al., 1989, Thomas et al., 2009, Unnithan et al., 1996, Waters et al., 1999]. En ayant une réserve métabolique plus basse, le seuil de fatigue peut alors être diminué et les enfants ayant une DMC peuvent donc éprouver de la fatigue musculaire plus rapidement [Bar-Or et
al., 2004, Maltais et al., 2005a]. En plus d’être lié à des stratégies motrices perturbées
telles que la coactivation musculaire [Unnithan et al., 1996], le niveau de dépense d’énergie métabolique serait également lié au niveau habituel d’activité physique chez les enfants ayant une DMC [Maltais et al., 2005a]. Ainsi, ceux ayant une réserve métabolique diminuée, dépensant donc plus d’énergie métabolique, participeraient moins à des activités physiques que les enfants ayant une plus grande réserve métabolique [Maltais et al., 2005a].
1.3 Conséquences des déficiences secondaires liées à la marche
Les déficiences secondaires liées à la marche mentionnées à la section précédente ont des conséquences sur le bon fonctionnement et la capacité à marcher des enfants ayant une DMC et marchant sans auxiliaire de marche. Les répercussions engendrées, telles que le faible niveau d’activité physique et la fatigue musculaire, auront un impact sur la vie quotidienne, mais également sur le fonctionnement à long terme de ces enfants [Bauman, 2009, Damiano, 2006].
1.3.1 Faible niveau habituel d’activité physique
L’activité physique est définie comme « tout mouvement du corps produit par les muscles squelettiques résultant en une dépense énergétique » [Caspersen et al., 1985], tandis que l’activité sédentaire est définie comme « toutes postures ou activités qui requièrent très peu de mouvement du corps » [CSEP, 2012] et « peu de dépense énergétique » [Tremblay et al., 2010]. Des exemples d’activités pour les enfants selon
le niveau d’intensité sont donnés au tableau 1.5. Le fait que l’activité physique est importante pour la santé et le bien-être des enfants sains [Janssen et al., 2010], autant d’un point de vue psychologique que physiologique [Trost, 2005], est bien connu. Chez les enfants ayant une DMC, une augmentation de leur niveau d’activité physique a un effet positif sur leur qualité de vie [Bratteby Tollerz et al., 2015, Maher et al., 2016], et sur certains facteurs de risque de maladies cardiovasculaires comme l’indice de masse corporelle, le tour de taille, la pression artérielle systolique et la capacité cardio-respiratoire [Hay et al., 2012, Ryan et al., 2014].
Cependant, bien qu’important, le niveau d’activité physique est diminué chez les enfants ayant une DMC comparativement aux enfants sains [Bjornson et al., 2007, Bratteby Tollerz et al., 2015, Maher et al., 2007]. Les enfants ayant une DMC légère feraient environ 1000 pas de moins que les enfants sains dans une journée [Bjornson et al., 2007]. Ces enfants passent moins de temps à faire des activités physiques modérées et vigoureuses et plus de temps à être sédentaires (8% de plus par jour) que les enfants sains [Capio et al., 2012, Ryan et al., 2015]. Cela est d’autant plus vrai pour les enfants plus âgés et chez les filles [Mitchell et al., 2015, van Eck et al., 2008].
Tableau 1.5 : Exemples d’activités selon les différents niveaux d’intensité de l’activité [Evenson et al., 2008]
Intensité de l’activité Exemples d’activités
Activité sédentaire Être assis, regarder la télévision, colorier
Activité physique modérée Monter un escalier, dribbler un ballon, marcher rapidement Activité physique vigoureuse Faire de la bicyclette, sauter, courir
Un faible niveau d’activité physique peut amener les enfants ayant une DMC dans un cercle vicieux de déconditionnement [Damiano, 2006, Fowler et al., 2007, Ryan et al., 2015, Van Wely et al., 2014]; le déconditionnement entraînant à son tour une diminution du niveau d’activité physique [Ryan et al., 2015, Van Wely et al., 2014] qui mène à l’inactivité. Cela pourrait influencer négativement les déficiences motrices existantes et conduire à un déconditionnement surtout à long terme [Bauman, 2009, Damiano, 2006] et à une diminution de la santé à l’âge adulte [Hallal et al., 2006]. La diminution de
et le système cardio-respiratoire [Damiano, 2006]; cela peut influencer de façon négative le niveau de forme physique (capacité aérobie) ainsi que la force et l’endurance musculaire [van Eck et al., 2008]. Puisque ces derniers sont nécessaires à la réalisation des activités quotidiennes telle que la marche, une diminution de l’endurance musculaire limitera leur performance lors de cette activité [Eken et al., 2016].
1.3.2 Fatigue musculaire
La fatigue musculaire est définie comme étant une capacité réduite à maintenir la production de force ou de puissance musculaire [Wessely, 1995] afin de réaliser une activité prolongée [Bigland-Ritchie et al., 1983]. La fatigue musculaire peut aussi être considérée comme une sensation de douleur ou d’inconfort musculaire [Brunton et al., 2013].
La fatigue est une des principales causes ayant un impact négatif sur la fonction, l’activité physique [Lauruschkus et al., 2015] et la capacité à marcher [Brunton et al., 2013] des enfants ayant une DMC. Ces enfants, incluant ceux ayant une DMC légère, rapportent une fatigue plus fréquente que les enfants sains [Eken et al., 2016]. De plus, cette fatigue est liée à une diminution de l’endurance musculaire (extenseurs du genou) et à une diminution de la capacité à marcher selon le test de marche de 6 minutes (TM6M) [Eken et al., 2016]. Chez les enfants ayant une DMC, la diminution de leur capacité à marcher (mesurée par une augmentation de dépense d’énergie métabolique [Maltais et al., 2005a] ou une diminution d’efficacité à la marche selon des mesures cinématiques [Maltais et al., 2005b]), est également liée à un niveau d’activité physique diminué. Il a été suggéré que ces enfants font moins d’activité physique afin d’éviter ou de réduire la fatigue engendrée par celle-ci [Maltais et al., 2005a]. Chez les adultes ayant une DMC, une diminution de la fonction physique et de l’activité physique sont significativement associées à la fatigue [Jahnsen et al., 2003]. Lorsqu’il n’est pas possible d’utiliser une mesure directe de la fatigue musculaire (une mesure de force musculaire), une mesure indirecte doit être utilisée, comme par exemple, le changement de fréquence médiane (FM) de l’électromyographie (EMG) de surface [Saey et al., 2006] ou encore de l’amplitude moyenne de l’activation musculaire (mEMG). Les descriptions de ces mesures seront présentées aux sections 2.5.4.1.1 et 2.5.4.1.2 du chapitre 2. Une indication de fatigue musculaire à la marche pourrait également être un changement
dans les mesures cinématiques, puisqu’une diminution de la stabilité du patron de la cinématique de marche (SPCM) indiquerait une perte de contrôle optimal du mouvement qui serait liée à la fatigue [Bouyer et al., 2014] (section 2.5.5.2 du chapitre 2).
Bien que la fatigue musculaire semble être un problème majeur vécu quotidiennement par les enfants ayant une DMC lors d’activités de longue durée, telle que la marche, la fatigue musculaire mesurée en laboratoire démontre souvent que leurs muscles seraient moins fatigables que ceux des enfants sains (tableau 1.6). Plusieurs différentes hypothèses ont été proposées pour expliquer ce phénomène, dont le fait que les enfants ayant une DMC recruteraient davantage les fibres musculaires de type I que les fibres de type II [Moreau et al., 2008, Stackhouse et al., 2005] ou encore que la spasticité pourrait être un mécanisme compensatoire qui mitigerait l’effet de la fatigue [Moreau et
al., 2016]. Cependant, la force musculaire maximale atteinte (servant de point
comparatif de départ pour déterminer l’effet de la fatigue), est plus basse chez les enfants ayant une DMC, permettant une comparaison possiblement inappropriée entre ces enfants et les enfants sains (tableau 1.6). De plus, la fatigue musculaire évaluée en laboratoire lors de ces études a été mesurée sur une courte durée (50 à 180 contractions consécutives ou ≤ 180 secondes), lorsque l’enfant était bien reposé et lors de tâches non-locomotrices (en position assise ou couchée) (tableau 1.6). Il semble donc que les protocoles actuels en laboratoire n’évaluent pas nécessairement la fatigue dans un contexte semblable à celui de la vie quotidienne des enfants ayant une DMC.
Tableau 1.6 : Résumé des études en laboratoire portant sur les mesures de fatigue musculaire Étude Caractéristiques des participants Protocole et mesure(s) de fatigue Résultats Stackhouse et coll., 2005 [Stackhouse et al., 2005] DMC : 7 ♂, 5 ♀; 10,5 ± 1,9 ans; Marchent avec et sans support (délimitation non spécifiée) ES : 4 ♂, 6 ♀, 9,8 ± 1,5 ans La force maximale du quadriceps et du TS droits étaient 56% et 73% plus basse chez les DMC que chez les ES.
Stimulation électrique au quadriceps et TS droits : 13 impulsions
électriques délivrées à 40 Hz, une fois par seconde, pour 180 contractions.
Position assise utilisée pour le quadriceps et décubitus dorsal pour le TS.
La moyenne des pics de force (normalisée selon le premier pic de force) des 5 dernières
contractions a été utilisée à des fins de comparaison.
La moyenne des pics de force du quadriceps était plus élevée pour les DMC que les ES (indiquant moins de fatigue chez les DMC).
Pas de différences entre les 2 groupes pour le TS. Moreau et coll., 2008 [Moreau et al., 2008] DMC : 5 ♂, 13 ♀; 17,5 ± 5,0 ans; Niveau I, II ou III au GMFCS (délimitation non spécifiée) ES : 3 ♂, 13 ♀, 16,6 ± 4,5 ans Le pic de force maximal était 48,2% et 41,9% plus bas chez les DMC que chez les ES pour les fléchisseurs et extenseurs du genou, respectivement. 35 répétitions de flexion et extension concentriques maximales du genou (côté évalué non indiqué) à 60°/sec sur un dynamomètre isocinétique. La position assise a été utilisée. Le taux de diminution du pic de force de chaque répétition (normalisé selon le pic de force maximal) a été utilisé comme indice de fatigue musculaire à des fins de comparaison.
Un plus grand taux de diminution du pic de force (plus grande fatigabilité) a été observé chez les ES comparés aux DMC pour les fléchisseurs et extenseurs du genou. Leunkeu et coll., 2010 [Leunkeu et al., 2010] DMC : 10 ♂, 2 ♀; 13 ± 2 ans; Hémiplégie; Niveau I ou II au GMFCS Contraction isométrique du quadriceps à 50% de la force isométrique maximale volontaire maintenue le plus
Pas de différence dans la durée du maintien de la contraction entre côté plus atteint et moins
(délimitation non spécifiée) ES : 10 ♂, 2 ♀, 14 ± 1 ans Les valeurs de force isométrique maximale volontaire du quadriceps pour les DMC étaient moins de 50% celles des ES. longtemps possible (<180 sec) sur un dynamomètre isocinétique. Les 2 côtés ont été évalués pour les DMC, le côté droit pour les ES. La position assise a été utilisée. La durée (secondes) du maintien de la contraction isométrique du quadriceps a été utilisée pour évaluer la performance musculaire. L’indice de fatigue musculaire a été mesuré par le % de changement de la VMQ et par le taux de diminution de FM du VL et du DF.
atteint des DMC ni entre DMC et ES. % d’augmentation de la VMQ du VL et DF était moindre au MI atteint des DMC vs ES, indiquant moins de fatigue chez les DMC (ou moins d’habileté à recruter les fibres de types II).
Pour le VL et le DF, le taux de diminution de la FM était plus élevé chez les DMC vs les ES et plus élevé du côté plus atteint vs moins atteint, indiquant plus de fatigue chez les DMC, plus spécifiquement du côté atteint. Eken et coll. 2014 [Eken et al., 2014] DMC : 6 ♂, 10 ♀; 15 ans 9 mois; Niveau I (n=10), II (n=6) au GMFCS ES : 8 ♂, 10 ♀; 15 ans 11 mois Le pic de force maximal était plus bas chez les DMC que chez les ES pour les extenseurs du genou.
3 séries de contractions isotoniques
sous-maximales (50 à 90% du pic de force maximal) en extension du genou jusqu’à épuisement avec une amplitude initiale de 90° à environ 60°/sec sur un dynamomètre isocinétique. ES : MI préféré, DMC : MI plus atteint La position assise a été utilisée. L’indice de fatigue musculaire a été mesuré par le taux de diminution de FM et
d’augmentation de l’amplitude de l’EMG normalisée des
Les DMC ont une endurance musculaire plus faible comparés aux ES lors d’un protocole de fatigue sous-maximal des extenseurs du genou.
Des niveaux similaires de fatigue musculaire ont été atteints pour les 2 groupes aux
Moreau et coll. 2016 [Moreau et al., 2016] DMC : n=9; 17,2 ± 4,3 ans; Niveau I (n=6), II (n=2) et III (n=1) au GMFCS ES : n=11; 17,3 ± 5,0 ans 50 répétitions de flexion et extension concentriques maximales du genou à 60°/sec sur un dynamomètre isocinétique. La position assise a été utilisée. La fatigue musculaire a été quantifiée en calculant le taux et le % de diminution du pic de force. Le taux et le % de diminution du pic de force pour les
extenseurs du genou étaient plus élevés chez les ES vs les DMC, indiquant plus de fatigue chez les ES.
Pas de changement pour les fléchisseurs du genou entre les 2 groupes.
DF : droit fémoral; DMC : enfants ayant une déficience motrice cérébrale; EMG : électromyographie; ES : enfants sains; FM : fréquence médiane; GMFCS : Gross motor function classification system; MI : membre inférieur; TS : triceps sural; VL : vaste latéral; VMQ : valeur moyenne quadratique (root mean square); % : pourcentage
Également, l’effet immédiat de l’exercice sur la capacité à marcher des enfants ayant une DMC n’est pas habituellement évalué en clinique ou en laboratoire de marche. Les variables reliées à la marche (telles que la cinématique, l’EMG et la dépense d’énergie métabolique) sont mesurées lorsque l’enfant n’a pas fait préalablement un effort physique et lors d’une période de courte durée [Bar-On et al., 2014, Bruijn et al., 2013, Gross et al., 2015, Iosa et al., 2012, Iosa et al., 2013, Van Campenhout et al., 2014]. Cela pourrait, encore une fois, n’être pas représentatif de la réalité quotidienne des enfants ayant une DMC, notamment pour ceux ayant une DMC légère (niveau I au GMFCS) qui marchent tout au long de leur journée [Bjornson et al., 2007], qui fréquentent habituellement un milieu scolaire régulier avec les obstacles que cela comporte [Majnemer et al., 2008] et où la fatigue peut être un enjeu. De plus, la revue systématique de Brunton et coll. (2013) a révélé que ces enfants seraient plus susceptibles à la fatigue musculaire à la fin de la journée ou suite à un effort prolongé [Brunton et al., 2013]. Des études récentes ont aussi démontré que l’exercice ou une marche de longue durée peut avoir un impact négatif sur les variables reliées à la marche comme la stabilité posturale en position debout chez les enfants ayant une DMC [Leineweber et al., 2016, Vitiello et al., 2016], d’où l’importance de mesurer les changements locomoteurs suite à un exercice physique.
1.4 Résumé de la problématique
Comme indiqué ci-dessus, les variables liées à la marche sont actuellement mesurées lorsque l’enfant est bien reposé, sans avoir fait d’exercice préalable, sur de courtes durées et/ou lors de tâches non-locomotrices. Un protocole d’évaluation de ces variables lors d’une tâche fonctionnelle telle que la marche, devrait conséquemment être réalisé avec une durée d’exposition à l’activité plus longue et fait à la suite d’un exercice physique, ce qui peut s’approcher davantage des conditions quotidiennes de ces enfants. Des changements dans les données d’EMG ou de cinématique à la marche, indiquant une fatigue musculaire, ont été démontrés chez l’adulte avec ou sans atteinte neurologique [Bouyer et al., 2014, Saey et al., 2006], cependant aucune étude n’a utilisé un tel protocole d’évaluation chez les enfants ayant une DMC à notre connaissance. Dans ce mémoire, les changements locomoteurs observés à la marche à la suite d’une séance d’exercice seront étudiés chez cette population. Ces travaux devraient générer de nouvelles connaissances concernant l’effet immédiat de l’exercice physique et donc de la fatigue musculaire sur les variables liées à la marche de ces enfants dans des conditions qui s’approchent davantage de celles vécues dans leur quotidien.
1.5 Objectifs
Ce mémoire comprend deux études s’intéressant aux changements locomoteurs suivant une séance d’exercice. La première étude porte sur les changements musculaires observés par le biais de l’EMG alors que la deuxième s’intéresse aux changements reliés à la cinématique et le niveau habituel d’activité physique et certains facteurs sociodémographiques. Les deux études s’intéressent également aux changements de dépense d’énergie métabolique lors de la marche.
1.5.1 Objectifs spécifiques : Étude I
L’objectif principal de cette étude était de décrire les changements immédiats pré- vs post-exercice modéré et intense de certaines variables locomotrices sensibles à la fatigue musculaire (FM de l’EMG de surface et la mEMG) lors de la marche chez des enfants ayant une DMC et marchant indépendamment.
Le premier objectif secondaire était de décrire les changements immédiats pré- vs post-exercice modéré et intense de coactivation musculaire des muscles antagonistes du membre inférieur le plus atteint et de la dépense d’énergie métabolique lors de la marche.
Le deuxième objectif secondaire était de décrire la relation entre les changements immédiats pré- vs post-exercice locomoteur modéré et intense de fatigue musculaire et de coactivation musculaire des muscles antagonistes du membre inférieur le plus atteint lors de la marche.
1.5.2 Objectifs spécifiques : Étude II
L’objectif principal de cette deuxième étude était de décrire les changements locomoteurs (SPCM des membres inférieurs et dépense d’énergie métabolique) immédiats pré- vs post-exercice intense lors de la marche chez des enfants ayant une DMC et marchant indépendamment.
L’objectif secondaire était de décrire les relations entre les changements locomoteurs pertinents immédiats pré- vs post-exercice intense lors de la marche et le niveau habituel d’activité physique ainsi que certains facteurs sociodémographiques reliés à l’activité physique (tels que l’âge et le sexe).
1.6 Hypothèses
1.6.1 Hypothèses spécifiques : Étude I
L’hypothèse principale de cette étude est que l’exercice modéré et intense entraine des changements locomoteurs lors de la marche chez des enfants ayant une DMC légère, dont 1) une diminution de la FM de l’EMG de surface, et 2) une augmentation de la mEMG.
La première hypothèse secondaire est que l’exercice modéré et intense entraine une augmentation de 1) la coactivation des muscles antagonistes du membre inférieur plus atteint et de 2) la dépense d’énergie métabolique à la marche.
La deuxième hypothèse secondaire est qu’une diminution de la FM de l’EMG de surface, un indicateur de fatigue musculaire, est liée à une augmentation de coactivation des muscles antagonistes du membre inférieur plus atteint.
1.6.2 Hypothèses spécifiques : Étude II
L’hypothèse principale de cette étude est que l’exercice intense entraine : 1) une diminution de la SPCM des membres inférieurs et 2) une augmentation de la dépense d’énergie métabolique lors de la marche chez des enfants ayant une DMC légère. L’hypothèse secondaire est que les enfants qui ont une plus grande diminution de la SPCM des membres inférieurs sont ceux faisant moins d’activité physique, qui sont plus âgés et de sexe féminin.
C
HAPITRE2 :
M
ÉTHODOLOGIECette section du mémoire reprend la méthodologie des études retrouvées aux chapitres 3 et 4 de manière plus détaillée. Le choix des tests et des mesures utilisés sera davantage élaboré.
2.1 Participants
La population cible des deux études réalisées dans ce mémoire est des enfants ayant une DMC légère, classée au niveau I au GMFCS. Étant donné que les deux études étaient exploratoires, un nombre de onze enfants ont été ciblé à chacune des études. Les critères suivants ont été utilisés lors de la sélection des participants.
2.1.1 Critères d’inclusion
Avoir une DMC de type spastique de niveau I au GMFCS, correspondant à la capacité à marcher et courir sans auxiliaire de marche;
Être âgé entre 6 et 18 ans;
Être inscrit au programme des atteintes cérébrales de la Direction des services à la clientèle enfants-adolescents du Centre intégré universitaire de santé et de services sociaux (CIUSSS) de la Capitale-Nationale (point de service Saint-Louis);
Fréquenter un milieu scolaire régulier de niveau primaire ou secondaire; Être en mesure de comprendre les consignes et de collaborer aux
évaluations.
2.1.2 Critères d’exclusion
Avoir une condition de santé (ex. : épilepsie non contrôlée) ou un diagnostic associé (ex. : déficience visuelle sévère) pouvant interférer avec la réalisation des tests;
Avoir subi une intervention médicale, soit une chirurgie orthopédique ou neurologique, dans les 6 mois précédents l’entrée dans l’étude;
Avoir eu une injection de toxine botulinique (Botox) au cours des 3 mois précédents la participation à l’étude;

![Tableau 1.4 : Critères principaux des différents niveaux du système de classification de la fonction motrice globale (GMFCS) pour les enfants de 6 à 12 ans [Palisano et al., 1997a]](https://thumb-eu.123doks.com/thumbv2/123doknet/5597104.134578/25.918.134.788.632.1041/tableau-critères-principaux-niveaux-système-classification-fonction-palisano.webp)
![Tableau 1.6 : Résumé des études en laboratoire portant sur les mesures de fatigue musculaire Étude Caractéristiques des participants Protocole et mesure(s) de fatigue Résultats Stackhouse et coll., 2005 [Stackhouse et al., 2005] DMC : 7 ♂, 5 ♀;](https://thumb-eu.123doks.com/thumbv2/123doknet/5597104.134578/32.918.131.799.146.1074/laboratoire-musculaire-caractéristiques-participants-protocole-résultats-stackhouse-stackhouse.webp)


![Figure 2.3: Courbe obtenue suite à la transformation rapide de Fourier permettant le calcul de la fréquence médiane du signal EMG [Konrad, 2005]](https://thumb-eu.123doks.com/thumbv2/123doknet/5597104.134578/47.918.232.681.122.361/figure-courbe-obtenue-transformation-fourier-permettant-fréquence-médiane.webp)
![Figure 2.5 : Chevauchement des enveloppes linéaires moyennes de deux muscles antagonistes [Maltais et al., 2004]](https://thumb-eu.123doks.com/thumbv2/123doknet/5597104.134578/48.918.159.746.517.796/figure-chevauchement-enveloppes-linéaires-moyennes-muscles-antagonistes-maltais.webp)

