Identification d’inhibiteurs peptidiques de
l’enzyme dipeptidyl peptidase 4 (DPP-4) et de
l’enzyme de conversion de l’angiotensine (ACE)
dans des laits fermentés
Mémoire
Dominic Bastien
Maîtrise en sciences et technologie des aliments
Maître ès sciences
(M. Sc.)
Québec, Canada
Identification d’inhibiteurs peptidiques de
l’enzyme dipeptidyl peptidase 4 (DPP-4) et de
l’enzyme de conversion de l’angiotensine (ACE)
dans des laits fermentés
Mémoire
Dominic Bastien
Sous la direction de :
iii
Résumé
L’incidence de l’hypertension et du diabète de type II (DT2) augmente à travers le monde. Les interventions diététiques sont une des voies les plus efficaces pour contrôler ou prévenir l’hypertension et le DT2. Des aliments qui fournissent non seulement tous les nutriments nécessaires au corps humain, mais aussi des inhibiteurs contre l’enzyme de conversion de l’angiotensine (ACE) et la dipeptidyl peptidase 4 (DPP-4) pourraient offrir une nouvelle alternative pour contrôler ou prévenir ces maladies. Le babeurre, le lait, les protéines de lactosérum et les protéines de blanc d’œuf sont connues pour contenir des inhibiteurs de l’ACE et de la DPP-4. Dans cette étude, plusieurs laits fermentés ont été produits par fermentation de ces milieux riches en protéines dans des conditions communément utilisées en industrie pour fabriquer les yogourts. Les produits fermentés obtenus ont ensuite été digérés dans un système digestif in vitro. Les extraits solubles obtenus ont été criblés contre les enzymes ACE et DPP-4. Les résultats montrent que la fermentation seule est rarement suffisante pour la production d’inhibiteurs de l’ACE et de la DPP-4. L’étape de digestion est nécessaire pour libérer ces inhibiteurs. Les analyses de spectrométrie de masse ont permis d’identifier 4 inhibiteurs de la DPP-4 et 9 de l’ACE dont 5 sont connus pour être bioactifs chez le rat. Cette étude préliminaire montre que des laits fermentés non conventionnels à base de babeurre, de concentrés protéiques de lactosérum et de protéines de blanc d’oeuf seraient une source potentielle d’inhibiteurs de l’ACE et de la DPP-4.
iv
Abstract
Incidence of hypertension and Type II diabetes (T2D) is increasing world wide. Dietetic intervention is one of the most effective way to prevent and control hypertension and T2D. Food that non-only provide all necessary nutriments but also provide ACE and DPP-4 inhibitors could offer a new health tool to prevent or control hypertension and T2D. Buttermilk, milk, whey proteins and white eggs proteins are known to possess ACE and DPP-4 inhibitors. In this regard, several fermented milks were produced using industrial starters and conditions. The products were then digested in a 2-steps in vitro digestive model. The resulting soluble extracts were screened against ACE and DPP-4 enzymes. Results showed that fermentation only did not produce ACE and DPP-4 inhibitors while the digestive process is required to release these inhibitors. Mass spectroscopy analysis of allowed the identification of 4 DPP-4 inhibitors and 9 ACE which 5 of them are known to be bioactive. This work provides the basis to produce fermented milks with ACE and DPP-4 inhibitors. Further analysis will be required to confirm if these yoghurts can improve blood pressure and glycemic response in humans
v
Tables des matières
Résumé ... iii
Abstract ... iv
Listes des tableaux ... vii
Listes des figures ... viii
Liste des abréviations ... ix
Remerciements ... x
Avant-propos... xi
1- Introduction ... 1
2- Revue de littérature ... 3
2.1- Obésité, hypertension et diabète de type II ... 3
2.2 - Effets de protéines alimentaires sur l’obésité, le diabète et l’hypertension. ... 5
2.2.1 – Les protéines de lactosérum ... 5
2.2.1.1 – Effets des protéines de lactosérum sur l’obésité ... 5
2.2.1.2- Effets des protéines de lactosérum sur la thermogénèse ... 5
2.2.1.3- Effets des protéines de lactosérum sur la satiété ... 6
2.2.1.4 – Effets des protéines de lactosérum sur le diabète ... 7
2.2.1.5 – Effets des protéines de lactosérum sur l’hypertension ... 10
2.2.2 – Les caséines ... 11
2.2.2.1 – Effet des caséines sur le diabète de type II... 11
2.2.2.2– Effet des caséines sur l’hypertension ... 12
2.2.2.3- Effet du babeurre sur l’hypertension ... 13
2.2.3 – Les protéines du blanc d’œuf ... 14
2.2.3.1 – Effets des protéines de blanc d’œuf sur le diabète de type II ... 14
2.2.3.2 – Effets des protéines de blanc d’œuf sur l’hypertension ... 15
2.3- Identification de peptides bioactifs ... 16
2.3.1 – Sources protéiques ... 16
2.3.2 – Protéolyse ... 16
2.3.3 - Criblage in vitro ... 18
vi
3- Hypothèse et objectif ... 20
3.1 – Hypothèse ... 20
3.2- Objectifs ... 20
4- Identification of angiotensin-converting enzyme (ACE) and dipeptidyl peptidase 4 (DPP-4) inhibitors in dairy and egg fermented products... 21
4.1- Introduction ... 22
4.2- Material and methods ... 25
4.3- Results and discussion ... 30
4.4- Conclusion ... 37
5 - Travaux futurs et conclusions ... 38
vii
Listes des tableaux
Tableau I : Composition en protéines de différents types de yogourts ... 16
Tableau II : DPP-4 assays ... 27
Tableau III : ACE assays ... 28
Tableau IV : Inhibition of DPP-4 and ACE.. ... 30
Tableau V: DPP-4 and ACE inhibitors after digestion of non-fermented or fermented products ... 33
viii
Listes des figures
Figure 1 : Mécanisme des inhibiteurs de la DPP-4 ... 9 Figure 2 : Système rénine angiotensine ... 10 Figure 3 : Processus de développement d’aliments fonctionnels.. ... 39
ix
Liste des abréviations
Alanine – A Dipeptidyl peptidase 4 - DPP-4
Arginine – R Enzyme de conversion de l’angiotensine - ACE
Acide aspartique – D Diabète de type II – T2D
Asparagine – N Cystéine – C Acide glutamique – E Glutamine – Q Glycine – G Histidine – H Isoleucine – I Leucine – L Lysine – K Méthionine – M Phénylalanine – F Proline – P Sérine – S Thréonine – T Tryptophane – W Tyrosine – Y Valine – V
x
Remerciements
Ce travail n’aurait pas été possible sans le support et l’aide de plusieurs personnes. Je remercie Diane Gagnon pour son support au laboratoire et pour son assistance dans la résolution d’une variété de problématiques du projet, par exemple la recherche de poudre de blancs d’œufs sans additifs ! Je remercie également Jacinthe Thibodeau pour son aide pour les analyses de spectrométrie de masse. Sans son expertise et ses conseils, le travail effectué lors de ce projet de recherche aurait été beaucoup plus laborieux.
Je veux aussi souligner la contribution de deux étudiantes de l’équipe, Nicoletta Foti et Gabriela Bayarres Ponce pour avoir fabriqué les yogourts qui ont été analysés dans ce travail. Évidemment, je remercie mon directeur de maîtrise, Jean-Christophe Vuillemard, pour m’avoir encadré et conseillé tout au long de ma maîtrise. Justement, par ses conseils, Jean-Christophe m’a grandement aidé dans ma recherche de stage. Il a également fait preuve d’une grande compréhension et de beaucoup de flexibilité, ce qui m’a permis de réaliser un stage à temps plein en milieu industriel tout en terminant ma maîtrise. Ce stage m’a permis d’obtenir un emploi. Ainsi, Jean-Christophe aura eu un effet direct sur la suite de ma vie professionnelle. Je tenais à souligner à quel point sa contribution a été importante.
D’ailleurs, je tiens aussi à remercier Aliments Ultima de m’avoir offert un stage au sein de leur entreprise. En particulier, je voudrais remercier ma superviseure directe, Marie-Claude Gentès, qui s’est toujours montrée compréhensive et m’a permis de terminer mes études malgré les nombreux projets sur lesquels nous travaillons.
xi
Avant-propos
Ce mémoire contient le manuscrit d’un article scientifique dont j’ai rédigé le protocole de recherche, réalisé le travail expérimental, analysé les résultats et rédigé l’article intitulé : Identification of angiotensin-converting enzyme (ACE) and dipeptidyl peptidase 4 (DPP-4) inhibitors in dairy and egg fermented products sous la supervision de Jean-Christophe Vuillemard, professeur à la Faculté des Sciences de l’Agriculture et de l’Alimentation de l’Université Laval. Jacinthe Thibodeau, professionnelle de recherche à l’Institut sur la nutrition et les aliments fonctionnels (INAF), a réalisé les analyses de spectrométrie de masse.
1
1- Introduction
Au Canada, de 1920 à 2009, l’espérance de vie augmenté de 22 ans1 en moyenne. Plusieurs facteurs expliquent cette augmentation comme l’amélioration des conditions de vie, de salubrité, l’abondance de nourriture et l’amélioration de la médecine.
La médecine préventive prend une place de plus en plus importante et cible en particulier les maladies chroniques comme le cancer, le diabète, l’obésité et l’hypertension. L’adoption de saines habitudes de vie, plus particulièrement au niveau de l’alimentation, est un des meilleurs moyens de prévenir ces maladies2. Ainsi, la consommation d’aliments fonctionnels qui sont à la fois nourrissants et qui possèdent une bioactivité contre ces maladies, est en hausse dans les pays occidentaux3.
Le marché mondial des aliments fonctionnels a été évalué à 150 milliards de dollars en 20174. Ce marché est divisé principalement en trois régions : l’Asie (50 milliards de dollars), l’Europe (40 milliards de dollars) et l’Amérique du Nord (30 milliards de dollars)4. En 2024, le marché mondial des aliments fonctionnels pourrait atteindre plus de 250 milliards de dollars4. Au Canada, en 2013, le marché des aliments fonctionnels et des produits de santé naturelle a été évalué à environ 13 milliards de dollars5.
Le marché des aliments fonctionnels est divisé principalement en 5 secteurs qui sont les produits laitiers, les céréales, les viandes, les produits à base de soya, les féculents et les gras et huiles qui comptent pour 33%, 20%, 15%, 15% et 10% du marché, respectivement4. Ainsi, les produits laitiers occupent la plus grande part du marché des aliments fonctionnels.
Justement, les produits laitiers sont reconnus pour posséder des effets contre le diabète et l’hypertension6. La consommation de yogourt a amélioré la perte de masse adipeuse (-4.43kg contre -2.75kg pour le placebo) chez une cohorte de 38 humains obèses lors d’une diète par restriction calorique7. La consommation de quatre portions de produits laitiers par jour a diminué la résistance à l’insuline et l’insuline plasmatique de 9% et 11% respectivement, chez une cohorte de 39 humains8. La consommation quotidienne de 500 à 600g de produits laitiers diminue les risques de souffrir d’hypertension de 16%8.
2
Tous ces effets seraient attribués aux protéines alimentaires. En effet, les protéines alimentaires sont reconnues comme étant une source importante de peptides bioactifs9. Par exemple, les protéines de lactosérum contiennent des peptides ayant des effets anti-diabète (dont des inhibiteurs de dipeptidyl peptidase-4) et anti-hypertension (incluant des inhibiteurs l’enzyme de conversion de l'angiotensine)10-11. Récemment, lors d’une étude clinique sur 34 humains, la consommation de babeurre a diminué la pression systolique de 2.6 mm/Hg12. Des hydrolysats de blanc d’œuf ont montré une inhibition de l’enzyme de conversion de l'angiotensine (ACE) et ont diminué la tension artérielle chez des rats hypertensifs13. Ainsi, de nouveaux produits contenant des protéines laitières, du babeurre et/ou des protéines d’œuf pourraient être consommés comme aliments fonctionnels pour aider à contrôler l’obésité, le diabète et l’hypertension.
Récemment, des produits fermentés à base de babeurre, de protéines de lactosérum et/ou de protéine d’œuf ont été développés. La qualité organoleptique d’un yogourt de babeurre de type grec a même obtenu des notes supérieures aux yogourts grecs du commerce (Foti, 2016, communication personnelle). Les propriétés santé de produits fermentés à base de babeurre et de blanc d’œuf n’ont jamais été étudiées. Ainsi, l’identification de peptides actifs dans ces produits pourrait conduire au développement de nouveaux produits fonctionnels ayant des propriétés contre l’obésité, le diabète et l’hypertension.
3
2-
Revue de littérature
2.1- Obésité, hypertension et diabète de type II
En 2008, l’Organisation mondiale de la santé déclarait une épidémie planétaire d’obésité1. Environ 1,5 milliard de personnes avaient un surpoids et 500 millions de personnes étaient atteintes d’obésité 1, 14. L’obésité est un facteur de risque important du développement de l’hypertension et du diabète. L’hypertension cause environ 10 millions de décès annuellement15. De 25 à 50 % des adultes de la planète, soit plus d’un milliard de personnes, sont en situation de pré-hypertension 16. D’autre part, le diabète de type II affecte environ 30 millions de personnes aux États-Unis avec 2 millions de nouveaux cas en 2012. De plus, environ 80 millions d’Américains sont pré-diabétiques 17. Les coûts en soins de santé pour le diabète de type II sont estimés à 250 milliards de dollars aux États-Unis17. Le diabète de type II est reconnu comme étant la première cause de cécité 18, d’insuffisance rénale 19 et d’amputation des membres inférieurs non accidentelles20.
Le syndrome métabolique est un regroupement de facteurs de risques qui sont : l’hypertension, le prédiabète ou le diabète, l’obésité et les dyslipidémies 2. Une personne possédant 3 ou plus de ces anomalies est considérée comme atteinte du syndrome métabolique 2. Les gens atteints du syndrome métabolique ont cinq fois plus de chances de développer le diabète de type II 2, deux fois plus de chance de développer des maladies cardiovasculaires 2, quatre fois plus de chance de faire un infarctus 21 et deux fois plus de chance de mourir d’un tel événement 21. La prévalence mondiale du syndrome métabolique varie de 10 % à 84 % 22. Une corrélation positive est établie entre le statut socio-économique, la sédentarité, l’âge et le syndrome métabolique 2. Aux États-Unis, environ 10 % des individus de 20 à 29 ans sont atteints du syndrome métabolique et cette fréquence augmente à 20 % et 45 % pour les tranches de 40-49 ans et 60-69 respectivement 23.
Présentement, des interventions pharmacologiques sont utilisées pour traiter et contrôler le syndrome métabolique et ses facteurs de risques. Pour traiter l’obésité, des médicaments, comme le Lorcaserin, sont utilisés en clinique24. Par contre, ces médicaments provoquent des effets secondaires comme des pertes de concentration ou des pertes de mémoire 24.
4
Pour traiter l’hypertension, les médicaments de première ligne sont les inhibiteurs de l’enzyme de conversion de l'angiotensine (ACE)15. Pour traiter le diabète, le médicament de première ligne est la metformine. Une nouvelle classe de médicament anti-diabète, les inhibiteurs de l’enzyme dipeptidyl peptidase-4 (DPP-4), a été approuvée par la FDA en 2006 25.
5
2.2 - Effets de protéines alimentaires sur l’obésité, le diabète et
l’hypertension.
2.2.1 – Les protéines de lactosérum
Les protéines de lactosérum représentent 20% des protéines totales du lait 10. Elles sont principalement composées de β-lactoglobuline, α-lactalbumine, protéose-peptones, d'immunoglobulines, d'albumine sérique bovine (BSA), de lactoferrine et de lactoperoxidase26. Le glycomacropeptide (GMP) est aussi présent dans le lactosérum suite à l'action de la chymosine lors de la coagulation du lait pour les fabrications fromagères26. Les protéines de lactosérum sont reconnues comme étant une source de peptides bioactifs qui sont générés durant la digestion 10. Les protéines de lactosérum possèdent des propriétés anti-obésité, anti-diabète et anti-hypertension qui pourraient être exploitées dans le développement de nouveaux aliments fonctionnels10-11.
2.2.1.1 – Effets des protéines de lactosérum sur l’obésité
Les protéines de lactosérum ont montré une capacité à augmenter la thermogénèse (augmentation de la dépense calorique) et améliorer la satiété.
2.2.1.2- Effets des protéines de lactosérum sur la thermogénèse
La digestion, l'absorption et la métabolisation des protéines requièrent environ 20% plus d'énergie que les glucides et les lipides27. Chez les humains, les protéines de lactosérum augmentent la thermogénèse de 14% tandis que la caséine et les protéines de soya l’augmentent de 12% et 11%, respectivement 28. La consommation de protéines de lactosérum est associée à une plus grande biosynthèse de protéines musculaires par le biais de l'activation de la voie de signalisation mTOR par la leucine 29. Les protéines de lactosérum sont rapidement absorbées et ont une haute teneur en leucine. Ces deux caractéristiques contribuent à l'augmentation du taux sanguin de leucine qui augmente l'activation de la voie mTOR et la synthèse de protéine endogène 10. De plus, la leucine diminue le ratio AMP/ATP dans les muscles, ce qui diminue l'activité de l'AMPK. La diminution de l’activité AMPK active la synthèse protéique 30. Ainsi, par leur action sur la thermogénèse, les protéines de lactosérum augmentent la dépense calorique et favorisent une balance énergétique négative, ce qui peut contribuer à la perte de poids.
6
2.2.1.3- Effets des protéines de lactosérum sur la satiété
Les protéines sont reconnues comme étant le macronutriment offrant la plus grande satiété. Une étude sur 16 humains en santé et maigres a montré qu’une supplémentation en protéines de lactosérum offre une plus grande satiété qu’une supplémentation de caséines31. Le groupe recevant le supplément de protéines de lactosérum consommait en moyenne 250 kcal de moins et avait en moyenne 10% moins d'appétit que le groupe recevant un supplément de caséines 31. Cet effet serait dû à la leucine qui est rapidement absorbée et transmise au cerveau. En effet, une étude a démontré qu'une injection directe de leucine dans les ventricules cérébraux de rat diminue l'appétit chez ces derniers10. Ce mécanisme impliquerait également l'activation de la voie mTOR (synthèse de protéine) dans une région de l'hypothalamus. Cette région contient des neurones anorexigènes exprimant le neuropeptide Y qui possède un rôle anorexigène 10.
La cholecystokinine (CCK) est une hormone anorexigène qui est naturellement sécrétée, suite à l'ingestion de protéines et de lipides, par les cellules endocrines du duodénum. Dans une étude sur 9 humains en santé, les protéines de lactosérum ont provoqué une augmentation de 60 % de la sécrétion de CCK comparativement à la caséine 31. Par contre, cet effet n'a pas été observé dans une autre étude similaire 32. Cette contradiction pourrait s'expliquer par le taux de pureté des protéines de lactosérum et de leurs contenus en GMP qui était différent entre les deux études 10.
Le peptide YY est une hormone anorexigène sécrétée par les cellules L de l'iléon et du colon suite à l'ingestion de nourriture. Une étude sur 6 humains en santé a démontré que l’ingestion de protéines de lactosérum ou de caséines augmentait la concentration plasmatique de PYY de 4 pM à 6 pM et 5 pM à 8 pM, respectivement 33. Lorsque les protéines de lactosérum étaient hydrolysées préalablement à l’ingestion, la concentration de PYY a augmenté de 5 pM à 10 pM. L’hydrolyse de la caséine n’a pas eu d’effet sur la sécrétion du PYY 33. Le mécanisme de la hausse de sécrétion de PYY est actuellement inconnu, mais l’implication de peptides ou d’acides aminés issus de la digestion des protéines de lactosérum est avancée.
7
La ghreline est la seule hormone orexigène connue. Elle est sécrétée surtout avant la prise d'un repas et sa sécrétion est diminuée lors de la consommation de nourriture. Dans une étude clinique sur 90 sujets en surpoids ou obèses, le groupe recevant un supplément en protéines de lactosérum avait une sécrétion de ghréline significativement plus faible (752±36 ng/L) que le groupe recevant des protéines de soya (837±23 ng/L) ou le contrôle recevant du glucose (870±23) 34. Ainsi, les protéines de lactosérum diminuent la sécrétion de ghréline.
Les effets anti-obésité des protéines de lactosérum s’apparentent aux mécanismes d’action des médicaments anti-obésité. Pour traiter l'obésité, des médicaments anorexigènes comme le Sibutramine et le Rimonabant sont relativement efficaces. Par contre, dû à leurs effets secondaires importants, ces médicaments ont été retirés du marché35. Le Lorcaserin, un médicament anorexigène, a provoqué une perte de poids significative de 5% comparée au groupe placebo lors d'une étude de 12 mois24. Cependant, le Lorcaserin cause des déficits d'attention et des problèmes de mémoire24. D’autres médicaments anorexigènes comme le Phentermine et le Topiramate réduisent aussi l'appétit, ce qui s’est traduit par une perte de poids36. Par contre, des effets secondaires comme l'hypertension et de la neuropathie sont associés à ces médicaments37. Ainsi, bien que des médicaments pour traiter l'obésité existent et soient relativement efficaces, ils provoquent des effets secondaires importants.
Ensemble, ces études montrent que les protéines de lactosérum peuvent augmenter la satiété ou réduire l'appétit, ce qui reproduit les mécanismes d’action de médicaments. Contrairement aux médicaments, les protéines de lactosérum ne sont généralement pas associées à des effets secondaires. Donc, des aliments fonctionnels contenant des protéines de lactosérum pourraient aider à améliorer le taux de succès d'une intervention par restriction calorique 38. Malgré son taux d'échec élevé, cette approche est actuellement une des plus utilisées pour réduire le poids et traiter l’obésité, l’hypertension et le diabète39.
2.2.1.4 – Effets des protéines de lactosérum sur le diabète
Les protéines de lactosérum peuvent augmenter la sécrétion d'insuline, réduire la résistance à l'insuline, augmenter la sécrétion et la biodisponibilité des incrétines.
8
2.2.1.4.1- Sécrétion de l'insuline et diminution de la glycémie
Chez une cohorte de 22 hommes en santé et maigres, les protéines de lactosérum ont provoqué une sécrétion d’insuline supérieure de 29%, 50% et de 96%, par rapport aux protéines de thon, de dinde et d’œuf, respectivement40. Une relation dose/réponse sur la glycémie a été observée quand des quantités de 5g, 10g et 20g de protéines de lactosérum ont été ajoutées à un breuvage contenant 50g de glucose41. L’aire sous la courbe des glycémies en fonction du temps était significativement plus faible pour le breuvage contenant 20g de protéines et une hausse, non statistiquement significative, a été observée pour les breuvages contenant 5g et 10g41.
Une étude de 14 humains atteints de diabète de type II a démontré qu'un supplément de 20g de protéines de lactosérum augmente la sécrétion d'insuline (jusqu'à 57%). Ainsi, l'augmentation de la sécrétion d'insuline induite par les protéines de lactosérum a aussi été observée chez les personnes diabétiques42. Les hausses d'insuline s'expliqueraient par la riche teneur en leucine et en dipeptides provenant des protéines de lactosérum43. La leucine est un activateur allostérique de la glutamate déhydrogénase. Cette enzyme produit de l'α-cétoglutarate qui active le cycle de Krebs. Le ratio AMP/ATP des cellules β diminue, ce qui favorise la sécrétion d'insuline par le pancréas. Le mécanisme impliquant les dipeptides est inconnu10.
2.2.1.4.2– Les incrétines
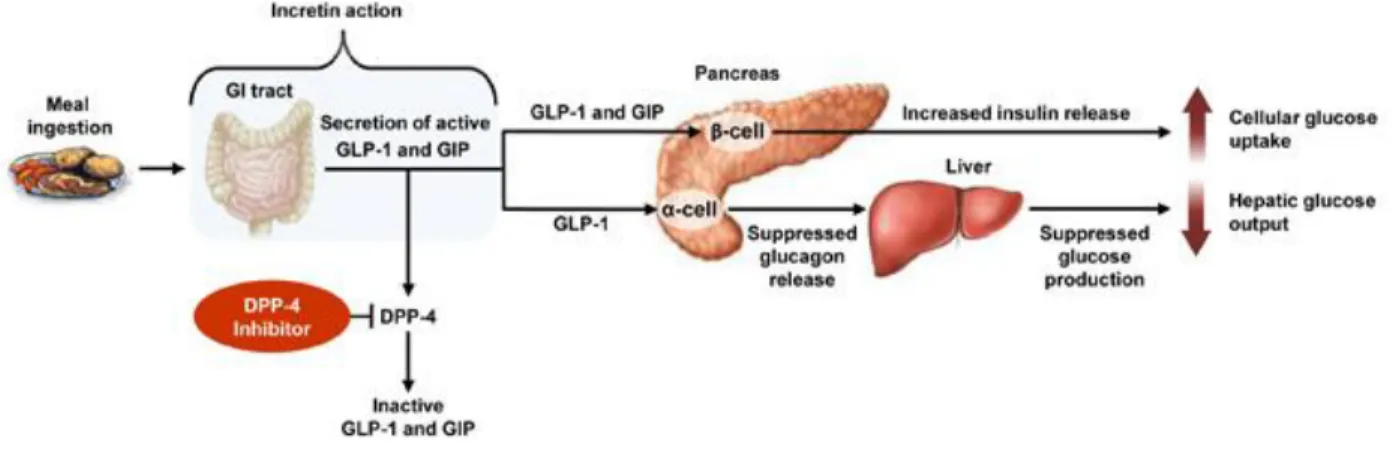
Lors de l’ingestion de nourriture, les cellules K et L de l’intestin grêle libèrent les hormones peptidiques gastric inhibitory peptide (GIP) et glucagon peptide like peptide (GLP-1), respectivement (figure 1)44. Le GIP et le GLP-1 favorisent la sécrétion de l’insuline par les cellules β du pancréas, ce qui favorise l’absorption du glucose par les cellules insulino-dépendantes telles que les myocytes (cellules musculaires)44. Le GLP-1 diminue la sécrétion du glucagon par les cellules α du pancréas, ce qui réduit la glyconéogenèse au niveau du foie. Ainsi, ces hormones favorisent la diminution de la glycémie44.
Cependant, l’enzyme DPP-4 clive et désactive le GIP et le GLP-1, ce qui réduit la biodisponibilité de ces hormones25. Les inhibiteurs de DPP-4 réduisent son activité et augmentent la demi-vie du GIP et du GLP-1, ce qui favorise les activités hypoglycémiantes
9
de ces deux hormones25. L’inhibition de la DPP-4 est aussi associée à plusieurs autres activités telles que la réduction de l’apoptose des cellules, la réduction de l’appétit ou le ralentissement de la digestion44.
Figure 1 : Mécanisme des inhibiteurs de la DPP-4 (Tirée de la référence 45).
Lors d’une étude sur 12 humains en santé, un supplément de 18g de protéines de lactosérum a augmenté la biodisponibilité du GIP jusqu'à 80%, comparativement au placebo46. Une étude sur 25 humains en santé a démontré que les protéines de lactosérum ont provoqué une plus grande biodisponibilité de GLP-1 (aire sous la courbe = 425), comparativement aux protéines de soja ou de la caséine (aire sous la courbe = 195 et 161, respectivement)47. L’inhibition de la DPP-4 par des peptides issus de la digestion de protéines de lactosérum serait un mécanisme moléculaire pouvant expliquer la hausse de la biodisponibilité des incrétines GIP et GLP-1
2.2.1.4.3– Les inhibiteurs de la DPP-4
L’inhibition de la DPP-4 par des peptides issus de la digestion de protéines de lactosérum serait un mécanisme moléculaire pouvant expliquer la hausse de la biodisponibilité des incrétines GIP et GLP-125.
Récemment, 10 inhibiteurs peptidiques de la DPP-4 (IC50 = 60 µM à 300 µM) ont été identifiés suite à l’hydrolyse enzymatique de protéines de lactosérum par la pepsine48. Par exemple, le tripeptide Ile-Pro-Ala a récemment été identifié comme inhibiteur de la DPP-449. De 2012 à 2014, 18 inhibiteurs de DPP-4 ont été brevetés et 8 d'entre-deux sont des
10
peptides provenant de sources alimentaires telles que le fromage feta, le lait (caséines), le gingembre ou le riz50.
Les inhibiteurs de la DPP-4 sont une nouvelle classe de médicaments anti-diabète. Le Linagliptin et l'Alogliptin ont été approuvés par la FDA en 2011 et 2013, respectivement25. Ensemble, ces observations démontrent l'intérêt et le potentiel des aliments, en particulier les produits laitiers, comme source d'inhibiteurs de la DPP-4.
2.2.1.5 – Effets des protéines de lactosérum sur l’hypertension
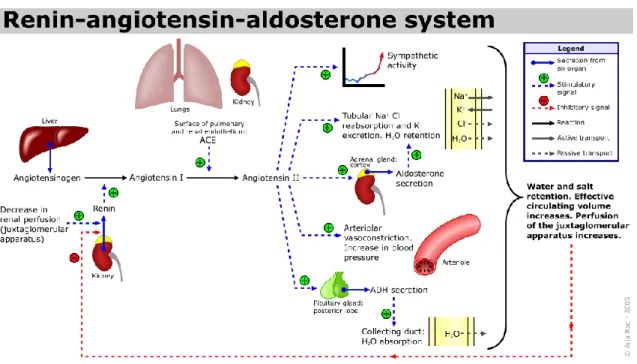
Le foie sécrète l’angiotensine I qui est clivée par l’ACE pour être convertie en angiotensine II qui est la forme active de cette hormone. L'angiotensine II favorise la vasoconstriction, la réabsorption d'eau, de sodium et de potassium ce qui augmente le volume sanguin donc la pression artérielle (figure 2).
Figure 2 : Système rénine angiotensine (tiré de la référence 51)
Les inhibiteurs de l’ACE réduisent la conversion de l’angiotensine I en angiotensine II, ce qui réduit la pression artérielle. De plus, ces inhibiteurs ont un effet bénéfique sur le métabolisme du glucose52, ce qui peut être un avantage pour le contrôle du diabète de type II. Les inhibiteurs de l’ACE sont aussi connus pour avoir des effets anti-inflammatoires35,
11
augmenter la sécrétion de l'adiponectine53 et réduire le stress oxydatif54 qui sont des facteurs impliqués dans l’obésité, le diabète et l’hypertension14.
Plusieurs peptides inhibiteurs de l’ACE ont été isolés suite à une fermentation ou une digestion enzymatique du lait. Ces inhibiteurs ont démontré des activités hypotensives in vivo, incluant des produits commerciaux55,56. Par exemple, au Japon, aux États-Unis, aux Pays-Bas, en France et en Finlande, des laits commerciaux contenant des peptides inhibiteurs de l’ACE sont commercialisés57. Les séquences de ces peptides sont VPP, IPP ou FFVAPFEVFGK57.
Le développement d'inhibiteurs de l'ACE est toujours d'actualité. Dans une récente revue de la littérature, 24 études ont été répertoriées pour avoir isolé un ou plusieurs peptides inhibiteurs de l'ACE. Ces peptides ont été isolés à partir de sources comme le lait, le lait écrémé, le lait de chèvre, le lait de Yak, le lait de mouton, le yogourt, le kéfir, le fromage ou les protéines de lactosérum57. Ces produits ont été fermentés ou hydrolysés par des enzymes selon différentes conditions de pH et température57. Ainsi, des centaines de peptides inhibiteurs de l'ACE ont été identifiés57. L’ensemble de ces études démontre l’intérêt pour les inhibiteurs peptidiques de l'ACE des produits laitiers, y compris les protéines de lactosérum.
2.2.2 – Les caséines
Les caséines composent 80% des protéines du lait58. Elles sont subdivisées en 3 grandes classes, soit les caséines α, les caséines β et les caséines κ58. Contrairement aux protéines du lactosérum, les caséines précipitent à pH acide59. La coagulation des caséines dans l’estomac ralenti leur digestion et leur absorption59. Ainsi, l’effet des caséines serait présent sur une plus longue durée60. En effet, il est avancé que l’effet des caséines sur la satiété et sur la sécrétion de l’insuline dure plus longtemps que celui des protéines de lactosérum60.
2.2.2.1 – Effet des caséines sur le diabète de type II
Plusieurs études cliniques récentes démontrent l’effet hypoglycémiant des caséines chez les humains61. L’effet des caséines sur la glycémie et la sécrétion de l’insuline a été étudié chez une cohorte de 60 humains en surpoids âgés en moyenne de 60 ans62. Une diminution
12
plus rapide de la glycémie a été mesurée chez les groupes ayant reçu le breuvage contenant un supplément de caséine intacte ou hydrolysée contenant du glucose par rapport au groupe contrôle qui avait reçu le breuvage ne contenant que le glucose62. La sécrétion d’insuline était plus élevée chez les groupes ayant reçu les caséines, ce qui explique la diminution plus rapide de la glycémie62.
Dans une autre étude sur une cohorte de 36 humains en surpoids âgés en moyenne de 62 ans63, le groupe ayant reçu le breuvage contenant 15g de caséines hydrolysées possédait une glycémie post-prandiale moindre comparativement au groupe n’ayant reçu que le breuvage contrôle et celui ayant reçu le breuvage de caséines intactes63. Cette observation suggère que des peptides issus des caséines sont responsables des effets hypoglycémiants des caséines et est cohérente avec le mécanisme moléculaire impliquant la leucine (section 2.2.1.4.1).
Un effet dose-réponse au niveau de la sécrétion de l’insuline a été observé dans une étude sur 13 humains en surpoids de 58 ans en moyenne. Les différents groupes ont reçu des breuvages contenant 50g de glucides et 0g, 6g ou 12g de caséine. Aucune différence dans la sécrétion de l’insuline n’a été observée chez le groupe ayant reçu 6g. Cependant, une différence significative a été mesurée pour le groupe ayant reçu 12g de caséine.
Ensemble, ces études démontrent que la consommation de caséines peut améliorer la sécrétion d’insuline, ce qui se traduit par une diminution de la glycémie chez les humains.
2.2.2.2– Effet des caséines sur l’hypertension
Dans une étude chez 70 sujets obèses, un supplément de 27 g de caséines non hydrolysées consommées deux fois par jour a significativement diminué la pression diastolique par rapport au groupe témoin64. Plusieurs peptides possédant une activité inhibitrice de l’ACE ont été identifiés65. Par exemple, chez des rats hypertendus, les peptides YKVPQL66 et TTMPLW67 issus de la caséine-α ont provoqué une diminution de la pression systolique de 1366 et 1467 mmHg, respectivement. Des peptides issus de la caséine- β ont également été isolés, comme l’IPP et le VPP, qui ont provoqué une diminution de la pression systolique de rats hypertendus de 28 et 30 mmHg, respectivement68.
13
Les peptides IPP et VPP sont parmi les peptides hypotensifs les plus étudiés. Chez l’humain, ces deux peptides ont provoqué une diminution de la pression systolique de 1469, et 1565 mmHg, respectivement. Des produits laitiers fonctionnels commerciaux contenant ces deux peptides ont été développés. Le Calpis est un lait acidifié vendu au Japon et l’Evolus est un yogourt vendu en Finlande65. Ainsi, des aliments contenant des caséines auraient le potentiel de fournir des peptides inhibiteurs de l’ACE pouvant diminuer la pression systolique chez des humains hypertendus.
2.2.2.3- Effet du babeurre sur l’hypertension
Le babeurre est un sous-produit issu de la fabrication du beurre70 et, comme les protéines du lactosérum, a longtemps été considéré comme un sous-produit. Cependant, de plus en plus d'études tendent à démontrer que le babeurre possède des propriétés bénéfiques pour la santé. Le babeurre est composé de 90% d'eau, 4% de glucides, 3.4% de protéines et 0.5% de gras70. Les protéines du babeurre se différencient des protéines du lait écrémé car elles contiennent les protéines des membranes des globules de gras du lait (MFGM)70. Les MFGM sont composés de protéines, de phospholipides, de minéraux et de vitamines A et E70. Durant le barattage, les membranes des globules de gras sont brisées et les protéines et autres constituants sont libérés dans le babeurre soit sous forme libre ou sous forme de complexe avec des résidus de MGFM, ce qui augmente leur biodisponibilité70.
Le babeurre a montré des effets hypocholestérolémiants in vitro 71. La solubilité micellaire du cholestérol était diminuée de 57% et de 17% en présence de babeurre de crème crue et de babeurre de crème pasteurisée, respectivement71. Une dose quotidienne de 45g de babeurre a montré un effet hypotenseur in vivo chez 34 humains hypercholestérolémiques12. La pression systolique et la concentration plasmatique d’ACE du groupe recevant le babeurre étaient diminuées de 2.6 mm/Hg et de 10%, respectivement, comparé au placebo. La diminution de la pression systolique s’expliquerait par la diminution de l'activité de l'ACE12. Cependant, le mécanisme n'a pas clairement été identifié. Les auteurs suggèrent que des peptides bioactifs provenant des MFGM pourraient inhiber l'enzyme ACE. Ceci expliquerait la diminution de la concentration d’ACE mesurée72. Cette hypothèse est crédible puisque de nombreux peptides inhibiteurs de l’ACE ont été identifiés dans différents produits laitiers.
14
Les protéines des MFGM ont démontré plusieurs autres effets biologiques comme des effets anti-cancer. Par exemple, les protéines de MFGM ont inhibé la croissance in vitro de cellules de cancer du sein70. Les protéines des MFGM possèdent aussi des propriétés anti-bactériennes. Dans une étude in vivo, les protéines de MFGM ont inhibé la colonisation du pylore de l'estomac par Helicobacter pylori et Escherichia coli70. Finalement, les protéines des MFGM diminueraient le risque de maladies cardiovasculaires70.
2.2.3 – Les protéines du blanc d’œuf
Le blanc d’œuf est composé de 88% d’eau, 11% de protéines et environ 1% de glucides, lipides et minéraux73. Les principales protéines du blanc d’œuf sont l’ovalbumine (54%), l’ovotransferrine (12%), l’ovomucoïde (11%), le lyzozyme (3.5%) et l’ovomucine (3.5%). Les protéines du blanc d’œuf possèdent une valeur biologique élevée, ce qui en fait une source de protéine intéressante du point de vue nutritionnel74.
2.2.3.1 – Effets des protéines de blanc d’œuf sur le diabète de type II
Dans une étude in vitro, plusieurs peptides inhibiteurs de l’α-glucosidase et de l’α-amylase (cibles pharmacologiques contre le diabète de type II) ont été identifiés à partir d’un hydrolysat de protéines de blanc d’œuf75. Le peptide RVPSLM est le plus puissant inhibiteur de l’α-glucosidase qui a été identifié lors de cette étude avec un IC50 de 23 µM75.
Une étude a démontré la présence d’inhibiteurs de la DPP-4 dans un hydrolysat de protéines de blancs d’œuf (IC50 = 0.9 mg/mL)76. Une supplémentation de cet hydrolysat chez des rats diabétiques de type II a réduit les dommages rénaux76.
Dans une étude clinique sur 17 patients atteints de diabète de type II, l’aire sous la courbe de la réponse à l’insuline était 1.9 fois plus élevée chez le groupe ayant reçu un repas contenant 50g de glucose supplémenté par 25g de protéines de blanc d’oeuf que le groupe ayant reçu un repas de 50g de glucose77. Cependant, dans cette étude, les protéines de blanc d’œuf n’ont pas modifié la réponse glycémique des patients comparativement au groupe témoin77.
15
L’ensemble de ces études démontre que des peptides possédant une activité contre le diabète de type II peuvent être formés à partir des protéines de blanc d’œuf.
2.2.3.2 – Effets des protéines de blanc d’œuf sur l’hypertension
L’hydrolyse de l’ovalbumine par la pepsine a permis d’identifier 6 inhibiteurs de l’ACE qui sont LW, FCF, NIFYCP, FFGRCVSP, ERKIKVYL, FGRCVSP13. L’hydrolyse de l’ovotransferrine par l’alcalase, la trypsine et l’α-chymotrypsine a permis d’identifier un peptide inhibiteur de l’ACE qui possède aussi des activités vasodilatatrices (KVREGT)78.
Les peptides YREERYPIL, RADHPFL et IVF obtenus par l’hydrolyse de blanc d’œuf par la pepsine ont réduit la pression artérielle chez des rats hypertendus spontanément tandis qu’aucune modification n’a été mesurée chez des rats normotendus13. Une étude plus poussée des peptides YREERYPIL et RADHPFL a démontré que ces peptides sont hydrolysés lorsqu’ils sont administrés oralement79. Les produits issus de cette hydrolyse seraient responsables des activités hypotensives de ces peptides79. Au contraire, le peptide IVF est directement biodisponible par voie orale80.
Dans une recherche similaire, le peptide QIGLF, qui est un inhibiteur in vitro de l’ACE, a été administré à des rats hypertensifs par voie orale81. Après 4 semaines, un effet dose réponse a été observé81. Les rats recevant la plus grande dose (50mg/kg) montraient une tension artérielle plus faible que les rats ayant reçu une dose de 10 mg/kg et 2mg/kg81. Une étude du peptide TNGIIR qui est un inhibiteur de l’ACE (IC50 = 70µM) sur des cellules Caco-2 a démontré que ce peptide est transporté du côté apical au côté basolatéral sans être modifié82. Ce résultat suggère que ce peptide a le potentiel d’être biodisponible chez les humains. Ces travaux démontrent que l’hydrolyse du blanc d’œuf peut former des peptides inhibiteurs de l’ACE qui ont un effet hypotensif in vivo. Des yogourts contenant des protéines de blanc d’œuf auraient le potentiel de posséder des propriétés hypotensives et hypoglycémiantes.
16
2.3- Identification de peptides bioactifs
La stratégie traditionnelle de découverte de peptides bioactifs suit les 4 grandes étapes suivantes : 1) choix de la source protéique, 2) protéolyse 3) criblage in vitro pour différentes bioactivités, 4) Identification des peptides83.
2.3.1 – Sources protéiques
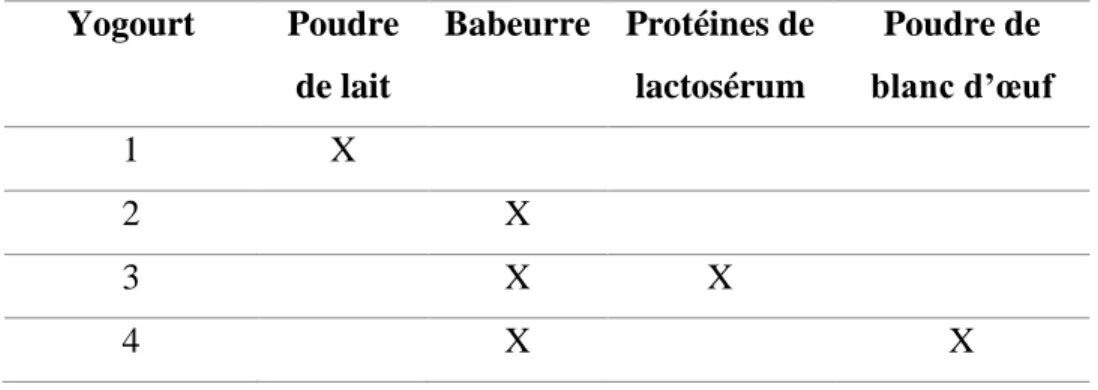
Comme démontré précédemment, les protéines de lactosérum, les caséines, le babeurre ou le blanc d’œuf ont le potentiel de contenir des peptides ayant des propriétés contre l’obésité, le diabète ou l’hypertension. Ces protéines présentent un intérêt pour la conception de yogourt, comme aliment fonctionnel, qui aurait des propriétés contre l’obésité, le diabète et l’hypertension. Ainsi, la fabrication de 4 types yogourts avec la composition protéique suivante serait à considérer:
Tableau I : Composition en protéines de différents types de yogourts Yogourt Poudre de lait Babeurre Protéines de lactosérum Poudre de blanc d’œuf 1 X 2 X 3 X X 4 X X 2.3.2 – Protéolyse
Le choix des enzymes protéolytiques, ou des ferments, est une étape cruciale dans la génération de peptides bioactifs, car ils scindent les protéines différemment et les peptides obtenus seront différents83. Les peptides bioactifs ont souvent une séquence de 2 à 20 acides aminés 84. Les petits peptides ont le potentiel d'être mieux absorbés et d'interagir avec des cibles dans le corps humain, ce qui explique leur bioactivité85. Pour produire des peptides actifs, les protéines doivent subir une hydrolyse par :
1) le système digestif, 2) digestion enzymatique in vitro , 3) fermentation
17
La fermentation microbienne, par le biais des protéases intracellulaires et extracellulaires des bactéries, est une des principales méthodes pour obtenir des peptides bioactifs à partir du lait86. En effet, les peptides hypotensifs VPP et IPP sont formés par la fermentation de lait écrémé par Lactobacillus helveticus et Saccharomyces cerevisiae87. Lactobacillus delbrueckii subsp. bulgaricus SS1 et Lactococcus lactis subsp. cremoris FT4 permettent de former les inhibiteurs peptidique de l’ACE suivants : LNVPGEIVE, NIPPLTQTPV et NVPGEIVE87. La fermentation de lait par Enterococcus faecalis CECT 5727, 5728 et 5726 a permis de former les peptides inhibiteurs de l’ACE suivants : LHLPLP (IC50 = 5.5 µM)88, LVYPFPGPIPNSLPQNIPP (IC50 = 5.2 µM)89, VRGPFPIIV (IC50 = 599 µM)89 et VLGPVRGPFP (IC50 = 137 µM)89. La fermentation de lait écrémé par Streptococcus thermophilus St1342 et Lactobacillus delbrueckii ssp. bulgaricus Lb1466 contenant les probiotiques Lactobacillus acidophilus LAFTIs L10, Lactobacillus casei LAFTIs L26 et Bifidobacterium lactis LAFTIs B94 a formé les peptides inhibiteurs de l’ACE suivants : TYKEE (IC50 = 12 µg/mL), IPP (IC50 = 4 µg/mL), YNEPVL (IC50 = 6 µg/mL), RINKK (IC50 = 12 µg/mL), SLPQN (IC50 = 5 µg/mL), VPP (IC50 = 3 µg/mL) et ARHPH (IC50 = 10 µg/mL)90. Ainsi, le choix des ferments peut avoir un impact sur les peptides actifs présents dans les yogourts.
Le système digestif humain libère aussi un nombre important de peptides bioactifs. Ainsi, des systèmes de digestion in vitro qui simulent le système digestif ont été développés pour étudier de tels peptides 9192. Pour simuler l’effet du système digestif humain, des systèmes reproduisant le système digestif comme le TIM-1 sont les méthodes les plus représentatives de la réalité 93. Par contre, ces approches sont dispendieuses et longues, ce qui ne s’applique pas à l’analyse d’un grand nombre d’échantillons. Des techniques plus simples, comme la digestion enzymatique en deux étapes, peuvent être utilisées pour simuler la digestion d’un seul macronutriment comme les protéines 94.
Pour reproduire l’effet de l’estomac, les protéines sont incubées en présence de fluide gastrique simulé et de pepsine. Ensuite, pour reproduire l’effet du duodénum, le pH des échantillons est augmenté. Les échantillons sont ensuite incubés en présence de sels biliaires, de trypsine et de chymotrypsine. L’hydrolyse est arrêtée par l’ajout d’inhibiteur de trypsine et de chymotrypsine ou par un traitement thermique94. L’avantage de cette
18
technique est qu’elle est applicable à de nombreux échantillons du fait qu’elle est simple, rapide et peu dispendieuse. Cette technique a déjà été utilisée pour caractériser les peptides de la β-lactoglobulline produits par le système digestif 94.
Dans cette étude, la digestion en deux étapes sera utilisée afin de reproduire l’effet du système digestif sur les protéines des laits fermentés. Cette étape pourrait dégrader des peptides bioactifs formés par les ferments mais aussi pourrait former d’autres peptides. De plus, cette étape permet de simuler, en partie, l’effet du système digestif sur le yogourt, ce qui est plus proche de la réalité.
2.3.3 - Criblage in vitro
Pour la découverte de peptides bioactifs, les échantillons obtenus suite à la protéolyse doivent être testés in vitro. Des tests de bioactivités comme l'inhibition enzymatique, la modulation de l'activité de récepteurs, le potentiel antioxydant, anti-microbien ou immunologique peuvent être réalisés 95.
L’activité des enzymes DPP-4 et ACE peut être évaluée par des essais spectrophotométriques qui mesurent l’activité enzymatique par la variation d’absorbance du milieu réactionnel. Dans le cas de la DPP-4, la formation du produit de la réaction enzymatique fait augmenter l’absorbance du milieu49. Plus l'augmentation d'absorbance sera faible, plus l'inhibition sera importante. Ce test a été utilisé pour découvrir des inhibiteurs de DPP-4 chez les protéines de lactosérum49. Dans le cas de l’ACE, la disparition du substrat fera diminuer l’absorbance du milieu96. Ainsi, plus l'augmentation d'absorbance sera faible, plus l'inhibition sera importante. Ce test a été utilisé pour découvrir des inhibiteurs de l’ACE dans des laits fermentés96. L’avantage de ces essais est qu’ils sont réalisables à l’aide de plaques de 96 puits et que les réactions sont suivies en temps réel. Ainsi, le criblage rapide d’un nombre important d’échantillons est possible.
2.3.4 – Identification des peptides bioactifs
La spectrométrie de masse (MS) est la technique la plus utilisée pour identifier les peptides83, 97. Les profils de fractionnement des peptides présents dans les échantillons sont comparés avec les peptides de bases de données comme Pepbank qui contient plus de
19
20 000 peptides bioactifs98. Ces bases de données contiennent des informations comme la séquence, l'activité, le EC50 et la littérature pertinente83. Ainsi, ces bases permettent d’identifier rapidement des peptides bioactifs pour lesquels les tests d'activités sont complexes comme la vérification du potentiel anti-obésité qui impliquent souvent des humains ou des animaux. Le désavantage de cette approche est qu’elle se limite aux peptides déjà connus.
La MS a été utilisée pour découvrir des peptides inhibiteurs de l’ACE (séquences VPP et IPP) suite à l'hydrolyse du lait par Lb. helveticus99. Un dipeptide (TP), inhibiteur de l'ACE, a aussi été identifié par MS à partir d'un yogourt fermenté par une protéase de Lb. helveticus100. Des peptides inhibiteurs de l'ACE ont été également identifiés, par MS, après fermentation de la β-caséine par Enterococcus faecalis101.
L'objectif général de ce projet est de détecter la présence de peptides à activité biologique dans des laits fermentés à base babeurre, de protéines de lactosérum et de protéines de blanc d'oeuf. Des analyses de spectrométrie de masse permettront d’identifier et de confirmer la présence de peptides inhibiteurs de la DPP-4 et de l’ACE.
20
3- Hypothèse et objectif
3.1 – HypothèseDes laits fermentés à base de babeurre, de protéines de lactosérum et de blanc d’œuf possèdent des peptides ayant des propriétés potentielles contre l’obésité, le diabète de type II ou l’hypertension.
3.2- Objectifs
1- Réaliser la digestion in vitro de laits fermentés contenant diverses sources de
protéines;
2- Évaluer l’activité de ces hydrolysats sur les enzymes ACE et DPP-4; 3- Identifier les peptides bioactifs.
21
4- Identification of angiotensin-converting enzyme (ACE) and
dipeptidyl peptidase 4 (DPP-4) inhibitors in dairy and egg
fermented products
Résumé
L’incidence de l’hypertension et du diabète de type II (T2D) augmente à travers le monde. Les aliments fonctionnels pourraient aider à prévenir ou contrôler l’hypertension et le T2D. Dans cette optique, différents produits de lait et d’œuf fermentés ont été digérés dans un système digestif in vitro en 2 étapes. Les peptides inhibiteurs des enzymes ACE et la DPP-4 ont été recherchés dans les échantillons de laits fermentés avant et après digestion. La majorité des résultats a montré que le processus de digestion est généralement requis pour libérer les inhibiteurs d’ACE et de DPP-4 des produits testés. Les analyses de spectrométrie de masse ont permis d’identifier 4 inhibiteurs de DPP-4 et 9 inhibiteurs d’Ace dont 5 sont connus pour posséder des propriétés in vivo.
Abstract
Incidence of hypertension and Type II diabetes (T2D) is increasing worldwide. Functional foods could helps prevent or control hypertension and T2D. In this regard, different fermented dairy and egg products were digested in a 2-step in vitro digestive model. ACE and DPP-4 enzymes inhibitors were screened in fermented milk samples before and after digestion. Most of results showed that the digestive process is required to release ACE and DPP-4 inhibitors from the tested products. Mass spectroscopy analysis allowed the identification of four DPP-4 and nine ACE inhibitors, five of them being known to be bioactive.
Key words: fermented products, hypertension, angiotensin-converting enzyme (ACE), dipeptidyl peptidase 4 (DPP-4), buttermilk, milk, whey proteins, egg white proteins,
22
4.1- Introduction
Hypertension and type II diabetes (T2D) are two of the most prevalent chronic diseases. It is estimated that 25% to 50% of world wide adults are either pre-hypertensive or hypertensive16. Hypertension alone is responsible for 10 million deaths each year15. In USA, more than 30 millions of persons are affected by T2D and more than 80 millions are pre-diabetics. Health care cost of T2D in USA is estimated to 250 billions of dollars/year17. Moreover, T2D is recognized to be the first cause of non-accidental blindness18, renal failure19 and non-accidental lower limb amputation20.
One of the most effective way to prevent and control hypertension and T2D is diet intervention2. People are encouraged to follow a diet which consists of a high consumption of fruits, vegetables, fibers, complex carbohydrates, low sodium, low saturated and low total fat intake. Moreover, nutraceuticals having a bioactivity against these chronic diseases could provide a new health tool to control hypertension and T2D. For instance, Lactium® is a trypsin α-casein hydrolysate enriched protein fraction known to possess antioxyolytic properties on animal and human102. A daily supplement of 150 mg of Lactium® improved the stress-related digestive, cardiovascular and intellectual symptoms in a double blind clinical study on 63 stressed women102. The commercial brand Calpis® and Evolus®
,
soldin Japan and Finland respectively, are milk enriched with the anti-hypertensive peptides VPP and IPP57. Therefore, food proteins are known to be a source of anti-hypertensive and anti-diabetes peptides that target the angiotensin-converting enzyme (ACE) and dipeptidyl peptidase 4 (DPP-4), which are effective pharmacologic target in the treatment of hypertension and T2D, respectively15, 25.
ACE is a protease in the renin-angiotensin system (RAS)103. In this system, the peptidic hormone angiotensinogen is cleaved by renin giving the angiotensin I peptide (ANG I). ANG I is then cleaved by ACE giving the more active angiotensin II peptide (ANG II). ANG II stimulates the vasoconstriction, sodium and water tubular reabsorption and ADH secretion, resulting in the increasing of the blood pressure. Inhibition of ACE results in a lower ANG I to ANG II conversion and lower blood pressure.
23
DPP-4 is a protease in the incretin system. Following the ingestion of food, the peptidic hormone glucagon-like peptide-1 (GLP-1) and glucose-dependent-insulinotropic polypeptide (GIP) are released in the intestine. GLP-1 and GIP are associated with various anti-diabetic effects such as stimulating the secretion of insulin, delay gastric emptying, increase insulin sensitivity, stimulate pancreatic β-cell proliferation, increase satiety, etc44. DPP-4 cleaves and deactivate the GLP-1 and GIP. The inhibition of DPP-4 raises the half-life of GLP-1 and GIP which favorize their anti-diabetic effects in the human body. In the last years, several ACE and DPP-4 peptidic inhibitors have been identified in food proteins57,50 such as dairy and egg white proteins. Several DPP-4 inhibitors (IPA, WV or ALPMH) and ACE inhibitors (YGLF and YLLF) were identified in whey proteins104,105,49,106 and caseins107. The FVAPFPEVF and PPFLQPEVM peptides from α-casein and β-α-casein, respectively, have been identified as inhibitors of both DPP-4 and ACE. In vivo anti-hypertensive effect of buttermilk was also reported in a randomized double blind clinical study conducted with 45 hypercholesterolemic men and women. A daily supplement of 45g buttermilk reduced the systolic blood pressure by 2.6 mmHg12. The authors hypothesized that peptidic ACE inhibitor originating from the milk fat globule membrane could explain the blood pressure drop observed12. Moreover, buttermilk contain both whey and casein proteins. Thus, buttermilk could be a source of DPP-4 and ACE inhibitors. The DPP-4 inhibitor effect of white egg protein hydrolysate has also been demonstrated76. In a clinical study on a cohort of 17 T2D patients, a supplement of 25 g white egg proteins improved the insulin secretion but did not improve the glycemic response77. The ACE inhibitors YREERYPIL, RADHPFL and IVF lowering the blood pressure in spontaneous hypertensive rats (SHR) have been identified in a white egg hydrolysate13. However, a further study demonstrated that YREERYPIL and RADHPFL
peptides are degraded in the digestive tract and their hypotensive activity due to sub-products79.
The proteolytic process required to release the active peptides from proteins occurs in the human digestive tract84. Thus, in vitro digestive systems are often used to study the release of DPP-4 and ACE inhibitor from food protein91,92. However, active peptides could also be released during a fermentation process via starter proteolytic enzymes86. Indeed, the
24
ACE peptidic inhibitors IPP and VPP present in Calpis® are released during skim milk fermentation by Lactobacillus helveticus and Saccharomyces cerevisiae87. Lactobacillus
helveticus CP90 is known to release the ACE peptidic inhibitor KVLPVPE in fermented
milk108. Lactobacillus delbrueckii subsp. bulgarius SS1 and Lactococcus lactis subsp.
cremoris FT4 are also known to release the ACE peptidic inhibitors LNVPGEIVE,
NIPPLTQTPV and NVPGEIVE in fermented milks87. These studies show that starter cultures can release ACE peptidic inhibitors from milk. However, the ACE and anti-DPP4 activities of fermented buttermilk enriched with whey protein or white egg proteins has not being studied. Therefore, the examination of the potential of fermented dairy and white egg proteins products as a source of both ACE and DPP-4 inhibitors was undertaken.
25
4.2- Material and methods
4.2.1 ChemicalsAll chemicals were bought from Sigma Aldrich (Oakville, ON, Canada) unless specified otherwise.
4.2.2 Dairy and white egg proteins
Buttermilk was purchased from Gay Lea (Mississauga, ON, Canada). Skim milk powder was provided by Agropur (St-Hubert, QC, Canada). White egg proteins were provided by Caldic (Mississauga, ON, Canada). Whey protein concentrates (WPC50 and WPC80) and whey protein isolate were provided by Caldic (Mississauga, ON, Canada).
4.2.3 Starters
Freeze-dried Yogourmet starter was provided by Lyo-san (Lachute, QC, Canada). Freezed YO-MIX® T11, YO-MIX® T860, CHOOZIT BMT 1070 and CHOOZIT MK5 starters were provided by Danisco (Mississauga, ON, Canada).
4.2.4 Production of the fermented milks
Buttermilk, skim milk and whey powders were rehydrated to obtain solutions containing 12% (W/V) of total solids. Buttermilk and whey or white egg powder mix were rehydrated to obtain 20% (W/V) of total solids. The ratio of buttermilk protein and whey or white egg protein was 1:1. The solutions were stirred for one hour and stored at 4ºC overnight. The following day, the mixes were warmed up to the incubation temperature and inoculated with 2% of the appropriate pre-culture or with 7.5g of the Yogourmet starter in 1L. After mixing, the inoculated solutions were distributed in 100 mL containers and incubated at 37ºC (YO-MIX® T11, YO-MIX® T860 and CHOOZIT® MK5) or 35ºC (CHOOZIT BMT 1070) until pH 4.7 was reached. The fermented products were then cooled at 4ºC and frozen at -20ºC until further use.
26
4.2.5 - Fermented milk digestion 4.2.5.1 - Gastric digestion
Three types of samples of each studied yoghurt were produced. Non-treated samples did not undergo digestion. Non-digested samples underwent gastric digestion but no enzymatic digestion. Finally, the digested samples underwent gastric and enzymatic digestion.
Fermented samples containing 250 mg of proteins were added to 20 mL of distilled water (non-treated samples) or simulated gastric fluid (0.2 M HCl, 0.2 M KCl, pH 2.5 109). Gastric samples were treated with 100 µL of simulated gastric fluid (non-digested samples) or a solution of 100 mg/mL of pepsin (digested samples) prepared in simulated gastric fluid (enzyme : protein ratio = 1:2594). Then, the samples were incubated at 37ºC in a water bath for 2h94.
After treatment, samples were immediately centrifugated at 6000 g at 4ºC for 30 min. The supernatants were filtered with 0.45 µM filter. freeze dried for 72h and stored at -20ºC.
4.2.5.2 - Intestinal digestion
After gastric digestion (simulated gastric fluid + pepsin), the pH of the solutions was adjusted to 7.5 with 1M KOH. Then, 2.5 mL of a 20% bile beef solution (w/v) was added to 20 mL samples in order to obtain a final bile concentration of about 2%109. pH was then re-adjusted to 7.5 with 0.2 M KOH. Thereafter, 200 µL of distillated water (non-digested samples) or 100 µL of a 6.25 mg/mL trypsin solution (1:10094) and 100 µL of 25 mg/mL chymotrypsin solution (1:40094) were added (digested samples). The samples were incubated at 37ºC in a water bath for 1h94. The non-digested and digested samples were then heated to 90 ºC for 10 min for enzyme deactivation.
Following the heating, the samples were centrifugated at 6000g at 4ºC for 30 min. The supernatants were filtrated with 0.45 µM filter, freeze dried for 72h and stored at -20ºC.
27
4.2.6 DPP-4 inhibition
All DPP-4 assays were conducted in 96 wells plates with the commercial DPP-4 Drug Discovery Kit (Enzo Life Sciences, Farmingdale, NY, USA). The Gly-Pro-p-nitroanilide hydrochloride (pNA) substrate, the DPP-4 enzyme and the fermented milk extracts were dissolved in Tris 50 mM buffer solution (pH 7.5) in order to obtain the final solutions described in Table II. The reactions were started with the addition of the DPP-4. The absorbance was monitored in a plate reader for 20 minutes (10 sec reading cycle) at 405 nm. One repetition in duplicate was carried during the screening.
Tableau II : DPP-4 assays Stock solutions Negative control (µL) Positive control (µL) Sample negative control (µL) Assay (µL) Tris-HCl solution 50 (50mM) a 35 (50mM) 25 (50mM) 10 (50mM) pNa (200 µM) 50 (100 µM) 50 (100 µM) 50 (100 µM) 50 (100 µM) DPP-4 (17.3 µU/µL) 0 (0 µU/µL) 15 µL (0.26 mU) 0 15 µL (0.26 mU) Sample (20mg/mL) 0 (0 mg/mL) 0 (0 mg/mL) 25 (5 mg/mL) 25 (5 mg/mL) a: values in brackets indicate the final concentration in the wells
The slopes of the enzymatic reactions were calculated and corrected to take account of the natural absorbance variation of the system. The percentage of inhibition of DDP-4 enzyme was calculated according to the following formula:
Relative DPP4 activity (%) = (sample slope – negative sample slope)
(positive control slope – negative control slope ) 𝑥 100
4.2.7 ACE inhibition
ACE activity was carried in 96 well plates with the furanacroloyl-Phe-Glu-Glu (FA-PGG) assay110. ACE enzyme, FA-PGG and the fermented milk extracts were dissolved in 50 mM Tris HCl buffer solution (pH 7.5) containing 0.3 M NaCl in order to obtain the final solutions illustrated in table III. The reactions were started with the addition of ACE. The absorbance of the reaction was monitored in a plate reader for 30 minutes (reading cycle of 10 sec) at 340 nm. One repetition in duplicate was carried during the screening.
28
Tableau III : ACE assays Stock solution Negative control (µL) Positive control (µL) Sample negative control (µL) Assay (µL) Tris-HCl NaCl solution 150 (50 mM)a 100 (50mM) 100 (50mM) 50 (50mM) FA-PGG (3.12 mM) 50 (780 µM) 50 (780 µM) 50 (780 µM) 50 (780 µM) ACE (40 mU/mL) 0 (0 U/mL) 50 µL (2 mU) 0 (0 U/mL) 50 µL (2 mU) Sample (20mg/mL) 0 (0 mg/mL) 0 (0 mg/mL) 50 (5 mg/mL) 50 (5 mg/mL) a: values in brackets indicate the final concentration in the wells
The slopes of the enzymatic reactions were calculated and corrected to take account the natural absorbance variation of the system. The percentage of inhibition of DDP-4 enzyme was calculated according to the following formula:
Relative ACE activity (%) = (Sample slope – negative sample slope)
(positive control slopte – negative control slope ) 𝑥 100
4.2.8 Mass spectrometry
RP-UPLC analyses were performed using a 1290 Infinity II UPLC (Agilent Technologies, Santa Clara, CA, USA). The equipment consisted of a binary pump (G7120A), a multisampler (G7167B), an in-line degasser and a variable wavelength detector (VWD G7114B) adjusted to 214 nm. Freeze-dried digested samples were diluted to 10mg/mL and filtered through 0.22µm PVDF filter into a glass vial. The samples were loaded (5µL) onto an Acquity UPLC CSH 130 1.7µm C18 column (2.1mm i.d.×150mm, Waters Corporation, Milford, MA, USA). The column was operated at a flow rate of 400µL/min at 45°C. The gradient consisted of solvent A (LC-MS grade water with 0.1% formic acid) and solvent B (LC-MS grade ACN with 0.1% formic acid) starting at 2% B and ramping to 35% B in 40 min, then ramping to 85% B to 40.50 min, holding until 42 min, then back to initial conditions until 45min.
A hybrid ion mobility quadrupole TOF mass spectrometer (6560 high definition mass spectrometry (IM-Q-TOF), Agilent, Santa Clara, USA) was used to identify the peptides. All LC-MS/MS experiments were acquired using Q-TOF. Signals were recorded in
29
positive mode at Extended Dynamic Range, 2Ghz, 3200m/z with a scan range between 100–3200m/z. Nitrogen was used as the drying gas at 13.0 L/min and 150°C, and as nebulizer gas at 30psig. The capillary voltage was set at 3500 V, the nozzle voltage at 300 V and the fragmentor at 400 V. The instrument was calibrated using an ESI-L low concentration tuning mix (G1969-85000, Agilent Technologies, Santa Clara, CA, USA). Data acquisition and analysis were done using the Agilent Mass Hunter Software package (LC/MS Data Acquisition, Version B.07.00 and Qualitative Analysis for IM-MS, Version B.07.00 with BioConfirm Software). Additional search was done using the Spectrum Mill MS Proteomics Workbench Rev B.05.00.180. The milk, whey and egg protein databases were used to search for tryptic, chymotrypsin and/or pepsin peptides. One repetition of fermented products was analysed.
30
4.3- Results and discussion
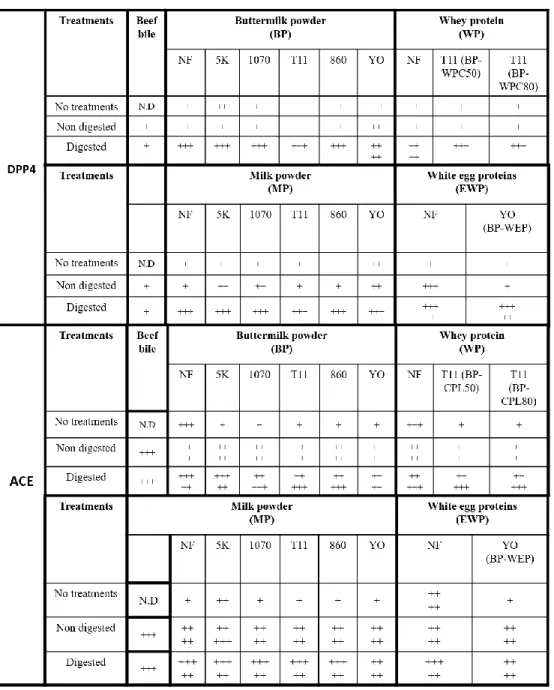
A 2-step in vitro digestive model was used to simulate the effect of the human digestive system. The inhibition rates of DPP-4 and ACE by the digested and non-digested
fermented milks are presented in Table IV. The beef bile used in this digestion model did not affect the DPP-4 activity and inhibited moderately the ACE activity (Table IV, beef bile column).
Tableau IV : Inhibition of DPP-4 and ACE. NF = Non-fermented. No treatment: non-treated fermented samples. Non-digested: samples exposed to digestion conditions (pH, bile) without pepsine, trypsin and chymotrypsin treatment. Digested = samples exposed to digestion conditions (pH, bile) and to pepsin, trypsin and chymotrypsin treatment. The inhibition of DDP-4 or ACE in presence of 5 mg/mL fermented sample is illustrated by the code: + = 81-100% activity, ++ = 61-80% activity, +++ = 41-60% activity, ++++ = 21-40%, +++++ = 0-20% activity.
31
4.3.1 - Inhibition of DPP-4 and ACE enzymes 4.3.1.1 - DPP-4
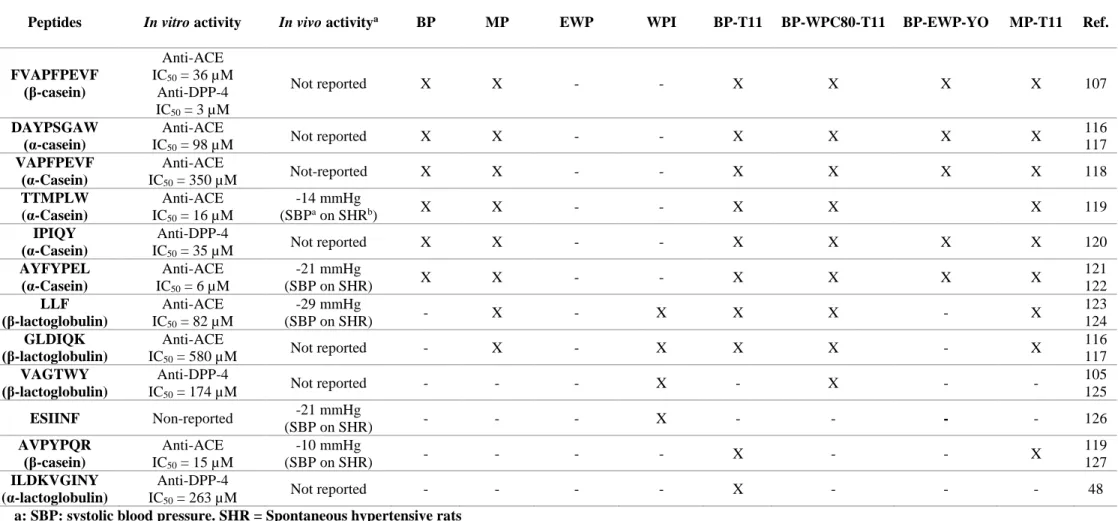
The non-fermented (NF) and non-treated BP, WP, MP and EWP samples slightly inhibited DPP-4 (Table IV). On the other hand, digested samples inhibited DPP-4 more strongly. A similar pattern was observed in the case of the fermented extracts. It should be noted that the digested EWP and digested EWP-YO showed the most potent inhibiting activity on the DPP-4 enzyme. In a recent study, a 2-step in vitro digestive model was applied on a commercial yoghurt107. The authors observed that non-digested yoghurt extracts weakly inhibited the DPP-4 while the digested extracts strongly inhibited the DPP-4107. They were able to identify the peptides FVAPFPEVF and PPFLQPEVM which inhibited DPP-4 in the low micro molar range107. In another study, the peptide LPQNIPPL was identified from gouda type cheese which inhibited DPP-4. Interestingly, the production of this peptide increased during the ripening period of the cheese which suggests that microbial proteolysis was implicated111.
In our study, the fermentation process of BP, WP, MP and EWP did not seem to enhance the release of DPP-4 inhibitors. Moreover, the similarities observed between the results of buttermilk and milk samples suggest that the MFGM is not implicated in the inhibition of the DPP-4. In fact, DPP-4 inhibitors were mainly released by the digestive enzymes. These results are in agreement with a recent study who reported that pepsin or pancreatin hydrolysates from sodium caseinate, whey protein isolate and milk protein concentrate inhibited DPP-4 (IC50 around 0.5 mg/mL)104. The same authors also reported that a pepsin α-lactoglobulin hydrolysate inhibited DPP-4 with an IC50 of 0.036 mg/mL48. In another study, pepsin/corolase whey proteins hydrolysates inhibited DPP-4 with an IC50 of 1.33mg/mL112 and a casein hydrolysate inhibited DPP-4 with an IC50 of 1.015 mg/mL113. Finally, the peptides LL, LV, LA, LLF, ALPMH, IPA and IPI, issued from the hydrolysis of β-lactoglobulin, were reported as DPP-4 inhibitors49. EWP hydrolysates also attenuated renovascular damage and slightly inhibited the plasmatic DPP-4 in type 2 diabetic rats models (IC50 = 0.9 mg/mL)76.