Évaluation de l’effet d’apports de caroténoïdes de
la luzerne déshydratée sur leur transfert dans les
sécrétions lactées et la stabilité oxydative des
matières grasses du lait.
Mémoire
Marie-Christine Fauteux
Maîtrise en sciences animales
Maître ès sciences (M. Sc.)
Québec, Canada
iii
Résumé court
Ce projet visait à déterminer l'efficacité du transfert du pouvoir antioxydant des caroténoïdes d’un extrait concentré de luzerne (ECL) de la ration de la vache au lait et d’évaluer la susceptibilité à l'oxydation de ce lait en le comparant avec celui de vaches n’ayant pas reçu d’antioxydants ou ayant reçu un supplément de vitamine E. Tous les animaux ont également reçu des perfusions intra-abomasales continues d’huile de lin. En comparaison aux animaux recevant le supplément de vitamine E, ceux alimentés avec l’ECL produisaient davantage de lait (tendance) et de protéines laitières. L’augmentation de la teneur en acides gras polyinsaturés des matières grasses du lait aura fragilisé leur stabilité oxydative du lait pendant l’entreposage, indépendamment des traitements. L’évaluation de la stabilité oxydative du lait frais a cependant permis de noter que l’ajout d’un ECL à la ration des vaches laitières contribue à prévenir la dégradation oxydative d’un lait enrichi en acides gras polyinsaturés.
v
Résumé long
Au cours des dernières décennies, plusieurs initiatives ont été mises de l’avant pour produire et mettre en marché un lait enrichi en acides gras ω-3, molécules reconnues pour leurs effets bénéfiques sur la santé du consommateur. Cependant, une augmentation de la teneur en acides gras polyinsaturés du lait s’accompagne d’une augmentation concomitante de la sensibilité de la matière grasse laitière à l’oxydation. Certains ingrédients ayant un pouvoir antioxydant sont actuellement ajoutés à la ration des vaches et pourraient aider à prévenir la détérioration des qualités nutritionnelles et organoleptiques de la matière grasse laitière. Notamment, la vitamine E est couramment utilisée en conditions commerciales. Cependant, le transfert du pouvoir antioxydant de la vitamine E au lait est peu élevé, ce qui rend son efficacité à prévenir l’oxydation du lait faible (St-Laurent et al., 1990).
Les objectifs du présent projet étaient d’ajouter à la ration des vaches un aliment ayant un pouvoir antioxydant (extrait concentré de luzerne, ECL), de déterminer l'efficacité du transfert de ce pouvoir antioxydant de la ration au lait et d’évaluer la susceptibilité à l'oxydation du lait obtenu en le comparant avec du lait de vache n’ayant pas reçu d’antioxydants (témoin négatif) et avec du lait de vaches ayant reçu un supplément de vitamine E (témoin positif). Pour ce faire, six vaches Holstein ont été réparties selon un dispositif en carré Latin double 3 × 3. Afin d’établir l’efficacité des traitements à prévenir l’oxydation de la matière grasse du lait, les vaches ont également reçu des perfusions intra-abomasales d’huile de lin, source d’acides gras polyinsaturés, tout au long des périodes expérimentales.
Les perfusions intra-abomasales d’huile de lin ont permis d’augmenter considérablement les teneurs en 18:2 cis-9, cis-12 et 18:3 cis-9, cis-12, cis-15 du gras du lait au cours de la période expérimentale par rapport à la période prétraitement. En comparaison aux animaux recevant le supplément de vitamine E, les animaux ayant été alimentés avec l’ECL avaient tendance à produire plus de lait et sécrétaient significativement plus de protéines dans leur lait. Six caroténoïdes ont été identifiés dans le plasma des vaches et une corrélation positive a été observée entre les concentrations totales de caroténoïdes et l’indice de couleur du
vi
plasma. De plus, une grande variabilité entre les individus a été remarquée pour les concentrations plasmatiques de caroténoïdes et pour l’indice de couleur. Dans les conditions expérimentales de cette étude, l’augmentation de la teneur en acides gras polyinsaturés des matières grasses aura fragilisé la stabilité oxydative du lait homogénéisé mesurée au cours d’un entreposage de dix jours sous une lumière fluorescente et ce, indépendamment des traitements alimentaires. L’évaluation de la stabilité oxydative du lait frais a cependant permis de noter que l’ajout d’un ECL à la ration des vaches laitières réduit le potentiel redox du lait, de même que ses teneurs en hexanal et 1-octen-3-one, produits d’oxydation des acides gras, et ainsi contribue à prévenir la dégradation oxydative d’un lait enrichi en acides gras polyinsaturés.
vii
Table des matières
RÉSUMÉ COURT ... III RÉSUMÉ LONG ... V TABLE DES MATIÈRES ... VII LISTE DES TABLEAUX ... XI LISTE DES FIGURES ... XIII LISTE DES ABRÉVIATIONS ... XV REMERCIEMENTS ... XVII AVANT-PROPOS ... XXI
INTRODUCTION ... 1
CHAPITRE 1 REVUE DES TRAVAUX ANTÉRIEURS ... 3
1.1 Définition et structure des acides gras ... 5
1.2 Rôles des acides gras chez l’humain ... 9
1.2.1 Acides gras saturés et insaturés ... 9
1.2.2 Acides gras essentiels chez l’humain ... 9
1.2.2.1 Acides gras ω-6 ... 11
1.2.2.2 Acides gras ω-3 ... 12
1.2.2.3 Ratio ω-3/ω-6 ... 13
1.3 Le lait comme source d’acides gras ... 13
1.3.1 Composition de la matière grasse du lait ... 13
1.3.2 Lipogenèse mammaire ... 18
1.3.2.1 Synthèse de novo... 18
1.3.2.2 Acides gras de l’alimentation ... 19
1.3.3 Facteurs permettant de moduler le profil en acides gras du lait... 22
viii
1.3.3.2 Modification du profil en acides gras du lait ... 24
1.4 Oxydation des lipides ... 26
1.4.1 L’oxydation du lait ... 29
1.4.2 Facteurs alimentaires influençant la stabilité oxydative du lait ... 30
1.4.2.1 Les antioxydants ... 30
1.4.2.2 Vitamine E ... 33
1.4.2.3 Autres éléments antioxydants ... 34
1.4.2.3.1 Lignanes du lin ... 34
1.4.2.3.2 Caroténoïdes de la luzerne ... 37
1.4.3 Évaluation du transfert des antioxydants et de l’oxydation ... 38
1.4.3.1 Évaluation du transfert des antioxydants ... 38
1.4.3.2 Mesure de l’oxydation et de l’efficacité antioxydante ... 39
1.5 Conclusion ... 41
1.6 Liste des ouvrages cités ... 43
CHAPITRE 2 PRODUCTION, COMPOSITION AND OXIDATIVE STABILITY OF MILK ENRICHED IN POLYUNSATURATED FATTY ACIDS FROM DAIRY COWS FED ALFALFA PROTEIN CONCENTRATE OR SUPPLEMENTAL VITAMIN E ... 51
Résumé ... 53
Abstract ... 57
2.1 Introduction ... 59
2.2 Material and methods ... 61
2.2.1 Animals and dietary treatments ... 61
2.2.2 Experimental measurements and samplings ... 63
2.2.2.1 Ruminal content ... 64
2.2.2.2 Blood ... 64
2.2.2.3 Milk ... 64
2.2.3 Feed analyses ... 65
2.2.4 Rumen fluid analyses ... 65
2.2.5 Plasma antioxidants ... 66
2.2.6 Plasma color index ... 66
ix
2.2.7.1 Composition ... 67
2.2.7.2 Oxidative stability ... 67
2.2.7.2.1 Volatile compounds ... 68
2.2.7.2.2 Conjugated diene hydroperoxides, redox potential and dissolved oxygen ... 69
2.2.8 Color index of butter ... 69
2.2.9 Statistical analysis ... 70
2.3 Results and discussion ... 71
2.3.1 Animal performance and ruminal fermentation... 71
2.3.2 Milk fatty acid composition ... 74
2.3.3 Transfer of carotenoids ... 80
2.4 Conclusion ... 93
2.5 Acknowledgments ... 95
2.6 References ... 97
xi
Liste des tableaux
Chapitre 1
Tableau 1.1- Fonctions biochimiques des acides gras ω-3 et ω-6 ... 12 Tableau 1.2- Distribution des principaux acides gras de la matière grasse du lait de vache ... 15 Tableau 1.3- Composition en acides gras du lait partiellement écrémé et du breuvage laitier expérimental. ... 25 Tableau 1.4- Stabilité oxydative de breuvages laitiers faits à partir d’une poudre de lait écrémé (témoin) et de lait provenant de vaches nourries avec une ration contenant de la graine de lin ... 37
Chapitre 2
Table 2.1- Ingredients, chemical composition, and fatty acid profile of experimental diets ... 62 Table 2.2- Chemical composition of alfalfa protein concentrate ... 63 Table 2.3- Effect of experimental diets on body weight, intake of nutrients, and milk yield and composition ... 73
Table 2.4- Effect of experimental diets on ruminal pH, NH3-N, and volatile fatty acid
content ... 74 Table 2.5- Effect of experimental diets on milk fat composition ... 76 Table 2.6- Antioxidant composition of alfalfa protein concentrate ... 83 Table 2.7- Color index of butter from cows fed control (CTL), supplemental vitamin E (VitE), or alfalfa protein concentrate (APC) diets. ... 85 Table 2.8- Concentrations of volatile lipid oxidation products in fresh milk from cows fed control (CTL), supplemental vitamin E (VitE), or alfalfa protein concentrate (APC) diets ... 90
xiii
Liste des figures
Chapitre 1
Figure 1.1- Acides oléique (18:1 ω-9) et α-linolénique (18:3 ω-3) ... 6 Figure 1.2- Acides gras saturés et insaturés et leurs principales sources ... 6 Figure 1.3- Triacylglycérols où R’, R’’ et R’’’ représentent les résidus d’acides gras estérifiés au glycérol ... 7 Figure 1.4-Phopholipides ... 7 Figure 1.5- Profil des principaux acides gras retrouvés dans le plasma sanguin chez l'humain ... 8 Figure 1.6- Élongation et désaturation des acides gras polyinsaturés ω-3 et ω-6 ... 11 Figure 1.7- Structure de la membrane du globule de gras du lait de bovin ... 14 Figure 1.8- Variation des niveaux de lipides sanguins après consommation d’acides gras saturés (AGS), d’acides gras monoinsaturés (AGMI), d’acides gras polyinsaturés (AGPI) ou d’acides gras trans comme remplaçant isocalorique des glucides ... 17 Figure 1.9- Biohydrogénation ruminale des acides linoléique et α-linolénique ... 20 Figure 1.10- Synthèse et sécrétion des lipides du lait chez les ruminants ... 21 Figure 1.11- Voies de la biohydrogénation ruminale de l'acide linoléique sous des conditions usuelles et lors de l’apparition du syndrome de chute de gras du lait induite par l'alimentation. ... 24 Figure 1.12- Phases de déclanchement et de propagation de l’oxydation ... 27 Figure 1.13- Chimie des antioxydants ... 31 Figure 1.14- Principaux composés naturels (ou de synthèse) possédant des propriétés antioxydantes ... 32 Figure 1.15- Effet de l'exposition à la lumière sur les concentrations de propanal et d'hexanal dans le lait enrichi en lignanes suite à l’ajout d’huile de lin dans l’alimentation de la vache ... 36 Figure 1.16- Relation entre les proportions d'aliment expérimental riche en caroténoïdes et en vitamine E (75% d'ensilage d'herbe et 25% de concentré protéique de luzerne) dans la ration et les concentrations de β-carotènes totaux (tout-trans et 13-cis β-carotènes). ... 38
xiv
Chapitre 2
Figure 2.1- Milk fat content of cis-9, cis-12 18:2 and cis-9, cis-12, cis-15 18:3 in cows fed pre-trial, control (CTL), supplemental vitamin E (VitE), or alfalfa protein concentrate (APC) diets. ... 80 Figure 2.2- Plasma concentrations of carotenoids in cows fed control (CTL), supplemental vitamin E (VitE), or alfalfa protein concentrate (APC) diets ... 81 Figure 2.3- Relationship between plasma color index and plasma carotenoid concentration ... 84 Figure 2.4- Redox potential in milk from cows fed control (CTL), supplemental vitamin E (VitE), or alfalfa protein concentrate (APC) diets. ... 86 Figure 2.5- Effect of time on redox potential in homogenized milk from cows fed control (), supplemental vitamin E (), or alfalfa protein concentrate () diets. ... 86 Figure 2.6- Dissolved oxygen in milk from cows fed control (CTL), supplemental vitamin E (VitE), or alfalfa protein concentrate (APC) diets. ... 87 Figure 2.7- Effect of time on dissolved oxygen in homogenized milk from cows fed control (), supplemental vitamin E (), or alfalfa protein concentrate () diets. ... 88 Figure 2.8- Conjugated diene hydroperoxides in milk from cows fed control (CTL), supplemental vitamin E (VitE), or alfalfa protein concentrate (APC) diets. ... 89 Figure 2.9- Effect of time on conjugated diene hydroperoxides in milk from cows fed control (), supplemental vitamin E (), or alfalfa protein concentrate () diets. ... 89 Figure 2.10- Effect of time on concentrations of volatile lipid oxidation products in homogenized milk from cows fed control (CTL), supplemental vitamin E (VitE), or alfalfa protein concentrate (APC) diets. ... 92
xv
Liste des abréviations
ADF Acid Detergent Fiber
ADH Acide docosahexaénoïque
AEC Acide eicosapentaénoïque
AET Apport énergétique total
AGMI Acide gras monoinsaturé
AGPI Acide gras polyinsaturé
AGS Acide gras saturé
AGV Acide gras volatil
ALC Acide linoléique conjugué
APC Alfalfa Protein Concentrate
BW Body Weight
CI Color Index
CT Cholestérol total
CTL Control
DM Dry Matter
DIM Days in Milk
ECL Extrait concentré de luzerne
ED Entérodiol
EE Ether Extract
EL Entérolactone
FA Fatty Acid
FCM Fat Corrected Milk
FRO Forme réactive de l’oxygène
GC Gas Chromatography
HDL High Density Lipoprotein
HPLC High Performance Liquid Chromatography
IU International Unit
LC Liquid Chromatography
LDL Low Density Lipoprotein
MG Matière grasse
MS Matière sèche
MS Mass spectrometry
MUN Milk Urea Nitrogen
NDF Neutral Detergent Fiber
PB Protéine brute
PV Peroxide Value
SBM Soybean Meal
SCC Somatic Cell Count
SDG Sécoisolaricirésinol-diglucoside
SIM Selected Ion Monitoring
SPME Solid Phase Microextraction
TBARS Thiobarbituric Reactive Substance
TMR Total Mixed Ration
VFA Volatile Fatty Acid
VitE Vitamin E
xvii
Remerciements
L’idée de faire une maîtrise avait germée tranquillement tout au long de mon baccalauréat, mais une intervention d’Yvan dans un cours de Production laitière a été l’élément déclencheur; j’ai eu envie de faire partie de cette équipe. Après avoir fait mon stage professionnel au sein de cette équipe, j’avais la confirmation que je voulais poursuivre dans cette voie.
Cette maîtrise a été une expérience de vie incroyable qui m’a permis d’acquérir de nouvelles compétences entourée de professionnels chevronnés et de gens généreux que je tiens à remercier :
Yvan, merci de m'avoir permis de vivre cette expérience qui fût des plus enrichissantes! Merci de m'avoir permis d'acquérir toutes ces connaissances par le biais de tes enseignements, de tes conseils ou des congrès auxquels il m'a été possible de participer. Rachel, je t’admire! Je ne suis même pas certaine de trouver les mots pour te dire à quel point je suis reconnaissante. Merci pour tout! Et le mot «tout» n’est même pas encore assez! Merci de m’avoir permis de passer à travers cette étape de ma vie en ne délaissant pas mes occupations et Chivas, merci d’avoir compris l’importance que ça avait pour moi! Merci d’avoir tenté (et réussi) par tous les moyens, d’adapter les horaires et les contrats pour que tout fonctionne, je l’apprécie vraiment! Merci pour ton aide constante, les réponses à mes milliards de questions à des moments pas possible. Merci pour ta présence tout au long de ma phase animale. Merci pour tout ce que tu m’as patiemment enseigné (et/ou répété) sans jamais me faire sentir incompétente. Merci pour les discussions hors contexte, les «insides» incroyables et les fous rires. Merci d’avoir cru en moi tout simplement. Merci pour ton temps car, Dieu seul sait que tu m’en as accordé beaucoup alors que tu en avais déjà très peu! «The greatest gift you can give to someone is your time. Because when you give time, you are giving a portion of your life that you will never get back» -Rick Warren.
xviii
Marie-Ève T., ma «cousine par alliance», merci pour ton aide, autant pour l’organisation de mon projet, qu’à l’étable, qu’au laboratoire ou que dans ma vie en général! Merci d’avoir été là à toutes heures du jour (et même de jour par mal tard!). Merci d’avoir toujours pris du temps pour moi en toutes circonstances. Merci d’avoir été là pour «dédramatiser ma vie» et Dieu sait qu’il peut m’arriver des évènements rocambolesques et que je suis capable de dramatiser beaucoup de choses! Merci pour tes conseils, merci de m’avoir écouté crier, pleurer, chialer et rire. Sans toi je n’y serais pas arrivée! J’espère te recroiser, au moins à l’écurie… ou dans un cours de «salsa-flûte»!
Dany, merci pour tes conseils agronomiques, académiques, équestres et tes conseils de vie en général! Merci de m’avoir ouvert ta porte pour entendre n’importe quel «Tu sais pas quoi?». Merci pour les tapes dans le dos comme les coups de pied de motivation! Finalement, merci pour les opportunités que tu m’as offertes, merci de m’avoir permis de croire en mes moyens parce que tu croyais en moi.
Les filles; Laetitia, Noémie et Marie-Ève G., Merci pour nos dîners de motivation! Merci pour les discussions qui m’ont permises de voir que je n’étais pas seule dans ce bateau-là! Bonne continuation à vous, vous êtes les meilleures!
La gang: Liliana, René, Daniel Eric et Max, Merci pour les soupers, les soirées, les discussions et le support, bref merci d’avoir été là pour rendre tout ça beaucoup plus agréable!
Un merci plus particulier à ceux qui ont participé à mon projet directement :
Eric, thank you for the laughter and the good times we share. Thanks for the discussions, the beers, the parties, but also the help for the blood samples and for your time at the barn! I hope to see you in the future!
René, gracias por tu ayuda en la granja cuando yo tenía que ir a clase. ¡Gracias por las risas y las «clases» de español! ¡Espero verte a tí y a Liliana de nuevo! ¡Nos vemos pronto, mata-ratones!
xix Les étudiantes d’été (et parfois d’automne et d’hiver), Cloé, Catherine, Andréanne et Roxanne, merci de vous être autant investies dans mon projet et pour votre aide généreuse. Merci pour votre attitude positive peu importe l’heure à laquelle on devait travailler. Merci pour votre support et votre travail consciencieux; ce fût un plaisir de travailler avec vous. Merci pour les soirées entre amis, où vous avez su rendre tout ça un peu plus léger.
Nancy, Yolaine et Micheline, merci; sans vous le temps passé dans le laboratoire aurait été très pénible. Merci pour vos enseignements et votre patience!
Philippe R., merci pour ton dévouement et ton travail dans le laboratoire.
Je tiens à remercier le département des sciences animales de la Faculté des sciences de l’agriculture et de l’alimentation d’avoir permis la conduite de cette maîtrise. Des remerciements plus particuliers à Édith C., Danny P., Diane P. et Jean B., merci de m’avoir fait confiance et de m’avoir permis de travailler avec vous au fil des sessions. Ce fût des expériences très enrichissantes, tant au plan professionnel que personnel.
Je tiens aussi à remercier tout le personnel du Centre de recherche en sciences animales de Deschambault pour avoir permis de mener à terme cette expérience, un merci plus spécial à André, Philippe, Daniel et Gilbert pour leur précieuse aide.
Bien sûr, merci à tous ceux qui se sont occupés de Chivas : Daniel P., Marc, Marie-Luce, Francis, Nicolas et Karine. Merci de m'avoir permis d'étudier, de travailler, d'aller à la ferme, d'aller en congrès, de rédiger, etc. tout en étant en confiance que mon bébé était entre bonnes mains!
Finalement, merci à mon père d'avoir cru en moi! Merci à ma mère et mon beau-père Marc pour le support!
xxi
Avant-propos
Ce mémoire contient un chapitre rédigé sous forme d'article scientifique. Je suis l'auteure
principale de cet article, les coauteurs sont les chercheurs R. Gervais et P.Y. Chouinard ainsi que la professionnelle de recherche, Yolaine Lebeuf. Toutes ces personnes se sont impliquées dans les travaux. L’article portant le titre «Production, composition, and oxidative stability of milk enriched in polyunsaturated fatty acids from dairy cows fed alfalfa protein concentrate or supplemental vitamin E» sera soumis pour publication dans la revue «Journal of Dairy Science».
1
Introduction
Une meilleure connaissance des mécanismes physiologiques qui sous-tendent les effets de la régie et de l’alimentation sur la composition du lait chez la vache peut fournir à l’éleveur des outils pour l’ajustement de la composition du lait produit par son troupeau afin de répondre efficacement aux besoins changeants du marché. De plus en plus d’initiatives sont d’ailleurs mises de l’avant pour produire et mettre en marché des laits dont la composition a été modifiée naturellement en cours de production. Actuellement, plusieurs efforts de recherche visent à identifier des moyens efficaces d’enrichir le lait en acides gras ω-3, molécules reconnues pour leurs effets bénéfiques sur la santé du consommateur. Un frein majeur au développement d’un tel lait est, sans contredit, l’effet potentiellement négatif d’un enrichissement en acides gras polyinsaturés sur la stabilité oxydative du lait.
C’est dans ce contexte que s’inscrivent les objectifs des travaux de recherche rapportés dans ce mémoire. Plus précisément, le but de l’étude présentée était d’évaluer l’impact des caroténoïdes extraits de fourrages déshydratés ajutés à la ration sur la stabilité oxydative des matières grasses laitières. À terme, ce projet de recherche permettra non seulement d’identifier des moyens techniques applicables à la ferme pour mieux contrôler les qualités nutritionnelles et organoleptiques des laits enrichis en acides gras polyinsaturés, mais aussi celles des laits de grand mélange. En effet, les stratégies nutritionnelles développées dans ce projet permettront de réduire efficacement l’incidence des épisodes d’oxydation spontanée du lait. On estime qu’environ 10 % des vaches des troupeaux commerciaux sont susceptibles de développer un problème de lait oxydé. Par contre, pour que le problème devienne apparent dans le bassin refroidisseur, au moins 30 % des vaches d’un troupeau doivent être affectées (Nicholson et Charmley, 1991). Une pratique couramment adoptée pour diminuer le risque d’oxydation est l’ajout de vitamine E à la ration. La vitamine E est un antioxydant puissant mais, comme son transfert dans le lait est peu élevé, son efficacité à prévenir l’oxydation du lait est souvent faible (St-Laurent et al., 1990). Or, certaines plantes utilisées dans la ration de la vache contiennent naturellement des quantités variables de composés phytochimiques actifs reconnus pour leur potentiel à prévenir l’oxydation, ce qui pourrait en faire d’excellentes sources peu coûteuses d'antioxydants. Parmi ceux-ci, les
2
caroténoïdes de la luzerne peuvent être transférés dans les sécrétions lactées de la vache et ainsi contribuer au maintien de l’intégrité de la matière grasse laitière (Calderón et al., 2007). Les caroténoïdes sont aussi reconnus pour leurs effets bénéfiques sur la santé chez l’humain. Entre autres, on leur reconnait un rôle de prévention des problèmes de rhumatisme et des maladies cardiovasculaires (Matés et al., 1999). Enfin, le pouvoir antioxydant des caroténoïdes contribuerait à diminuer les risques de peroxydation des lipides sanguins et tissulaires de l’animal qui les consomme (Calderón et al., 2007).
Notre hypothèse est, par conséquent, que le pouvoir antioxydant des caroténoïdes de la luzerne est transféré de la ration aux sécrétions lactées chez la vache, ce qui réduit la susceptibilité des matières grasses du lait à l’oxydation. Les recherches ayant mené à la rédaction de ce mémoire de maîtrise ont porté d’une part sur le transfert des antioxydants dans le plasma et d’autre part, sur la stabilité oxydative de la matière grasse du lait enrichi en acides gras polyinsaturés. Ainsi, afin d’expliquer et de mettre en relation les concepts abordés au cours de cette étude, une description des acides gras composant la matière grasse laitière sera d’abord présentée. Par la suite, la synthèse de la matière grasse laitière et les facteurs permettant de moduler sa composition seront abordés. Aussi, les réactions d’oxydation des matières grasses seront expliquées pour enfin permettre d’explorer la valeur du pouvoir antioxydant de certains ingrédients retrouvés en alimentation animale. Le second chapitre de ce mémoire est consacré à l’étude de la production, de la composition et de la stabilité oxydative d’un lait enrichi en acides gras polyinsaturés chez des vaches ayant reçu un extrait concentré de luzerne ou un supplément de vitamine E.
CHAPITRE 1
5
1.1 Définition et structure des acides gras
Les lipides sont des substances retrouvées dans les organismes vivants et sont insolubles dans l’eau, mais solubles dans les solvants organiques. Un lipide contient au moins une longue chaîne hydrocarbonée et peut posséder plusieurs groupements fonctionnels. Les lipides sont divisés en plusieurs classes selon leur structure moléculaire. Parmi celles-ci, les plus étudiées sont les triacylglycérols, les acides gras libres, les phospholipides (glycoglycérolipides, glycérophospholipides et sphingolipides), les esters de cholestérols et les eicosanoïdes (Christie et Han, 2010).
Les acides gras sont les constituants de base d’une grande partie des lipides. Ils contiennent généralement un nombre pair d’atomes de carbone (entre 12 et 24) formant une chaîne linéaire. Elle peut également être ramifiée, c’est-à-dire que d’autres groupements
moléculaires (e.g. -OH, -CH3) sont accrochés à la chaîne carbonée (Christie et Han, 2010).
Les acides gras qui contiennent des doubles liens sont appelés acides gras insaturés, ceux qui contiennent un seul double lien sont appelés acides gras monoinsaturés (AGMI) et ceux qui contiennent deux insaturations et plus sont appelés acide gras polyinsaturés (AGPI). Les acides gras (saturés, monoinsaturés et polyinsaturés) sont identifiés par le nombre de carbone que contiennent les molécules et le nombre de double(s) liaison(s) (e.g. 18:0, 18:1, 18:2) présente(s) sur leur chaîne carbonée. Il est aussi possible de préciser la position du ou des double(s) lien(s) dans la chaîne de carbone. Cette précision prend différentes formes selon la nomenclature employée. La nomenclature ω précise la position de la première double liaison identifiée à partir de l’extrémité méthyle. La nomenclature ∆ prévoit quant à elle l’identification de toutes les positions des doubles liens à partir de l’extrémité carboxylique. L’identification des acides gras est complétée par la configuration cis ou
trans du ou des double(s) lien(s). Par conséquent, une chaîne de 18 carbones, avec deux
double liaisons, dont la première se retrouve sur le sixième atome de carbone à partir de l’extrémité méthyle est identifiée 18:2 ω-6. La figure 1.1 représente des exemples d’acides gras à 18 carbones, l’acide oléique, un acide gras monoinsaturé noté 18:1 ω-9, et l’acide α-linolénique, un acide gras polyinsaturé noté 18:3 ω-3. Les acides gras prédominants diffèrent selon différentes sources alimentaires (Figure 1.2).
6
Acide oléique
Acide α-linolénique
Figure 1.1- Acides oléique (18:1 ω-9) et α-linolénique (18:3 ω-3)
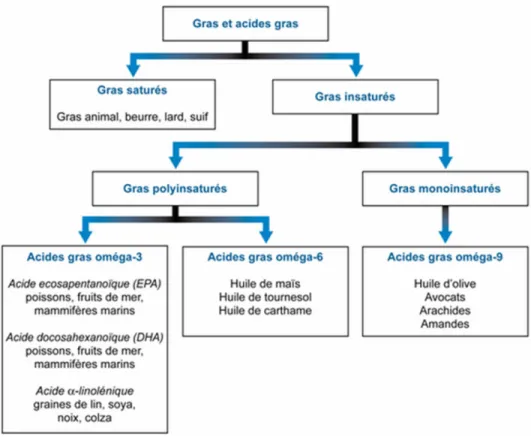
Figure 1.2- Acides gras saturés et insaturés et leurs principales sources (Adaptée de Bélanger, 2007)
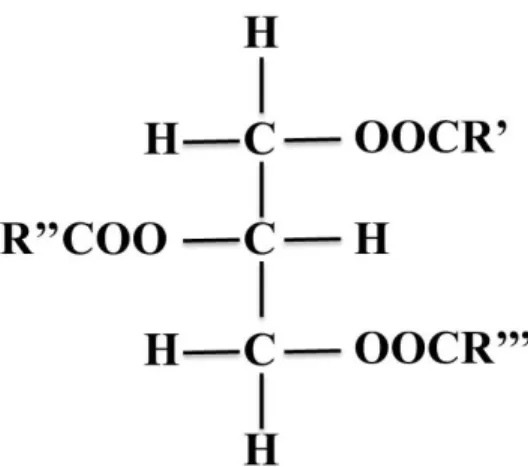
7 Effectivement, les acides gras retrouvés dans le plasma et les tissus animaux, de même que dans l’huile et les tissus végétaux sont majoritairement estérifiés à une molécule de glycérol. Ces esters de glycérol sont composés d’au moins une chaîne carbonée ayant une extrémité carboxylique (Figure 1.3; Bélanger, 2007). De plus, les phospholipides sont aussi des exemples de molécules avec des acides gras estérifiés au glycérol (Figure 1.4)
Figure 1.3- Triacylglycérols où R’, R’’ et R’’’ représentent les résidus d’acides gras estérifiés au glycérol
8
La figure 1.5 présente les concentrations des principaux acides gras retrouvés dans le plasma humain.
Figure 1.5- Profil des principaux acides gras retrouvés dans le plasma sanguin chez l'humain (% mol), basé sur 472 hommes et 510 femmes de neuf études (Adaptée de Hodson et al., 2008)
9
1.2 Rôles des acides gras chez l’humain
1.2.1 Acides gras saturés et insaturés
Les acides gras occupent de nombreuses fonctions nécessaires au maintien des activités physiologiques normales et d’une bonne santé de l’individu. Spector (1999) explique que les acides gras saturés sont impliqués dans la production et le stockage de l’énergie, le transport des lipides, la synthèse des phospholipides et des sphingolipides nécessaires à l’assemblage et à la structure de la membrane cellulaire et la modification de nombreuses protéines régulatrices. Les acides gras sont également impliqués dans plusieurs de ces processus et jouent un rôle clé dans le maintien de la fluidité optimale de la bicouche lipidique de la membrane.
Les AGPI ont des effets importants sur la structure et les propriétés physiques des domaines membranaires et ils sont impliqués dans la production d'eicosanoïdes, des composés qui sont retrouvés dans tous les organes et tissus, où elles exercent une fonction de régulation dans l’activité des cellules au cours de nombreux processus comme la contraction des muscles lisses, l’agrégation plaquettaire et la sécrétion gastrique, ainsi que dans la transduction du signal et l'activation des facteurs de transcription nucléaires (Spector, 1999).
1.2.2 Acides gras essentiels chez l’humain
Bien que les nombreux rôles physiologiques des acides saturés ou monoinsaturés soient clairement vitaux, le terme «essentiel» ne s'applique pas à ces acides gras. Ce nom est réservé aux AGPI qui sont nécessaires pour une bonne santé et qui ne peuvent pas être totalement synthétisés dans l’organisme (Simopoulos, 2002). Cela implique que ces acides gras jouent des rôles essentiels, mais qu’ils sont également des éléments nutritifs indispensables. Ces acides gras essentiels doivent, par conséquent, être présents dans l’alimentation. Deux familles d’AGPI ne peuvent être totalement synthétisées par les cellules des mammifères mais sont cependant présentes dans les tissus et les fluides corporels, il s’agit des AGPI ω-6 et ω-3.
10
Plus précisément, l’acide linoléique (18:2 ω-6) et l’acide α-linolénique (18:3 ω-3) sont dits «essentiels» (Calder, 2006; Bélanger, 2007). Ces derniers sont des substrats pour tous les autres acides gras de leur famille respective (ω-3 et ω-6). Simopoulos (2008) explique que les acides gras essentiels sont métabolisés en acides gras à longue chaîne de 20 à 22 atomes de carbones.
Ainsi, ces acides gras peuvent être modifiés par la création de liaisons doubles, grâce aux désaturases et par l’élongation de la chaîne, grâce aux élongases. Par ailleurs, l’acide linoléique peut être converti en acide γ-linolénique (18:3 ω-6) et en acide dihomo-γ-linolénique (20:3 ω-6), lequel est converti en acide arachidonique (20:4 ω-6). En utilisant les mêmes enzymes, l’acide α-linolénique peut être converti en acide stéaridonique (18:4 ω-3) puis en acide eicosatétraénoïque (20:4 ω-3) et en acide eicosapentaénoïque (AEP, 20:5 ω-3), qui à son tour peut être converti en acide docosahexaénoïque (ADH, 22:5 ω-3) par l’addition de deux carbones (Figure 1.6). Il y a donc compétition entre les familles d’acides gras ω-3 et ω-6 pour les enzymes impliqués dans leur métabolisme (Calder, 2006). Les humains et autres mammifères peuvent donc convertir ces acides gras, mais le processus est assez lent. Ainsi, lorsqu’un grand apport en acide linoléique est fourni à l’organisme, cas caractéristique de l’alimentation occidentale, celui-ci interfère avec la désaturation et l’élongation de l’acide α-linolénique (Simopoulos, 2008).
11 Figure 1.6- Élongation et désaturation des acides gras polyinsaturés ω-3 et ω-6
Le régime alimentaire occidental habituel contient environ 10 fois plus d’AGPI ω-6 que d'AGPI ω-3 (Blasbalg et al., 2011). De plus, le plasma et la plupart des autres tissus contiennent aussi de 10 à 20 fois plus d'acides gras ω-6. Les exceptions sont le cerveau et la rétine qui sont riches en AGPI ω-3 (Spector, 1999).
1.2.2.1 Acides gras ω-6
Le principal acide gras ω-6 est l’acide linoléique (18:2 cis-9, cis-12). Cet acide gras est abondamment présent dans l'alimentation moderne puisqu’on le retrouve dans les huiles de maïs, de tournesol, de soya, de carthame, de pépins de raisin, etc. (Ruby, 2008). Les fonctions biochimiques des acides gras ω-6 sont présentées dans le tableau 1.1. L’acide linoléique joue un rôle dans la synthèse des lipides qui forment les barrières de perméabilité épidermiques. L’acide arachidonique (20:4 ω-6), quant à lui, joue un rôle important dans la structure des membranes neuronales et des yeux (Ruby, 2008), et est une composante des phospholipides (Spector, 1999). Il peut être obtenu à partir de l’acide linoléique (18:2 ω-6), comme montré auparavant à la figure 1.6.
Acide linoléique (18:2 ω-6) Acide α-linoléique (18:3 ω-3)
Acide stéaridonique (18:4 ω-3) Acide γ-linolénique (18:3 ω-6) Acide docosahexaénoïque (22:6 ω-3) Acide eicosapentaénoïque (20:5 ω-3) 20:4 ω-3 Acide dihomo-γ-linolénique (20:3 ω-6) Acide arachidonique (20:4 ω-6) Δ6-désaturase Δ5-désaturase Δ5-désaturase Δ6-désaturase Élongase Élongase Élongase Élongase Δ6-désaturase β-oxydation
12
Tableau 1.1- Fonctions biochimiques des acides gras ω-3 et ω-6 (Adapté de Spector, 1999)
Famille Nom de l’acide gras Fonction
ω-6 Arachidonique
(20:4 ω-6)
• Synthèse des eicosanoïdes
• Composante des phospholipides
• Linoléique
(18:2 ω-6)
• Synthèse des lipides qui forment les
barrières de perméabilité épidermiques
ω-3 Eicosapentaénoïque
(20:5 ω-3)
• Synthèse des eicosanoïdes
Docosahexaénoïque (22:6 ω-3)
• Structure des domaines des lipides
membranaires
• Modulation des protéines membranaires
• Métabolisme de la
phosphatidyléthanolamine, de
l’éthanolamine plasmalogène et de la phosphatidylsérine
• Formations de radicaux libres
• Régulation de l’expression des gènes
1.2.2.2 Acides gras ω-3
Les acides gras ω-3 se retrouvent entre autres dans l’huile et la graine de lin et de chanvre ou encore dans les huiles de marines. Les principaux acides gras ω-3 sont l’acide α-linolénique, l’AEP et l’ADH (Ruby, 2008).
Les fonctions biochimiques des acides gras ω-3 sont listées au tableau 1.2. L'AEP peut être transformé en eicosanoïdes de série 3, des composés qui contribuent à la protection des artères et du cœur et qui ont des effets anti-inflammatoires et anti-allergiques reconnus. L’ADH, quant à lui, joue un rôle fondamental dans le développement du cerveau et de la rétine, ainsi que dans la formation et la motilité des spermatozoïdes (Ruby, 2008).
13
1.2.2.3 Ratio ω-3/ω-6
Les sociétés industrialisées ont une consommation d’énergie élevée et une dépense énergétique qui tend à diminuer. D’ailleurs, Simopoulos (2008) précise que l’énergie retrouvée dans l’alimentation provenant des gras saturés, des acides gras ω-6 et des acides gras trans a subi une augmentation alors que la proportion de l’énergie provenant des acides gras ω-3 a diminué par rapport aux sociétés de chasseurs/cueilleurs ou agricole. On estime en général que le rapport ω-6:ω-3 dans l'alimentation occidentale est de 10:1 à 30:1, tandis qu'il devrait idéalement se situer entre 1:1 et 4:1 (Spector 1999; Simopoulos, 1999; 2002; 2008). En outre, cet excès d’acides gras ω-6 nuit à l'utilisation optimale des acides gras ω-3 par l'organisme. En effet, comme mentionné précédemment, le métabolisme des acides gras ω-3 et celui des acides gras ω-6 partagent les mêmes désaturases et élongases. Bien que le substrat privilégié de certaines enzymes, notamment
la ∆6-désaturase, soit l’acide α-linolénique, lorsqu’un grand apport en acide linoléique est
fourni à l’organisme, celui-ci interfère avec la désaturation et l’élongation de l’acide α-linolénique (Simopoulos, 2008). Ainsi un excès d'acides gras ω-6 empêche l'organisme d'utiliser adéquatement les sources d'acides gras ω-3. Ce déséquilibre induit, entre autres, un état physiologique propice aux maladies cardiovasculaires ainsi qu'aux troubles allergiques et inflammatoires (Simopoulos, 1999).
Simopoulos (2002) précise enfin que les cellules des mammifères ne peuvent pas convertir les acides gras ω-6 en ω-3 car elles ne possèdent pas d’ω-3 désaturase. Ces deux familles d’acides gras essentiels ne sont donc pas interchangeables et ont un métabolisme et des fonctions physiologiques distincts.
1.3 Le lait comme source d’acides gras
1.3.1 Composition de la matière grasse du lait
Le lait est considéré comme le véhicule le plus efficace pour l’absorption des composés lipidiques parce que ses matières grasses sont hautement dispersées dans des micelles (Baró et al., 2003). Les lipides (3 à 5 %) se retrouvent dans le lait sous forme de globules en
14
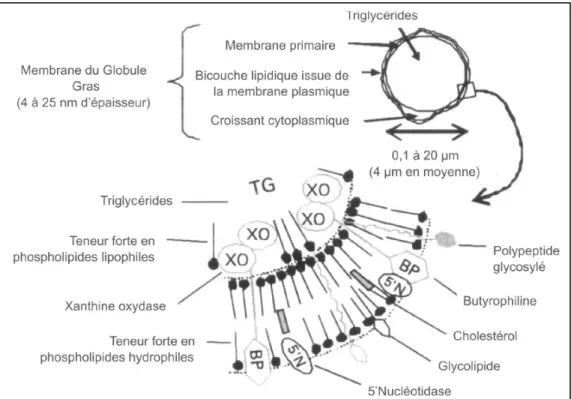
émulsion dans la phase aqueuse (87 %). Les globules contiennent des lipides non-polaires tels que des triacylglycérols ou des esters de cholestérol. Comme le montre la figure 1.7, ils sont recouverts d’une bicouche de phospholipides incluant aussi des protéines, du cholestérol et des enzymes (Jensen, 2002). La proportion importante d’acides gras saturés est une caractéristique de la matière grasse laitière (Livingstone et al., 2012).
Figure 1.7- Structure de la membrane du globule de gras du lait de bovin (Adaptée de Couvreur et Hurtaud, 2007)
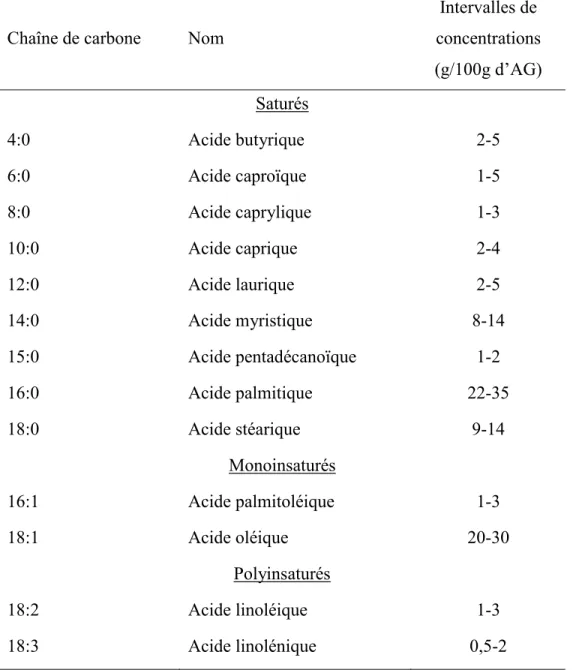
Les acides gras saturés proviennent de deux sources pour les humains et les animaux; ils sont soit synthétisés par l’organisme (foie, cerveau, tissu adipeux, glande mammaire), soit apportés par l’alimentation. Les connaissances scientifiques récentes indiquent que les acides gras saturés ont des fonctions très importantes (Micha et Mozaffarian, 2010). Dans les cellules animale et humaine, ils assurent tout d’abord une part importante de l’apport énergétique. Les acides gras saturés sont aussi des constituants des triacylglycérols de réserve, des glycérophospholipides et des sphingolipides (structure des membranes, myéline). Dans la matière grasse laitière, on observe que ces acides gras saturés sont
15 constitués de l’ensemble des longueurs de chaîne (Tableau 1.2; Jensen, 2002). Depuis l’acide butyrique (4:0), pour son rôle protecteur dans le cancer du côlon, jusqu’aux acides gras plus longs comme l’acide myristique (14:0), pour l’acylation spécifique des protéines, ces acides gras saturés sont actifs et très utiles à la vie cellulaire.
Tableau 1.2- Distribution des principaux acides gras de la matière grasse du lait de vache (Adapté de Jensen, 2002)
Chaîne de carbone Nom
Intervalles de concentrations (g/100g d’AG) Saturés 4:0 Acide butyrique 2-5 6:0 Acide caproïque 1-5 8:0 Acide caprylique 1-3 10:0 Acide caprique 2-4 12:0 Acide laurique 2-5 14:0 Acide myristique 8-14 15:0 Acide pentadécanoïque 1-2 16:0 Acide palmitique 22-35 18:0 Acide stéarique 9-14 Monoinsaturés 16:1 Acide palmitoléique 1-3 18:1 Acide oléique 20-30 Polyinsaturés 18:2 Acide linoléique 1-3 18:3 Acide linolénique 0,5-2
16
Auparavant, les acides gras saturés étaient pointés du doigt parce qu’ils étaient considérés comme les responsables de l’augmentation de la concentration du cholestérol sanguin. Kromhout et al. (1995) considèrent que chez l’homme, la consommation excessive d’acides gras saturés alimentaires induit une augmentation du taux plasmatique de cholestérol et plus particulièrement du niveau de cholestérol LDL (lipoprotéines de faible densité- low
density lipoproteins; C-LDL). Le C-LDL en trop grande quantité peut être délétère pour la
santé en augmentant, entre autres, le risque d’apparition de lésions d’athérosclérose. Par contre, tous les acides gras saturés alimentaires n’ont pas le même métabolisme et n’ont donc pas les mêmes effets. De plus en plus d’évidences démontrent que seulement certains types d’acides gras saturés augmentent le cholestérol sanguin total (CT) et le C-LDL (Williams, 2000).
La figure 1.8 montre que comparativement aux glucides, la consommation d’AGS augmente le C-LDL et le C-HDL, mais n’a pas d’effet significatif sur le ratio CT:C-HDL. En revanche, la consommation d’acides gras monoinsaturés et d’acides gras polyinsaturés a conduit à une diminution du ratio CT:C-HDL et du C-LDL.
À ce sujet, une étude de Micha et Mozaffarian (2010) révèle que les modifications des niveaux de lipides et d’apolipoprotéines prédisent des effets minimaux sur les risques de maladies coronariennes quand les glucides sont remplacés par des AGS, des effets bénéfiques quand les AGPI et les AGMI remplacent les AGS et des effets dommageables lorsque les acides gras trans remplacent les AGS. De plus, Micha et Mozaffarian (2010) rapportent que plusieurs études évaluant l’impact de la consommation d’AGS sur la résistance à l’insuline, le diabète et les maladies cardiovasculaires n’ont pas démontré d’effets précis et soulignent aussi la nécessité de recherches plus approfondies.
17 Figure 1.8- Variation des niveaux de lipides sanguins après consommation d’acides gras saturés (AGS), d’acides gras monoinsaturés (AGMI), d’acides gras polyinsaturés (AGPI) ou d’acides gras trans comme remplaçant isocalorique des glucides. * = P < 0.05 (Adaptée de Micha et Mozaffarian, 2010)
18
La matière grasse laitière contient aussi une importante diversité d’acides gras insaturés issus de l’alimentation, directement ou suite à une biohydrogénation partielle dans le rumen. Parmi ceux-ci, certains font l’objet de recherche en raison des associations potentielles entre leur teneur dans le lait et des effets bénéfiques ou délétères sur la santé du consommateur (Lock et Bauman, 2004; Motard-Bélanger et al., 2008). Entre autres, certaines études ont démontré qu’il était possible d’augmenter la teneur en acide linoléique conjugué (ALC) 18:2 cis-9, trans-11, acide gras reconnu pour ses propriétés anti-cancérigènes, de la matière grasse laitière en ajoutant une source d’AGPI à la ration des vaches laitières (Bauman et al., 2000). Par ailleurs, au cours des dernières années, des efforts de recherche ont été consentis afin d’augmenter les teneurs en acides gras ω-3 de la matière grasse laitière (Ferlay, 2013).
1.3.2 Lipogenèse mammaire
Comme mentionné précédemment, il existe une grande variété d’acides gras dans le lait, dont les principaux sont présentés au tableau 1.2 (Jensen, 2002). Cette diversité vient du fait que les acides gras du lait résultent de plusieurs processus physiologiques. Certains sont synthétisés de novo par la glande mammaire alors que d’autres sont prélevés de la circulation sanguine et proviennent de l’alimentation de la vache, soit directement, ou soit modifiés par la biohydrogénation, et peuvent également provenir des réserves corporelles dans le rumen.
1.3.2.1 Synthèse de novo
Harfoot et Hazlewood (1997) rapportent que 40 % des acides gras sécrétés dans le lait sont synthétisés de novo par la glande mammaire à partir de l’acétate et du β-hydroxybutyrate. Cette proportion peut toutefois varier selon le stade de lactation ou l’alimentation de l’animal. Chilliard et al. (2001) expliquent que la principale voie métabolique implique deux enzymes clefs: l’acétyl-CoA carboxylase et l’acide gras synthase. L’acide gras synthase condense entre elles les unités à deux carbones jusqu’à l’obtention de chaînes de 4 à 16 atomes de carbone, qui sont ensuite libérées du complexe enzymatique. Chilliard et al. (2001) mentionnent que la glande mammaire ne peut pas convertir le 16:0 en 18:0 par
19 élongation de la chaîne carbonée. En outre, les cellules mammaires sécrétrices montrent
une forte activité de la ∆9-désaturase qui convertit l’acide stéarique en acide oléique
(18:1 cis-9). Environ 40 % de l’acide stéarique prélevé par la glande mammaire est désaturé, contribuant ainsi à plus de 50 % de la quantité d’acide oléique sécrétée dans le lait.
1.3.2.2 Acides gras de l’alimentation
L’alimentation des ruminants contient généralement entre 2 et 5 % de lipides dont environ la moitié sont des acides gras (Doreau et Ferlay, 1994). Lock et Bauman (2004) précisent que les principaux acides gras polyinsaturés présents dans la ration des ruminants sont l’acide linoléique et l’acide α-linolénique, le premier étant présent principalement dans les cultures fourragères, le second étant une composante majeure des oléagineuses et des concentrés.
La matière grasse du lait est composée d’environ 98 % de triacylglycérols (dans lesquels les acides gras représentent environ 95 %), de moins d’un pourcent de phospholipides et de petites quantités de cholestérol, de 1,2-diacylglycérols, de monoacylglycérols et d’acides gras libres sur une base pondérale (Jensen, 2002).
Certains acides gras peuvent être transférés directement de l’alimentation à la glande mammaire. Cependant, une grande proportion des acides gras de la ration subira d’importantes modifications avant d’être absorbée et transportée via la circulation sanguine. En effet, chez les monogastriques, la digestion et l’absorption des lipides de la ration se produit dans le petit intestin et seulement quelques modifications peuvent se produire au cours de la digestion. Chez les ruminants, comme l’explique Harfoot et Hazlewood (1997), la situation est très différente en raison de l’activité des micro-organismes dans le réticulo-rumen. Une portion des lipides alimentaires sont hydrogénés dans le rumen avant d’être absorbés par l’intestin. Ainsi les acides gras absorbés sont plus saturés que les acides gras de la ration (Doreau et Chilliard, 1997). L’activité microbienne du rumen est très forte, ce qui crée une lipolyse très rapide des glycolipides, phospholipides et triacylglycérols du régime par les lipases microbiennes. Cette lipolyse est presque complète et les produits
20
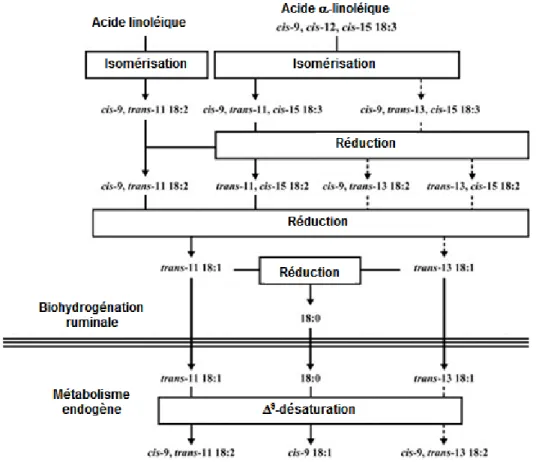
finaux de celles-ci sont majoritairement constitués d’acides gras libres (Chilliard et al., 2001). Cependant, la lilpolyse des glycérolipides de l’alimentation produit aussi du glycérol et du galactose qui seront métabolisés en acides gras volatils (AGV), principalement du propionate et du butyrate (Doreau et Ferlay, 1994). Une fois libérés, la majorité des acides gras insaturés sont sujets à la biohydrogénation par les bactéries du rumen (Harfoot et Hazlewood, 1997). Chilliard et al. (2001) ainsi que Destaillats et al. (2005) expliquent que l’acide linoléique est en grande partie isomérisé en acide ruménique (18:2 cis-9, trans-11). Ce dernier est ensuite hydrogéné en acide trans-vaccénique (18:1 trans-11), qui lui est absorbé par la vache. Suite à son absorption, l’acide trans-vaccénique peut subir une
Δ9-désaturation, ce qui conduit à la formation de l’acide ruménique comme montré dans la
figure 1.9. L’acide α-linolénique, quant à lui, est dirigé vers plusieurs voies de biohydrogénation, générant une grande variété d’intermédiaires. La voie du trans-11 reste toutefois dominante.
Figure 1.9- Biohydrogénation ruminale des acides linoléique et α-linolénique (Adaptée de Destaillats et al., 2005)
21 Harfoot et Hazlewood (1997) précisent qu’à la suite de ces transformations microbiennes, les acides gras contenus dans les lipides du rumen et dans le contenu digestif post-ruminal sont différents de ceux présents dans l’alimentation en étant riches en acide stéarique (18:0) au détriment des acides linoléique (18:2) et α-linolénique (18:3).
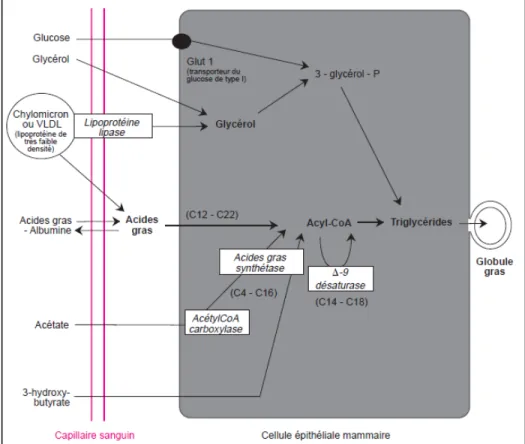
Les acides gras provenant du plasma sont transportés sous forme libre (non estérifiés) ou de triacylglycérols dans des lipoprotéines (chylomicrons ou lipoprotéines de très faible densité- very low density lipoprotein; VLDL). Le prélèvement des triacylglycérols par la glande mammaire est réalisé par l’action de la lipoprotéine lipase (Chilliard et al., 2001). Finalement, la figure 1.10 montre que tous les types d’acides gras, qu’ils aient été synthétisés de novo ou qu’ils proviennent de l’alimentation de la synthèse microbienne ou des réserves corporelles de la vache, ceux-ci seront estérifiés à l’intérieur de la cellule épithéliale pour être sécrétés sous forme de triacylglycérols (Chilliard et al., 2001).
Figure 1.10- Synthèse et sécrétion des lipides du lait chez les ruminants (Adaptée de Chilliard et al., 2001)
22
1.3.3 Facteurs permettant de moduler le profil en acides gras du lait
En raison de la prise de conscience de la population sur le lien entre l’alimentation et la santé, plusieurs efforts de recherche ont été consacrés à identifier des moyens efficaces permettant de moduler le profil en acides gras du lait pour le rendre compatible avec les perceptions des consommateurs et les recommandations visant à améliorer la santé (Lock et Bauman, 2004).
1.3.3.1 Teneur en matière grasse du lait
Chilliard et al. (2001) expliquent qu’un moyen naturel et économique de moduler rapidement la production et la composition en acides gras du lait est de modifier l’alimentation des vaches. L’un des principaux moyens de modulation du profil en acides gras des sécrétions lactées est l’apport de suppléments lipidiques dans la ration.
Doreau et Chilliard (1997) rapportent qu’une supplémentation en gras dans l’alimentation des vaches fait diminuer le taux de protéines et a des effets variables sur le gras du lait, dépendamment de la source des lipides alimentaires. Effectivement He et Armentano (2011) ont remarqué une baisse significative de la concentration et de la production de matières grasses du lait suite à une alimentation riche en acide linoléique (18:2 cis-9,
cis-12). De plus, Chilliard et al. (2001) confirment que cette pratique a des conséquences
bien connues sur la production et les teneurs en matières grasses et en protéines du lait: tendance à l’accroissement de production ainsi qu’une diminution faible mais quasi systématique du taux protéique. Lorsque les lipides sont encapsulés, le contenu en acide linoléique du lait tend à augmenter. Cependant, les qualités organoleptiques du lait peuvent être altérées (Doreau et Chilliard, 1997).
Des études récentes ont montré que les changements de rendements en matières grasses du lait suivant l’ajout d’huiles végétales non-protégées aux rations contenant peu de gras concordent avec l’inhibition de la synthèse d’acides gras à courte et moyenne chaînes qui elle est compensée par une augmentation de l’absorption d’acides gras à longue chaîne provenant du sang (He et Armentano, 2011).
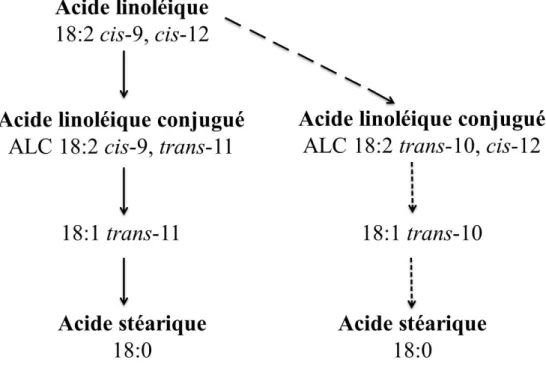
23 Bauman et Griinari (2001) proposent que, sous certaines conditions, la voie de biohydrogénation dans le rumen serait altérée ayant pour conséquence l’apparition de plus grandes concentrations de certains acides gras intermédiaires qui inhibent la synthèse de gras du lait. En effet, comme Bauman et al. (2006) le décrivent, la matière grasse est la composante la plus variable du lait. La nutrition est le facteur prédominant affectant la matière grasse du lait. Un exemple important et bien documenté de l’effet nutritionnel est le syndrome du lait à faible teneur en matière grasse. Bauman et al. (2006) précisent que l’apparition de ce syndrome est conditionnelle à la présence de deux caractéristiques précises dans la ration de l’animal. Premièrement, la ration doit altérer l’environnement ruminal, causant ainsi des changements dans l’équilibre microbien. Deuxièmement, la ration doit contenir des acides gras insaturés comme substrat pour la biohydrogénation. Ainsi, la diminution du gras du lait causée par la ration implique des produits des bactéries du rumen qui sont formés suite à une modification au niveau des sentiers de biohydrogénation. Tel que mentionné précédemment, les acides gras trans sont formés comme intermédiaires dans la biohydrogénation ruminale et l’acide trans-vaccénique (18:1
trans-11) est l’isomère prédominant dans des conditions dites normales, comme l’illustre la
figure 1.11. Lorsque les conditions ruminales sont altérées, les voies de biohydrogénation se déplacent et les isomères de la voie du trans-10 sont synthétisés en plus grande concentration. Or, Baumgard et al. (2001) ont montré que l’intermédiaire 18:2 trans-10,
24
Figure 1.11- Voies de la biohydrogénation ruminale de l'acide linoléique sous des conditions usuelles (côté gauche) et lors de l’apparition du syndrome de chute de gras du lait induite par l'alimentation (côté droit; Adaptée de Bauman et Griinari, 2003).
1.3.3.2 Modification du profil en acides gras du lait
À ce jour, deux types de laits enrichis en acides gras ω-3 sont disponibles sur le marché. Le premier est obtenu en usine par l’ajout d’ingrédients riches en acides gras ω-3 dans le lait, tandis que le deuxième est obtenu par voie de l’alimentation de la vache. La combinaison d’huile de lin et de matières grasses du lait dans les proportions de 25:75 permet d’obtenir un mélange contenant environ 12 % d’acides gras ω-3. L’émulsion de ce mélange de gras au taux de 1 % dans le lait écrémé donne un breuvage apportant 300 mg d’acides gras ω-3 dans une proportion de 250 ml; ce qui correspond selon Santé Canada au seuil minimal pour qu’un produit puisse porter la mention «source d’acides gras ω-3» (Chouinard, 2008). Un autre mélange, créé à des fins expérimentales, qui lui contiennait des AGPI ω-3, de l’huile d'olive, de vitamines B6 et E, et de l'acide folique, a été produit et inclus dans du lait écrémé afin de créer un breuvage laitier appétant comme source concentrée de nutriments spécifiques (acides gras et vitamines; Carrero et al., 2004). Le produit obtenu contenait un total de matières grasses comparable à celui du lait partiellement écrémé (1,9 g/100mL) mais avec des profils en acides gras et en vitamines modifiés (tableau 1.3).
25 Tableau 1.3- Composition en acides gras du lait partiellement écrémé et du breuvage laitier expérimental. (Adapté de Carrero et al., 2004)
Lait partiellement écrémé Breuvage laitier expérimental Énergie, kcal/100mL 46,5 52,0 Protéines, g/100mL 3,1 3,5 Glucides, g/100mL 4,7 5,2 MG, g/100mL 1,9 1,9 18:1, % 21,5 54,4 18:3 ω-3, % ND 0,6 20:5 ω-3, % ND 1,4 22:6 ω-3, % ND 2,1 AGS, % 70,5 23,7 AGMI, % 27,2 56,8 AGPI, % 2,3 19,5 Calcium, mg/100mL 120 132 Vitamine A, µg/100mL 120 120 Vitamine D, µg/100mL 0,75 0,75 Vitamine E, µg/100mL ND 1,50 Vitamine B6, µg/100mL ND 0,30 Vitamine B12, µg/100mL 0,38 0,38 Acide folique, µg/100mL ND 30
MG, matières grasses; AGS, acides gras saturés; AGMI, acides gras monoinsaturés; AGPI, acides gras polyinsaturés; ND, non détecté.
Dans un autre ordre d’idées, Chilliard et al. (2001) expliquent que les acides gras polyinsaturés ne sont pas synthétisés par les tissus des ruminants, de sorte que leur concentration dans le lait dépend étroitement des quantités absorbées dans l'intestin et donc des quantités quittant le rumen. Cette quantité peut être accrue par l’apport alimentaire
26
d’AGPI et par les facteurs réduisant la biohydrogénation ruminale, incluant la séquestration des acides gras dans les cellules végétales, ou l'utilisation de techniques d'encapsulation. Le lait enrichi obtenu par voie de l’alimentation de la vache peut présenter des teneurs en acides gras ω-3 de deux à trois fois plus élevées lorsque la ration de la vache est complémentée en graines de lin sous différentes formes (Gonthier et al., 2005; Mustafa et al., 2003). Il est également intéressant de constater que l’ajout de graines de lin dans la ration augmente la teneur en acides linoléiques conjugués dans la matière grasse du lait (Gonthier et al., 2005). Le lait obtenu via des procédés de production présente à cet égard un avantage par rapport aux breuvages élaborés en usine.
Ainsi, peu importe la façon dont il est fabriqué, c’est-à-dire soit en usine ou via l’alimentation de la vache, le lait enrichi représente une bonne alternative puisqu’il permet d’augmenter la prise journalière d’AGPI ω-3 et de diminuer l’apport d’acides gras saturés d’une quantité similaire (Benito et al., 2006).
1.4 Oxydation des lipides
Les acides gras polyinsaturés sont sensibles à l’oxydation et cette sensibilité augmente avec le nombre de doubles liens présents sur la chaîne carbonée. L'oxydation des lipides est un phénomène par lequel l'oxygène atmosphérique réagit spontanément avec les acides gras insaturés des lipides (Para Radanielina, 2007).
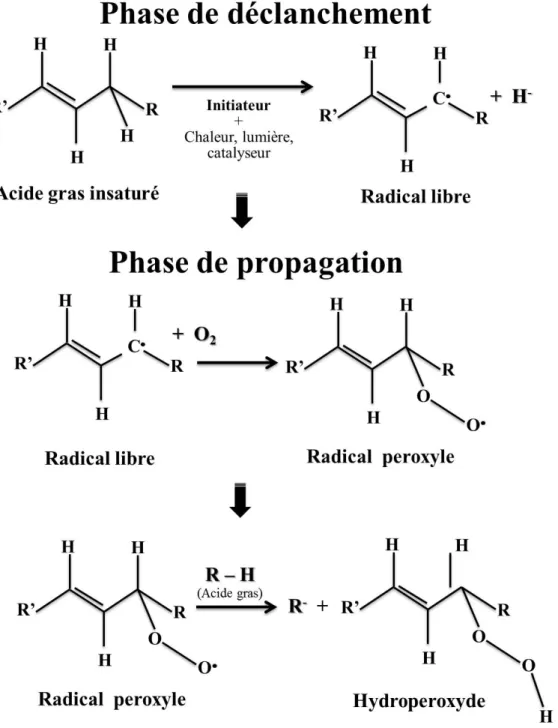
En présence d’un initiateur, les acides gras insaturés perdent un atome d’hydrogène à proximité de la double liaison pour former des radicaux libres (1). Marc et al. (2004) expliquent que lors de la phase de déclenchement (Figure 1.12) où se forme un premier radical libre, l’arrachement du proton est facilité tant par la chaleur (agitation moléculaire), que la lumière, ou un catalyseur (métaux tels que Cu, Fe, Co, Mn et Ni).
(1) RH → R• + H•
(2) R• + O2 → ROO•
27 Dans une deuxième étape, la phase de propagation (Figure 1.12), les radicaux libres formés fixent l'oxygène et forment des radicaux peroxyles instables (2) qui réagissent avec d'autres molécules d'acides gras et conduisent à de nouveaux radicaux libres et des hydroperoxydes (3) (Frankel, 1980; Marc et al., 2004).
28
Enfin, lors de la phase de terminaison, les hydroperoxydes se scindent alors en composés plus courts et les différents radicaux formés se recombinent (Marc et al., 2004).
Miller et Brezezinska-Slebodzinska (1993) relatent que les formes réactives de l’oxygène (FRO) sont des produits incontournables des processus métaboliques normaux et ne sont pas toujours nuisibles. Inévitablement, les FRO sont formées dans chaque cellule vivante (Bartosz et Kolakowska, 2011b). La production des FRO n’est pas seulement un mal inévitable du métabolisme aérobie, elle joue un rôle important dans la défense contre les pathogènes ainsi que dans la signalisation intra et intercellulaire (Bartosz, 2009). Effectivement, Aurousseau (2002) montre que les FRO se forment de façon inévitable en parallèle au métabolisme énergétique et par une multitude d’autres voies. Les FRO favorisent habituellement le bon fonctionnement de l’organisme et la santé des mammifères, mais leur excès peut être néfaste. Alors que des concentrations élevées de FRO causent la mort cellulaire, de faibles concentrations de peroxyde d'hydrogène et de radical superoxyde stimulent la prolifération et améliorent la survie d’une grande variété de cellules. Cependant, un déséquilibre, comme un excès de production de FRO ou une défense insuffisante, conduit à une situation appelée stress oxydatif où les FRO infligent des dégâts plus ou moins importants sur les systèmes biologiques.
Selon Miller et Brezezinska-Slebodzinska (1993), un déséquilibre entre la production de FRO et leur élimination peut initier des réactions oxydatives en chaîne et la peroxydation des lipides. Lorsque les FRO ne sont pas efficacement éliminées, le stress oxydatif peut nuire à la santé de la vache elle-même, à la fois de façon directe et indirecte. Les effets directs sont des dommages faits à des lipides importants ou des macromolécules. Les effets indirects représentent quant à eux des changements produits par les FRO dans les membranes cellulaires qui peuvent ensuite modifier les voies métaboliques.
Les radicaux libres sont des composés caractérisés par une structure électronique déséquilibrée qui leur confère une grande réactivité sur les constituants organiques et sur les structures cellulaires. Les molécules oxydées enlèvent des électrons aux autres molécules, il en résulte ainsi une réaction en chaîne. Cette réaction, si elle n’est pas
29 contrôlée, peut affecter la perméabilité des membranes, la fonction des enzymes et même le tonus musculaire (Miller et Brezezinska-Slebodzinska, 1993). Bartosz et Kolakowska (2011b) expliquent que les effets potentiellement dommageables des réactions non contrôlées avec les constituants cellulaires peuvent être empêchés par des enzymes antioxydantes ou des antioxydants de faible masse moléculaire.
La lipoperoxydation n’est pas dommageable seulement pour la santé de l’animal lui-même, elle peut aussi diminuer la valeur nutritionnelle des produits provenant de cet animal. Dans les aliments, les produits de l’oxydation des lipides sont responsables du développement de la rancidité et de saveurs indésirables. De plus, ces produits seraient possiblement impliqués dans l’incidence de problèmes de santé comme, entre autres, le cancer et les accidents vasculaires cérébraux. Bartosz et Kolakowska (2011b) expliquent que dans plusieurs cas, une augmentation de FRO ou une défense antioxydante inadéquate semblent jouer un rôle significatif dans le développement de ces maladies.
1.4.1 L’oxydation du lait
Le lait est un produit périssable et deux problèmes majeurs peuvent occasionner une dégradation de sa qualité: la contamination bactériologique et/ou l'oxydation. Plusieurs précautions peuvent être prises à partir de la traite pour maintenir la qualité du lait en utilisant de bonnes pratiques à la ferme et à l’usine. Par contre, malgré ces précautions, il arrive que le lait s'oxyde de manière spontanée sans raison apparente, ce qui modifie sa flaveur et diminue son acceptabilité auprès du consommateur. Parmi les produits de dégradation, les composés aldéhydiques volatils sont responsables du goût rance. Pour cette raison, la réaction d’oxydation est souvent associée à la notion de rancissement chimique aldéhydique. Il est toutefois important de distinguer ce processus chimique du rancissement butyrique ou du rancissement cétonique, qui sont des réactions enzymatiques d’hydrolyse (Judde, 2004). Ce phénomène d’oxydation spontanée pourrait être d'ordre nutritionnel ou de régie (Mounchili et al., 2004). L’ajout de gras polyinsaturés (comme des huiles de lin, soya, tournesol, etc.) dans la ration de la vache permet de modifier le profil en acides gras du lait, notamment en augmentant la teneur en acides gras ω-3 ou en acides linoléiques
30
conjugués (Liu et al., 2010). Par contre, Doreau et Chilliard (1992) expliquent que l’ajout de lipides dans la ration a souvent été considéré comme préjudiciable aux qualités organoleptiques des produits laitiers. Par exemple, l’accroissement de la teneur en acide linoléique du lait entraîne, entre autres, une tendance à l’oxydation et des altérations de goûts dûes au rancissement. Aussi, lorsque des rations riches en acides gras ω-3 (e.g. acide α-linolénique) sont offertes aux vaches laitières, cela augmente la teneur en gras insaturés des produits provenant de ces ruminants. Une pratique couramment adoptée dans l’industrie laitière, pour diminuer le risque d'oxydation, est l'ajout de vitamine E à la ration (St-Laurent et al., 1990).
Or, il a été démontré que les plantes contiennent naturellement des caroténoïdes ou des polyphénols qui sont des composés phytochimiques actifs tels que les lignanes. Certains de ces composés possèdent une activité antioxydante plus puissante que celle de la vitamine E (Halvorsen et al., 2002). Comme certains aliments utilisés dans la ration de la vache contiennent des quantités variables de ces composés, cela pourrait faire d'excellentes sources peu coûteuses d'antioxydants. De ce fait, il est possible d’émettre l'hypothèse que des composés phénoliques ou des caroténoïdes aux propriétés antioxydantes présents dans différents aliments utilisés dans l'alimentation de la vache sont transférés de la ration aux sécrétions lactées réduisant ainsi la susceptibilité des matières grasses du lait à l'oxydation. 1.4.2 Facteurs alimentaires influençant la stabilité oxydative du lait
1.4.2.1 Les antioxydants
En présence d'oxygène, l'oxydation des lipides insaturés est une réaction irréversible. Elle peut cependant être empêchée. Les antioxydants sont des réducteurs qui ralentissent et inhibent l'oxydation des lipides. Ils peuvent agir sur différentes étapes de l'auto-oxydation et de l'oxydation (Marc et al., 2004). Dans la littérature, les antioxydants ont été définis comme étant des substances qui, en petites quantités, sont capables de prévenir ou de fortement retarder l’oxydation des composés facilement oxydables comme les matières grasses (Chipault, 1962 cité par Bartosz et Kolakowska, 2011a).
31 Les antioxydants réagissent généralement avec les radicaux libres produits pendant l'initiation et la propagation et les rendent moins actifs. L'action préventive bloque l'étape d'initiation en complexant les catalyseurs, en réagissant avec l'oxygène ou en déviant de l'aliment les effets de la lumière ou des rayonnements (Figure 1.13; Marc et al., 2004).
Figure 1.13- Chimie des antioxydants
Les antioxydants entrent en compétition avec les substrats lors de la propagation comme donneurs d'hydrogène pour les radicaux libres présents dans le milieu et forment des hydroperoxydes (Para Radanielina, 2007). Les radicaux libres générés sont à faible réactivité. Ces molécules plus stables limitent donc la propagation (Marc et al., 2004). Il existe plusieurs composés ayant des propriétés antioxydantes (Figure 1.14). Ceux-ci peuvent être classés selon leur mode d’action, c’est à-dire ceux qui bloquent la réaction en réagissant avec les radicaux pour fabriquer des produits stables, et ceux qui retardent le processus d’oxydation par divers mécanismes. D’autre part, certains auteurs regroupent les antioxydants au sein de classes plus précises, dépendamment de leur mécanisme d’action (Bartosz et Kolakowska. 2011a).
32
Figure 1.14- Principaux composés naturels (ou de synthèse) possédant des propriétés antioxydantes
33 De plus, certains composés d’origine végétale sont considérés comme une source d’antioxydants. Par exemple, certaines plantes sont des sources de vitamines C et E, de caroténoïdes ou de lignanes ou encore sont riches en d’autres composés phénoliques.
1.4.2.2 Vitamine E
La vitamine E est un antioxydant connu et reconnu dans la littérature depuis longtemps. Cuvelier et al. (2003) expliquent que la vitamine E (α-tocophérol) est communément ajoutée à l’alimentation animale et humaine à cause de sa capacité à inhiber la peroxydation lipidique. C’est une vitamine liposoluble de la famille des tocophérols qui comprend l’α-tocophérol, qui est la vitamine E proprement dite, le β-tocophérol, le γ-tocophérol et le δ-tocophérol (Cuvelier et al., 2003). L’α-tocophérol est très réactif envers l’oxygène
singulet1 et inhibe l’oxydation photosensible à la fois physiquement, c’est-à-dire en
empêchant l’activation de l’oxygène en oxygène singulet, et en réagissant avec cette molécule afin de former des produits stables (Frankel, 1991). Il s’agit donc d’un antioxydant dit «briseur de chaîne» (Miller et Brezezinska-Slebodzinska, 1993).
Une pratique qui est couramment adoptée en production laitière pour diminuer le risque d’oxydation est l’ajout de vitamine E à la ration à raison de 1000 à 1500 UI/j. Comme mentionné précédemment, la vitamine E est un antioxydant puissant mais, comme son transfert dans le lait est peu élevé, son efficacité à prévenir l’oxydation du lait est souvent faible (St-Laurent et al., 1990). Pour cette même raison, la vitamine C, un autre antioxydant, n’est guère plus efficace (Weiss, 2001). De plus, Gobert et al., (2009) ont montré qu’une supplémentation de 7500 UI/j de vitamine E, dans la ration de la vache, n’avait pas d’effet sur la lipoperoxydation. Une option pour améliorer l’effet protecteur de la vitamine E contre la peroxydation lipidique pourrait être d’augmenter sa concentration dans la ration. Cependant, une grande concentration de vitamine E dans l’alimentation ne serait pas efficace parce que les excès seraient catabolisés et excrétés (Aurousseau, 2002).
1 L’oxygène singulet est un état excité de la molécule de dioxygène.