Sous-produits de la désinfection dans l’eau potable des
petits réseaux municipaux: variabilité spatio-temporelle,
modélisation et stratégies de suivi
Thèse
Stéphanie Guilherme
Doctorat en aménagement du territoire et développement régional
Philosophiae doctor (Ph.D.)
Québec, Canada
Résumé
Les trihalométhanes (THM) et les acides haloacétiques (AHA) constituent les seules familles réglementées de sous-produits de la désinfection (SPD). Les SPD sont des composés issus de la réaction de la matière organique naturelle présente dans l’eau et du désinfectant lors du traitement de l’eau potable. La plupart de ces composés ne sont pas réglementés, même si plusieurs études ont montré que certains SPD peuvent présenter un risque toxicologique plus important que les THM et les AHA. De nos jours, très peu d’informations sont disponibles sur l’occurrence des SPD non-réglementés dans l’eau potable, en particulier dans les petits réseaux municipaux. Paradoxalement, les petits réseaux approvisionnés en eau de surface ont souvent des difficultés à mettre en place des traitements adéquats pour enlever les précurseurs de SPD dans l’eau soumise à la désinfection. L’eau potable des petits réseaux est ainsi plus vulnérable aux SPD et leur suivi y est d’autant plus important. Cette thèse s’est donc consacrée à améliorer les connaissances sur l’occurrence des SPD (et en particulier, les SPD non-réglementés) dans les petits réseaux de distribution d’eau potable, en étudiant notamment leur évolution spatiale et temporelle. Pour ce faire, deux campagnes d’échantillonnage ont été réalisées sur deux ans (entre 2010 et 2012) dans 25 petits réseaux du Québec et de Terre-Neuve-et-Labrador. Les THM, les AHA et trois autres familles de SPD non-réglementés, à savoir les haloacétonitriles, les halonitrométhanes et les haloacétones, ont été étudiés. Les résultats obtenus ont permis de mieux comprendre leur patron de variabilité spatio-temporelle, de modéliser leur présence et de développer un outil d’aide à la décision pour la mise en place d’une stratégie de suivi des SPD réglementés et non-réglementés.
Abstract
Trihalomethanes (THMs) and haloacetic acids (HAAs) constitute the only regulated disinfection by-products (DBPs) in various countries. DBPs are compounds formed during drinking water treatment, from the reaction between natural organic matter and the disinfectant. Most DBPs are not regulated, even if they may have more pronounced toxicological effects than regulated ones. There is currently very little information about the occurrence of non-regulated DBPs, particularly in small water systems (SWS). Paradoxically, in many cases, SWS supplied by surface waters lack adequate treatment processes to remove DBP precursors in water subjected to the disinfection process. Their tap water may be more vulnerable to the presence of DBPs. This thesis is dedicated to improving the knowledge of the occurrence of DBPs (especially non-regulated DBPs) in SWS by studying their spatial and temporal variability. To do that, two sampling programs were carried out in 25 SWS during two years (between 2010 and 2012) in Canada. Small systems in the provinces of Newfoundland & Labrador and Quebec were considered. The following DBPs were measured during the study: THMs, HAAs, haloacetonitriles, haloketones and halonitromethanes. The obtained results contribute to a better understanding of the DBP spatio-temporal variation patterns, to establishing models to evaluate their levels and to developing decision-making schemes for simultaneously monitoring various families of DBPs, including non-regulated DBPs.
Table des matières
Résumé ... iii
Abstract ... v
Table des matières ... vii
Liste des tableaux ... xi
Liste des figures ... xiii
Liste des abréviations... xv
Remerciements ... xvii
Avant-Propos ... xix
Introduction ... 1
Bibliographie de l’introduction ... 11
Chapitre 1: Occurrence of regulated and non-regulated disinfection by-products in small drinking water systems ... 19
1.1. Introduction ... 20
1.2. Methodology ... 21
1.2.1. Case studies ... 21
1.2.2. Sampling and analysis... 21
1.2.3. Data Analysis ... 23
1.3. Results and discussion ... 23
1.3.1. Portrait of DBP occurrence in small system ... 23
1.3.2. Temporal variations of DBP levels ... 26
1.3.3. Spatial variations of DBP occurrence within the distribution systems ... 30
1.3.4. Spatio-temporal variations of DBP occurrence ... 31
1.4. Conclusions ... 33
1.5. References ... 34
Chapitre 2: Models for estimating non-regulated disinfection by-product occurrence in small drinking water systems ... 39
2.1. Introduction ... 41
2.2. Methodology ... 42
2.2.1. Case studies ... 42
2.2.2. Sampling and analysis... 42
2.3. Results ... 44
2.3.1. Influence of treatment conditions on DBP speciation ... 44
2.3.2. Influence of water quality characteristics on non-regulated DBP levels in the DS ... 45
2.3.3. Correlations between regulated and non-regulated DBPs ... 46
2.3.4. Modelling levels of non-regulated DBPs in small water systems ... 50
2.3.5. Validation of HAN and HK models ... 53
2.4. Discussion and conclusions ... 54
2.5. References ... 55
Chapitre 3: Short-term spatial and temporal variability of disinfection by-product occurrence in small drinking water systems... 61
3.1. Introduction ... 63
3.2. Methodology ... 64
3.2.1. Case studies ... 64
3.2.2. Sampling and analysis ... 65
3.3. Results and discussion ... 66
3.3.1. Short-term temporal variability of DBP occurrence ... 66
3.3.2. Spatial variability of DBP occurrence ... 73
3.3.3. Impact of the location on the short-term variability of DBPs ... 75
3.4. Conclusions ... 77
3.5. References ... 77
Chapitre 4: Decision-making scheme for disinfection by-product monitoring intended for small drinking water systems ... 83
4.1. Introduction ... 84
4.2. Methodology ... 86
4.2.1. Case studies ... 86
4.2.2. Sampling and analysis ... 87
4.3. Results and discussion ... 88
4.3.1. Sampling period identification ... 88
4.3.2. Sampling location identification ... 99
4.3.3. Decision-making scheme for DBP monitoring ... 103
4.4. Conclusions ... 105
4.5. References ... 106
Annexe 1 : Répartition géographique des 25 petits réseaux étudiés dans les provinces a) de Québec et b) de
Terre-Neuve-et-Labrador ... 115
Annexe 2 : Caractéristiques des 25 petits réseaux étudiés des provinces de Québec et Terre-Neuve-et-Labrador ... 116
Annexe 3 : Informations sur les méthodes analytiques utilisées pour l’analyse des SPD ... 117
Annexe 4: Comparison of water characteristics between SWS in QC and NL ... 121
Annexe 5: Spatial evolution of regulated DBP concentrations in SWS in a) NL and b) QC ... 122
Annexe 6: Spatial evolution of non-regulated DBP concentrations in SWS in a) NL and b) QC ... 123
Annexe 7: Distribution of daily levels (average of the six SWS under study in DS3) of a) free chlorine, b) THMs, c) HAAs, d) HANs, e) CPK and f) HKs ... 124
Annexe 8: Evolution of average DBP and free residual chlorine levels along the DS in a) NL1, b) NL2, c) NL3, d) QC1, e) QC2 and f) QC3 (average of 5 measurements for NL1 and 12 for the others) ... 125
Annexe 9: Summary of annual average levels of a) THMs, b) HAAs, c) HANs, c) CPK, and e) HKs, based on the various scenarios ... 130
Liste des tableaux
Tableau 0.1: Normes et recommandations internationales concernant les THM et les AHA Table 1.1: Parameters measured during the sampling campaign
Table 1.2: Regional variation of regulated and non-regulated DBP occurrence in SWS of NL and QC Table 1.3: Levels of regulated and non-regulated DBPs observed in the literature
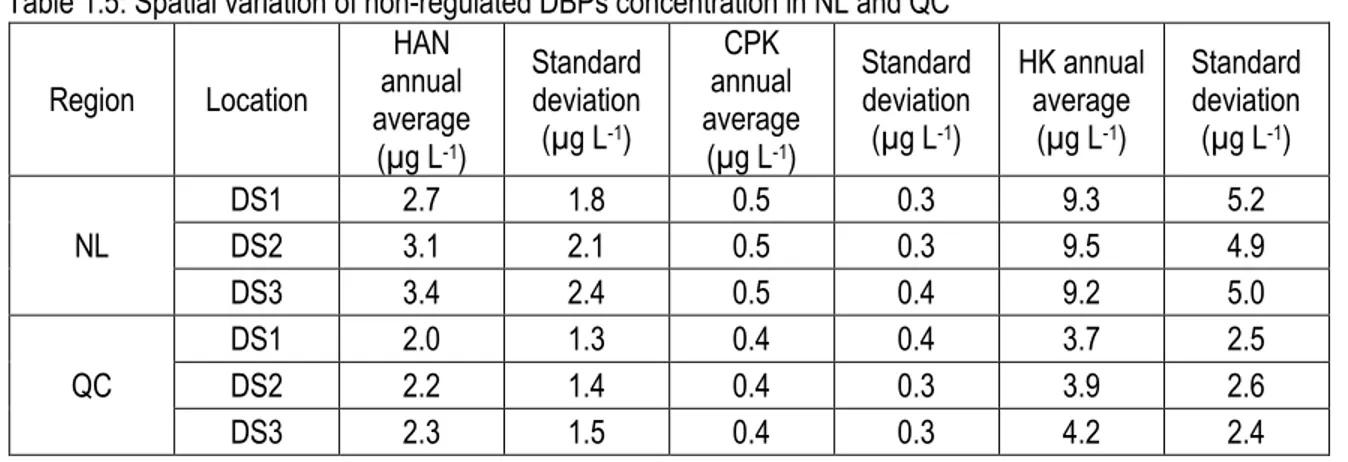
Table 1.4: Spatial variation of residual disinfectant, THMs and HAAs in NL and QC Table 1.5: Spatial variation of non-regulated DBPs concentration in NL and QC Table 2.1: Parameters measured during the sampling campaigns
Table 2.2: Average levels of non-regulated DBP in location DS2 during summer (July, August and September) and in winter (January, February and March) in four SWS using different types of treatment (number of observations per season = 3)
Table 2.3: Spearman correlation matrix between water quality characteristics of treated water at the treatment plant (after filtration and before disinfection) and non-regulated DBP levels in the DS in all SWS (number of observations for each parameter = 300)
Table 2.4: Spearman correlation matrix between DBP average levels in location DS2 (number of observations for each parameter = 300)
Table 2.5: Spearman correlation matrix between DBP variation ratios a) DS1 and DS2 winter/summer; b) DS2 and DS3 winter/summer
Table 2.6: Classification of DOC levels at the WTP (number of observations = 300) Table 2.7: Multivariate regression models for non-regulated DBP levels
Table 3.1: General characteristics of SWS under study
Table 3.2: Parameters measured during the sampling campaign
Table 3.3: Weekly average levels of DBPs and free chlorine in DS3 (with coefficients of variation-CV) in the SWS under study
Table 3.4: Specific locations for the maximum levels of DBPs and free residual chlorine in the SWS under study Table 4.1: Description of the different scenarios to calculate the annual average levels of DBPs
Table 4.2: Correlation (Spearman) between different results of scenarios for annual average levels of a) THMs, b) HAAs, c) HANs, d) CPK and e) HKs
Table 4.3: Months presenting the maximum DBP level observed in all SWS (QC and NL included) for each trimester between fall 2010 and summer 2011 (based on 12 monthly DBP measurements)
Table 4.4: Summer average levels of a) THMs, b) HAAs, c) HANs, d) CPK and e) HKs based on different scenarios (levels in µg/L)
Table 4.5: Values of free residual chlorine decrease in each location with maximum DBP level obtained in four SWS (second campaign in summer 2012)
Liste des figures
Figure 1.1: Temporal evolution of regulated DBP concentrations in SWS in a) NL and b) QC Figure 1.2: Temporal evolution of non-regulated DBP concentrations in SWS in a) NL and b) QC
Figure 1.3: Variation of average DBP occurrence along the DS in NL and QC in: a) to f) summer (July-September); g) to l): winter (January-March)
Figure 2.1: Identification of the most correlated regulated DBPs (Spearman correlation factors indicated) with non-regulated DBPs according to DOC levels before disinfection, season and location in the DS
Figure 2.2: Validation of HAN models: correlation between observed and estimated values in a) all systems, b) only small systems
Figure 2.3: Validation of HK models: correlation between observed and estimated values in a) all systems, b) only small systems
Figure 3.1: Variations from day to day within the week of levels of a) Free chlorine, b) THMs, c) HAAs, d) HANs, e) CPK and f) HKs in NL2 in DS3 (number of observations per day: 4)
Figure 3.2: Variations from day to day within the week of levels of a) Free chlorine, b) THMs, c) HAAs, d) HANs, e) CPK and f) HKs in QC3 in DS3 (number of observations per day: 4)
Figure 3.3: Daily evolution of raw water characteristics and DBP occurrence in DS3 a) and b) in NL2 and c) and d) in QC3
Figure 3.4: Location of the maximum levels of DBPs and free residual chlorine along the DS for all SWS under study
Figure 3.5: Temporal variability of the DBP levels in two locations along the DS of QC3: a) and b) in DS1; c) and d) in DS6 (SWS presenting an average level of free chlorine higher than 0.3 mg/L in DS6
Figure 3.6: Temporal variability of the DBP levels in two locations along the DS of NL2: a) and b) in DS1; c) and d) in DS6 (SWS presenting an average level of free chlorine lower than 0.3 mg/L in DS6)
Figure 4.2: Comparison of results of the various scenarios for the annual average level of a) THMs, b) HAAs, c) HANs, d) CPK, and e) HKs
Figure 4.3: Variations of average a) regulated and b) non-regulated DBP levels along the DS in winter (January - March) in all SWS in NL and QC (number of observations for each DBP in each location = 75)
Figure 4.4: Variations of average DBP levels along the DS in summer, a) and c) in two SWS presenting a free chlorine level higher than 0.3 mg/L at the end of the DS, and b) and d) in two SWS presenting a free chlorine Figure 4.5: Decision-making scheme for regulated and non-regulated DBP monitoring
Liste des abréviations
ADBA: acide dibromoacétiqueADCA: acide dichloroacétique AHA: acide haloacétique
AMBA: acide monobromoacétique AMCA: acide monochloroacétique ANOVA: analyse de variance ATCA: acide trichloroacétique BCAN: bromo-chloroacétonitrile; BDCM: bromodichlorométhane
CEAEQ: centre d'expertise en analyse environnementale du Québec CPK: chloropicrin (trichloronitrométhane)
COD: carbone organique dissous CV: coefficient de variation DBAN: dibromoacétonitrile DBCM: dibromochlorométhane DBP: disinfection by-products DCAN: dichloroacétonitrile DCBM: dichlorobromométhane DCP: 1,1-dichloropropanone DS: distribution system
HAN: haloacétonitrile HC: halocétone
HNM: halonitrométhanes
MDDELCC: ministère du développement durable, de l’environnement et de la lutte contre les changements climatiques
MON: matière organique naturelle NL: Newfoundland and Labrador QC: Québec
RW: raw water
SUVA: absorbance UV spécifique SPD: sous-produits de la désinfection SWS: small water system
TBM: tribromométhane TCAN: trichloroacétonitrile TCM: trichlorométhane TCP: 1,1,1-trichloropropanone THM: trihalométhane TN: Terre-Neuve et Labrador
USEPA: United States environmental protection agency UV-254: absorbance UV à 254nm
Remerciements
Je voudrais remercier vivement mon directeur de thèse, Pr. Manuel Rodriguez, pour son soutien, sa disponibilité et sa confiance en moi tout au long de ma thèse. Ses connaissances illimitées et ses précieux conseils m’ont permis de réaliser ce beau projet et de surmonter les difficultés de ce doctorat. Je tiens aussi à remercier les membres de mon jury, Mr Patrick Drogui, Mr. Caetano Dorea, Mr. Jean-Baptiste Sérodes pour leurs commentaires et remarques qui m’ont permis de bonifier ce manuscrit.
Aussi, je tiens à remercier les partenaires financiers sans qui la réalisation de ce projet n'aurait pas été possible : RES’EAU-WaterNET, le Conseil de recherches en sciences naturelles et en génie du Canada (CRSNG) et la Chaire de recherche en eau potable de l'Université Laval.
Je remercie aussi tous les opérateurs des 25 petits réseaux étudiés, pour leur aide, leur disponibilité et leur accueil durant toutes les campagnes d’échantillonnage. En particulier, je tiens à remercier, Mr. Mario Demers, Mr. Harvey Henstridge, Mr. Jean Claude Lapointe, Mr James Jr. Peckford, Mr. Philip Smith et Mr. Alain Tousignant, pour leur grande gentillesse et leur bonne humeur à toute épreuve. Je tiens à remercier les autorités locales et provinciales qui ont permis la mise en place de ces deux campagnes, en particulier Mme. Anouka Bolduc et Mr. Haseen Khan.
Je voudrais remercier tous les membres du laboratoire, Sabrina Simard, Michel Bisping et tous les étudiants qui ont participé aussi bien à l’échantillonnage qu’aux analyses en laboratoire lors des deux campagnes. Sans leur aide précieuse, ce projet n’aurait pas pu se réaliser. Je voudrais également remercier tout particulièrement Sabrina Simard pour son soutien et sa grande disponibilité. Aussi, je souhaite aussi adresser un merci particulier à Catherine Mercier-Shanks, dont ses travaux d’une grande qualité sur les SPDE m’ont permis d’analyser ces composés.
Je souhaite également remercier tous les étudiants du CREPUL et du CRAD pour leur soutien et leur gentillesse tout au long de ce doctorat et en particulier mes deux colocataires de bureau qui m’ont supporté pendant quatre ans : Christelle Legay et Anna Scheili. Je voudrais aussi remercier tout le personnel et les professeurs du CRAD et de l’ÉSAD et plus particulièrement Francine Baril, Lyne Béland, Marie-Pier Bresse, Willem Fortin et Francis Rioux pour leur aide et leur bonne humeur communicative.
Finalement, j’aimerais profondément remercier ma famille et mes amis pour leur soutien, leur gentillesse et leurs encouragements. Tout d’abord, ma mère, Maria, mon père, Luciano, ma sœur, Christelle et ma belle Léa qui m’ont toujours encouragé dans tous mes projets et en particulier celui-ci de l’autre côté de l’océan. Leur incroyable soutien ont permis le succès de ce doctorat. Aussi, je tiens à remercier mes amis qui m’ont toujours
soutenu et encouragé dans ce doctorat Orphé, Jérémy, Léo, Maman Caro, Juliane, Marion, Fabien et Rose-Marthe. Je voudrais remercier tout particulièrement Orphé pour son génie, son optimisme, sa bonne humeur et sa motivation, merci d’avoir toujours été là pour moi durant toutes ces années. Je tiens à remercier aussi ceux qui m’ont encouragé à distance, Delphine, Laure, Yacine, Jeff, Nils, Bertrand, Gary, Joel, Pierrick, Etienne, Charlotte et Aurélie. Aussi, un grand merci à Sylvie et Catherine pour nos pauses Yoga qui m’ont permis de rester zen en période de stress.
Enfin, je ne sais comment remercier mon beau Seb pour m’avoir soutenu et encouragé durant mon doctorat. Son énergie, sa motivation, sa confiance en moi ainsi que ses farces, ses surprises et ses poutines m’ont permis de surmonter les obstacles de ce doctorat. Je tiens aussi à remercier sa famille Marie-Lise, Fernand, Fred, Marc, Claudine et Mia pour leur gentillesse.
Avant-Propos
Cette thèse est composée de quatre chapitres. Chaque chapitre est constitué d’un article publié ou soumis à des revues scientifiques avec comité de lecture. Ces articles ont été rédigés en anglais, en accord avec les directives des revues scientifiques. Le premier article a été publié récemment dans la revue « Chemosphere ». Le troisième a été soumis à « Science of the Total Environnement » et les deux autres sont prêts à être soumis à d’autres revues scientifiques. Les articles sont présentés dans l’ordre chronologique du développement des travaux de recherche de la thèse. Bien que chaque article puisse être lu séparément, l’ensemble des articles constitue un cheminement organisé pour une caractérisation par étapes de l’évolution spatio-temporelle des sous-produits de la désinfection (SPD) dans l’eau potable de petits réseaux municipaux. Ainsi, des rappels de notions ou de méthodes peuvent être observés dans les articles constituant la thèse. Aussi, entre les chapitres 2, 3 et 4, un texte a été ajouté afin d’expliquer le lien entre chaque article et la logique de développement suivie. Enfin, le manuscrit contient un résumé de la thèse et quatre chapitres en français et en anglais. Il est aussi composé d’une introduction générale, d’une conclusion générale ainsi que d’une bibliographie et des annexes. Pour chaque article, les auteurs sont l’auteur de la thèse ainsi que le directeur de recherche (Manuel J. Rodriguez). Les titres et références de chaque article constituant cette thèse sont présentés ci-dessous.
CHAPITRE 1
Occurrence of regulated and non-regulated disinfection by-products in small drinking water systems
Stéphanie Guilherme and Manuel J. Rodriguez, 2014, Chemosphere, vol. 117, pp.425–432
CHAPITRE 2
Models for estimating non-regulated disinfection by-product occurrence in small drinking water systems
Stéphanie Guilherme and Manuel J. Rodriguez Prêt à être soumis
CHAPITRE 3
Short-term spatial and temporal variability of disinfection by-product occurrence in small drinking water systems
Stéphanie Guilherme and Manuel J. Rodriguez Soumis à « Science of the Total Environment »
CHAPITRE 4
Decision-making scheme for disinfection by-product monitoring intended for small drinking water systems
Stéphanie Guilherme and Manuel J. Rodriguez Prêt à être soumis.
Introduction
La qualité de l’eau potable est un des plus importants déterminants de la santé, et sa gestion reste un élément essentiel dans la prévention et le contrôle des maladies hydriques (Organisation Mondiale de la Santé, 2011). En cela, la désinfection est une étape indispensable à la salubrité de l’eau potable. Elle permet d’inactiver les micro-organismes pathogènes présents dans l’eau mais aussi de prévenir leur croissance dans le système de distribution. Ayant l’avantage d’être peu coûteux et facile à utiliser, le chlore est devenu le désinfectant le plus communément utilisé dans le monde, principalement sous forme d’hypochlorite de sodium (Cedergren et al., 2002; Villanueva et al., 2007). Cependant, en 1974, J. J. Rook (Rook, 1974) découvre que le chlore utilisé pour désinfecter l’eau, réagit avec la matière organique naturelle (MON) présente dans l’eau pour générer des sous-produits chlorés potentiellement toxiques que l’on appelle usuellement sous-sous-produits de la désinfection (SPD). On sait maintenant que les désinfectants sont, à l’exception du rayonnement U.V., des oxydants (chlore, bioxyde de chlore, ozone ou chloramines) qui peuvent générer la formation de SPD. Plusieurs facteurs influencent la formation ainsi que la spéciation (la variété des composés présents) des SPD. Le type de traitement joue un rôle important dans la formation des SPD, surtout en sa capacité à enlever la matière organique de l’eau brute avant la chloration (Rodriguez & Sérodes, 2001; Bull et al., 2009). D’autres paramètres physico-chimiques de l’eau influencent leur formation comme la dose de désinfectant, le temps de contact de l’eau avec le désinfectant (Singer, 1994; Rodriguez & Sérodes, 2001; Liang & Singer, 2003; Rodriguez et al., 2004; Speight & Singer, 2005; Bull et al., 2009), le pH (Bove et al., 2002; Liang & Singer, 2003; Bull et al., 2009) et la température de l’eau traitée(Singer, 1994; Liang & Singer, 2003; Rodriguez et al., 2004; Bull et al., 2009). De plus, les propriétés du réseau de distribution, comme la présence de biofilms dans sur les parois des conduites(Singer, 1994), la nature et les dimensions des canalisations, les conditions hydrauliques et la présence de réservoirs de stockage et de stations de rechloration au sein du réseau(Rodriguez et al., 2004) vont, elles aussi, jouer un rôle dans la formation de SPD. Aussi, le type de MON présente dans l’eau va influencer la formation des SPD. En effet, une eau riche en substances humiques comme les acides fulviques et humiques (composés multi-aromatiques) va potentiellement former plus de SPD (Crittenden et al., 2005). Ainsi, le SUVA (rapport de l’absorbance UV à 254nm et de la mesure de carbone organique dissous) représente un bon indicateur de ces précurseurs spécifiques car il indique la proportion de composés aromatiques présents dans la MON de l’eau brute (Crittenden et al., 2005). De même, à la suite d’un traitement équivalent,une eau de surface plus riche en MON présentera une contamination en SPD plus importante qu’une eau souterraine(Singer, 1994; Mouly et al., 2010). À ce jour, bien que plus de 700 SPD ont été répertoriés dans la littérature, l’occurrence et les effets sur la santé de peu d’entre eux ont été étudiés (Richardson, 2011; Villanueva et al., 2014). Notre étude se concentre principalement sur les SDP formés lors de la chloration, en particulier par la réaction de l’acide hypochloreux et la MON, dont la majorité sont des sous-produits organochlorés. Certains de ces SPD, comme les
trihalométhanes (THM) et les acides haloacétiques (AHA) sont relativement bien documentés et sont réglementés dans de nombreux pays. Les THM et AHA sont les principaux SPD présents dans l’eau potable, en concentration massique (µg/L), et les plus étudiés depuis les 30 dernières années(Singer, 2002; Rodriguez et al., 2004). Les THM sont un groupe de composés organiques volatils(Pérez Pavon et al., 2008) dont les plus communément observés dans l’eau potable sont le trichlorométhane ou chloroforme (TCM), le bromo-dichlorométhane (BDCM), le dibromo-chlorométhane (DBCM) et le tribromométhane (TBM). Concernant les AHA, les plus communément observés dans l’eau potable sont l’acide monobromoacétique (AMBA), l’acide monochloroacétique (AMCA), l’acide dibromoacétique (ADBA), l’acide dichloroacétique (ADCA) et l’acide trichloroacétique (ATCA) (Rodriguez et al., 2004). La particularité des SDP est associée aussi aux modes d’exposition multiples dus à leur présence dans l’eau potable. En effet, trois principales voies d’exposition humaine aux SPD sont recensées globalement dans la littérature. La principale voie d’exposition étudiée est l’ingestion orale, spécialement pour les SPD non ou peu volatils, comme les AHA par exemple (Richardson et al., 2007; Nieuwenhuijsen et al., 2009; Villanueva et al., 2014). Les autres voies alternatives d’exposition pour les SPD plus volatils, comme les THM par exemple, sont par inhalation et absorption cutané lors d’activités telles que la douche, le bain et la natation (Richardson et al., 2007; Nieuwenhuijsen et al., 2009; Villanueva et al., 2014). En plus de présenter une variété de voies d’exposition, les SPD présentent des types et des niveaux de toxicité très variables selon leurs propriétés chimiques.
Différentes études ont montré que les THM étaient cancérigènes (Richardson et al., 2007; Villanueva et al., 2014), notamment sur les rats. En effet, des études toxicologiques sur le TCM et le BDCM ont révélé que, administrés dans l’eau potable, ces composés pouvaient causer des tumeurs sur le foie et le rein lors de tests réalisés sur des animaux (National Cancer Institute, 1976; Jorgenson et al., 1985; Department of health & human services USA, 2006). Par conséquent, les rapports du centre international de recherche sur le cancer (CIRC) ont déclaré le TCM et BDCM comme possiblement cancérigènes chez l’homme (2B) (International Agency for Research on Cancer, 1991; International Agency for Research on Cancer, 1999). Cependant, il reste encore une incertitude sur la toxicité pour l’homme du TCM. En effet, l’USEPA a déclaré le TCM à la fois possiblement cancérigènes chez l’homme (2B) et peu probablement cancérigène pour l’homme (USEPA, 2001). Aussi, les THM ont été associés à une certaine toxicité pour le développement (Bull et al., 2009). Concernant les AHA, des études épidémiologiques sur l’ADBA, l’ADCA, l’AMBA et l’AMCA ont montré qu’ils étaient mutagènes, avec une plus forte toxicité des AHA bromés (Giller et al., 1997; Kargalioglu et al., 2002; Plewa et al., 2002; Richardson et al., 2007). Plusieurs études ont aussi montré une certaine cancérogénicité sur les animaux de l’ADBA, l’ADCA et l’ATCA principalement sur le foie (Bull et al., 1990; DeAngelo et al., 1996; DeAngelo et al., 1999; Melnick et al., 2007; Richardson et al., 2007; Bull et al., 2009; Villanueva et al., 2014)
Due à leur potentielle toxicité et leur forte exposition, des règlementations sur les THM et AHA ont été mises en place dans différents pays dans le monde (Tableau 0.1). En Amérique du nord, les premières règlementations sur les SPD sont apparues aux États-Unis, par l’intermédiaire de l’Environmental Protection Agency (USEPA). En 1979, l’USEPA avait établi une concentration maximale de THM4 (somme des concentrations des TCM, BDCM, DBCM et TBM) de 100 μg/L pour les systèmes desservant une population supérieure à 10 000 habitants (Environmental Protection Agency, 1998). En décembre 1998, USEPA a publié l’étape 1 du plan de réglementation des désinfectants et des SPD fixant de nouveaux standards sur les THM et les AHA et une obligation de suivi de ces composés. Ainsi, les THM4 ne doivent pas dépasser une concentration moyenne annuelle maximale de 80 μg/L. La concentration d’AHA5 (somme des concentrations des MCAA, DCAA, TCAA, MBAA et DBAA) ne doit, elle, pas dépasser une concentration moyenne annuelle maximale de 60 μg/L. Les normes ont été mises en place dans les grands réseaux publics de distribution d’eau potable (plus de 10 000 consommateurs) alimentés en eau de surface, puis dans les petits réseaux publics de distribution d’eau potable (moins de 10 000 consommateurs) alimentés par des eaux de surface ou souterraine (Environmental Protection Agency, 1998). Les données collectées lors du suivi des SPD dans les réseaux de distribution ont permis d’approfondir la réglementation sur les SPD et de mettre en place par la suite, l’étape 2 du plan de réglementation des désinfectants et des SPD. La nouvelle norme établit des points de suivi spécifiques dans le réseau pour les différents composés réglementés par l’étape 1 (Environmental Protection Agency, 2006b). Ainsi, la concentration des SPD ne se base plus sur une moyenne de mesures sur différents points dans le réseau, mais à des points où la concentration des composés réglementés est la plus élevée. Pour cela, les municipalités doivent réaliser une auto-évaluation dans leur réseau afin d’identifier les sites les plus appropriés pour le suivi des THM et des AHA. Ce programme, intitulé « évaluation du système de distribution initiale (Initial Distribution
System Evaluation (IDSE)) » est une étude ponctuelle durant laquelle les concentrations de THM et de AHA
sont mesurées à plusieurs localisations le long du système (de deux à quatre sites) d’une à six fois au cours d’une année. Le nombre de points d'échantillonnage, le nombre d'échantillons prélevés à chaque emplacement et la fréquence d'échantillonnage dépendent du type de la source d'eau ainsi que de la taille de la population desservie par le réseau (Environmental Protection Agency, 2006a). Finalement, ce programme permet d’identifier les localisations présentant les niveaux les plus élevés de THM et de AHA dans le système de distribution, correspondant aux sites d'échantillonnage où le suivi réglementaire de ces composés devrait être fait.
Au Canada, il existe une recommandation relative aux concentrations des THM et des AHA dans l’eau potable. La concentration maximale acceptable (moyenne annuelle sur quatre trimestres) pour les THM4 est fixée à 100 μg/L et celle des AHA5 à 80 μg/L (Health Canada, 2012). Cependant ces valeurs ne sont que des recommandations. En effet, la règlementation sur l’eau potable au Canada est sous la juridiction des provinces. Le Québec fait partie des rares provinces canadiennes à s’être dotées d’une réglementation exigeante sur la
qualité de l’eau potable. La concentration annuelle maximale acceptable des THM4 est à 80 μg/L, concentration moyenne maximale calculée sur quatre trimestres consécutifs (MDDELCC, 2012). De plus, une obligation de suivi des THM au moyen de un à huit prélèvements par trimestre (selon la taille de la population desservie par le réseau) a été établie. Les AHA, quant à eux, sont règlementés depuis peu au Québec. La norme sur les AHA5 est fixée à 60 µg/L, concentration moyenne maximale calculée sur quatre trimestres consécutifs (MDDELCC, 2012) mais il n’existe pas encore d’obligation de suivi. Par comparaison, la province de Terre-Neuve-et-Labrador a mis sur place une recommandation sur la concentration maximale en THM dans l’eau potable en suivant les recommandations de Santé Canada. Ainsi, la concentration annuelle maximale acceptable des THM4 est fixée à 100 μg/L, concentration moyenne maximale calculée sur quatre trimestres consécutifs (Health Canada, 2012). Cependant, aucune de ces provinces n’a mis en place d’auto-évaluation du système (comparable à l’IDSE) afin d’identifier les sites les plus appropriés pour le suivi des SPD dans les réseaux.
Tableau 0.1 : Normes et recommandations internationales concernant les THM et les AHA
Lieux SPD Normes
Québec
(MDDELCC, 2012) THM 80 µg/L (Concentration moyenne maximale calculée sur 4 trimestres) AHA 60 µg/L (Concentration moyenne maximale
calculée sur 4 trimestres) USA
(Environmental Protection Agency, 2006b) THM 80 µg/L (Concentration moyenne maximale calculée sur 4 trimestres) AHA 60 µg/L (Concentration moyenne maximale
calculée sur 4 trimestres) Europe
(Conseil de l’Union Européenne, 1998) THM 100 µg/L (Norme réglementaire) Canada (recommandation)
(Health Canada, 2012) THM 100 µg/L (Concentration moyenne maximale calculée sur 4 trimestres) AHA 80 µg/L (Concentration moyenne maximale
calculée sur 4 trimestres) OMS (recommandation)
(Organisation Mondiale de la Santé, 2011) THM TCM: 300 µg/L; BDCM: 60 µg/L; DBCM: 100 µg/L; TBM: 100 µg/L AHA DCAA: 50 µg/L; TCAA: 200 µg/L HAN DBAN: 70 µg/L ; DCAN: 20 µg/L
Les SPD organiques réglementés (THM et AHA) ne représentent que 30 à 60% de tous les composés organiques halogénés formés dans l’eau(Karanfil et al., 2008). La majorité des SPD restent encore non-réglementés. De ces contaminants, trois familles ont été retenues pour cette étude: les haloacétonitriles (HAN),
les halonitrométhanes (HNM) et les halocétones (HC). Cette étude se concentre sur les quatre haloacétonitriles suivants: le trichloroacétonitrile (TCAN), le dichloroacétonitrile (DCAN), le dibromoacétonitrile (DBAN) et le bromo-chloroacétonitrile (BCAN) et sur un seul HNM, le trichloro-nitrométhane (la chloropicrine (CPK)), qui est d’ailleurs le HNM le plus étudié dans la littérature (Merlet et al., 1985). De plus, cette étude se porte aussi sur les deux HC suivant : le 1,1-dichloro-2-propanone (DCP) et le 1,1,1-trichloro-2-propanone (TCP). Ces SPD non-réglementés sont encore peu étudiés. Leurs concentrations étant plus faibles que celles des THM et des AHA, l’étude des SPD non-réglementés n’a pu se développer qu’avec l’amélioration des techniques analytiques (Krasner et al., 1989). De plus, peu d’études épidémiologiques ont été consacrées aux SPD non-réglementés. Or, certaines indiquent une toxicité des HAN et des HNM (SPD azotés), plus forte que celle des AHA(Muellner et al., 2007; Hu et al., 2010). Certaines études ont montré une certaine génotoxicité des HAN étudiés ici (Muellner et al., 2007). Aussi, une toxicité pour le développement ainsi qu’une certaine toxicité pour la thyroïde (à forte dose sur les animaux) ont été reportées pour les HAN (International Agency for Research on Cancer, 1999; Muller-Pillet et al., 2000; Bull et al., 2009). Des études sur la CPK ont conclu à une génotoxicité du composé sur les animaux (Giller et al., 1995; Schneider et al., 1999; Kundu et al., 2004; Richardson et al., 2007; Bull et al., 2009). Et enfin, les HC ont été reportés, eux aussi, comme génotoxiques (Robinson et al., 1989; Bull et al., 2009). Les diverses voies d’exposition, types et niveaux de toxicité font de ces SPD non-réglementés un réel problème de santé publique. De plus, peu d’études se sont consacrées à étudier l’évolution temporelle et spatiale de leur occurrence dans l’eau potable (Golfinopoulos et al., 2003; Krasner et al., 2006; Goslan et al., 2009; Mercier-Shanks et al., 2013). Il existe donc un manque essentiel de données sur ces contaminants dans l’eau potable. Afin d’assurer une eau potable de qualité, il est essentiel d’enrichir notre connaissance sur ces SPD non-réglementés.
Cette thèse de doctorat s’intéresse tout particulièrement à l’étude de l’occurrence des SPD dans les petits réseaux d’eau potable, qui desservent des petites municipalités ou communautés de moins de 5 000 habitants. Environ 20% de la population canadienne vit dans des petites municipalités (Statistics Canada, 1851 to 2006), or, ces petits réseaux ont des difficultés à maintenir la qualité de leur eau potable à des niveaux adéquats (Coulibaly & Rodriguez, 2004; Hrudey, 2008). Les petits réseaux desservis en eau de surface sont particulièrement vulnérables aux contaminations microbiennes (Davies & Mazumder, 2003; Edwards et al., 2012). En particulier, les systèmes d’eau potable des Premières nations et les petits réseaux ruraux ont des difficultés à assurer une eau de bonne qualité et à répondre aux normes en matière d’eau potable en comparaison avec des plus grands réseaux municipaux (Edwards et al., 2012). En 2006, au Canada, environ 30% des systèmes d’eau potable de communautés de Premières nations étaient classés à risque élevé (un système d'eau potable à risque élevé est un système présentant des lacunes majeures dans plusieurs domaines, notamment un problème lié à la source, à la conception, à l'exploitation ainsi qu'à la formation ou à la certification de l'opérateur). Aussi, beaucoup de ces petits réseaux sont sujets à des avis d’ébullition qui
peuvent rester en vigueur pendant plusieurs années (Patrick, 2011). En effet, une étude de Santé Canada sur les avis d’ébullition dans les Premières nations a montré que 25% de ces avis sont des avis à long terme (en application pendant plus d’un an) (Health Canada, 2008). Les avis d’ébullition sont 2,5 fois plus souvent appliqués à des systèmes d’eau potable de communautés de Premières nations qu’à des systèmes d’autres communautés (Patrick, 2011).
Les petits réseaux ruraux et des Premières nations de l’Amérique du nord sont particulièrement vulnérables en raison des coûts d’opération du système de traitement de l’eau potable trop importants pour leurs propres capitaux, bien que quelques juridictions offrent des subventions pour couvrir les coûts d’investissement (Dore et al., 2013). Ainsi, les coûts de construction et de maintenance d’un système de traitement d’eau représentent un budget très important pour les petits réseaux qui ont alors davantage de difficultés à moderniser leur système de traitement (Davies & Mazumder, 2003; Dore et al., 2013). De plus, la plupart des petits systèmes n’ont pas de programme de protection des sources, ce qui pourrait possiblement réduire les frais de traitement. En effet, ces programmes sont plus difficiles à mettre en place dans les petits réseaux car souvent les bassins versants où se trouvent les prises d’eau sont partagés entre plusieurs juridictions (Davies & Mazumder, 2003).
En plus de leurs limitations financières, les petits réseaux manquent de ressource humaine pour satisfaire aussi bien aux réglementations sur la qualité de l’eau potable qu’aux attentes des consommateurs (Hrudey 2008; Kot et al., 2011). En effet, les coûts de formation des opérateurs d’eau peuvent être difficiles à gérer pour les petits systèmes (Hrudey, 2009; Kot et al., 2011). En plus du coût, la durée de la formation du personnel peut être problématique pour les petits réseaux puisqu’elles se retrouvent sans opérateur durant cette période (Kot et al., 2011). Plusieurs études rapportent aussi le fardeau de la conformité aux réglementations pour les opérateurs des petits réseaux (Kot et al., 2011). En effet, les opérateurs sont souvent accablés par la conformité aux règlementations, ce qui peut entraîner un stress au travail et une relation négative avec la communauté qu’ils servent (Kot et al., 2011). Aussi, une étude a révélé que le contexte culturel et politique, particulièrement dans les réseaux des Premières nations rendait difficile le développement d’un sentiment de responsabilité de la part de l’opérateur et de la prise en charge par celui-ci de la protection de la santé de sa communauté (Smith et al., 2006).
Finalement, les contraintes économiques et logistiques des petits réseaux impliquent que leurs infrastructures de traitement de l’eau sont souvent moins complètes que celles des plus grands réseaux. En particulier, leurs filières de traitement sont souvent moins efficaces pour enlever les précurseurs de SPD présents dans l’eau brute. Les petits réseaux seraient donc plus vulnérables aux SPD que les grands réseaux. Cependant, peu d’études ont été menées sur l’occurrence des SPD (réglementés ou non) dans l’eau potable des petits réseaux des États-Unis et du Canada (Charrois et al., 2004; White et al., 2007; Tung & Xie, 2009), la plupart des études
ont été réalisées sur des grands réseaux(Hebert & al, 2010; Mouly et al., 2010; Ye et al, 2009). De plus, les seules études effectuées aux États-Unis et Canada dans les petits réseaux se concentrent sur les SPD réglementés (Charrois et al., 2004; White et al., 2007; Tung & Xie, 2009). La vulnérabilité des petits réseaux face aux SPD n’est donc pas assez documentée. Les études récentes sur de grands réseaux ont permis d’observer que les variations saisonnières de l’eau brute ainsi que les variations du temps de résidence de l’eau le long du réseau ont une influence importante sur les niveaux de SPD observés dans ces réseaux (Lebel et al., 1997; Rodriguez & Sérodes, 2001; Mouly et al., 2010; Mercier-Shanks et al., 2013). Or, peu d’informations sur la variabilité spatiale et temporelle des SPD dans les petits réseaux sont présentement disponibles. Il n’existe pas de données sur la variabilité de l’occurrence des SPD basée sur des programmes d’échantillonnage structurés et réalisés sur un nombre important de petits réseaux représentatifs des petits réseaux du nord-est de l’Amérique du Nord.
Si les données ne sont pas disponibles dans la littérature, les petits réseaux disposent cependant de bases de données réglementaires afin d’estimer le niveau d’exposition de la population aux SPD. Là encore, seules des données sur les SPD réglementés sont disponibles, et ce uniquement dans les juridictions où des normes sur les SPD sont en vigueur. D’ailleurs, aucune étude spécifique aux petits réseaux n’a été réalisée afin d’estimer les niveaux de SPD non-réglementés à partir des seules données disponibles (notamment les données provenant du suivi réglementaire).
Il a été également observé dans les grands réseaux que la saison estivale est une période particulièrement difficile pour la gestion des SPD car les niveaux de ces contaminants sont souvent plus élevés et les conditions environnementales de cette saison (en particulier la température et l’activité microbienne) peuvent favoriser la formation, la décomposition1, la biodégradation2 ou la transformation de certains SPD (Lebel et al., 1997; Nikolaou et al., 2000; Nikolaou et al., 2001; Rodriguez et al., 2007). Cependant, aucune étude intensive et concentrée sur la saison estivale concernant l’occurrence des SPD dans les petits réseaux n’a été réalisée. Finalement, il existe des outils pour les petits systèmes afin d’estimer les besoins et les coûts liés à l’installation et à l’entretien des systèmes de traitements de l’eau et qu’il y a des indicateurs permettant d’évaluer la performance des petits réseaux de distribution (Coulibaly & Rodriguez, 2004; Dore et al., 2013). Cependant, aucun outil permettant d’orienter les décisions quant aux stratégies de suivi des SPD dans le temps et dans l’espace n’a été développé.
1 Dans cette thèse, le terme décomposition indique une décomposition chimique d’un composé, par hydrolyse par exemple, qui peut être affectée par les propriétés physico-chimiques de l’eau (pH, température, mesure de chlore résiduel libre, etc.) 2 Dans cette thèse, le terme biodégradation indique une décomposition d’un composé par l’activité de micro-organismes, par exemple par l’activité d’un biofilm.
Ainsi l’objectif de cette thèse de doctorat est de répondre à tous ces manques de connaissances sur l’évolution spatiale et temporelle des SPD, particulièrement les SPD non-réglementés, dans les petits réseaux de distribution d’eau potable. Pour arriver à cet objectif, cette étude se concentre successivement sur les quatre axes de recherche suivants:
- L’étude de la variabilité spatio-temporelle à long terme des SPD réglementés et non-réglementés dans l’eau potable de petits réseaux de distribution;
- le développement de modèles afin d’estimer l’occurrence des SPD non-réglementés dans l’eau potable de petits réseaux de distribution;
- l’étude de la variabilité spatio-temporelle à court terme des SPD réglementés et non-réglementés dans l’eau potable de petits réseaux de distribution; et,
- le développement d’un outil d’aide à la décision pour le suivi des SPD dans les petits réseaux de distribution Pour ce faire, deux campagnes d’échantillonnage ont été organisées entre 2010 et 2012 dans 25 petits réseaux, dont 14 dans la province de Québec (QC) et 11 dans la province de Terre-Neuve-et-Labrador (TN) (Annexe 1). Les principales caractéristiques des 25 petits réseaux étudiés sont répertoriées dans l’annexe 2.
Les réseaux ont été sélectionnés sur la base de ces six critères de sélection :
- la taille du réseau : les réseaux étudiés sont considérés comme des petits réseaux (caractérisé par une population desservie par le réseau de moins de 5 000 habitants pour Santé Canada et moins de 10 000 habitants pour USEPA), desservant des populations de moins de 6 200 habitants dans les municipalités québécoises et de moins de 2 200 dans celles de Terre-Neuve-et-Labrador,
- la nature de la source d’eau : tous les réseaux sont desservis par des eaux de surface,
- la nature du désinfectant : le chlore (ou la chloramine) doit être utilisé comme désinfectant primaire ou secondaire,
- la distance et l’accessibilité : les réseaux de Québec doivent se trouver à moins de deux heures de voiture de l’Université Laval. Les réseaux de Terre-Neuve-et-Labrador doivent être le plus proche possible de la route Transcanadienne afin que l’envoi des échantillons se fasse le plus rapidement possible,
- la disponibilité de l’opérateur de l’usine de traitement de l’eau, en particulier à Terre-Neuve-et-Labrador où ils étaient en charge de l’échantillonnage.
Lors de la première campagne, l’échantillonnage a été réalisé mensuellement entre septembre 2010 et octobre 2011 afin d’observer l’évolution temporelle des SPD sur l’année. Les SPD ont été mesurés à trois différentes localisations dans le réseau (début, milieu et fin de réseau). Cette première campagne se concentrait sur l’évolution à long terme des concentrations en SDP. Afin de compléter cette campagne et d’observer l’évolution à court terme des concentrations en SPD, une deuxième campagne a été organisée. Durant cette deuxième campagne (dans uniquement les trois réseaux de chaque province présentant les niveaux en SPD les plus élevés), un échantillonnage quotidien sur une durée d’un mois (en juillet 2012 à QC et août 2012 à NL) a été réalisé dans six localisations le long du réseau. Cette deuxième campagne a permis, de plus, d’étudier de façon détaillée l’évolution spatiale des SPD le long du réseau. Durant les deux campagnes, plusieurs indicateurs de précurseurs de SPD et d’autres paramètres de la qualité de l’eau ont été mesurés à l’eau brute et à chaque point d’échantillonnage le long du réseau. Au total, cinq familles de SPD ont été mesurées dans l’eau des réseaux à l’étude: les THM, les AHA, les HAN, les HC et les HNM. Les SPD étudiés sont principalement des sous-produits issus de la chloration car la majorité des réseaux étudiés utilisent le chlore comme désinfectant primaire et/ou secondaire. Les méthodes d’échantillonnage et d’analyses utilisées lors des deux campagnes sont fournies en annexe 3.
Cette thèse se compose de quatre chapitres correspondant chacun à un article scientifique. Le premier chapitre se concentre sur l’étude de la variabilité spatiale et temporelle des SPD réglementés et non-règlementés au cours de l’année dans les 25 petits réseaux à l’étude. Les variabilités spatiales des niveaux de SPD ont été étudiées. C’est-à-dire, les différences de niveaux de SPD mesurés entre les deux régions à l’étude (QC et TN) et entre les réseaux d’une même région ont été analysées ainsi que l’évolution temporelle au cours de l’année (selon les saisons). Pour la première fois à notre connaissance, l’occurrence spatiale et temporelle des SPD non-réglementés a été étudiée dans l'eau potable de plusieurs dizaines de petits réseaux sur la base d’un programme d'échantillonnage structuré.
La difficulté de développer et d’appliquer des méthodes analytiques capables d’analyser les SPD non-réglementés ainsi que les coûts d’analyse élevés sont en partie responsables du peu d’informations disponibles sur l’occurrence des SPD non-réglementés dans les petits réseaux d’eau potable. Le deuxième chapitre se concentre donc sur une méthode alternative aux analyses de laboratoire souvent coûteuses afin d’évaluer les niveaux en SPD non-réglementés dans l’eau potable des petits réseaux. Dans ce chapitre, des modèles sont développés afin d’estimer les niveaux des SPD non-réglementés. Pour cela, les paramètres les plus corrélés avec les concentrations des SPD non-réglementés ont tout d’abord été identifiés par des analyses de
corrélations bivariées. Ensuite, tous les paramètres pouvant influencer l’occurrence des SPD ont été réunis dans des modèles de régression pour estimer les concentrations de SPD non-réglementés. Pour la première fois, à notre connaissance, des modèles pour estimer les concentrations des SPD non-réglementés dans l’eau potable de petits réseaux ont été développés.
À la lumière de l’importante variabilité temporelle et spatiale des SPD dans les petits réseaux observée dans le premier chapitre, le troisième chapitre se concentre sur l’étude de cette variabilité mais, cette fois-ci, à court terme. Ainsi, le chapitre se concentre sur l’étude de la variabilité des SPD non-réglementés au cours de l’été, saison durant laquelle les concentrations et la variabilité des SPD sont globalement les plus importantes. Pour ce faire, la variabilité temporelle journalière des SPD (réglementés et non-réglementés) a été étudiée sur une période d’un mois. De même, la variabilité spatiale, sur de multiples points le long du réseau, de ces SPD a été analysée. A notre connaissance, c’est la première fois que la variabilité spatio-temporelle des SPD non-réglementés a été étudiée sur le court terme et à haute fréquence dans les petits réseaux de distribution d’eau potable.
Le quatrième chapitre résume toutes les connaissances accumulées sur l’étude de la variabilité spatiale et temporelle des SPD en un outil d’aide à la décision pour le suivi des SPD destiné aux petits réseaux. Cet outil constitue un guide dans la mise en place de la stratégie de suivi des SPD pour les petits réseaux. Il peut être utilisé pour identifier les meilleurs périodes et sites d’échantillonnage pour le suivi réglementaire des THM et des AHA (si un suivi est mis en place) et peut aussi être utilisé pour identifier les périodes et lieux dans le réseau de distribution où l’exposition de la population aux SPD non-réglementés est maximale. L’outil développé, peut être facilement utilisé par des petits réseaux car il ne nécessite qu’un suivi du chlore libre résiduel le long du réseau.
Bibliographie de l’introduction
Bove, F., Shim, Y., Zeitz, P., 2002. Drinking water contaminants and adverse pregnancy outcomes: a review. Environmental Health Perspective 110, 61-74.
Bull, R.J., Rice, G., Teuschler, L.K., 2009. Determinants of Whether or Not Mixtures of Disinfection By-Products are Similar. Journal of Toxicology and Environmental Health, Part A 72, 437-460.
Bull, R.J., Sanchez, I.M., Nelson, M.A., Larson, J.L., Lansing, A.J., 1990. Liver tumor induction in B6C3F1 mice by dichloroacetate and trichloroacetate. Toxicology 63 (3), 341-359.
Cedergren, M.I., Selbing, A.J., Löfman, O., Källen, B.A.J., 2002. Chlorination byproducts and nitrate in drinking water and risk for congenital cardiac defects. Environmental Research 2 (89), 124-130.
Charrois, J.W.A., Graham, D., Hrudey, S.E., Froese, K.L., 2004. Disinfection By-products in Small Alberta Community Drinking Water Supplies. Journal of Toxicology and Environmental Health, Part A 67, 1797-1803. Conseil de l’Union Européenne, 1998. Directive 98/83/CE relative à la qualité des eaux destinées à la consommation humaine.
Coulibaly, H.D., Rodriguez, M.J., 2004. Development of performance indicators for small Quebec drinking water utilities. Journal of Environmental Management 73, 243–255.
Davies, J.M., Mazumder, A., 2003. Health and environmental policy issues in Canada: the role of watershed management in sustaining clean drinking water quality at surface sources. Journal of Environmental Management 68, 273-286.
DeAngelo, A.B., Daniel, B.F., Most, B.M., Olson, G.R., 1996. The carcinogenicity of dichloroacetic acid in the male Fischer 344 rat. Toxicology 114 (3), 207-221.
DeAngelo, A.B., George, M.H., House, D.E., 1999. Hepatocarcinogenicity in the male B6C3F1 mouse following a lifetime exposure to dichloroacetic acid in the drinking water: dose – response determination and modes of action. Journal of toxicology and environmental health 58 (8), 485-507.
Department of health & human services USA, 2006. National Toxicology Program, Toxicology and carcinogenesis studies of bromodichloromethane in male F344/N rats and female B6C3F1 mice (drinking water studies). National toxicology program, Technical report series, Issue 321.
Dore, M.H.I., Singh, R.G., Achari, G., Khaleghi-Moghadam, A., 2013. Cost scenarios for small drinking water treatment technologies. Desalination and Water Treatment 51, 3628-3638.
Edwards, J.E., Henderson, S.B., Struck, S., Kosatsky, T., 2012. Characteristics of small residential and commercial water systems that influence their likelihood of being on drinking water advisories in rural British Columbia, Canada: a cross-sectional study using administrative data. Journal of Water and Health 10 (4), 629-649.
Environmental Protection Agency, USEPA, 1998. National Primary Drinking Water Regulations: Disinfectants and Disinfection Byproducts; Final Rule. Federal Register 63 (241).
Environmental Protection Agency, USEPA, 2001. Toxicological review of chloroform.
Environmental Protection Agency, USEPA, 2006a. Initial distribution system evaluation guide for systems serving fewer than 10,000 people for the final stage 2 disinfectants and disinfection byproducts rule, Washington, DC, US.
Environmental Protection Agency, USEPA, 2006b. National Primary Drinking Water Regulations: Stage 2 Disinfectants and Disinfection Byproducts Rule. Federal Register 71 (2).
Giller, S., Le Curieux, F., Erb, F., Marzin, D., 1997. Comparative genotoxicity of halogenated acetic acids found in drinking water. Mutagenesis 12 (5), 321-328.
Giller, S., Le Curieux, F., Gauthier, L., Erb, F., Marzin, D., 1995. Genotoxicity assay of chloral hydrate and chloropicrine. Mutation research letters 348 (4), 147-152.
Golfinopoulos, S.K., Nikolaou, A.D., Lekkas, T.D., 2003. The Occurrence of Disinfection By-Products in the Drinking Water of Athens, Greece. Environmental Science and Pollution Research 10 (6), 368-372.
Goslan, E.H., Krasner, S.W., Bower, M., Rocks, S.A., Holmes, P., Levy, L.S., et al., 2009. A comparison of disinfection by-products found in chlorinated and chloraminated drinking waters in Scotland. Water Research 43, 4698-4706.
Hansen, K.M.S, Zortea, R., Piketty A., Rodriguez Vega, S., Rasmus Andersen, H., 2013. Photolytic removal of DBPs by medium pressure UV in swimming pool water. Science of the Total Environment 443, 850–856. Health Canada, 2008. Drinking water advisories in First Nations communities in Canada, Ottawa, Ontario, CANADA.
Health Canada, 2012. Guidelines for Canadian Drinking Water Quality.
Hebert, A., Forestier, D., Lenes, D., Benanou, D., Jacob, S., Arfi, C., et al., 2010. Innovative method for prioritizing emerging disinfection by-products (DBPs) in drinking water on the basis of their potential impact on public health. Water research 44, 3147-3165.
Hrudey, S.E., 2009. Public health wonder or unwitting vector of disease: the challenge of delivering safe supplies. Reviews in Environmental Science and Bio/Technology 8 (3), 235-237.
Hrudey, S. E., 2008. Safe water? Depends on where you live! Canadian Medical Association Journal 178 (8), 975.
Hu, J., Song, H., Addison, J.W., Karanfil, T., 2010. Halonitromethane formation potentials in drinking water. Water research 44, 105-114.
International Agency for Research on Cancer, 1991. IARC Monographs on the evaluation of carcinogenic risks to humans: chlorinated drinking-water; chlorination by-products; some other halogenated compounds; cobalt and cobalt compounds, Lyon, FRANCE
International Agency for Research on Cancer, 1999. Monographs on the evaluation of carcinogenic risks to humans: some chemicals that cause tumours of the kidney or urinary bladder in rodents and some other substances, Lyon, FRANCE
International Agency for Research on Cancer, 1999. Re-evaluation of Some Organic Chemicals, Hydrazine and Hydrogen Peroxide. ARC Monograph on the Evaluation of the Carcinogenic Risks to Humans 71.
Jorgenson, T.A., Meierhenry, E.F., Rushbrook, C.J., Bull, R.J., Robinson, M., 1985. Carcinogenicity of chloroform in drinking water to male Osborne–Mendel rats and female B6C3F1 mice. Fundamental and applied toxicology 5 (4), 760-769.
Karanfil, T., Krasner, S.W., Westerhoff, P., Xie, Y., 2008. Disinfection By-Products in Drinking Water: Occurence, Formation, Health Effects and Control. Washington, DC: American Chemical Society.
Kargalioglu, Y., McMillan, B.J., Minear, R.A., Plewa, M.J., 2002. Analysis of the cytotoxicity and mutagenicity of drinking water disinfection by-products in Salmonella typhimurium. Teratogenesis, carcinogenesis, and mutagenesis 22 (2), 113-128.
Kot, M., Castleden, H., Gagnon, G.A., 2011. Unintended consequences of regulating drinking water in rural Canadian communities: examples from Atlantic Canada. Health & Place 17, 1030-1037.
Krasner, S.W, McGuire, M.J., Jacangelo, J.G., Patania, N.L, Reagan K.M., Aieta, E.M., 1989. The occurrence of disinfection by-products in US drinking water. Journal American Water Works Association 81, 41-53. Krasner, S. W., Weinberg, H. S., Richardson. S., Pastor, S.J., Chinn, R., Sclimenti, M.J., et al., 2006. Occurrence of a new generation of disinfection byproducts. Environmental Science & Technology 40, 7175-7185.
Kundu, B., Richardson S.D., Swartz P.D., Matthews P.P., Richard A.M., DeMarini, D.M., 2004. Mutagenicity in Salmonella of halonitromethanes: a recently recognized class of disinfection byproducts in drinking water. Mutation Research/Genetic Toxicology and Environmental Mutagenesis 562 (1-2), 39-65.
Lebel, G.L., Benoit, F.M., Williams, D.T., 1997. A one-year survey of halogenated disinfection by-products in the distribution system of treatment plants using three different disinfection processes. Chemosphere 34 (11), 2301-2317.
Liang, L., Singer, P.C., 2003. Factors influencing the formation and relative distribution of haloacetic acids and trihalomethanes in drinking water. Environmental Science & Technology 37 (13), 2920-2928.
Ministère du Développement Durable, de l'Environnement et de la Lutte contre les Changements Climatiques, MDDELCC, 2012. Réglement sur la qualité de l'eau potable, Annexe 1.3.
Melnick, R. L., Nyskaa, A., Fostera, P.M., Roycrofta. J.H., Kisslingb, G.E., 2007. Toxicity and carcinogenicity of the water disinfection byproduct, dibromoacetic acid, in rats and mice. Toxicology 230 (2-3), 126-136.
Mercier-Shanks, C., Sérodes, J.-B., Rodriguez, M.J., 2013. Spatio-temporal variability of non-regulated disinfection by-products within a drinking water distribution system Water Research 47, 3231-3243
Merlet, N., Thibaud, M., Dore, M., 1985. Chloropicrin formation during oxidative treatments in the preparation of drinkig water. The Science of the Total Environment 47, 223-228.
Mouly, D., Joulin, E., Rosin, C., Beaudeau, P., Zeghnoun, A., Olszewski-Ortar A., et al., 2010. Variations in trihalomethane levels in three French water distribution systems and the development of a predictive model. Water Research 44, 5168-5179.
Muellner, M.G., Wagner, E.D., McCalla, K., Richardson, S.D., Woo, Y.-T., Plewa, M.J., 2007. Haloacetonitriles vs. regulated haloacetic acids: are nitrogen-containing DBPs more toxic? Environmental Science & Technology 41, 645-651.
Muller-Pillet, V., Joyeux, M., Ambroise, D., Hartemann, P., 2000. Genotoxic activity of five haloacetonitriles: comparative investigations in the single cell gel electrophoresis (comet) assay and the ames fluctuation test. Environmental and Molecular Mutagenesis 36 (1), 52-58.
National Cancer Institute, 1976. Report on the carcinogenesis bioassay of chloroform.
Nieuwenhuijsen, M.J., Martinez, D., Grellier, J., Bennett, J., Best, N., Iszatt, N., et al., 2009. Chlorination disinfection by-products in drinking water and congenital anomalies: review and meta-analyses. Environmental Health Perspective 117 (10), 1486-1493.
Nikolaou, A.D., Golfinopoulos, S.K., Kostopoulou, M.N., Lekkas, T.D., 2000. Decomposition of dihaloacetonitriles in water solutions and fortified drinking water samples. Chemosphere 41, 1149-1154. Nikolaou, A.D., Lekkas, T.D., Kostopoulou, M.N., Golfinopoulos, S.K., 2001. Investigation of the behaviour of haloketones in water samples. Chemosphere 44, 907-912.
Organisation Mondiale de la Santé, OMS, 2011. Guidelines for drinking water quality, Geneva, SWITZERLAND Patrick, R.J., 2011. Uneven access to safe drinking water for First Nations in Canada: Connecting health and place through source water protection. Health & Place 17, 386-389.
Pérez Pavon, J.L., Herrero Martin, B., Garcia Pinto, C., Moreno Cordero, B., 2008. Determination of trihalomethanes in water samples: A review. Analytica Chimica Acta 629, 6-23.
Plewa, M. J., Wagner, E. D., Jazwierska, P., 2004. Halonitromethane Drinking Water Disinfection Byproducts: Chemical Characterization and Mammalian Cell Cytotoxicity and Genotoxicity. Environmental Science and Technology 38, 62-68.
Richardson, S.D., 2011. Disinfection byproducts: formation and occurrence in drinking water. The Encyclopedia of Environmental Health 2, 110-136.
Richardson, S.D., Plewa, M.J., Wagner, E.D., Schoeny, R., DeMarini, D.M., 2007. Occurrence, genotoxicity, and carcinogenicity of regulated and emerging disinfection by-products in drinking water: A review and roadmap for research. Mutation Research 636, 178–242.
Robinson, M., Bull, R.J., Olson, G.R., Stober, J., 1989. Carcinogenic activity associated with halogenated acetones and acroleins in the mouse skin assay. Cancer Letters 48 (3), 197-203.
Rodriguez, M.J., Sérodes, J.-B., 2001. Spatial and temporal evolution of trihalomethanes in three water distribution systems. Water Research 35 (6), 1572-1586.
Rodriguez, M.J., Sérodes, J.-B., Levallois, P., 2004. Behavior of trihalomethanes and haloacetic acids in a drinking water distribution system. Water Research 38, 4367-4382.
Rodriguez, M.J., Sérodes, J.-B., Levallois, P., Proulx, F., 2007. Chlorinated disinfection by-products in drinking water according to source, treatment, season, and distribution system. Journal of Environmental Engineering and Science 6, 355-365.
Rook, J.J., 1974. Formation of haloforms during chlorination of natural waters. Water Treatment Examination 23, 234-243.
Samadi, M.T., Nasseri, S., Mesdaghinea, A. R., Alizadehfard, M. R., 2009. Comparison of nanofiltration efficiency with GAC adsorption and air stripping processes for CHCl3 removal from Tehran drinking water. Journal of Water Supply: Research and Technology—AQUA 58 (4).
Schneider, M., Quistad, G.B., Casida, J.E., 1999. Glutathione activation of chloropicrin in the Salmonella mutagenicity test. Mutation Research/Genetic Toxicology and Environmental Mutagenesis 439 (2), 233-238. Singer, P.C., 1994. Control of disinfection by-products in drinking water. Journal of Environmental Engineering 120 (4), 727-744.
Singer, P.C., 2002. Occurrence of haloacetic acids in chlorinated drinking water. Water Science and Technology: Water Supply 2 (5-6), 487-492.
Smith, D.W., Guest, R.K., Svrcek, C.P., Farahbakhsh, K., 2006. Public health evaluation of drinking water systems for First Nations reserves in Alberta, Canada. Revue du génie et de la science de l'environnement, 5 (S1), S1-S17.
Speight, V., Singer, P.C., 2005. Association between residual chlorine loss and HAA reduction in distribution systems. Journal of American Water Works Association 97 (2), 82.
Tung, H.-H., Xie, Y.F., 2009. Association between haloacetic acid degradation and heterotrophic bacteria in water distribution systems. Water Research 43, 971-978.
Villanueva, C., Cantor, K.P., Grimalt, J.O., Malats, N., Silverman D., Tardon, A., et al., 2007. Bladder cancer and exposure to water disinfection by-products through ingestion, bathing, showering and swimming in pools. American Journal of Epidemiology 165, 148-156.
Villanueva, C.M., Kogenivas, M., Cordier, S., Templeton, M.R., Vermeulen, R., Nuckols, J.R., et al., 2014. Assessing exposure and health consequences of chemicals in drinking water: current state of knowledge and research needs. Environmental Health Perspectives 122 (3).
White, D.M., Garland, S.D., Woolard, C.R., Narr, J., 2007. Investigations into disinfection by-product formation and control for small drinking water systems in Northern Regions. Cold Region Engineering, 991-998.
Wobma, P., Pernitsky, D., Bellamy, B., Kjartanson, K., Sears, K., 2000. Biological filtration for ozone and chlorine DBP removal. Ozone Science & Engineering 22, 393-413.
Ye, B., Wang, W., Yang, L., Wei, J., Xueli, E., 2009. Factors influencing disinfection by-products formation in drinking water of six cities in China. Journal of Hazardous Materials 171, 147-152
Chapitre 1
Occurrence of regulated and non-regulated
disinfection by-products in small drinking water
systems
Abstract
The occurrence of regulated and non-regulated disinfection by-products (DBPs) was investigated in the drinking water of small systems in two provinces in Canada, Newfoundland and Labrador (NL) and Quebec (QC), through an intensive sampling program. Sixteen DBPs were studied: four trihalomethanes (THMs), five haloacetic acids (HAAs), four haloacetonitriles (HANs), one halonitromethane, chloropikrin (CPK) and two haloketones (HKs). Average measured concentrations of these compounds were much higher than those reported in the literature for medium and large systems. The measured average value for THMs was 75 µg/L (Stdv = 69 µg/L); HAAs, 77 µg/L (Stdv = 75 µg/L); HANs, 2.5 µg/L (Stdv = 1.8 µg/L); CPK, 0.4 µg/L (Stdv = 0.3 µg/L) and HKs, 6.0 µg/L (Stdv = 4.5 µg/L). The gap (some 10 times difference) between the average levels of regulated DBPs (THMs, HAAs) and non-regulated DBPs (HANs, CPK and HKs) is comparable to that observed in large systems where the occurrence of the same compounds has been reported. Generally, investigated DBPs followed a comparable seasonal evolution during the year: they decreased between the fall and winter and then increased to eventually reach a maximum in late summer. This trend was less observable in NL than in QC. However, observed seasonal fluctuations of DBPs were less considerable than those observed in medium and large systems located in similar temperate environments reported in the literature. Spatial variations from the plant to the extremities were high and comparable to those observed in large systems, which is surprising, considering the smaller size of distribution networks supplying small communities. Generally speaking, the results support the premise that problems associated with implementing treatment that removes DBP precursors in water submitted to chlorination can increase population exposure to these contaminants in small systems.
Keywords: Small systems, disinfection by-products, drinking water, haloacetic acids, trihalomethanes;
non-regulated DBPs
Résumé
L’occurrence des sous-produits de la désinfection (SPD) réglementés et non-réglementés a été étudiée dans l'eau potable de petits réseaux de deux provinces du Canada, Québec (QC) et Terre-Neuve-et-Labrador (TN), grâce à un programme d'échantillonnage intensif. Seize SPD ont été étudiés: quatre trihalométhanes (THM), cinq acides haloacétiques (AHA), quatre haloacétonitriles (HAN), un halonitrométhane, la chloropicrine (CPK)