>Dans le cerveau adulte des mammifères, deux zones neurogéniques persistent tout au long de la vie: la zone sous-granulaire (ZSG) du gyrus dentelé et la zone sous-ventriculaire (ZSV), située sur les parois des ventricules latéraux. Dans l’hippo-campe, la ZSG produit des cellules qui se différencient en cellules granulaires (neu-rones glutamatergiques) [1]alors que la ZSV fournit les interneurones (neurones essentiellement GABAergiques) destinés à peupler le bulbe olfactif (BO) [2]. Une des différences principales qui distingue ces deux zones neurogéniques repose sur la distance de migration. Celle-ci est quasi nulle (environ 100 µm) dans l’hippocampe alors qu’elle est très importante et com-plexe dans le cas de la neurogenèse bul-baire (2 à 3 mm séparent la ZSV du BO, chez la souris). Pour atteindre le BO, les neuroblastes doivent d’abord emprunter un trajet qualifié de «tangentiel » (c’est-à-dire parallèle à la surface du cerveau) le long d’un chemin nommé «courant de migration rostrale» (CMR). Les neuro-blastes migrent en chaînes, liés les uns aux autres par des interactions de type «homophilique». À l’arrivée dans le BO, les cellules se détachent des chaînes pour se réorienter (changement à 90 degrés) et entamer leur ascension pour atteindre leur site final d’intégration. Cette migration perpendiculaire à la surface cérébrale est qualifiée alors de «radiaire». Dans notre laboratoire, nous nous intéressons aux mécanismes génétiques et épigénétiques qui gouvernent cette neurogenèse chez l’adulte [3]. Au sein du système ZSV-BO, le terme «neurogenèse» comprend quatre phases indépendantes les unes des autres: la prolifération, la migration, la
survie et la différenciation des cellules nouvelles en
véritables neurones [4]. Alors que les mécanismes qui régissent la prolifération, la migration tangentielle et la survie des néo-neurones ont été bien étudiés, on ne savait pas jusqu’à présent quels disposi-tifs sous-tendent le brusque passage d’une migration tangentielle à la migra-tion radiaire dès l’entrée des neuroblastes dans le BO. Comme la glie radiaire est absente chez l’adulte, nous avons pensé qu’il pouvait exister dans cette région cible, une molécule extracellulaire jouant un rôle attracteur des neuroblastes depuis le cœur du BO vers les zones plus superfi-cielles.
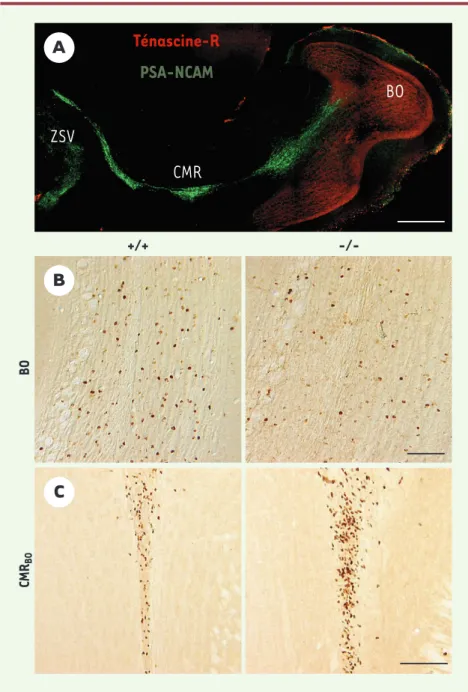
Nous avons observé que l’expression de la Ténascine (la forme R), une glycoprotéine de la matrice extracellulaire, était res-treinte à la couche de neurones qui recouvre le CMR présent dans le BO des souris adultes [5]. Or, cette couche cellu-laire est précisément le lieu où s’opère la réorientation des cellules migrantes (Figure 1A). Ce profil d’expression faisait de la Ténascine-R un candidat de choix dans notre recherche d’un facteur assu-rant la migration radiaire. Pour étudier précisément l’implication potentielle de cette molécule pour la neurogenèse bul-baire, nous avons utilisé des souris défi-cientes pour la Ténascine-R et comparé les résultats avec nos observations réali-sées à partir de leurs congénères sau-vages. La première expérience a consisté à administrer le 5-bromo-2’-désoxyuri-dine (BrdU, un analogue de la thymi5-bromo-2’-désoxyuri-dine qui se fixe dans l’ADN des cellules en phase S de mitose) aux deux groupes de souris puis de les sacrifier trois semaines
plus tard. Cette durée est suffisante pour que les cellules marquées essen-tiellement dans la ZSV (zone proliférative) puis-sent migrer, atteindre leur destination finale avant d’être éliminées pour certaines ou se dif-férencier en neurones pour d’autres. Ce protocole donne donc une idée de l’effet de la suppression de la Ténascine-R sur les quatre phases précédemment défi-nies. Sur des coupes coronales de BO des souris déficientes pour la Ténascine-R, nous avons observé une diminution de 40 % de la densité de « nouvelles » cellules (Figure 1B). Cette réduction peut traduire quatre dysfonctionnements chez les ani-maux mutants : (1) une prolifération plus faible ; (2) un défaut de migration tan-gentielle ; (3) une migration radiaire altérée ; et/ou (4) une survie réduite des néo-neurones. Nous avons donc voulu tester séparément ces quatre hypothèses. En sacrifiant les souris quelques heures après l’injection de BrdU, ce protocole révèle essentiellement les cellules sur leur site de prolifération. Dans ce cas, nous n’avons observé aucune différence dans la densité de cellules nouvellement pro-duites dans la ZSV. Ce résultat montre que la prolifération reste normale en l’absence de Ténascine-R.
In vitro, la vitesse de migration tangen-tielle a été évaluée en mesurant la lon-gueur des chaînes de neuroblastes quit-tant un explant de ZSV cultivé dans du Matrigel. Celle-ci ne change pas quel que soit le génotype de la souris. De plus, après un marquage anti-PSA/NCAM (poly-sialyl neural cell adhesion molecule) de coupes cérébrales, nous n’avons relevé aucune différence dans l’organisation cyto-architecturale de la ZSV et du CMR, sièges de la migration tangentielle. Après avoir éliminé l’hypothèse d’un
M/S n° 6-7, vol. 20, juin-juillet 2004
620
La Ténascine : une molécule clé
pour recruter les néo-neurones
chez l’adulte
Antoine de Chevigny, Pierre-Marie Lledo
NOUVELLE
Laboratoire Perception et Mémoire Olfactive, CNRS URA 2182, Institut Pasteur, 25, rue du Docteur Roux, 75015 Paris, France. pmlledo@pasteur.fr
défaut dans la prolifération ou la migration tangentielle, il nous restait à trancher entre celles d’une survie ou
d’une migration radiaire altérées chez les souris Ténascine-R-/-. Nous avons éliminé l’hypothèse d’une diminution de
la survie cellulaire chez les souris Ténascine-R-/-, suggérant ainsi que la diminution de la neurogenèse résultait d’un déficit en migration radiaire. En toute logique, la réduction du nombre de « nouvelles » cellules arrivant chaque jour dans le BO adulte devait s’accompagner d’une accumulation de ces mêmes cellules en fin de migration tangentielle. En adaptant le protocole de BrdU afin de révéler principalement les neuroblastes dans la partie la plus rostrale du CMR (c’est-à-dire dans le cœur du BO nommé CMRBOpour CMR du
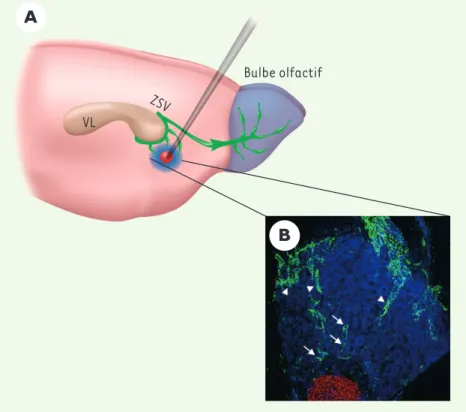
BO) (Figure 1C), nous avons constaté une augmentation significative de la densité de cellules BrdU-positives dans le CMRBOaccompagnée d’une réduction de cette même densité dans les couches bulbaires (Figure 1B). Il y a donc bien accumulation de cellules en fin de migration tangentielle, confirmant ainsi le déficit de migration radiaire chez les souris Ténascine-R-/-[5]. Par la suite, nous avons voulu identifier plus précisément par quel mécanisme agissait la Ténascine-R : était-ce un signal de détachement, un signal stop pour la migration tangentielle, une molécule permissive et/ou attractive pour les neuroblastes dans le BO ? Dans des cultures d’explants de ZSV réalisées en présence ou non de Ténascine-R, le nombre de cellules individualisées est doublé en présence de Ténascine-R, indiquant le rôle de la Ténascine-R dans le désassemblage des chaînes de neuro-blastes. Nous avons également testé si la Ténascine-R pouvait exercer un rôle attractif. Pour cela, nous avons greffé des agrégats de cellules transfectées ou non avec l’ADNc codant pour la Ténascine-R, au sein de deux régions cérébrales : le striatum et le cortex (Figure 2). À notre grande surprise, nous avons constaté que la Ténascine-R libé-rée par les cellules greffées était suffi-sante pour dévier les néo-neurones de leur chemin migratoire normal et les attirer dans ces deux régions. Cette expérience ne permet toutefois pas de savoir si l’action de la Ténascine-R est
N
O
U
V
E
L
L
E
S
M
A
G
A
Z
IN
E
621 M/S n° 6-7, vol. 20, juin-juillet 2004Figure 1.Rôle clé de la Ténascine-R dans la migration radiaire des néo-neurones du bulbe olfac-tif adulte. A. Coupe sagittale de cerveau antérieur. La Ténascine-R (rouge) est restreinte à la couche granulaire du BO. Elle reste absente dans la ZSV et tout le long du CMR marqués par un anticorps dirigé contre PSA/NCAM (vert). B.Noyaux BrdU-positifs dans la couche granulaire des souris+/+(gauche) et Ténascine-R-/-(droite) sacrifiées 21 jours après l’injection de BrdU. On observe une diminution drastique chez les mutants. C.Coupes de BO de souris+/+(gauche) et
Ténascine-R-/-(droite), sacrifiées 2 jours après l’injection de BrdU. Noter l’accumulation de
noyaux BrdU-positifs dans le CMRBO(en fin de migration tangentielle) des souris Ténascine-R-/.
Échelles :A, 500 µm ;B, C, 100 µm. BO : bulbe olfactif ; CMR : courant de migration rostrale ; CMRBO: courant de migration rostrale du bulbe olfactif ; ZSV : zone sous-ventriculaire.
une réelle attraction ou si elle permet de réunir les conditions favorables à la migration radiaire. Elle permet néan-moins de conclure que la Ténascine-R est nécessaire et suffisante pour acheminer les néoneurones vers sa source de pro-duction.
Pour finir, nous nous sommes demandés si la fonction de la Ténascine-R dans la migration radiaire pouvait être modulée par l’activité sensorielle. Nous avons montré, lors d’une précédente étude, que le degré d’activité bulbaire influen-çait directement le nombre de néo-neu-rones atteignant les différentes couches bulbaires. Nous avons donc avancé l’hy-pothèse suivante : la sécrétion plus ou moins importante de Ténascine-R pour-rait dépendre du degré d’activité du BO. Ce mécanisme d’homéostasie permet-trait d’ajuster le nombre de néo-neu-rones nécessaires pour que le traitement de l’information reste toujours aussi efficace alors que le niveau d’activité des entrées sensorielles s’accroît. Afin de tester cette hypothèse, nous avons réalisé une privation sensorielle par occlusion unilatérale d’une narine (le BO est le premier relais qui reçoit directe-ment l’information des neurones senso-riels situés dans la cavité nasale). Nous avons alors noté une réduction significa-tive du taux de l’ARNm codant pour la Ténascine-R et de la protéine même, dans le BO connecté à la narine occluse. Cette observation prouve que l’expres-sion de la Ténascine-R est dépendante du degré d’afférences sensorielles attei-gnant le BO. Elle montre également que lorsque l’activité bulbaire est réduite, cela se traduit par un déficit en migra-tion radiaire.
Ce travail prouve que la Ténascine-R est un médiateur important qui relie l’acti-vité des réseaux neuronaux au recrute-ment des neurones nouvellerecrute-ment
géné-rés. Nous cherchons actuellement les implications possibles de l’expression plus ou moins importante de Ténascine-R pour certaines formes d’apprentissage et de mémoire olfactive. Gageons que cette molécule recèle encore quelques surprises !◊
tenascin-R fosters radial migration of neuroblasts in the adult forebrain
M/S n° 6-7, vol. 20, juin-juillet 2004
622
Figure 2. Pouvoir attractif de la Ténascine-R.L’expression ectopique de Ténascine-R suffit pour attirer les nouveaux neurones. A. Vue sagittale de cerveau. En vert, les neuroblastes en migra-tion. Un agrégat cellulaire (rouge) exprimant la Ténascine-R a été greffé dans le striatum. La protéine sécrétée dans l’espace extracellulaire apparaît ici en bleu. Noter que les neuroblastes quittent leur chemin de migration normal pour se diriger ver le halo de Ténascine-R. B.
Immunofluorescence montrant à un plus fort grossissement les neuroblastes (en vert, marquage au PSA-NCAM) attirés par le halo de Ténascine-R (bleu) libérée par la greffe (rouge). Les flèches montrent des neuroblastes individualisés en migration alors que les têtes de flèches désignent des chaînes de neuroblastes migrant les uns sur les autres. VL : ventricule latéral ; ZSV : zone sous-ventriculaire.
RéféREnCES
1.Gage FH. Neurogenesis in the adult brain. J Neurosci 2002 ; 22 : 612-3.
2.Alvarez-Buylla A, Garcia-Verdugo JM. Neurogenesis in adult subventricular zone. J Neurosci 2002 ; 22 : 629-34.
3.Gheusi G, Lledo PM. Olfactory processing in a changing brain. Neuroreport 2003 ; 14 : 1655-63. 4.Brazel CY, Romanko MJ, Rothstein RP, Levison SW.
Roles of the mammalian subventricular zone in brain development. Progress in Neurobiology 2003 ; 603 : 1-21.
5.Saghatelyan A, DeChevigny A, Schachner M, Lledo PM. Tenascin-R fosters radial migration of neuroblasts in the adult forebrain. Nat Neurosci 2004; 7: 347-56.