© Mariana De Moraes Pontual, 2020
Exposition au mercure via la chaîne alimentaire au
Nunavik: Tendances géographiques et temporelles chez
les femmes enceintes
Mémoire
Mariana De Moraes Pontual
Maîtrise en santé publique - avec mémoire
Maître ès sciences (M. Sc.)
Exposition au mercure via la chaîne alimentaire au
Nunavik :
Tendances géographiques et temporelles chez les
femmes enceintes
Mémoire
Mariana de Moraes Pontual
Sous la direction de :
ii
Résumé
En Arctique, les populations autochtones vivent de la consommation de mammifères marins et de poissons et peuvent être exposées à des doses élevées de méthylmercure (MeHg). Par ailleurs, puisque la disponibilité des espèces concernées varie au fil des mois, tout porte à croire que l’exposition au MeHg change aussi d’un mois à l’autre. Il existe encore d’importantes lacunes dans les connaissances quant aux variations géographiques et temporelles de l’exposition au MeHg et quant aux aliments responsables de celles-ci, surtout pour ce qui est de l’exposition chronique et à de plus faibles doses chez les femmes enceintes au Nunavik. Plusieurs résultats de l’Étude sur le développement de l’enfant au Nunavik (EDEN) montrent que la vie fœtale est un moment crucial pour prévenir l’exposition au MeHg afin d’éviter plusieurs effets neurologiques qui se répercutent jusque tard dans l’enfance. En conséquence, en 2011, la Régie régionale de la santé et des services sociaux du Nunavik (RRSSSN) a publié et diffusé un message recommandant aux femmes enceintes et en âge de procréer de réduire leur consommation de viande de béluga. L’objectif de la présente étude était de caractériser les variations géographiques et temporelles de l’exposition au MeHg chez les femmes Inuit durant la grossesse et mieux identifier les aliments traditionnels responsables de ces variations.
Cette étude transversale réalisée d’octobre 2016 à mars 2017 visait les femmes enceintes âgées de 16 ans et plus au Nunavik. Les femmes ont été recrutées sur une base volontaire et des échantillons sanguins et de cheveux ont été collectés. Un questionnaire administré lors d’un entretien a été utilisé pour recueillir des informations sur la grossesse, la fréquence de consommation des aliments traditionnels par saison et la sensibilisation aux messages de santé publique. Le Hg total dans le sang a été mesuré par spectrométrie de masse avec plasma à couplage inductif (ICP-MS). Dans les cheveux, le Hg total a été analysé par spectrométrie d’absorption atomique à vapeur froide (CV-AAS), ceci par centimètre (cm) pour évaluer l’exposition mensuelle et rétrospective au mercure (Hg). Des analyses de régressions multiples ont été effectuées afin d’évaluer la variation saisonnière et régionale des niveaux de Hg. Une analyse de classes latentes a été réalisée afin d’identifier les femmes enceintes présentant des trajectoires mensuelles similaires des variations de niveaux de Hg dans les cheveux au fil du temps. Basé sur les concentrations de MeHg dans les aliments traditionnels et la fréquence de consommation de ces aliments, l’apport moyen en MeHg par saison a été estimé.
Au final, 97 femmes enceintes de 13 des 14 communautés du Nunavik ont été recrutées. Plus de 23% des participants avaient des concentrations sanguines de Hg supérieures à la recommandation de Santé Canada (≥ 8 µg/L) au moment du recrutement (automne 2016 - hiver 2017). Alors qu’aucune différence régionale des concentrations de Hg dans le sang et dans les cheveux n’a été constatée pendant cette période, les analyses séquentielles de Hg dans les cheveux ont révélé d’importantes variations mensuelles de l’exposition au Hg : les concentrations de Hg étaient plus élevées durant les mois d’été (p < 0.05) et plus basses durant ceux de l’hiver (p < 0.001). Trois classes latentes (groupes) de femmes enceintes avec des trajectoires similaires de variations mensuelles de Hg dans les cheveux ont été identifiées : variation élevée (n = 20; 22%), variation modérée (n = 38; 41%) et faible variation au fil des mois (n = 35; 38%). La viande de béluga était l’aliment traditionnel contribuant globalement à la plus grande proportion de l’apport quotidien en MeHg au sein de chaque groupe de femmes enceintes et durant chaque saison, mais principalement en été. La consommation de viande de béluga était également le seul aliment traditionnel associé au risque d’être classifié dans les groupes de variations mensuelles de Hg modérées et élevées (OR = 1,19 [1,01-1,39] d’être dans le groupe modéré par rapport au faible; OR = 1,25 [1,04 -1,50] d’être dans le groupe élevé par rapport au faible). Un peu plus du tiers
iii
(35%) des femmes enceintes avait déjà entendu le message de santé publique recommandant de réduire leur consommation de viande de béluga durant leur grossesse.
Notre étude montre une exposition élevée au MeHg chez les femmes enceintes du Nunavik, particulièrement en été, et que la consommation de viande de béluga est la principale source d’exposition au MeHg chez ces femmes. Nos résultats soulignent également l’importance de documenter les variations saisonnières de la consommation d’aliments traditionnels avant de mener des études de biosurveillance pour évaluer de manière plus adéquate l’exposition au MeHg sur une base annuelle. Compte tenu de la prévalence élevée d’insécurité alimentaire au Nunavik et du rôle central que jouent les aliments traditionnels dans la culture et pour le statut nutritionnel des Inuit, une approche plus consolidée avec les professionnels de la santé locaux et des conseils alimentaires ciblés à l’approche de l’été et dans les villages où la viande de béluga est souvent consommée peuvent être des avenues prometteuses pour prévenir l’exposition au MeHg tout en faisant la promotion des aliments traditionnels pour des grossesses et des enfants en santé au Nunavik.
iv
Abstract
In the Arctic, indigenous populations living off marine mammals and fish consumption may be exposed to high doses of methylmercury (MeHg). Furthermore, since their availability varies over months, there is every reason to believe that exposure to MeHg also varies from month to month. There are still significant knowledge gaps with respect to geographic and temporal variations in MeHg exposure and about country foods responsible for MeHg exposure, particularly for pregnant women in Nunavik. Several findings from the Nunavik Child Development Study highlight that fetal life is a critical moment to prevent MeHg exposure in order to avoid neurodevelopmental outcomes later in childhood. Accordingly, in 2011, the Nunavik Regional Board of Health and Social Services (NRBHSS) released and disseminated a dietary recommendation for pregnant and childbearing age women to reduce their consumption of beluga meat. The aim of the present study was to characterize the geographic and temporal variations in MeHg exposure among Inuit women during pregnancy and to better identify country foods responsible for these variations.
This cross-sectional study was carried out with pregnant women aged 16 and over in Nunavik between October 2016 and March 2017. Pregnant women were recruited on a voluntary basis and blood and hair samples were collected. An interview-administered questionnaire was used to gather information on pregnancy, country food frequencies of consumption by season and awareness of public health messages. Blood total Hg was measured using Inductively coupled plasma mass spectrometry (ICP-MS). Hair total Hg was measured by centimeter as a surrogate for monthly exposure using Cold vapor atomic absorption spectrometry (CV-AAS). Multiple regressions analyses were done to assess the seasonal variation and the regional difference of mercury (Hg) levels. A latent class growth analysis was conducted to identify pregnant women with similar monthly trajectories in hair Hg levels over time. Based on the MeHg concentrations in country foods and consumption frequencies, their seasonal daily intake of MeHg was estimated.
In total, 97 pregnant women from the 13 of the 14 Nunavik communities were recruited. Up to 23% of participants had blood Hg levels above the Health Canada guideline (≥ 8 µg/L) at the recruitment time (Oct 2016 – March 2017). While no regional difference in hair and blood Hg were observed in this period, sequential Hg hair analyses show important monthly variations in Hg exposure over the past year as Hg hair concentrations were significantly higher in summer (p<0.05) and lower in winter (p<0.001). Three latent classes (groups) of pregnant women with similar trajectories of Hg hair monthly variations were identified: high variation (n=20, 22%), moderate variation (n=38, 41%) and low variation over time (n=35, 38%). Beluga meat was the country food generally contributing to most of daily MeHg intake within each group of pregnant women for all seasons, but primarily in the summer. Beluga meat intake was also the only country food associated to the odd of being classified into moderate and high hair Hg monthly variations groups (OR = 1.19 [1.01-1.39] for moderate versus low; OR = 1.25 [1.04 -1.50] for high versus low). Only one-third (35%) of pregnant women were aware of the public health message recommending to reduce their consumption of beluga meat.
Our study shows a high MeHg exposure among Nunavik pregnant women, particularly in the summer, and that beluga meat consumption was the primary source of exposure to MeHg among these women. This study also highlight the importance of documenting the seasonality in country foods consumption before conducting biomonitoring studies in order to more adequately assess MeHg exposure on an annual basis. Given the high prevalence of food insecurity in Nunavik and the central role that country foods play in the culture and nutritional status of Inuit, a more consolidated approach together with local health professionals and targeted dietary counselling as summer is coming and in villages where beluga meat is often consumed may be promising
v
avenues for preventing MeHg exposure while promoting traditional foods for healthy pregnancies and children in Nunavik.
vi
Table des matières
Résumé ... ii
Abstract ... iv
Liste des tableaux ... viii
Liste des figures ... ix
Liste des abréviations, sigles, acronymes ... x
Remerciements ... xi
Avant-propos ... xii
Introduction ... 1
Chapitre 1 - Recension des écrits ... 3
1.1 Le Mercure (Hg) ... 3
1.2 Le Hg dans l’environnement ... 3
1.3 Le Hg en Arctique et dans les aliments traditionnels Inuit ... 3
1.4 Valeurs de référence quant à l’exposition au MeHg et toxicocinétique du MeHg durant la grossesse ... 5
1.5 Les niveaux de MeHg chez les femmes en âge de procréer et enceintes de la région circumpolaire et ailleurs au Canada... 7
1.6 Les effets neurodéveloppementaux du MeHg sur le fœtus et l’enfant... 9
1.7 La consommation d’aliments traditionnels et l’exposition au MeHg au Nunavik………...……….10
1.7.1 Les préférences et les usages des aliments traditionnels et l’exposition au MeHg………11
1.7.2 Les variations régionales de la consommation d’aliments traditionnels et de l’exposition au MeHg..11
1.7.3 Les variations temporelles de la consommation d’aliments traditionnels et de l’exposition au MeHg ………...12
1.8 Les bioindicateurs d’exposition au Hg………..13
1.9 Les bénéfices des aliments traditionnels pour la grossesse et le développement de l’enfant………..….14
1.10 Activités de prévention concernant l’exposition au Hg chez les femmes enceintes ... 15
Chapitre 2 - Cadre conceptuel, hypothèses et objectifs de recherche ... 18
2.1 Cadre conceptuel ... 18
2.2 Hypothèses... 19
2.3 Objectif général et spécifique ... 19
Chapitre 3 – Méthode Générale ... 21
3.1 Contexte et devis d’étude ... 21
3.2 Population et échantillon ... 21
vii
3.4 Variables d’étude ... 23
3.5 Considérations éthiques ... 24
3.6 Analyses statistiques ... 24
Chapitre 4 : Exposure to mercury and consumption of country foods in Nunavik: Geographical and temporal trends among pregnant women ... 26
4.1 Résumé ... 27 4.2 Abstract ... 29 4.3 Introduction ... 31 4.4 Methods ... 32 4.5 Results ... 35 4.6 Discussion ... 42 4.7 Conclusion ... 45 4.8 Supplementary materials ... 47 Conclusion Générale ... 54 Bibliographie ... 58 Annexes ... 67
Annexe 1: message d’information sur le projet NQN ... 67
Annexe 2: formulaire d’information et consentement ... 68
Annexe 3: questionnaires ... 73
viii
Liste des tableaux
Tableau 1 – Concentration de MeHg dans les tissus des espèces animales de l’Arctique canadien ... 5
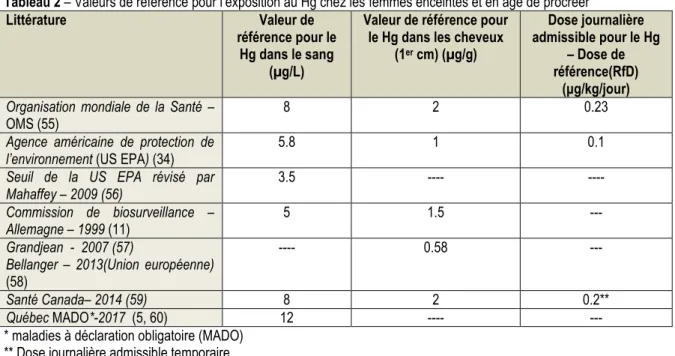
Tableau 2 – Valeurs de référence pour l’exposition au Hg chez les femmes enceintes et en âge de procréer .. 6
Tableau 3 – Les niveaux de Hg chez les femmes en âge de procréer et enceintes de la région circumpolaire et ailleurs au Canada ... 8
Tableau 4 – Nombre de femmes enceintes éligibles et recrutées au Nunavik entre Octobre 2016 et Mars 2017 ... 21
Tableau 5 : Échelle utilisée pour le questionnaire sur la consommation des aliments traditionnels ... 23
Tableaux dans le chapitre 4 _ Article:
Table 1: Descriptive table for participants and biomarkers of Hg exposure by region ……… 36Table 2: Seasonal Hair Hg variation ... 36
Table 3: Participants’ profile according to the three groups of hair Hg monthly variation trajectories identified using in the Latent Class Analysis ... 39
Table 4: Odds Ratios for the association between country food intake and the three groups of hair Hg monthly variation trajectories during the summer ... 41
Table S1: Typical country food portion size in Nunavik ... 47
Table S2: The concentration (µg/g, w.w.) of Hg in Inuit country foods harvested in Nunavik, QC ... 48
ix
Liste des figures
Figure 1 – Effet sauterelle (grasshopper effect) ... 4 Figure 2 – Concentrations de Hg sanguin chez les femmes en âge de procréer et enceintes de la région circumpolaire. ... 7 Figure 3 – Carte du Nunavik.. ... 12 Figure 4 – Cadre conceptuel représentant la problématique de recherche. ... 19
Figures dans le chapitre 4 – Article :
Figure 1 – Map of Nunavik. ... 32 Figure 2: Example of three participants’ hair Hg monthly profile from one village with one peak in MeHg exposure between September and June. ... 37 Figure 3: Example of two participants’ hair Hg monthly profile from another village with several peaks in MeHg exposure. ... 37 Figure 4: Latent classes of Hg hair exposition trajectories with 95% CIs (dashed lines) adjusted for age, hemoglobin and trimester of pregnancy.. ... 38 Figure 5: Average daily country food intake during summer within the three groups of hair Hg monthly variation trajectories identified in the Latent Class Analysis.. ... 40 Figure 6: Average MeHg intake by country food during summer within the three groups of hair Hg monthly variation trajectories identified in the Latent Class Analysis. ... 40 Figure 7: Average MeHg intake by country food during summer among participants reporting not to eat beluga meat in the summer by levels of hair Hg (n=33). ... 41 Figure 8: Percentage of awareness about health messages among pregnant women that participated in the project (n=93) ... 42 Figure S1: Average country food intakes by season and presented according to the three groups found in the Latent Class Growth Analysis ... 49 Figure S2: Average MeHg intakes by season and presented according to the three groups found in the Latent Class Growth Analysis. ... 51 Figure S3: Guide for the pregnant women in Nunavik developed by Ricard, S (Nunavik Regional Board of Health and Social Services).. ... 53
x
Liste des abréviations, sigles, acronymes
AMAP : Arctic Monitoring and Assessment Programme / Programme de surveillance et d'évaluation de l'Arctique (PSEA)
AM : Arithmetic mean BPC : Bisphényles polychlorés
CHU de Québec : Centre Hospitalier Universitaire de Québec CI : Confidence Intervals
cm : Centimètre
CTQ: Centre de toxicologie du Québec
CV-AAS: Cold vapor atomic absorption spectrometry / Spectrométrie d'absorption atomique à vapeur froid ECMS : Enquête canadienne sur les mesures de la santé
FFQ: Food frequency questionnaire /Questionnaire de fréquence alimentaire Fe : Fer
g : Gramme GM : Geometric mean Hg: Mercure
ICP-MS: Inductively coupled plasma mass spectrometry / Spectrométrie de masse à plasma à couplage inductif
INSPQ : Institut national de santé publique du Québec L : Litre
LD : Limit of detection /limite de détection
MADO : Maladies à déclarations obligatoires attribuables à un agent chimique ou physique MeHg : Méthylmercure
µg : Microgramme mg : Miligramme Kg : Kilogramme
NCDS: Nunavik Child Development Study / Étude sur le développement de l’enfant au Nunavik (EDEN) NHANES : National Health and Nutrition Examination Survey / Enquête sur la santé nationale et la nutrition NIP : Numéro d’identification personnel
NRBHSS: Nunavik Regional Board of Health and Social Services / Régie régionale de la santé et des services sociaux du Nunavik (RRSSSN)
NRC : Nunavik Research Centre OR : Odds ratio
POP : Polluants organiques persistants
pTDI: Provisional Tolerable Daily Intake / Dose journalière admissible temporaire (DJA) QI : quotient intellectuel
RRSSSN : Régie régionale de la santé et des services sociaux du Nunavik SAS: Statistical Analysis System
xi
Remerciements
Je voudrais remercier en premier lieu ma directrice de recherche, Prof. Mélanie Lemire, pour m’avoir accueillie au sein de son équipe de travail, ainsi que pour sa disponibilité, sa patience, son aide et ses critiques toujours constructives. Merci d’avoir cru en moi et de m’avoir soutenue, de m’avoir donné une chance même sachant que j’avais des difficultés dû au fait que le français n’est pas ma langue d’origine. Merci d’être cette personne qui ne voit pas la nationalité, la couleur ou la race, mais plutôt des étudiants qui veulent juste avoir la chance d’apprendre comme tout le monde. J’ai eu la chance de travailler sur un projet de recherche très intéressant et formateur qui m’a permis d’acquérir de bonnes bases en recherche. Je ne saurais assez remercier ma directrice pour son encadrement; elle a toujours voulu que je pousse mes réflexions et que j’avance dans ce projet. Son optimisme, dans mon parcours quelque peu parsemé d’embûches, a été une source de motivation tout au long de ma rédaction lorsque j’éprouvais certaines difficultés à respecter mon échéancier et à garder le moral. La finalisation de ce mémoire témoigne pour moi d’une victoire, en grande partie grâce à elle.
L’un des principaux avantages de ce projet est qu’il est réalisé avec plusieurs responsables de la santé publique au Nunavik. Il a eu des efforts soutenus pour diffuser les résultats de cette étude et promouvoir la sensibilisation des professionnels de la santé et de la communauté aux préoccupations de la contamination des aliments traditionnels par le mercure. J’aimerais exprimer ma gratitude à toutes ces personnes qui ont pris le temps de discuter de ce sujet. Chacun de ces échanges m’a aidé à faire avancer mon projet de recherche.
À Elhadji Anassour-Laouan-Sidi, un grand merci pour son aide avec les analyses statistiques. Je le remercie pour tous ses conseils et sa disponibilité tout le long de ce projet de maîtrise. Merci à Annie Turgeon qui a facilité mon intégration quand je suis arrivée dans l’équipe du projet. Je remercie aussi Gisèle Groleau, responsable de la formation pratique de la maîtrise en santé publique, qui m’a orientée et a démontré une très grande disponibilité tout au long de mon parcours universitaire.
Je remercie toutes les femmes enceintes qui ont participé à l’étude en donnant généreusement de leur temps. Sans elles, ce mémoire n’aurait pu être possible. Un merci aussi aux partenaires du projet, aux hôpitaux, aux centres de pratique de sage-femme et au Centre de recherche au Nunavik de la Société Makivik pour l’analyse du mercure dans les cheveux.
Merci à la Chaire de recherche Nasivvik sur les approches écosystémiques de la santé dans le Nord et au CHU de Québec pour les bourses de recherche et de diffusion des résultats qui m’ont été octroyées pendant mes études. Enfin, un remerciement spécial à ma famille, malgré la distance qui nous sépare, ainsi qu’à mon mari Rodrigo et à ma fille et source de joie, Alice, pour leur amour et leurs encouragements.
xii
Avant-propos
Ce mémoire a été rédigé par Mariana Pontual et est destiné à l’obtention d’une maîtrise en santé publique. Mariana a réalisé les analyses statistiques, l’interprétation des résultats, la rédaction du mémoire et d’un article scientifique sous la supervision de Mélanie Lemire, Ph.D., directrice de recherche et professeure adjointe au Département de médecine sociale et préventive et chercheure à l’Axe Santé des populations et pratiques optimales en santé du Centre de recherche du CHU de Québec. Dre Lemire a collaboré à toutes les étapes du projet, de sa conception à sa révision, et elle m’a aussi apporté une aide importante avec la correction, la validation des résultats et surtout pour la rédaction en français et en anglais.
Cette étude s’inscrit dans le cadre du projet « Nutaratsaliit qanuingisiarningit niqituinnanut - Pregnancy wellness with country foods - Grossesses en santé avec les aliments locaux », aussi appelé NQN, financé par le Programme de lutte contre les contaminants dans le Nord, des Affaires autochtones et du Nord Canada. Ce mémoire se compose d’un article scientifique (chapitre 4), écrit en anglais, qui contient les résultats de cette étude. Les autres parties de ce document sont en français et contiennent l’introduction, la recension des écrits, les objectifs de recherche, la méthodologie générale, ainsi qu’une conclusion générale.
L’article inséré dans ce document sera soumis prochainement pour publication dans la revue Science of the Total Environment ou bien International Journal of Circumpolar Health. L’article s’intitule « Exposure to mercury and consumption of country foods in Nunavik: Geographical and temporal trends among pregnant women ». Mariana Pontual est la première auteure. Cet article a pour coauteurs ma directrice de recherche Mélanie Lemire1. Certains coauteurs ont contribué à l’élaboration du projet NQN et des questionnaires : Pierre Ayotte1, 2, 3, Christopher Furgal4, Amanda Boyd5 et Gina Muckle1, 6. D’autres coauteurs ont participé à la réflexion quant au design du projet, l’interprétation des résultats et l’implication de cette recherche pour la santé publique : Ellen Avard7; Marie-Josée Gauthier8 et Sylvie Ricard8. Elhadji A. Laouan Sidi2 m’a aidé avec les analyses statistiques et a été responsable de la construction du modèle de trajectoires par classes latentes.
1 Chaire Nasivvik, Axe santé des populations et pratiques optimales en santé, Centre de recherche du CHU de Québec – Université Laval, Québec, QC, Canada.
2 Institut national de santé publique du Québec, Québec, QC, Canada. 3Département de médecine sociale et préventive, Québec, QC, Canada.
4 Indigenous Environmental Studies & Sciences Program, Trent University, Peterborough, ON, Canada. 5 Washington State University, Pullman, WA, United States.
6 École de psychologie, Université Laval, Québec, QC, Canada. 7 Nunavik Research Centre, Makivik Corporation, Kuujjuaq, QC, Canada. 8 Nunavik Regional Board of Health and Social Services, Kuujjuaq, QC, Canada.
1
Introduction
Le mercure (Hg) est un polluant environnemental largement répandu dans le monde qui est connu pour voyager aux pôles et s’accumuler sous forme de méthylmercure (MeHg) dans la chaîne alimentaire aquatique (1, 2).
En Arctique, de nombreuses communautés autochtones vivent en étroite relation avec la mer, les rivières et les lacs pour s’alimenter (3). Ces communautés nordiques présentent souvent des niveaux sanguins de MeHg plus élevés que d’autres populations plus au Sud et qui varient d’une région de l’Arctique à une autre selon les types et la fréquence des espèces aquatiques consommées (4, 5). Les Inuit du Nunavik sont parmi les plus exposés au MeHg au Canada et ailleurs dans le monde (1, 4, 6). En effet, en 2013, 38% des femmes enceintes Inuit au Nunavik présentaient des niveaux sanguins de Hg au-delà de la valeur de référence établie par Santé Canada (7), alors que la majorité (98%) des femmes âgées de 16 et 49 ans dans les grandes villes canadiennes présentait des niveaux sanguins en deçà de cette valeur (8, 9).
Les femmes enceintes et les enfants sont considérés comme un groupe particulièrement vulnérable à l’exposition au MeHg puisqu’il peut traverser les barrières placentaires et hématoencéphaliques (10-14). L’exposition chronique à de faibles concentrations de MeHg durant la vie fœtale est associée à plusieurs effets neurodéveloppementaux qui se répercutent jusque tard dans l’enfance, tels que des difficultés d’attention, de mémoire et de langage, et ceci au Nunavik et ailleurs dans le monde (15-19). L’exposition durant l’enfance est aussi associée à une diminution de la motricité fine chez les enfants Inuit (19). Pour cette raison, il est important que les femmes enceintes, les enfants et les femmes en âge de procréer soient, dans la mesure du possible, protégées de l’exposition au MeHg (20).
Au Nunavik, les principales sources connues de MeHg sont la viande de béluga, les organes de mammifères marins et la truite grise. Les viandes locales sont généralement consommées crues. Les Inuit mangent également de la viande séchée, par exemple celle de béluga et malheureusement ce processus d’évaporation de l’eau dans la viande accroît considérablement la concentration de MeHg dans cet aliment (21).
Il n’y a actuellement pas d’évidence que les niveaux de MeHg diminuent dans les écosystèmes Arctiques (22). Toutefois, entre 1992 et 2013, l’exposition maternelle au MeHg a diminué de 57% au Nunavik, essentiellement en lien avec la diminution de la consommation d’aliments traditionnels (7). Malgré cela, plus du tiers des femmes enceintes au Nunavik présentaient toujours une exposition élevée au MeHg en 2013 (7). Toutefois, puisque l’alimentation des Inuit varie en fonction des écosystèmes et des espèces disponibles où sont établis les villages, il existe une grande variation des niveaux d’exposition au MeHg d’un village à l’autre au Nunavik (21). En effet, des données de l’Enquête de santé Qanuippitaa? Comment allons-nous?, réalisée en 2004 au Nunavik montrent qu’à l’époque, la moitié des femmes en âge de procréer (50%) présentaient des niveaux sanguins élevés de MeHg, et que cette exposition était beaucoup plus élevée (78%) dans les villages de la région du Détroit d’Hudson, où se pratique fréquemment la chasse au béluga. Il semble aussi que la truite grise soit fortement consommée, surtout en hiver, dans d’autres villages du Nunavik, mais il n’existe à ce jour que peu de données qui confirment cette hypothèse. Par ailleurs, tout porte à croire que l’exposition au MeHg varie aussi fortement d’un mois à l’autre puisque les aliments locaux chassés, pêchés et consommés varient grandement au fil des saisons (20).
Il existe donc encore d’importantes lacunes quant à notre connaissance des variations géographiques (régions, villages) et temporelles (saisons, mois) de l’exposition au MeHg au Nunavik et quant aux aliments responsables de celles-ci (20, 23).
La mesure du Hg total dans le sang complet, qui représente l’exposition au cours des trois derniers mois, est le bioindicateur le plus souvent utilisé pour évaluer l’exposition au MeHg chez des femmes enceintes au sein
2
de populations qui vivent de la consommation de poissons (24). Toutefois, la mesure du Hg total dans les cheveux a aussi été déjà utilisée dans de nombreuses études et est reconnue comme un bon indicateur de l’exposition au MeHg de la mère et du fœtus (23, 25-30) qui est bien corrélé à l’alimentation de la mère et ses niveaux de Hg total dans le sang (25, 27). Par ailleurs, puisque les cheveux poussent d’environ 1 cm par mois, l’analyse de Hg total par cm de cheveux permet de reconstruire l’exposition moyenne passée au fil des mois précédant l’étude (25, 28, 31-35).
Hormis le MeHg dans certains aliments traditionnels, ceux-ci sont de qualité exceptionnelle et importants pour des grossesses et des enfants Inuit en santé. Pour ces raisons, il est important de bien caractériser l’exposition actuelle au MeHg chez les femmes enceintes et de mieux identifier les sources alimentaires locales et saisonnières de MeHg. Ces résultats permettront d’élaborer des stratégies de prévention de l’exposition au MeHg mieux adaptées à la réalité des différentes communautés tout en faisant la promotion des aliments locaux au Nunavik.
3
Chapitre 1 - Recension des écrits
1.1 Le Mercure (Hg)
Le Hg est un métal largement répandu dans le monde et ses effets sur la santé des écosystèmes et la santé humaine sont bien documentés (20, 36). Les conditions d’exposition et la toxicité chez l’humain sont étroitement liées à la forme chimique impliquée : le Hg élémentaire, le Hg inorganique et le Hg organique, dont le méthylmercure (MeHg) (22, 34, 37). Chez l’humain, puisque le MeHg est absorbé à pratiquement 100% au niveau de l’intestin s’il est retrouvé dans des aliments et puisqu’il peut traverser les barrières placentaires et hématoencéphaliques (11, 32, 34), il est connu comme la forme la plus toxique de Hg, en particulier pour le développement du fœtus (2, 34).
1.2 Le Hg dans l’environnement
Le Hg élémentaire est volatile et naturellement présent dans l’air, l’eau et les sols. Il est retrouvé en concentrations naturellement élevées dans la croûte terrestre. L’érosion des sols ainsi que l’activité volcanique contribuent à l’augmentation des concentrations naturelles de Hg dans les écosystèmes (32, 38).
Toutefois, l’activité humaine contribue également aux émissions de Hg (environ 30 %) (36). Du Hg inorganique peut être rejeté dans l’atmosphère comme un sous-produit de processus industriels tels que les émissions provenant de la combustion de charbon, de pétrole et des incinérateurs. L’orpaillage artisanal, la création de bassins hydro-électriques, la déforestation, l’exploitation de sables bitumineux et le bris d’ampoules fluocompactes et de thermomètres au Hg sont d’autres activités humaines qui contribuent à la remobilisation du Hg naturellement présent en concentrations élevées dans certains sols, aux émissions de Hg élémentaire et inorganique, et à l’augmentation des niveaux de Hg inorganique dans les rivières et les lacs (39, 40). Les émissions et les rejets de Hg d’origine anthropique ont doublé la quantité de Hg retrouvée dans les océans, les rivières et les lacs au cours des 100 dernières années (36). Une fois dans les écosystèmes aquatiques, le Hg inorganique est méthylé par les bactéries anaérobiques présentes dans les sédiments aquatiques et les racines des macrophytes, contribuant à la formation du MeHg (32, 38, 41).
Le MeHg possède une forte affinité pour les protéines et se bioaccumule tout au long de la vie des organismes aquatiques si l’apport en MeHg est constant dans l’écosystème. De plus, en raison du phénomène de bioamplification, sa concentration augmente au long de la chaîne trophique et est particulièrement élevée dans la chair des poissons piscivores et des mammifères marins (38).
Les émissions et les rejets de Hg d’origine anthropique ont mené à une accumulation considérable de Hg dans l’environnement, de sorte que les efforts nationaux et internationaux comme la nouvelle Convention de Minamata (42), visant à réduire l’utilisation et les émissions de Hg à l’échelle mondiale, prendront plusieurs années pour avoir un effet notable sur les niveaux de MeHg dans écosystèmes aquatiques et chez les populations humaines (36).
1.3 Le Hg en Arctique et dans les aliments traditionnels Inuit
Une grande quantité des polluants circulent dans le monde entier sous l’effet d’un phénomène appelé « effet sauterelle » (grasshopper effect). Le Hg fait partie de ce phénomène de distillation mondial qui transporte les émissions chimiques à partir de régions équatoriales, subtropicales et tempérées vers les régions polaires. Ce cycle répété d’évaporation, de transport et de condensation (Figure 1) permet au Hg d’être transporté sur de grandes distances et surtout de s’accumuler aux pôles sous forme de MeHg (43). Toutefois, il reste encore des incertitudes à propos du mécanisme détaillé et de l’étendue de ce phénomène (44).
4
L’effet sauterelle explique pourquoi des concentrations relativement élevées de Hg sont trouvées dans l’environnement Arctique, dans le biote marin et par conséquent dans l’organisme des personnes qui consomment les aliments locaux, même si aucune source majeure de Hg n’est retrouvée en Arctique (4, 36, 43).
Figure 1 – Effet sauterelle (grasshopper effect).Tiré du site internet Jocara Indian Ocean Quest (45).
Contrairement aux plus anciens contaminants organiques persistants (POP) comme les biphényles polychlorés (BPC) et les pesticides organochlorés, il n’y a actuellement pas d’évidence que le Hg diminue dans les écosystèmes nordiques (22). Une augmentation des niveaux de MeHg dans le béluga serait même observée dans l’ouest de l’Arctique. Il est présumé que cette différence est attribuable à la proximité de cette région aux principales sources d’émissions mondiales de Hg en Asie du Sud-Est, mais ceci reste à confirmer (22).
De plus, l’Arctique est particulièrement affectée par le réchauffement planétaire. En effet, le cycle biogéochimique du Hg peut être particulièrement sensible aux changements climatiques puisque le transport du Hg comprend des échanges entre l’air, l’eau, les sols, les sédiments et les biotes. En conséquence, les changements de température, de précipitations et de la couverture de glace pourraient entraîner une remobilisation du Hg dans les écosystèmes marins et terrestres, et aussi affecter sa volatilité, son dépôt et les échanges air-eau du Hg en l’Arctique (46, 47). De plus, selon Stern et coll. (2012), les changements climatiques augmenteraient également la méthylation du Hg en MeHg puisque l’activité des bactéries anaérobiques est généralement augmentée à des températures élevées. Toutefois, la déméthylation dans les sédiments est aussi un processus microbien qui augmente à une plus haute température et il n’est donc pas clair dans quelle mesure les changements de température influenceront ces processus (46). En résumé, selon l’état actuel des connaissances, il n’est pas possible de prédire avec certitude les effets positifs ou négatifs des changements sur les concentrations de MeHg dans les écosystèmes arctiques (46, 48). Or, les données longitudinales du Centre de recherche de Makivik au Nunavik confirment que les niveaux de Hg ne sont actuellement pas en diminution dans la chair des bélugas au Nunavik qui est localisé dans la portion est de l’Arctique canadien (Kwan, données non publiées).
Le tableau 1 présente les aliments traditionnels consommés au Nunavik selon leurs niveaux de MeHg et les concentrations recommandées par Santé Canada à cet effet (49). Il est important de noter que la grande majorité des espèces animales (et leur différentes parties consommées par les Inuit) sont faibles en MeHg. Au Nunavik, les aliments traditionnels les plus élevés en MeHg sont essentiellement la viande de béluga, les organes de mammifères marins et la truite grise. Les viandes locales sont généralement consommées crues. Les Inuit mangent également de la viande séchée, par exemple celle de béluga, et puisque le MeHg se lie aux protéines dans la viande, ce processus d’évaporation de l’eau accroît considérablement la concentration de MeHg dans cet aliment (21).
5
Tableau 1 – Concentration de MeHg dans les tissus des espèces animales de l’Arctique canadien*
*adapté de l’étude de Lemire et al., 2015 (21).
a basée sur la valeur de 12% de MeHg dans le Hg total. b basée sur la valeur de 25% de MeHg dans le Hg total. c basée sur la valeur de 26% de MeHg dans le Hg total. d basée sur la valeur de 8% de MeHg dans le Hg total. ebasée sur la valeur de 20% de MeHg dans le Hg total.
1.4 Valeurs de référence quant à l’exposition au MeHg et
toxicocinétique du MeHg durant la grossesse
À partir des études menées initialement à Minamata en 1957 (50) et en Irak en 1972 (51) et dans les vingt dernières années aux îles Féroé (52) et chez des populations autochtones au Canada (15, 16, 18, 19, 53, 54), différentes Organisations gouvernementales (OMS, US EPA, Santé Canada) ont tenté d’établir des valeurs de référence sécuritaires afin de protéger l’humain, en particulier le fœtus, contre les effets toxiques du MeHg
Concentration faible
(≤ 0.2 μg/g) Concentration moyenne (0.21– 0.50 µg/g) Concentration élevée (0.51 – 1.00 µg/g) Concentration très élevée (> 1 µg/g)
Poisson chaboisseau (Fourhorn sculpin)
0.18 µg/g
Foie de Caribou 0.49 µg/g
Viande crue de goélands argentés 1.00 µg/g Viande de béluga Séchée (nikku) 4.01 µg/g Crue, cuite ou surgelée 1.07 µg/g Viande crue d’eider à duvet
0.15 µg/g Peau de béluga 0.46 µg/g Rein de Caribou 0.86 µg/g Foie de béluga 1.22 µg/ga Poisson grand corégone
0.14 µg/g
Peau et graisse de béluga (mattaaq) 0.38 µg/g
Poisson doré jaune 0.86 µg/g
Foie de phoque annelé 2.73 µg/gb Viande crue de caribou
0.03 µg/g Viande crue de phoque 0.28 µg/g
Viande crue de plongeon huard 0.70 µg/g
Poisson truite grise 1.03 µg/g Poisson omble chevalier Cru 0.03 µg/g Poisson lotte
0.27 µg/g Poisson grand brochet 0.69 µg/g ---- Séché (pitsik)
0.13 µg/g Poisson omble de fontaine
0.11 µg/g
Rein de phoque annelé 0.23 µg/gc
Rein de béluga
0.52 µg/gd ---- Viande crue de morse
0.07 µg/g
Œufs d’eider à duvet
0.22 µg/g ---- ----
Graisse de béluga 0.07 µg/g
Œufs de goélands argentés
0.22 µg/g ----
Viande crue d’ours polaire
0.07 µg/g ---- ---- ----
Rein de morse
0.06 µg/ge ---- ---- ----
Poisson morue arctique (Artic cod)
0.06 µg/g ---- ---- ----
Poisson saumon atlantique
0.04 µg/g ---- ---- ----
Foie de Bernache du Canada 0.02 µg/g Graisse de phoque annelé et
de morse 0.01 µg/g
---- ---- ----
Moules bleues
6
(38). Le tableau 2 présente les valeurs mises de l’avant par différents pays et l’Organisation mondiale de la santé (OMS).
Tableau 2 – Valeurs de référence pour l’exposition au Hg chez les femmes enceintes et en âge de procréer
* maladies à déclaration obligatoire (MADO) ** Dose journalière admissible temporaire
En 1998, la Direction des aliments de Santé Canada a examiné de nouvelles études à la lumière desquelles elle a réduit la dose journalière admissible (DJA) du MeHg à 0,2 µg/kg poids corporel/jour pour les femmes enceintes, les femmes en âge de procréer et les jeunes enfants (5, 49). En 2003, l’OMS a proposé une valeur similaire à la DJA de Santé Canada de 0,23 µg/kg poids corporel/jour (5, 57). Les valeurs de référence présentées au Tableau 2 permettent aux chercheurs et aux cliniciens d’évaluer les risques individuels et de la population et servent de seuils pour les actions de santé publique (5). Toutefois, ils doivent être adaptés au contexte puisque certaines populations se nourrissent abondamment de poisson ou mammifères marins et que ces ressources représentent, à plusieurs égards, un excellent apport en nutriments. Par ailleurs, bien qu’il n’y ait aucun doute que l’exposition prénatale élevée au MeHg puisse interférer dans la croissance et la migration des neurones et ainsi causer des effets neurodéveloppementaux délétères, les concentrations seuil de MeHg qui peuvent affecter négativement le fœtus en développement sont mal connues (59).
Clarkson (2002) souligne que les niveaux de MeHg dans le sang de cordon ombilical du nouveau-né sont légèrement plus élevés que les niveaux dans le sang maternel (32), ceci en raison du phénomène de bioconcentration du MeHg à travers le placenta. En effet, les niveaux de Hg dans le sang de cordon sont en moyenne 1,7 fois plus élevés (42.5% plus élevé) que les niveaux de Hg dans le sang maternel (61, 62). En conséquence, Mahaffey, Clickner et Jeffries (2009) suggèrent de réviser le seuil de la US EPA de 5.8 à 3.5 µg/L puisque la valeur de référence de 5.8 µg/L est basée sur le sang du cordon ombilical et ne représente pas la valeur de MeHg dans le sang maternel dû au transport et à la concentration de MeHg à travers le placenta (56). Or, les résultats les plus récents de l’EDEN montrent d’ailleurs des effets néfastes de l’exposition prénatale au MeHg sur les fonctions cognitives des enfants Inuit à une concentration moyenne de 7.5 µg/L dans de cordon ombilical à la naissance, ce qui correspondrait à 4.4 µg/L dans le sang maternel selon la conversion proposée par Mahaffey et coll. (2009) (8, 18, 56).
Plusieurs études signalent que le trimestre gestationnel influence les niveaux de Hg retrouvés dans le sang de la femme enceinte au moment de la collecte. Des études rapportent une diminution significative des niveaux de Hg dans le sang de la femme enceinte lors du deuxième et troisième trimestre de gestation, même si
Littérature Valeur de
référence pour le Hg dans le sang
(µg/L)
Valeur de référence pour le Hg dans les cheveux
(1er cm) (µg/g) Dose journalière admissible pour le Hg – Dose de référence(RfD) (μg/kg/jour) Organisation mondiale de la Santé –
OMS (55) 8 2 0.23
Agence américaine de protection de
l’environnement (US EPA) (34) 5.8 1 0.1
Seuil de la US EPA révisé par
Mahaffey – 2009 (56) 3.5 ---- ----
Commission de biosurveillance –
Allemagne – 1999 (11) 5 1.5 ---
Grandjean - 2007 (57)
Bellanger – 2013(Union européenne) (58)
---- 0.58 ---
Santé Canada– 2014 (59) 8 2 0.2**
7
l’exposition au MeHg demeure la même tout au long de la grossesse (8, 23, 62). Arbukcle et coll. (2016) ont identifié une diminution significative de niveaux de Hg (0.12 μg/L) entre le premier et le troisième trimestre gestationnel (8). Ceci pourrait être expliqué par une augmentation du transfert placentaire du MeHg de la mère vers le fœtus au cours des trois derniers mois de la grossesse (23). Toutefois, Grandjean et Budtz-Jørgensen (2007) soulignent que ce phénomène serait aussi attribuable à une augmentation du volume sanguin chez la mère pendant la fin de grossesse, ce qui entraîne une diminution de l’hématocrite et des concentrations d’hémoglobine, et conséquemment une diminution de l’accumulation de MeHg chez la femme enceinte (le MeHg se lie à l’hémoglobine) pour une même exposition au MeHg (57).
De plus, contrairement à Mahaffey et al (2009), Grandjean et Budtz-Jørgensen (2007) soulèvent que la concentration de Hg dans le sang du cordon pourrait être jusqu’à 50% supérieure (2 fois plus élevé) à celle du sang chez la femme à l’accouchement et proposent une diminution de la valeur de référence pour le sang maternel de 5.8 µg/L à 2.9 µg/L (au lieu de 3.5 µg/L) (57).
Entre l’exposition et les effets toxiques éventuels du MeHg, de nombreuses barrières physiques, chimiques et biologiques ainsi que des phénomènes de détoxification, de biotransformation et d’élimination modulent l’action du MeHg sur les fonctions biologiques et rendent difficile d’établir la relation dose effet (34, 57). Par ailleurs, les effets associés à l’exposition au MeHg sont aussi modulés par une série d’autres facteurs comme la génétique, l’âge, le sexe, l’état de santé, les interactions entre les nutriments dans différents aliments et la période de grossesse durant laquelle la femme a été plus exposée (20, 35).
1.5 Les niveaux de MeHg chez les femmes en âge de procréer et
enceintes de la région circumpolaire et ailleurs au Canada
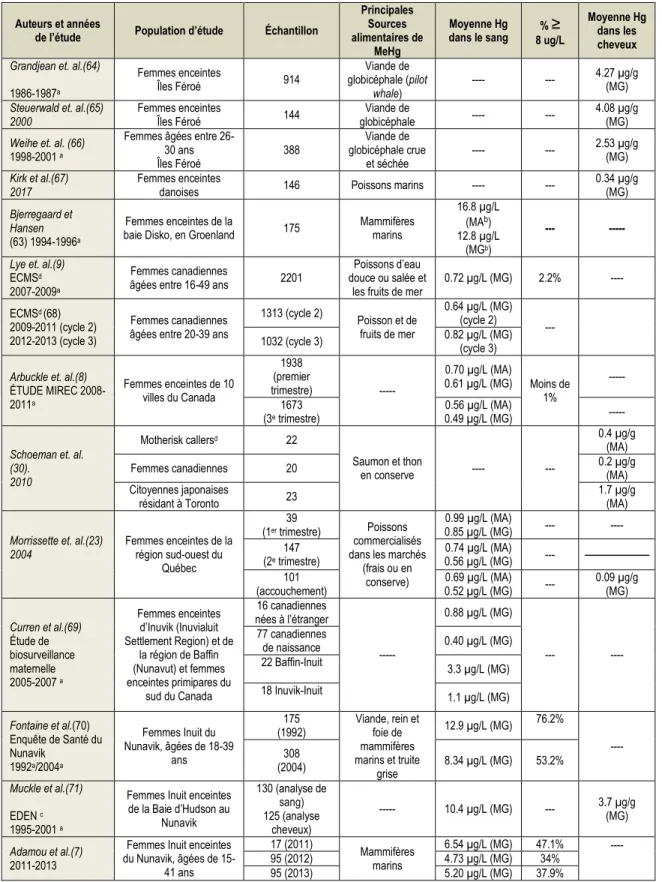
Les concentrations élevées de MeHg dans certains poissons et mammifères marins qui sont à la base de l’alimentation des Inuit et d’autres populations circumpolaires les amènent à être fortement exposées au MeHg (6). Ainsi, depuis les années 1990, plusieurs études ont été réalisées dans les régions circumpolaires afin de suivre l’évolution de l’exposition au MeHg au fil des années (figure 2), avec un focus chez les femmes enceintes et en âge de procréer. Ces résultats ainsi que ceux d’autres études ailleurs au Canada sont partiellement reproduits dans le tableau 3 (63).
Figure 2 – Concentrations de Hg sanguin chez les femmes en âge de procréer et enceintes de la région circumpolaire. Figure adaptée du PSEA 2015, tiré de AMAP (2015) (6).
8
Tableau 3 – Les niveaux de Hg chez les femmes en âge de procréer et enceintes de la région circumpolaire et ailleurs au Canada.
Auteurs et années
de l’étude Population d’étude Échantillon
Principales Sources alimentaires de
MeHg
Moyenne Hg
dans le sang 8 ug/L % ≥
Moyenne Hg dans les cheveux
Grandjean et. al.(64)
1986-1987a Femmes enceintes Îles Féroé 914 Viande de globicéphale (pilot whale) ---- --- 4.27 µg/g (MG)
Steuerwald et. al.(65)
2000 Femmes enceintes Îles Féroé 144 globicéphale Viande de ---- --- 4.08 µg/g (MG)
Weihe et. al. (66)
1998-2001 a
Femmes âgées entre 26-30 ans Îles Féroé 388 Viande de globicéphale crue et séchée ---- --- 2.53 µg/g (MG) Kirk et al.(67)
2017 Femmes enceintes danoises 146 Poissons marins ---- --- 0.34 µg/g (MG)
Bjerregaard et Hansen
(63) 1994-1996a
Femmes enceintes de la
baie Disko, en Groenland 175 Mammifères marins
16.8 µg/L (MAb)
12.8 µg/L (MGb)
--- ---
Lye et. al.(9)
ECMSd
2007-2009a
Femmes canadiennes
âgées entre 16-49 ans 2201
Poissons d’eau douce ou salée et
les fruits de mer 0.72 µg/L (MG) 2.2% ---- ECMSd (68)
2009-2011 (cycle 2) 2012-2013 (cycle 3)
Femmes canadiennes âgées entre 20-39 ans
1313 (cycle 2) Poisson et de fruits de mer 0.64 µg/L (MG) (cycle 2) --- 1032 (cycle 3) 0.82 µg/L (MG) (cycle 3)
Arbuckle et. al.(8)
ÉTUDE MIREC 2008-2011a Femmes enceintes de 10 villes du Canada 1938 (premier trimestre) --- 0.70 µg/L (MA) 0.61 µg/L (MG) Moins de 1% --- 1673 (3e trimestre) 0.56 µg/L (MA) 0.49 µg/L (MG) ---
Schoeman et. al. (30). 2010 Motherisk callersd 22 Saumon et thon en conserve ---- --- 0.4 µg/g (MA)
Femmes canadiennes 20 0.2 µg/g (MA)
Citoyennes japonaises
résidant à Toronto 23 1.7 µg/g (MA)
Morrissette et. al.(23)
2004 Femmes enceintes de la région sud-ouest du
Québec
39
(1er trimestre) Poissons
commercialisés dans les marchés
(frais ou en conserve) 0.99 µg/L (MA) 0.85 µg/L (MG) --- ---- 147 (2e trimestre) 0.74 µg/L (MA) 0.56 µg/L (MG) --- 101 (accouchement) 0.52 µg/L (MG) 0.69 µg/L (MA) --- 0.09 µg/g (MG) Curren et al.(69) Étude de biosurveillance maternelle 2005-2007 a Femmes enceintes d’Inuvik (Inuvialuit Settlement Region) et de la région de Baffin (Nunavut) et femmes enceintes primipares du sud du Canada 16 canadiennes nées à l’étranger --- 0.88 µg/L (MG) --- ---- 77 canadiennes de naissance 0.40 µg/L (MG) 22 Baffin-Inuit 3.3 µg/L (MG) 18 Inuvik-Inuit 1.1 µg/L (MG) Fontaine et al.(70) Enquête de Santé du Nunavik 1992a/2004a Femmes Inuit du Nunavik, âgées de 18-39 ans 175
(1992) Viande, rein et foie de mammifères marins et truite grise 12.9 µg/L (MG) 76.2% ---- 308 (2004) 8.34 µg/L (MG) 53.2% Muckle et al.(71) EDEN c 1995-2001 a
Femmes Inuit enceintes de la Baie d’Hudson au Nunavik 130 (analyse de sang) 125 (analyse cheveux) --- 10.4 µg/L (MG) --- 3.7 µg/g (MG) Adamou et al.(7) 2011-2013
Femmes Inuit enceintes du Nunavik, âgées de 15-41 ans 17 (2011) Mammifères marins 6.54 µg/L (MG) 47.1% ---- 95 (2012) 4.73 µg/L (MG) 34% 95 (2013) 5.20 µg/L (MG) 37.9%
9
a Période d’échantillonnage
b MA – moyenne arithmétique ; MG – moyenne géométrique c Étude sur le développement de l’enfant au Nunavik (EDEN) d Enquête canadienne sur les mesures de la santé (ECMS)
eFemmes qui ont eu recours à Motherisk, un service de consultation de Toronto pour femmes enceintes f Arctic Monitoring and Assessment Programme / Programme de surveillance et d'évaluation de l'Arctique (PSEA).
Même s’il n’y a actuellement pas d’évidence que les niveaux de MeHg diminuent dans les écosystèmes arctiques, une diminution marquée de l’exposition maternelle au MeHg a été mise en évidence depuis les années 1990 au Nunavik et ailleurs en Arctique (7, 22), essentiellement en lien avec la diminution de la consommation d’aliments traditionnels en ce qui a trait au Nunavik. Toutefois, les dernières données du Programme de surveillance et d’évaluation de l’Arctique (PSEA) rapportent qu’une proportion importante de femmes enceintes présente toujours une exposition élevée au Hg au Nunavik, au Nunavut et au Groenland. En 2013, 38% de ces femmes enceintes du Nunavik dépassaient la valeur établie par Santé Canada (8 µg/L) (6). Au Nunavut, en 2007 – 2008, 36% de femmes en âge de procréer dépassaient cette valeur. Les femmes en âge de procréer du Nord et de l’Est du Groenland avaient des niveaux légèrement inférieurs de Hg total dans le sang et 28% dépassaient la valeur de 8 µg/L. Les niveaux les plus bas ont été observés chez les femmes de la Suède et de la Norvège (6).
L’écart est plus évident lorsqu’on compare les niveaux d’exposition au Hg des femmes Inuit du Nord du Canada à celle des femmes qui habitent ailleurs au Canada. En effet, dans le cycle 1 (2007-2009) de l’Enquête canadienne sur les mesures de la santé (ECMS) réalisée dans cinq régions du sud du pays, seulement 2.2% de femmes en âge de procréer présentaient des niveaux sanguins de Hg au-delà de la valeur de référence de Santé Canada (9). Au sein de l’étude mère-enfant sur les composés chimiques de l’environnement (étude MIREC) réalisée dans dix villes du Canada en 2007-2009, moins de 1% des femmes enceintes présentaient des niveaux sanguins de Hg au-delà de la valeur de référence de Santé Canada (8).
1.6 Les effets neurodéveloppementaux du MeHg sur le fœtus et
l’enfant
La toxicité du MeHg sur le fœtus est importante puisque la barrière hématoencéphalique est en développement, le taux d’érythrocytes est élevé et le fœtus ne semble pas éliminer le MeHg qu’il accumule (14). Le MeHg est reconnu pour ses effets neurotoxiques et a des effets particulièrement néfastes sur les
Auteurs et années
de l’étude Population d’étude Échantillon
Principales Sources alimentaires de
MeHg
Moyenne Hg
dans le sang 8 ug/L % ≥
Moyenne Hg dans les cheveux AMAP /PSAEf (6) Femmes enceintes de la région du Yukon-Delta de
la Kuskokwim, Alaska 160 (2009-2012) Mammifères marins 2.2 µg/L (MG) --- --- Femmes Inuit en âge de
procréer de la région
désignée des Inuvialuit 74 (2007 – 2008)
Rein de phoque
annelé 2.1µg/L (MG) 12.2% ---
Femmes inuites en âge
de procréer duNunavut 491 (2007 – 2008) Rein de phoque annelé 5.0 µg/L (MG) 36% --- Femmes Inuit en âge de
procréer de Nunatsiavut 60 (2007 – 2008) Rein de phoque annelé 1.7 µg/L (MG) 9.3% --- Femmes Inuit enceintes
de Groenland 194 (2002-2004, 2010-2011 et 2013) --- 3.6 µg/L (MG) 28% --- 184 (2014) 4.8 µg/L (MG) --- Femmes enceintes du
Nord de la Norvège 282 (2006 – 2008) Poisson 1.2 µg/L (MG) --- --- Femmes enceintes nord de la Suède 96 (2003 – 2004) Poisson 0.6µg/L (MG) --- 0.19µg/g (MG) l'ouest de la Suède 99 (2001 – 2002) 1.2 µg/L (MG) 0.43 µg/g (MG) Suède méridionale 100 (2003 – 2004) 0.6 µg/L (MG) 0.22 µg/g (MG)
10
fonctions cérébrales du fœtus qui y est exposé (10-14). En effet, cette période est l’une des plus susceptibles aux actions des contaminants parce que c’est une phase de développement où l’organisme vit plusieurs processus de division cellulaire, de différenciation et de migration de cellules (23).
Même si le système nerveux semble particulièrement vulnérable au MeHg pendant les premières phases de la formation du tube neural (premier mois de la grossesse), le cerveau subit une croissance énorme au cours de toute la période de la gestation (72). Ainsi, même si le MeHg a un effet toxique de façon différente selon la période d’exposition, les effets délétères sur le système nerveux du fœtus peuvent se produire pendant toutes les phases de la grossesse (73).
L’EDEN a pour objectif d’étudier les effets de l’exposition pré et postnatale à plusieurs contaminants, dont le MeHg, sur le développement des nourrissons et des enfants à différents stades de vie. Les effets les mieux connus de l’exposition fœtale au MeHg mis en évidence par cette étude sont des troubles cognitifs, de mémoire et d’attention (15, 16, 64), une altération des fonctions visuelles (54, 74) et une diminution du quotient intellectuel (QI) (18). L’étude de Jacobson et.al. (2015) a mis en évidence que les enfants avec un niveau de Hg dans le cordon ombilical plus grand ou égal à 7,5 μg/L étaient quatre fois plus susceptibles d’avoir un score de quotient intellectuel (QI) plus petit que 80, le seuil clinique limite du QI (18). L’exposition élevée au MeHg durant l’enfance est aussi associée à un déficit des fonctions motrices fines (19, 64). Des effets similaires ont également été mis en évidence aux Îles Féroé (64, 65) et en Nouvelle-Zélande (75). Cependant, l’hypothèse qu’une exposition prénatale à de faibles doses de MeHg peut entraîner des effets néfastes sur le système nerveux central ne fait pas l’unanimité. Une étude de cohorte mère-enfant aux îles Seychelles à des niveaux d’exposition similaires n’a pas mis en évidence de relations entre l’exposition au MeHg et les effets neurodéveloppementaux observés chez d’autres populations qui vivent de la consommation de poissons et de mammifères marins (76). Néanmoins, les conclusions parfois contradictoires de ces études pourraient être attribuées à des méthodologies différentes, des caractéristiques différentes de la population comme les nutriments présents dans l’alimentation traditionnelle de chaque région, l’âge des enfants dans les populations échantillonnées, les différents bioindicateurs utilisés (le sang du cordon ombilical versus les cheveux de la mère) et les différents tests neurologiques et psychologiques réalisés (34).
Au Nunavik, l’exposition postnatale au MeHg a aussi été associée à une diminution de la variabilité cardiaque chez les enfants d’âge scolaire (77) et chez les adultes, à une augmentation de la pression artérielle et une diminution de la variabilité cardiaque (78). Aux îles Féroé, l’exposition prénatale au MeHg a aussi été associée à une augmentation de la pression artérielle chez les enfants à l’âge de 7 ans (52).
Les aliments traditionnels ou locaux comme le poisson sont des sources importantes de nutriments pour des milliards de personnes à travers le monde. Donc, étudier les effets du MeHg sur le développement du fœtus et de l’enfant jusqu’à l’âge adulte en tenant compte des effets bénéfiques des nutriments dans ces aliments permet de mieux comprendre les risques auxquels ces populations sont exposées et d’agir en prévention pour réduire l’exposition au MeHg (qui provient en grande partie d’un nombre limité d’aliments marins) tout en faisant la promotion des aliments traditionnels (79).
1.7
La consommation d’aliments traditionnels et l’exposition au
MeHg au Nunavik
Les aliments traditionnels du Nunavik sont un élément central de la culture et de la subsistance des Inuits. En 2004, près d’un tiers (33%) des Inuit au Nunavik affirmaient participer à des activités de pêche une fois par semaine ou plus au moins deux saisons par année (80). Une étude réalisée au Nunavik visant à documenter les perceptions des Inuit concernant les risques et les avantages associés à la consommation de divers types d’aliments a conclu que pour les Inuit, les aliments traditionnels sont associés à une bonne santé, à la force et
11
même considérés comme un médicament (81). Les aliments chassés et pêchés sont riches en nutriments et ont aussi un teneur élevé en protéines et acide gras essentiels (3, 82).
Toutefois, même si ces aliments sont reconnus pour leur grande qualité nutritionnelle, certains aliments traditionnels contribuent à l’exposition à des contaminants environnementaux tels que le MeHg (21). Les résultats de l’enquête Qanuippitaa, en 2004 ont révélé que les concentrations sanguines observées pour le Hg augmentaient significativement avec la consommation mammifères marins (80, 83), et plus précisément la viande de béluga crue ou séchée (21). À la baie de Disko, au Groenland, et aux Îles Féroé, la consommation de différentes parties de mammifères marins a également été associée à des niveaux élevés de Hg sanguin (63, 65, 66).
1.7.1 Les préférences et les usages des aliments traditionnels et l’exposition
au MeHg
Le savoir traditionnel Inuit est transmis à travers les générations. Il souligne l’importance des animaux sauvages et des plantes comme partie de l’alimentation, de la médecine et de la culture des Inuit. L’alimentation des Inuit est traditionnellement composée de poissons, de caribous, d’oiseaux, de baleines, de phoques et de fruits de mer. Elle est souvent complétée par des petits fruits, des algues et des plantes sauvages (84). Ces aliments représentent les valeurs et l’identité des Inuit. Pour ces communautés, la chasse, la récolte et le partage des aliments locaux sont fondamentaux pour la cohésion sociale et la continuité culturelle (85). Leur valeur revêt encore plus d’importance lorsque l’on considère le défi que représente l’accès à des aliments sains et abordables achetés à l’épicerie dans plusieurs communautés (7, 80).
En Arctique, les poissons, le béluga et le phoque se mangent souvent crus ou congelés (84). Mais afin de conserver les aliments, les Inuit préparent et mangent également de la viande de béluga séchée (appelée nikku) et de poisson séché (de différentes espèces, appelée pitsik), processus qui accroît la concentration de MeHg à cause de l’évaporation de l’eau (20, 21). Le béluga mattaaq, un des aliments traditionnels le plus prisé des Inuit, est composé de la peau et d’une couche de gras de béluga, qu’ils mangent le plus souvent cru (86).
1.7.2 Les variations régionales de la consommation d’aliments traditionnels
et de l’exposition au MeHg
Les données de l’étude de 2004 présentées dans Lemire et coll. (2015) mettent en évidence qu’il y a une grande différence régionale de l’exposition au MeHg au sein du Nunavik (Figure 3). Les résidents des villages du Détroit d’Hudson (78.4% des femmes en âge de procréer avaient des niveaux de Hg sanguin au-delà de 8 µg/L) présentaient une concentration significativement plus élevée de Hg sanguin que ceux de villages de l’Est de la Baie d’Hudson (47.7% des femmes en âge de procréer avaient des niveaux de Hg sanguin au-delà de 8 µg/L) et ceux de la Baie d’Ungava (43.4% des femmes en âge de procréer avaient des niveaux de Hg sanguin au-delà de 8 µg/L). Les habitants du Détroit d’Hudson rapportaient une consommation beaucoup plus élevée de mammifères marins, notamment de viande de béluga (21). C’est d’ailleurs dans cette région que la chasse au béluga a principalement lieu au Nunavik. Ces résultats reflètent donc que les habitudes alimentaires traditionnelles des Inuit varient selon les écosystèmes et les espèces animales et végétales disponibles (84), et que ceci entraîne une variation géographique, mais à l’échelle plus locale, de l’exposition au MeHg.
12
Figure 3 – Carte du Nunavik. Tiré de l’article de Lemire et al. (2015) (21)
De telles variations régionales de l’exposition au MeHg ont aussi été observées ailleurs. L’Enquête sur la santé nationale et la nutrition (NHANES) menée entre 1999 et 2004 aux États-Unis a mis en évidence que les femmes qui habitaient les régions côtières présentaient des niveaux plus élevés de Hg sanguin et rapportaient consommer plus de poissons contenant des niveaux plus élevés de Hg (10). Aux Îles Féroé, l’étude réalisée en 1999-2000 a mis en évidence que les femmes qui résidaient dans les districts où la viande de baleine était disponible présentaient en moyenne des niveaux de Hg dans les cheveux plus élevés (3,03 µg/g) que les femmes des districts sans accès local à la viande de baleine (1.88 µg/g) (66).
1.7.3 Les variations temporelles de la consommation d’aliments traditionnels
et de l’exposition au MeHg
La pratique d’activités comme la chasse et la pêche, et l’alimentation des Inuit qui en découle, sont liés aux saisons et à l’abondance et la diversité des espèces qu’on retrouve dans les écosystèmes locaux (87). Au Nunavik, selon l’enquête de 2004, la chasse et la pêche étaient des activités pratiquées principalement au printemps et à l’été (87).
La saisonnalité de ces activités et des habitudes alimentaires qui en découlent influence également l’exposition au MeHg tout au long de l’année (88). En effet, plusieurs études longitudinales ont été réalisées ailleurs qu’au Nunavik afin de vérifier la variation des niveaux de MeHg d’un mois à l’autre au cours d’une année. Toutes les recherches ont mis en évidence une grande variabilité des niveaux de MeHg au fil des mois dans les cheveux des participants en fonction des aliments consommés (25, 88, 89). En Oklahoma, aux États-Unis, le niveau de Hg dans les cheveux était significativement plus faible en hiver qu’en été parce que la consommation du poisson-chat, qui présente un niveau de MeHg plus élevé que les autres poissons, était plus
13
élevée pendant l’été et l’automne, et plus basse en hiver (88). Les résultats d’une autre étude réalisée en Amazonie au Brésil ont montré des niveaux de Hg dans les cheveux plus élevés pendant la saison sèche comparée à la saison des pluies. Les poissons herbivores, qui ont une concentration beaucoup plus faible de MeHg, étaient plus consommés pendant la saison des pluies (72,2 %) en comparaison de la saison sèche (47,2 %) (25). À Qikiqtarjuaq, sur l’île Baffin au Nunavut, une étude réalisée entre 1985 et 1988 auprès de 179 adultes, hommes et femmes, a mis en évidence que les niveaux de Hg sanguins étaient plus élevés en septembre et plus bas en janvier (89).
Les changements climatiques en cours et à venir amèneront des changements dans l’abondance de certaines espèces (à la baisse ou à la hausse) et possiblement également quant aux différentes périodes pour la chasse et la pêche de ces espèces (3). En effet, selon Moore et Huntington (2008), les différents changements climatiques en Arctique auront des répercussions environnementales directes et indirectes sur les mammifères marins et poissons puisqu’ils modifieront leur habitat et leurs périodes de migrations (90). L’Institut polaire norvégien a d’ailleurs documenté que des groupes de phoques du Groenland ont été aperçus sur la côte est de Svalbard entre les mois de janvier et mars, période de l’année durant laquelle ils ne sont habituellement pas présents dans cette région (91).
En résumé, l’exposition des femmes enceintes au MeHg est susceptible de varier selon la disponibilité et l’accès aux espèces animales dans l’espace et dans le temps, leurs habitudes et leurs préférences alimentaires, les niveaux de MeHg dans les aliments consommés (58), et le trimestre de grossesse (23).
1.8 Les bioindicateurs d’exposition au Hg
Le bioindicateur d’exposition le plus utilisé pour étudier l’exposition au MeHg est la mesure du Hg total dans le sang complet (24). Chez les populations qui vivent de la consommation de poissons et de mammifères marins, la mesure du Hg total dans le sang est un bon indicateur de l’exposition au MeHg, parce qu’il représente généralement 90-95% du Hg total (31, 34). La demi-vie du MeHg est de environ 50 à 70 jours (32, 34, 92).
La mesure de Hg total dans les cheveux a aussi souvent été utilisée pour documenter l’exposition au MeHg (30, 53, 64-67), puisque les cheveux sont une des nombreuses voies métaboliques d’excrétion du MeHg (93). Par ailleurs, puisque les cheveux poussent à une vitesse d’environ un centimètre par mois, en fonction de la longueur des cheveux échantillonnés et en analysant les niveaux de Hg dans chaque centimètre, il est possible d’obtenir une estimation de l’exposition mensuelle et rétrospective de l’exposition au MeHg sur une période de plusieurs mois, voire même deux ans (25, 93). Comme dans le sang, la mesure du Hg total dans les cheveux est aussi un bon indicateur de l’exposition au MeHg parce que 80-90% du Hg total dans les cheveux est sous la forme de MeHg (25, 94) et le ratio entre les concentrations sanguines et capillaires se situe entre 250 et 300 (55).
Toutefois, Liberda et coll. (2014) soulignent que même si l’OMS recommande un ratio de 250 pour convertir les concentrations de Hg dans les cheveux maternels en concentrations de Hg dans le sang de la mère (55), cette analyse comporte des incertitudes. Dans leur étude, réalisée auprès d’une population des Premières Nations au Nord du Québec, la marge d’erreur était de 98,7 % à 1040 %, au niveau individuel, avec des ratios cheveux-sang observés allant de 3 à 2845. Les auteurs découragent donc l’utilisation de ce ratio pour convertir les niveaux de Hg entre le sang et les cheveux à l’échelle individuelle (24). Par ailleurs, comme cela prend environ un 20 jours pour que les cheveux apparaissent à la surface de la peau, le premier centimètre de cheveux à partir du cuir chevelu correspond à une période de 3 semaines avant la collecte des échantillons (34).