Les différences liées au sexe dans la physiopathologie
de la sténose valvulaire aortique: impact du phénotype
valvulaire, de l’âge, et des hormones sexuelles.
Mémoire
Maxime Hervault
Maîtrise en sciences cliniques et biomédicales - avec mémoire
Maître ès sciences (M. Sc.)
Les différences liées au sexe dans la physiopathologie
de la sténose valvulaire aortique
Impact du phénotype valvulaire, de l’âge, et des hormones
sexuelles
Maîtrise
Maxime Hervault
Sous la direction de :
Marie-Annick Clavel, directrice de recherche
Patrick Mathieu, co-directeur de recherche
Résumé
La sténose valvulaire aortique (SVA) est une pathologie dégénérative de la valve aortique qui touche 2 à 4% de la population âgée de plus de 65 ans, et 4,6% des personnes âgées de plus de 75 ans. Cette pathologie se traduit par un épaississement et une rigidification des feuillets de la valve aortique, induisant un défaut d’ouverture et de fermeture de la valve. Parmi les nombreux facteurs de risque de développer une SVA, nous retrouvons la bicuspidie (anomalie congénitale touchant 1 à 2% de la population générale), l’âge, la dyslipidémie et le sexe mâle. Les mécanismes impliqués dans la physiopathologie de la SVA sont bien connus, nous retrouvons des mécanismes impliqués dans l’inflammation, la fibrose, la calcification, la survie et la prolifération cellulaire. Toutefois, malgré une littérature abondante sur la physiopathologique de la SVA, peu de recherches ont été effectuées sur l’impact du sexe et des hormones sexuelles sur la progression de la SVA. Il a été récemment observé que pour une même sévérité hémodynamique de la SVA, les hommes présentent un degré de calcification plus important et une proportion de fibrose valvulaire moins élevée comparativement aux femmes.
Ainsi, l’objectif de cette maîtrise est d’étudier l’impact du sexe, du phénotype valvulaire et de l’âge sur le degré de calcification et le remodelage de la valve aortique chez des patients humains. Pour mener à bien ce projet, nous avions accès aux caractéristiques cliniques, aux données de tomodensitométrie, et aux valves explantées des patients. Les résultats obtenus montrent que les femmes, indépendamment du phénotype valvulaire ou de l’âge, vont présenter un degré de calcification plus faible et un remodelage fibrotique plus important des valves aortiques comparativement aux hommes. De plus, chez les patients bicuspides, les femmes jeunes présentent une valve aortique moins calcifiée que les femmes plus âgées.
Abstract
Aortic valve stenosis (AS) is a degenerative pathology of the aortic valve that affects 2 to 4% of the population over 65 years of age, and 4,6% of people over 75 years of age. This pathology results in a thickening and stiffening of the aortic valve leaflets, leading to an impaired opening, and closing of the valve. The risk factors for developing AS are bicuspid valve (a congenital anomaly affecting 1 to 2% of the general population), age, dyslipidemia, and male sex. The mechanisms involved in the pathophysiology of AS are relatively well known. Mechanisms involved in inflammation, fibrosis, calcification, survival, and cell proliferation are found. However, despite an important bibliography on the pathophysiology of AS, very little research has been done on the impact of sex and sex hormones on the progression of AS. It has recently been shown that for the same hemodynamic severity of AS, men have a higher degree of calcification and a lower proportion of fibrosis of their valve than women.
Thus, the objective of this master is to study the impact of sex, valve phenotype and age on the degree of calcification and valve remodelling in human patients for whom we had their clinical characteristics as well as CT-scan data and explanted valves. Results obtained shown that women, regardless of valve phenotype or age, will have a lower degree of valve calcification and a greater fibrotic remodelling of their valves than men. In addition, in bicuspid patients, young women have a less calcified aortic valve compared to older women.
Table des matières
Résumé ... ii
Abstract ... iii
Table des matières ... iv
Liste des figures ... viii
Liste des abréviations ... xi
Liste des sigles ... xii
Liste des acronymes ... xviii
Avant-propos ... xix
Introduction ... 1
Chapitre 1 – La sténose valvulaire aortique : présentation clinique et physiopathologique ... 2
1.1 Anatomie, épidémiologie, présentation clinique et traitement de la sténose valvulaire aortique ... 2
1.1.1 La valve aortique : anatomie et fonction ... 2
1.1.1.1 Les différentes couches anatomiques de la valve aortique et leur fonction ... 2
1.1.1.2 Les forces mécaniques subies par la valve aortique ... 4
1.1.1.3 Les cellules de la valve aortique ... 4
1.1.2 La sténose aortique : épidémiologie et présentation clinique ... 6
1.1.2.1 Histoire naturelle de la sténose valvulaire aortique ... 6
1.1.2.2 Les outils diagnostiques pour l’évaluation de la SVA ... 7
1.1.2.3 L’épidémiologie de la sténose valvulaire aortique ... 8
1.1.2.4 Les facteurs de risques associés à la sténose valvulaire aortique ... 8
1.1.2.5 Les caractéristiques hémodynamiques et physiologiques de la SVA ... 9
1.1.3 La prise en charge des patients et le traitement de la SVA ... 12
1.1.3.1 Les recommandations des guides de pratique ... 12
1.1.3.2 Les traitements par remplacement valvulaire chirurgical et par implantation percutanée de bioprothèse ... 13
1.1.3.2.1 Les prothèses chirurgicales ... 13
1.1.3.2.2. Les prothèses implantables par cathéter ... 13
1.2 La physiopathologie de la sténose valvulaire aortique ... 14
1.2.1 Généralités ... 14
1.2.2 L’inflammation et remodelage de la valve aortique ... 16
1.2.2.1 Infiltration et oxydation des lipides : ... 16
1.2.2.3 Remodelage fibrotique du tissu valvulaire : ... 20
1.2.2.4 Angiogénèse dans la valve aortique : ... 22
1.2.3 La calcification de la valve aortique ... 23
1.2.3.1 Les VECs et le stress mécanique : ... 23
1.2.3.2 La différenciation ostéogénique des VICs : ... 23
1.2.3.3 Le système ectopurinergique dans les processus de minéralisation dans la valve aortique sténosée : ... 26
1.2.3.4 La calcification induite par les éléments sanguins : ... 29
1.2.4 Modulations de la physiopathologie par les ARN non codants ... 30
1.2.5 Les mécanismes épigénétiques et la génétique dans la SVA ... 30
1.2.5.1 La méthylation de l’ADN : ... 31
1.2.5.2 Les variants génétiques associées à la SVA : ... 31
Chapitre 2 – La bicuspidie valvulaire aortique ... 33
2.1 Présentation clinique ... 33
2.2 Mécanismes impliqués dans la bicuspidie et le développement de la SVA ... 34
2.2.1 Les différences anatomopathologiques entre les BAV et les TAV calcifiées ... 34
2.2.2 Les différences dans les mécanismes cellulaires impliqués dans les SVA chez les BAV et les TAV ... 36
2.2.3 Les différences transcriptomiques ... 36
2.2.4 Les différences génomiques ... 37
Chapitre 3 – Les différences liées au sexe dans la physiopathologie de la sténose valvulaire aortique ... 39
3.1 Les chromosomes sexuels ... 39
3.2 Les hormones sexuelles, leur récepteurs et leurs mécanismes d’actions ... 39
3.2.1 Synthèse et métabolismes des hormones sexuelles ... 39
3.2.2 Les récepteurs aux hormones sexuelles ... 40
3.2.2.1 Action génomique ... 41
3.2.2.2 Action non-génomique ... 41
3.3 Les différences épidémiologiques liées au sexe dans la sténose valvulaire aortique ... 41
3.4 Les différences structurelles liées au sexe dans la sténose valvulaire aortique ... 42
3.5 Les différences liées au sexe dans les processus cellulaires de la physiopathologie la sténose valvulaire aortique ... 43
3.6 Les différences liées au sexe dans le remodelage du VG induit par la SVA ... 46
3.7 La ménopause et les maladies cardiovasculaires ... 47
4.1 Hypothèse générale ... 49
4.2 Hypothèses spécifiques ... 49
4.3 Objectifs généraux ... 50
4.4 Objectifs spécifiques ... 50
Chapitre 5 – Age, sex and valve phenotype differences in fibro-calcific remodeling of calcified aortic valve .... 51
5.1 Résumé ... 51 5.2 Abstract ... 52 5.3 Introduction ... 52 5.4 Methods ... 53 5.4.1 Patient populations ... 53 5.4.2 Clinical data ... 54
5.4.3 MDCT scans and AVC assessment ... 54
5.4.4 Doppler Echocardiography ... 55
5.4.5 Aortic valve histology ... 55
5.4.6 Statistical analysis ... 56
5.5 Results ... 57
5.5.1 MDCT-cohort ... 57
5.5.1.1 Patients characteristics ... 57
5.5.1.2 Differences in aortic valve calcification evaluated by MDCT ... 59
5.5.2 Histological cohort ... 60
5.5.2.1 Patients characteristics ... 60
5.5.2.2 Semi-quantitative assessment of fibrous tissue with Masson’s Trichrome and Picrosirius Staining ... 63
5.6 Discussion ... 64
5.7 Limitations ... 65
5.8 Conclusions ... 66
Chapitre 6 – Discussion intégrative ... 67
6.1 Les différences anatomopathologiques de la SVA entre les valves bicuspides et les valves tricuspides67 6.2 Le rôle des hormones sexuelles dans le développement de la SVA ... 68
6.3 Les limitations du projet d’étude ... 70
6.4 Les perspectives d’étude ... 71
Conclusion ... 72
Annexe A : Les différentes sténoses valvulaires aortiques et leurs caractéristiques ... 95 Annexe B : Classification fonctionnelle NYHA ... 956 Annexe C : Sommaire des recommandations pour la SVA : choix d’une intervention chirurgical ou percutanée ... 97 Annexe D : Rôle des ARN non codants dans la SVA ... 98
Annexe E : Rôle de la méthylation de l’ADN dans la SVA 100
Annexe F : Voies et gènes différentiellement et communément régulés entre les BAV calcifiées et les TAV saines
Liste des figures
Chapitre 1 :
Figure 1-1 : Anatomie du cœur. 2
Figure 1-2 : Anatomie de la valve aortique et de ses différentes couches structurelles. 3
Figure 1-3 : Schéma des différentes forces mécaniques que subit la valve aortique durant la systole (à gauche) et la diastole (à droite). 4
Figure 1-4 : Représentation schématique d'une valve aortique saine et d’une valve aortique fibrocalcifiée, en position ouverte et fermée. 9
Figure 1-5 : La loi Frank-Starling : courbe de fonction ventriculaire. 10
Figure 1-6 : Tracés de vélocités transaortiques obtenues par échocardiographie Doppler. 11
Figure 1-7 : Évolution du nombre de valves percutanées implantées. 14
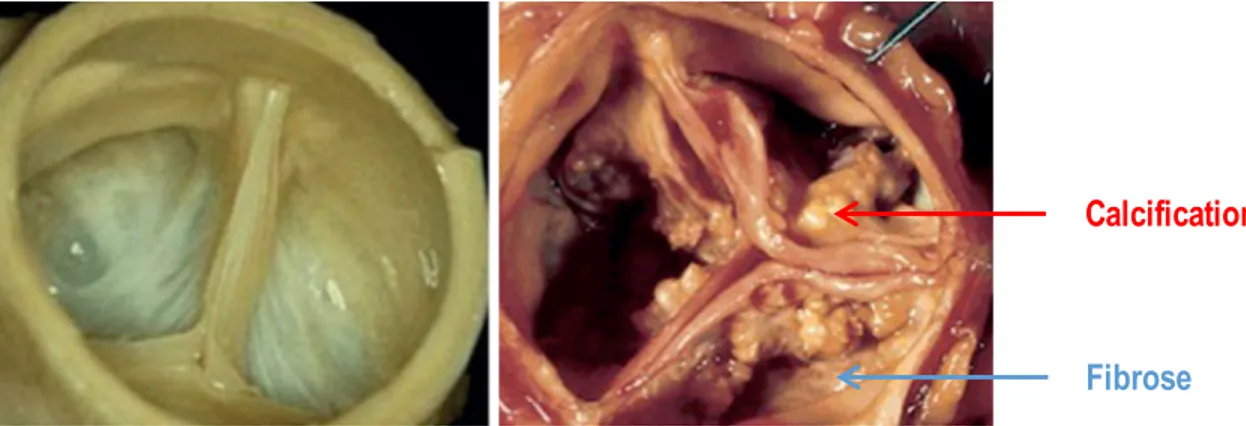
Figure 1-8 : Observation macroscopique d’une valve saine (à gauche) et d’une valve sténosée (à droite) et ayant accumulé des dépôts calciques (en rouge) et fibrotiques (en bleu). 15
Figure 1-9 : Évolution de la physiopathologie de la SVA. 16
Figure 1-10 : Effet de l’ATX circulante et liée à la Lp(a) sur les VICs. 18
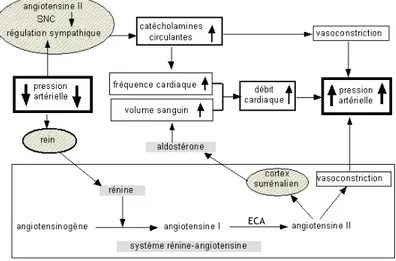
Figure 1-11 : Régulation de la pression artérielle par le système rénine-angiotensine-aldostérone. 22
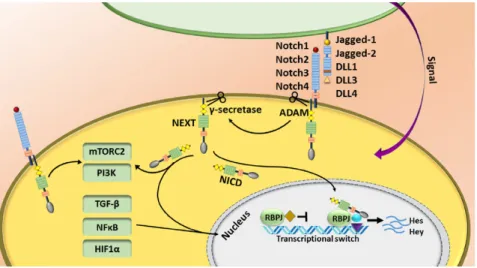
Figure 1-12 : La voie de signalisation canonique NOTCH. 24
Figure 1-13 : Signalisation canonique de la voie Wnt. 26
Figure 1-14 : Schéma représentant l’hydrolyse de l’ATP par les ectonucléotidases. 27
Figure 1-15 : Un taux élevé d’ENPP1 contribue à favoriser la calcification de la valve aortique. 28
Figure 1-16 : L’hémorragie intra-feuillets stimule la calcification valvulaire. 30
Chapitre 2 :
Figure 2-1 : Illustration schématique d'une valve aortique bicuspide, dont une bicuspidie vraie et 3 bicuspidie issues de la fusion de 2 feuillets d'une valve tricuspide 33Chapitre 3 :
Figure 3-1 : Biosynthèse des hormones stéroïdiennes. 40
Figure 3-2 : Définition et prévalence des modèles de remodelage du VG 42
Figure 3-3 : Association entre la calcification valvulaire et la sévérité de la SVA, caractérisée par la Vmax 42
Chapitre 4 :
Figure 4-1 : Possibles chemins dans la différence physiopathologique liée au sexe dans la SVA 49
Chapitre 5 :
Figure 5-1 : Flowchart 54
Figure 5-2 : Masson’s trichrome and picrosirius red staining of aortic valves according to sex-age-phenotype group. 56 Figure 5-3 : Aortic valve gradient assessed by echocardiography and calcification assessed by MDCT according to sex-age-phenotype group. 59 Figure 5-4 : Correlation between aortic valve calcification density and hmodynamic severity of aortic stenosis (mean gradient) according to the sexe-age-phenotype group 60 Figure 5-5 : Histological assessement of matched stenotic valves. 63
Liste des tableaux
Chapitre 5 :
Table 5-I : Characteristics of the MDCT cohort. 58 Table 5-II : Characteristics of the histological study population. 62
Liste des abréviations
Alk2 : activin receptor-like kinase-2
ALP : alkaline phosphatase – phosphatase alcaline Ang : angiotensine
Apo : apolipoprotéine
cm.s-1 : centimètre par seconde
cm2 : centimètre carré
cm2/m2 : centimètre carré par mètre carré
cm3.s-1 : centimètre cube par seconde
E-selectin : sélectine endothéliale H2O2 : peroxyde d’hydrogène
Hes : Hairy/enhancer os split
Hrt : Hairy-related family of transcription factors kg/m2 : kilogramme par mètre carré
m.s-1 : mètre par seconde
Mhz : mégahertz
ml/m2 : millilitre par mètre carré
mmHg : millimètre de mercure O2- : ion superoxide
PALMD : palmdelphine Vao : valve aortique
Liste des sigles
5’-NT : 5’-nucléotidase
5-HT2B : 5-hydroxytryptamine 2B ACE : angiotensin-converting enzyme ADN : acide désoxyribonucléique ADP : adenosine diphosphate
AHA/ACC : American Heart Association / American College of Cardiology AMP : adenosine monophosphate
ANP : peptide natriurétique atrial APC : adenomatous polyposis coli Ar : androgen receptor gene ARB : angiotensin receptor blocker
ARB : bloqueur des récepteur à l’angiotensine II ARN : acide ribonucléique
ARNlnc / lncRA : ARN long non codant ARNm/mRNA : ARN messager ARNnc / ncRNA : ARN non codant AS : aortic stenosis
ATP : adenosine triphosphate ATPase : adenosine triphosphatase ATX : autotaxine
ATXR : récepteur de type X à l’angiotensine de type II
AVA : aire valvulaire aortique
AVAi : aire valvulaire aortique indexée AVAVTI : aortic VTIs
AVC : accident cérébro-vasculaire aVIC : VIC activée
AVpeak : peak aortic velocity
BAFF : B cell-activating factor
BAV : bicuspid aortic valve - valve aortique bicuspide Bax : IBcl-2-associated X
Bcl-2 : B-cell lymphoma 2 BMI : body mass index
BMP : bone morphogenetic protein, protéine osseuse morphogénétique BSA : body surface area
BSP : bone sialoprotéine – sialoprotéine osseuse CA12 : anhydrase carbonique 12
CAVD : calcific aortic valve disease
CCVG : chambre de chasse du ventricule gauche CD : cluster de différenciation
CEP : cellule endothéliale prpgénitrice CK-1 : casein kinase-1
CM - MC : castrated male – mâle castré CO : cardiac output
CRP : protéine réactive C Ctnnb1 : gène de la β-caténine CVA : calcification de la valve aortique CWD : continuous-wave Doppler DC : cellule dendritique
ddPCR : digital droplet PCR
DLK : delta-like non-canonical Notch ligand DLL : delta-like protein
DNMT3B : DNA (cytosin-5-)-methyltransferase 3 β ECA : enzyme de conversion à l’angiotensine ECAi : inhibiteur de l’ECA
EGFR : epidermal growth factor receptor – récepteur du facteur de croissance épidermal eGFR : estimated glomerular filtration rate
eNOS: endothelial nitric oxide synthase – oxide nitrique synthase endothéliale ENPP1 : l’ectonucléotide pyrophosphatase/phosphodiésterase 1
EOF – FOE : estrogen supplemented ovariectomized female – femelle ovariectomisées supplémentée en estrogène ERK : extracellular signal-regulated kinase
ESC : European Society of Cardiology Esr : gène du récepteur à l’estrogène eVIC : VIC dérivant de l’endothélium
FEVG: fraction d’éjection du ventricule gauche GAG : glycosamynoglycane
GAPDH : glycéralfhégyde-3-phosphate déshydrogénase Gas-6 : growth arrest-specific gene 6
GM : gradient de pression moyen GPIIb/IIIa : glycoprotéine IIb/IIIa
GPX3 : glutathione peroxydase 3
GSK3β : glycogen synthase kinase 3 beta GTPase : guanine triphosphatase HDL : lipoprotéine de haute densité HFSC : high fat/sucrose/cholesterol
HIF : hypoxia-inducible factor – facteur hypoxie-inductible
HMG-CoA réductase : hydroxy-méthyl-glutaryl-coenzyme A réductase HPRT : hypoxanthine-guanine phosphoribosyltransférase
HTAP : hypertension artérielle pulmonaire ICCinter : inter-observer correlation coefficient
ICCintra : intra-class correlation coefficient
IF- FI : intact female – femelle intact IFN : interféron
Ig : immunoglobuline
IGFII : insulin-like growth factor II
IκBα : nuclear factor of kappa light polypeptide gene enhancer in B-cells inhibitor IL : interleukine
il1rn : récepteur antagoniste à l’interleukine 1 IM - MI: intact male – male intact
IRM: imagerie par résonnance magnétique ITV : intervalle temps-vitesse
KCCQ : Kansas City Cardiomyopathy Questionnaire LB : lymphocyte B
LDL : low density lipoportein – lipoprotéine de faible densité LDLr : récepteur au LDL
Lox : gène de la lysyl oxidase
Loxl1 : gène de la lysyl oxydase homologue 1 Lp(a) : lipoprotéine (a)
Lp-PLA2 : lipoprotein-associated phospholipase A2
LPS : lipopolysaccharide Lrp : LDLr-related protein LV : left ventricle
LVEDD : LV internal end diastole dimension LVESD : LV internal end systole dimension LVEF : left ventricular ejection fraction LVOTCSA :LVOT cross sectional area
LVOTd : LV outflow-tract diameter lysoPA : acide lysophosphatidique lysoPC : lysophosphatydilcholine MAPK : mitogen-activates protein kinases MDCT : multidetector computed tomography MEC : matrice extracellulaire
MG : mean gradient
MGP : protéine matricielle Gla miRNA/mi-R : micro-ARN
MLHFQ: Minnesota Living with Heart Failure Questionnaire MMP : matrix metalloproteinase - métalloprotéinases matricielles MSX2 : Msh homeobox 2
MVC : maladie valvulaire cardiaque
NADPH : nicotinamide adénine dinucléotide phosphate NF-κB : nuclear factor-kappa B, facteur nucléaire-kappa B Nfkbia : gène de l’inhibiteur alpha du NF-κB
NHLBI: National Health, Lung and Blood Institute NICD : Notch intracellular domain
NO : oxyde d’azote
NOS : oxyde nitrique synthase NYHA: New York Heart Association obVIC : VIC ostéoblastique OCT: Optimal Cutting Temperature
OF - FO : ovariectomized female – femelle ovariectomisées OPG : ostéoprotégérine
ox-LDL / LDLox : oxidized LDL / LDL oxydé oxLDL : LDL oxide
PCR : polymerase chain reaction
PCSK9 : protéine convertase subtilisine/kexine de type PDE5 : phosphodiestérase
PG : protéoglycane Pi : phosphate inorganique PI3K : phosphoinosistide 3-kinase
PiT-1 : transporteur de phosphate inorganique – 1 PKC : protéine kinase C
PLox : phospholipide oxydé PPi : pyrophosphate
Prkcd : gène de la protein kinase C delta
PTPN22 : protein tyrosine phosphatase non-receptor type 22 PWD : pulsed-wave Doppler
qVIC : VIC quiescente RA : régurgitation aortique
RAAS : renin-angiotensin-aldosterone system
RBPJ-κ : recombining binding protein suppressor of hairless RcpA : récepteur aux androgènes
RE : récepteur aux estrogènes
Runx2 : Runt-related transcription factor2 – facteur de transcription lié à Runt 2 siRNA : small interferent RNA – petit ARN interférent
SNP : single nucleotid polymorphism – polymorphisme d’un seul nucléotide SRAA : système rénine-angiotensine-aldostérone
SR-B1 : scavenger receptor class type 1 SRXN1 : sulfiredoxin-1
SV : stroke volume
SVA : sténose valvulaire aortique T2D : type-2 diabetes
TAV : tricuspid aortic valve – valve aortique tricuspide TCF : T-cell factor
TCM – MCT : testosterone supplemented castrated male – mâles castré supplémenté en testostérone TDI : tissue Doppler imaging
TDM : tomodensitométrie
TEM : transition épithélio-mésenchymateuse
TGF-β : transforming growth factor-β, facteur de croissance transformant-β
TIMP : tissue inhibitor of metalloproteinase – inhibiteur de métalloprotéinases matricielles TiT : TAV-in-TAV
TLR : toll like receptor
TNF : tumor necrosis factor, facteur de nécrose tumorale
TNFRXX : TNF receptor superfamily member XX - membre XX de la superfamille de récepteur au TNF TWAS : tissue-wide association study - étude d’association à l’échelle tissulaire
UA – AU : unité Agatston –Agatston unit UTR : untranslated transcribed region
VEGF : vascular endothelial growth factor – facteur de croissance de l’endothélium vasculaire VG : ventricule gauche
VLDL : very low density lipoprotein - lipoprotéine de très faible densité Vmax : vélocité transvalvulaire maximale
Vpeak : peak aortic jet velocity
VSMC : vascular smooth muscle cell / cellule musculaire lisse vasculaire VTI : velocity-time integral
Liste des acronymes
ANOVA : Analysis Of Variance
ASPEN : Aortic Stenosis and PhosphodiEsterase Type 5 iNhibition
ASTRONOMER : Aortic Stenosis Progression Observation : Measuring the Effect of Rosuvastatin EAVaLL : Early Aortic Valve Lipoprotein(a) Lowering Trial
HEPES : acide4-(2-hydroxyéthyl)-1-pipérazine éthane sulfonique
ICAM : intercellular adhesion molecule, molécule d’adhésion intercellulaire JAK : Janus Kinase
JNK : c-Jun N-terminal kinase
MASDAS : Mouse Animal model of Sex Differences in Aortic Stenosis MALAT1 : metastasis associated lung adenocarcinoma transcript 1 OBAV : old bicuspid aortic valve / patient âgée avec une valve bicuspide
OBSERVANT : OBservational Study of Effectiveness of transcatheter aortic valve implantation with new geneRation
deVices for severe Aortic steNosis Treatement
PARTNER : Placement of AoRTic TraNscathetER RANKL : receptor activator of NF-κB ligand RIAS : Ramipril In Aortic Stenosis
ROCK : Rho-associated protein kinase, protéine kinase associée à Rho
SALTIRE : Scottich Aortic Stenosis and Lipid Lowering Trial, Impact on Regression SAQ : Seattle Angina Questionnaire
SAVR : surgical aortic valve replacement
SCOPE-AS : symptomatic cardiac obstruction – pilot study of enalapril in aortic stenosis SEAS : Simvastatin and Ezetimibe in Aortic Stenosis
SERCA2a : ATPase 2a du réticulum endoplamsique STAT : Signal Transducers and Activators of Transcription TAVR : transcatheter aortic valve replacement
TRAIL : TNF-related apoptosis inducing ligand
TRAIL-R : TNF-related apoptosis inducing ligand receptor VEC : valve endotehelial cell - cellule endothéliales de valve VIC : valve interstitial cell - cellule interstitielle de valve ViV : valve-in-valve
XIAP : X-linked inhibitor of apoptosis protein - protéine inhibitrice liée au chromosome X YBAV : young bicuspid aortic valve / patient jeune avec une valve bicuspide
Avant-propos
Les travaux de recherche présentés dans ce mémoire de maîtrise ont été réalisés au Centre de Recherche de l’Institut Universitaire de Cardiologie et de Pneumologie de Québec sous la direction du Dre Marie-Annick Clavel et la co-direction du Dr Patrick Mathieu.
L’article présent dans ce manuscrit est un article original intitulé « Age, sex and valve phenotype differences in fibro-calcific remodeling of calcified aortic valve ». Cet article a été soumis au journal Journal of
the American Heart Association en janvier 2020 et a été accepté en avril 2020. L’étudiant est co-premier auteur avec
Martine Voisine et Mylène Shen. Les autres co-auteurs sont Anne-Julie Boilard, Dr Benoît Filion, Dr Mickael Rosa, Dr Yohan Bossé, Dr Patrick Mathieu, Dre Nancy Côté et Dre Marie-Annick Clavel. Dans cette étude, l’étudiant a participé à la constitution des cohortes de patients et a effectué la totalité de l’étude histologique, à la coupe des tissus valvulaire, à l’analyse des résultats et la rédaction de la première version de l’article.
Introduction
La sténose valvulaire aortique (SVA) est une pathologie dégénérative de la valve aortique qui touche 2 à 4% de la population âgée de plus de 65 ans et 4,6% des personnes âgées de plus de 75 ans1,2. Dans son stade le plus avancé,
la valve aortique est épaissie et calcifiée conduisant à son défaut de fonctionnement, impactant le système cardiovasculaire et entraînant des complications dangereuses pour la santé des patients s’ils ne sont pas pris en charge. Les facteurs de risque majeurs de la SVA sont l’âge, le sexe, la dyslipidémie ainsi que la bicuspidie, une maladie congénitale touchant 2% de la population générale qui se traduit par une malformation de la valve aortique favorisant le développement d’une SVA. Depuis bientôt 20 ans, il est reconnu que pour une même sévérité hémodynamique, les hommes présentent une calcification aortique plus importante3. Il a également été montré que le degré de calcification valvulaire est fortement
corrélé à la sévérité hémodynamique. Néanmoins, très peu d’études se sont intéressées aux différences physiopathologiques pouvant exister dans ces mécanismes entre les hommes et les femmes. Là où la calcification prend une part prépondérante chez les hommes, chez les femmes, la fibrose serait si importante qu’elle aurait le même impact sur la sévérité de la maladie.
Cependant, à ce jour, seulement 4 articles originaux ont étudié les probables différences liées au sexe dans la physiopathologie de la SVA, mais aucun des auteurs ne s’est intéressé à l’implication des hormones sexuelles4-7. Les
observations de ces articles originaux réalisés sur des cellules interstitielles de valves animales et humaines (VICs), suggèrent que les processus de calcification seraient plus importants chez les mâles, notamment avec des processus liés à l’inflammation plus fortement activés. Chez les femelles, les mécanismes de survie cellulaire permettraient de limiter la production de calcium par les VICs. De même, aucune étude s’intéressant aux différences liées au sexe dans la physiopathologie de la SVA n’a été réalisée sur un modèle in vivo. Enfin, aucune étude n’a investigué s’il existait des différences liées au sexe dans la physiopathologie de la SVA chez des patients présentant une valve bicuspide, et si ces différences étaient les mêmes chez les patients avec une valve anatomiquement normale.
Ainsi, cette maîtrise vise à étudier l’impact du sexe chez des patients ayant une valve bicuspide. Nous comparerons nos résultats avec ceux obtenus chez des patients dont la valve est anatomiquement normale. Cette étude devrait nous donner de nouvelles informations précieuses pour améliorer la compréhension de la physiopathologie de la SVA.
Chapitre 1 – La sténose valvulaire aortique :
présentation clinique et physiopathologique
1.1 Anatomie, épidémiologie, présentation clinique et traitement
de la sténose valvulaire aortique
1.1.1 La valve aortique : anatomie et fonction
On dénombre 4 valves cardiaques : la valve mitrale (entre l’oreillette gauche et le ventricule gauche), la valve aortique (entre le ventricule gauche et l’aorte), la valve tricuspide (entre l’oreillette droite et le ventricule droit), et la valve pulmonaire (entre le ventricule droit et l’artère pulmonaire ; Figure 1-1). Ces 4 valves ont la fonction d’assurer le passage unidirectionnel du sang dans le cœur. Dans ce mémoire, nous allons nous intéresser à la valve aortique (Vao), située entre le ventricule gauche (VG) et l’aorte. Lors de la systole, la pression exercée sur la valve aortique par le ventricule gauche sera supérieure à la pression exercée par la colonne du sang dans l’aorte, entrainant ainsi l’ouverture de la valve aortique et le passage du sang. À la fin de la systole, la pression dans le ventricule gauche chute et redevient inférieure à la pression dans l’aorte, permettant ainsi la fermeture de la valve aortique8. La valve
aortique s’ouvre et se ferme plus de 100 000 fois par jour pour assurer le passage unidirectionnel du flux sanguin, nécessitant de coordonner les mouvements des cuspides de la valve.
Figure 1-1 : Anatomie du cœur9.
1.1.1.1 Les différentes couches anatomiques de la valve aortique et leur fonction
Les cuspides de la valve aortique sont définies comme étant des replis d’endocarde rattachés à la paroi aortique. Chaque cuspide est composée d’une couche externe de cellules endothéliales de valves (VECs) bordant trois couches de matrice extracellulaire (MEC) (la fibrosa, la spongiosa et la ventricularis), possédant chacune une fonction et des propriétés biomécaniques spécifiques10 et peuplées de cellules interstitielles de valve (VICs)11,12
(Figure 1-2). Valve pulmonaire Oreillette droite Valve tricuspide Ventricule droit Oreillette gauche Valve aortique Valve mitrale Ventricule gauche Veines pulmonaires
Veine cave inférieure Veine cave supérieure
Aorte Artère pulmonaire
Figure 1-2 : Anatomie de la valve aortique et de ses différentes couches structurelles13. A gauche,
un schéma de valve aortique avec les 3 sous-couches ; à droite, une valve saine colorée au pentachrome de Movat (jaune : fibres de collagène, bleu : glycosamynoglycane, violet : fibres d’élastine, noir : noyaux cellulaires)
La ventricularis se caractérise par une proportion d’élastine plus importante que dans les autres couches de la valve. Il a été suggéré que la propriété mécanique isotropique de la valve aortique est principalement due à l’élastine14-16. Le rôle de cette protéine fibreuse, dans la valve aortique porcine, serait de permettre un retour du
collagène dans un état de repos, après la fin de chaque cycle. De plus, lorsque la valve est ouverte à son maximum, lors de la systole, l’élastine permet de réduire la tension exercée sur la valve par le passage du sang.
La spongiosa est la couche intermédiaire de la valve aortique et est majoritairement composée de glycosaminoglycanes (GAG) et protéoglycanes (PG) (versicane, biglycane, decorine, huyluronane) hautement hydratés17, mais l’on y retrouve également des fibres de collagène ainsi que de la fibronectine18. Ces molécules, du
fait de leur propriété hydrophile, rendent la spongiosa riche en eau, contribuant à lui donner de la souplesse et de la plasticité. La spongiosa est le tissu « lâche » de la valve aortique, et même si la nature de son rôle reste encore à démontrer, l’hypothèse la plus répandue est que son architecture particulière confère à la valve une flexibilité et une capacité à absorber et dissiper les forces auxquelles elle est soumise19, limitant les forces de cisaillement entre la
ventricularis et la fibrosa12,20.
La fibrosa est la couche située sur la face aortique des cuspides de la valve, c’est la couche la plus épaisse et elle est majoritairement constituée de collagène de type I. La fibrosa semble être la couche principalement impliquée dans la résistance de la valve aortique lors de son ouverture21. Vesely a montré que dans cette couche,
l’élastine permet de ramener les fibres de collagène dans leur configuration de départ. Toutefois, l’apport de l’élastine de la fibrosa sur la biomécanique de la cuspide serait beaucoup moins important que celui de l’élastine de la ventricularis14.
1.1.1.2 Les forces mécaniques subies par la valve aortique
La valve aortique subit différentes forces mécaniques : force de pression, force de cisaillement, contrainte de flexion, et étirement axial22 (Figure 1-3).
Figure 1-3 : Forces mécaniques appliquées à la Vao durant la systole (à gauche) et la diastole (à droite)22.
La force de pression exercée sur la valve aortique est différente lors de la systole et lors de la diastole. Cette force est supportée par la fibrosa, puis est transmise des fibres de collagène vers les cellules du tissu valvulaire qui sont alignées avec les fibres de collagène23. Les forces de cisaillement sont subies par la face ventriculaire de la
valve lors de la systole (stress laminaire) et par la face aortique lors de la diastole (stress oscillatoire), et modulent l’orientation et l’élongation des cellules endothéliales24,25. La contrainte de flexion est due aux changements de
courbure des feuillets lors du cycle cardiaque et elle exerce à la fois une force de tension (sur la face convexe/ventriculaire) et de compression (sur la face concave/aortique). L’étirement axial est la force qui est subie par la valve lorsque les feuillets s’étirent pour réaliser une zone de coaptation adéquate. La capacité d’étirement de la valve diminue au cours de la vie, provoquant ainsi une coaptation sous-optimale et conduisant à une régurgitation aortique26. La diminution de l’étirement du feuillet avec l’âge est provoquée par la synthèse d’une fibre de collagène
plus épaisse nécessitant d’exercer une force plus importante pour atteindre une élongation identique à celle d’une fibre de collagène de largeur normale.
Les composants de la valve sont soumis à un stress mécanique permanent et doivent, conserver une durabilité afin de pouvoir résister à ce stress durant des années. Ainsi la valve aortique comporte 3 populations de cellules distinctes : les cellules endothéliales de la valve, les cellules interstitielles de la valve, et les cellules musculaires lisses (CML)27.
1.1.1.3 Les cellules de la valve aortique
Les VECs qui délimitent la surface de la valve aortique, sont des cellules relativement proches des autres cellules endothéliales que l’on peut trouver dans le système vasculaire, mais présentent toutefois des différences phénotypiques. Les VECs sont alignées perpendiculairement au flux sanguin28, contrairement aux cellules
engendre donc des activations de voies de signalisation différentes25. Au sein même de la valve aortique, les VECs
présentent un profil d’expression différent en fonction de leur localisation sur la face ventriculaire ou aortique de la cuspide29. Les VECs ont un rôle dans le maintien de la bonne homéostasie de la valve en régulant la prolifération
des VICs et en maintenant leur état quiescent30. Les VECs modulent également la production de collagène des
VICs31. Au vu des propriétés anti-calcifiantes des VECs, une dysfonction de l’endothélium due à une lésion de la
valve peut altérer les propriétés protectrices des VECs et donc avoir un effet défavorable sur la calcification de la valve32.
Les VICs sont présentes en grand nombre dans toutes les couches de la valve aortique et sont indispensables au maintien de l’intégrité de la valve. Les VICs synthétisent les composants de la MEC, ainsi que diverses enzymes, comme les métalloprotéinases matricielles (matrix metalloproteinase, MMP) et leurs inhibiteurs (tissue inhibitor metalloproteinase, TIMP), nécessaires à la régulation du remodelage du collagène et des autres composants du tissu valvulaire12. La population des VICs au sein de la Vao est très hétérogène12,33. On dénombre 6
sous-populations de VICs : les cellules endothéliales/mésenchymateuses progénitrices, les VICs quiescentes (qVICs), les VICs activées (aVICs), les VICs progénitrices, les VICs dérivant de l’endothélium (eVICs) et les VICs ostéoblastiques (obVICs) 34. Chaque sous-population de VICs possède un phénotype et une fonction qui lui est
spécifique.
- Cellules endothéliales/mésenchymateuses progénitrices : ce sont les cellules qui, durant la valvulogénèse, subissent la transition épithélio-mésenchymateuse (TEM), processus qui initie la formation de la valve aortique. Ce sont les cellules endothéliales de la valve qui migrent vers le coussin endocardique et qui se différencient en VICs.
- qVICs : les VICs quiescentes sont dans un état de repos et maintiennent la physiologie normale de la valve aortique. Leur dénomination « quiescente » ne signifie pas que ces cellules ont une activité mitotique faible, mais permet de les différencier des aVICs, qui sont phénotypiquement et fonctionnellement différentes.
- aVICs : ce sont les VICs qui répondent à un phénomène pathologique lors d’une lésion de la valve aortique. Dans une valve saine, les aVICs représentent 5% de la population cellulaire totale 27, alors
que dans les modèles in vitro, elles représentent plus de 90% de la population, ce qui montre la capacité des qVICs à rapidement devenir actives33,35. Les aVICs ont une capacité contractile plus grande, ont
un taux de prolifération plus important, ont la capacité de sécréter et de remodeler la MEC, et surexpriment des fibres de stress36 ainsi que le marqueur myofibroblastique actine-α du muscle lisse
(α-smooth muscle actin, α-SMA)27,37. Les aVICs représentent la population charnière entre l’état
- pVICs : ces cellules pourraient être impliquées dans la réparation du tissu valvulaire et trouvent leur origine à l’extérieur du tissu valvulaire. On distingue trois types cellulaires de pVICs : les cellules endothéliales progénitrices38, les cellules dendritiques; et enfin les cellules hématopoïétiques de moelle
osseuse.
- eVICs : ces cellules sont des VECs ayant subi une TEM et sont impliquées dans la réparation du tissu valvulaire39. Il est important de noter que les VICs « natives » de la valve ont la capacité d’inhiber la
TEM et la différenciation ostéogénique des VECs.
- obVICs : ce sont les cellules qui régulent l’ostéogénèse dans la valve aortique, responsable du dépôt actif de calcification40-42. Les obVICs sont absentes de la valve aortique saine. A l’heure actuelle, il n’y
a pas de certitude à savoir si les obVICs viennent uniquement des aVICs et des eVICs, ou bien si les qVICs peuvent également subir cette différentiation ostéogénique.
Les CML sont présentes dans la Vao mais en faible proportion, moins de 5% de la population cellulaire totale de la valve27. Les CML ont une origine embryologique43, mais peuvent également provenir de la différenciation
de cellules précurseurs myofibroblastiques. La localisation, l’organisation, et la nature même des CML dans la Vao suggèrent qu’elles participent à la bonne mécanique de l’appareil valvulaire.
1.1.2 La sténose aortique : épidémiologie et présentation clinique
1.1.2.1 Histoire naturelle de la sténose valvulaire aortique
La sténose valvulaire aortique (SVA) se traduit, au commencement, par une sclérose de la valve, un épaississement des feuillets valvulaires qui ne va pas entraver le passage du sang. Cette sclérose va évoluer progressivement et altérer le passage du sang du ventricule vers l’aorte, et devenir une sténose.
La sclérose de la valve est une altération morphologique de la valve relativement courante puisqu’elle atteint environ 25% de la population âgée de 65 ans, et ce pourcentage augmente avec l’âge44-46. Bien que la sclérose
n’entraîne pas de dysfonction de la Vao, elle est malgré tout associée à une augmentation de la mortalité cardiovasculaire46. Parmi les patients présentant une sclérose de la Vao, 16% d’entre eux vont la voir évoluer en
sténose47,48. La SVA se différencie de la sclérose par la présence de calcification au niveau des feuillets valvulaires,
qui vont participer au défaut d’ouverture de la valve. Au début de l’étape de sténose, le patient ne présente pas de symptôme et le risque de décès est inférieur à 1%49-51. La vitesse de progression, ainsi que l’impact de la sténose
sur le ventricule gauche et l’aorte vont varier selon chaque patient46,50,52-56. Les premiers symptômes que les patients
atteints de SVA vont présenter sont une intolérance à l'effort et une dyspnée56-58 et ceux-ci vont survenir généralement
vers l’âge de 70-80 ans chez les patients n’ayant pas de malformation congénitale59. Dans les stades les plus sévères
de la SVA, les patients présentent de l’angines de poitrine, des syncopes et une insuffisance cardiaque56,60. Si les
significativement, c’est pourquoi l’évaluation des symptômes est fondamentale dans la bonne prise en charge des patients.
1.1.2.2 Les outils diagnostiques pour l’évaluation de la SVA
Il existe plusieurs outils permettant de diagnostiquer et d’évaluer la sévérité d’une SVA. Une SVA peut être suspecté chez un patient dès son auscultation par un médecin à l’aide d’un stéthoscope. En effet, la présence d’un souffle cardiaque ainsi que la difficulté à percevoir un pouls va être une première indication de la présence d’une SVA. Un test d’effort sur tapis ou ergocycle est également un outil permettant d’aider au diagnostic de la SVA61-63.
L’échocardiographie-Doppler est le principal examen paraclinique étape permettant de confirmer le diagnostic de la SVA et d’en évaluer la sévérité et l’atteinte morphologique. L’échographie standard permet de détecter un objet et sa forme par l’utilisation d’ultrasons. À l’aide d’une sonde, des ultrasons vont être émis et, lorsque ceux-ci vont rencontrer un obstacle, ils seront renvoyés et captés par la sonde émettrice. Le logiciel peut ensuite, par calcul de la durée de temps séparant l’émission et la réception des ondes, déterminer la forme et l’emplacement de l’objet. L’écho-Doppler repose sur un principe identique, mais est en plus capable de déterminer le sens et la vitesse de déplacement d’un élément en mouvement. Dans le cadre de l’échocardiographie, les éléments en question vont être les cellules circulantes du sang. L’examen échocardiographique se fait généralement par voie transthoracique, mais lorsque les patients présentent une faible échogénicité (par exemple les patients obèses), l’examen est réalisé par voie œsophagienne. Les principales caractéristiques hémodynamiques de la Vao évaluées par échocardiographie sont développées dans la section 1.1.2.5. Le VG est fortement impacté par la dysfonction valvulaire aortique, ainsi, l’échocardiographie permet d’évaluer la fonction et la géométrie ventriculaire gauche, apportant d’autres informations corroborant la sévérité de la SVA.
Même si l’échocardiographie est l’examen de référence dans l’évaluation de la SVA, d’autres examens sont souvent effectués afin d’affiner le diagnostic. Il est possible notamment de quantifier le taux de calcification de la valve aortique par tomodensitométrie (TDM), une méthode d’imagerie basée sur l’utilisation de rayon X64. Cet examen
clinique permet une évaluation complémentaire à l’examen échocardiographique et affine le diagnostic, puisqu’il permet entre autres de mesurer l’aire valvulaire aortique par planimétrie. La TDM est particulièrement intéressante chez les patients dont l’évaluation échocardiographique est difficile, et est principalement utilisée pour quantifier le calcium valvulaire (ou score calcique), déterminée grâce à la méthode d’Agatston65. Le score calcique est exprimé
en unité arbitraire. Selon Clavel et al., une SVA est sévère (Vmax supérieure 4 m.s-1) à partir d’un score calcique
supérieur à 2000 unités arbitraires chez les hommes, et supérieur à 1200 unités arbitraires chez les femmes66,67.
Le cathétérisme cardiaque étant de moins en moins pratiqué, et l’imagerie par résonnance magnétique ainsi que la tomographie par émission de positron étant principalement employées dans le secteur de la recherche, nous ne détaillerons pas ces examens dans cette section.
1.1.2.3 L’épidémiologie de la sténose valvulaire aortique
La SVA touche principalement une catégorie âgée de la population, puisque sa prévalence augmente avec l’âge1,2,40,68. En effet, en 1995, la prévalence de la SVA était estimée à 1,3% de la population âgée de 65 à 74 ans,
et à 4% chez les patients âgés de plus 85 ans69. Deux études plus récentes suggèrent une augmentation de la
prévalence de sténose aortique modérée à sévère avec l’âge1,2. La première a été réalisée par le National Health, Lung and Blood Institute (NHLBI) sur des patients ayant reçu une échocardiographie de dépistage et rapporte une
prévalence de la SVA inférieur à 0,02% chez les patients âgés de 18 à 44 ans, et une prévalence supérieure à 2,8% chez les patients âgés de plus de 75 ans. La deuxième étude a été réalisée sur une population de personnes vivant dans le comté de Olmsted, dans le Minnesota et, pour les mêmes tranches d’âges de l’étude du NHLBI, Nkomo et ses collaborateurs ont observé une prévalence respectivement de 0.7% et 13.3%. L’espérance de vie étant en augmentation à travers le monde, la plupart des pays occidentaux voit leur population vieillir, ce qui explique l’augmentation de l’incidence de la sténose aortique dans ces pays, et fait de cette valvulopathie un problème de santé publique majeur.En 2016, Andell et ses collaborateurs publient les résultats d’une étude réalisée auprès de la population suédoise globale, soit 10 164 211 personnes, afin d’identifier tous les patients avec un premier diagnostic de valvulopathie entre 2003 et 201070. Avant l’âge de 50 ans, l’incidence de la pathologie est inférieure à 0,25‰ de
nouveaux cas par année, puis atteint son maximum pour la tranche d’âge des 80-84 ans, avec une incidence de 4‰ nouveaux cas par année chez les hommes et 3.25‰ chez les femmes. Il est intéressant de noter que pour toutes les tranches d’âge de cette étude, l’incidence chez les femmes est toujours plus faible que chez les hommes. Au total, l’incidence de la sténose aortique chez les hommes et les femmes de la population suédoise est respectivement de 37,8 et 24,2 pour 100 000 personnes par année. Martinsson et ses collaborateurs ont également observé des différences de diagnostic chez les hommes et les femmes71. Selon leurs résultats, les patients âgés de moins de 75
ans se faisant diagnostiquer une sténose aortique sont majoritairement des hommes (environ 60%). Cependant, après 75 ans, les proportions d’hommes et des femmes présentant une SVA sont identiques.
1.1.2.4 Les facteurs de risque associés à la sténose valvulaire aortique
Il existe de nombreux facteurs de risque de développer une sténose aortique, que l’on peut distinguer en 3 groupes : les facteurs de risque biologiques innés, les facteurs de risque biologiques acquis, et les facteurs de risque environnementaux. Les facteurs de risque biologiques innés regroupent l’âge, le sexe, ou encore la présence d’une malformation congénitale (ex : bicuspidie). Nous avons vu précédemment que la prévalence et l’incidence de la SVA augmentent avec l’âge. De même, les diverses études mentionnées précédemment indiquent que les hommes présentent des signes de sténose aortique à un plus jeune âge que les femmes.
La bicuspidie est également un facteur de risque. En effet, les patients présentant cette malformation congénitale développeront une SVA 10 à 20 ans plus tôt que les patients avec une valve tricuspide72,73. De plus, il a
été montré que la bicuspidie est un facteur de risque plus fréquent chez les hommes (3 hommes atteints de bicuspidie pour 1 femme). Chez les patients avec une valve bicuspide, on observe également des différences dans les facteurs
de risque. Ainsi la proportion de patients avec bicuspidie souffrant d’hypertension ou de coronaropathie est plus grande chez les hommes que chez les femmes74, à l’instar de la population générale. La proportion de patients
présentant un diabète de type 2 n’est cependant pas significativement différente entre les sexes. Il existe également des facteurs de risque biologiques acquis, qui apparaissent au cours de la vie du patient, comme l’hypertension, les dyslipidémies, le diabète de type 2 et l’insuffisance rénale chronique1,2,75,76. Enfin, il existe des facteurs de risque
environnementaux, liés au style de vie du patient, comme l’obésité, la sédentarité et le tabagisme45,75,76.
1.1.2.5 Les caractéristiques hémodynamiques et physiologiques de la SVA
La sténose aortique est une pathologie qui se traduit par un épaississement et une rigidification de la valve aortique, entraînant un défaut d’ouverture et de fermeture de la valve aortique (Figure 1-4). Ce dysfonctionnement de la valve va avoir un impact délétère sur l’ensemble du système circulatoire. En effet, le système cardiovasculaire est soumis aux lois de la mécanique des fluides. On regroupe sous le terme « hémodynamie » toutes les propriétés physiques liées à la circulation du sang dans le système cardiovasculaire. L’écoulement du sang à travers la valve est donc soumis à l’équation suivante : v=D/S, dans laquelle v est la vitesse d’écoulement du sang (en cm.s-1), D est
le débit volumique (cm3.s-1) et S est l’aire de la valve aortique lors de la systole (en cm2).
Figure 1-4 : Représentation schématique d'une valve aortique saine et d’une valve aortique fibrocalcifiée, en position ouverte et fermée.
Dans le cas d’une SVA, l’ouverture de la valve est réduite. Cependant, le volume de sang à expulser dans l’aorte devant être constant, le ventricule gauche (VG) va devoir expulser le même volume de sang à travers un orifice valvulaire plus petit. Le VG va donc exercer une pression plus importante lors de la systole afin de répondre aux exigences imposées par la valve sténosée. La SVA impose une limitation importante au débit cardiaque car le volume de sang éjecté lors de la systole dépend de la durée de la systole et de la puissance du VG. Au fur et à mesure que la valvulopathie progresse et que la pathologie devient sévère, le VG subit un remodelage pouvant conduire à une hypertrophie. La SVA et l’atteinte du VG vont impacter la précharge et la postcharge77.
La précharge désigne la tension exercée par le volume de sang sur la paroi ventriculaire lors de la télédiastole, c’est-à-dire avant la contraction des fibres musculaires. Les fibres musculaires sont soumises à la loi de Frank-Starling (Figure 1-5), qui stipule que plus la tension exercée sur les fibres musculaires est élevée, plus la contraction suivant cette tension va-t-être puissante. Cette relation entre la tension d’étirement des fibres musculaires et la puissance de la contraction suit une pente de recrutement, jusqu’à un plateau au-delà duquel l’augmentation du
Normale Fibrocalcifiée Valve fermée
Valve ouverte
volume télédiastolique ne conduit seulement qu’à une augmentation des pressions de remplissage, mais pas à une amélioration de la performance systolique.
La postcharge est la résistance que rencontrent les fibres myocardiques lors de leur contraction. Cette force est définie pour le cœur comme la tension de paroi ventriculaire maximale en cours de systole et se mesure en force par unité de surface (dynes/cm²). Plusieurs facteurs influencent la postcharge : la résistance artérielle périphérique, la compliance aortique et la rigidité de la valve aortique. Ces 3 facteurs exercent une force d’opposition à l’éjection ventriculaire. La résistance artérielle périphérique reflète la capacité d’écoulement du sang dans les artères de petits calibres (artérioles, capillaires). Une déficience de la vasodilatation de ces vaisseaux provoque une augmentation de la résistance artérielle, une augmentation de la pression artérielle et une augmentation de la postcharge. La compliance aortique est la capacité de la paroi aortique à s’étirer lorsqu’elle subit une pression, augmentant ainsi son volume. Cette capacité permet notamment de maintenir une pression dans les vaisseaux malgré le rythme discontinu de la pompe cardiaque78. La compliance aortique peut être notamment réduite par la présence de plaques
athérosclérotiques, augmentant ainsi la postcharge. Or, la prévalence des plaques athérosclérotiques est plus grande chez les patients présentant une SVA (30% - 54%) comparés à des patients n’ayant pas de SVA (10% - 19%)79-82.
Enfin, les feuillets rigidifiés de la valve aortique vont opposer une résistance importante au flux lors de l’éjection ventriculaire, conduisant aussi à une augmentation de la postcharge. Plus la postcharge est élevée, plus la fraction de raccourcissement du myocarde et sa vélocité de contraction sont faibles, donc plus la performance du VG sera abaissée. À terme, la progression de la SVA va conduire au développement d’une insuffisance cardiaque, entraînant la mort du patient, s’il n’est pas pris en charge.
Figure 1-5 : La loi Frank-Starling : courbe de fonction ventriculaire77. Pour un cœur sain, une même variation de
précharge obtenue par des épreuves de remplissage vasculaire successives par exemple (R1 à Rn) augmente beaucoup le volume d’éjection systolique dans la proportion ascendante de la courbe de fonction ventriculaire (R1, zone de précharge-dépendance) (double flèches). Cependant, dans la situation Rn, les pressions de remplissage augmentent fortement et exposent à la congestion en amont du ventricule (non montré sur la figure).83
La sténose aortique est une pathologie progressive dont la communauté scientifique a défini et caractérisé les différents degrés de sévérité (Annexe A). Ceux-ci sont définis par les caractéristiques hémodynamiques, l’anatomie de la valve, les conséquences de l’obstruction de la valve sur le VG et sur le système vasculaire, et par les symptômes présentés par le patient. Les caractéristiques hémodynamiques sont mesurables par
R1 Rn Vol um e d’ éj ectio n sy sto liqu e Précharge
échocardiographie-Doppler (écho-Doppler). Ainsi, 3 caractéristiques mesurables par échocardiographie permettent de déterminer le degré sévérité de la SVA :
- La vélocité transvalvulaire maximale (Vmax) : vitesse maximale à laquelle le sang s’écoule à travers la valve lors de la systole, exprimée en mètre par seconde (Figure 1-6). Une Vmax élevée est synonyme de rétrécissement de l’aire valvulaire aortique. Le débit de sang passant à travers la valve doit être constant. Si l’orifice par lequel le sang doit passer est réduit, la vitesse à laquelle il passera au travers sera augmentée.
Figure 1-6 : Tracés de vélocités transaortiques obtenues par échocardiographie Doppler. A gauche : forme de la courbe en présence d’une obstruction sévère de la valve aortique ; à droite : forme de la courbe en présence d’une obstruction légère de la valve aortique. - Le gradient de pression moyen (GM) : la différence de pression qui existe entre la pression ventriculaire
et la pression aortique, en millimètre de mercure (mmHg). Le GM est la moyenne de la somme des gradients instantanés. Le GM est positivement corrélé au degré de sévérité de la SVA. En effet, dans un contexte de SVA, la pression intraventriculaire peut augmenter en réponse à la rigidification des feuillets de la valve. Plus la valve se rigidifie, plus le ventricule doit exercer une pression importante, plus la différence de pression entre la VG et l’aorte va augmenter. Le GM est calculé par l’appareil d’échocardiographie à partir de l’acquisition de la vélocité transvalvulaire et est calculé grâce à l’équation de Bernoulli : ΔP= 4 x (V²Vao – V²CCVG) dans laquelle ΔP est le gradient de pression, V²Vao est
le carré de la vélocité dans l’aorte et V²CCVG est le carré de la vélocité dans la chambre de chasse du
VG (CCVG). Le GM est calculé à partir de la courbe de la Vmax dessinée à l’écran.
- L’aire valvulaire aortique (AVA) : la surface effective d’ouverture de la valve aortique, c’est-à-dire l’aire de la lumière de la valve aortique occupée par le sang et non par les feuillets de la valve. Elle se calcule grâce à l’équation de continuité qui indique que le flux à travers la CCVG est le même que le flux passant à travers la valve : SVAo x ITVVao = SCCVG x ITVCCVG, dans laquelle S est la surface en cm² et
ITV est l’intervalle temps-vitesse en cm. La SCCVG se calcule en mesurant son diamètre par
échocardiographie et l’ITV se mesure également par échocardiographie-Doppler grâce au flux. L’AVA peut être indexée à l’aire de la surface corporelle (AVAi). Ce calcul permet de corriger l’AVA pour les différences morphologiques interindividuelles. En effet, plus la surface corporelle d’un patient va être élevée, plus la réduction de l’AVA va être délétère pour le patient. Toutefois, chez les personnes
obèses, l’indexation de l’AVA peut être une source d’erreur en surestimant la sévérité de la SVA du patient.
Une personne n’étant pas atteinte de SVA aura une Vmax inférieure à 2 m.s-1, un GM inférieur à 20 mmHg,
une AVA supérieure à 2 cm² et aucune calcification valvulaire. La prise en charge du patient et le traitement qui lui sera prescrit va dépendre du degré de sévérité de la SVA qu’il présente. Le guide de pratique de l’American Heart
Association / American College of Cardiology (AHA/ACC) de 2014 a défini 4 stades dans la progression de la SVA (A,
B, C1 cet C2)84 dont les caractéristiques sont détaillées dans l’Annexe A.Les symptômes des patients vont impacter
leur qualité de vie. La communauté scientifique a créé une classification permettant de classer les symptômes d’une maladie cardiovasculaire en fonction de son impact sur la qualité de vie du patient : la classification NYHA. Un test de marche de 6 minutes peut être effectué par le patient afin de déterminer sa classe fonctionnelle, en complément de l’échocardiographie. L’impact des symptômes sur la qualité de vie des patients est catégorisé en 4 classes (Annexe B).
1.1.2.6 L’impact de la SVA sur le ventricule gauche
Le remodelage cardiaque se définit comme des « changements moléculaires et cellulaires qui se manifestent de manière clinique par des changements de taille, de forme et de fonction du cœur après une lésion »85,
et apparaît dans les cœurs atteints de SVA sévère avec surcharge de pression86. Le rétrécissement de la valve
aortique va conduire à une surcharge de pression du VG87. La réponse à cette surcharge de pression va être un
remodelage du VG, qui peut être concentrique ou excentrique, avec ou sans hypertrophie, et qui va conduire à une augmentation de la paroi ventriculaire et une diminution de la cavité du VG. Le remodelage du VG va, dans un premier temps, permettre de compenser l’altération hémodynamique induit par le rétrécissement aortique. Cependant, à long terme, le remodelage va devenir délétère, avec la survenue d’apoptose des cardiomyocytes et de fibrose, avec une altération de la fonction systolique et diastolique88.
1.1.3 La prise en charge des patients et le traitement de la SVA
À l’heure actuelle, malgré les nombreuses voies impliquées dans la physiopathologie de la SVA, il n’existe pas de traitement pharmacologique efficace permettant de ralentir, stopper, ou même renverser la progression de la physiopathologie. Ainsi, de nos jours, le seul traitement efficace contre la SVA reste le remplacement valvulaire par voie chirurgicale ou percutanée. Dans cette section, nous allons aborder dans un premier temps les traitements de remplacements valvulaires, puis nous ferons un tour d’horizon des traitements pharmacologiques ayant été proposés.
1.1.3.1 Les recommandations des guides de pratique
Ce sont les guides de pratique de l’AHA/ACC et de l’European Society of Cardiology (ESC) qui guident le clinicien dans la prise en charge d’un patient. Pour cela, les cliniciens doivent tout d’abord déterminer la sévérité
hémodynamique de la sténose aortique du patient et son état de santé (âge, présence de comorbidités, contre-indications particulières). Ensuite, à l’aide d’un tableau de classification des recommandations et des niveaux d’efficacité du traitement, et après avoir déterminé les risques liés à l’intervention, les cliniciens vont pouvoir décider si le patient est éligible à la chirurgie ou s’il est préférable de lui implanter une nouvelle valve par voir percutanée (Annexe C).
1.1.3.2 Les traitements par remplacement valvulaire chirurgical et par implantation percutanée de
bioprothèse
1.1.3.2.1 Les prothèses chirurgicales
Les prothèses chirurgicales nécessitent une sternotomie médiane sous anesthésie générale avec circulation extracorporelle. Cette opération est risquée pour les patients âgés présentant des comorbidités, et est souvent réservée aux patients présentant un faible risque de complications liées à la chirurgie. La chirurgie est également la méthode favorisée pour les patients présentant une valve bicuspide, en raison des complications liées à ce phénotype valvulaire, comme la dilatation de l’aorte. De plus, la forme ovoïde de la racine aortique des valves bicuspides peut être responsable d’une mauvaise étanchéité des valves implantées par voie percutanée et être source de fuites paravalvulaires.
Il existe 2 types de valves chirurgicales : les valves mécaniques et les valves biologiques. Les valves mécaniques, composées de métal ou de carbone, ont une longue durée de vie. Cependant, du fait de leur structure, elles respectent peu l’orientation et le mouvement du flux sanguin et imposent donc des forces de cisaillement importantes. Cela, comme le revêtement métallique de ces prothèses, va enclencher la cascade de coagulation pouvant conduire à la formation d’une thrombose des feuillets. Les patients ayant des valves mécaniques reçoivent donc un traitement à vie à base d’anticoagulants oraux, ce qui peut entraîner des risques de saignements spontanés (au gastro-intestinal par exemple) ou un de saignements suite à un traumatisme (hématome sous-dural) qui peuvent être la cause de mortalité ou de morbidité89. La longue durée de vie de ces prothèses est la raison pour laquelle ce
sont les prothèses les plus implantées chez les patients jeunes. En effet, les prothèses biologiques (ou bioprothèses) ont une durée de vie de 10 à 20 ans. Moins de 15% des valves implantées dégénèrent dans la première décennie, puis on observe une augmentation de l’incidence90. Du fait que ce soit de vraies valves, leur hémodynamie est
optimale. Ainsi, et malgré une durée de vie plus faible, on observe depuis les années 90 une augmentation du nombre de bioprothèses implantées, et parallèlement une diminution de l’implantation de valves mécaniques91.
1.1.3.2.2. Les prothèses implantables par cathéter
L’implantation d’une prothèse par cathéter est un procédé relativement récent puisque la première implantation de valve par cette méthode date de 200292. Cette technique permet d’implanter une valve prothétique
chez un patient sans qu’il n’ait à subir une chirurgie à cœur ouvert. C’est pourquoi les bioprothèses étaient, dans leurs premières utilisations, réservées aux patients chez qui l’intervention chirurgicale était contre indiquée. Ces
dernières années, le nombre de valves percutanées implantées a considérablement augmenté pour les patients les plus âgés pour lesquels le risque chirurgicale est très élevé (Figure 1-7)93.
Figure 1-7 : Évolution du nombre de valves percutanées implantées93.
mech-SAVR : valves mécaniques implantées par voie chirurgicale, bio-SAVR : bioprothèses implantées par voie chirurgicale, TAVR : bioprothèses implantées par voie percutanée.
L’opération de remplacement peut être réalisée par différente voies d’accès : transseptale antérograde, transfémorale, sous-clavière, transaortique, transapicale, transcarotidienne 94. Contrairement à la chirurgie classique,
le remplacement valvulaire par voie percutanée permet d’éviter l’arrêt temporaire du cœur et la mise en place d’une circulation extracorporelle. Les prothèses implantées par voie percutanée sont toutes d’origine biologique.
Nous allons maintenant, à travers le chapitre suivant, faire un état de la physiopathologie générale de la SVA. Les différences liées au sexe, d’un point de vue clinique et physiopathologiques seront abordées dans le 3ème
chapitre qui leur est exclusivement dédié, afin de nous focaliser sur ce seul sujet.
1.2 La physiopathologie de la sténose valvulaire aortique
1.2.1 Généralités
La SVA est une pathologie caractérisée par la fibro-calcification des feuillets de la valve aortique conduisant à un défaut fonctionnel de la valve aortique (Figure 1-8)95.