UNIVERSITE TOULOUSE III- PAUL SABATIER
U.F.R SVTTHESE
En vue de l’obtention du
DOCTORAT DE L’UNIVERSITE PAUL SABATIER
délivré par l’Université Toulouse III-Paul Sabatier
Discipline : innovation pharmacologique
présentée et soutenue
par
Jean-Philippe PRADERE
Le 26 Novembre 2007
Titre
ETUDE DE LA REGULATION ET DU ROLE DE L’AUTOTAXINE ET DE L’ACIDE LYSOPHOSPHATIDIQUE DANS LE TISSU ADIPEUX ET LE REIN
Directeur de thèse :
Dr Jean-Sébastien SAULNIER-BLACHE
JURY
Pr Thierry LEVADE Président
Professeur des Universités-Praticien Hospitalier
Pr Karine CLEMENT Rapporteur
Professeur des Universités-Praticien Hospitalier
Pr Bertrand KNEBELMANN Rapporteur
Professeur des Universités-Praticien Hospitalier
Dr Olivier PEYRUCHAUD Examinateur
Table des Matières :
RESUME ... 5
ABSTRACT ... 6
LISTE DES ABREVIATIONS ... 7
LISTE DES FIGURES : ... 9
I/. INTRODUCTION GENERALE SUR L’ OBESITE:... 10
I/.1 DEFINITION ET INDEX DE MESURE : ... 10
I/.2 EPIDEMIOLOGIE : ... 11
I/.3 PHARMACOLOGIE DE L’OBESITE :... 12
II. DESCRIPTION DU TISSU ADIPEUX :... 14
II/.1 LES TISSUS ADIPEUX : ... 14
II.2 COMPOSITION CELLULAIRE DU TISSU ADIPEUX :... 15
II.3 METABOLISME DU TISSU ADIPEUX : ... 17
II.3.1 Fonction de lipomobilisation ou lipolyse :... 17
II.3.2 Fonction de stockage ou lipogénèse : ... 18
III. DEVELOPPEMENT DU TISSU ADIPEUX : ... 22
III.1 CONTROLE TRANSCRIPTIONNEL DE LA DIFFERENCIATION ADIPOCYTAIRE: ... 22
III.2 FACTEURS PRO ET ANTI-ADIPOGENIQUES : ... 24
IV. FONCTION SECRETOIRE DU TISSU ADIPEUX :... 26
IV.1. QUELLES SECRETIONS POUR QUELLES FONCTIONS PHYSIOLOGIQUES ? : ... 27
IV.2 L’ADIPOCYTE : DIFFERENTS MODES DE SECRETION : ... 36
IV.2.1 Les voies conventionnelles de sécrétion : ... 38
IV.2.2 La Sécrétion de type non-conventionnelle : ... 40
IV.2.3 Exemples de trois adipokines :... 40
V. PATHOLOGIES ASSOCIEES A L’OBESITE :... 43
VI. L’ACIDE LYSOPHOSPHATIDIQUE (LPA) ET L’AUTOTAXINE (ATX) :... 45
VI.1 L’ACIDE LYSOPHOSPHATIDIQUE (LPA) : ... 45
VI.1.1 Description et Historique: ... 45
VI.1.2 LPA dans les fluides biologiques :... 46
VI.1.3 Voies de Synthèse : ... 46
VI.1.4 Voie de dégradation : ... 48
VI.1.5 Récepteurs au LPA: ... 50
VI.1.6 Molécules analogues du LPA:... 53
VI.1.7 Effets biologiques :... 54
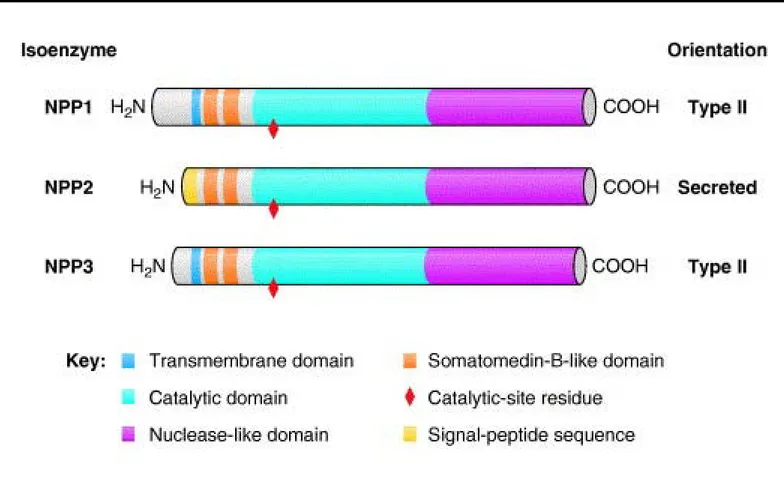
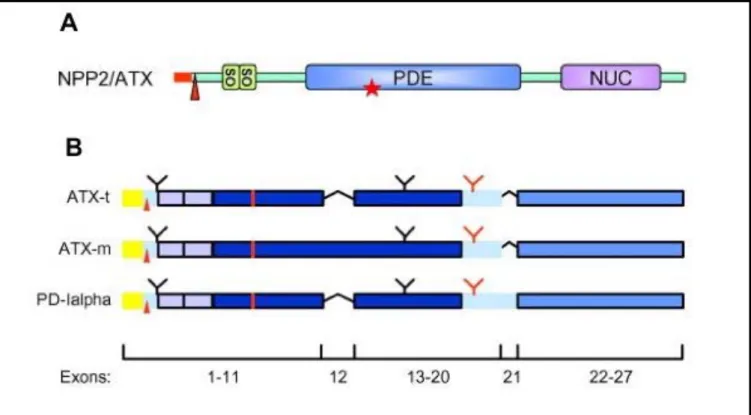
VI.2 L’AUTOTAXINE (ATX) : ... 55
VI.2.2 L’Autotaxine (autrement nommée ATX, E-NPP2, PD-Iα) :... 56
VI.3 LE COUPLE ATX-LPA ET LE TISSU ADIPEUX :... 67
OBJECTIFS... 70
PREMIERE PARTIE : ETUDE DES PROCESSUS DE SECRETION ET DE MATURATION DE L’ATX PAR L’ADIPOCYTE 3T3F442A : ... 70
DEUXIEME PARTIE : ETUDE DES EFFETS BIOLOGIQUES DU LPA DANS LE TA : ... 70
TROISIEME PARTIE : ETUDE DES EFFETS BIOLOGIQUES DU LPA DANS LE REIN :... 71
RESULTATS ... 72 ARTICLE 2 :... 72 RESULTATS COMPLEMENTAIRES : ... 80 ARTICLE 3 ... 82 RESULTATS COMPLEMENTAIRES :... 84 ARTICLE 4 ... 94 RESULTATS COMPLEMENTAIRES :... 98 PERSPECTIVES : ... 107
1- ROLES DE L’ATX ET DU LPA DANS LE TISSU ADIPEUX :... 107
2- RELATION ENTRE LPA ET FIBROSE : ... 108
3- LE TA POURRAIT-IL ETRE CONCERNE PAR LA FIBROSE ? ... 109
ANNEXES ... 113
ARTICLE 6 ... 113 REFERENCES BIBLIOGRAPHIQUES : ... 114
Résumé
Parallèlement à son activité métabolique, le tissu adipeux (TA) possède également une activité sécrétoire intense. L’Autotaxine (ATX) est une protéine soluble sécrétée par le TA qui possède une activité enzymatique de type lysophospholipase D (lysoPLD) responsable de la synthèse d’acide lysophosphatidique (LPA). Le LPA est un phospholipide générant divers effets biologiques (prolifération, motilité…) via l’activation de cinq récepteurs couplés aux protéines G (LPA1-5).
Dans un premier temps, nous avons étudié les mécanismes de maturation et de sécrétion de l’ATX par l’adipocyte 3T3F442A in vitro. Nos résultats montrent que l’ATX est une protéine N-glycosylée et que l’inhibition de la N-glycosylation empêche la sécrétion de l’ATX et inhibe son activité lysoPLD. Nous avons aussi démontré que l’ATX suit une mode de sécrétion classique après clivage protéolytique par des signal peptidases.
Dans un deuxième temps, nous avons étudié les effets biologiques du LPA au sein du TA. Nos résultats montrent que le LPA est un puissant inhibiteur de la différenciation adipocytaire via la diminution d’expression du récépteur nucléaire PPARγ2. Cet effet anti-adipogénique du LPA est confirmé par l’augmentation de la masse adipeuse des animaux invalidés pour le récepteur LPA1. Ainsi, la production locale de LPA pourrait exercer un effet tonique inhibiteur sur le développement du TA.
Dans la troisième partie du travail, nous avons étudié, chez la souris, l’implication potentielle du LPA dans la mise en place de la fibrose tubulointerstitielle rénale (FTI) induite par l’obstruction urétérale unilatérale (OUU). La FTI induite par l’OUU entraîne une augmentation de la libération de LPA par le rein et une augmentation de l’expression rénale du récepteur LPA1. Les animaux LPA1 -/-, comme les animaux traités avec l’antagoniste du récepteur LPA1, le Ki16425, sont protégés des lésions induites par l’UUO. Ce travail permet donc de proposer le récepteur LPA1 comme une nouvelle cible pharmacologique d’intérêt dans le traitement de la fibrose rénale.
Abstract
White adipose tissue is now considered as an endocrine organ because of its huge capacity for secreting a large number of factors. Among them is Autotaxin (ATX), a soluble protein possessing a lysophopholipase D activity responsible for synthesis of lysophosphatidic acid (LPA), a bioactive phospholipid able to mediate different cellular responses (proliferation, motility…) via the activation of five distinct G protein coupled receptors (LPA1-5).
In the present thesis, we first investigated the mechanisms of maturation and secretion of ATX in 3T3F442A adipocytes in vitro. Our results show that ATX is a N-glycosylated protein and that inhibition of N-glycosylation inhibits both secretion and lysoPLD activity of ATX. We also demonstrated that ATX follows a classical secretion pathway and undergoes a signal peptidase proteolytic cleavage which is required for its secretion.
The second part of our work addressed the biological effects of LPA in white adipose tissue. Our data show that LPA is a strong inhibitor of adipogenesis resulting from a down-regulation of the nuclear receptor PPARγ2. The anti-adipogenic activity of LPA is accompanied by the higher adiposity of LPA1 receptor knockout mice compared to their wild type counterpart. Therefore, the local production of LPA could exert an inhibitory effect on white adipose tissue development.
In the third part of the thesis, we studied the possible involvement of LPA in the progression of renal tubulointerstitial fibrosis (TIF) in mice subjected toan unilateral ureteral obstruction (UUO). UUO-induced TIF is associated with an increase in LPA production and LPA1 receptor expression in kidneys. In addition, LPA1 -/- mice, as well as mice treated with an LPA1 receptor antagonist (Ki16425), are protected against UUO-induced TIF. This work led us to propose LPA1 receptor as a potential pharmacological target in the treatment of renal fibrosis.
Liste des abréviations
AGL : Acides gras libres
ATGL : Adipose triglyceride lipase
ATX : Autotaxine
BSA : Bovine serum albumin
CMK : Chloro méthylkétone
CTGF : Connective tissue growth factor
DG : Diglycérides
EMT : Transition épithélio-mesenchymateuse
E-NPP : Ecto-nucléotide pyrophatase phosphodiesterase
FATP : Fatty acid transporter protein
FSV : Fraction stroma-vasculaire
FTI : Fibrose tubulointerstitielle
GTG : Gold thioglucose
HFD : high fat diet
IMC : Index de masse corporelle
LHS : Lipase hormono sensible
LPA : Acide lysophosphatidique
LPE : Lysophosphatidyl ethanolamine
LPL : Lipoprotéine lipase
LPP : Lipides phosphate phosphatase
LPC : Lysophosphatidylcholine
lysoPLD : Activité lysophospholipase D
MEC : Matrice extracellulaire
NTS : Nephrotoxic serum
OUU : Obstruction urétérale unilatérale
PA : Acide phosphatidique
PDE : Activité phosphodiestérase
PG : péri-gonadique
PLA2 :Phospholipase A2
PPARγ : Peroxisome proliferator activating receptor γ
SC : Dépôt sous-cutané
S1-P : Sphingosine 1-Phosphate
TA : Tissu adipeux
TG : Triglycérides
TGFβ : Transforming growth factor β
TNFα : Tumor necrosis factor α
Liste des figures :
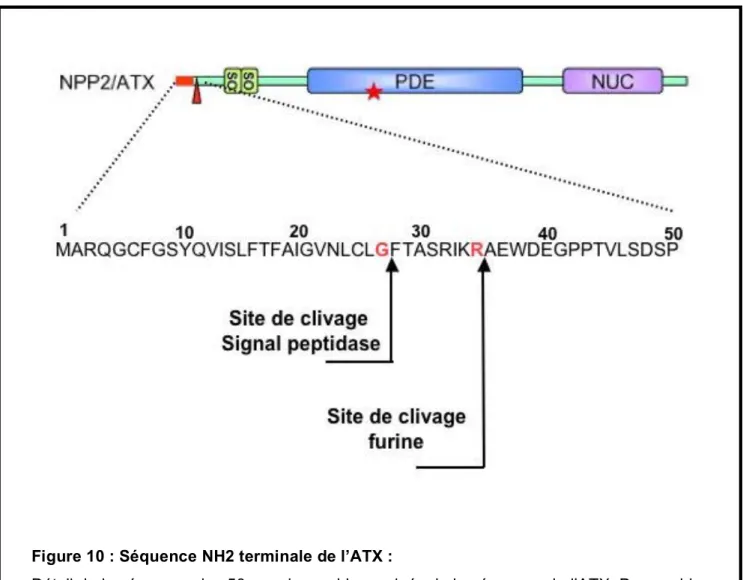
Figure 1 : Voies de régulation de la lipolyse dans l’adipocyte humain………..p19 Figure 2 : Stockage et mobilisation des lipides dans l’adipocyte………….………..p21 Figure 3 : Sécrétions du Tissu adipeux………..p37 Figure 4 : Différents modes de sécrétion………p39 Figure 5: Formule développée du LPA………...………p45 Figure 6 : Voies de synthèse du LPA ……….p49 Figure 7 : Structure des principaux membres de la famille des ENPP………..p57 Figure 8 :Structure de l’ATX et de ses différentes isoformes ……….p60 Figure 9 : Différentes activités enzymatiques de l’ATX ………..p63 Figure 10 : Séquence NH2 terminale de l’ATX……….p75 Figure 11 : Modèle de Sécrétion de l’ATX……….p78 Figure 12 : Sites potentiels de N-Glycosylation présents sur la séquence de l’ATX………..p79 Figure 13 : Inhibition de la sécrétion de l’ATX par le plasma et le sérum………….p80 Figure 14 : Cinétique de prise de poids et de prise alimentaire des animaux LPA1-/- mis en HFD ……….p85 Figure 15 : Influence du traitement GTG sur la prise de poids des animaux LPA1-/- ...p86 Figure 16 : Influence du traitement GTG sur l’infiltrat macrophagique du TA des
animaux wt et LPA1-/- ………p89
Figure 17 : Contrôle paracrine de l’adipogénèse par le tandem ATX/LPA ………..p91 Figure 18 : Synthèse des différentes étapes de la mise en place de la FTI……...p96 Figure 19 : Expression des récepteurs au LPA dans le modèle de FTI induit par le sérum néphrotoxique (NTS)………...p100 Figure 20 : Enzymes potentiellement impliquées dans le métabolisme du LPA………..p103
I/. Introduction Générale sur l’ Obésité:
I/.1 Définition et index de mesure :
Définition :
L’obésité se définit comme une augmentation excessive de la masse grasse pouvant avoir des conséquences délétères sur la santé. Cette prise de poids indésirable résulte le plus souvent d’un excès d’apports et/ou d’une diminution des dépenses énergétiques [1]. L’obésité ne constitue pas une pathologie en elle-même. L’obésité est délétère pour l’organisme, car elle est à l’origine du développement d’autres pathologies (diabète de type II, dyslipidémies, atteintes cardio-vasculaires etc...voir chapitre V).
Index de Mesure :
→ Le paramètre standard international de mesure de l’obésité est l’index de masse corporel (IMC) ou Body Mass Index (BMI) en anglais. Il correspond au rapport du poids (en kilogrammes) sur le carré de la taille (en mètres). Chez l’adulte, l’excès de poids se définit par un IMC ≥ 25 kg/m2. L’état pré-obèse se définit par un IMC de 25,0-29,9 kg/m2; et l’obésité par un IMC ≥ 30 kg/m2. Un IMC supérieur à 40 kg/m2 signe une obésité sévère ou morbide [2]. D’un point de vue clinique l’IMC est corrélé positivement avec de nombreux désordres métaboliques. De nombreuses études montrent son association avec une augmentation des lipides sériques, l’hypertension artérielle, les marqueurs inflammatoires circulants (CRP, MCP1 ou IL6) ou la résistance à l’insuline [3-8].
Cependant l’interprétation de l’IMC peut avoir quelques limites. En effet, l’IMC ne donne aucune indication quant à la répartition du TA dans l’organisme dont dépend le risque de complications associées à l’augmentation de la masse grasse. Le TA regroupe un ensemble complexe de dépôts adipeux dispersés au sein de l’organisme. Deux types de dépôts sont à distinguer, le TA sous-cutané et le TA profond (voir chapitre II.1). Ainsi, la mesure du ratio tour de taille (en mètre)/tour de hanche (en mètre) permet d’évaluer l’adiposité abdominale (TA sous-cutané) (connue pour être associée à la morbidité cardio-vasculaire). Un ratio de 0,9 pour les hommes et ≤0,8 pour les femmes est le reflet d’une répartition adipeuse saine ou
n’entraînant pas de complications. A contrario un ratio ≥1 est considéré comme un facteur de risque.
→ Une mesure fine de l’obésité et de la quantité des dépôts adipeux peut se faire par tomodensitométrie (CT-scan) ou par imagerie à résonance magnétique (IRM). Ces méthodes non invasives, basées sur l’utilisation des rayons X, permettent de localiser et de quantifier précisément le TA au sein de l’organisme [9].
I/.2 Epidémiologie :
Au plan mondial, l’International Obesity Task Force estime à 1,1 milliard le nombre d’adultes en surpoids et à près de 312 millions le nombre d’adultes obèses. En Europe, depuis les années 80, la prévalence de l’obésité a été multipliée par trois, même dans les pays traditionnellement caractérisés par des taux peu élevés de surcharge pondérale et d’obésité. Selon un rapport récent de l’OMS, l’obésité en Europe serait à l’origine d’un million de décès par an [2].
Si aucune mesure n’est prise et si la prévalence de l’obésité continue à progresser au même rythme que durant les années 90, on estime que l’Europe comptera 150 millions d’adultes (20% de la population) et 15 millions d’enfants et d’adolescents obèses (10% de la population) d’ici 2010 [2]. Aujourd’hui, dans la plupart des pays, 30 à 80% des adultes sont en surpoids. Les données montrent différents degrés de surcharge pondérale allant, par exemple, de 28% des hommes en Ouzbékistan à 66% des hommes en Irlande. Pour l’obésité, les niveaux mesurés vont de 13% des adultes au Portugal à 23% des adultes en Finlande. Il existe d’importantes différences non seulement entre les pays, mais aussi entre les régions, les groupes sociaux, les hommes et les femmes et les groupes d’âge.
L’épidémie se répand à des taux particulièrement alarmants chez les enfants. En Europe, la surcharge pondérale est le problème de santé le plus fréquent chez les enfants. Actuellement, quelque 20% des enfants sont en surpoids et parmi eux, un tiers sont obèses. En 2010, quatre enfants sur dix seront obèses. Ces enfants courent un risque élevé de développer un diabète de type 2, de souffrir d’hypertension et de troubles du sommeil, et de présenter des troubles psychosociaux. Comme les enfants acquièrent, en matière d’alimentation et d’activité physique, des habitudes qu’ils conservent le reste de leur vie, les enfants obèses
resteront très probablement obèses à l’âge adulte. Ils développeront alors des maladies plus graves qui réduiront la durée et la qualité de leur vie [10]. D’après le Ministère britannique de la santé, l’espérance de vie des hommes pourrait, en 2050, être de cinq ans inférieure à ce qu’elle est aujourd’hui.
Conclusions : L’expansion actuelle de l’obésité est un problème majeur de santé publique. L’augmentation de l’obésité infantile est sans doute encore plus alarmante. En effet, plus de 60 % des enfants accusant un surpoids avant la puberté conserveront cette surcharge pondérale au début de l’âge adulte. Les services de santé verront leur charge largement augmenter dans la mesure où les personnes atteintes devront recevoir un traitement pendant une bonne partie de leur existence.
I/.3 Pharmacologie de l’obésité :
Une diminution du poids corporel de 5 à 10 % a un impact significatif sur l’amélioration des facteurs de risques cardio-vasculaires et la progression du diabète de type II [11, 12]. Pour « perdre du poids », plusieurs stratégies sont possibles. Théoriquement l’exercice physique est la stratégie la plus « simple » et la moins coûteuse. En augmentant des dépenses énergétiques de l’organisme, l’exercice physique entraîne une diminution de la taille des dépôts adipeux [13]. Cependant cette stratégie comporte des limites. En effet, l’exercice physique est connu pour améliorer avant tout les paramètres cardiovasculaires, mais n’est pas toujours efficace sur la perte de poids chez l’obèse [14]. Une autre approche consiste à une restriction calorique, c’est-à-dire une diminution des apports alimentaires. Ces deux approches peuvent être menées en parallèle, mais il semble que la combinaison des deux ait de meilleurs résultats pour maintenir la perte de poids sur le long terme [15]. Dans certaines situations, ces deux approches ne sont pas probantes et il faut envisager une approche pharmacologique. Généralement l’utilisation de médicaments n’est tolérée que pour des adultes ayant un IMC≥27 associé à des complications ou un IMC≥30 sans complications associées. Ces stratégies pharmacologiques se sont développées depuis les années 60 et ciblent principalement deux grands mécanismes : la prise alimentaire (supprimer l’appétit ou augmenter la satiété) et la diminution de l’absorption des nutriments (induction d’une restriction calorique). D’autres stratégies, visant notamment à augmenter la dépense
énergétique, ont été envisagées (utilisation de l’éphédrine) mais restent très controversées en raison de nombreux effets indésirables [16].
À l’heure actuelle, trois molécules efficaces sont utilisées couramment en thérapeutique [17]. L’inhibiteur de la lipase gastrique et pancréatique (Orlistat) réduit l’absorption de lipides de 30%. L’inhibiteur de la re-capture de monoamine (Sibutramine) agit sur le système nerveux central et augmente la satiété. Très récemment a été mis sur le marché un antagoniste du récepteur aux cannabinoïdes CB1 (Rimonabant). Sa liaison sur le récepteur induit une diminution de la prise alimentaire, une augmentation de la thermogenèse musculaire et une diminution de la lipogenèse hépatique. Cependant l’utilisation de cette molécule est remise en cause depuis peu, puisque la Food and Drug Administration (FDA) a refusé sa mise sur le marché américain en raison de puissants effets indésirables (troubles dépressifs majeurs).
Le traitement de l’obésité par chirurgie peut être envisagé chez certains patients (40<BMI<50). Les deux principales techniques sont la pause d’un anneau gastrique et le bypass gastrique. L’anneau gastrique permet de limiter le volume de l’estomac et d’augmenter le sentiment de satiété. Le bypass gastrique consiste à relier l’extrémité distale de l’œsophage au jéjunum distal. Cette stratégie permet de court-circuiter l’estomac le duodénum et le jéjunum proximal et de diminuer significativement l’absorption intestinale [18].
Conclusions: La pharmacologie de l’obésité reste encore imparfaite. Aucune stratégie médicamenteuse ne permet de perte de poids à long terme. Mais compte tenu de l’expansion de l’obésité dans le monde et des enjeux financiers considérables, de nombreuses compagnies pharmaceutiques tentent de mettre au point de nouvelles molécules et il y a fort à parier que la pharmacopée « anti-obésité » va s’accroître considérablement dans les prochaines années [19].
II. Description du tissu adipeux :
II/.1 Les tissus adipeux :
Il existe deux sortes de tissus adipeux : un TA brun et un TA blanc (TA).
→ Le tissu adipeux brun. Sa coloration provient du nombre très important de mitochondries contenues dans les adipocytes. Son rôle est tout autre que celui du blanc : il participe à la thermogenèse de non-frisson en oxydant les acides gras sans production d’ATP. Le BAT est présent en permanence chez les mammifères hibernants et les rongeurs, Mais bien que ce concept soit actuellement controversé, il semblerait que le BAT disparaisse après la naissance chez la plupart des autres mammifères y compris l’Homme [20].
→ Le tissu adipeux blanc (TA) est un tissu extrêmement plastique. En effet, son poids évolue en fonction des apports et des dépenses énergétiques de l’organisme. L’énergie y est stockée sous forme de triglycérides (TG). Le TA est le principal tissu de réserve de l’organisme et représente à lui seul plus de ¾ des réserves énergétiques, soit 10 à 15 kg chez un jeune individu adulte de poids moyen.
NB : Notre travail est basé uniquement sur l’étude du TA et c’est de ce tissu dont il s’agira lorsque le terme TA apparaîtra sans autre précision.
Le TA est localisé dans plusieurs zones de l’organisme. Les dépôts adipeux sont classés en deux catégories. Le TA sous-cutané et le TA interne (ou profond). Le TA cutané est composé d’un dépôt de TA sous cutané superficiel et sous-cutané profond. Le TA interne est composé du TA viscéral, non viscéral, intra et péri-musculaire [9]. Ces dépôts adipeux semblent êtres différents, mais leur rôle respectif au cours de la mise en place de l’obésité reste encore mal caractérisé. A l’heure actuelle les dépôts sous cutanés et profonds semblent avoir un profil sécrétoire différent [21, 22]. Le tissu viscéral présente une plus forte expression de cytokines pro-inflammatoires (TNFα par exemple) que le sous-cutané. Au cours du développement de l’obésité, l’infiltration macrophagique semble être plus importante dans le TA profond comparativement au TA sous-cutané [23]. La quantité de TA
profond est plus fortement corrélée à la résistance à l’insuline que celle du TA sous-cutané [24]. L’ensemble de ces observations montre que les dépôts adipeux, en plus de leur localisation différente, présentent des caractéristiques métaboliques distinctes. Des études complémentaires sont nécessaires pour mieux comprendre le rôle précis de chacun de ces dépôts adipeux dans les processus physiopathologiques associés à l’obésité.
II.2 Composition cellulaire du Tissu adipeux :
Le TA présente une grande hétérogénéité cellulaire. Les cellules du TA blanc peuvent être séparées (après digestion à la collagénase et centrifugation) en deux grandes populations: les adipocytes matures et la fraction stroma-vasculaire (FSV). Les deux fractions sont séparées par flottaison, grâce à la différence de densité entre les adipocytes et les autres types cellulaires. Les adipocytes gorgés de lipides remontent à la surface à l’inverse des autres types cellulaires qui sédimentent [25]. L’adipocyte représente le type cellulaire majoritaire. La plasticité du TA provient de la grande capacité de stockage des adipocytes qui peuvent stocker l’énergie sous forme de TG dans une vacuole lipidique unique pouvant représenter 95% du volume cytoplasmique. Ainsi, l’adipocyte gorgé de lipides, peut voir son diamètre atteindre 100 µm ou plus. Dans ce cas, il s’agit d’hypertrophie adipocytaire. L’augmentation de la masse du TA peut également résulter d’une augmentation du nombre d’adipocyte (hyperplasie) résultant de la différenciation des pré-adipocytes.
Les cellules de la Fraction Stroma-Vasculaire : Un nombre croissant de cellules est décrit comme faisant partie de la FSV, et quatre groupes cellulaires sont identifiés :
→ Le pré-adipocyte est un type cellulaire relativement immature qui peut se différencier en adipocyte. Il ne semble pas posséder de marqueurs antigéniques spécifiques, mais appartiennent à une population cellulaire différente des cellules progénitrices (voir ci-dessous) [26]. Dans certaines conditions, le pré-adipocyte pourrait également se différencier en macrophage [27].
→ Les cellules endothéliales. Le TA possède un réseau de capillaires équivalent à celui du muscle squelettique [28]. Les cellules endothéliales participent à la néo-vascularisation du TA et permettent ainsi son développement. Ces cellules sont
caractérisées par des marqueurs CD34+/CD31+ et le nombre de ces cellules augmente avec la prise de poids [29].
→ Les cellules d’origine hématopoïétique caractérisées par l’expression du marqueur CD45. Trois populations cellulaires sont distinguables : les lymphocytes et les macrophages. Les lymphocytes présents dans le TA sont de la famille des NK, NKT, Tγδ (la proportion des populations varie selon le type de dépôt adipeux) [30]. Le rôle des lymphocytes du TA n’est pas connu et est en cours de caractérisation. Les macrophages présents dans le TA ne sont pas clairement caractérisés. Leur proportion et leur phénotype varient lors de la mise en place de l’obésité [31, 32, 33 , 34]. Chez l’homme, l’infiltrat macrophagique est corrélé positivement avec l’IMC mais leur rôle au sein du TA est sujet à controverse. Chez la souris, deux populations de macrophages semblent co-exister dans le TA au cours du développement de l’obésité. Une première population appelée M1 présentant un phénotype « pro-inflammatoire » et une deuxième population M2 présentant un phénotype « anti-inflammatoire » [32]. Les M1 pourraient jouer un rôle dans la mise en place de la résistance à l’insuline associée à l’obésité via la sécrétion de certaines cytokines inflammatoires [35 , 36]. A contrario les M2 joueraient un rôle bénéfique et permettraient, via le récepteur nucléaire PPAR γ, de maintenir la sensibilité à l’insuline du TA [37, 38]. Le mécanisme expliquant la transition entre les populations M2 et M1 reste à déterminer, un travail récent montre que chez la souris la mise en régime gras pourrait favoriser l’expansion de la population M1 [39]. Le rôle des macrophages infiltrés dans le TA est encore flou. De nombreuses études restent à être menées chez l’homme et le rongeur, pour comprendre notamment la dynamique entre les populations M1 et M2 et in fine déterminer si l’infiltrat macrophagique a des conséquences délétères ou non sur la physiologie du TA.
→ Les cellules progénitrices encore appelées cellules souches du TA ont un phénotype qui n’est pas clairement établi. Ces cellules peuvent être à l’origine de différents lignages cellulaires. Une fois isolées et mises en culture in vitro, elles peuvent s’orienter soit vers un phénotype adipocytaire, soit vers un phénotype endothélial en fonction du milieu de culture [40]. In vivo, lorsque ces cellules sont injectées dans une zone tissulaire ischémiée, elles permettent une revascularisation importante du tissu [41, 42]. Ces cellules progénitrices sont en cours de caractérisation, et ont un potentiel thérapeutique prometteur.
→ Les cellules nerveuses. Le TA est principalement innervé par des fibres sympathiques. Les fibres noradrénergiques sont étroitement associées au réseau vasculaire et aux adipocytes. Le neurotransmetteur impliqué dans les messages nerveux du TA est la noradrénaline, qui se lie aux différents sous-types de récepteurs adrénergiques (récepteurs β1,β2, et α2 adrénergiques) régulant, en autres, la lipolyse. Ces fibres nerveuses semblent aussi pouvoir moduler les processus de prolifération et de différenciation des pré-adipocytes et ainsi réguler l’évolution de la masse grasse [43 , 44].
Conclusion : Les cellules de la FSV constituent une population importante et hétérogène du TA. Leur caractérisation n’est pas encore terminée, mais il est désormais acquis que leur présence au sein du TA module son développement et sa physiologie.
II.3 Métabolisme du Tissu Adipeux :
Le TA possède une activité métabolique intense. Il peut stocker l’énergie sous forme de TG lorsque les apports caloriques sont supérieurs aux dépenses, c’est la lipogenèse. Inversement il peut libérer de l’énergie sous forme d’acides gras libres dans le sang dans des situations de jeûne, d’exercice physique, de stress ou d’exposition au froid : c’est la lipolyse ou lipomobilisation.
II.3.1 Fonction de lipomobilisation ou lipolyse :
La lipolyse consiste en l’hydrolyse des TG en 3 acides gras libres (AGL) et une molécule de glycérol. La libération des AGL dans le sang permet de fournir l’énergie nécessaire aux tissus périphériques (foie ou muscles) via la β-oxydation. La lipolyse est régulée par l’activation des récepteurs lipolytiques β1 et β2 adrénergiques, et du récepteur anti-lipolytique α2 adrénergique. Ces deux types de récepteurs sont couplés respectivement à des protéines G de type Gs ou Gi et contrôlent ainsi les taux intracellulaires d’AMPc via l’adenylate cyclase. Ces variations d’AMPc régulent l’activité de la lipase hormono-sensible (LHS). La LHS est la seule enzyme de la lipolyse régulable par des facteurs hormonaux (catécholamines, insuline) et en fait l’enzyme clé de la lipolyse. La LHS phosphorylée par la protéine kinase A hydrolyse
les TG (en diglycérides) et les diglycérides (DG) (en monoglycérides) [45]. L’hydrolyse des monoglycérides, en AGL et glycérol, est sous la dépendance de la monoglycéride-lipase (MGL). Outre les catécholamines, de nombreuses molécules sont connues pour réguler positivement la lipolyse (thyroid stimulating hormone (TSH), glucagon ou TNFα …) [46 , 47] (cf figure 1).
La régulation négative est principalement assurée par l‘insuline. Elle intervient dans la régulation des taux intracellulaires d’AMPc via la phosphodiestérase de type 3B (PDE-3B) [48]. D’autres facteurs, sans avoir un effet anti-lipolytique aussi puissant que celui de l’insuline, sont aussi décrits comme l’IGF1 ou l’Adénosine [49 , 50]. Très récemment a été mis en
évidence une nouvelle voie de régulation de la LHS par le peptide atrial natriurétique (ANP). Via son récepteur NPR-A, l’ANP induit la production de GMPc, puis l’activation de la protéine kinase G et in fine l’activation de la LHS [51 , 52]. Parallèlement à la LHS, une autre enzyme pourrait jouer un rôle important dans la lipolyse : l’adipose triglycéride lipase (ATGL) [53 , 54]. Cette lipase ne peut hydrolyser que les TG, n’est pas phosphorylée par la PKA et n’est pas régulée par les catécholamines [55]. Elle semble jouer un rôle important dans la lipolyse basale. Conclusions : Le clonage de l’ATGL a remis en question le dogme du rôle unique de la LHS dans la lipolyse . La contribution respective la LHS et de l’ATGL dans la lipolyse basale et stimulée est l’objet de nombreuses études. L’élaboration de la double invalidation LHS et ATGL permettra de répondre à cette question.
II.3.2 Fonction de stockage ou lipogénèse :
Deux mécanismes différents aboutissent dans un premier temps à la synthèse d’AG puis à la synthèse de TG via une estérification des AG ( cf figure2):
→ Le captage des AGL circulants :
En situation post-prandiale, les TG circulent sous forme de vésicules lipidiques synthétisées par l’intestin (chylomicrons) ou de lipoprotéines synthétisées par le foie (very low density lipoprotein ou VLDL) [56]. Ces TG circulants sont ensuite hydrolysés dans le courant sanguin par la lipoprotéine lipase (LPL) [57]. La LPL
Figure 1 : Voies de régulation de la lipolyse dans l'adipocyte blanc humain :
α2A-RA: récepteur antilipolytique alpha2-adrénergique ; AC: adenylate cyclase ; AG: acide gras ; AMPc: adénosine monophosphate cyclique ; ANP (atrial natriuretic peptide): peptide atrial natriurétique; ATGL (adipose triglyceride lipase): lipase adipocytaire des triglycérides; β1/2-RA: récepteurs lipolytiques beta1 et 2 adrénergiques ; BNP (brain natriuretic peptide); DG: diglycéride ; GC: guanylyl cyclase; GMPc: guanosyl monophosphate cyclique ; Gs ou Gi: protéines G de type Gs ou Gi ; IRS-1 et IRS-2 (insulin receptor substrate 1 et 2): substrat des récepteur à l'insuline de type 1 et 2 ; LHS: lipase hormono-sensible ; MG: monoglycéride ; MGL: lipase de monoglycéride ; NPR-A: récepteurs membranaires des peptides natriurétiques de type A ; PDE-3B: phosphodiestérase de type 3B ; PI3-K: phosphatidyl-inositol-3 kinase ; PKA: protéine kinase A; PKB : protéine kinase B/Akt ; PKG protéine kinase G
est synthétisée par l’adipocyte, puis transférée dans la lumière du capillaire sanguin [58 , 59].L’hydrolyse des TG par la LPL entraîne la libération d’AG qui sont ensuite
AMPc PKA β-1/2RA PK G GMPc G C LHS IRS1/2 PKB Récepteur insuline - - et autres récepteurs inhibiteurs Inhibition de la lipolyse Stimulation de la lipolyse DG+AG MG+AG MGL ATGL AC Gs Gs Gi Gi α2A-RA Périlipines Triglycérides Récepteur peptides Natriurétiques (ANP-BNP) ( NPR-A) PI3-K PDE-3B Glycérol + AG +
internalisés dans l’adipocyte par transport passif (pour les AGL à courtes chaînes) ou par transport actif via les protéines de la famille des fatty acid transport protein (FATP).
→ La synthèse de novo d’acides gras (lipogenèse):
Ce processus métabolique a lieu à partir des carbohydrates (glucose) et peut aussi se produire dans le foie [60]. Le glucose est, par la voie de la glycolyse, transformé en acétyl-coA qui est ensuite « greffé » à un malonyl-coA par l’action de la fatty acid synthase (FAS) et permet ainsi la synthèse d’un AG. Alors que la contribution de cette voie dans l’accumulation de triglycérides dans le TA est clairement démontrée chez le rongeur, elle semble beaucoup moins importante chez l’Homme [61].
→ La réaction de ré-estérification des AG:
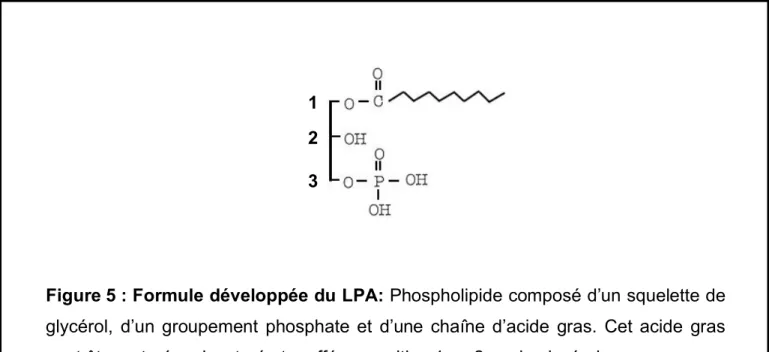
Une fois les AG néoformés ou captés de la circulation, une dernière étape permet la synthèse des TG par la liaison de 3 acides gras sur un squelette de glycérol phosphorylé en position 3. Cette réaction se produit en séquence, chaque AG étant greffé successivement par des enzymes spécifiques. Le premier AG est greffé sur le glycérol-3 phosphate, (en position 1) par la G3P acyltransférase (G3PAT) pour former un intermédiaire métabolique appelé monoacyl-glycerol-phosphate ou acide lysophosphatidique (LPA). Le deuxième AG est greffé, en position 2, par la G3PAT pour former le diacylglycerol-phosphate ou acide phosphatique (PA). Le PA est déphosphorylé par une phosphatidate phosphohydrolase en diacylglycérol (DAG). La dernière réaction consiste en une liaison d’un troisième acide gras, en position 3, par la diacylglycérol acyltransférase pour donner un triacylglycérol ou triglycéride. Conclusion : Cette fonction du TA est primordiale puisque en cas d’altération de la lipogénèse du TA, le stockage des lipides serait diminué. Cette altération entraînerait une augmentation importante des lipides circulants (AG) capables d’induire de nombreux processus pathologiques comme la résistance à l’insuline.
Figure 2 : Stockage et mobilisation des lipides dans l’adipocyte : Le stockage de
l’énergie sous forme lipidique dans l’adipocyte est essentiellement constituté de la synthèse
de novo d’acides gras à longue chaîne (lipogenèse) et/ou de la captation d’acides gras
exogènes provenant des lipoprotéines circulantes et de leur estérification. La lipogenèse nécessite la production de molécules en C2 fournies notamment par le catabolisme du glucose circulant. Le pyruvate, issu de la glycolyse, est transformé en acétyl-coA dans la mitochondrie. L’acétyl-coA va servir à la synthèse de novo des acides gras par action séquentielle de l’ACC et de la FAS. Chez l’Homme, l’hydrolyse des TG venant du foie ou de l’intestin transportés par VLDL et les CM, représentent le principal apport d’acides gras exogènes. Cette hydrolyse est catalysée par la LPL. L’estérification des AG dans l’adipocyte permet leur mise en réserve sous forme de TG. Les TG adipocytaires peuvent être hydrolysés par la LHS puis la MGL pour redonner des AG et du glycérol qui rejoignent la circulation.
ACC : acétyl-coA carboxylase ; AG : acides gras ;CM : chylomicron ; DHAP :
Dihydroxy-acétone- phosphate ; FAS : Fatty acid synthase ; FATP : fatty acid transporter protein,
G3PDH : glycérol-3P deshydrogenase ; GLUT : glucose transporter ; HKII : hexokinase II ; LHS : lipase hormono sensible ; LPL : lipoproteine lipase ; MGL : Monoglycéride lipase ; VLDL : lipoprotéines de faible densité.
III. Développement du tissu adipeux :
L’adipocyte dérive de cellules souches mésenchymateuse. Quelques tentatives ont été réalisées pour essayer de décrire les intermédiaires cellulaires entre ces cellules souches et l’adipocyte mature. La plupart des données dont nous disposons proviennent d’étude in vitro sur des fibroblastes ou des pré-adipocytes. L’adipogénèse semble organisée en deux parties :
→ La première phase (la détermination) consiste en une conversion de cellules souches pluripotentes en pré-adipocytes. En l’absence de distinctions morphologiques ou immunologiques, le pré-adipocyte ne se différencie de la cellule souche que par son impossibilité à se différencier en d’autres types cellulaires que l’adipocyte. D’un point de vu moléculaire, peu de choses sont connues, seules les voies de signalisation de Wnt ou δFosB semblent êtres impliquées dans le processus de détermination [62, 63] .
→ La deuxième phase (la détermination terminale) voit le pré-adipocyte acquérir les caractéristiques de l’adipocyte mature et notamment la machinerie cellulaire permettant de transporter ou de synthétiser les lipides, la sensibilité à l’insuline ou le potentiel sécrétoire. Les bases moléculaires de cette deuxième phase ont été principalement étudiées sur les lignées cellulaires de pré-adipocyte in vitro (lignées 3T3-L1 ou 3T3F442A).
Le contrôle des deux phases de détermination est primordial car il conditionne la taille du pool de pré-adipocytes qui permettra le développement du TA au cours de l’existence d’un individu. Cependant la présence d’un large stock de pré-adipocytes peut conduire au développement d’une obésité de type hyperplasique (caractérisée par un grand nombre d’adipocytes).
III.1 Contrôle transcriptionnel de la différenciation adipocytaire:
La différenciation adipocytaire est contrôlée par une expression génique finement régulée dans le temps [64]. Ces vingt dernières années, l’attention s’est portée sur les facteurs de transcription de la famille des C/EBPs (CCAAT/Enhancer Binding Proteins) et des PPARs (Peroxisome Proliferator Activated Receptor) mais d’autres facteurs de transcription interviennent dans ce processus de différenciation comme
les SREBP (Sterol Regulatory Element Binding Protein) ou les KLF (Kruppel-Like zinc finger transcription Factor) [65, 66].
→ Les facteurs de transcription CEBPs. Ce sont des facteurs à « glissière à leucines », qui n’ont pas de ligand et s’activent par homo- ou hétéro-dimérisation. La région adjacente à la glissière à leucines permet la liaison à l’ADN. De nombreux membres de la famille des CEBPs sont exprimés par l’adipocyte comme le CEBPα, CEBPβ et CEBPδ. L’expression de ces facteurs de transcription est soumise à une régulation temporelle très fine. En effet, les sous-types CEBPβ et CEBPδ, exprimés précocement par le pré-adipocyte, vont induire l’expression du sous-type CEBPα. Une fois exprimés, ces facteurs de transcription vont induire une cascade d’expression de gènes des protéines sécrétées (leptine, adiponectine etc) ou impliquées dans la sensibilité à l’insuline (récepteur de l’insuline, GLUT4 etc) [67]. Ces facteurs de transcription activent aussi l’expression des PPARs.
→ Les PPAR appartiennent à la superfamille des récepteurs nucléaires. Suite à la liaison avec un ligand endogène, les PPARs s’hétéro-dimérisent avec le récepteur au rétinoïde X (RXR) [68]. Il existe plusieurs sous-types de PPARs : PPARα, PPARγ et PPARδ. Il est maintenant admis que PPARγ est un facteur clé de l’adipogénèse. L’expression de PPARγ est nécessaire et suffisante pour la mise en place du programme de différenciation adipocytaire [69]. Le ligand endogène des PPARγ n’est pas encore clairement identifié, mais la 15-deoxy-δ-prostaglandine J2 (PGJ2), les acides gras poly-insaturés (linoléique 18:2 et linolénique 18:3), l’acide 9-13 hydroxyoctadecadienoique (HODE) ou l’acide lysophosphatidique (LPA) seraient des activateurs de PPARγ [70 , 71 , 72-74]. Il faut distinguer trois sous-types de PPARγ (PPARγ1, γ2 et γ3). PPARγ2 est exprimé exclusivement dans le TA alors que PPARγ1 et γ3 sont aussi exprimés dans de nombreux tissus tels que le rein ou l’intestin [75, 76]. Dans l’adipocyte, il semble que PPARγ2 soit le sous-type prépondérant [75, 76]. PPARγ2 induit l’expression d’un grand nombre de gènes impliqués dans le métabolisme lipidique parmi lesquels la Lipoprotéine lipase (LPL), l’Acétyl-coA Carboxylase (ACC) ou l’adipocyte fatty acid binding protein (aP2) [67, 77]. PPARγ est une cible pharmacologique de première importance dans le traitement du diabète de type II. Les agonistes synthétiques de PPARγ, les thiazolidinediones (TZD), permettent de restaurer la sensibilité à l’insuline en favorisant la différenciation adipocytaire, l’utilisation des AGL, et l’utilisation du
glucose [78]. Les TZD (rosiglitasone ou la pioglitasone) sont couramment utilisées en thérapeutique chez l’Homme [78].
Conclusions : La régulation de la différenciation adipocytaire est importante. Toutes dérégulations de ce processus conduisant à l’augmentation du recrutement des pré-adipocytes peut conduire à un développement important du TA aboutissant à une obésité de type hyperplasique.
III.2 Facteurs pro et anti-adipogéniques :
Comme discutée ci-dessus, la différenciation adipocytaire est la conséquence d’une activation séquentielle de facteurs de transcription. Ces facteurs interviennent en aval d’une voie de signalisation induite par des signaux extracellulaires. Les études in vitro ont permis d’identifier un grand nombre de molécules capables d’activer ou d’inhiber le processus d’adipogénèse. Mais nombre de facteurs anti- ou pro- adipogéniques, identifiés pour leur efficacité in vitro, n’ont pas toujours démontré leurs effets in vivo.
→ Les facteurs anti-adipogéniques :
In vitro, nombre de facteurs de croissance (EGF, le FGF ou le PDGF) ou cytokines inflammatoires (IL6, IL1 ou TNFα) ont des propriétés anti-adipogéniques. Nous allons détailler les effets anti-adipogéniques de trois protéines à partir de démonstrations convaincantes menées in vivo.
La glycoprotéine Wnt10b est connue pour réguler le développement de nombreux tissus de façon auto ou paracrine. Wnt est sécrétée par le pré-adipocyte et inhibe la différenciation adipocytaire de la lignée 3T3-L1 in vitro [79]. La surexpression de Wnt10b dans le TA de souris, grâce à l’utilisation du promoteur spécifique FABP4, entraîne une diminution des dépôts adipeux de prés de 50% et une résistance à l’obésité induite par régime gras [80]. De plus la surexpression de Wnt10b, chez la souris ob/ob (obèse et diabétique), induit une diminution des dépôts adipeux de 75% et une augmentation de la sensibilité à l’insuline [81].
Pref-1 est une protéine transmembranaire abondamment exprimée par le pré-adipocyte. Son expression diminue au cours de la différenciation adipocytaire et est quasiment nulle dans l’adipocyte mature. In vitro, le blocage de l’expression de Pref 1 induit une augmentation de l’adipogénèse [82]. In vivo la surexpression de Pref-1,
spécifiquement dans le TA, entraîne une réduction importante du poids des dépôts adipeux associée à une diminution de la taille adipocytaire [83].
De façon analogue aux deux études précédentes, le TGFβ est un inhibiteur puissant de l’adipogénèse in vitro [84]. Sa surexpression dans le TA entraîne une lipoatrophie de 60% et un développement très important de la matrice extra-cellulaire [85].
→ Les facteurs pro-adipogéniques :
De même que dans le paragraphe précédent, de nombreux facteurs possèdent des effets pro-adipogéniques in vitro, comme l’hormone de croissance ou l’hormone thyroïdienne. Nous allons maintenant porter une attention particulière aux facteurs pro-adipogéniques dont les effets ont été démontrés in vivo.
L’insuline a des effets inducteurs puissants sur l’adipogénèse in vitro [86]. In vivo de nombreuses études ont été menées et notamment via l’invalidation du récepteur de l’insuline (IR) ou des protéines impliquées dans la cascade de signalisation en aval du récepteur comme les Insulin Receptor substrate (IRS). L’invalidation de l’IR protège contre la prise de poids induite par le régime gras [87]. De plus la double invalidation des IRS 1 et 3 entraîne une importante lipoatrophie associée au développement du diabète [88].
Les glucocorticoides (GC) sont des puissants inducteurs de l’adipogénèse in vitro [89] via notamment l’activation des facteurs de transcription de la famille des C/EBPs [90]. In vivo, la surexpression spécifique dans le TA, de l’enzyme responsable de la synthèse des GC (11β-hydroxy steroid deshydrogenase 1 ou 11β-HSD1) induit une augmentation de la production des GC par le TA et le développement d’une obésité de type viscérale [91].
Le Macrophage Colony Stimulating Factor (MCSF) est une protéine connue pour induire le recrutement des cellules pluri-potentes [92]. À ce titre, cette protéine possède un fort potentiel adipogénique. Le MCSF (et son récepteur) est exprimé par l’adipocyte chez le lapin et son expression augmente au cours de la mise en régime gras [93]. La surexpression spécifique, chez le lapin, dans le TA sous-cutané, par adénofection induit une augmentation importante des dépôts adipeux. Cette prise de poids résulte d’un recrutement important de pré-adipocytes (hyperplasie adipocytaire) [93].
Conclusions : Le développement du TA est la résultante de la balance entre les facteurs pro et anti-adipogéniques. La production de ces facteurs est finement
régulée. Ces facteurs peuvent être produits localement (Glucocorticoides,Wnt10b) ou par d’autres organes (insuline par le pancréas).
IV. Fonction sécrétoire du tissu adipeux :
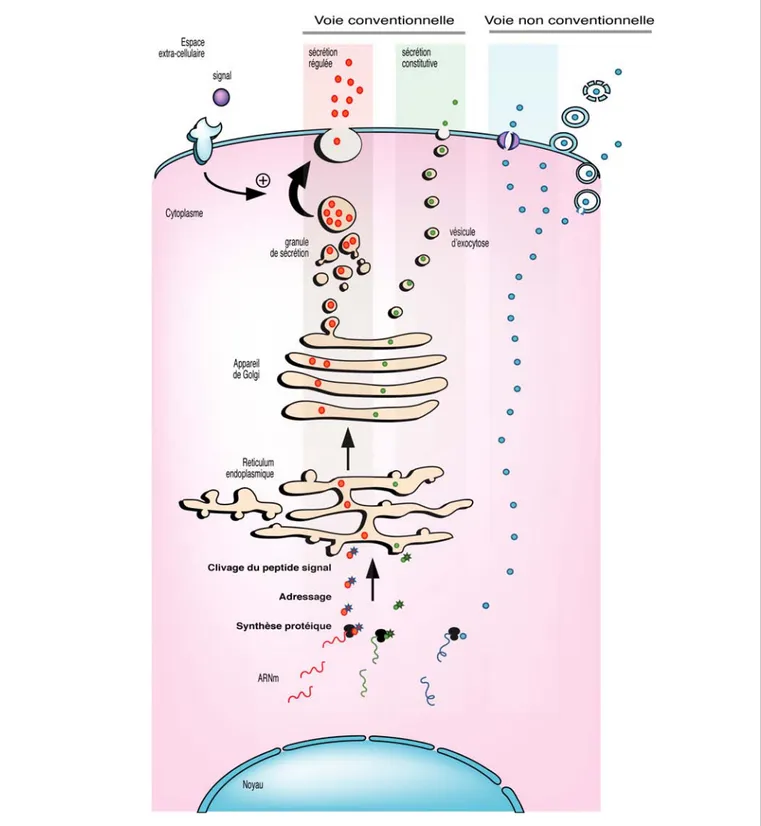
Il est maintenant admis que le TA joue un rôle important dans la régulation de nombreux processus physiopathologiques via son activité sécrétoire. La capacité sécrétoire et le profil des sécrétions de l’adipocyte varient au cours de la différenciation adipocytaire et avec l’inflammation du TA associée à l’obésité. Le profil de sécrétion du pré-adipocyte est différent de celui de l’adipocyte mature, et au cours de l’adipogénèse de nombreuses protéines voient leur sécrétion augmenter ou diminuer [94 , 95]. De nombreuses sécrétions ont été caractérisées, et sont regroupées sous le terme d’adipokines ou adipocytokines (cf figure 3). Ce terme d’adipokine est utilisé pour décrire des protéines (cytokines) ou des lipides qui sont synthétisés et sécrétés par le TA. Certaines adipokines ne sont pas exclusivement produites par le TA.
Ces cinq dernières années, des approches à large spectre (de type protéomique) ont été menées afin de mieux caractériser le « secretome » du TA. Par exemple, 259 protéines sont sécrétées par le TA humain, plus particulièrement par des explants de TA viscéral [96]. Ces sécrétions sont classées en cinq catégories : signalisation, homéostasie de matrice extracellulaire, fonction immunitaire, fonction de dégradation et autres. Parmi ce nombre considérable de sécrétions, la part revenant aux sécrétions de l’adipocyte semble faible. En effet, une étude récente a pu identifier 80 protéines sécrétées par l’adipocyte isolé de rat [97]. Ces deux études suggèrent que seul 1/3 des sécrétions d’adipokines serait imputables à l’adipocyte. Différentes études montrent en effet que la FSV, plus particulièrement les macrophages qui sont en nombre important dans le TA des sujets obèses, est responsable de la majorité des sécrétions du TA [21, 98]. A ce jour, seules deux protéines sont connues pour n’être sécrétées que par l’adipocyte : la leptine et l’adiponectine [21]. Par abus de langage, le mot « adipokine » reste largement utilisé pour désigner les sécrétions du TA quelqu’en soit leur origine cellulaire.
IV.1. Quelles sécrétions pour quelles fonctions physiologiques ? :
Comme évoqué ci-dessus, le TA est doué d’une activité sécrétoire importante, mais près de 30 ans furent nécessaires pour que cette fonction endocrine soit reconnue. La découverte de la première sécrétion adipocytaire remonte à 1964 avec la découverte par Martin Rodbell de la lipoprotéine lipase [25]. Puis en 1985, le groupe de Bruce Spiegelman a montré que le TA était la source principale d’adipsine [99]. Mais « la prise de conscience » n’a eu vraiment lieu qu’en 1994 avec la découverte de la leptine par le groupe de Jeffrey Friedman [100].
Au vu de la grande quantité d’adipokines produites (protéines, peptides ou lipides) un large spectre de fonctions physiologiques est concerné par l’ensemble de ces sécrétions. Nous allons donc décrire les adipokines dont les fonctions sont à ce jour les mieux décrites dans la littérature.
La fonction immuno-inflammatoire :
De nombreux travaux décrivent l’activation des voies pro-inflammatoires au sein du TA lors de la mise en place de l’obésité. Mais la contribution relative du TA dans les taux circulants des cytokines, n’est pas encore déterminée. Le TA des individus obèses est le siège d’un important infiltrat macrophagique. La quantité de macrophage infiltrés est corrélée positivement à l’IMC. Ces macrophages (voir chapitre précédent) semblent être à l’origine de sécrétions dites inflammatoires (le TNFα par exemple) et à l’installation d’un état inflammatoire de « bas niveau » (low grade inflammation state). Les macrophages infiltrés et activés, en présence des autres cellules de la FSV et des adipocytes vont générer un cercle vicieux comprenant le recrutement de nouveaux macrophages et les productions de cytokines pro-inflammatoires. En aval, ces sécrétions vont moduler le métabolisme du TA lui-même mais aussi les fonctions inflammatoires et immunitaires.
→ TNFα (Tumor Necrosis Factor α): Le TNFα est une protéine trimère de 51 kDa, composé de 3 sous-unités de 17kDa. Il est produit par le TA et son expression augmente avec l’IMC [101] et diminue avec la perte poids ou l’amélioration la résistance à l’insuline [102]. Le TNFα a été la première production adipocytaire pressentie comme lien entre obésité, inflammation et insulino-résistance. De nombreuses études ont démontré in vitro et in vivo que le TNFα altère la
signalisation à l’insuline [103 , 104 , 105]. L’injection d’anticorps anti-TNFα à des animaux obèses et diabétiques améliore la sensibilité à l’insuline [104]. De plus l’invalidation du TNFα chez la souris protège de l’insulino-résistance induite par l’obésité [106]. Les cellules responsables de l’expression du TNFα au sein du TA reste controversée. Certaines études montrent une production de TNFα quasi exclusive par la FSV [21] et d’autres travaux plus anciens montrent une expression principalement adipocytaire [102]. Une des réponses à cette controverse pourrait être technique. En effet pour séparer la FSV des adipocytes, une digestion du tissu à la collagénase est nécessaire. Cette digestion est un facteur d’agression fort pour les cellules qui pourraient induire les voies d’inflammation aigues, de type TNFα. De ce fait l’expression du TNFα dans l’une ou l’autre des fractions pourrait être en partie artéfactuelle [101 , 107].
→ MCP-1 (Monocyte Chemoattractant Protein 1) : MCP1 fait partie de la famille des MCP (Monocyte Chemoattractant Protein), dont la fonction consiste principalement à recruter les cellules de l’immunité innée sur les sites inflammatoires. MCP1 est une chimiokine au motif C-C, d’où son autre appellation CCL2 (C-C Ligand 2) [108]. Son expression est étroitement corrélée avec l’IMC chez l’Homme [109 , 110]. Les effets cellulaires de MCP1 passent par l’intermédiaire du récepteur CCR2 (C-C motif Chemokine Receptor 2). L’expression de MCP1 dans le TA est imputable aux cellules de la FSV [109, 111]. MCP1 pourrait être à l’origine du recrutement de macrophage au cours de la mise en place de l’obésité et du diabète de type II. Une succession d’articles a confirmé cette hypothèse. Chez les souris, l’invalidation pour le récepteur CCR2 ou le traitement avec un antagoniste de CCR2 diminue significativement l’infiltration macrophagique induite par un régime gras. Dans ces deux approches, l’homéostasie glucidique et la sensibilité à l’insuline sont améliorées [112]. La sur-expression de MCP1 dans le TA entraîne le recrutement important de macrophages ainsi que le développement d’une obésité massive associée au diabète [113, 114]. Mais le choix de sur-exprimer MCP1 dans le TA en utilisant le promoteur aP2 (promoteur induisant une expression spécifique dans le TA) semble être un biais de l’étude. En effet avec le promoteur aP2, la surexpression ne se fait que dans les adipocytes, or MCP1 n’est pas produit par les adipocytes. Ce résultat est d’autant plus sujet à caution que l’invalidation de MCP1 chez la souris, n’affecte pas le recrutement des macrophages lors de la mise en régime gras [115].
L’ensemble des résultats suggère que CCR2 semble être le récepteur impliqué principalement dans le recrutement des macrophages dans le TA. Mais bien qu’étant le ligand du récepteur CCR2, MCP-1 ne semble pas être la chémokine responsable de l’attraction des macrophages au cours de la prise de poids.
→ IL-6 (Interleukine de type 6) : IL-6 est une cytokine multi fonctionnelle de 21 à 28 kDa. Elle est produite par un très grand nombre de types cellulaires comme les cellules endothéliales ou les macrophages [116]. L’IL-6 est également produite par le TA, mais il semble cependant que sa production soit majoritairement dépendante des cellules de la FSV [117]. Néanmoins la contribution du TA aux taux plasmatiques d’IL-6 semble être conséquente. En effet, des expériences de différences artério-veineuses montrent que près de 30% de l’IL-6 plasmatique serait imputable au TA [118, 119]. Les taux plasmatiques d’IL-6 sont étroitement corrélés avec l’IMC et inversement reliés à la sensibilité à l’insuline [120 , 121]. In vitro, l’IL-6 induit la résistance à l’insuline sur des hépatocytes, ceci via la protéine SOCS-3 (Suppressor Of Cytokines Signalling) qui inhibe l’autophosphorylation du récepteur à l’insuline [122 , 123]. Mais ce concept est mis à mal par l’invalidation génique de l’IL-6 chez la souris qui donne un phénotype obèse associé à une intolérance au glucose [124]. De plus l’injection centrale d’IL-6 entraîne l’augmentation de la dépense énergétique et la diminution des dépôts adipeux [124]. L’ensemble de ces observations suggère que l’IL-6 peut agir au niveau central ou périphérique pour moduler la prise de poids et/ou la sensibilité à l’insuline.
Il est important de préciser que les facteurs évoqués précédemment appartiennent à la sphère immuno-inflammatoire. Or seul un facteur sur les trois cités, joue un rôle avéré sur les cellules de l’inflammation (MCP-1 et son impact sur les macrophages). Pour l’heure, les deux autres ont un impact plutôt métabolique, principalement sur la sensibilité à l’insuline. Mais il n’est pas exclu que par ailleurs ces molécules puissent contribuer à la mise en place de processus physiopathologiques associé à l’obésité (diabète de type II) par leur propriété immuno-modulatrice [125, 126].
La fonction métabolique :
Une très grande partie des sécrétions du TA régule le métabolisme du TA lui-même mais aussi de nombreux autres tissus. Ces sécrétions peuvent avoir un impact central (leptine) mais aussi périphérique sur le foie ou les muscles squelettiques
(adiponectine, acides gras ou visfatine). Les fonctions métaboliques ciblées sont principalement la régulation de la prise alimentaire, la sensibilité à l’insuline ou l’oxydation des acides gras.
→ Leptine : La leptine est une protéine de 16 kDa dont le gène a été cloné en 1994 [100]. Elle est exprimée par le TA, l’adipocyte restant la source principale [127]. L’expression de la leptine augmente chez l’homme et les animaux obèses de même que les taux plasmatiques qui sont corrélés avec la masse adipeuse chez la souris ou chez l’homme [128]. La découverte de la leptine et de ses récepteurs s’est faite avec la mise en évidence chez la souris de deux mutations « spontanées » conduisant à une obésité qui ressemble aux symptômes de l’obésité morbide chez l’Homme. La première mutation a été localisée sur un gène baptisé par la suite ob (pour obèse) qui code pour la leptine [100]. La deuxième a été identifiée sur le gène baptisé db (pour diabète) qui code pour les récepteurs de la leptine [129]. La perfusion de leptine recombinante à des souris ob/ob réduit la prise alimentaire, le poids corporel et le poids des dépôts adipeux [130 , 131]. Ce résultat apportant la preuve que l’absence de leptine est responsable du phénotype obèse des souris ob via notamment la régulation de la prise alimentaire. Cependant l’administration de leptine induit une perte de poids plus importante qu’une restriction calorique, suggérant une action de la leptine sur la régulation des dépenses énergétiques. La leptine augmente le métabolisme de base, stimule la production de T3, augmente la production de protéines découplantes mitochondriale (UCP1, 2 et 3) [132]. La leptine sensibilise les tissus périphériques à l’insuline [133]. En effet elle active l’oxydation des acides gras, diminue la production hépatique de glucose et réduit l’accumulation ectopique de lipides [132]. Cet effet passe par l’activation directe de l’AMP-kinase des muscles squelettiques et indirecte de l’hypothalamus [134]. Au cours la mise en place de l’obésité, un processus de résistance à la leptine se développe, entraînant notamment la perte des effets sensibilisateurs à l’insuline [135]. Ce processus est un des éléments contribuant à la mise en place du diabète de type II. À ce jour, les mécanismes de cette résistance à l’insuline sont flous voire controversés. Très récemment il a été envisagé que l’interaction de la protéine de l’inflammation CRP (C-reactive protein) avec la leptine entraîne la perte de ses fonctions physiologiques [136 , 137].
→ Adiponectine : L’hormone adiponectine a été identifiée par différents groupes à la recherche de gènes augmentés spécifiquement au cours de la différenciation
adipocytaire et porte différents noms : apM1, GBP28, AdipoQ ou ACRP30 [138]. L’adiponectine circulante peut exister sous forme de trimères, d’hexamères ou de multimères comprenant 12 à 18 sous-unités. Elle se lie à deux sous-classes de récepteurs couplés aux protéines G, nommés adipoR1 et adipoR2 [139]. L’adiponectine est exclusivement exprimée par le TA et l’adipocyte en particulier, et circule à un niveau très élevé dans le sang des primates et des rongeurs. Contrairement aux autres adipokines, l’adiponectine diminue fortement au cours de la mise en place de l’obésité et de la résistance à l’insuline que ce soit chez le rongeur ou chez l’homme. De même une perte de poids induit une augmentation de l’adiponectinémie comme un traitement thiazolidine-diones (TZD) in vitro ou in vivo. L’invalidation du gène adiponectine a permis de mieux comprendre le rôle biologique joué par cette hormone. Elle induit une diminution de la glycémie, la concentration plasmatique d’acides gras ou de triglycérides dans différents modèles de souris obèses et/ou diabétiques. Les effets sur la glycémie s’expliquent principalement en deux points : la stimulation du transport de glucose adipocytaire et l’inhibition de la production hépatique de glucose [140 , 141]. Les effets sur le profil des lipides plasmatiques s’expliquent par la stimulation de l’oxydation des acides gras au niveau musculaire via l’activation de l’AMP-kinase [142].
→ Resistine : La resistine a été identifiée (technique de banque soustractive) comme un facteur réprimé par les TZD et augmenté lors de la différenciation adipocytaire [143]. C’est un polypeptide de type cystein-rich de 12kDa qui appartient à la famille des protéines FIZZ (pour Found in Inflammatory Zone). Chez la souris mise en régime gras ou génétiquement obèse (souris ob/ob), la resistine est exprimée quasi exclusivement par l’adipocyte et détectée au niveau plasmatique. L’administration de resistine recombinante chez le rongeur induit une résistance à l’insuline systémique tandis que l’administration d’anticorps anti-resistine induit l’effet opposé [143]. In vitro, la diminution de la réponse à l’insuline induite par la resistine passerait par les protéines de type SOCS (Suppressor Of Cytokines Signalling) [144]. Cependant une grande incertitude demeure sur la pertinence physiologique de la resistine chez l’Homme. En effet, les ARNm ne sont pas détectables dans le TA de sujets de poids normal mais seulement dans le TA d’individus obèses [145]. Aucune corrélation avec l’IMC ou la résistance à l’insuline n’est décrite [146]. Les macrophages seraient la source prédominante de la resistine circulante [147]. Par conséquent la détection de la resistine dans le TA de patients obèses est
probablement due à l’infiltration macrophagique. Enfin la controverse est aussi alimentée par le fait que les effets de type diabétogène chez la souris ne sont pas retrouvés chez l’homme [148].
Au vu de tout ce débat [149], des études supplémentaires sont nécessaires pour déterminer l’implication de la resistine murine dans les processus de résistance à l’insuline et l’importance physiologique de la resistine humaine.
→ Visfatine: La visfatine n’a été caractérisée que très récemment par une approche visant à étudier différentiellement les gènes exprimés par le TA viscéral entre une situation contrôle et obèse [150]. Cette protéine se nomme aussi PBEF (pre-B cell colony-enhancing factor) et est connue pour réguler la prolifération des lymphocytes B. Ce facteur peut être synthétisé par la moelle osseuse, le foie ou les muscles squelettiques et aussi le TA viscéral, d’où il tire son nom (Visceral fat). L’expression tissulaire de la visfatine comme ses taux plasmatiques sont augmentés avec l’obésité associée à une résistance à l’insuline [150]. La visfatine est caractérisée par des effets insulino-mimétiques marqués. C’est un puissant agent adipogénique via la stimulation du transport de glucose et de la lipogenèse in vitro. En effet elle induit une augmentation du transport de glucose in vitro sur les pré-adipocytes 3T3L1 ou les myocytes L6 [150]. L’administration de visfatine à des souris diabétiques induit une amélioration de la sensibilité à l’insuline. Cette thèse est confirmée par la présence d’une hyperglycémie « basale » chez les animaux hétérozygotes pour l’invalidation de la visfatine. Tout cela serait expliqué par le fait que la visfatine peut se lier sur les récepteurs à l’insuline, avec une affinité similaire à l’insuline (le site de liaison est différent) [150]. Malgré ces évidences expérimentales, la question de la pertinence physiologique de la visfatine se pose. En effet, ces résultats chez la souris ne sont pas confirmés par d’autres modèles animaux [151]. Les doutes subsistent aussi sur ses effets insulino-mimétiques [152]. En effet, la visfatine n’est régulée ni par le jeûne ni par la prise alimentaire et sa concentration plasmatique à l’état basal ne représente que 3 à 10% de la concentration de l’insuline. Enfin chez l’homme, les taux de visfatine ne sont pas corrélés avec la quantité de TA viscéral et aucune différence d’expression n’est décrite entre les dépôts adipeux sous-cutanés et viscéral [153].
La visfatine semble être une adipokine dont le rôle n’est pas encore précisé (facteur pro-adipogénique et/ou insulino-mimétique), de nombreuses études restent à mener