ANNEE: 200 THESE N°:
A
A
n
n
e
e
s
s
t
t
h
h
é
é
s
s
i
i
e
e
r
r
é
é
a
a
n
n
i
i
m
m
a
a
t
t
i
i
o
o
n
n
p
p
o
o
u
u
r
r
c
c
h
h
i
i
r
r
u
u
r
r
g
g
i
i
e
e
d
d
e
e
s
s
p
p
a
a
r
r
a
a
t
t
h
h
y
y
r
r
o
o
ï
ï
d
d
e
e
s
s
( (ééttuuddee rrééttrroossppeeccttiivvee aa pprrooppooss ddee 5577 ccaass))THESE
Présentée et soutenue publiquement le :………..
PAR
Mr. Moncef EL MANSOURI
Né le 01 Décembre 1979 à Souk Larbaa du Gharb
Médecin interne du CHU Rabat-Salé
Pour l'Obtention du Doctorat en
Médecine
MOTS CLES Hyperparathyroïdie – Hypercalcèmie – Techniques anesthésiques – Hypocalcémie postopératoire.
JURY
Mr. A. AZZOUZI PRESIDENT
Professeur d'Anesthésie réanimation
Mr. A. EL HIJRI RAPPORTEUR
Professeur Agrégé d'Anesthésie réanimation Mr. S. KABBAJ
Professeur Agrégé d'Anesthésie réanimation Mr. R. MOHSINE
Professeur Agrégé de Chirurgie Générale Mr. Y. SEFIANI
MATERIEL ET METHODES ... 4
RESULTATS ... 8
I- Type d‟hyperparathyroïdie ... 9
II- Caractéristiques des patients ... 10
III- Données de l‟évaluation préopératoire ... 12
1. Eléments cliniques ... 12
2. Eléments biologiques ... 14
IV- Préparation préopératoire ... 15
V- Données peropératoires ... 15
1. Installation ... 15
2. Technique anesthésique- monitorage ... 15
3. Technique chirurgicale ... 16
VI- Période postopératoire ... 17
DISCUSSION ... 19
I- Physiologie des glandes parathyroïdes : Régulation du métabolisme phosphocalcique ... 20
1. Distribution du calcium dans l‟organisme... 20
2. Régulation de la calcémie ... 22
3. Physiologie de la parathormone ... 26
II- Hyperparathyroïdie ... 30
III- Anesthésie pour chirurgie des glandes parathyroïdes ... 42 1. Période préopératoire ... 42 Evaluation préopératoire ... 42 Préparation à l‟intervention... 44 2. Période peropératoire ... 50 Installation du patient ... 50 Monitorage peropératoire ... 51 Technique anesthésique ... 51 Techniques chirurgicales... 67 3. Période postopératoire ... 73 Réanimation postopératoire ... 73 Eléments de la surveillance... 75 Complications postopératoires ... 76 Mortalité opératoire ... 85 CONCLUSION ... 87 RESUMES ... 90 BIBLIOGRAPHIE ... 97
La chirurgie des glandes parathyroïdes s‟adresse en règle aux hyperparathyroïdies et revêt des aspects contrastés. Dans la plupart des cas, il s‟agit d‟une chirurgie peu traumatisante avec des suites opératoires simples.
Toutefois, les conséquences périopératoires de l‟hyperparathyroïdie et de la parathyroïdectomie sur le métabolisme phosphocalcique peuvent générer des perturbations physiologiques majeures susceptibles de mettre en jeu le pronostic vital.
Dans le but de minimiser le risque opératoire, une prise en charge anesthésique appropriée doit être de mise. Celle-ci, s‟articule autour des éléments suivants :
la prise en ligne de compte du terrain de l‟opéré;
le respect des impératifs liés à toute chirurgie cervicale;
la connaissance des conséquences de l‟hyperparathyroïdie et de leurs implications anesthésiques;
l‟appréhension des effets de la parathyroïdectomie sur le métabolisme phosphocalcique et des conséquences qui en découlent.
Dans le cadre de la chirurgie de l‟hyperparathyroïdie, les anesthésistes- réanimateurs sont, en fait, souvent confrontés à des patients de plus en plus âgés, porteurs de pathologies associées et dont la gravité de la maladie est directement liée à l‟amplitude et à la durée de l‟hypercalcémie. Cela est bien mis en exergue lors de l‟anesthésie pour hyperparathyroïdie secondaire à l‟insuffisance rénale chronique. Celle-ci imposant une évaluation préopératoire soigneuse et une technique anesthésique adaptée.
Durant la période postopératoire, le souci spécifique majeur étant celui des complications endocriniennes, notamment l‟hypocalcémie.
Dans ce travail nous nous sommes proposés de mener une étude à propos de l‟ensemble des patients opérés pour hyperparathyroïdie au bloc opératoire central de l‟hôpital Avicenne durant la période allant de Janvier 2000 à Décembre 2007.
L‟objectif de l‟étude a été, bien entendu, de mettre l‟accent sur les aspects de la prise en charge anesthésique de la chirurgie des hyperparathyroïdies, avec revue de la littérature.
Matériel et
méthodes
Il s‟agit d‟une étude descriptive, rétrospective qui a porté sur les patients opérés pour hyperparathyroïdie, au bloc opératoire central de l‟hôpital Avicenne. La période d‟étude s‟est étalée sur une durée de huit ans (début janvier 2000- fin décembre 2007).
Ont été inclus dans l‟étude, tous les patients des cliniques chirurgicales « A » (Pr A. Belkouchi) et « D » (Pr Y. Bensaid) opérés pour hyperparathyroïdie primitive ou secondaire à l‟insuffisance rénale chronique.
Le diagnostic de l‟hyperparathyroïdie a été établi sur la base de donnés morphologiques (échographie et/ ou scintigraphie) et biologiques (élévation du taux de parathormone plasmatique).
Au cours de cette étude, nous avons relevé les paramètres suivants :
1. Les caractéristiques des patients
les données démographiques (âge, sexe) ;
les éléments de co-morbidité (diabète sucré, hypertension artérielle, insuffisance rénale chronique…) ;
l‟existence d‟une chirurgie cervicale antérieure.
2. Le type de l‟hyperparathyroïdie, selon qu‟elle a été primitive ou
secondaire à l‟insuffisance rénale chronique. L‟analyse des données anatomopathologiques après cervicotomie permettait de spécifier la lésion parathyroïdienne causale : adénome, carcinome ou hyperplasie des parathyroïdes.
3. Les éléments de l‟évaluation préopératoire
En plus des données générales, nous avons recueilli les manifestations traduisant le retentissement viscéral et métabolique de l‟hyperparathyroïdie.
Les signes recherchés étaient d‟ordre :
cardiovasculaire (hypertension artérielle, lésions coronaires, troubles de rythme, troubles de conduction, hypertrophie ventriculaire gauche…) ;
rénal (lithiase rénale, syndrome polyuropolydipsique, insuffisance rénale aiguë…). L‟insuffisance rénale aiguë périopératoire a été définie par une élévation du taux de créatinine et/ou d‟urée de plus de 20% par rapport aux valeurs de base.
ostéo-articulaire (douleurs osseuses, fractures pathologiques, déminéralisation osseuse…) ;
neuromusculaire (asthénie, fatigabilité à l‟effort…) ;
neuropsychiatrique (troubles de l‟humeur, perte de mémoire, désordres psychotiques…) ;
digestif (douleurs abdominales, vomissement, nausées, ulcères peptiques…) ;
biologique (calcémie, taux de parathormone plasmatique).
L‟hypercalcémie a été définie par une valeur de calcium plasmatique supérieure à 105 mg/l (2,60 mmol/l). L‟hyperparathyroïdie a été définie par un taux sanguin dépassant la limite supérieure de la normale (11-69 pg/ml).
Il est à souligner que dans notre étude, nous n‟avons pas procédé à une correction de la calcémie en fonction des chiffres de protidémie et/ou d‟albuminémie.
4. Une éventuelle préparation préopératoire à l‟intervention, ainsi que ses
modalités (réhydratation, traitement diurétique, inhibiteurs de la résorption osseuse, épuration extra- rénale).
5. Les données peropératoires
le type d‟installation et monitorage ;
la technique anesthésique utilisée (anesthésie générale, anesthésie locorégionale) ;
le geste chirurgical effectué ;
la durée de l‟intervention chirurgicale ;
la survenue éventuelle de complications peropératoires.
6. Les données de la période postopératoire
le suivi postopératoire des patients inclus dans l‟étude a porté sur la recherche de complications hémorragiques (hématome cervical), de lésions recurrentielles et de signes cliniques neuromusculaires, d‟hypocalcémie.
nous avons également recueilli les valeurs de la calcémie postopératoire. Quand celle-ci a été basse (inférieure à 85 mg/l), nous avons précisé les thérapeutiques utilisées.
enfin, nous avons calculé la durée globale du séjour hospitalier et la durée de séjour postopératoire.
L‟ensemble des variables quantitatives relevées dans l‟étude étaient exprimées en moyenne ± écart-type. Les variables qualitatives étaient exprimées en pourcentage.
Durant la période d‟étude, 72 patients ont été opérés pour hyperparathyroïdie. 15 patients, parmi eux, ont été exclus de l‟étude car les dossiers n‟étaient pas exploitables. Le nombre de cas inclus dans l‟étude était alors de 57 patients.
Le nombre des cas opérés dans les cliniques chirurgicales « A » et « D » était respectivement de 43 et 14 patients.
I. TYPE D’HYPERPARATHYROÏDIE
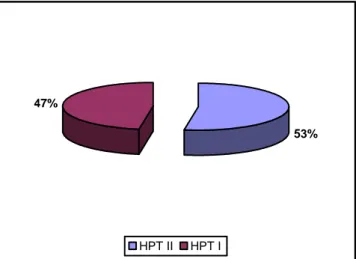
La répartition des patients en fonction du type de l‟hyperparathyroïdie était comme suit :
27 patients, soit 47,37% ont été opérés pour hyperparathyroïdie primitive ;
30 patients, soit 52,63% ont été opérés pour hyperparathyroïdie secondaire (Fig.1).
53% 47%
HPT II HPT I
Figure 1 : Répartition des patients selon le type d’hyperparathyroïdie. HPT I = Hyperparathyroïdie primitive
II. CARACTÉRISTIQUES DES PATIENTS
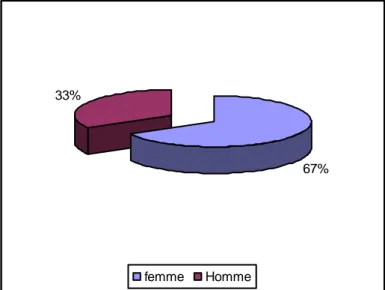
L‟âge moyen des patients était de 45 ans avec des extrêmes allant de 20 à 71 ans. Le sex-ratio était de deux (38 femmes/19 hommes). (Fig.2)
L‟analyse des données démographiques en fonction du type de l‟hyperparathyroïdie montrait les résultats suivants (Tableau I) :
Dans l‟hyperparathyroïdie primitive, l‟âge moyen des patients était de 48 ans avec un sex-ratio de huit (24 femmes/3hommes) ;
Dans l‟hyperparathyroïdie secondaire, l‟âge moyen des patients était de 43 ans avec un sex-ratio de 0,9 (14 femmes/16 hommes).
67% 33%
femme Homme
Hyperparathyroïdie primitive
Hyperparathyroïdie secondaire Age (en années)
moyenne ± écart-type 48 ± 12,85 43 ± 11,86
Sex-ratio
femmes/hommes 24 (89%) / 3 (11%) 14 (47%) / 16 (53%)
Tableau I- Caractéristiques des patients selon le type d’hyperparathyroïdie.
En plus de l‟insuffisance rénale chronique observée chez les 30 patients opérés pour hyperparathyroïdie secondaire, on a relevé comme éléments essentiels de co-morbidité : l‟hypertension artérielle notée chez 18 patients (31,5 %) et le diabète sucré qui était présent dans six cas (10,5%). Ces tares étaient observées particulièrement chez les patients opérés pour hyperparathyroïdie secondaire (Tableau II).
Hyperparathyroïdie primitive Hyperparathyroïdie secondaire Insuffisance rénale chronique 0 30 (100%) HTA 2 (7,4%) 16 (53%) Diabète sucré 2 (7,4%) 4 (13%)
Tableau II- Eléments de co-morbidité en fonction du type de l’hyperparathyroïdie.
Enfin, cinq patients avaient déjà bénéficié d‟une chirurgie cervicale antérieure, dont quatre cas de chirurgie parathyroïdienne et un cas de chirurgie thyroïdienne.
III. DONNÉES DE L’ÉVALUATION PRÉOPÉRATOIRE
1. Éléments cliniques
Les manifestations les plus fréquemment relevées chez les patients étaient essentiellement d‟ordre cardiovasculaire et ostéo-articulaire.
Les signes cardiovasculaires étaient, en effet, observés chez 29 patients, soit 51%. Ils étaient dominés par l‟hypertension artérielle et les calcifications vasculaires périphériques.
41 patients, soit 72% présentaient des signes ostéo-articulaires à type de douleurs osseuses essentiellement ; sept patients ont présenté des fractures pathologiques.
Dix patients (17,5%) avaient, par ailleurs, des lithiases rénales, dont un cas de lithiase sur rein unique, responsable d‟une insuffisance rénale aiguë.
Huit patients (14%) avaient des signes neuromusculaires à type d‟asthénie et de fatigabilité à l‟effort et neuf patients (16%) ont manifesté des signes digestifs à type de douleurs abdominales non spécifiques, d‟ulcère gastro-duodénal et de vomissements.
L‟ensemble des manifestations cliniques retrouvées chez nos patients en fonction du type de l‟hyperparathyroïdie, sont représentées sur le tableau III.
Hyperparathyroïdie primitive
Hyperparathyroïdie secondaire
Total
Signes cardiovasculaires 05 cas (18,5%) 24 cas (80%) 29 cas (51%) - Hypertension artérielle - Troubles du rythme - Hypertrophie ventriculaire gauche - Cardiomyopathie - Calcifications vasculaires 4 1 1 - - 20 3 3 1 5 24 4 4 1 5 Manifestations rénales 13 cas (48%) - 13 cas
(23%) - Lithiase rénale
- Syndrome
polyuropolydipsique - Insuffisance rénale aiguë
10 2 4 - - - 10 2 4 Manifestations ostéo-articulaires
19 cas (70%) 22 cas (73%) 41 cas (72%) - Douleurs osseuses - Fractures pathologiques - Déminéralisation osseuse - Tuméfaction osseuse 19 4 10 1 22 3 14 2 41 7 24 3 Manifestations neuromusculaires
5 cas (18,5%) 3 cas (10%) 8 cas (14%) Manifestations
neuropsychiatriques
1 cas (3,7%) 5 cas (17%) 6 cas (10,5%) - Agitation - Neuropathie périphérique 1 - - 5 1 5 Manifestations digestives 6 cas (22%) 3 cas (10%) 9 cas
(16%) Tableau III- Répartition des manifestations cliniques relevées dans l’étude,
2. Éléments biologiques
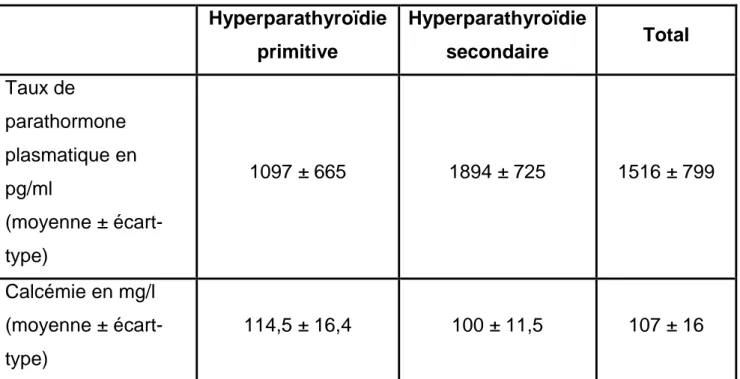
Le taux de parathormone plasmatique était élevé chez tous les patients, avec une moyenne de 1500 pg/ml. Celle-ci était particulièrement élevée dans le groupe des patients opérés pour hyperparathyroïdie secondaire.
La moyenne de la calcémie (non corrigée) était de 107 mg/l. Celle-ci était particulièrement élevée dans le groupe des patients opérés pour hyperparathyroïdie primitive ; cinq patients de ce groupe avait une calcémie normale.
Dans le groupe des patients opérés pour hyperparathyroïdie secondaire, la calcémie (non corrigée) moyenne était de 100 mg/l ; avec un taux normal dans 22 cas (73%) (Tableau IV).
Hyperparathyroïdie primitive Hyperparathyroïdie secondaire Total Taux de parathormone plasmatique en pg/ml (moyenne ± écart-type) 1097 ± 665 1894 ± 725 1516 ± 799 Calcémie en mg/l (moyenne ± écart-type) 114,5 ± 16,4 100 ± 11,5 107 ± 16
Tableau IV- Répartition du taux de parathormone plasmatique et de calcémie selon le type d’hyperparathyroïdie.
IV. PRÉPARATION PRÉOPÉRATOIRE
La préparation préopératoire a été nécessaire chez 16 patients. Elle a eu recours à la réhydratation par voie parentérale et/ou orale, éventuellement associée aux diurétiques de l‟anse. Un patient porteur d‟une insuffisance rénale obstructive, a nécessité la mise en place d‟une sonde de dérivation (JJ) avant la chirurgie.
V. DONNEES PEROPERATOIRES
1. Installation
Tous les patients de notre série ont été installés en décubitus dorsal, avec un billot sous les épaules et une hyperextension cervicale. Dans la plupart des cas, les bras étaient placés le long du corps.
2. Technique anesthésique- monitorage
L‟anesthésie générale était la technique de choix. Elle a été réalisée dans 56 cas (98%).
L‟induction anesthésique était assurée par l‟utilisation de fentanyl, de bromure de vécuronium et de thiopental. L‟entretien anesthésique faisait appel à l‟halothane, au protoxyde d‟azote et aux réinjections de morphiniques et de curares.
Chez les patients opérés pour hyperparathyroïdie secondaire, le curare de choix a été l‟atracurium.
Un monitorage standard a été utilisé chez tous les patients. Il comprenait l‟oxymétrie de pouls, l‟électrocardioscope, la capnographie et la mesure automatisée de la pression artérielle.
Un patient a été opéré pour adénome parathyroïdien sous anesthésie locorégionale. Le choix de cette technique a été dicté par la pathologie parathyroïdienne en cause (adénome), le terrain (hypertension artérielle, insuffisance rénale en rapport avec une lithiase sur rein unique, manifestations ostéo-articulaires avec fractures pathologiques…) et la préférence du patient ; celui-ci ayant exprimé son souhait de se faire opérer sous anesthésie locorégionale.
Quant au protocole d‟anesthésie locorégionale proprement dit, il était à base d‟un bloc combiné du plexus cervical. Nous avons procédé, en effet, à la réalisation d‟un bloc superficiel du plexus cervical en association avec un bloc profond. La solution anesthésique comprenait un mélange de lidocaïne à 2% et de bupivacaïne à 0,5%.
3. Technique chirurgicale
Dans le groupe des patients opérés pour hyperparathyroïdie primitive, l‟intervention chirurgicale a consisté en une adénomectomie (un adénome parathyroïdien était en cause dans tous les cas).
Deux patients parmi les 27 patients opérés pour hyperparathyroïdie primitive ont bénéficié, toutefois, d‟une parathyroïdectomie subtotale. Celle-ci était, en fait, jugée indispensable en raison de la persistance de la symptomatologie de l‟hyperparathyroïdie après réalisation d‟une adénomectomie simple.
Il est à noter par ailleurs, qu‟un geste associé au niveau des glandes thyroïdes pour lésions nodulaires a été réalisé chez quatre patients.
Dans le groupe des patients opérés pour hyperparathyroïdie secondaire, la technique chirurgicale a consisté en une parathyroïdectomie subtotale.
Deux patients ont bénéficié d‟une adénomectomie. Il s‟agit, en fait, de deux malades ayant déjà bénéficié d‟une parathyroïdectomie subtotale et chez lesquels il y avait persistance de la symptomatologie de l‟hyperparathyroïdie. Celle-ci est s‟avérée être en rapport avec un adénome parathyroïdien médiastinal antérieur dans les deux cas.
Deux patients ont, par ailleurs, fait l‟objet d‟une isthmolobectomie associée pour lésions thyroïdiennes.
Quant à la durée de la chirurgie, elle a été en moyenne de 105 minutes, avec des extrêmes allant de 65 minutes à 135 minutes.
VI. PERIODE POSTOPERATOIRE
Tous les patients ont été extubés sur table opératoire. Il n‟y avait aucun incident particulier, notamment respiratoire, dans les suites immédiates de l‟extubation.
L‟analgésie postopératoire était à base d‟anti-inflammatoires non stéroïdiens et de paracétamol.
Aucun patient n‟a présenté de complications hémorragiques postopératoires ; les drains de redons ont été retirés le lendemain de l‟intervention.
Un patient a présenté, en postopératoire, une dysphonie en rapport avec une paralysie récurrentielle unilatérale droite.
Un dosage de la calcémie a été réalisé chez tous les patients. Elle était en moyenne de 85 mg/l avec des extrêmes allant de 60 à 130 mg/l.
Dans le groupe des patients opérés pour hyperparathyroïdie primitive, la calcémie (moyenne ±écart-type) était de 88,26 ± 15,31 mg/l. Celle-ci était de 82,03 ± 13,19 mg/l dans le groupe des patients opérés pour hyperparathyroïdie secondaire.
Une hypocalcémie, inférieure à 85 mg/l, a été observée chez 30 patients, soit 53%. Elle était précoce durant les vingt-quatre premières heures postopératoires chez 17 patients et tardive au-delà du 2éme jour postopératoire chez 13 patients.
L‟hypocalcémie était, par ailleurs, symptomatique dans 16 cas (28%). Les principaux signes cliniques rapportés étaient à type de :
paresthésies et fourmillements ; crises de tétanie ;
trismus ;
signe de Shvosteck positif.
La correction de ces troubles a fait appel à l‟apport de gluconate de calcium par voie intraveineuse, du calcium par voie orale (Calcidia®) et de dérivés actifs de vitamine D (un-alpha®).
Nous déplorons un cas de décès survenu durant les premières heures postopératoires. Il s‟agit d‟un patient connu hypertendu artériel qui a été opéré pour hyperparathyroïdie secondaire, et qui a présenté un tableau de défaillance cardiaque d‟évolution rapidement fatale.
Quant à la durée globale de séjour hospitalier, elle a été en moyenne de 16,5 jours avec des extrêmes allant de 3 à 49 jours. La durée moyenne du séjour hospitalier postopératoire était de 6 jours avec des extrêmes allant de 1 à 42 jours.
I. PHYSIOLOGIE DES GLANDES PARATHYROÏDES :
RÉGULATION DU MÉTABOLISME PHOSPHOCALCIQUE
Le calcium représente le principal cation de l‟organisme. Il est impliqué directement ou comme cofacteur dans de nombreuses fonctions métaboliques. Le calcium étant aussi un élément essentiel du squelette osseux.
La régulation de sa concentration extracellulaire est sous la dépendance de plusieurs systèmes hormonaux permettant le maintien de la calcémie dans des limites très étroites. Ceci est assuré par l‟adaptation homéostatique des entrées du calcium dans le liquide extracellulaire et de la capacité rénale d‟excrétion du calcium.
Par son action sur l‟os et sur le tubule rénal, l‟hormone parathyroïdienne représente l‟élément essentiel de cette adaptation. Elle régule le métabolisme calcique, tant en situation normale que pathologique [1].
1. Distribution du calcium dans l’organisme
Le pool calcique total de l‟organisme est de 1 à 2 kg (soit 25000 à 50000 mmol). La plus grande partie (99%) étant contenue dans le squelette osseux, principalement sous forme de cristaux d‟hydroxyapatite [1,2].
Le pool extracellulaire du calcium n‟est que de 1 g (25 mmol). Dans le secteur vasculaire, le calcium circule pour 40%, sous forme non ultrafiltrable, fixé aux protéines plasmatiques (principalement l‟albumine et accessoirement les globulines). 60% du calcium plasmatique est ultrafiltrable : 50% sous forme libre ionisée et 10% sous forme complexée aux anions (bicarbonates, citrates, phosphates, lactates) (Fig. 3) [3].
La forme libre ionisée du calcium plasmatique représente la fraction régulable et biologiquement active du calcium extracellulaire.
Enfin, le calcium intracellulaire représente environ 250 mmol. La majeure partie se trouvant dans les organites intracellulaires, mitochondries ou réticulum endoplasmique.
Les fonctions du calcium intracellulaire sont multiples. Il contribue à la stabilité des membranes plasmiques et intervient dans de nombreux processus physiologiques tels que la contraction musculaire, la sécrétion hormonale ou la division cellulaire. Il a également un rôle majeur dans la signalisation intracellulaire agissant comme un second messager.
2. Régulation de la calcémie
La calcémie est maintenue dans des limites très étroites, principalement grâce à trois flux bidirectionnels au niveau intestinal, rénal et osseux.
La parathormone représente l‟hormone clé de ce métabolisme (Fig.4). Avant d‟étudier la physiologie de cette hormone, nous allons rappeler les trois facteurs régissant la régulation de la calcémie.
Figure 4 : Régulation de la calcémie [4].
PTH= parathormone.
2.1. Flux intestinal du calcium
Chez les individus normaux, les apports alimentaires en calcium représentent la seule source de calcium externe. L‟alimentation amène quotidiennement 1g de calcium (25 mmol/j).
Dans les conditions normales, l‟absorption intestinale nette ne représente que 20% du calcium ingéré (5mmol/j). Cette absorption est la résultante de deux flux opposés : flux lumière- plasma (absorption = 35%) sous l‟influence de la vitamine D et flux plasma- lumière (sécrétion = 15%) dépendant du gradient de concentration de calcium ionisé entre le plasma et la lumière digestive (Fig.5).
L‟absorption a lieu essentiellement dans la partie proximale du tube digestif, au niveau du duodénum et du jéjunum (absorption active) et de la partie terminale du jéjunum et de l‟iléon (absorption passive).
*
2.2. Flux osseux du calcium
Le remodelage osseux mobilise 500 mg de calcium par jour (Fig.5). Environ 1% de la masse totale du calcium s‟échange chaque mois par un mécanisme de flux bidirectionnels : le flux de résorption et le flux de formation (accrétion). Chez un adulte normal, la formation osseuse compense la résorption.
La parathormone et la 1,25 (OH)2 D3 représentent les principaux stimulants de la résorption osseuse. La calcitonine, quant à elle, inhibe le flux de résorption tendant à abaisser la calcémie [6-8].
2.3. Flux rénal du calcium
Seule la fraction du calcium non liée aux protéines est librement ultra filtrée par le glomérule. Le calcium excrété dans les urines (2 à 7 mmol/j) résulte de la différence entre la quantité filtrée (270 mmol/j) et la quantité réabsorbée.
La majeure partie du calcium filtrée (70%) est réabsorbée dans le segment proximal du néphron. Cette réabsorption proximale est essentiellement passive, pour 80%, selon un transfert paracellulaire, secondaire à la réabsorption du sodium, du chlore et de l‟eau, avec un flux d‟entraînement du calcium. 20% de la réabsorption proximale du calcium se fait selon un mécanisme actif par voie transcellulaire [2, 9].
Les branches étroites ascendante et descendante de l‟anse de Henlé ont une perméabilité très faible au calcium et n‟interviennent pas dans le processus de réabsorption.
La branche ascendante large intervient pour 20% de la réabsorption tubulaire du calcium, qui serait à la fois passive et active en proportion
identique, avec une possibilité de régulation par la parathormone et la calcitonine : ces dernières stimulant la réabsorption active du calcium [10].
Le tube contourné distal est responsable de la réabsorption de 10% du calcium filtré. L‟absorption calcique à ce site est exclusivement active par voie transcellulaire, et soumise à une régulation hormonale étroite, permettant l‟adaptation fine de l‟excrétion urinaire du calcium. Le tube contourné distal est en effet le site principal de régulation de la réabsorption calcique par la parathormone, la calcitonine et la 1,25 (OH)2 D3.
La réabsorption calcique dans le tube collecteur est modeste, 1 à 3 % du calcium filtré, selon un flux passif sans régulation hormonale [10].
Au total, 1 à 3% du calcium filtré sera finalement éliminé dans les urines (Fig.6) [5].
3. Physiologie de la parathormone
Comme cité plus haut, la parathormone joue un rôle primordial dans la régulation du métabolisme calcique. Elle mobilise le calcium osseux, augmente la réabsorption tubulaire du calcium filtré et stimule la synthèse du 1,25 (OH) 2 D3 qui gouverne, en partie, l‟absorption digestive du calcium. Par ailleurs, la sécrétion même de la parathormone est régulée, en grande partie, par la valeur du calcium extracellulaire.
3.1. Biosynthèse [11]
La parathormone est un polypeptide composé d‟une seule chaîne de 84 acides aminés, dont le poids moléculaire est de 9500 daltons. Elle est sécrétée par les glandes parathyroïdiennes habituellement au nombre de quatre en situation rétrothyroïdienne.
Chez l‟homme, le gène, situé sur le bras court du chromosome 11, code pour un peptide de 115 acides aminés, la préproparathormone. Celle-ci est rapidement clivée en un peptide de 90 acides aminés, la proparathormone, puis en parathormone qui est la molécule stockée et sécrétée.
La préproparathormone a un poids moléculaire de 13000 daltons, sa structure est celle de la proparathormone, augmentée à son extrémité amino-terminale d‟un peptide hydrophobe de 25 acides aminés. Ce dernier représente la séquence signal ou « leader » qui définit le produit de synthèse du gène comme étant un peptide destiné à être sécrété.
La synthèse se produit dans les ribosomes accolés à la membrane du réticulum endoplasmique. En cours de synthèse, la molécule est guidée par la séquence signal hydrophobe, à l‟intérieur du réticulum endoplasmique où se
produit le clivage de cette séquence par destruction de la liaison glycine-lysine.
La proparathormone possède la structure de la parathormone avec une extension de 6 acides aminés à l‟extrémité amino-terminale. Elle est rapidement transférée du réticulum endoplasmique vers l‟appareil de Golgi, où se produit le clivage des 6 acides aminés initiaux, aboutissant à la formation de parathormone.
L‟ensemble du processus de synthèse (de la transcription du gène au clivage de la proparathormone) dure 15 à 20 minutes.
La parathormone libérée, stockée dans les granules sécrétoires, est la forme hormonale la plus abondante dans les cellules parathyroïdiennes puisque proparathormone ne compte que pour 7% de l‟immunoréactivité cytoplasmique.
Dans le sang, la parathormone circule sans être liée à une protéine. Elle a une demi-vie plasmatique de 30 minutes et est dégradée, surtout, dans le foie par protéolyse.
3.2. Contrôle de la sécrétion [5]
La sécrétion de la parathormone dépend, en grande partie, des variations de la calcémie. Toute augmentation de la calcémie au-delà de 2,8 mmol/l diminue la sécrétion de parathormone. Toute diminution en deçà de 1,8 mmol/l l‟augmente.
La rapidité de la chute de calcémie est aussi importante que son amplitude dans cette régulation. Le signal calcique est transmis à la cellule parathyroïdienne par un récepteur à sept traversées membranaires récemment cloné. Il est caractérisé par un énorme domaine amino-terminal
extracellulaire de 6650 amino-acides qui sert de détecteur de calcium. Le reste du récepteur transmet l‟information à une phospholipase C conduisant, in fine, à une diminution de la sécrétion de la parathormone.
L‟augmentation de la sécrétion de la parathormone en réponse à une hypocalcémie est liée à une activation de l‟adénylcyclase.
A long terme, les modifications de la calcémie ne portent pas seulement sur la sécrétion de parathormone, mais aussi sur sa synthèse et sur la prolifération des cellules parathyroïdiennes.
Il est à noter, enfin, qu‟en plus des variations de la calcémie, d‟autres éléments interviennent dans la régulation de la sécrétion de parathormone. C‟est le cas des métabolites de la vitamine D, notamment la 1,25 (OH) 2 D3 ou calcitriol. En effet, indépendamment des variations de la calcémie, le calcitriol inhibe la sécrétion de parathormone [1, 11, 12].
Au même titre que le calcitriol, les agents α- adrénergiques, les prostaglandines et l‟hypomagnésémie sont des éléments susceptibles d‟inhiber la sécrétion de parathormone [1,11, 12].
Les agonistes β- adrénergiques, la dopamine et l‟histamine augmentent, quant à eux, la sécrétion de parathormone [11].
3.3. Actions de la parathormone [1, 11, 13, 14]
La parathormone agit sur trois organes cibles : le rein, l‟os et le tube digestif.
3.3.1. Action sur le rein
La parathormone possède des récepteurs membranaires sur tous les segments du néphron.
L‟hormone augmente la réabsorption tubulaire du calcium. Ce par le biais des mécanismes suivants :
Augmentation de l‟entrée du calcium dans la cellule de la branche ascendante de l‟anse de Henlé ;
Augmentation de la pénétration cellulaire du calcium dans les cellules du tube contourné distal par activation des canaux calciques ;
Augmentation de l‟activité de l‟échangeur Na+/Ca++ au niveau du tube collecteur.
En cas d‟hypersécrétion de parathormone, on assiste à une augmentation de la calciurie du fait de l‟hypercalcémie associée entraînant une élévation du calcium filtré.
La parathormone augmente également la phosphaturie. Elle inhibe, en effet, au niveau du tube proximal et distal le co-transport sodium- phosphate.
La parathormone stimule l‟activité de la 1-25- hydroxylase rénale, ce qui augmente la synthèse rénale du calcitriol, augmentant à son tour la réabsorption du calcium par l‟intestin.
3.3.2. Action sur l’os
La parathormone stimule l‟ostéolyse et l‟action de résorption osseuse des ostéoclastes dont la prolifération augmente [5].
3.3.3. Action sur le tube digestif
Au niveau du tube digestif, les effets de la parathormone sont indirects, par l‟intermédiaire de la vitamine D, dont elle active la synthèse au niveau du rein.
II.HYPERPARATHYROÏDIE
1. Classification
Hyperparathyroïdie primitive (HPP)
L‟HPP est la conséquence d‟une production excessive, inappropriée, d‟hormone parathyroïdienne ayant pour principale conséquence une hypercalcémie.
Dans l‟espace d‟une trentaine d‟années, le profil clinique de l‟HPP a complètement changé. Cela est lié essentiellement à l‟introduction en routine de la mesure automatisée de la calcémie, qui a permis de dépister l‟HPP au stade asymptomatique [15-17].
La découverte de l‟HPP au stade de complications (lithiases rénales, atteintes osseuses majeures) étant devenue exceptionnelle [12, 15, 17].
L‟HPP représente 80% de l‟ensemble des hyperparathyroïdies [18,19]. Elle touche essentiellement les femmes ; celles-ci sont touchées deux à trois fois plus souvent que les hommes. La femme ménopausée parait particulièrement touchée.
L‟âge moyen de survenue se situe souvent entre la quatrième et la sixième décennie [15, 16].
La cause en est un adénome solitaire dans 75 à 85 % des cas, des adénomes multiples dans 5 % des cas, une hyperplasie diffuse dans 10 à 20%, et très rarement un carcinome (1 à 2 % des cas) [20].
Hyperparathyroïdie secondaire
Elle représente 20% des cas, touchant également les deux sexes avec un pic de fréquence vers 40-50 ans [21].
La cause la plus fréquente en est l‟insuffisance rénale chronique. L‟hyperplasie des glandes parathyroïdes et l‟élévation de la parathormone plasmatique surviennent précocement au cours de l‟évolution de l‟insuffisance rénale chronique.
Les facteurs responsables de cette hypersécrétion parathyroïdienne dans l‟insuffisance rénale sont la rétention de phosphore, la réduction de la production de calcitriol induisant initialement une hypocalcémie, ainsi que la résistance de l‟os à l‟action de la parathormone.
Hyperparathyroïdie tertiaire [22]
L‟hyperparathyroïdie tertiaire ou autonomisée est une forme rare, observée chez les patients ayant développé une hyperparathyroïdie secondaire sévère et qui ont bénéficié d‟une transplantation rénale.
En effet, la correction de l‟insuffisance rénale n‟entraîne pas forcément une normalisation du bilan phosphocalcique chez les patients ayant une hyperparathyroïdie secondaire. Cinq pour cent des patients transplantés rénaux conservent une hypercalcémie modérée qui est le résultat d‟une hypersécrétion autonome non régulable de parathormone. C‟est dans ce cadre que l‟on parle d‟hyperparathyroïdie tertiaire. Beaucoup de ces troubles se normalisent dans les douze mois suivant la transplantation ; dans le cas contraire, un geste chirurgical sur les glandes parathyroïdes s‟impose.
2. Conséquences physiopathologiques
L‟hypersécrétion de parathormone et l‟hypercalcémie qui l‟accompagne peuvent avoir des conséquences variables, touchant différents appareils. Ceci explique le polymorphisme clinique et les différents aspects de l‟hyperparathyroïdie.
2.1. Manifestations cardiovasculaires
2.1.1 Constatations anatomiques [15]
Les études anatomiques montrent la fréquence des dépôts calcaires intracardiaques au cours de l‟HPP. Ces lésions sont susceptibles d‟avoir des conséquences fonctionnelles :
Ischémie myocardique en cas de calcification coronaire ;
Dysfonctions, à type de fuites essentiellement, en cas de calcifications mitrales, et de sténoses en cas de calcifications aortiques ;
Troubles de conduction à type de bloc auriculo-ventriculaire pouvant être observés en cas de calcifications myocardiques proches du septum interventriculaire.
Ce rôle délétère du calcium est confirmé, par analogie d‟une part avec les observations effectuées dans l‟hypervitaminose D où des lésions de médiacalcose coronaire et de calcification myocardique ont été décrites et, d‟autre part, chez les patients dialysés pour une insuffisance rénale chronique où l‟on observe une plus grande fréquence de calcifications métastatiques cardiaques.
2.1.2. Anomalies électrophysiologiques
La dépolarisation de la cellule myocardique et la contraction cardiaque sont le résultat de mouvements ioniques où le calcium ionisé joue un rôle de premier plan.
La première phase de dépolarisation de la membrane cellulaire est due à l‟entrée rapide de sodium dans la cellule, la repolarisation rapide correspond à la sortie de potassium de la cellule. Enfin, l‟ouverture des canaux calciques voltage dépendants permet d‟une part l‟entrée de calcium ionisé dans la
cellule et d‟autre part la libération des stocks de calcium intracellulaire. Ce calcium libre intracytoplasmique va se fixer à la troponine C et entraîner l‟interaction actine-myosine et la contraction myocardique. La relaxation des myocytes intervient lorsque la pompe ATPase réintègre le calcium dans le réticulum sarcoplasmique et le fait sortir de la cellule grâce à l‟échange avec des ions Na+. La diminution du Ca++ intracellulaire permet la libération de troponine C, l‟arrêt de l‟interaction actine-myosine et la relaxation des myocytes.
L‟hypercalcémie, en augmentant le gradient entre l‟extérieur et l‟intérieur de la cellule, accélère l‟entrée du calcium lors de l‟ouverture des canaux calciques raccourcissant, de ce fait la phase de repolarisation (Fig.7).
La traduction électrocardiographique en est un raccourcissement du segment ST, évalué en pratique par la mesure de l‟intervalle QT.
2.1.3. Aspects cliniques
En raison des données citées plus haut, des anomalies cardiovasculaires variables sont observées en cas d‟hyperparathyroïdie. L‟hypercalcémie et l‟élévation du taux de parathormone sont, bien entendu, les facteurs présumés de ces anomalies.
a- Hypertension artérielle
La prévalence de l‟hypertension artérielle au cours de l‟hyperparathyroïdie varie de 20 à 70% [23-26].
Les mécanismes de l‟hypertension artérielle ne sont pas tous compris, même si les principaux facteurs semblent être liés à l‟hypercalcémie. L‟hypertension artérielle pourrait, en effet, être liée à une augmentation de la concentration extracellulaire de calcium, avec potentialisation de l‟action des substances vasopressives comme la rénine et les catécholamines. Après parathyroïdectomie, on constate que la baisse de la pression artérielle est corrélée à la baisse de la calcémie [25, 27].
Toutefois, des études à long terme des patients hypertendus opérés, n‟ont pas montré la disparition de l‟hypertension artérielle après parathyroïdectomie et normalisation de la calcémie [12, 28, 29].
b- Hypertrophie ventriculaire gauche
Une hypertrophie ventriculaire gauche est fréquente. Elle est d‟autant plus fréquente qu‟il existe des manifestations cliniques d‟hyperparathyroïdie, elles-mêmes corrélées au taux de parathormone. Son incidence varie de 50 à 80% [15, 16].
Au même titre que l‟hypertension artérielle, des études ont montré une régression partielle de l‟hypertrophie ventriculaire gauche après parathyroïdectomie [25, 30].
c- Calcifications cardiaques [12, 15, 16]
Des études échographiques ont également rapporté la fréquence des calcifications valvulaires et myocardiques dans l‟hyperparathyroïdie notamment primitive. Leur traduction fonctionnelle est variable et plusieurs facteurs participent à la précipitation de ces lésions calcifiantes incluant l‟hypertension artérielle, mais également les perturbations du métabolisme phosphocalcique. Ce dernier paramètre semble, en fait, prédominant concourant au développement de valvulopathies calcifiantes de siège aortique et/ou mitral. Après parathyroïdectomie, ces calcifications persistent sans signes d‟évolution [30].
Il a également été mis en évidence, des dépôts calciques au niveau des artères coronaires. Les dépôts pourraient produire ou être associées à des sténoses coronaires significatives, faisant de l‟hypercalcémie chronique un facteur de risque coronaire à part entière [31]. De même, l‟effet vasoconstricteur de l‟hypercalcémie sur le muscle lisse des vaisseaux artériels pourrait expliquer les manifestations d‟ischémie myocardique avec spasme des artères coronaires, parfois rapportées au cours des hyperparathyroïdies [31].
2.1.4. Anomalies électrocardiographiques
Elles sont, le plus souvent, la traduction de l‟hypercalcémie chronique. De façon schématique, l‟hypercalcémie se traduit par le raccourcissement de l‟espace QT, réversible après parathyroïdectomie, et d‟un aplatissement des ondes T.
Dans les formes sévères, peuvent survenir des troubles de rythme à l‟étage ventriculaire, ainsi que des troubles de conduction dont les blocs sino-auriculaires et auriculo-ventriculaires.
2.2. Manifestations rénales
Les conséquences rénales de l‟hyperparathyroïdie sont variables. Les formes graves demeurent, toutefois, exceptionnelles.
2.2.1. Le syndrome polyuropolydipsique [17, 23]
Il s‟agit d‟une situation rare, en rapport avec un diabète insipide néphrogénique. De même, du fait de l‟activation du récepteur calcique rénal, l‟hypercalcémie est susceptible d‟entraîner des modifications de la réabsorption du sodium et de l‟eau. Il existe, en effet, une inhibition de l‟activité de la pompe Na+-K+- ATPase dans le tube proximal avec diminution de la réabsorption de Na+. Au niveau de la branche ascendante de l‟anse de Henlé, on assiste à une inhibition du cotransport Na+-K+ avec là aussi, une diminution de réabsorption de Na+, mais aussi de Ca++ et de Mg++.
L‟ensemble de ces modifications concourent à l‟apparition d‟une polyurie.
2.2.2. Déshydratation et alcalose métabolique [15-17]
L‟hypercalcémie induit une acidurie par augmentation de la réabsorption tubulaire des bicarbonates et de l‟excrétion d‟acides qui, avec la contraction
des volumes extracellulaires, sont responsables de l‟alcalose métabolique souvent associée à l‟hypercalcémie.
2.2.2. Lithiase rénale
L‟atteinte rénale avec lithiase n‟est actuellement observée que dans 15 à 20% des hyperparathyroïdies, alors qu‟elle était retrouvée dans plus de 50%, il y a une quarantaine d‟années [13-15, 32, 33].
Il reste, néanmoins, conseillé de rechercher les calculs, de nature oxalocalcique et/ou phosphocalcique. Le principal facteur de risque de lithiase est représenté par l‟hypercalciurie observée chez 40 à 50% des sujets atteints d‟hyperparathyroïdie, celle-ci, est en fait, la conséquence de l‟augmentation de la charge filtrée de calcium qui dépasse les capacités de réabsorption par le tubule rénal.
2.2.4. Insuffisance rénale
Au cours de l‟hyperparathyroïdie primitive, l‟origine de l‟insuffisance rénale est multifactorielle.
Elle peut être d‟origine fonctionnelle, en rapport avec l‟hypovolémie et la déshydratation ou organique par dépôts intratubulaires de calcium et néphropathie interstitielle.
2.3. Atteintes osseuses
Les manifestations osseuses reflètent l‟action de la parathormone sur les os. Les atteintes osseuses de l‟hyperparathyroïdie, antérieurement mises en évidence par des radiographies, ont pratiquement disparu. Il s‟agissait de formes associant une ostéite fibrokystique, une résorption sous-périostée et des tumeurs brunes. Celles-ci représentaient plus de 20% des manifestations cliniques de l‟hyperparathyroïdie [21, 24].
Actuellement, la présentation osseuse de l‟hyperparathyroïdie est dominée par de l‟ostéoporose, compliquée ou non de fractures. Le diagnostic repose essentiellement sur la mesure de la densité minérale osseuse (DMO) par ostéodensitométrie à rayons X [34].Il semble que l‟ostéoporose soit plus marquée en cas d‟hyperparathyroïdie secondaire et tertiaire [15, 35].
Il est à souligner, enfin, que plusieurs études ont mis l‟accent sur l‟existence d‟un gain de DMO après parathyroïdectomie [34-36].
2.4. Manifestations musculaires et neuropsychiatriques
Les troubles musculaires regroupent une faiblesse, une fatigabilité et une atrophie musculaire prédominant au niveau des ceintures. Dans les cas extrêmes, un syndrome pseudomyopathique « rhabdomyolyse hypercalcémique » pourrait être observé avec troubles de la marche, amyotrophie, fasciculations, hyperréflexie ostéo-tendineuse et élévation des enzymes musculaires. [12-16]
Ces anomalies musculaires sont susceptibles d‟induire une modification de la pharmacologie des myorelaxants, avec notamment une diminution de la sensibilité aux curares dépolarisants [13, 24].
Sur le plan neuropsychiatrique, on observe fréquemment, outre l‟asthénie, des céphalées, un syndrome dépressif, des troubles de la concentration et de la mémoire, une agitation, un syndrome confusionnel pouvant conduire au coma.
L‟ensemble des manifestations neuropsychiatriques évolue souvent favorablement après parathyroïdectomie [25, 37, 38].
2.5. Manifestations digestives
Elles associent, à des degrés divers :
douleurs abdominales non spécifiques ; nausées et vomissements ;
anorexie ; constipation.
Une hypergastrinémie avec augmentation de la sécrétion acide gastrique est responsable d‟une fréquence accrue d‟ulcères gastro-duodénaux.
La pancréatite représente, enfin, une complication classique de l‟hyperparathyroïdie. Elle peut s‟observer dans plus de 20% des cas, en particulier chez les patients porteurs d‟hyperparathyroïdie primitive [12, 17].
3. Indications chirurgicales
Dans le cadre des hyperparathyroïdies, l‟intervention chirurgicale vise l‟exérèse d‟un adénome parathyroïdien ou la réalisation d‟une parathyroïdectomie subtotale en cas d‟hyperplasie des quatre glandes.
Dans le cas particulier de l‟hyperparathyroïdie primitive, la chirurgie est requise pour environ 60-70% des patients [18].
A ce propos, il est à souligner que les indications chirurgicales de l‟hyperparathyroïdie primitive ont été redéfinies par le National Institute of Health (NIH) en 2002 [39].
Ces critères sont, actuellement, à la base de la décision thérapeutique des hyperparathyroïdies primitives. Ils regroupent les éléments suivants :
Tout patient âgé de moins de 50 ans ;
Calcémie supérieure aux normes de ≥ 1mg/dl ; Calciurie ≥ 400 mg/24 heures ;
Altération de la fonction rénale (diminution de la clairance de la créatinine de plus de 30%) ;
Lithiase rénale ou néphrocalcinose ; Ostéopénie sévère ;
Episode antérieur d‟hypercalcémie aiguë ; Suivi aléatoire ;
Le patient souhaite l‟opération.
Il est à noter, toute fois, qu‟il existe actuellement, une tendance à élargir les indications opératoires « restrictives » sus-citées [40].
Les arguments avancés sont les suivants :
L‟hyperparathyroïdie totalement asymptomatique est rare : plusieurs études ont, en effet, bien démontré que la plupart des sujets chez qui une hyperparathyroïdie primitive a été découverte fortuitement, ont malgré tout un certain nombre de symptômes aspécifiques, ne faisant pas partie des critères du consensus (asthénie, douleurs osseuses, problèmes psychologiques ou socioprofessionnels, troubles digestifs…) [18, 36, 41]. Ces symptômes sont, par ailleurs améliorés après correction chirurgicale. [41]
Environ, 25 % des patients non opérés et suivis pendant 10 ans ont acquis un ou plusieurs des critères opératoires du consensus [36, 42].
La réduction de la morbidité et de la mortalité liées aux interventions parathyroïdiennes, grâce aux avancées anesthésiologiques et chirurgicales. Les approches mini-invasives permettant même, dans certains cas, une intervention ciblée sous anesthésie locale [43, 44].
Il faut préciser, enfin, que dans ce contexte, il n‟y a pas d‟alternative bien établie à la chirurgie ; ce en raison des limites et aux contraintes liées au traitement médical [45, 46].
En raison des données citées plus haut, il se profile une tendance à la correction chirurgicale systématique de toute hyperparathyroïdie primitive [36, 47].
En ce qui concerne l‟hyperparathyroïdie secondaire, il importe de rappeler qu‟elle résulte essentiellement de l‟hyperphosphorémie et de l‟hypocalcémie liées à l‟insuffisance rénale. Le traitement demeurera essentiellement médical.
Au stade initial de l‟insuffisance rénale, une restriction en phosphore et des apports suffisants en calcium permettent de contrôler la sécrétion de la parathormone. Quand celle-ci est élevée (> 10 fois la normale) avec hypercalcémie persistante, la parathyroïdectomie s‟avérera nécessaire [48, 49].
Enfin, au même titre que l‟hyperparathyroïdie secondaire, l‟hyperparathyroïdie tertiaire après transplantation rénale relève
essentiellement d‟un traitement médical [48, 50]. La chirurgie est réservée aux formes symptomatiques ou d‟hypercalcémie asymptomatique dépassant 3,13 mmol/l et persistant au-delà d‟une année après la transplantatation [48, 51].
III. ANESTHÉSIE POUR CHIRURGIE DES GLANDES
PARATHYROÏDES
La chirurgie pour hyperparathyroïdie repose sur l‟exérèse d‟un adénome parathyroïdien ou sur la réalisation d‟une parathyroïdectomie. Elle peut être émaillée par la survenue, en périopératoire, de complications variables.
Dans ce qui va suivre, nous allons décrire les principes de prise en charge anesthésique aux différentes temps opératoires.
1. Période préopératoire
Évaluation préopératoire
Au delà des considérations préanesthésiques systématiques habituelles, l‟évaluation préopératoire a pour but d‟apprécier les manifestations cliniques et biologiques de l‟hyperparathyroïdie (Cf. Conséquences physiopathologiques).
Elle va axer particulièrement sur la pathologie cardiovasculaire, le degré d‟hypercalcémie et les manifestations neuropsychiatriques associées à l‟hyperparathyroïdie. Ajoutons à cela les impératifs de la prise en charge préopératoire du patient insuffisant rénal dans le cadre de l‟hyperparathyroïdie secondaire et du patient sous immunosuppresseur dans le cadre de l‟hyperparathyroïdie tertiaire.
Appareil cardiovasculaire :
Les conséquences cardiovasculaires de l‟hyperparathyroïdie sont, sans nul doute, les plus préoccupantes en périopératoire. Elles sont la conséquence de l‟hypercalcémie et de l‟élévation du taux de parathormone.
Elles regroupent, par ailleurs, des aspects variables : hypertension artérielle, hypertrophie ventriculaire gauche, dépôts calciques intra myocardiques, annulaires ou valvulaires, ainsi que les manifestations électrocardiographiques, le plus souvent liées à l‟hypercalcémie (aplatissement de l‟onde T, raccourcissement de l‟espace QT, troubles du rythme à l‟étage ventriculaire et supraventriculaire….) [23, 25].
Il faut, parailleurs, préciser que l‟impact de la pathologie cardiovasculaire sur le risque opératoire varie en fonction du type de l„hyperparathyroïdie. En effet, dans le cadre de l‟hyperparathyroïdie primitive, seule l‟hypertension artérielle est fréquemment retrouvée. Le reste des manifestations ne se rencontre que dans les formes anciennes et évoluées. Par conséquent, le retentissement de cette pathologie cardiovasculaire sur le risque opératoire semble modéré ; la mortalité de la parathyroïdectomie est minime et la morbidité postopératoire reste faible même lorsque la population est âgée [23, 25, 52, 53].
Dans le cadre de l‟hyperparathyroïdie secondaire, les complications cardiovasculaires sont au premier plan. Celles-ci représentent la première cause de mortalité chez l‟insuffisant rénal chronique, en dehors de tout contexte anesthésique [25,54-56]. L‟évaluation cardiovasculaire est primordiale dans ce contexte. En plus de l‟examen clinique, elle reposera sur l‟électrocardiographie et l‟échodoppler cardiaque et sur l‟évaluation, si besoin, de la circulation coronaire.
Pathologie neuropsychiatrique
En plus des conséquences neuropsychiatriques propres de l‟hypercalcémie majeure (trouble de conscience, épilepsie, coma…), on retrouve, surtout chez les personnes âgées avec hyperparathyroïdie primitive, des neuropathies périphériques et des manifestations psychiatriques de mécanisme inconnu. Les patients sont souvent grabataires et présentant une altération majeure de l‟état général. Il importe, toutefois, de préciser que leur état ne constitue en aucun cas un obstacle à la prise en charge anesthésique. La chirurgie parathyroïdienne étant même susceptible d‟entraîner une amélioration franche du statut neuropsychiatrique [25, 37, 38].
Bilan biologique
Il va être axé essentiellement sur l‟évaluation de la calcémie et de la phosphorémie. Tout patient candidat, à une chirurgie de l‟hyperparathyroïdie, devant bénéficier d‟un bilan phosphocalcique récent, datant de moins de trois semaines. Ce bilan servira de référence pour juger de l‟évolution de la calcémie en postopératoire et de la nécessité d‟une éventuelle préparation préopératoire.
Ce qui nous amène à étudier la préparation pour chirurgie des parathyroïdes.
Préparation à l’intervention
La préparation à l‟intervention s‟articule essentiellement autour de la correction de la calcémie dans le cadre de la crise hyperparathyroïdienne. Il s‟agit d‟un mode de présentation aiguë de l‟hyperparathyroïdie primitive, liée à une hypercalcémie sévère mettant en jeu le pronostic vital.
L‟hypercalcémie sévère étant définie par : - une calcémie supérieure à 3,5 mmol/l ;
- ou une calcémie supérieure à 3mmol/l avec manifestations associées notamment cardiovasculaires.
Devant de telles situations, la correction préopératoire de l‟hypercalcémie s‟impose, reposant sur la réhydratation, l‟excrétion urinaire du calcium et la diminution de la résorption osseuse [13, 25].
a- Réhydratation
La réhydratation est une mesure générale à prendre devant toutes les hypercalcémies. Elle permet de diluer l‟hypercalcémie et de restaurer la volémie et la filtration glomérulaire du calcium.
Les volumes administrés seront fonction du niveau de la calcémie, de l‟importance de la déshydratation mais aussi de l‟âge et de la tolérance cardiaque. Ils sont habituellement compris entre 2,5 et 4,5 l/24h. [13, 57]
b- Augmentation de l’excrétion urinaire du calcium
En plus de la réhydratation, l‟augmentation de l‟excrétion urinaire du calcium repose sur l‟utilisation des diurétiques de l‟anse. Ces derniers provoquent une augmentation de la calciurie en inhibant la réabsorption du calcium (de même que celle du sodium) au niveau du tube proximal et de l‟anse de Henlé. Les doses quotidiennes utilisées de Furosémide varient de 250 mg à 1g [13, 25, 58].
Ces posologies élevées peuvent être à l‟origine d‟une déshydratation et de troubles électrolytiques. Ce qui impose une compensation hydro électrolytique efficace, adaptée aux données des ionogrammes sanguins et
c- Inhibition de la résorption osseuse
Les inhibiteurs de la résorption osseuse sont regroupés essentiellement en trois familles : les biphosphonates, la calcitonine et la plicamycine.
Biphosphonates :
Ce sont des analogues des pyrophosphates, inhibiteurs naturels de la calcification que l‟on retrouve dans le plasma et dans les urines.
Les biphosphonates ont une grande affinité pour l‟hydroxyapatite osseuse et sont de plus résistants à l‟action des phosphatases. Ils vont dès lors se fixer dans l‟os sur l‟hydroxyapatite et agir sur les ostéoclastes en inhibant leurs fonctions et en diminuant leur viabilité [13].
Dans le cadre des hyperparathyroïdies, les biphosphonates de dernière génération ont prouvé leur efficacité dans le traitement de l‟hypercalcémie.
Celle-ci est corrigée, le plus souvent, en 1 à 8 jours pour une durée de 2 à 4 semaines [36, 59].
L‟absorption digestive de ces molécules est en général très faible avec moins de 1% de biodisponibilité per os, incitant à leur utilisation par voie intraveineuse [13].
Les principales molécules appartenant à cette classe, sont représentées par :
L‟étidronate (Didronel*) [13]
Il fait partie de la première génération des biphosphonates et possède une faible activité d‟inhibition de la résorption osseuse. Son délai d‟action est de 48 heures en moyenne et plusieurs injections de 7,5 mg/kg sont nécessaires afin de faire diminuer la calcémie. Ce produit est actuellement
peu utilisé dans cette indication en raison de la mise au point de produits plus puissants et à efficacité plus prévisible, l‟étidronate n‟étant actif que dans 25 à 30% des cas.
Le clodronate (Clastoban*) et le pamidronate (Aredia*) [13] Ils font partie de la deuxième génération des biphosphonates.
Le clodronate (Clastoban*) a une puissance intermédiaire et est utilisé le plus souvent à la dose de 5mg/kg/j en perfusion intraveineuse de 2 à 5 heures, pendant 3 à 5 jours.
Ceci permet la normalisation de la calcémie chez 80 à 90% des malades, en 7 jours en moyenne.
Le pamidronate (Aredia*) est plus puissant, avec un délai d‟action plus court et une durée d‟action plus prolongée que le clodronate. Une perfusion unique permet le plus souvent une normalisation de la calcémie pour une à deux semaines. La posologie du pamidronate dépend du taux initial de la calcémie : 30 mg pour une calcémie variant de 3 à 3,5 mmol/l, 60 mg pour une calcémie variant de 3,5 à 4 mmol/l et 90 mg pour une calcémie dépassant 4 mmol/l.
Les effets secondaires sont limités à une fièvre le plus souvent inférieure à 39°C, à une leucopénie transitoire et à une hypophosphorémie modérée.
Le zolédronate (Zometa*) [13]
Il fait partie de la troisième génération des biphosphonates. Son effet sur la résorption osseuse serait 850 fois plus puissant in vitro que le pamidronate. Il est utilisé à raison de 4 à 8 mg en injection intraveineuse unique sur cinq minutes.
Les effets secondaires de ce produit sont comparables à ceux des générations précédentes.
Calcitonine [13, 17]
Il s‟agit d‟une hormone polypeptidique sécrétée par les cellules C para folliculaires de la thyroïde, qui inhibe la résorption osseuse et qui augmente l‟excrétion urinaire du calcium. La dose recommandée est de 4 à 8 UI/kg toutes les 6 à 12 heures en intraveineux, en sous cutané ou en intramusculaire.
La calcitonine inhibe très rapidement la résorption osseuse avec une baisse de la calcémie dans les premières heures du traitement. Son effet est toutefois modéré et est limitée par un phénomène de tachyphylaxie.
Plicamycine [13, 17]
La plicamycine, autrefois appelée mithromycine, est à l‟origine un antibiotique possédant la propriété de bloquer la synthèse d‟ARN dans l‟ostéoclaste et d‟inhiber ainsi la résorption osseuse en empêchant la formation d‟ostéoclastes matures. La réduction de l‟hypercalcémie est obtenue rapidement en 24 à 48 heures le plus souvent après une seule perfusion intraveineuse de 15 à 25 μg/kg de calcitonine.
Cependant, en raison des nombreux effets secondaires imputés à son utilisation (hépatites aiguës, thrombocytémie, néphrotoxicité, troubles de la coagulation…), la plicamycine n‟est plus recommandée dans le cadre de la préparation à la chirurgie des hyperparathyroïdies.
d- Epuration extra-rénale [12, 60]
Dans certains cas de figures, où les signes cliniques sont au premier plan et où l‟effet doit être immédiat, notamment chez l‟insuffisant rénal, ou en cas
d‟hyperparathyroïdie à évolution rapide, l‟épuration extra-rénale doit être envisagée. Celle-ci permet également l‟attente de l‟effet des médicaments à délai d‟action lent comme les biphosphonates et permet par ailleurs de contrôler rapidement la calcémie lorsqu‟une indication opératoire urgente est posée.
L‟épuration extra-rénale repose sur l‟hémodialyse ou la dialyse péritonéale. La première hémodialyse représente toutefois la technique la plus efficace puisqu‟elle permet d‟épurer 6g/j de calcium contre moins de 2g/j de calcium pour la dialyse péritonéale.
En ce qui concerne la prise en charge préopératoire des patients de notre série, nous tenons à préciser que l‟essentiel des manifestations relevées d‟hyperparathyroïdie était d‟ordre cardiovasculaire et ostéoarticulaire. Ces signes étaient, par ailleurs, particulièrement notés chez les patients porteurs d‟hyperparathyroïdie secondaire. Ceci s‟expliquerait, en grande partie, par la morbidité cardiovasculaire directement liée à l‟insuffisance rénale chronique.
Quant aux données biologiques, l‟analyse des résultats de notre série montre que la moyenne de la calcémie était normale dans le groupe des patients opérés pour hyperparathyroïdie secondaire. Ceci serait justifié par le fait que la calcémie mesurée dans notre étude n‟a pas été corrigée en fonction des valeurs de l‟albuminémie et/ou de la protidémie.
Précisons enfin que 16 patients (soit 28%) ont bénéficié d‟une préparation préopératoire. Celle-ci était essentiellement à base de réhydratation associée, dans certains cas, aux diurétiques de l‟anse. Aucun patient n‟a bénéficié d‟inhibiteurs de la résorption osseuse.
2. Période peropératoire
Comme dans toute cervicotomie, la chirurgie des parathyroïdes offre un accès limité aux voies aériennes supérieures. L‟intervention est non hémorragique et dure en moyenne 1 à 4 heures en fonction du temps de découverte et d‟identification des parathyroïdes. La technique anesthésique doit être adaptée au terrain, à fortiori quand il s‟agit d‟une hyperparathyroïdie secondaire.
2.1. Installation du patient
La position du malade est le décubitus dorsal, bras le long du corps. Un billot est placé sous les épaules et la tête est mise en extension (Fig.8).
Cette installation offre une meilleure dissection cervicale antérieure et permet d‟éviter dans la plupart des cas la sternotomie.
En cas d‟hyperparathyroïdie secondaire, chez un malade hémodialysé, la fistule artério-veineuse doit être protégée par une gouttière et/ou par l‟interposition d‟un coussin pour éviter toute compression. La perméabilité de cette fistule doit, par ailleurs, être vérifiée de façon régulière.
En présence d‟une atteinte osseuse évoluée, l‟installation du patient et l‟extension du rachis cervical doivent être prudentes pour éviter tout traumatisme osseux notamment vertébral. Une intubation sous fibroscopie serait très indiquée dans ces situations, pour éviter une extension abusive du rachis cervical pendant la laryngoscopie.
L‟extension de la tête doit être également mesurée quand la mobilité du cou est limitée par une atteinte dégénérative des disques intervertébraux. Cette précaution permet de limiter les cervicalgies postérieures postopératoires.
Figure 8 : Installation du patient pour cervicotomie.
2.2. Monitorage peropératoire
Le monitorage peropératoire du patient doit être conforme aux recommandations des sociétés savantes en la matière. Il repose sur la mesure automatisée de la pression artérielle, la capnographie, l‟oxymétrie de pouls et l‟éléctrocardioscope. Ce dernier fera l‟objet d‟une attention particulière étant donné le risque de troubles de rythme notamment lorsque la calcémie est élevée.
Le monitorage de la curarisation est également indispensable dans cette chirurgie compte tenu de l‟interaction existant entre les myorelaxants et l‟hyperparathyroïdie. (Cf. Infra).
2.3. Technique anesthésique

![Figure 3 : Répartition du calcium plasmatique [3].](https://thumb-eu.123doks.com/thumbv2/123doknet/15037550.690680/25.892.179.714.575.902/figure-répartition-calcium-plasmatique.webp)
![Figure 4 : Régulation de la calcémie [4].](https://thumb-eu.123doks.com/thumbv2/123doknet/15037550.690680/26.892.205.688.409.802/figure-régulation-calcémie.webp)
![Figure 5- Répartition journalière du calcium [5].](https://thumb-eu.123doks.com/thumbv2/123doknet/15037550.690680/27.892.239.629.631.949/figure-répartition-journalière-du-calcium.webp)

![Figure 7: Hypercalcémie et potentiel d’action de la cellule myocardique [13].](https://thumb-eu.123doks.com/thumbv2/123doknet/15037550.690680/37.892.216.679.634.956/figure-hypercalcémie-potentiel-action-cellule-myocardique.webp)
