HAL Id: hal-02609992
https://hal.inrae.fr/hal-02609992
Submitted on 16 May 2020HAL is a multi-disciplinary open access
archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Influence des coupes de bois-énergie sur la diversité et la
composition des bryophytes et des plantes vasculaires
A. Miton
To cite this version:
A. Miton. Influence des coupes de bois-énergie sur la diversité et la composition des bryophytes et des plantes vasculaires. Sciences de l’environnement. 2019. �hal-02609992�
1
Influence des coupes de bois-énergie sur la diversité et la composition des
bryophytes et des plantes vasculaires
Arnaud MitonLaboratoire : Irstea, Arboretum national des Barres, 45290 Nogent-sur-Vernisson Encadrants : Marion Gosselin, Yann Dumas
Mots-clés : whole-tree harvest, energy wood harvest, fine woody debris, slash, stumps
Résumé : Dans le contexte d’un intérêt pour le développement des énergies renouvelables, les
modes de récoltes des forêts évoluent, et pose question sur les risques que cela implique sur la biodiversité. La plupart des études à ce sujet portent sur les forêts scandinaves, et assez peu concernent les variations de richesse spécifique de la flore liées à ce mode de récolte. Cette étude porte donc sur l’impact que peut avoir ces types de récoltes de bois-énergie dites « par arbre entier » sur la diversité et la composition des bryophytes et des plantes vasculaires sur différents types de supports (notamment le bois mort). Elle a été menée en forêt d’Orléans et en Sologne. Des modèles GLM ont été réalisés pour analyser la richesse spécifique, ainsi qu’une classification ascendante hiérarchique et une analyse factorielle de correspondance pour la composition floristique. Les résultats indiquent que la richesse spécifique des bryophytes réagit négativement à la coupe, mais avec une magnitude faible. La richesse spécifique des plantes vasculaires a tendance à augmenter, sans que l’on ne puisse conclure sur la magnitude. La coupe entraine un changement de composition floristique assez important, sans modifier fortement les groupes écologiques auxquelles elle appartient.
2
Abstract : The need for developping renewable energies is changing the way forest
management is led, and raise concerns about preserving biodiversity. Most studies on this subject involve scandinavian forests, and few of them concern flora species richness variations linked to this type of harvest. This study is about the impact of biofuel « whole-tree » harvest on bryophytes and vascular plants, on different substrates (especially deadwood) diversity and composition. It was led in Orléans’ forest and in Sologne. GLM models were used to analyse species richness, and an ascending hierarchical classification with a correspondance factor analysis for flora composition. Results indicate that bryophytes species richness reacts negatively to the harvest, but with a low magnitude. Vascular plants species richness tend to increase, without certainty. Forest management results in an important change in flora composition, without strongly modifying the ecological group it belongs to.
Introduction
Les choix des politiques récentes dans le but de réduire l’impact des énergies fossiles et atténuer les changements climatiques poussent au développement des énergies renouvelables, dont fait partie la biomasse ligneuse issue des forêts. Mais cette augmentation de la demande en bois-énergie pose question sur l’impact de l’intensification des nouveaux modes de récolte sur les écosystèmes forestiers. Ces modes de récoltes consistent à prélever la biomasse non valorisée des coupes de bois traditionnelles, c’est-à-dire principalement les menus bois et les souches habituellement laissés sur la parcelle. La récolte des menus bois est réalisée soit après une coupe « classique », soit au moment même de la coupe lors d’une récolte dite « par arbre entier ». La récolte des souches, elle, se fait par prélèvement après la coupe. Des questions sont alors posées quant à la durabilité de ces modes de récolte accompagnés de l’intensification du nombre de récoltes à l’échelle du paysage. En effet, en exploitant les menus bois et les souches, ces nouveaux types de récoltes sont susceptibles, par rapport aux méthodes conventionnelles, de modifier d’une part le profil de bois mort, dont on sait qu’il constitue un habitat crucial pour la biodiversité forestière; d’autre part la fertilité des sols, qui interagit avec la biodiversité dans et sur le sol. De plus, plusieurs paramètres sont susceptibles de faire varier l’abondance, la diversité spécifique ainsi que la composition des communautés saproxyliques, tels que le volume et le type de bois mort, et le microclimat, et ces paramètres varient en fonction du type, de la fréquence et de l’intensité de l’exploitation.
3
Le bois mort, qu’il soit au sol (arbres tombés, souches, menus bois), ou debout (chandelle, arbre
mort sur pied) est un support pour de nombreux taxons : une espèce sur quatre est saproxylique. Le bois mort de feuillu héberge une plus grande diversité que le bois mort de résineux, et la diversité des espèces saproxyliques dépend de la diversité spécifique des espèces ligneuses et de l’état de décomposition de leur bois mort.
Dans les études les plus récentes, on relève qu’une augmentation de la quantité moyenne de bois mort induit une augmentation de la diversité spécifique de plusieurs taxa (forêt tempérée : Doerfler et al. (2018) ; forêt boréale : Jokela et al. (2018)). De plus sachant que le bois mort est en général un facteur limitant en forêt gérée, une augmentation légère de sa quantité et de sa diversité induit une hausse significative des espèces associées (Jokela et al. 2018). Toutefois, Hofmeister et al. (2015) concluent qu’en forêt tempérée, un volume total important de bois mort ne résultait pas nécessairement en une grande diversité d’espèces cryptogames, mais qu’une variété des types de bois mort (tailles, positions, essences, stades de décomposition) serait nécessaire pour maintenir cette biodiversité. Pour finir, la diversité et le volume de bois mort sont des variables expliquant bien la richesse spécifique à l’échelle du peuplement d’une forêt boréale (Jokela et al. 2018).
Plusieurs études récentes montrent l’influence de l’ensoleillement sur le bois mort comme un facteur important sur la biodiversité, notamment en modifiant des conditions du milieu, parfois plus sec après exploitation (carabes : Zolotarjova et al. (2016) ; plantes vasculaires : Jokela et al. (2018) ; bryophytes : Haughian (2018) ; hépatiques : Tullus et al. (2018)).
Dans l’expertise collective Resobio (Landmann and Nivet. 2014), il est décrit qu’à l’échelle de la parcelle et à court terme, la récolte de rémanents diminuerait le volume de menus bois et de gros bois mort. Elle réduirait de ce fait le volume moyen et la diversité du bois mort à l’échelle du paysage. Ce phénomène serait accentué par la mise en exploitation de forêts jusqu’alors non exploitées, mais que le marché du bois-énergie permettrait d’exploiter. A long terme, cela se traduirait par une forte diminution du volume de très gros bois mort. De même, le rajeunissement de certains peuplements diminuerait la quantité de bois en décomposition avancée. Finalement, maintenir le volume de bois mort présent avant coupe ne garantirait pas le maintien à long terme (après plusieurs coupes successives) d’un volume et d’une diversité de bois mort suffisants, car le stock pré-existant se décomposerait ou serait fragmenté par le passage d’engins ou le débardage des troncs et ne serait pas renouvelé par apport de gros bois mort « frais » au moment de la coupe si les rémanents ou menus-bois sont exportés. La synthèse
4 Resobio concluait également sur le fait que les menus bois pouvaient contenir de nombreux habitats pour un large nombre d’espèces et que les communautés présentes sur les menus bois différaient de celles sur les gros bois morts.
La synthèse Resobio montrait qu’il pouvait y avoir un impact de la diminution des quantités de bois mort à l’échelle de la parcelle, mais que cela ne résultait pas forcément en une diminution de la richesse spécifique des espèces saproxyliques. Cependant, à l’échelle du paysage, des effets négatifs sur les assemblages saproxyliques ont été relevés, notamment causés par une fragmentation et une perte des habitats de manière générale (Lassauce et al. 2011).
Selon Ranius et al. (2018), en forêt boréale et à l’échelle du peuplement, les risques de perte de diversité et d’extinction lié aux dynamiques de la forêt et à l’abondance des populations peuvent être très variables, mais quelques taxons apparaissent comme étant sensibles à l’intensification des récoltes et à l’extraction des rémanents de manière générale, notamment les espèces saproxyliques des gros bois morts ensoleillés, les espèces généralistes rares, et les espèces spécialistes.
En ce qui concerne les effets à long terme, le manque de recul ne permet pas d’avoir des données empiriques, mais des simulations (Hof et al. (2018) ; Johansson et al. (2016)) ont été effectuées afin d’estimer la disponibilité en bois mort (profil et quantité) à long terme et à l’échelle du paysage en réponse à ces nouvelles pratiques.
Nous nous plaçons ici dans un contexte de forêt tempérée. Nous avons analysé les effets à court terme de la coupe de bois énergie par arbre entier sur la biodiversité des bryophytes corticoles (qui exploitent une diversité de supports ligneux susceptibles d’être affectés par les nouveaux modes de coupes), terricoles et des plantes vasculaires (qui sont susceptibles d’être affectées à court terme par un apport de lumière, et à long terme par une modification de la fertilité du sol) dans deux types de peuplements en région Centre. L’analyse procède par comparaison de la diversité des espèces avant et après coupe.
Les hypothèses ont été formulées sur la base de l’étude de la richesse spécifique et de l’analyse de la composition d’espèces.
Hypothèses :
H1 : La richesse spécifique des bryophytes corticoles et terricoles baisse (lié à la diminution des supports disponibles pour les corticoles et à des conditions trop sèches pour les terricoles)
5 sur l’ensemble des parcelles après une coupe bois énergie, alors que les plantes vasculaires sont favorisées par la mise en lumière provoquée par la coupe.
H2 : La richesse en espèces de bryophytes saprolignicoles diminue après coupe (par diminution des volumes de gros bois mort potentiellement récoltés ou fragmentés lors de la coupe). H3 : Le passage en coupe modifie la composition en espèces sur une même parcelle, ou sur un même type de support, avec notamment plus d’espèces héliophiles, et moins de bryophytes saprolignicoles et de milieux humides.
Matériels et méthodes :
Zone d’étude :
La zone étudiée comprend d’une part des forêts de Sologne privées de l’Indre-et-Loir et du Loir-et-Cher (placettes Beaumont9A, StViatreA et VernouA), et d’autre part en forêt domaniale d’Orléans dans le Loiret, à proximité de Courcy-aux-Loges, Sully-la-Chapelle et Chilleurs-aux-Bois (placettes CourcyA, ChilleursA et SullyA).
Les peuplements de type A (forêts privées) sont constitués de réserves peu denses de chênes et de pins avec un sous étage de trembles, châtaigniers et bouleaux. Les coupes pratiquées dans ces peuplements sont des coupes de taillis, avec maintien de réserves peu denses. Les peuplements de type B (forêt d’Orléans) sont des futaies régulières de chêne avec sous étage de charme, dans lesquelles on procède à une coupe de relevé de couvert (c’est-à-dire une coupe du taillis de charme pour mettre les chênes en lumière et préparer leur régénération).
Echantillonnage :
Nous analysons l’effet du passage en coupe (avant (AV) et après (AP)) des deux types de peuplements A et B, soit 4 modalités : « AV en peuplement A », « AP en peuplement A », « AV en peuplement B » et « AP en peuplement B ».
Pour chaque modalité, nous avons 3 répétitions, à savoir 3 chantiers en peuplement de type A et 3 chantiers en peuplement de type B, avec une placette d’échantillonnage par chantier de coupe et un passage avant et après coupe sur chaque chantier (sauf pour un chantier, non terminé, où il n’y a pas eu d’échantillonnage après la coupe). Il y a donc 6 passages avant + 5 passages après coupe = 11 relevés.
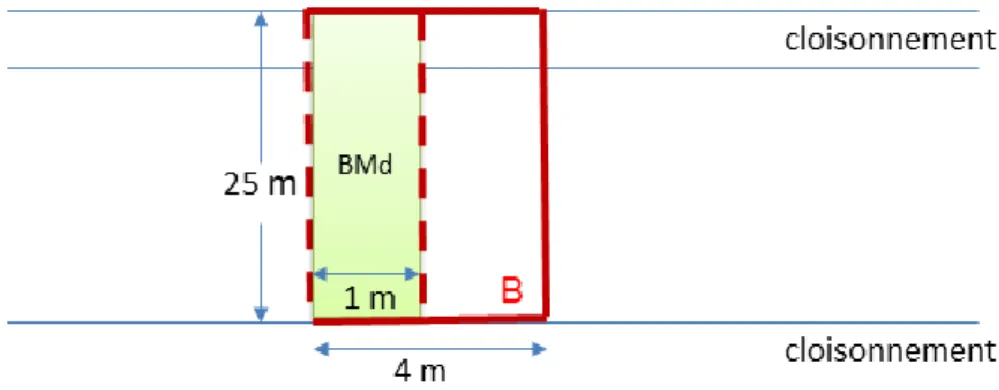
6 Figure 1 : Délimitation des placettes
Les données de biodiversité floristique et bryologique, et les données du profil de bois mort au sol, avant et après chantier d’exploitation ont été collectées en délimitant une placette de 100m² au total, intégrant si possible un cloisonnement (certains chantiers étaient dépourvus de cloisonnements). Plusieurs sous-placettes sont ensuite délimitées :
Une sous-placette B de 100m², sur laquelle on fait l’inventaire systématique :
- Des espèces de bryophytes présentes par catégorie de support, pour les supports suivants :
BMS (bois mort au sol) < 4cm BMS 4 à 7cm
BMS 7 à 22,5cm BMS >22,5cm
Base des troncs d’arbres vivants (jusqu’à 2 m) Base des chandelles (jusqu’à 2 m)
Souches Sol
- Des espèces de plantes vasculaires et bryophytes au sol
Une sous-placette BMd sur laquelle on réalise des mesures dendrométriques de tous les bois morts au sol >4 cm de diamètre (circonférence, longueur, recouvrement d’écorce, stade de
7 décomposition) et un inventaire des bryophytes présentes sur chacune de ces pièces de bois mort. L’objectif est de faire le lien entre le profil de bois mort au sol et le cortège d’espèces de bryophytes, d’une part, et d’évaluer l’effet du passage en coupe sur le profil de bois mort au sol, d’autre part.
L’identification des différentes espèces de bryophytes et de plantes vasculaires a été effectuée soit sur place, soit au laboratoire après collecte d’échantillons, à l’aide de clés d’identification : Smith (2004), Paton (1999), Malcolm (2006), Atherton et al. (2010).
Pour une analyse plus fine permettant d’évaluer les modifications en composition, les bryophytes ont été catégorisées dans plusieurs groupes écologiques (épiphytes, terricoles, saprolignicoles, espèces de substrats humides, héliophiles, forestières) grâce à des bases de données (Hill et al. (2007) pour les forêts britanniques et Schmidt et al. (2013) pour les forêts allemandes). Finalement, la base de données de Schmidt a été choisie car les forêts allemandes et françaises sont des forêts continentales se situant aux mêmes latitudes, et ont un passé de gestion forestière similaire.
Statistiques :
Effet de la coupe et du type de peuplement sur la richesse spécifique :
Pour modéliser l’influence de la coupe sur la richesse spécifique moyenne, des modèles GLM (generalised linear model) avec une fonction de lien (log) ont été utilisés. On n’utilise pas de modèles linéaires simples car les données de richesse sont des données de comptage qui ne suivent pas une distribution normale. La distribution des données a été considérée comme suivant une loi généralisée de Comwell-poisson, grâce au package TMB du logiciel R, version 1.1.456. Les modèles sont réalisés par combinaison linéaire des variables explicatives, et c’est le log de la moyenne de la richesse spécifique considérée que l’on obtient.
La richesse spécifique (RS) totale, par groupe écologique et par type de support a été modélisée en fonction de plusieurs variables explicatives : le passage de la coupe (AV/AP), et le type de peuplement (A/B) (Tableau des modèles en annexe). 3 types de modèles ont donc été construits pour ces variables à expliquer :
- Modèle 1 : l’effet de la coupe (AV/AP) sur la RS
- Modèle 2 : l’effet de la coupe (AV/AP) et l’effet additionnel de la covariable « type de peuplement (A/B) » sur la RS
8 - Modèle 3 : l’interaction des deux variables explicatives (effet coupe/effet peuplement)
sur la RS
Dans chacun des cas, ces modèles ont été comparés via le critère AIC : celui avec l’AIC le plus bas a été retenu.
La significativité a été notée ainsi : - . : p<0.1
- * : p<0.05 - ** : p<0.01 - *** : p<0.001 - NS : non significatif
Une analyse de magnitude a également été réalisée pour les effets de chacune des variables explicatives de ces modèles, avec un seuil de négligeabilité établi à 10%. Elle a été notée ainsi : - - : Effet négatif et fort (perte de RS supérieure à 10 %, dans plus de 90% des cas simulés, quand on simule une modification de la variable explicative, à savoir : passage de AV à AP pour la variable « passage en coupe » et passage de A à B pour la variable « type de peuplement »
- + : Effet positif et fort (gain de RS de plus de 10 %, dans plus de 90% des cas simulés, quand on simule une modification de la variable explicative)
- 0 : effet négligeable (perte ou gain de RS inférieur à 10 %, dans plus de 90% des cas simulés, quand on simule une modification de la variable explicative)
- NC : pas de conclusion possible
Lors de l’échantillonnage, il ne restait aucune chandelle après la coupe. Elles n’ont donc pas été analysées en ce qui concerne la richesse spécifique.
Effet de la coupe et des types des peuplements sur la composition des cortèges de bryophytes et de vasculaires :
En plus de l’analyse des RS par groupe écologique d’espèces, qui est une première approche de l’analyse en composition, une classification ascendante hiérarchique (avec la fonction « decostand » du package « vegan » du logiciel R version 1.1.456, sous la forme de dendrogrammes) sur la base des distances de Jaccard a été effectuée. L’indice de Jaccard a été calculé en faisant le rapport entre les espèces (en présence/absence) partagées par 2
9 échantillons, et l’ensemble des espèces de ces 2 échantillons. Plus cet indice est grand, plus les 2 échantillons sont similaires.
Une analyse factorielle des correspondances (avec la fonction « dudi.coa » du package « ade4 » du logiciel R version 1.1.456) a également été réalisée afin de mettre en valeur les éventuels liens entre les espèces et les relevés, et les proximités de composition entre relevés.
Il a été décidé que les individus n’ayant été identifiés qu’au niveau du genre et non au niveau de l’espèce soient conservées dans la CAH et l’AFC, pouvant ainsi apparaître comme des espèces différentes des autres espèces du même genre, bien qu’il soit possible qu’elles soient les mêmes espèces.
Résultats :
Rappel de l’hypothèse H1 : La richesse spécifique des bryophytes corticoles et terricoles baisse
(lié à la diminution des supports disponibles pour les corticoles et à des conditions trop sèches pour les terricoles) sur l’ensemble des parcelles après une coupe bois énergie, alors que les plantes vasculaires sont favorisées par la mise en lumière provoquée par la coupe.
Richesse spécifique des bryophytes : a) Effet global
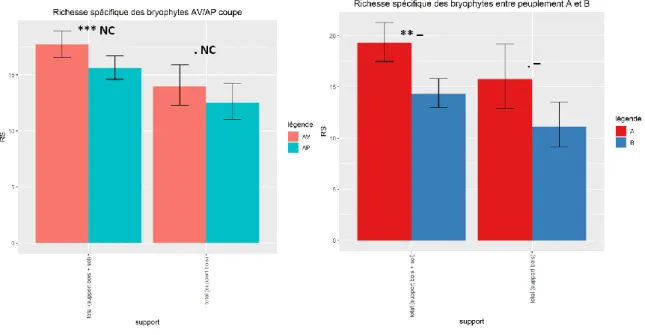
Selon le critère AIC, le meilleur modèle pour expliquer la richesse spécifique totale de bryophytes est le modèle 2 : effet additionnel de la coupe et du type de peuplement (Figure 2). L’effet peuplement est significatif (**) et fort, avec plus de 10 % d’espèces en plus en A qu’en B. En plus de cet effet « type de peuplement », l’effet de la coupe sur l’ensemble des bryophytes (corticoles et terricoles), est hautement significatif (***), quel que soit le peuplement, mais la RS ne varie négativement de 10% ou plus que dans 74% des cas simulés. Cependant, on peut affirmer que la RS baisse d’au moins 5% dans plus de 95 % des cas : effet significatif de magnitude assez faible (perte de 5 % en richesse. Si l’on ne prend en compte que le relevé corticole, on observe la même tendance mais avec moins de significativité (.).
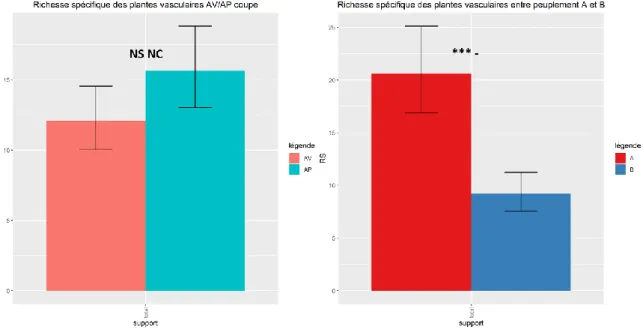
10 Figure 2 : Richesse spécifique moyenne de l’ensemble des bryophytes entre passage avant et après coupe (gauche) et entre les peuplements de type A et B (droite).
b) Effet par type de support
L’analyse des effets par type de support (Figure 3) montre : - un effet négatif de la coupe sur la RS sur
BV, avec une interaction forte avec le type de peuplement (modèle 3) : forte perte en richesse dans les peuplements B (*/-), perte non significative sans conclusion possible sur la magnitude dans les peuplements A. On observe ce même effet de perte forte (-) et significative de RS dans les peuplements B pour l’ensemble des groupes écologiques étudiés (épiphytes, terricoles, saprolignicoles, de milieux humides et héliophiles).
- un effet positif fort de la coupe sur la RS sur souches (**/+), quel que soit le type de peuplement (modèle 1). Cet effet est lié à
Figure 3 : Richesse spécifique moyenne de l’ensemble des bryophytes entre passage avant et après coupe, en fonction du type de support. (AV : avant coupe, AP : après coupe, A : en peuplements de type A, B : en peuplements de type B).
11 un même effet fort (+) de la RS sur
souches des épiphytes (**) et des espèces de milieux humides (.).
- un effet négatif fort de la coupe (**/-, modèle 1) sur les bryophytes présentes au sol.
- un effet positif fort de la coupe (*/+, modèle 3) sur la RS des BMS <4cm dans les peuplements de type B, et non significatif dans les peuplements de type A.
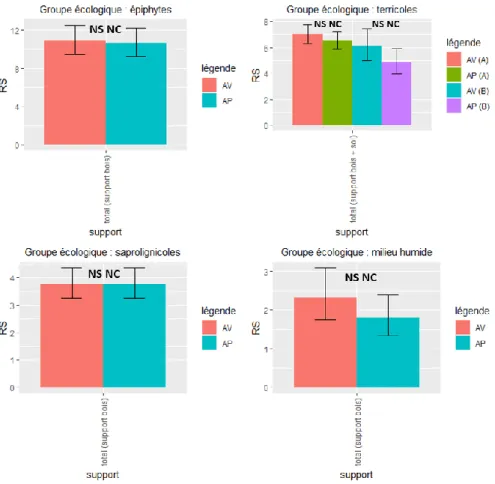
Figure 4 : Richesse spécifique moyenne des bryophytes entre passage avant et après coupe selon le groupe écologique (AV : avant coupe, AP : après coupe, A : peuplements de type A, B : Peuplements de type B).
Figure 5 : Richesse spécifique moyenne des bryophytes héliophiles entre passage avant et après coupe (AV : avant coupe, AP : après coupe, A : peuplements de type A, B : Peuplements de type B).
12 - pas d’effet significatif (modèle 1) de la coupe sur la RS des BMS de 4-7cm, bien que l’analyse de magnitude n’indique pas non plus d’effet négligeable. On ne peut donc pas conclure à l’absence d’effet.
- un effet significatif (***, modèle 3) du passage en coupe sur les BMS de 7-22,5cm négatif et fort (–) dans les peuplements de type A et positif et fort (+) dans les peuplements de type B. Par ailleurs, il n’y avait que très peu de BMS de plus de 22,5cm (une seule pièce présente sur une seule parcelle AV et une seule sur une autre parcelle AP coupe). On ne peut donc pas conclure sur l’effet de la coupe sur la RS présente sur cette catégorie de bois mort.
c) Effet par groupe écologique :
En ce qui concerne les différents groupes écologiques (Figure 4), on n’observe pas de différence significative du passage en coupe pour la richesse en espèces de bryophytes épiphytes, terricoles, saprolignicoles et de substrat humide. Toutefois, on ne peut pas conclure non plus
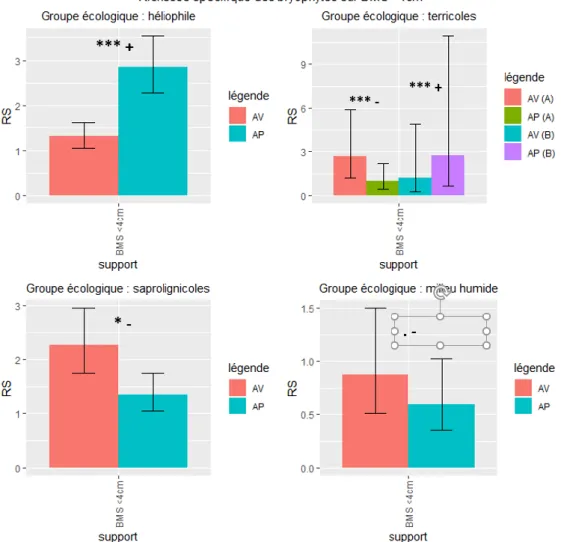
Figure 6 : Richesse spécifique moyenne entre passage avant et après coupe sur les BMS <4 cm en fonction du groupe écologique (AV : avant coupe, AP : après coupe, A : en peuplements de type A, B : en peuplements de type B).
13 qu’il n’y a pas d’effet, car l’analyse de la magnitude n’aboutit pas à un effet systématiquement négligeable.
On observe (Figure 5) une baisse significative et non négligeable (***/-, modèle 3) de la RS des bryophytes héliophiles après coupe en peuplement de type A. En peuplement B on observe une tendance à la hausse de la RS (80% des cas simulés), avec une faible significativité (.).
Sur le BMS <4 cm (Figure 6), la RS des héliophiles augmente (***/+, modèle 2) et la richesse des terricoles (en peuplement de type A, ***/-, modèle 3), saprolignicoles (*/-, modèle 1) et de milieu humide (. /-, modèle 1) diminue après passage de la coupe.
Richesse spécifique des plantes vasculaires :
Le meilleur modèle (modèle 2) indique que l’effet du passage en coupe (Figure 7, gauche) sur la richesse spécifique des plantes vasculaires n’est pas significatif (p value = 0,124), bien qu’il y ait un effet positif fort dans 80% des cas simulés. En addition, on observe une différence significative forte (***/-) entre les peuplements avec plus d’espèces en A qu’en B (Figure 7, droite).
Figure 7 : Richesse spécifique moyenne des plantes vasculaires entre passage avant et après coupe (gauche), et entre peuplements de type A et B (droite)
14
Rappel de l’hypothèse H2 : La richesse en espèces de bryophytes saprolignicoles diminue après
coupe (par diminution des volumes de gros bois mort potentiellement récoltés ou fragmentés lors de la coupe).
Le meilleur modèle (modèle 1) (Figure 9) indique qu’il n’y a pas d’effet significatif de la coupe sur la RS du groupe écologique des saprolignicoles dans leur ensemble.
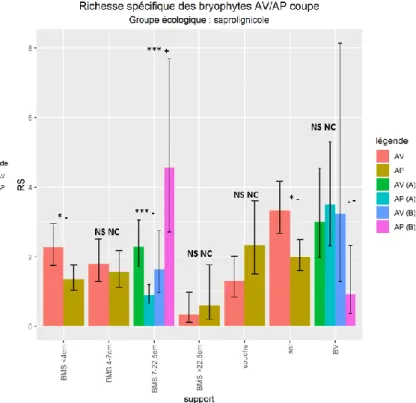
On observe cependant (Figure 8) :
- un effet négatif fort (*/-, modèle 1) sur la RS saprolignicole présente sur BMS <4cm,
- un effet négatif fort dans les peuplements de type A (***/-, modèle 3) et positif fort dans les peuplements de type B (***/+)
- un effet négatif fort (*/-, modèle 1) sur la RS saprolignicole présente au sol,
- un effet négatif fort (./-, modèle 3) sur la RS saprolignicole présente sur BV dans les peuplements de type B.
Figure 8 : Richesse spécifique moyenne des bryophytes saprolignicoles entre passage avant et après coupe, en fonction du type de support. (AV : avant coupe, AP : après coupe, A : en peuplements de type A, B : en peuplements de type B).
Figure 9 : Richesse spécifique moyenne des bryophytes saprolignicoles entre passage avant et après coupe. (AV : avant coupe, AP : après coupe)
15
Rappel de l’hypothèse H3 : Le passage en coupe modifie la composition en espèces sur une
même parcelle, ou sur un même type de support, avec notamment plus d’espèces héliophiles, et moins de bryophytes saprolignicoles et de milieux humides.
Composition des espèces bryophytes :
Le calcul de l’indice de similarité de Jaccard indique que les communautés de bryophytes de l’ensemble des placettes avant passage de la coupe partagent 58,5% d’espèces avec l’ensemble des placettes après passage de la coupe. La matrice de similarité de Jaccard (Tableau 1) indique également que la composition d’espèces avant et après la coupe varie moins en peuplement A (Beaumont9 et StViatreA) qu’en peuplement B (ChilleursA, CourcyA et SullyA).
Tableau 1 : Indices de similarité de Jaccard (en %) des espèces de bryophytes calculés entre chaque relevé
16 Selon le dendrogramme (Figure 10), les communautés présentes sur BMS <4 cm, de 4 à 7 cm et de 7 à 22,5 cm sont assez proches entre elles et sont légèrement impactées par le passage de la coupe.
Le premier AFC (Figure 11, haut) indique qu’au niveau écologique, les communautés de bryophytes varient assez peu entre les différents relevés, hormis pour CourcyA_AV où on retrouve la présence d’espèces plutôt adaptés à des sols nus (Pleuridium subulatum, Fissidens taxifolius, Bryum rubens, à l’extrémité droite de l’axe 1), et que l’on ne retrouve pas proche de CourcyA_AP. On observe ce même effet sur la deuxième AFC (Figure 11, bas), sur laquelle on
Figure 11 : Analyse factorielle de correspondance entre les espèces de bryophytes et les relevés (figure du haut, avec en bleu des espèces plutôt ubiquistes, en orange des épiphytes de gros bois vivant et en violet les terricoles de sol nu) et entre les espèces de bryophytes et les types de supports (figure du bas, avec en violet les terricoles de sol nu, en vert des épiphytes de bois vivant et de bois mort volumineux, et en rouge les espèces plutôt ubiquistes.)
17 observe sur le sol_AV des espèces caractéristiques de sol nu (en plus de celles précédemment citées : Bryum capillare, Dicranella heteromalla, Polytrichum formosum et Atrichum ondulatum, situés à l’extrémité gauche de l’axe 1), plus éloignées du sol_AP, traduisant un glissement de l’écologie des espèces présentes au sol entre AV et AP.
De même, pour le bois vivant AV et AP coupe (Figure 11, bas), on observe un glissement de l’écologie des espèces, caractéristiques de bois vivant et gros bois mort (Ulota crispula, Orthotrichum diaphanum, Zygodon rupestris, Homalothecium sericeum, situés en haut à droite du graphique) avant coupe, vers des espèces plus ubiquistes ou communes après coupe (au niveau de la croisée des axes).
Composition des espèces vasculaires :
Les communautés de plantes vasculaires de l’ensemble des placettes avant passage de la coupe partagent 43,8% d’espèces avec l’ensemble des placettes après passage de la coupe.
A l’échelle de la placette, la matrice de similarité de Jaccard (Tableau 2) la composition d’espèces est assez dissimilaire entre avant et après la coupe (de 30% à 53%), à l’exception de SullyA (70% d’espèces en commun entre AV et AP).
Du point de vue de l’AFC (Figure 12), on retrouve des espèces de même type écologique entre avant et après la coupe, mais des écologies assez différentes entre les placettes, notamment entre les peuplements de type A répartie dans la partie de droite du graphique et les peuplements de type B à gauche.
Les peuplements de type B sont plutôt associées à des espèces plus sciaphiles (en jaune) que les peuplements de type A. A l’inverse, les peuplements de type A sont associés davantage à des espèces adaptées à des milieux plus riches et avec plus de lumière (en rouge). Le cercle bleu regroupant plutôt les espèces de milieu intermédiaire (acidicline).
18 Tableau 2 : Indices de similarité de Jaccard (en %) des espèces de plantes vasculaires calculés entre chaque relevé
Figure 12 : Analyse factorielle de correspondances entre les espèces de plantes vasculaires et les relevés (avec un gradient plutôt héliophile/sciaphile (de gauche à droite) et plutôt acidiphile/neutrocline (de bas en haut)).
Discussion :
Richesse spécifique et composition des bryophytes :
Dans l’ensemble :
Une fois pris en compte l’effet fort du type de peuplement, l’effet de la coupe sur la RS globale des bryophytes est significatif et négatif, mais avec une magnitude faible (perte en RS < 5% de la RS initiale). Toutefois, on ne peut pas conclure non plus qu’il n’y ait pas d’effet, car l’analyse de la magnitude n’aboutit pas à un effet systématiquement négligeable. Cela peut
19 potentiellement être lié à des données assez bruitées, par manque de répétitions, produisant des effets trop variables d’une placette à l’autre.
Par type de support :
Les résultats montrent que globalement, la richesse spécifique après la coupe augmente sur les souches et les BMS <4 cm, et diminue sur les autres supports.
La perte de RS sur les BV est potentiellement liée à la coupe, prélevant directement ces supports, et réduisant (mécaniquement) la probabilité de trouver des espèces différentes. A l’inverse, l’augmentation globale de la RS sur souche, notamment des épiphytes strictes, pourrait correspondre à l’augmentation (lié de fait à la coupe) de ce type de support, et à la plus forte probabilité d’y trouver des espèces différentes (notamment des espèces épiphytes de base de tronc). Il est également possible qu’avec le temps, les souches accueillent davantage d’espèces plutôt saprolignicoles et de milieu humide.
La diminution forte de la richesse d’espèces relevée au sol pourrait être lié directement à l’impact des travaux de coupe, mais ne signifie pas nécessairement que certaines espèces ayant disparues sur ces placettes ne réapparaissent pas après un certain temps, le relevé ayant été effectué très peu de temps après le passage de la coupe. Müller et al. (2019) évoquent le fait qu’en Europe centrale et à plus long terme, les terricoles (par le sol mis à nu) sont impactées plutôt positivement du fait de la gestion.
L’augmentation sur BMS <4 cm de la RS des héliophiles et la diminution de la RS de terricoles, saprolignicoles et de substrats humides peut s’expliquer par l’apport de BMS « frais » (qui correspondraient à des pertes d’exploitations). Ils portent sur eux un cortège d’espèces de houppier (plutôt des espèces de lumière et de conditions plus sèches) et ne sont pas encore colonisés par les terricoles ou les saprolignicoles. Ce résultat irait donc dans le sens de la première et la troisième hypothèse.
Les espèces saprolignicoles :
La très faible présence de bois mort au sol >22,5 cm révèle en partie, du fait de leur gestion, la faible quantité de très gros bois mort présent de manière générale dans ces types de peuplement, que ce soit avant ou après une coupe.
La RS des saprolignicoles présent sur les BMS <4 cm et au sol diminue après passage de la coupe, révélant possiblement l’impact direct des travaux de coupe sur les bois morts en place (passage d’engins notamment, mais aussi ramassage possible de ce support). Allant dans ce
20 sens, Okland et al. (2016) précise que les effets à court terme de la coupe sur la biodiversité sont essentiellement dus aux dégâts physiques au sol (et aux piles de résidus, pas présents dans le cadre de cette étude).
On observe ce même effet pour les saprolignicoles présents sur BMS de 7-22,5cm, en peuplement de type A, qui pourrait également être dû à la fragmentation, ou au ramassage de cette catégorie de bois mort dans ces parcelles avec le reste du bois prélevé. Cependant en peuplement de type B, c’est l’effet inverse que l’on constate. On peut penser pour cela à des espèces acidiphiles présentes sur la base des troncs (vivants ou morts), qui se seraient retrouvés au sol au moment de la coupe et qui n’aurait pas été ramassé.
Etude de la composition
Comme vu précédemment, il est possible que la diminution du nombre d’arbres vivants après coupe explique la diminution de la RS des espèces caractéristiques de bois vivant (épiphytes strictes). Cela expliquerait le fait que l’on retrouve davantage d’espèces spécifiques au bois vivant avant coupe, et plutôt des espèces généralistes après coupe (cf. Figure 11, bas).
Selon la matrice de similarité de Jaccard, l’évolution (apparition ou disparition d’espèces) de la flore de bryophytes entre avant et après la coupe est plus marquée en forêt d’Orléans qu’en Sologne, pouvant signifier que l’ensemble des bryophytes dans les parcelles en forêt d’Orléans étaient plus sensibles à un changement causé par la coupe. Cela étant, on remarque tout de même une assez grande différence dans l’ensemble des parcelles entre la communauté de bryophytes avant et après la coupe, indiquant un effet sensible à court terme de ce type de coupe sur la composition.
En forêt d’Orléans (peuplements de type B), les peuplements avaient un couvert dans l’ensemble plus dense que dans les peuplements en Sologne (peuplements de type A), et donc moins lumineux. Cela pourrait expliquer la différence du nombre d’espèces de bryophytes héliophiles entre ces peuplements, moins importante en forêt d’Orléans qu’en Sologne (cf. Figure 5). En effet, quelques espèces héliophiles étant déjà présentes dans les peuplements à couvert faibles de Sologne, la coupe aurait eu un effet moins fort sur l’apparition d’espèces héliophiles que dans les peuplements à plus fort couvert de la forêt d’Orléans, dans lesquels le passage de la coupe aurait plutôt eu tendance à en faire apparaitre (par apport de lumière). Richesse spécifique et composition des plantes vasculaires :
21 La luminosité étant plus forte dans les peuplements de Sologne que dans les peuplements en forêt d’Orléans, on peut observer dans l’AFC que les espèces plutôt sciaphiles ont tendance à se retrouver proche des relevés en forêt d’Orléans, et inversement les espèces plutôt héliophiles et de milieu plus riche proche des relevés en Sologne. Cela pourrait expliquer la différence de richesse d’espèces de plantes vasculaires (qui seraient favorisées par la plus forte luminosité) plus importante en Sologne qu’en forêt d’Orléans, multipliée par 2 en moyenne. Ce résultat est probablement renforcé par la différence de richesse du sol entre les deux types de peuplement (cf. AFC Figure 12).
On remarque cependant que la matrice de similarité de Jaccard indique une différence floristique assez importante entre avant et après le passage en coupe (cf. Tableau 2), ce qui permet de dire que la coupe induit un changement à très court terme important de la composition des plantes vasculaires, sans pour autant modifier fortement leur écologie (cf. AFC Figure 12). Selon Astrom et al. (2005), en forêt boréale, les travaux de coupe ont tendance à impacter la flore au sol dans son ensemble directement (avec le ramassage des rémanents), et à court terme par compaction du sol. On pourrait donc supposer que l’écologie des plantes vasculaires changerait dans le temps pour s’adapter à des sols possiblement plus compacts.
Conclusion :
Dans cette étude effectuée en forêt tempérée à l’échelle du peuplement et à court terme, on peut affirmer qu’il y a bien un effet négatif du passage en coupe de bois-énergie par arbre entier sur les bryophytes, mais le manque de répétitions induit du bruit dans les données, et ne nous permet pas de conclure sur la magnitude de cet effet pour un seuil de négligeabilité fixé à 10%. On voit également apparaitre un effet de la coupe sur la richesse en espèces bryophytes des différents substrats, et notamment au sol (négatif), et sur les souches (positif). La richesse spécifique des plantes vasculaires a également tendance à augmenter dans l’ensemble, sans que l’effet ne soit fort. Pour finir, les communautés de plantes vasculaires et de bryophytes varient entre le passage avant et après coupe. Cela étant, le fait que l’étude ait été réalisée dans deux types de peuplements assez différents a induit un effet peuplement fort dans de nombreux cas, et complique l’interprétation des résultats selon les hypothèses posées, mais a également permis de mettre en valeur certains paramètres écologiques (notamment la richesse du sol et la luminosité) ayant influencé les résultats.
22 A la suite de cette première analyse est envisagée une analyse plus approfondie par modélisation GLM de l’effet de la coupe et du type de peuplement sur le volume et le profil de bois mort, ainsi que sur la probabilité de présence des espèces.
Une étude à plus long terme (quelques années) sur ces sites permettrait d’observer ou non un éventuel changement d’écologie de la flore au sol et présente sur les différents supports, et la disparition ou l’apparition d’espèces.
Remerciements :
Je tiens à remercier ma responsable de stage Marion Gosselin qui a su me guider dès le début vers les objectifs que nous nous sommes fixés, et qui a été très bienveillante dans l’aide qu’elle m’a apporté tout au long du stage. Je souhaite également remercier mon co-encadrant de stage Yann Dumas, qui en plus de m’avoir été d’une aide précieuse, a su me transmettre sa passion pour les bryophytes, et grâce à qui j’ai beaucoup appris.
Je remercie l’ensemble de mes collègues du laboratoire pour leur accueil, qui m’a permis très vite de me sentir intégré et soutenu dans mon travail, et en particulier Ugoline et Guilhem, qui m’ont apporté leur aide et leur soutien pendant la rédaction de ce rapport.
Pour finir je remercie ma compagne Mélanie pour ses conseils et son soutien inconditionnel.
Références :
Astrom, M., Dynesius, M., Hylander, K., and Nilsson, C. (2005). "Effects of slash harvest on bryophytes and vascular plants in southern boreal forest clear-cuts." Journal of
Applied Ecology, 42(6), 1194-1202.
Atherton, I., Bosanquet, S., and Lawley, M. (2010). Mosses and Liverworts of Britain and
Ireland. A Field Guide, British Bryological Society, 1, 848.
Doerfler, I., Gossner, M., Müller, J., Seibold, S., and Weisser, W. (2018). "Deadwood enrichment combining integrative and segregative conservation elements enhances biodiversity of multiple taxa in managed forests." Biological Conservation , 228, 70-78.
Haughian, S. R. (2018). "Short-term effects of alternative thinning treatments on the richness, abundance and composition of epixylic bryophytes, lichens, and vascular plants in conifer plantations at microhabitat and stand scales." Forest Ecology and Management , 415, 106-117.
23 Hill, M., Preston, C., Bosanquet, S., and Roy, D. (2007). "Bryoatt. Attributes of British and
Irish Mosses, Liverworts and Hornworts, With Information on Native Status, Size, Life Form, Life History, Geography and Habitat." , NERC ; Centre for Ecology and Hydrology (CEH) ; Countryside Council for Wales, Cambridgeshire, 88.
Hof, A. R., Lofroth, T., Rudolphi, J., Work, T., and Hjalten, J. (2018). "Simulating Long-Term Effects of Bioenergy Extraction on Dead Wood Availability at a Landscape Scale in Sweden." Forests Forests , 9(8 84).
Hofmeister, J., Hošek, J., Brabec, M., Dvořák, D., Beran, M., Deckerová, H., Burel, J., Kříž, M., Borovička, J., Bě͗ák, J., Vašutová, M., Malíček, J., Palice, Z., Syrovátková, L., Steinová, J., and Černajová. (2015). "Value of old forest attributes related to cryptogam species richness in temperate forests: A quantitative assessment."
Ecological Indicators , 57, 497-504.
Johansson, V., Felton, A., and Ranius, T. (2016). "Long-term landscape scale effects of bioenergy extraction on dead wood-dependent species." Forest Ecology and
Management , 371, 103-113.
Jokela, J., Juutilainen, K., Korpela, L., Kouki, J., Kuntsi, S., Koivula, M., and Siitonen, J. (2018). "Cross-taxon congruence and relationships to stand characteristics of vascular plants, bryophytes, polyporous fungi and beetles in mature managed boreal forests."
Ecological Indicators , 85, 137-145.
Landmann, G., and Nivet., C. (2014). "Projet Resobio. Gestion des rémanents forestiers : préservation des sols et de la biodiversité." -243.
Lassauce, A., Paillet, Y., Jactel, H., and Bouget, C. (2011). "Deadwood as a surrogate for forest biodiversity: Meta-analysis of correlations between deadwood volume and species richness of saproxylic organisms." Ecological Indicators, 11(5), 1027-1039. Malcolm, B. (2006). Mosses and other bryophytes, an illustrated glossary, Micro-Optics
Press, Nelson (New Zealand), 336.
Müller, J., Boch, S., Prati, D., Socher, S., Pommer, U., Hessenmöller, D., Schall, P., Schulze, E., and Fischer, M. (2019). "Effects of forest management on bryophyte species richness in Central European forests." Forest Ecology and Management , 432, 850-859.
Okland, T., Nordbakken, J. F., Lange, H., Rosberg, I., and Clarke, N. (2016). "Short-term effects of whole-tree harvesting on understory plant species diversity and cover in two Norway spruce sites in southern Norway." Scandinavian Journal of Forest Research, 31(8), 766-776.
Paton, J. (1999). The liverwort flora of the British Isles, Harley Books, 626.
Ranius, T., Hämäläinen, A., Egnell, G., Olsson, B., Eklöf, K., Stendhal, J., Rudolphi, J., Sténs, A., and Felton, A. (2018). "The effects of logging residue extraction for energy on ecosystem services and biodiversity: A synthesis." Journal of Environmental
24 Schmidt, M., Kriebitzsch, W., and Ewald, J. (2013). "Waldartenlisten der Farn- und
Blütenpflanzen, Moose und Flechten Deutschlands.", 299, 111.
Smith, A. (2004). The Moss Flora of Britain and Ireland, Cambridge University Press, Cambridge, 1024.
Tullus, T., Rosenvald, R., Leis, M., and Lõhmus, P. (2018). "Impacts of shelterwood logging on forest bryoflora: Distinct assemblages with richness comparable to mature forests."
Forest Ecology and Management , 411, 67-74.
Zolotarjova, V., Kraut, A., and Löhmus, A. (2016). "Slash harvesting does not undermine beetle diversity on small clear-cuts containing sufficient legacies." Journal of Insect
25
Annexes : Tableau des sorties de modèles GLM de la richesse spécifique floristique en fonction des différentes variables explicatives (en gras le
26
Sans covariable Avec covariable : type de peuplement Effet interaction TP:passage
Effet TP à passage donné
Effet passage à TP
donné Peuplement A Peuplement B
Response variable AIC
Magnitu de Significati vité AIC Magnitu de Significati vité Magnitu de Significati vité AIC Magnitu de Significati vité Magnitu de Significati vité RS_tot_vasc 77. 9 NC NS 71. 7 - *** NC NS 73. 7 NC NS NC NS RS_totale_cort 61. 1 NC . 60. 5 - . NC . 61. 6 NC NS NC * RS_totale_cort_ter 55. 8 NC *** 52. 2 - ** NC *** 53. 0 NC . NC NS RS_Bois_vivant 70. 8 - * 68. 8 - * - * 65. 8 NC NS - * RS_BMS_sup_22.5cm 30. 9 ~+ NS 32. 3 ~+ NS ~+ NS 32. 6 NC NS NC NS RS_BMS_inf_4cm 56. 6 NC NS 56 - . NC NS 54. 8 NC NS + * RS_BMS_4_a_7cm 60. 2 NC NS 60. 7 NC NS NC NS 62. 6 NC NS NC NS RS_BMS_7_a_22.5cm 54. 4 NC NS 56. 2 NC NS NC NS 39. 9 - *** + *** RS_Souche 49. 5 + ** 51. 4 NC NS + ** 53. 0 + . NC NS mod_RS_tot_sol 45. 0 - ** 47. 0 NC NS - ** 48. 9 NC NS NC NS RS_epi_totale_cort 55. 8 NC NS 56. 5 NC NS NC NS 58. 3 NC NS NC NS RS_epi_Bois_vivant 67. 9 - . 67. 4 NC NS - * 64. 5 NC NS - * RS_epi_BMS_sup_22.5c m 30. 9 ~+ NS 32. 3 ~+ NS ~+ NS 32. 6 NC NS NC NS
27 RS_epi_BMS_inf_4cm 53. 2 + . 53. 6 NC NS + * 47. 1 NC NS + *** RS_epi_BMS_4_a_7cm 59. 2 NC NS 61. 0 NC NS NC NS 63. 0 NC NS NC NS RS_epi_BMS_7_a_22.5c m 49. 5 NC NS 50. 6 NC NS NC NS 36. 4 - ** + *** RS_epi_Souche 46. 3 + ** 48. 0 NC NS + ** 49. 6 NC NS NC NS mod_RS_epi_sol 45. 5 NC NS 47. 0 NC NS NC . 48. 5 NC NS - NS RS_ter_totale_cort 32. 5 NC NS RS_ter_totale_cort_ter 38. 9 ~- * 36. 0 NC NS NC NS RS_ter_Bois_vivant 49. 2 NC NS 49. 9 NC NS NC NS 47. 7 NC NS - * RS_ter_BMS_sup_22.5c m 27. 6 NC NS 28. 5 NC NS NC NS RS_ter_BMS_inf_4cm 32. 3 - * 34. 2 NC NS - * 29. 3 - *** + *** RS_ter_BMS_4_a_7cm 37. 9 NC NS 39. 3 NC NS NC NS 40. 3 NC NS NC NS RS_ter_BMS_7_a_22.5c m 28. 5 NC NS 28. 3 NC NS NC NS 13. 7 ~- *** - *** RS_ter_Souche 40. 2 NC NS 42. 2 NC NS NC NS 44. 2 NC NS NC NS mod_RS_ter_sol 43. 4 - ** 42. 7 NC . - ** 44. 3 - * NC NS RS_sapli_totale_cort 36. 3 NC NS 38. 1 NC NS NC NS 40. 1 NC NS NC NS RS_sapli_Bois_vivant 48. 1 NC NS 48. 8 NC NS NC NS 47. 8 NC NS - .
28 RS_sapli_BMS_sup_22.5c m 27. 6 NC NS 28. 5 NC NS NC NS RS_sapli_BMS_inf_4cm 32. 3 - * 34. 2 NC NS - * RS_sapli_BMS_4_a_7cm 36. 3 NC NS 37. 0 NC NS NC NS 38. 3 NC NS NC NS RS_sapli_BMS_7_a_22.5c m 37. 9 NC NS 35. 6 + * NC NS 27. 8 ~- *** - *** RS_sapli_Souche 42. 2 NC NS 44. 1 NC NS NC NS 45. 9 NC NS NC NS mod_RS_sapli_sol 37. 3 - * 38. 9 NC NS - * 39. 9 - * NC NS RS_humhill_totale_cort 34. 3 NC NS 33. 7 + . NC NS 34. 7 NC NS NC NS RS_humhill_Bois_vivant 38. 9 NC NS 40. 9 NC NS NC NS 41. 3 NC NS NC NS RS_humhill_BMS_sup_22 .5cm RS_humhill_BMS_inf_4c m 31. 8 NC NS 33. 7 NC NS NC NS 34. 9 NC NS NC NS RS_humhill_BMS_4_a_7c m 37. 2 NC NS 38 NC NS NC NS 40. 0 NC NS NC NS RS_humhill_BMS_7_a_22 .5cm 34. 6 NC NS RS_humhill_Souche 27. 7 + ** RS_forhill_totale_cort 54. 4 NC NS 55. 0 NC NS NC NS 56. 3 NC NS NC NS RS_forhill_Bois_vivant 67. 9 - . 67. 4 - NS - * 64. 5 NC NS - *
29 RS_forhill_BMS_sup_22. 5cm 30. 9 ~+ NS 32. 3 ~+ NS ~+ NS 32. 6 NC NS NC NS RS_forhill_BMS_inf_4cm 53. 2 + . 53. 6 NC NS + * 47. 1 NC NS + *** RS_forhill_BMS_4_a_7c m 59. 9 NC NS 61. 5 NC NS NC NS 63. 5 NC NS NC NS RS_forhill_BMS_7_a_22. 5cm 49. 5 NC NS 50. 6 NC NS NC NS 36. - ** + *** RS_forhill_Souche 46. 3 + ** 48. 0 NC NS + ** 49. 6 + NS NC NS RS_forschm_totale_cort 38. 1 NC NS 39. 4 NC NS NC NS 41. 3 NC NS NC NS RS_forschm_Bois_vivant 42. 3 NC NS 43. 8 NC NS NC NS 44. 5 NC NS NC NS RS_forschm_BMS_sup_2 2.5cm 18. 4 NC NS 20. 4 NC NS NC NS 22. 4 NC NS NC NS RS_forschm_BMS_inf_4c m 33. 6 NC NS 35. 5 NC NS NC NS RS_forschm_BMS_4_a_7 cm 39. 1 NC NS 40. 2 NC NS NC NS 42. 1 NC NS NC NS RS_forschm_BMS_7_a_2 2.5cm 39. 6 NC NS 39. 4 + NS NC NS 33. 2 - * + *** RS_forschm_Souche 33. 7 + * 33. 1 + NS + * 35. 1 NC NS NC NS RS_humschm_totale_cor t 37. 7 NC NS 39. 5 NC NS NC NS 41. 3 NC NS NC NS RS_humschm_Bois_vivan t 30. 3 - . 32. 3 NC NS - . 32. 4 NC NS NC NS RS_humschm_BMS_sup_ 22.5cm RS_humschm_BMS_inf_4 cm 30. 1 - . 34 NC NS - . 33. 2 NC NS NC NS
30 RS_humschm_BMS_4_a_ 7cm 24. 6 NC NS RS_humschm_BMS_7_a_ 22.5cm 31. 0 NC NS 32. 2 NC NS NC NS RS_humschm_Souche 23. 1 + . 25. 0 NC NS + . mod_RS_humschm_sol 35. 2 NC . 37. 0 NC NS NC . RS_lumschm_totale_cort 34. 1 - *** 28. 6 - *** - *** 28. 6 - *** ~+ . RS_lumschm_Bois_vivant 45. 7 - * 43. 2 - * - * RS_lumschm_BMS_sup_ 22.5cm RS_lumschm_BMS_inf_4 cm 33. 8 + ** 32. 5 - * + *** RS_lumschm_BMS_4_a_ 7cm 45. 4 NC NS 43. 3 - ** NC NS 44. 8 NC NS NC NS RS_lumschm_BMS_7_a_ 22.5cm 30. 0 NC NS 30. 2 NC NS NC NS 32. 1 NC NS NC NS RS_lumschm_Souche NC NS NC NS mod_RS_lumschm_sol 16. 0 NC NS