ةيبعشلا ةيطارقوميدلا ةيرئازجلا ةيروهمجلا
République Algérienne Démocratique et Populaire يملعلا ثحبلاو يلاعلا ميلعتلا ةرازو
Ministère de l’Enseignement Supérieur et de la Recherche Scientifique ةعماج
80 يام 5491 ةملاق
Université 8 Mai 1945 Guelma
Faculté des Sciences de la Nature et de la Vie, Sciences de la terre et de l’Univers
Mémoire En Vue de l’Obtention du Diplôme de Master Domaine : Sciences de la Nature et de la Vie
Filière : Sciences Biologiques Département : Biologie
Spécialité/Option : Biologie Moléculaire et Cellulaire
Thème :
Présenté par : Devant le jury composé de :
Khelaifai Sawsen Président : Dr Oumeddour Abde Elkader (MCA)
Labied Meriem Encadreur : Dr Aissaoui Ryadh (MCB)
Rahim Nour Elhouda Examinateur : Dr Hemici Ahmed (MCB)
Septembre 2020
Etude de la Cryptosporidiose dans les eaux de
la région de Guelma
REMERCIEMENT
Au terme de ce travail:
Nous tenons a remercié DIEU le
Tout Puissant pour Nous avoir
préservé, donné la santé, et guidé
vers
La connaissance et le savoir.
Nous tenons vivement à remercie
notre promoteur
^^Aissaoui Ryadh^^
Pour avoir accepté la charge
d’encadrer ce travail, son sérieux,
sa rigueur et sa patience.
Les membres du jury
Dr : Oumeddour Abde Elkader Dr :Hemici Ahmed
A tous ceux, qui nous ont enseigné pendant toute
Notre vie.
dd
Je dédie ce mémoire
Ames très chers Parents : Abdelghani et Zahour que j’aime le plus au monde,
Pour leur amour, Sacrifices, aide et soutien, qui m’ont toujours Encouragé Tout au
long de mes études
Que Dieu les gardes et les protèges, en leur souhaitant une longue vie pleine de santé
et
de bonheur
A mes très chères sœurs Hadjer et Asma
A mon très chér frère Mohammed
A mes très chère oncles Abd el naser et Djamel
A mes chères tantes Soraia& Fatima et Nasira
« Pour votre soutien à tous les instants, quelque soit l’occasion, toujours avec moi »
A toutes les familles LABIED et DOUBABI petits et grand
A toutes les personnes qui sont très chères à mon cœur surtout tante Khoula ,Alima ,Ahlem
,Sara et Asma…et mes amies intimes avec lesquelles j’ai partagé mes moments de joie et de
bonheur
Pour leurs encouragements et leurs soutient
A tous ceux qui ne sont pas mentionnées dans ce modeste mémoire, mais ils sont dans notre cœur
A l’occasion de cet évènement marquant de ma vie,
Je dédie ce modeste travail à :
Mes très chers parents qui m’ont toujours encouragé, poussé et
motivé durant mes études.
Puisse Dieu vous donne santé et bonheur
A toi spécialement ma très chère mère, la lumière de mes jours,
pour ta tendresse, ta patience et ton encouragement qui me
donne toujours la force pour affronter les différents obstacles de
la vie.
A mes très chères sœurs : « Malak » et « Hadil », source de joie
et bonheur, pour votre amour, et je m’excuse de vous avoir
fatiguées avec moi au cours de mes études.
A ma très chère cousine « Yamina »pour votre encouragement
A tous mes chères amies
Sans oublier tous les professeurs qui ont contribués afin que ce
moment arrive et se réalise, je vous remercie de tout cœur soit
du primaire, du moyen, du secondaire ou
de l’e
nseignement
supérieur
Je vous souhaite une vie pleine de bo
nheur
et de succès
Je dédie ce modeste travail à :
A mes très chers parents pour leurs sacrifices et leurs
encouragements durant toute ma formation.
Amon paradis dans ma vie, ma mère « Aziza ».
Amon très cher père « Tahar ».
Puisse dieu vous donne santé et bonheur
Amon très cher frère « Slah Edinn » et ma
très chères sœur « Hadjira ».
Je dédie ce mémoire en particulier à mon pulsation, mon
petit frère « Rayen » que le bon Dieu dans son vaste
paradis.
A ma meilleure amie dans ma vie « Amel ».
Enfin je dédie ce travail à toutes les personnes qui sont
dans mon cœur et pas écrit dans ma feuille.
sommaire
Liste des figures
Liste des tableaux I
Liste des abréviations III
Introduction. 1 Partie bibliographique 1. Historique 4 2. Biologie de parasite 5 2.1. Définition du Cryptosporidium 5 2.2. Taxonomie 5 2.2.1. La classification taxonomique 6 2.3. Cycle biologique 7
2.3.1. Caractéristiques et propriétés biologiques d’oocyste 7
2.3.2. Caractéristiques du cycle 7
2.3.3. Déroulement de cycle 7
3. Morphologie de parasite 10
3.1. La Morphologie des différents stades parasitaires 10
3 .1.1. Les oocystes 10
3.1.2. Les sporozoïtes 11
3.1.3. Les trophozoïtes 11
3.1.4. Les mérontes et mérozoïtes des types I et II 12
3.1.5. Les macrogamontes 12
3.1.6. Les microgamontes 13
4. Définition de la Cryptosporidiose 13
4 .2. Cryptosporidiose animale
5. Localisation du parasite ( cryptosporidiume) 14
6. Epédimiologie de la cryptosporidiose 14
6.1. Les type d’épidémiologies 15
6.1.1. Les épidémies d’origine hydrique 15
6.1.2. Les épidémies liées aux aliments 15
6.2. L’épidémiologie chez les êtres vivants 15
6.2.1. Chez l’homme 15
6.2.2. Chez les bovins laitiers 16
6.2.3. Chez les ovins 16
6.3. Epidémiologie mondiale 16 7. Epidémiologie analytique 17 7.1. Source du parasite 17 7.2. Réceptivité et sensibilité 18 7.2. 1. Espèce 18 7.2. 2.Age 18 7.2.3. Race 18 7.2 .4. Etat immunitaire 19
7.3. Résistance des parasites 19
8. Le mode de contamination 19
9. Les Symptômes 20
9.1. Pour l’animal 20
10. Le diagnostic
10.1. Le microscopie conventionnelle 21
10.2. Les méthodes de concentration 21
10.3. Les méthodes de coloration 22
10.3.1. Méthode de Henriksen modifiée, aussi appelée Ziehl-Neelsen
modifiée (1981) 22
10.3.2. Méthode de Heine 22
10.3.3. les biopsies 22
10.3.4. la fluorescence 22
10.4. Les méthodes d’immunomarquage 23
10.5. Diagnostic de biologie moléculaire 23
11. Le Traitement de cryptosporidies 24 11.1. Pour l’homme 24 11.1.1.Le nitazoxanide 24 11.1.2. la paromomycine 25 11.2. Pour l’animal 25 11.2.5. Le lactate d’halofuginone 25
11.2.2 .Le sulfate de paromomycine 25
11.2.3. Le lasaloside 25 12. La Prévention 25 12.1. Pour l’homme 25 12.2. Pour l’animal 26 Partie pratique 1. Matériel et méthode 28
1. Présentation de la région d’étude 28
1.1. Présentation des stations d’échantillonnage 28
2. Matériels utilisées 28
2.1. Matériel biologique 28
2.2. Matériel de laboratoire 29
2.3. Matériel de prélèvement 29
3. méthodes utilisées 29
Henriksen et Pohlenz 30
2. Résultats et interprétations 31
Conclusion 41
Références bibliographiques
Liste des annexes -
صخلملا -
Abstract -
Liste des figures
Liste des figures
Désignation page
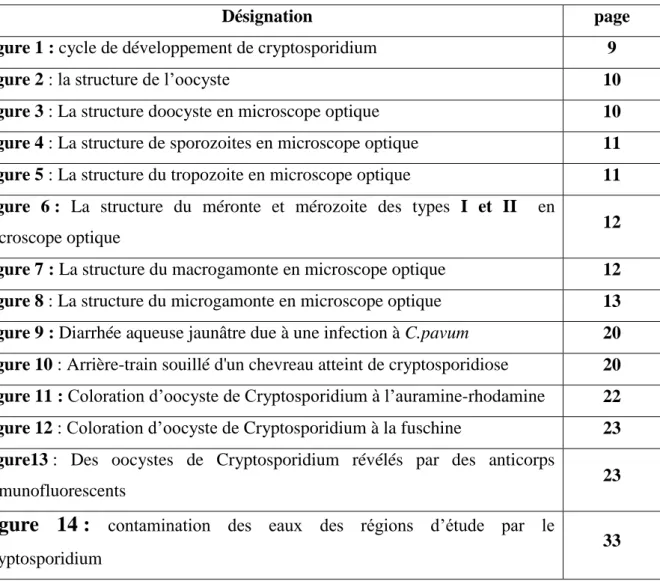
Figure 1 : cycle de développement de cryptosporidium 9
Figure 2 : la structure de l’oocyste 10
Figure 3 : La structure doocyste en microscope optique 10 Figure 4 : La structure de sporozoites en microscope optique 11 Figure 5 : La structure du tropozoite en microscope optique 11 Figure 6 : La structure du méronte et mérozoite des types I et II en
microscope optique 12
Figure 7 : La structure du macrogamonte en microscope optique 12 Figure 8 : La structure du microgamonte en microscope optique 13 Figure 9 : Diarrhée aqueuse jaunâtre due à une infection à C.pavum 20 Figure 10 : Arrière-train souillé d'un chevreau atteint de cryptosporidiose 20 Figure 11 : Coloration d’oocyste de Cryptosporidium à l’auramine-rhodamine 22 Figure 12 : Coloration d’oocyste de Cryptosporidium à la fuschine 23 Figure13 : Des oocystes de Cryptosporidium révélés par des anticorps
immunofluorescents 23
Figure 14 :
contamination des eaux des régions d’étude par le CryptosporidiumListe des tableaux
Liste des tableaux
Désignation
pageTableau 1 : La classification taxonomique 6
Tableau 2 : les différentes stations de Ain Makhlouf 32
Tableau3 : les différentes stations d’Ain Raggada 35
Liste des tableaux
Liste des abréviations
SIDA Syndrome l’immunodéficience acquisC Cryptosporidium
mg/kg/j milligramme par kilogramme par jour
mg milligramme
kg kilogramme
km kilomètre
% Pourcentage
PCR Ploymerase chain reaction
ADN Acide disoxyribo-nucleique
°C Degré Celsius
µg Microgramme
µm
Micromètre(+)
Présence(-)
Absence1
Introduction
1
Introduction
La Cryptosporidiose est une parasitose intestinale responsable de nombreuses épidémies d’origine hydrique, observé la première fois par Edward Tyzzer en 1907, a été rapportée sur tous les continents avec une incidence et une prévalence très variables, à ce jour, pas moins de 165 épidémies ont été répertoriées à travers le monde, majoritairement dans les pays développés. Dans les pays en voie de développement où la surveillance de la qualité des eaux est absente le nombre d’épidémies est très certainement sous-estimé. Malheureusement, l’Algérie est l’un des pays touchés par cette maladie qui est causée par un parasite nommé le Cryptosporidium. qui est un agent zoonotique pathogène important, pouvait vivre dans l’intestin grêle de l’hôte infecté. Plusieurs espèces de ce parasite ont été identifiées, parmi lesquels : C. parvum, C. muris Possèdent une assez faible spécificité d’hôte, ce qui signifie qu’elles peuvent être pathogènes à la fois pour les animaux et les humain (O’donoghue, 1995 ; Naciri, 1992 ).
Le mode de transmission reconnu aujourd’hui responsable de la pluparts des épidémies de la Cryptosporidiose humain est la transmission par l’eau : ingestion d’eau contaminé et baignade en eau douce ou dans la mer.
Cette maladie a plusieurs symptômes remarquables mais se caractérise le plus souvent chez les patients humains immunodéficitaires notamment ceux atteints du SIDA, par une infection sévère se traduisant par une diarrhée prolongée, qui est souvent irréversible et se termine par le décès du patient. Les patients immunocompétents sont moins sévèrement affectés, diarrhées et douleurs abdominales étant accompagnées d’un état de type grippal qui dure généralement de 7 à 14 jours, bien que les sensations de malaise puissent persister jusqu’à un mois (Doron, 2000).
L’objectif du présent travail est basé sur l’analyse des eaux de différentes régions de la wilaya de Guelma, en essayant de détecter la présence du parasite dans les eaux de surfaces utilisées, (comme les abreuvoirs des bovins) et d’évaluer le taux d’infection de cette maladie.
Le travail est subdivisé en deux parties :
La partie bibliographique, où nous présenterons le parasite, la maladie, les symptômes, les techniques de diagnostic, les traitements possibles et les méthodes de lutte contre cette parasitose.
Introduction
2
La deuxième partie concerne la partie pratique : elle subdivisé en deux volets : matériel et méthodes et les résultats préliminaires obtenus
3
Partie
4
1- Historique :
La première découverte du genre Cryptosporidium était en 1907 par Tyzzer dans les glandes gastriques d’une souris de laboratoire (Mus musculus), il lui donna le nom de
Cryptosporidium muris en 1910.En 1912, Tyzzer observe une autre espèce dans l’intestin
grêle de souris du même genre aussi de la même morphologie mais de petite taille que la première qu’il nomma Cryptosporidium parvum (O’Donoghue, 1995).
En 1955, Slavin découvre la pathogénicité du genre Cryptosporidium meleagridis due à une infection dans le système digestif de la dinde provoquant une diarrhée et une faible mortalité (Slavin, 1955), Les premiers cas de la cryptosporidiose chez l’homme ont été rapportés en 1976 ( Meisel et al., 1976 ; Weisburger et al., 1979),chez deux patients : l’un immunodéprimé,(il s’agit d’un affaiblissement du système immunitaire à cause de la maladie à la fois, et constitue un facteur de risque à un autre maladie) (Meisel et al., 1976) , et l’autre un enfant de trois ans immunocompétent .Leur système immunitaire a la capacité de produire une réponse immunitaire normale face à un agent pathogène (Nime et al., 1976), les personnes qui sont les plus risquées sont les personnes immunodéficientes (ex :souffrent de SIDA)( Chen XM et al., 2002).
Une recherche réalisée dans Iowa (USA) en 1978, a reconnu les différentes espèces de Cryptosporidium comme des agents entéropathogènes importants chez les veaux (Pohlenz et
al. 1978),
En 1993 le Milwaukee (Etats-Unis d’Amérique), a connu une épidémie la plus élevée, qui aurait touché plus de 400 000 personnes ayant bu de l’eau du robinet contaminée (Mac Kenzie et al., 1994)
En Algérie durant 1992, les premiers cas de Cryptosporidiose ont été diagnostiqués par le médecin Azzam chez deux patients immunodéprimés et trois immunocompétents dans l’hôpital d’El Kettar (willaya d’Alger).
5
2. Biologie de parasite
2.1. Définition du Cryptosporidium :
Le Cryptosporidium est un parasite unicellulaire capable de parasiter un grand nombre de Vertébrés (oiseaux, mammifères.., et même l’homme) (O’donoghue, 1995) . Cependant, ces espèces sont nommées selon l’hôte infecté la première fois (Slapeta, 2009). Ce parasite est l’agent causal de la maladie appelée « Cryptosporidiose », qui est reconnue par une diarrhée chez le patients (Nadham et al., 2004), se développe dans les cellules épithéliales de l'intestin de l’hôte (Tzipori, 1983).
Le développement des techniques de typage moléculaire a permis de distinguer 26 espèces de Cryptosporidium, les deux espèces responsables de la majorité des cas humains sont Cryptosporidium parvum, et Cryptosporidium hominis. en marge de ces espèces validées, plus de 60 génotypes de Cryptosporidium ont été décrits, mais leur pathogénicité reste encore incertaine (Elwin et al., 2012 ; Robinson et al., 2008).
2.2.
Taxonomie :
La taxonomie des protozoaires en général est délicate car elle repose sur des critères parfois subjectifs : quand il n’y a pas de différences morphologiques visibles, ce sont les différences de distribution géographique, de spécificité d’hôte ou de comportement entre les parasites qui servent à définir ce qu’est une espèce
Au sein du genre Cryptosporidium, environ 30 espèces sont recensées à ce jour, . (Šlapeta, 2009). Il été retrouvé chez plus de 250 groupes de Vertébrés différents (mammifères, poissons, oiseaux…). Près de 20 espèces existent chez l’homme, dont deux sont responsables de plus de 90% des cas de cryptosporidiose : C. hominis et C. parvum. (Xiao 2010).
6
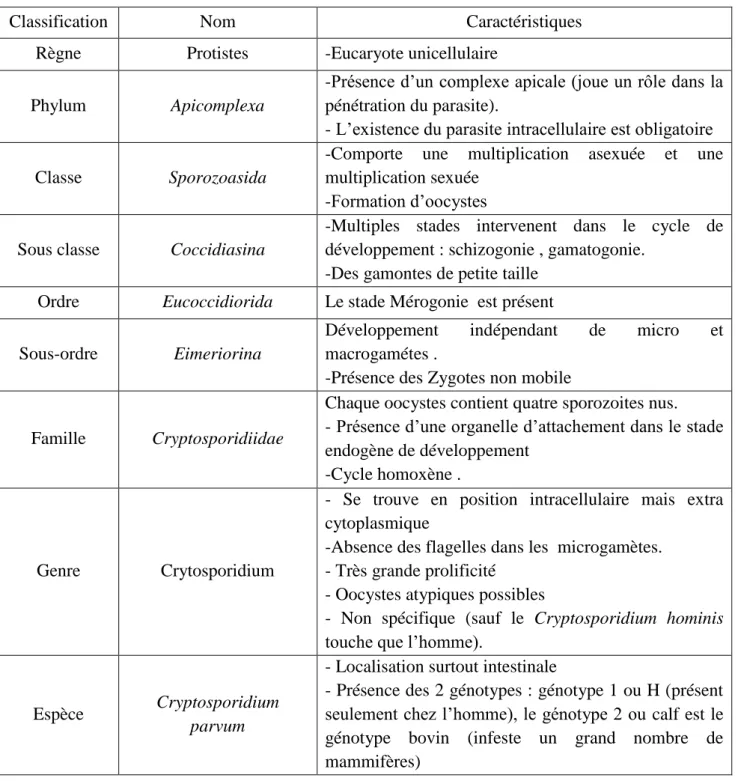
2.2.1La classification taxonomique :
Le tableau N° 1 regroupe les différentes caractéristiques de la calssification de Cryptosporidium
Tableau 01 : La classification taxonomique (Barta ,2006).
Classification Nom Caractéristiques
Règne Protistes -Eucaryote unicellulaire
Phylum Apicomplexa
-Présence d’un complexe apicale (joue un rôle dans la pénétration du parasite).
- L’existence du parasite intracellulaire est obligatoire
Classe Sporozoasida
-Comporte une multiplication asexuée et une multiplication sexuée
-Formation d’oocystes
Sous classe Coccidiasina
-Multiples stades intervenent dans le cycle de développement : schizogonie , gamatogonie.
-Des gamontes de petite taille
Ordre Eucoccidiorida Le stade Mérogonie est présent
Sous-ordre Eimeriorina
Développement indépendant de micro et
macrogamétes .
-Présence des Zygotes non mobile
Famille Cryptosporidiidae
Chaque oocystes contient quatre sporozoites nus. - Présence d’une organelle d’attachement dans le stade endogène de développement
-Cycle homoxène .
Genre Crytosporidium
- Se trouve en position intracellulaire mais extra cytoplasmique
-Absence des flagelles dans les microgamètes. - Très grande prolificité
- Oocystes atypiques possibles
- Non spécifique (sauf le Cryptosporidium hominis touche que l’homme).
Espèce Cryptosporidium
parvum
- Localisation surtout intestinale
- Présence des 2 génotypes : génotype 1 ou H (présent seulement chez l’homme), le génotype 2 ou calf est le génotype bovin (infeste un grand nombre de mammifères)
7
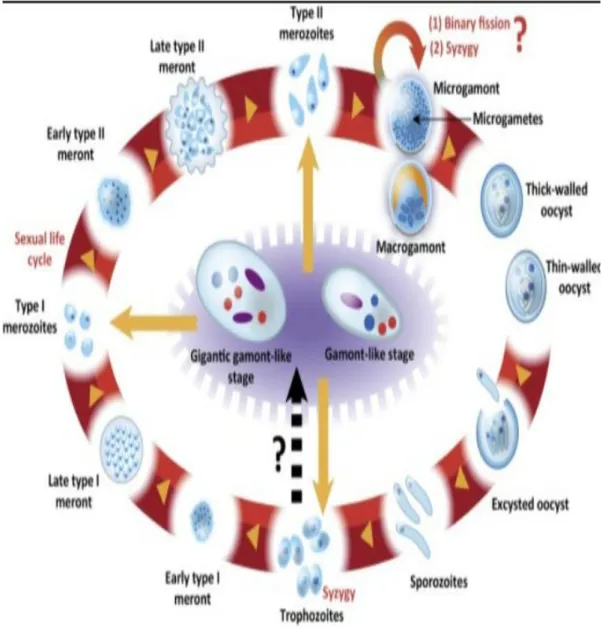
2.3. Cycle biologique :
2.3.1.Caractéristiques et propriétées biologiques d’oocyste :
Les ookystes de Cryptosporidium résistent aux conditions d’environnement et conservent leur pathogénicité pour plusieurs mois dans le sol et l’eau grâce à leurs paroi (Naciri et al., 1999), en plus, ils résistent aussi aux désinfectants usuels tel que l’eau de javel (Anderson, 1985). Le genre Cryptosporidium issu d’une organelle localisée dans la vacuole parasitophore, qui assure leur nutrition aux dépend de la cellule hôte (O’donoghue , 1995) .
Une étude menée par Campbell et ses collaborateurs (1982) a permis d’évaluer la viabilité des ookystes chez des souris dans sept désinfectants différents. Leurs analyses indiquent que seuls l’ammoniac et la formaline détruisent complètement le caractère infectieux des ookystes. D’après des observations personnelles, mais non publiées, de Campbell et ses collaborateurs (1982), la viabilité des ookystes peut être compromise lorsqu’ils sont exposés à des températures extrêmes (plus de 65°C ou moins de —20 °C) (Campbell et al., 1982).
2.3.2.Caractéristiques du cycle :
Le cycle biologique du genre Cryptosporidium est complexe comportant une multiplication asexuée suivie par une multiplication sexuée (Anofel, 2014), aussi, le cycle monoxène direct, se déroule dans un seul hôte (Bonnina et al., 1992 ), exactement dans les cellules épithéliales de l’intestin grêle, gastro- intestinal, cependant, d’autres localisations sont possibles (localisation erratiques) (Appelbee et al., 2005). Ce cycle de vie peut se terminer à l’intérieur de l’hôte en deux jours (Villeneuve, 2003).
2.3.3. Déroulement de cycle :
Les oocystes de Cryptosporidium qui contiennent quatre sporozoites immédiatement infectieux, sont excrétés dans les selles de l’hôte cible (infecté), une fois intégré, l’extrémité de la paroi de l’ookyste est dégradée à cause de l’action de plusieurs facteurs tels que : la température, les enzymes pancréatiques, les sels biliaires et le dioxyde de carbone (O’Donoghue, 1995), ce qui permet la libération de ces 4 sporozoites nus qui vont s’attacher à la surface apical des cellules épithéliale de l’intestin (Chen et al., 2002). Dans ce cas le parasite est en position extracytoplasmique mais intracellulaire et prend le nom de
8
«trophozoite », où ce dernier constitue une vacuole parasitophore qui joue un rôle important dans leur nutrition et leur attachement (Chen et al., 2000 )
La première multiplication est la multiplication asexuée (mérogonie ou schizogonie):
La première génération de cette reproduction est transformée du trophozoites, dit « mérontes » ou « schizontes » de type
I
qui vont libérer huit mérozoites de leurs vacuole parasitophore, ceux –ci envahissent les cellules épithéliales voisines pour pratiquer une nouvelle mérogonie et former des mérontes de typeII
qui contiennent quatre mérozoites , c’est la deuxième génération de cette reproduction. Mais, la première génération peut faire un recyclage de mérontes de typesI
, qui permet d’allonger la période d’excrétion (O’Donoghue, 1995).La deuxième multiplication est la multiplication sexuée (gamogonie) :
La forme capable de reproduction sexuée du parasite est : les mérozoites de type
II
qui vont se transformer pour devenir des gamétocytes, les microgamétocytes donnent des microgamétes mâles et les macrogamétocytes donnent des macrogamétes femelles, la fertilisation du macrogamétes femelles par les microgamétes mâles se fait dans les tractus intestinal afin de former des zygotes.Finalement la sporogonie se fait chez l’hôte : après la formation des zygotes, développés en ookyctes sporulés dans le tractus intestinale, contenant 4 sporozoites, une fois libérés, un autre cycle va redémarrer (Naciri, 1992 ; O’donoghue, 1995).
Les oocytes issus se différencient en deux catégories selon leur paroi (l’enveloppe kystique formé après la fertilisation) : 80% du oocystes possèdent une paroi épaisse qui assure leurs résistance dans l’environnement, et sont relâchés dans les selles représentent la forme responsable de la transmission d’un hôte à l’autre, et 20% du oocystes possèdent une paroi fine libèrent leurs sporozoites dans le tractus digestif, présentent la forme responsable du phénomène de auto-infection avec redémarrage d’un nouvel cycle de vie à l’intérieur du même hôte(Current et Garcies.,1991) .
9
La figure 1 représente les différentes étapes de cycle biologique du parasite Cryptosporidium :
10
3. Morphologie de parasite :
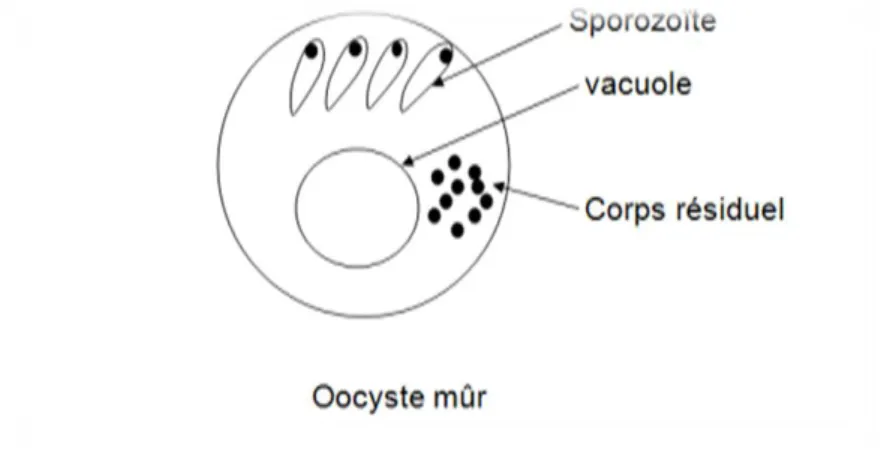
Les cryptosporidies sont retournes dans les selles sous formes d’oocystes sporulés murs arrondis ou ovalaires, de petite dimension varie à 2-6 um, contenant à l’intérieur 4 sporozoites, une vacuole parasitophore et un corps résiduelles, ces oocystes sont préservés par un enveloppe kistique )Khellaf ,2007 ).
La figure 02 représente la structure d’un oocyste de Cryptospridium.
Figure 2 : la structure d’oocyste )Khellaf ,2007 )
3-1 La Morphologie des différents stades parasitaires :
Dans les années 1980, la microscopie électronique a fait son apparition et a permis la différenciation des différents stades parasitaires et de préciser les caractères morphologiques de Cryptosporidium spp. )Valigurova et al., 2008(. Le tableau suivant représente la morphologie du parasite dans le cycle évolutif du parasite.
3 .1.1. Les oocystes
11
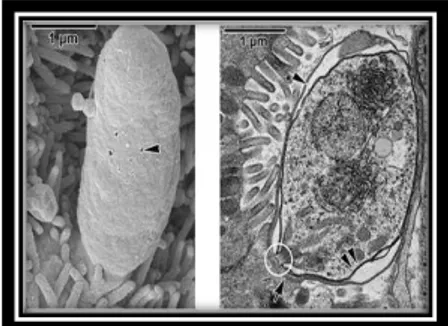
La figure 3 représente :
A : (o) Oocyste mature, (Ps) la vacuole parasitophore, (Fo) l’organelle nourricier).
B : Oocyte mature récolté dans les fèces.
Ils ont une forme sphérique à ovoïde et contiennent chacun quatre sporozoïtes, nus (sans sporocyste), libres agencés autour d’un corps résiduel granuleux très réfringent mesurant un micron de diamètre. Leur paroi est très résistante, elle leur permet une grande survie dans le milieu extérieur. Elle est composée de deux couches : la couche externe qui est composée d’une matrice polysaccharidique et la couche interne, qui est composée de glycoprotéines filamenteuses. (Fayer et Xiao, 2007).
3.1.2 Les sporozoïtes
Figure 4 présente la structure de sporozoites en microscope optique ( Valigurova et al., 2008).
Dont A et B : Sporozoïtes fixés à la cellule hôte, (mv)microvillosités.
Les sporozoites ont une forme de croissant, avec une partie postérieure arrondie, et renferment un noyau proéminent. Elle contienne un complexe d’organelles contenant des protéines essentielles. Parmi ces organelles on retrouve : des rhoptries, des micronèmes, des granules denses, un noyau, des ribosomes et des microtubules.. )Valigurova et al., 2008).
3.1.3 Les trophozoïtes
12
Figure 5 représente la structure de tropozoites en microscope optique ( Valigurova et
al.,2008).
A : Trophozoïte en maturation complètement enveloppé par la vacuole parasitophore.
B : Trophozoïte en maturation. Les flèches désignent la vacuole parasitophore et la présence d’un organelle nouricier (en bas à gauche).
Les trophozoïtes sont caractérisés par la présence d’un noyau unique de grande taille .
Le complexe apical observé chez les sporozoïtes n’est plus présent mais un organelle nourricier est bien développé à ce stade. )Valigurova et al., 2008).
3.1.4 Les mérontes et mérozoïtes de types I et II
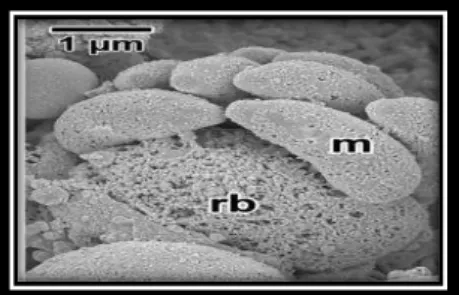
Figure 6 représente la structure de méronte et mérozoite des types I et II en microscope optique (Valigurova et al., 2008).
(m) : des mérozoïtes , ( rb) : corps résiduel.
Les mérozoïtes ont la même morphologie que les sporozoïtes. Leurs extrémités antérieure et postérieure sont arrondies. Ils contiennent un noyau et de nombreux granules denses. Le méronte est mature, il contient des mérozoïtes (m) qui bourgeonnent à partir du corps résiduel (rb). (Valigurova et al., 2008(Les deux types de mérontes mesurent entre 4 et 5 μ de diamètre. Les mérozoïtes de type I sont attachés à un corps résiduel par leur extrémité postérieure. Valigurova et al., 2008(
13
Fugure 7 représente la structure du macrogamonte en microscope optique (Valigurova et al ., 2008).
(fo) : l’organelle nourricier .
Les macrogamontes sont caractérisés par la présence de granules d’amylopectine qui les différencient des trophozoïtes. Ils ont une forme sphérique à ovoïde et une taille comprise
entre 4 et 6 μm . Il présente une vacuole et un grand noyau en position central (Valigurova et al., 2008(
3.1.6 Les microgamontes
Figure 8 représente la structure du microgamonte en microscope optique (Valigurova et al., 2008).
Les microgamontes ressemblent aux mérontes mais contiennent de plus petits noyaux.ils sont rarement observés du fait de leur vie brève. Ils renferment 14 à 16 microgamètes, ces microgamètes ont une forme allongée avec une extrémité antérieure aplatie.
Chaque microgamète se forme par une profusion nucléaire à la surface du gamonte. (Valigurova et al., 2008 (
4.Définition de la Cryptosporidiose :
La cryptosporidiose est une infection cosmopolite non spécifique(zoonose) (Naciri, 1992 ( parasitaire provoquée par un parasite intestinale, ubiquiste du genre Cryptosporidium, parasitant les épithéliums des voies digestives de l’homme et de nombreuses espèces animales.
14
Il existe deux types de la Cryptosporidiose selon l’hôte infectée : La cryptosporidiose humaine et la cryptosporidiose animale.
4.1.La Cryptosporidiose humaine :
Chez l'Homme, le parasite est principalement retrouvé dans le tractus intestinal. Néanmoins, des localisations autres que digestives sont rencontrées mais semblent être limitées chez les immunodéprimés )Meisel et al., 1976). L’espèce qui presque exclusivement responsable de l’infection chez l’humain, Cryptospridium parvum qui est un parasite se localisant dans la bordure microvillositaire des entérocytes et se développe dans une vacuole parasitophore (Okhuysen et Chappell, 2002).
4 .2. La Cryptosporidiose animale :
Chez les bovins, la description du premier cas d'infection par le Cryptosporidium associée avec une diarrhée chronique, a été détectée chez une génisse de huit mois. Depuis, de très nombreux rapports font état d'infection en particulier chez le veau dont l'âge est inférieur à trois semaines avec une morbidité élevée et une faible mortalité alors que chez les adultes l'infection asymptomatique semble prévaloir (O’donoghue, 1995).
5.Localisation du parasite ( Cryptosporidium) :
La position qui occupe le genre Cryptosporidium sp dans la cellule est une position intracellulaire mais extracytoplasmique, absolument une position unique (Tzipori et Griffiths,1998).
Les cryptosporidies semblent avoir une préférence pour l’iléon, mais les autres portions de l’intestin peuvent être atteintes (Tzipori et Griffiths,1998).
En effet, le parasite montre un préférence aux domes épithéliaux des plaques de l’iléon chez le veaux et le cobaye, (Chermette et Boufassa-Ouzrout,1988). Ainsi peuvent touchés l’épithélium des glandes annexes , du tractus respiratoire surtout chez les oiseaux , et les personnes immunodéprimés.(Chermette et Boufassa –Ouzrout,1988).
6. Epédimiologie de la Cryptosporidiose :
La cryptosporidiose a une distribution ubiquitaire et a été retrouvée dans une centaine de pays. La prévalence mondiale de la maladie est très variable. Elle diffère notamment en fonction des régions et de la population.
15
La Cryptosporidiose est responsables de 2 ,2 % (7 % chez les enfants) des cas de diarrhée chez les personnes immunocompétentes, mais de 14% (plage de 6 à 70%) chez les individus immunodéprimés (Chen et al., 2002).
Différentes épidémies ont été rapportées suite à des contaminations des eaux de distribution destinées à la consommation humaine. (Chen et al., 2002). Cependant, les enseignements qui peuvent être tirés sont limitées dans la mesure où d’une part des investigations prospectives sont rarement effectuées, et d’autre part la qualité du recueil rétrospectif des informations ne permet pas d’imputer l’origine de la contamination, de façon indiscutable à une cause précise (Chen et al., 2002).
6.1. Les
types d’épidémiologies :
Selon le mode de contamination il existe deux types d’épédimiologies de la Cryptosporidiose :
6.1.1. Les épidémies d’origine hydrique :
Ce type d’épidémie est particulièrement bien illustré par l’accident de Milwaukee (USA) survenu en 1993, consécutif à une modification du procédé de traitement de l’eau utilisée , (le rapport ne prend pas en compte les épidémies liées aux eaux de loisir ( piscine , lacs , …. ) , pour lesquelles un nombre importants d’épidémies a été rapporté dans plusieurs pays européens. (Chen et al., 2002).
6.1.2. Les épidémies liées aux aliments :
Les principaux aliments mis en cause dans des cryptosporidioses sont principalement : le lait et les crudités.
Dans toutes les situations rapportées, il est apparu un dysfonctionnement d’origine humaine dans la chaîne de traitement des aliments tel qu’une absence ou un défaut de pasteurisation des aliments (lait, jus de fruits), une absence de lavage des légumes, un manque d’hygiène du personnel de cuisine. S’agissant de la consommation spécifique de coquillages crus, un risque potentiel existe, bien qu’aucun cas humain de cryptosporidiose n’ait pu être rattaché de façon certaine à la consommation de tels produits. (Chen et al., 2002).
16
6.2.1 .Chez l’homme :
La sensibilité à l’infection dépend largement de l’âge et du statut immunitaire de l’individu. De nombreuses études montrent une plus grande sensibilité à la maladie chez les enfants (< 4 ans), les personnes âgées et les individus immunodéprimés (sidéens, greffés...) (Areeshi et al., 2008).
La prévalence la plus élevée est notée dans les pays en voie de développement qui peut s’expliquer par des conditions sanitaires médiocres (manque d’hygiène, mauvaise qualité de l’eau...). Il a également été montré, que selon les pays et les saisons, la prévalence pouvait varier. Celle-ci serait plus élevée pendant les mois les plus chauds et plus humides de l’année (Ripert et Guyot, 2003).
Il reste tout de même difficile d’évaluer la fréquence réelle de ce parasitisme dû à
Cryptosporidium spp de par l’existence d’humains excréteurs non malades (porteurs
asymptomatiques) (Ripert et Guyot, 2003).
6.2.2. Chez les bovins laitiers :
Une succession chronologique d’espèces fait intervenir les quatre principales espèces retrouvées chez les bovins : C. parvum qui est majoritairement présent chez les jeunes veaux non sevrés, C. ryanae et C. bovis qui sont retrouvés chez les jeunes animaux sevrés et C.
andersoni qui devient prépondérant chez les vaches adultes (Santín et al., 2004).
Plus récemment, il a été mis en évidence la présence de C. xiaoi (anciennement C.
bovis like genotype ou C.bovis ,chez les moutons), chez des chevrettes de moins de 21 jours
présentant de la diarrhée en Espagne (Díaz et al., 2010 ).
6.2.3. Chez les ovins :
Deux espèces principalement ont été identifié jusqu’à présent sont ;C. parvum et C.
ubiquitum . Des différences de prévalence pour ces deux espèces ont été observées selon les
études. En Europe (Espagne, Royaume-Uni et Italie), des auteurs ont rapporté la présence de
C. parvum chez des agneaux diarrhéiques ou non diarrhéiques (Quílez et al., 2008 ) , D’autres
auteurs ont rapporté la présence de C. ubiquitum chez l’agneau (Ryan et al., 2005 ( .
C. ubiquitum est l’espèce qui a également été majoritairement rapportée chez les ovins de tout
17
Enfin, en 2008 l’espèce C. hominis a été retrouvée de façon importante en Ecosse où 88 échantillons sur 255 récoltés ont été identifiés C. hominis en mono ou co-infection avec d’autres espèces de Cryptosporidium chez des agneaux agés de plus de 4 mois (Quílez et al., 2008).
6.3. Epidémiologie mondiale
Dans les pays industrialisés, la cryptosporidiose est responsable d’environ 2% des cas de diarrhée chez les personnes immunocompétentes (7% chez les enfants). Elle est de 14% en moyenne (intervalle de 6 à 70%) chez les individus immunodéprimés par le VIH, qui sont infectés de manière sporadique (Chen XM et al., 2002). La prévalence est globalement plus importante dans les pays en développement, au vu des conditions environnementales et d’hygiène générale. Elle est de 6% en moyenne (intervalle de 1,4% à 41%), et 12% plus spécifiquement chez les enfants. Les patients immunodéprimés sont nettement plus touchés (24%) (Chen XM et al., 2002 ).
Au sein de cette distribution générale, la tranche d’âge la plus touchée est celle des enfants âgées de 0 à 4 ans.
Enfin, la distribution des espèces varie selon la région du globe et les sujets atteints
( Xiao L.2010 ). C. hominis et C. parvum sont majoritaires et retrouvés en même proportion en Europe, tandis qu’ailleurs et surtout dans les pays en développement, C. hominis prédomine.
C. parvum est néanmoins plus souvent retrouvé au Moyen-Orient, et généralement plus
dans les zones rurales qu’urbaines (présence d’animaux qui favorise la transmission zoonotique).
Selon les études, l’espèce prédominante chez les enfants varie, sauf chez les moins d’1 an où
C. hominis serait reconnu comme le plus fréquent.
Les espèces autres que hominis et parvum sont le plus souvent retrouvées chez les immunodéprimés.
7 Epidémiologie analytique
7.1. Source de parasite :18
Les sources d’ookystes sont les animaux excréteurs, ayant présentés ou non des
symptômes. La contamination des chiots en bas-âge est due au léchage des mamelles, flancs
ou périnée de la mère excrétrice, mais aussi par l’environnement, l’eau et l’alimentation (Barr 1997 ; Derouin et al., 2002).
La période patente de C. parvum chez le chien dure entre 3 et 33 jours
les oocystes excrétés provoquant alors la contamination de l’environnement. Aucune durée spécifique à C. canis n’est connue à l’heure actuelle (Derouin et al., 2002)..
7.2. Réceptivité et sensibilité :
La majorité des cas décrits intéresse des chiens jeunes, âgés de moins d’un an. Des
cryptosporidioses ont cependant été décrites chez des animaux âgés, dont les examens
para cliniques permettaient de conclure à une immunodépression.
Les animaux, immunodéprimés et atteints d’une affection intercurrente (campylobactériose, salmonellose, giardiose présentent des symptômes exacerbés. (Barr ,1997)
7.2. 1. Espèce :
La cryptosporidiose infecte un très grand nombre d’espèces animale aussi bien domestique que sauvages (rongeurs, cervidés) ( Charter et Paradus , 2010 ) .. Tous les Ruminants peuvent héberger et excréter des oocystes. Parmi les ruminants qui représentent le plus grand groupe d’espèces concernées par la cryptosporidiose, le chevreau est le plus sensible à l’infection par C. parvum , suivis des bovin et des ovins (Charter et Paradus , 2010) .
7.2. 2.Age
De la même manière, chez les petits ruminants la prévalence de la cryptosporidiose varie selon l’âge des animaux, elle est plus élevée chez les jeunes que chez les adultes. La cryptosporidiose est essentiellement une maladie du nouveau-né, La plupart des cas cliniques se produisent entre l’âge de 5 et 15 jours chez les veaux. Chez les adultes, la maladie est généralement asymptomatique (Paradus et al., 2012 ).
19
7.2.3.Race
En ce qui concerne les Ruminants, les différences de prévalence de la maladie entre les races allaitantes et les races laitières seraient dues à des différences dans le mode d’élevage de celles-ci, les races allaitantes étant élevées sur un mode extensif seraient ainsi moins sensibles au parasite (Manent-Manent, 2014).
7.2 .4 . Etat immunitaire :
Comme chez l’homme, le parasite s’installe plus facilement chez l’animal sur un terrain immunodéprimé. Chez le cheval, le premier cas de cryptosporidiose a été décrit chez un poulain immunodéprimé (Paradus et al., 2012 ). La pression d’infection augmente dans le milieu ambiant au moment où les agneaux sont les plus vulnérables. Chez les bovins, il n’y a pas d’augmentation de l’excrétion autour de la mise-bas (Paradus et al ., 2012 ).
7.3. Résistance des parasites
Les ookystes de cryptosporidies sont extrêmement résistants dans l’environnement,
Jusqu’à plusieurs mois dans l’eau, les matières fécales et l’eau de mer (Derouin et al. 2002)
pour une température comprise entre 0°C et 30°C. Seule une exposition à des températures élevées (1 minute à 72°C ou 5 minutes à 64°C) (Lindsay et Zajac 2004), (Derouin et al., 2002) ou un contact prolongé à de l’ammoniaque 5% ou du formol 10% ( Barr 1997, Derouin
et al., 2002) détruisent les oocystes. La résistance des oocystes dans l’environnement est
importante. Les ookystes sont viables entre 0°C et 30°C durant plusieurs mois dans l’environnement (eau, matières fécales, eau de mer) ( Derouin et al., 2002).
8. Le mode de contamination :
L’infection à Cryptosporidium résulte d’une exposition directe (d’un animal à animal, d’un animal à l’homme ou de l’homme à l’homme) ou indirecte (par ingestion d’eau contaminée, ingestion de nourritures contaminé ou l’air contaminé ( Fayer et al., 2000, Diaz et al., 2001).
Les infections à Cryptospridium se transmettent par :
20
contact avec des hôtes infectés (AFSSA, 2002).
l’ingestion d’oocystes de ce parasite (Daignault, 2007 ( .
Consommation d’eau souillée (Salven, 1955).
voie féco-orale (Daignault, 2007).
Les oiseaux peuvent consommer et transporter des œufs même s’ils ne sont pas sensibles à l’infection ou sécrétant les œufs dans leurs excréments (Fayer et al., 1997b) .
Insectes exposés aux excréments de vache qui contiennent des œufs sur leurs surfaces extérieures ainsi que dans le tractus intestinal (Fayer et al., 1997b) .
par contact direct avec des animaux ou par consommations de souillés (comme l’eau) (Daignault, 2007).
9 Les Symptômes :
9.1 Pour l’animal :
Cette maladie affecte les vaches et les bovins de manière significative et la période d’incubation du Cryptospridium est comprise entre 10 et 14 jours ) Villeneuve, 2003( et est généralement sans symptômes pour les adultes ) Ouchene et
al 2012(, mais chez les jeunes âgés l’incubation dure 13 à 14 jours et les symptômes
sont clairs tels que:
Une diarrhée profuse à couleur jaune (Figure 3) pâle et ayant un odeur désagréable. (O’Donoghue, 5991 . (
Diarrhées néonatales graves, souvent mortelles. (Naciri, 1992)
La déshydratation, la perte d’appétit et, en conséquence, la perte de poids (Daignault, 2007)
Des fasciculations musculaires des membres et de dépression ) Villeneuve, 2003 (
21
Figure4:
Arrière-train souillé d'un chevreau atteint de cryptosporidiose (Barkat, 2017).9.2 Pour l’homme :
La contamination par ce parasite est plus beaucoup observée chez les sujets de bas âge et les personnes âgées et les personnes présentant une immunodéficience.
Chez ces personnes, la propagation de ce parasite affecte le pancréas, les canaux biliaires et le système respiratoire. Ainsi que les intestins conduisant à un changement de leur structure tissulaire ainsi qui une atrophie des synapses qui semblent plus courtes et plus larges et affecte également les cellules intestinales conduisant à la perte de microvesis, la création d’un grand vide dans le cytoplasme et le gonflement des mitochondries. Ils causent également des perturbations dans l’absorption des nutriments tels que le glucose et la vitamine B12, (Dambrine, 2001), Ce parasite provoque également la diarrhée de 17 litres par jour, causant la déshydratation, qui entraîne la mort (Naciri, 1992).
10. Le diagnostic :
Afin de déterminer le facteur responsable des signes cliniques pour les animaux et les humains, les techniques de laboratoire sont le moyen le plus efficace de confirmer cette maladie en prélevant des échantillons d’excréments et peuvent être prélevés sur le rectum ou le sol contenant les œufs de ce parasite (Royer ,2015)
.
On peut également effectuer des recherches par des biopsies duodénales, dans le liquide biliaire voire dans les expectorations induites et les lavages broncho alvéolaires en cas de suspicion de localisation broncho-pulmonaire (Guyot et al., 2012).Les techniques de diagnostic et de recherche de Cryptosporidium peuvent comprendre :
22
L’échantillon est observé directement au microscope, à l'état frais mais il est recommandé d'effectuer des colorations qui rendant l'observation plus facile. (O’Donoghue, 1995).
10.2. Les méthodes de concentration :
Cette technique est utilisée lorsqu’il y a une faible concentration d’œufs après l’extraction de granules de Cryptospordium suivi par le processus de suspension des excréments et l’ablation des gros corps (Anofel, 2014).
10.3. Les méthodes de coloration
La recherche des œufs de Cryptosporidium est réalisée par plusieurs techniques de coloration dont les plus utilisées sont les suivantes :
10.3.1. Méthode de Henriksen modifiée, aussi appelée Ziehl-Neelsen modifiée (1981) : La coloration de Ziehl-Neelsen conduit à une coloration des oocystes en rose fuschine )Figure 6(, bien visible après contre coloration en vert ou en bleu. Les oocystes ont une forme arrondie avec une paroi épaisse et un contenu granuleux, leur taille est de 5 à 8 microns suivant les espèces. (Anofel, 2014)
10.3.2. Méthode de Heine :
Les oocystes apparaissent brillants sur un fond rouge et plus sombre (Current, 1991).
10.3.3. les biopsies :
Les œufs peuvent être trouvés par un examen tissulaire des biopsies intestinales après une coloration à l’hématoxyline. Cet examen permet de voir les parasites en cours de leur multiplication dans les entérocytes (O’Donoghue, 1995).
10.3.4. La fluorescence :
Des fluorochromes, tels que l’auramine-rhodamine (Figure 5) et l’auraminecarbol-fuchsine, peuvent également être utilisés, ils sont très sensibles mais demeurent coûteux. (O’Donoghue, 1995) .
23
Figure5: Coloration d’oocyste de Cryptosporidium à l’auramine-rhodamine (Hezla, 2018).
Figure6: Coloration d’oocyste de Cryptosporidium à la fuschine) Hezla ,2018). 10.4. Les méthodes d’immunomarquage :
La technique d’immunomarquage nous permet de détecter les œufs dans l’échantillon à l’aide d’un anticorps de la réaction antigènes qui reconnait l’antigène de surface des œufs en utilisant d’anticorps polyclonaux fluorescents (Fayer et al., 2000).
Figure7: Des oocystes de Cryptosporidium révélés par des anticorps immunofluorescents. (Hezla, 2018)
10.5. Diagnostic de biologie moléculaire :
Le parasite est détecté par une technique PCR qui aide à identifier la maladie à ses premiers stades en amplifiant l’ADN parasite du modèle génétique.
24
(fayer et al,. 2000).
11. Le Traitement des cryptosporidies :
Lorsque la maladie se déclare, l’utilisation traitements médicaux spécifiques suite à ou des symptômes permet de réduire la mortalité et la morbidité ainsi que la sécrétion ovules.
11.1 Pour l’homme :
À l’heure actuelle, il n’existe aucun remède efficace pour cette maladie. Beaucoup de molécules ont une efficacité partielle et ne peuvent pas éliminer complètement le parasite (Guyot et al. 2012).Car il s’est avéré être une maladie auto-spécifique chez les personnes ayant une immunité. (Crockett et Haas, 1997).
Parmi les traitements, nous mentionnons :
11.1.1.Le nitazoxanide:
Il s’est avéré bénéfique pour le traitement, en particulier chez les patients immunodéficiés, à une diminution de la diarrhée de 80 à 90% des cas et les doses proposées sont (Guyot et al., 2012) :
Dose adulte 500 mg deux fois par jour pendant 3 jours. Posologie pédiatrique.
1-3 ans: 100 mg deux fois par jour pendant 3 jours.
4-11 ans: 200 mg deux fois par jour pendant 3 jours. (Derouin, 2010)
11.1.2. La paromomycine
Ce médicament inhibe le développement du parasite et assure également la réponse immunitaire tout au long du traitement et la dose de 100 mg est recommandé de prendre une ou deux fois par jour (Derouin, 2010).
11.2 Pour l’animal :
Il n’existe pas de remède convaincant cette maladie l’animal cependant de nombreuses molécules ont été suggérées (Khelef, 2007) :
25
11.2.5. Le lactate d’halofuginone :
Il s’agit d’une molécule artificielle appartenant à des quinazolinones connues pour leurs activités anti-maladies. La dose à utiliser est de 100 à 120 µg/kg de poids vif une fois par jour, soit 2 ml d’halocur par 10 kg de poids vif pendant sept jours consécutifs, par voie orale. (Khelef, 2007).
Le lactate d’halofuginone atténue les signes cliniques de diarrhée et réduit l’excrétion des oocystes et le risque de mortalité. Ce produit ne détruira pas toutes les cryptosporidies infectant l’animal, mais limitera leur multiplication (Morin, 2002).
11.2.2 .Le sulfate de paromomycine :
Cette molécule est un antibiotique aminoside, Il a été testé sur les veaux. Elle a diminué l’intensité de la diarrhée et le nombre d’oocystes excrété par ces derniers en leurs administrant une dose variant de 25 à 100mg/kg/j pendant 11 jours. (Khelef, 2007)
11.2.3. Le lasaloside:
C’est un antibiotique ionophore à activité anticoccidienne. Cette molécule a empêché ou supprimé les manifestations cliniques de l’infection. Toutefois, une dizaine de jours après l’arrêt du traitement, l’infection s’est redéclarée. La dose curative utilisée est de 3 à 5 mg /kg/j par voie orale pendant 3 jours. (Morin, 2002)
Le traitement correctionnel est également très important en :
a) Traitement de la déshydratation par liquide oral ou intraveineux. b) Gestion des protecteurs de muqueuses (Villeneuve, 2003).
a) L’utilisation d’antibiotiques pour lutter contre les maladies d’origine bactérienne ou par des infections bactériennes secondaires (Shahiduzzaman et Daugschies, 2012).
12. La Prévention :
Afin de réduire le risque de transmission, plusieurs mesures préventives devraient être prises en considération.
12.1 Pour l’homme :
Les individus, en particulier ceux qui souffrent d’immunodéficience, devraient éviter toutes les causes d’infection :
26
Se laver les mains avec l’eau savonneuse (superviser le lavage des mains des enfants) :
après usage des sanitaires ou après changement de leurs couches.
après un contact avec des animaux ou après nettoyage de leurs excréments.
après un contact avec des objets souillés tels que des chaussures qui peuvent être contaminées avec des matières fécales avant de manger, de préparer ou de servir de la nourriture. )Derouin,2010(
Eviter de boire de l’eau non traitée provenant de lacs, rivières ou toute autre surface d’eau à cause d’une possible contamination par du fumier, peler et rincer tous les fruits légumes ou végétaux qui peuvent être mangés crus .
Éviter le contact avec des animaux susceptibles d’être contaminés (jeunes veaux) (Guyot et al., 2012).
12.2 Pour l’animal :
La protection des animaux contre le risque d’infection implique plusieurs mesures sanitaires et préventives.
La désinfection des bergeries, avec l’ammoniac 5 et 10 %, l’eau oxygénée à 3% ou le formol à 10%. (Naciri ,1992)
1) Les animaux doivent être limités pour réduire le contact entre eux.
2) Eviter d’introduire des animaux d’une ferme avec l’état de santé inconnu. (De Graaf et al., 1995).
3) Eviter le mélange d’animaux de différents groupes d’âge (Bourgouin ,1996) 4) Isoler les animaux malades des animaux en bonne santé.
5) Placer les animaux nouveau-nés dans un environnement propre et peu fréquenté (Quilez et al., 1995).
27
Partie pratique
28
1.Matériel et Méthode
1.1. Présentation de la région d’étude :
Cette étude a été réalisée sur les eaux des différentes localités de la wilaya de Guelma,
1.1.1. Présentation des stations d’échantillonnage :
• Ain ReggadaAin Reggada est une commune de Daira d’ Oued Zenati, situé à une l’altitude de 731m et le nombre d’habitants est 7688. caractérise par un climat méditerranéen. La distance entre Ain Reggada et le chef-lieu de wilaya est 51Km.
• Ain Makhlouf :
La municipalité d’Aïn Makhlouf est l’une des communes de Guelma. Situé à environ 55 kilomètres du le chef-lieu de wilaya, l’altitude 838m et le nombre d’habitants 12300.Caractérisé par un climat méditerranéen il a un emplacement économique et stratégique.
Bouhachana :
La commune de Bouhachana se trouvant à une altitude de 847m et connue par une population de 5596 habitants.
Le région se caractérise par des activités agricoles surtout basées sur l’élevage des bovins, ovins et même caprins .
2 .Matériel utilisé :
2.1. Matériel biologique :
Notre matériel biologique est exclusivement les eaux des surfaces (l’eau des lacs (l’eau de boisson des animaux) et l’eau de robinet…)
2.2. Matériels de laboratoire
- Les lames- Les lamelles - Les boites
- Les tubes coniques à centrifuger. - Portoir
Partie pratique
29
- Pinces - Bêcher - L’eau physiologique - Micropipette - L’huile à immersion- Les filtres de 0.45µm de porosité - Les réactifs :
Méthanol pur.
Fuchsine phéniquée.
Vert malachite à 5% :5g vert malachite + 100ml eau distillé.
Acide sulfurique à 2% :2ml d’acide sulfurique + 98ml d’eau distillé. - appareillage :
La rampe de filtration La centrifugeuse Microscope optique
2.3. Matériel de prélèvement :
-Des bouteilles en verre stérilisés.-Glacière pour le transport des échantillons.
3. méthodes utilisées :
3. 1 .Technique de filtration de l’eau (Ouchene, 2008) (annexe 1)
1- Déposer les filtres de 0,45µm de porosité dans la rampe de filtration. 2- Faire fonctionner à appareil pour filtrer l’eau.
2- Récupérer les filtres et les déposer dans une boite de Pétri. 3- Laver les filtres avec de l’eau physiologique dans un bêcher. 4- Verser le contenu du bêcher dans un tube à centrifugation. 5- Centrifuger à 2500 tours/minute pendant 5 minutes. 6- Récupérer le culot.
7- Confectionner un frottis à partir du culot.
Partie pratique
30
3.2. Technique de coloration de Ziehl-Neelsen modifiée par Henriksen et
Pohlenz :(Henriksen et Pohlenz, 1981) (Guillaume, 2007 ;Belkaid et al.,
1992)
C’est une technique spécifique pour la coloration des oocystes de Cryptosporidium sp. (Annexe 2).
Confection du frottis : On dépose sur une lame bien à l’aide de pipette pasteur, une goutte du culot de centrifugation
1- Laisser le frottis sécher à l’air libre.
2- Fixer le frottis par le méthanol pendant 5 minutes. 3- Sécher de nouveau.
4- Colorer la lame dans un bain de fuchsine phéniquée pendant 1 heure. 5- Rinçage sous l’eau du robinet.
6- Différencier avec l’acide sulfurique à 2 % pendant 20 secondes. 7- Rincer sous l’eau du robinet.
8- Colorer par le vert malachite à 5% pendant 5 minutes. 9- Rincer de nouveau.
10- Sécher à l’air libre.
Observation microscopique : La lecture du frottis coloré se fait au microscope optique au grossissement ×40 puis ×100 (avec l’huile). La lecture doit se faire sur toute la surface de la lame. (annexe 3)
Le diagnostic est dit positif, quand les oocystes de Cryptosporidium sp. apparaissent en rouge-vif sur un fond vert (vert malachite), ils se présentent sous forme d’éléments arrondis de 5 à 8 µm de diamètre et renfermant de grosses granulations noirâtres (Belkaid et al., 1992). Il est dit négatif quand aucun oocyste n’est visualisé après observation de 100 champs microscopiques (Khelef et al., 2007).
4.Les Résultats et interprétations:
Nons avons collecté plusieurs échantillons de l’eau de plusieurs points dans des bouteilles bien stérilisés, de trois régions de la wilaya de Guelma.
Partie pratique
Partie pratique
32
1_Les résultats concernant la région de Ain Makhlouf Tableau 2 : Les différentes stations de Ain Makhlouf
La région Position
d’eau Date du prélèvement Date d’analyse La photo
Présente / Absence Ain M ak h lou f Tafira 29/02/2020 01/03/2020 (-) Ain El Grezza 29/02/2020 01/03/2020 (+) Ain El Blad 29/02/2020 02/03/2020 (-) Ain El Hamra 28/02/2020 02/03/2020 (+)
Partie pratique
33
Ain K Saille 29/02/2020 02/03/2020 (-) Djnane Morsal 29/02/2020 03/03/2020 (-) Ain Houche 29/02/2020 03/03/2020 (-) Ain Rahmoni 29/02/2020 03/03/2020 (-) El mraydiya 29/02/2020 01/03/2020 (-)Partie pratique
34
Mdjaz EL Bagar 29/02/2020 01/03/2020 (-) Ain Maamar 04/03/2020 09/03/2020 (+) Ain Mahmoudi 04/03/2020 09/03/2020 (+)Dans la région de Ain Makhlouf nous avons collectés 12 échantillons issus de différents origines. L’analyse de laboratoire de détecter la présence de C .parvum dans Ain Elgrazza, Ain El Hamra, Ain Maamar et Ain Mahmoudi.
Partie pratique
35
2. Les résultats concernant la région d’Ain Raggada Tableau3 : Les différents stations d’Ain Raggada .
Ain Ragada Oued Hdjar El Mrakab 27/02/2020 01/03/2020 (-) Ain Chawech 29/02/2020 02/03/2020 (-) Ain Goumiya 28/02/2020 03/03/2020 (-) Salawa Anona 08/03/2020 09/03/2020 (-) Oued EL Dyaba 29/02/2020 02/03/2020 (-)
Partie pratique
36
Oued Kaf
Hmama 28/02/2020 03/03/2020 (-)
Ain El Firma 27/02/2020 01/03/2020 (+)
Partie pratique
37
3 .Les résultats concernant la région de Bouhachana Tableau 4 : Les différentes stations de Bouhachana
B ou h ac h an a Ain Souda 27/02/2020 01/03/2020 (-) Ain Marzoug 04/03/2020 09/03/2020 (+) Rass Elma 28/02/2020 01/03/2020 (-) Ain Ktoun 29/02/2020 02/03/2020 (-)
Partie pratique
38
_ La présence d’oocyste de C .parvum dans l’eau d’Ain marzoug.
Ain Awicha 27/02/2020 01/03/2020 (-)
39
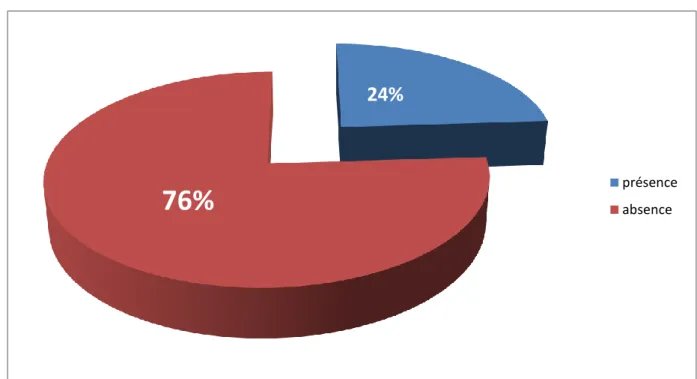
Globalement l’analyse de 25 échanillons issus des trois régions d’étude nous a permis de détecter la contamination de 6 échantillons, représentant 24% du total des prélèvements (figure8).
Les stations de la région d’Ain Makhlouf sont plus touchés, comparativement à cette d’Ain Reggada et Bouhachana .
Figure 8 :
contamination des eaux des régions d’étude par le Cryptosporidium.présence absence
24%
40
41
Conclusion
Le parasite du genre Cryptosporidium est à l’origine d’une infection intestinale chez les animaux et chez les humains à travers le monde. L’infection par ce parasite touche en particulier les jeunes enfants et les patients immunodéprimés, que les sujets sains.
Basé dans notre étude sur le concept de la maladie de la Cryptosporidiose et les facteurs qui se préparent à l’infection nous avons analysé 25 prélèvements d’eau (sources d’eau, étangs) de différentes régions de la wilaya de Guelma qui sont respectivement Ain Makhlouf, Ain Reggada et Bouhachana, pour détecter la présence ou l’absence des oocystes de Cryptosporidium en effet, sur les 25 prélèvements effectue, nous avons enregistré un pourcentage de 24% de contamination par rapport aux autres échantillons. La comparaison entre les trois régions montre que la région d’Ain Makhlouf plus touché par C.parvum que les deux autres régions, à savoir Ain Reggada et Bouhachana
Le parasite est caractérisé par la haute résistance aux conditions environnementales et même divers désinfectants, rendant son élimination complètement difficile, et traduit par l’absence de vaccin et de traitement efficace spécifique, ce qui oblige les responsables de secteur sanitaire aussi bien humain que vétérinaire de suivre les mesures préventives et sanitaires nécessaires, afin de préserver les eaux de surface de bonne qualité .
42
43
Références
Fssa. )2002( .Rapport d’expertise sur les infections à protozoaires liées aux aliments et à l’eau : évaluation scientifique des risques associés à Cryptosporidium
sp. 185 pp
Anderson BC. Most heat inactivation of Cryptosporidium sp. Am J Pub Health (1985) ; 75 : 1433-4.
Areeshi, M., Dove, W., Papaventsis, D., Gatei, W., Combe, P., Grosjean, P., Leatherbarrow, H., Hart, C.A. (2008).Cryptosporidium species causing acute diarrhea in children in Antananarivo, Madagascar. Ann. Trop. Med. Parasitol. 102, 309-315
Anofel. (2014). Amoebose, Polycopié national. Université Médicale Virtuelle Francophone, Paris, p30.
Appelbee A.J., Thompson R.C.A., Olson M.E., (2005).Giardia and Cryptosporidium in mammalian wildlife-current status & future needs, Trends in parasit.,21(8),370-376.
ARR F. (1997) Cryptosporidiosis.J. Small Anim. Pract., 38 (7) : 319-320. BARKAT Mohamed Ayoub, BENAKOUCHE Nabila. (2017). Enquête sur la cryptosporidiose des ruminants par Questionnaire auprès des vétérinaire dans région de Centre. UNIVERSITE SAAD DAHLEB DE BLIDA des Sciences Vétérinaire s. p 28
Belkaid, Tabet Derraz, Zenaidi, Hamrioui. (1992). Cours De Parasitologie (Tome Protozooses). Office des publications universitaires. Alger.192-205.p244.
Bonnina., Camerlynck P . (1992) Cryptosporidies-cryptosporidioses Edition techniques-encycle. Med. Chir. (Paris, France), maladies infectieuses 8-501-A-10.; 6 p.
Bonnina A, Camerlynck P (1989). Cryptosporidiose humaine - Aspects épidémiologiques et cliniques. Méd. Maladies Infect. 19, 35-41.
Bourgouin H. (1996). « La place de la cryptosporidiose dans les maladies néonatales du Veau en Correze ». Bulletin des GTV, n° 2. 19-41.
A
44
urrent WL, Garcia LS. Criptosporidiosis. Clin. Microbiol. Rev. 1991 ; 4 (3) :325-58
CROCKETT C.S & HAAS C-N. (1997). Understanding protozoa in your
Watershed. J. Am. Water Works Assoc., 89: 62- 73.
Chen XM, Keithly JS, Paya CV.)2002), LaRusso NF. Cryptosporidiosis. N.EngI.J .Med.346(22): 1723-31
Chermette R. ET BOUFASSA-OUZROUT S.(1988). Cryptosporidiosis -A Cosmopolitan Disease in Animals and Man. Vet. Parasitology, 35 : 179-182
Campbell I, Tzipori AS, Hutchison G, Angus KW. (1982);Effect of disinfectants on
survival of Cryptosporidium oocysts. Vet.Rec. 111 (18):414-5.
CHARTIER C, PARAUD C (2010). La cryptosporidiose des ruminants. Bull. GTV, 52, 83-92.
aignault, P. A. (2007). Ce qu’il faut savoir de la cryptosporidiose .Médecine Vétérinaire.44 _45.
D’ambrine. G (2001), Rôle de l’interféron-γ dans la réponse immunitaire mucosale à l’infection par Cryptosporidium parvum chez la souris. UNIVERSITE FRANÇOIS RABELAIS TOURS p 9_10
De Graaf, D.C., Vanopden bosch, E., Ortega. Mora, L.M., Abbassi, H., Peeters, J.E.(1999).<<A review of the importance of cryptosporidiosis in farm animals>> .Int J Parasitol 29, 1269.1287.
DEROUIN F., ELIASZEWICZ M., POUILLOT R., ROZE S. (2002) Rapport sur les « Infections à protozoaires liées aux aliments et à l’eau » : « Evaluation scientifique des risques associés à Cryptosporidium sp. » AFSSA [http://www.afssa.fr/Documents/EAUX-Ra-
Crypto.pdf] (consulté le 13 novembre)