HAL Id: tel-01124122
https://tel.archives-ouvertes.fr/tel-01124122
Submitted on 6 Mar 2015
HAL is a multi-disciplinary open access
archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Zeina El Ali
To cite this version:
Zeina El Ali. Rôle du facteur de transcription Nrf2 dans le contrôle de l’allergie cutanée en réponse aux molécules allergisantes. Allergologie. Université Paris Sud - Paris XI, 2013. Français. �NNT : 2013PA114847�. �tel-01124122�
ECOLE DOCTORALE :
INNOVATION THÉRAPEUTIQUE : DU FONDAMENTAL À L’APPLIQUÉ
PÔLE : PHARMACOLOGIE ET TOXICOLOGIE
DISCIPLINE : TOXICOLOGIE
ANNÉE 2013-2014 SÉRIE DOCTORAT N° 1233
THÈSE DE DOCTORAT
S
OUTENUE LE 12 DÉCEMBRE 2013Pour l'obtention du grade de
DOCTEUR DE L'UNIVERSITE PARIS-SUD
PARZEINA EL ALI
RÔLE DU FACTEUR DE TRANSCRIPTION NRF2 DANS LE CONTRÔLE DE
L'ALLERGIE CUTANÉE EN RÉPONSE AUX MOLÉCULES CHIMIQUES
Composition du jury :
Prof. Saadia KERDINE-RÖMER Directrice de thèse Professeur des Universités - INSERM UMR-S 996 Université Paris-Sud
Prof. Françoise PONS Rapporteur Professeur des Universités – CNRS UMR 7199
Université de Strasbourg
Dr Bertrand DUBOIS Rapporteur Chargé de recherche (CR1) – INSERM UMR 1052,
CNRS 5286
Prof. Marcel BONAY Examinateur Professeur des Universités – EA 4497
Université de Versailles Saint-Quentin Praticien Hospitalier - Hôpital Ambroise Paré
Prof. Stefan MARTIN Examinateur Professeur des Universités
Universitätsklinikum für Dermatologie und Venerologie, Freiburg - Allemagne
Prof. Oliver NÜSSE Examinateur Professeur des Universités – INSERM UMR-S 757
3
Cette thèse est dédiée
A celle qui nous a quittés tôt cette année et dont je regrette son absence ! A ma chère petite sœur Imane qui me manque beaucoup !
Que ton âme repose en paix !
A celle qui m'a toujours entourée par son affection, sa tendresse, son amour et ses prières, celle qui m'a toujours conseillée, soutenue et encouragée aux moments les plus difficiles, ma très chère maman Salwa A celui qui est toujours fier de moi, n'arrête pas de m'encourager et qui a
hâte que je rentre au Liban, mon cher papa Abed El Kader A celle qui, malgré parfois nos mésententes, m'a toujours encouragée,
soutenue et pensé à moi, ma chère sœur Samar
A celui qui, malgré les distances qui nous séparent était toujours proche de moi, celui qui m'a toujours encouragée, mon cher frère Ayman
A celle à qui je dois tout ce que suis professionnellement, celle qui m'a poussée à continuer en Thèse, celle qui pense toujours à moi, celle qui malgré son exigence sait ce qui est le meilleur pour moi, celle qui était toujours proche de moi et m'a entourée par sa tendresse et son affection, à celle qui va me manquer beaucoup après mon départ, ma chère directrice
de Thèse (et elle sait ce qu'elle représente aussi pour moi !), ma précieuse Saadia
A celle qui a été toujours là pour me conseiller, me soutenir et m'encourager, mon amie Rafah
A tous ceux qui m'ont soutenue et pensé à moi de près ou de loin Que ce modeste travail soit l'expression de mon affection et de ma reconnaissance pour vos conseils, votre patience, votre amour et vos
prières
7
oilà quatres années de thèse qui s’achèvent et il est temps de faire le bilan, un bilan aussi bien professionnel qu’humain. Une thèse représente, certes, quatres années de travail de recherche mais aussi un travail d'équipe et de collaboration contribuant à la réussite de ce travail. Cette étape finale de rédaction qui clôt le chapitre entrepris 4 ans auparavant pourrait paraître de loin la plus facile. Mais Non ! C’est quand il s’agit de mettre sur papier ses remerciements qu'on se rend compte de toute la difficulté que cela représente.
Je tiens tout d'abord à remercier le Prof. Françoise Pons et le Dr Bertrand Dubois de m'avoir fait l'honneur d'être rapporteurs pour l'évaluation de ce travail de thèse. Je tiens également à remercier les Prof. Marcel Bonay, Stefan F. Martin et Oliver Nüsse d'avoir acceptés de juger mon travail en faisant partie de mon jury de thèse.
Mes profonds et sincères remerciements vont à ma trèse chère directrice de thèse le Prof. Saadia Kerdine-Römer. Quoi te dire ma Saadia ? Le mot MERCI ne suffit pas pour exprimer toute la reconnaissance et la gratitude que j'ai envers toi, pour tout ce que tu as fait et tu fais pour moi ! Merci de m'avoir guidée depuis mon arrivée en Master 2. Merci de m'avoir formée et initiée au monde de la cellule dendritique. Merci pour ton appui, tes conseils et tes encouragements qui m'ont été précieux pour la réalisation de ce travail. Merci pour ta confiance, ton optimisme, ta bonne humeur, ton affection si maternelle, ton enthousiasme et ta motivation qui m'ont toujours impressionnée. Merci d'avoir toujours trouvé du temps pour moi malgré ton temps hyper chargé. Merci, parfois, pour ton exigence qui m'a poussée à être plus curieuse scientifiquement. Merci de m'avoir appris la rigueur, la précision et les mots français que je ne connaissais pas. Merci pour TOUS les moments passés et partagés ensemble. Merci pour nos discussions scientifiques et non scientifiques au moment des repas. Merci de partager avec moi les moments les plus difficiles de cette année sur le niveau personnel et professionnel, et surtout de m'avoir soutenue, cela m'a profondément touchée. Merci pour tout le temps et les weekends consacrés à 'moi', pour toutes les corrections de ma thèse. Je sais que ce n'était pas facile pour nous deux la période de la rédaction mais nous avons réussi ensemble d'être dans les temps pour finir ! Et, je n'oublie pas de te remercier pour la table que tu m'as prêtée sans laquelle j'aurais eu du mal à rédiger … ma thèse ! Bref, MERCI pour TOUT ! Je tiens également à te dire que je suis contente de rester avec toi encore pour un petit moment après ma thèse pour avancer sur notre intérêt commun "Nrf2". Grâce à
8
toi, je sors de cette thèse plus mûre et plus autonome. Enfin, le reste, tu le sais et c'est entre nous !
Je remercie également le Prof. Marc Pallardy de m'avoir accueillie au sein de son équipe de recherche. Merci pour la confiance que tu m'as accordée même avant mon arrivée en France. Je tiens également à te remercier chaleureusement pour ta visite chez nous au Liban qui a été si précieuse pour ma famille et moi au moment le plus difficile. Merci encore !
Merci à Rafah, ma chère amie libanaise, qui a partagé avec moi, depuis le début de ma thèse, les pires et les meilleurs moments tout au long de ces quatre ans. Merci pour tes encouragements et tes conseils. Merci d'être toujours là pour m'écouter et me soutenir. C'est un peu grâce à toi que j'ai commencé à grandir et mûrir à partir de ma 2ème année de thèse.
Bon courage pour la fin de ta thèse, tu tiens le bon bout. Nous avons commencé ensemble notre chemin et nous le finirons ensemble au même moment !
Un grand merci à mon amie le Dr Diane Antonios-Gholam, qui malgré la distance qui nous sépare, pense toujours à moi. Merci pour tes petits textos de temps en temps, tes encouragements et ton soutien.
Merci au Prof. Hayat Azouri-Tannous, qui grâce à elle, j'ai pu rencontrer Marc à Beyrouth au cours de mon Master 1 au Liban. Merci pour ta confiance, tes encouragements et ton soutien.
Merci à Marie-Éliane Azouri (MEA), ma compatriote et voisine de bureau, merci d'être là pour m'écouter, me soutenir et m'encourager. Je te souhaite la bonne continuation et le bon courage pour la suite de ta thèse.
Soumaya Karaki, ma deuxième copine libanaise, merci pour tes encouragements et ton soutien tout au long de la rédaction de ma thèse. Je te souhaite la bonne continuation et la bonne chance pour la suite dans ta carrière en recherche.
Merci à Lorena Barientos, la jeune Docteur argentine qui vient de soutenir ! Merci pour ta présence au labo quand nous restions tard pour finir nos manips ou bien pour purifier les MoDC. Merci pour toutes les soirées et les discussions passées ensemble soit au McDonald, au japonais, à l'italien, au mexicain ou au libanais. Merci pour ta bonne humeur, ton calme, ta sympathie et ta bienveillance. Bonne chance dans ta nouvelle vie de jeune chercheur que tu
9
Je tiens à remercier le Prof. Sylvie Chollet-Martin pour son soutien et ses doux mots au moments les plus difficiles. Je n'oublierai jamais ta phase :"Tu es notre soleil de Châtenay" que tu m'avais dite à mon retour du Liban après le décès de ma petite sœur. Cela m'a profondément touchée. Merci !
Merci à Marie-Hélène Damiens qui m'a initiée dès mon arrivée en Master 2 aux Western blots. Merci pour ton aide précieuse, ta disposition, ta bienveillance et ta bonne humeur. Merci pour tout ton temps passé à faire les génotypes des souris nrf2.
Merci à tous les doctorants, Marie de Bourayne, Maire-Alix Espinasse, Romain Génard et Yann Gallais. Je vous souhaite le bon courage pour vos thèses respectifs! Marie, c'était une grande expérience pour moi de te former pendant ton Master 2, de t'initier sur les THP1 et les MoDC et de te transmettre les différentes techniques en biochimie que je connaissais surtout la Co-IP. Je te souhaite le bon courage pour la suite de ta thèse, ne lâche pas, tiens jusqu'au bout et surtout il faut y croire ! J'espère que tu m'inviteras à ta thèse et je ferai de mon mieux pour être présente avec toi, pour te soutenir ce jour-là. Marie-Alix, bon courage pour la fin de ta thèse, tu tiens le bon bout, c'est ta dernière ligne droite. C'est toi la prochaine, bonne chance ! Romain, je te souhaite plein de résultats sur les souris nrf2. C'était un plaisir de t'encadrer au cours de ton M2 et de t'initier sur les BMDC. Après mon départ, je te confie la lignée Nrf2. Prends bien soin de nos souris nrf2, ce sont notre trésor avec Saadia ! Yann, bonne continuation aussi pour la suite de ta thèse.
Une petite pensée à Camille Migdal ! Merci d’avoir partagé avec moi notre bureau. Merci pour les discussions scientifiques ensemble autour de Nrf2. Ce fut un plaisir de t'avoir parmi nous à ma soutenance. Bonne chance dans ton stage post-doctoral.
Merci à Claudine Déloménie de m'avoir formée à la PCR quantitiative. Merci pour tout le temps passé toute seule ou avec Saadia pour l'analyse des résultats du PCR array. C'est vrai que ce fut un long travail mais fructueux.
Merci à tout le personnel de l'animalerie tout particulièrment Valérie Domergue-Dupont, Pauline Robert et récemment Ayma Galland, d'avoir si bien gérées l'élevage de nos
10
souris Nrf2 qui n'était pas facile au départ. Merci pour tout votre temps consacré à couper les queues de souris pour rester à jour dans le cahier Nrf2.
Merci au Dr Armelle Biola-Vidamment pour sa gentillesse et sa compréhension de me laisser monter plus tôt des TP pour continuer ma rédaction de thèse. C'était un plaisir de faire les TP de Toxicologie, en tant qu'ATER, avec toi cette année et l'année dernière.
Merci à tous les membres de l'équipe 2 de l'UMR-996 que j'ai côtoyés au cours de ma thèse. Merci à Muriel Berthault, Isabelle Boristhènes, Luc de Chaisemartin, Aude Glaizes, Roseline Gorges, Vanessa Granger, Natacha Kerzerho-Szely, Viviana Marin-Esteban, Benoît Noël, Isabelle Turbica, Catherine Sandré pour leur sympathie, leur bonne humeur et leur bienveillance.
Merci à tous les autres membres de l'UMR-996 présents à Clamart. Je remercie particulièrement Patrice Hémon pour toutes les manips de marquages d'immunohistochimie effectuées sur les oreilles des souris. Merci pour ta disponibilité et ton aide.
Sans nos collaborations ce travail n'aurait pas pu être complet. C'est pourquoi, je remercie tous les collaborateurs qui ont participé à ce travail :
Un grand merci au CitoxLab pour leur collaboration et leur aide pour la réalisation de tous les tests du Local Lymph Node Assay (LLNA). Je tiens tout particulièrement à remercier Cédric Gerbeix pour sa disponibilité et sa gentillesse. Je remercie également Roy Forster et Nick Pearson pour leur confiance en notre projet.
Une chaleureuse pensée à nos collaborateurs Allemands, le Prof. Stefan F. Martin, le Dr Philipp R. Esser et le Dr Andréa Haase.
Merci à Philipp de m'avoir appris comment faire des Mouse Ear Swelling Test (MEST). Merci pour ta disponibilité et ta rapidité pour répondre à mes questions techniques. Un grand merci à Stefan de nous avoir montré avec Saadia au cours de notre visite à Freiburg en Allemagne comment récupérer les ganglions lymphatiques et comment injecter des cellules dans les oreilles des souris. Merci de nous avoir appris ces précieuses techniques. Je le remercie également pour l'agréable séjour passé à Freibug en 2011. Je tiens aussi à remercier Andréa pour sa gentillesse, sa disponibiilité, son efficacité et sa rapidité à me répondre quand j'avais besoin de son aide. Je la remercie également pour sa collaboration avec nous. J'espère que cette collaboration se concrétisera prochainement par la soumission du papier.
11
pour ton aide pour faire les CO-IP.
Je remercie aussi nos collaborateurs en Pharmacologie le Prof. Alain Gardier, le Dr Denis David et Indira David. Indira et Denis, merci pour votre gentillesse, votre enthousisamse, votre optimisme qui m'ont impressionnées et félicitations pour votre petit Bryan qui vient de naître. Merci à Alain pour les discussions et les repas partagés ensemble avec Saadia au resto universitaire. Merci à vous 3 de m'avoir donné la chance de travailler et de signer avec vous un premier papier. C'était un grand plaisir !
Merci au Dr Christophe Lemaire pour ses conseils scientifiques et son aide technique concernant l'apoptose.
Je n'oublie pas non plus mes anciens collègues de l'UMR-749. Un grand merci à Joël Raingeaud pour sa bonne humeur, sa gentillesse, ses discussions et ses commentaires au quotidien qui me faisaient plaisir. Merci pour nos escapades de détente à la piscine avec Saadia sur le temps du midi. Merci à Aurélie Siret, Virginie Hivert et Lyne Valentino pour nos soirées en dehors du labo, pour votre bonne humeur et votre soutien.
Merci au Dr Paul Telolahy et à Catherine le Callonec, mes collègues de TP, pour leur gentillesse et leur bonne humeur.
Un grand MERCI à la petite famille Römer pour votre compréhension concernant les weekends et les soirées consacrés par Saadia à corriger ma thèse au lieu de les passer avec vous. Merci à Sarah-Maria, ma petite Saradou, pour sa gentillesse et sa douceur. Merci à Sascha, mon petit Saschou, pour son affection et sa tendresse. Merci à Michael pour tous les bons moments. Merci Mischa d'avoir initié Saadia à Dropbox et qui me l'a ensuite transmis. Cela a rendu notre vie professionnelle plus facile ! Merci aussi de me considérer un membre de votre adorable petite famille ! Merci pour tout !
Merci à mes amis en France et au Liban qui m'ont toujours soutenue. Je tiens particulièrement à remercier ma meilleure amie Adila Al Soufi (Didi) qui m'a toujours écoutée, soutenue, encouragée et surtout qui a toujours su me faire rire aux moments les plus difficiles pendant mes pleurs !
12
Merci à mes amis Rima Hassan-Mallat et Amjad Mallat pour leur soutien pendant la rédaction de ma thèse. Merci pour leurs conseils pendant tout mon séjour en France.
Enfin, je remercie chaleureusement ma famille, ma maman, Salwa, mon papa, Abdel Kader, ma sœur, Samar, et mon frère, Ayman, qui ont toujours eu confiance en moi, m'ont toujours soutenue et encouragée. C'est grâce à vous que j'ai pu en arriver jusque là !
Une chaleureuse et affectueuse pensée va à ma petite sœur, Imane, qui nous a malheureusement quittés cette année. Je regrette beaucoup que tu ne sois pas entre nous aujourd'hui mais sois sûre que ta belle image restera toujours dans mon cœur comme tu l'as souhaitée ! Tu me manques beaucoup Imano ! Que ton âme repose en paix ma chère !
13
REMERCIEMENTS ... 5
SOMMAIRE ... 13
LISTE DES FIGURES ... 16
LISTE DES TABLEAUX ... 18
LISTE DES ABRÉVIATIONS ... 19
AVANT-PROPOS ... 23
INTRODUCTION ... 27
PARTIE I : IMMINUTÉ CUTANÉE ... 27
1. LA PEAU ... 29
1.1. L’épiderme ... 29
1.2. Le derme ... 31
1.3. L’hypoderme ... 32
2. LES CELLULES DENDRITIQUES ... 32
2.1. La diversité des cellules dendritiques ... 33
2.2. Les cellules dendritiques cutanées ... 35
2.2.1.Les cellules de Langerhans ... 35
2.2.2.Les cellules dendritiques dermales ... 37
2.2.3.Les cellules dendritiques inflammatoires de la peau ... 38
S Les cellules dendritiques inflammatoires épidermales ... 39
S Les cellules dendritiques productrices de TNF-α et d’iNOS ... 40
S Les cellules dendritiques exprimant le 6-sulfo LacNac ... 41
S Les cellules dendritiques plasmacytoïdes ... 42
2.3. Les cellules dendritiques tolérogènes ... 42
2.4. Le rôle des cellules dendritiques dans l’immunité cutanée ... 44
2.4.1.La reconnaissance des signaux de danger ... 44
S Les récepteurs toll-like ... 45
S Les récepteurs de la famille des lectines de type C ... 45
S Les récepteurs NOD-like ... 46
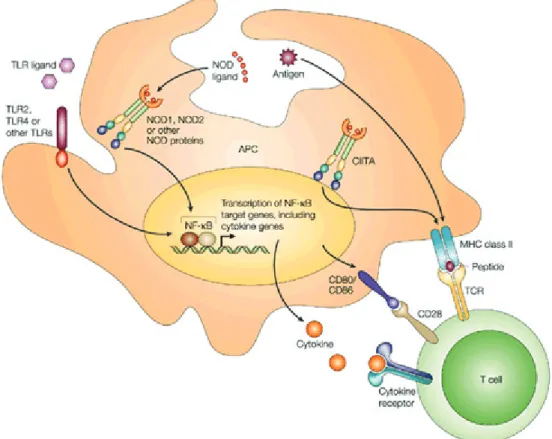
2.4.2.Apprêtement des antigènes par les DC ... 49
2.4.3.La migration des cellules dendritiques vers les ganglions lymphatiques drainants ... 51
2.4.4.Rôle des cellules dendritiques dans le contrôle de la réponse lymphocytaire ... 52
3. LES LYMPHOCYTES T CUTANÉS ... 54
3.1. Les lymphocytes T gd ... 54
3.2. Les Lymphocytes T mémoires ... 55
3.3. Les Lymphocytes T régulateurs ... 56
4. LES AUTRES CELLULES DE L’IMMUNITÉ CUTANÉE ... 57
4.1. Les kératinocytes ... 57
4.2. Les mastocytes ... 59
PARTIE II : L'ECZÉMA DE CONTACT ... 61
1. ECZÉMA ALLERGIQUE DE CONTACT OU HYPERSENSIBILITÉ CUTANÉE ... 63
1.1. Les manifestations cliniques et histologiques de l'eczéma allergique de contact ... 63
14
1.2.1.Le diagnostic ... 67
1.2.2.Les tests ... 68
1.3. Le traitement ... 70
2. LES MOLÉCULES CHIMIQUES ALLERGISANTES ... 70
2.1. Caractéristiques physico-chimiques des molécules chimiques allergisantes ... 70
2.1.1.Les liaisons covalentes ... 71
2.1.2.Les liaisons de coordination ... 72
2.2. Les différents types d’haptènes ... 73
2.2.1.Les haptènes vrais ... 73
2.2.2.Les pro-haptènes ... 74
2.2.3.Les pré-haptènes... 74
2.3. Pénétration des haptènes à travers la peau ... 75
3. LES MÉCANISMES CELLULAIRES DE L’ECZÉMA ALLERGIQUE DE CONTACT ... 77
3.1. La phase de sensibilisation de l'eczéma allergique de contact ... 78
3.1.1.Rôle des cellules dendritiques ... 78
S Activation des cellules dendritiques ... 78
S Migration des cellules dendritiques ... 80
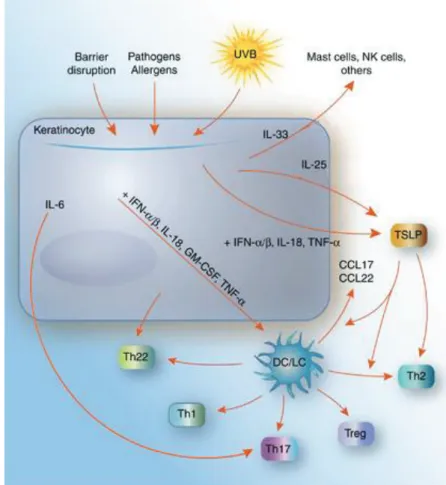
3.1.2.Rôle des kératinocytes dans la réaction d'hypersensibilité cutanée ... 83
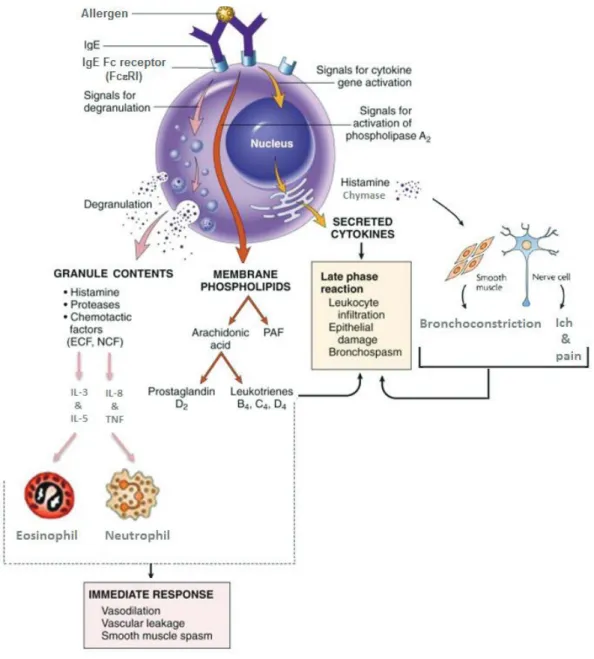
3.1.3.Rôle des mastocytes dans la réaction d'hypersensibilité cutanée ... 84
3.1.4.Rôle des lymphocytes B et du complément... 85
3.1.5.Activation des LT naïfs spécifiques des haptènes par les DC ... 86
S L'interaction entre le TCR et le complexe CMH/peptide hapténisé ... 86
S Les molécules de co-stimulation ... 88
S La sécrétion des cytokines par la DC ... 89
S La génération des lymphocytes T effecteurs ... 89
S La génération des lymphocytes T mémoires ... 90
3.1.6.La phase précoce d’élicitation ... 92
S Le rôle du complément et des polynucléaires neutrophiles ... 92
S Le rôle des cellules 'natural killer' ... 93
S Le rôle des lymphocytes T ... 94
3.1.7.La phase tardive de l’élicitation ... 95
S Le rôle des kératinocytes ... 95
S Le rôle des lymphocytes T ... 96
3.2. La régulation de la réponse inflammatoire ... 96
3.2.1.Le rôle des lymphocytes régulateurs ... 97
S Les lymphocytes T régulateurs conventionnels ... 97
S Les lymphocytes T régulateurs non conventionnels ... 100
S Les lymphocytes B ... 102
3.2.2.Le rôle des cellules dendritiques tolérogènes ... 102
PARTIE III : LA VOIE NRF2/KEAP1 ... 103
1. LES ESPÈCES RÉACTIVES DE L'OXYGÈNE ET LE STRESS OXYDANT ... 105
2. LA VOIE NRF2/KEAP1 ... 108
2.1. Le facteur de transcription Nrf2 et sa structure ... 108
2.2. La régulation de la réponse antioxydante par Nrf2 via ses éléments de réponse antioxidante "ARE" ... 110
2.3. Keap1 : le senseur naturel de Nrf2 ... 111
2.3.1.La structure de Keap1 ... 111
2.3.2.Le mécanisme d'interaction entre Keap1 et Nrf2 ... 113
2.4. Le mécanisme moléculaire de régulation de la voie Nrf2/Keap1 ... 113
2.4.1.Le mécanisme d'activation du complexe Nrf2/Keap1 ... 113
2.4.2.Les gènes régulés par Nrf2 ... 115
15
S Les activateurs de Nrf2 ... 126
S Les inhibiteurs de Nrf2 ... 134
2.5. Les autres membres de la famille Nrf2... 136
2.6. Les modifications post-traductionnelles du complexe Nrf2/Keap1 ... 138
2.6.1.La phosphorylation de Nrf2 ... 138
2.6.2.L'acétylation et la désacétylation de Nrf2 ... 140
2.6.3.Ubiquitination et phosphorylation du senseur naturel de Nrf2 ... 141
2.7. La régulation indirecte de la voie Nrf2/Keap1 ... 142
2.7.1.Les protéines partenaires de Keap1 ... 142
S La prothymorsine alpha ... 142
S La kayryophérine a6 ... 143
S L'IKKβ ... 143
S La sous-unité p65 du facteur de transcription NF-κB... 144
S La phosphoglycérate mutase 5, Bcl-xl et Bcl-2 ... 145
S La protéine de choc thermique Hsp90 ... 146
S La protéine p62 ... 146
2.7.2.Les protéines partenaires de Nrf2 ... 147
S La protéine P21 ... 147
S La cavéoline-1 ... 148
S La protéine DJ-1 ... 149
3. LE RÔLE FONCTIONNEL DE NRF2 ... 150
3.1. Le rôle de Nrf2 dans la fonction cellulaire ... 150
3.1.1.Mécanisme de survie ... 150
3.1.2.Mécanisme de mort cellulaire par autophagie... 153
3.2. Le rôle de Nrf2 dans le contrôle de la réponse inflammatoire... 154
PRESENTATION DU TRAVAIL ... 159 ARTICLE 1 ... 165 ARTICLE 2 ... 179 RÉSULTATS COMPLÉMENTAIRES ... 219 DISCUSSION ... 239 CONCLUSIONS ET PERSPECTIVES ... 247 BIBLIOGRAPHIE ... 253 COMMUNICATIONS SCIENTIFIQUES ... 281 ANNEXES ... 287
16
LISTE DES FIGURES
FIGURE 1:STRUCTURE DE LA PEAU ... 29
FIGURE 2:LES DIFFERENTES COUCHES ET CELLULES DE L’EPIDERME ... 30
FIGURE 3:ORIGINE DES CELLULES DENDRITIQUES ... 33
FIGURE 4:LES DIFFERENTES SOUS-POPULATIONS DE DC HUMAINES ET MURINES ... 34
FIGURE 5:LE RENOUVELLEMENT DES CELLULES DE LANGERHANS ... 35
FIGURE 6:ACTIVATION DE LA VOIE PAR LES PROTEINES NOD1/NOD2 OU LES TLR ... 47
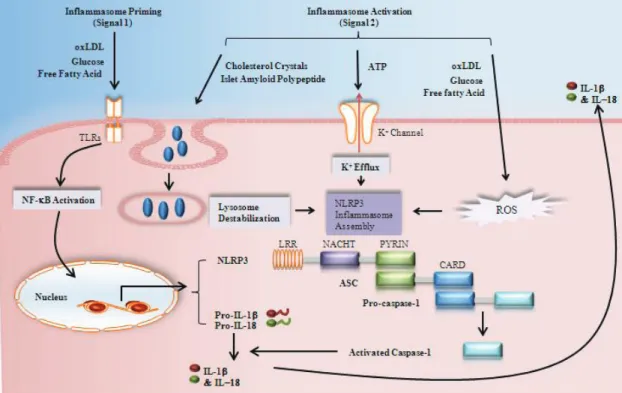
FIGURE 7:ACTIVATION DE L'INFLAMMASOME NLRP3 PAR LES SIGNAUX DE DANGER ... 48
FIGURE 8:REPRESENTATION DE CERTAINS INFLAMMASOMES ET DE LEURS ACTIVATEURS BACTERIENS OU VIRAUX ... 49
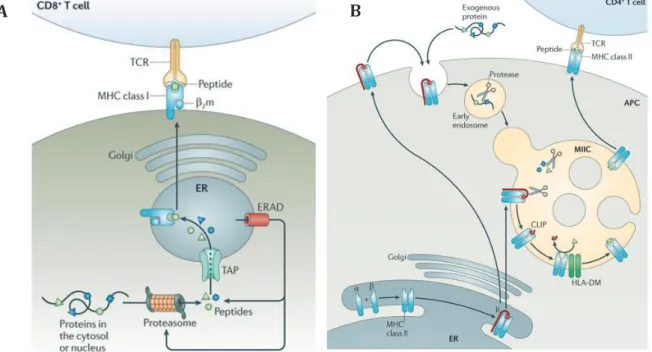
FIGURE 9:PRESENTATION DES ANTIGENES PAR LES DC ... 50
FIGURE 10:LES VOIES INTRACELLULAIRES DE LA PRESENTATION CROISEE DANS LES CELLULES DENDRITIQUES ... 51
FIGURE 11:LA SYNAPSE IMMUNOLOGIQUE ... 52
FIGURE 12:LES DIFFERENTES SOUS-POPULATIONS DE LYMPHOCYTES T ... 53
FIGURE 13:LES LYMPHOCYTES T MEMOIRES DANS LA PEAU MURINE ... 56
FIGURE 14:LES CELLULES DENDRITIQUES ET LYMPHOCYTES T CUTANES MURINS ... 57
FIGURE 15:LES MEDIATEURS SECRETES PAR LES KC ACTIVANT LA REPONSE IMMUNITAIRE ... 58
FIGURE 16:ACTIVATION D'UN MASTOCYTE PAR UN ALLERGENE ... 60
FIGURE 17:HISTOPATHOLOGIE DE L’ECZEMA ALLERGIQUE DE CONTACT ... 65
FIGURE 18:TESTS EPICUTANES OU PATCH TESTS ... 69
FIGURE 19:LES DIFFERENTES REACTIONS OBSERVEES SUITE A UN PATCH TEST ... 69
FIGURE 20:LES LIAISONS COVALENTES ... 71
FIGURE 21:LES PRINCIPAUX ACIDES AMINES NUCLEOPHILES SUSCEPTIBLES DE REAGIR AVEC LES HAPTENES. ... 71
FIGURE 22:EXEMPLES DE LIAISONS DE COORDINATION EFFECTUEES PAR LES METAUX ... 73
FIGURE 23:LES DIFFERENTES CATEGORIES D’HAPTENES ... 73
FIGURE 24:INTERACTION DU DNCB AVEC LES RESIDUS NUCLEOPHILE DES PROTEINES ... 73
FIGURE 25:OXYDATION DE L’ALCOOL CINNAMIQUE EN ALDEHYDE CINNAMIQUE ... 74
FIGURE 26:ADDITION D’UNE PROTEINE NUCLEOPHILE SUR UNE ORTHOQUINONE DERIVEE D’UN CATECHOL ... 74
FIGURE 27:AUTO OXYDATION A L’AIR DU D-LIMONENE ... 75
FIGURE 28:PRODUITS D’OXYDATION DE LA PARA-PHENYLENEDIAMINE ... 75
FIGURE 29: VOIES DE PENETRATION EMPRUNTEES PAR LES MOLECULES EXOGENES POUR PENETRER DANS L’EPIDERME. ... 76
FIGURE 30:MECANISME CELLULAIRE DE L’ECZEMA DE CONTACT ... 78
FIGURE 31:ACTIVATION DES CELLULES DENDRITIQUES PAR LES MOLECULES ALLERGISANTES (HAPTENES ET NICKEL) ... 79
FIGURE 32:ROLE DES CYTOKINES ET CHIMIOKINES DANS LA MIGRATION DES DC ... 83
FIGURE 33:INITIATION DE LA REPONSE D'HSC PAR L'ACTIVATION PRECOCE DES LB-1 PERITONEAUX ... 86
FIGURE 34:REPRESENTATION DE LA RECONNAISSANCE HAPTENIQUE PAR LES LT... 87
FIGURE 35:EXPANSION ET PROLIFERATION DES LTCD8+ NAÏFS EN LT EFFECTEURS ET MEMOIRES APRES L'INTERACTION AVEC LA DC ACTIVEE PAR UN PATHOGENE ... 90
FIGURE 36:LES PRINCIPAUX EVENEMENTS DE MIGRATION CELLULAIRE AU COURS DE L'HYPERSENSIBILITE CUTANEE INDUITE PAR UN HAPTENE ET MEDIEE PAR LES CELLULES NK ... 94
FIGURE 37:ACTIVATION DES LT VERS LES TISSUS INFLAMMATOIRES AU COURS DE LA PHASE D’ELICITATION ... 95
FIGURE 38:LES QUATRE ETAPES DE REDUCTION DE L’OXYGENE ET FORMATION DES INTERMEDIAIRES REDUITS ... 105
FIGURE 39:LES DEUX REACTIONS DE TRANSFORMATION DE L'ANION SUPEROXYDE ... 105
FIGURE 40:EXEMPLE D'OXYDATION REVERSIBLE PAR LE GSH ET/OU LA TRX ... 106
FIGURE 41:REACTION DE REDUCTION DU PEROXYDE D'HYDROGENE EN EAU ... 107
FIGURE 42:REDUCTION DE L’OXYGENE EN ANION SUPEROXYDE PAR LA NADPH OXYDASE ... 107
FIGURE 43:STRUCTURE DE NRF2 ... 110
FIGURE 44:STRUCTURE DE KEAP1 ... 112
FIGURE 45:MODELE SPECULATIF D’INTERACTION ENTRE KEAP1 ET NRF2 ... 112
FIGURE 46:MECANISME D'ACTIVATION DE LA VOIE NRF2/KEAP1 ... 114
17
FIGURE 51:OXYDATION DU FER AU COURS DE LA REACTION DE FENTON ... 120
FIGURE 52:LA REACTION DE GLUCURONIDATION ... 121
FIGURE 53:REDUCTION DES QUINONES EN HYDROQUINONE PAR LA NQO1 ... 122
FIGURE 54:MECANISME DES EPOXYDES HYDROLASES ... 124
FIGURE 55:REACTION DE L'ADDITION DE MICHAEL ENTRE LES ACCEPTEURS DE MICHAEL ET LES GROUPEMENTS SULFHYDRILES (-SH) DES CYSTEINES DE KEAP1 ... 127
FIGURE 56:LA STRUCTURE CHIMIQUE DU CURCUMIN ... 127
FIGURE 57:MECANISME D'ADDITION DE MICHAEL ENTRE CAPE ET KEAP1 ... 128
FIGURE 58:INTERACTION DE KEAP1 AVEC DES FONCTIONS QUINONES... 129
FIGURE 59:MECANISME D'INTERACTION DU SULFORAPHANE AVEC KEAP1... 129
FIGURE 60:PHASE PRECOCE DE PHOSPHORYLATION DE NRF2 ... 139
FIGURE 61:PHASE TARDIVE DE PHOSPHORYLATION DE NRF2 ... 140
FIGURE 62:LA VOIE NRF2/KEAP1 REGULEE PAR L'IMPORTINE a7 ... 143
FIGURE 63:LA REGULATION DE LA VOIE NF-KB PAR KEAP1 ... 144
FIGURE 64:LA REGULATION DE BCL-2 PAR KEAP1 ... 146
FIGURE 65:LA REGULATION DE LA VOIE NRF2/KEAP1 PAR P62 ... 147
FIGURE 66:LA REGULATION DE LA VOIE NRF2/KEAP1 PAR P21 ... 148
FIGURE 67:LA REGULATION DE NRF2 PAR DJ-1 ... 150
FIGURE 68:NRF2 CONTROLE L'INFLAMMATION CUTANEE INDUITE PAR LE TNCB... 222
FIGURE 69:LES MOLECULES D'ISOCYANATES AUGMENTENT L'INFLAMMATION CUTANEE CHEZ LES SOURIS NRF2-/- COMPAREES AUX SOURIS NRF2+/+.. ... 223
FIGURE 70:LES MOLECULES D'ANHYDRIDES INDUISENT UNE INFLAMMATION CUTANEE CHEZ LES SOURIS NRF2-/- COMPAREES AUX SOURIS NRF2+/+. ... 224
FIGURE 71:LE NISO4 N’INDUIT UNE HSC QUE CHEZ LES SOURIS NRF2-/- ... 226
FIGURE 72:PROTOCOLE EXPERIMENTAL... 227
FIGURE 73:LES DC NRF2+/+ CONTROLENT LES REACTIONS D'HYPRESENSIBILITES CUTANEES EN REPONSE AU TNCB CHEZ LES SOURIS NRF2+/+ ... 230
FIGURE 74:LES DC NRF2+/+ CONTROLENT LA REACTION D'HSC EN REPONSE AU TNCB DANS LES SOURIS NRF2+/+ ... 232
FIGURE 75:LES DC NRF2-/- GENERENT UNE INFLAMMATION CUTANEE PLUS IMPORTANTE CHEZ LES SOURIS NRF2+/+ ET NRF2-/- EN REPONSE AU TNCB ... 233
FIGURE 76: CARACTERISATION DU PHENOTYPE MEMBRANAIRE ET CYTOKINIQUE DES DC NRF2+/+ET NRF2-/- A L'ETAT BASAL.………...234
FIGURE 77:EXPRESSION BASALE DES DIFFERENTS GENES REPRIMES OU SUREXPRIMES DANS LES DC NRF2-/- COMPAREES AUX DC NRF2+/+. ... 234
FIGURE 78:CARACTERISATION DES TREG DANS LES SOURIS NRF2+/+ ET NRF2-/- ... 235
FIGURE 79:ABSENCE DE RECRUTEMENT DE TREG CHEZ LES SOURIS NRF2+/+ OU NRF2-/- SENSIBILISEES AU CINA75%. ... 236
FIGURE 80: ABSENCE DE LA REPONSE TOLEROGENE CHEZ LES SOURIS NRF2-/- PRE-TRAITEES PAR LE DNTB CONTRAIREMENT AUX SOURIS NRF2+/+. ... 237
18
LISTE DES TABLEAUX
TABLEAU 1:PHENOTYPE DES LC CUTANEES MURINES ET HUMAINES ... 36
TABLEAU 2:LES MARQUEURS PHENOTYPIQUES DES DC CUTANEES MURINES ET HUMAINES ... 38
TABLEAU 3: LES MARQUEURS PHENOTYPIQUES DES DIFFERENTES DC INFLAMMATOIRES DE LA PEAU ... 39
TABLEAU 4:LES DIFFERENTS LIGANDS DES TLR HUMAINS ... 45
TABLEAU 5:LES DIFFERENTES LESIONS CUTANEES QUI PEUVENT ETRE OBSERVEES AU COURS D'UN ECZEMA DE CONTACT ALLERGIQUE ... 66
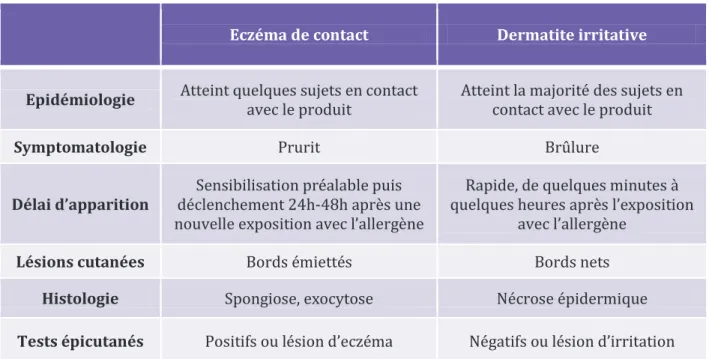
TABLEAU 6:DIAGNOSTIC DIFFERENTIEL ENTRE L’ECZEMA DE CONTACT ET LA DERMATITE IRRITATIVE ... 68
TABLEAU 7:FONCTIONS CHIMIQUES ELECTROPHILES DES HAPTENES ET LES MECANISMES DE REACTIONS ASSOCIES EN PRESENCE D’UN NUCLEOPHILE (NU) ... 72
TABLEAU 8:LES POPULATIONS DE LT MEMOIRES ... 91
TABLEAU 9:PRINCIPALES FONCTIONS PHYSIOLOGIQUES DES ERO ET ERA ... 106
TABLEAU 10:LES GENES REGULES PAR NRF2 ... 125
TABLEAU 11:LES DIFFERENTS INDUCTEURS DES ARE ET DE LA VOIE NRF2 ... 134
TABLEAU 12:TABLEAU COMPARATIF ENTRE L'INDEX DE STIMULATION (IS) ET LE NIVEAU D'IRRITATION DES DIFFERENTES MOLECULES CHIMIQUES ... 225
19
A
a.a : acide aminé Ac : anticorps
ADN : acide désoxyribonucléique ADP : Adénosine diphosphate Ag : Antigène
AKR : Aldo-kéto réductase
AMP : adénosine monophosphate
AMPc : adénosine monophosphate cyclique Antioxidant Response Element : ARE
AP-1 : activator protein-1
ARE : antioxydant response element ATG7 : Autophagy-related protein 7 ATP : adénosine triphosphate
ATRA : Acide tout-trans-rétinoïque ou rétinoïne
B
BACH1 : BTB And CNC Homology 1 Bcl-2 : B-cell lymphoma 2
Bcl-xl : B-cell lymphoma-extra large BDCA : Blood DC antigen
BHA : ter-butylhydroxyanisole
BM-DC : Cellules dendritiques murines issues des progéniteurs de la moelle osseuse
BPCO : Bronchopneumopathie chronique obstructive
Breg : LB régulateur
BTB : broad complex tramtrack and bric a brac
bZip : domaine leucine zipper
C
CAT : catalase Cav-1 : Cavéoline-1
CCL : cys-cys chemokine ligand CCR : cys-cys chemokine receptor CD : cluster de differenciation
CD34-DC : Cellules dendritiques humaines issues à partir de précurseurs CD34+
cDC : cellule dendritique conventionnelle ChIP : Immunoprécipitation de la
chromatine
CinA : cinnamaldéhyde CK2 : caséine kinase 2
CLA : cutaneous lymphocyte antigen Clec9A : C-type lectin molecule
CLR : Récepteur de la famille des lectines de type C
CMH : Complexe majeur d’histocompatibilité CNC : cap n collar
CPA : cellule présentatrice d’antigène CTLA-4 : Cytotoxic T lymphocyte antigen-4 Cul3 : cullin-3-based E3 ubiquitin ligase CXCL : chemokine (C-X-C motif) ligand Cys : cystéine
CYP : Cytochrome
D
D3T : 1,2-dithiole-3-thione
DAMP : Damage-associated molecular pattern molecule
DC : Cellule dendritique
DC-SIGN : DC-specific intercellular adhesion molecule-3-grabbing non-integrin
DDC : Cellule dendritique dermale DETC : Dendritic Epidermal T cells DGR : Double glycine repeat/kelch DJ-1 ou PARK7 : Parkinson protein 7 DNCB : 2,4-dinitrochlorobenzène DNFB : Dinitrofluorobenzène DNTB : Dinitrothiocyanobenzène
DTA : Sous-unité A de la toxine diphtérique DTR : récepteur de la toxine diphtérique simienne
20
E
E. Coli : Escherichia Coli
EAC : Eczéma allergique de contact ECF : Eosinophil chemotactic factor ECH : Erythroïd cell-derived protein with CNC homology
EGCG : Epigallocatéchine-3-gallate EGF : facteur de croissance épidermal ou epidermal growth factor
EH : Epoxyde hydrolase EP : Ethyl pyruvate
EpCAM : Epithellial-cell adhesion molecule ERA : Espèces réactives de l’azote
ERK : Extracellular signal-regulated kinase ERO : Espèces réactives de l’oxygène
F
FITC : fluorescéine isothiocyanate FLT3 : FMS-like tyrosine kinase 3 FoxP3 : Forkhead box P3
G
GCL : Glutamylcystéine ligase c GM-CSF : Granulocyte macrophage-colony stimulating factor GPx : glutathion peroxydase GR : glutathion réductase GSH : glutathionGSK-3k : glycogen synthase kinase 3k GST : Glutathion-S-transférase
H
H2O2 : peroxyde d’hydrogène H4R : Récepteur 4 de l'histamine HA : acide hyaluronique hBD : Bêta-défensine humaine HDAC : Histone désacetylase HETE : acide12-hydroxyeicosatétraénoïque
His : Histidine
HMGB1 : High mobility group box 1 protein HO• : radical hydroxyl
HO-1 : hème oxygénase 1
HSC : Hypersensibilité de contact
HSP : Heat Shock Protein ; protéine de choc thermique
HSPC : Cellules souches hématopoïétiques
I
IAB : N-iodoacetyl-N biotinylhexylenediamine
ICAM : Intercellular adhesion molecule ICOS : Inducible costimulator
IDEC : Inflammatory dendritic epidermal cells ou cellules dendritiques épidermales inflammatoires
IFN-g : Interféron-g Ig : Immunoglobuline
IGF-1 : Inulin growth factor-1 IkB : Inhibiteur de kappa B IKK : IkB kinase
IL : Interleukine
ILT : Immunoglobulin-like transcript Immunoglobuline : Ig
iNOS : Nitric oxyde synthase inductible INrf2 : inhibiteur Nrf2 ou Keap1
IS : Index de stimulation IVR : intervening region
J
JNK : c-jun N-terminal kinase
K
KC : Kératinocyte kDa : kilodalton
Keap1 : Kelch-like ECH-associated protein 1
21 LB : Lymphocyte B
LC : Cellule de Langerhans LDL : low density lipoprotein
LFA-1 : Lymphocyte function-associated antigen-1
LLNA : Local lymph node asssay LPS : lipopolysaccharide
LT : lymphocyte T
LTh : Lymphocyte T auxiliaire LTreg : Lymphocyte T régulateur Lys : Lysine
LZT : Low Zone Tolerance
M
MAPK : Mitogen-activated protein kinase MARE : Maf Recognition Element
MCP-1 : Monocyte chemoattractant protein-1
Mcpt5 : Protéase 5 des mastocytes ou mast cells protesase 5
M-CSF : macrophage colony stimulating factor
MDA : dialdéhyde malonique
mDC : Cellule dendritique myéloïde MEST : Mouse ear swelling test MIP-1α : Macrophage inflammatory protein-1a
MMP : matrix metalloproteinase
Mo-DC : Cellules dendritiques générées à partir des monocytes humains
MRP : Mutidrug resistance-associated protein
N
NAC : N-acétylcystéine
NADH : nicotinamide adénine dinucléotide NADPH : nicotinamide adénine
dinucléotide phosphate
NCF : Neutrophil chemotactic factor
NES : Nuclear Export Sequence NF-E2 : Nuclear Factor Erythroid 2 NF-kB : Nuclear factor-kappa B NiSO4 : Sulfate de nickel
NK : Natural killer
NLR : Récepteur NOD-like
NLS : Nuclear Localization Sequence NO• : monoxyde d’azote radicalaire
NOD : Nucleotide-binding oligomerization domain
NOS : monoxyde d'azote synthase NOX : NAD(P)H oxydase membranaire NQO1 : NADPH quinone oxydoréductase Nrf2 : Nuclear factor erythroid 2 (NF-E2)-related factor 2
O
O2•- : anion superoxide ONOO- : peroxynitriteP
P2X7 : Récepteur prurinergique PAM : Peptide anti-microbienPAMP : Pathogen-associated molecular pattern
PCR : Polymerase chain reaction PBS : Phosphate buffer saline
pDC : Cellule dendritique plasmacytoïde PERK : protein kinase RNA (PKR)-like endoplasmic reticulum (ER) kinase PGAM5 : Phosphoglycérate mutase 5 PGE2 : Prostaglandine E2
PI3K : Phosphoinositide-3 kinase PKC : Protéine kinase C PM : Poids moléculaire PN : Polynucléaire neutrophile pPD : para-phénylènediamine Prdx : peroxyrédoxine Prostaglandine : PG
22
PRR : Pattern recognition receptor PSGL-1 : P-selectin glycoprotein ligand-1 PSM : Sous-unité 19S du protéasome PTMa : Prothymorsine alpha
R
RANK : Receptor activator of NF-kB
RANTES : regulated on activation, normal T cell expressed and secreted
Rbx1 : Ring box 1
RE : Reticulum endoplasmique RO• : Radical alkoxyl
RO2• : Radical peroxyde
S
SCF : Stem cell factor Ser : Sérine
siRNA : small interfering RNA, ARN interférant
SlanDC : 6-sulpho LacNac DC sMAF : small musculoaponeurotic fibrosacroma
SMX : Sulfaméthoxazole SOD : Superoxyde dismutase ssRNA : ARN simple brin
T
TAP : Transportor associated with antigen processing tBHQ : tert-Butyl hydroquinone t-BQ : ter-butylquinone TCM : LT à mémoire centrale TCR : T cell receptor TEM : LT effecteurs mémoires
TGF-b : Transforming growth factor b Th : réponse T helper
Thr : Thréonine
Tip-DC : TNF/iNOS producing dendritic cells DC productrices de TNF-α (tumor
necrosis factor- α) et d’iNOS (inducible nitric oxide synthase
TLR : Récepteur Toll-like
TNBS : Acide trinitrobenzène sulfonique TNCB : Trinitrochlorobenzène
TNF : Tumor necrosif factor
TNF-α : Tumor necrosis factor alpha TRM : LT résidentes mémoires
Trx : Thiorédoxine TrxR : Trx réductase
TSLP : Thymic stromal lymphopoietin Tyr : Tyrosine
U
UGT : Uridine diphospho (UDP)-glucuronosyltransférase
UV : Ultraviolet
V
VCAM : Vascular cell adhesion molecule VLA-4:Very late antigen-4
25
Les réactions allergiques telles que les réactions d’hypersensibilité de contact (HSC) sont un problème de santé publique. Elles sont classées au quatrième rang des maladies mondiales selon l'Organisation Mondiale de la Santé (OMS). L’incidence de ces réactions est estimée à 20% dans les pays industrialisés. Il s’agit d’une réaction inflammatoire aiguë qui survient suite à des expositions répétées d’une molécule allergisante avec la peau et dans laquelle les cellules dendritiques (DC) jouent un rôle essentiel. Les composés chimiques responsables de HSC sont majoritairement des haptènes, molécules de faibles poids moléculaires, qui ne deviennent immunogènes qu’après association stable avec des protéines. L’HSC est composée de deux phases : une phase de sensibilisation et une phase d’élicitation. Lors du premier contact avec la peau, l'haptène est pris en charge par les DC épidermales, les cellules de Langerhans (LC), et les DC dermales qui vont migrer vers les ganglions lymphatiques via la lymphe pour induire une réponse lymphocyte T primaire spécifique de l'haptène.
Ces mêmes haptènes sont capables d'induire un stress chimique. Parmi les voies de détoxication en réponse aux xénobiotiques, la voie Nrf2 est une voie majeure connue pour jouer un rôle clef dans la défense anti-oxydante. Quand la cellule n’est pas soumise à un stress chimique ou un stress oxydant, une protéine senseur appelée Keap1 (Kelch-like ECH associated protein 1), séquestre Nrf2 dans le cytoplasme. En réponse au stress oxydant et aux molécules électrophiles, Keap1 libère Nrf2. Ce dernier transloque alors dans le noyau, se fixe sur des séquences consensus ARE (Antioxydant Responsive Element) et forme un complexe avec les facteurs de transcription de la famille Maf pour induire l’expression de gènes cibles
[la NAD(P)H:quinone réductase (nqo1), la hème oxygénase (ho-1), la glutathion péroxydase (gpx), la superoxyde dismutase (sod)]. Cette voie Nrf2/Keap1 est une voie centrale pour la
détection de composés électrophiles tant endogènes qu’exogènes par la cellule.
Les molécules allergisantes cutanées contrairement aux irritants induisent les expressions de gènes cibles de Nrf2, codant pour des enzymes anti-oxydantes, (la nqo1 et l'ho-1) et induisent l’accumulation de Nrf2 dans les DC humaines et les cellules de la lignée THP1. Natsch & Emter (2008) ont aussi montré que de nombreux composés chimiques connus pour être des molécules allergisantes cutanées sont capables d’activer la voie Nrf2.
L'objectif de ce travail a été d'étudier le rôle du facteur de transcription Nrf2 dans (1) le contrôle de la survie des DC en réponse aux molécules chimiques et (2) le contrôle des
26
réactions allergiques cutanées. Cette étude a été effectuée à l'aide d'un modèle murin de souris déficientes pour le gène codant pour nrf2.
INTRODUCTION
29 La peau constitue l’organe le plus lourd et le plus étendu du corps humain. Chez l'adulte, elle couvre plus ou moins 2 m2 et pèse 4,5 à 5 kg, soit environ 16 % de la masse corporelle.
Elle constitue un tissu de revêtement en continuité avec les muqueuses et une barrière physique contre l’environnement extérieur (McLafferty et al., 2012).
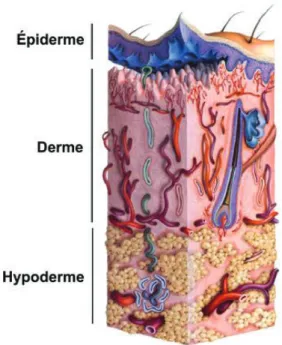
La peau est composée de trois compartiments distincts : l’épiderme, le derme et l’hypoderme (Figure 1).
Figure 1 : Structure de la peau (Geras, 1990) 1.1. L’épiderme
L’épiderme est un épithélium stratifié, squameux et kératinisé. Il constitue la partie supérieure de la peau qui est en contact direct avec l’extérieur. Il est composé de plusieurs couches superposées : la couche basale, la couche épineuse, la couche granuleuse, la couche claire et la couche cornée (Figure 2). L'épiderme assure une protection mécanique, chimique (sueur et sébum) et physiologique contre les agressions physiques telles que le soleil, agressions chimiques ou infectieuses.
30
Figure 2 : Les différentes couches et cellules de l’épiderme [figure modifiée à partir (Tortora and Derrickson 2007)]
L’épiderme est constitué de 4 types cellulaires : · Les kératinocytes
Les kératinocytes (KC) constituent environ 90 % des cellules épidermiques. Ils prolifèrent au niveau de la couche basale puis se différencient en progressant vers la couche cornée. Ils s’aplatissent progressivement tout en synthétisant la kératine, une protéine qui protège la peau et les tissus sous-jacents contre la chaleur, les microorganismes et les agents chimiques (Tortora and Derrickson 2007). Au niveau de la couche cornée, les KC deviennent des cellules plates, sans noyau, les cornéocytes, attachés les uns aux autres par les cornéodesmosomes (Dreno, 2009). La cohésion et la souplesse de l’ensemble sont renforcées par une couche de lipides constituée de céramides, de cholestérol et d’acides gras. Les céramides constituent une classe de lipides qui assurent l'hydratation de la peau. Neuf céramides libres sont retrouvés dans la couche cornée dont les céramides A et les céramides B (Proksch et al., 2008). Le cholestérol, constituant une classe majeure des lipides de la couche cornée, est synthétisé dans l’épiderme in situ à partir de l’acétate (Proksch et al., 2008). L’épiderme contient aussi des acides gras libres ou liés à des triglycérides, des phospholipides et des glycosylcéramides (Proksch et al., 2008). Les KC assurent la première ligne de défense grâce à
31 · Les mélanocytes
Les mélanocytes représentent environ 8% des cellules épidermiques. Ils sont responsables de la pigmentation de la peau. Les mélanocytes se trouvent dans les couches profondes de l’épiderme où ils synthétisent la mélanine. Grâce aux prolongements longs et minces des mélanocytes qui rentrent en contact avec les KC, la mélanine est transférée aux KC (Tortora and derrickson 2007). La mélanine ainsi absorbée s’accumule dans les KC et forme une barrière pigmentaire qui protège les cellules des rayonnements ultra- violets (UV) (McLafferty et al., 2012).
· Les cellules de Langerhans
Les cellules de Langerhans (LC) représentent 3 à 5 % des cellules épidermiques (Merad
et al., 2013). Elles appartiennent au groupe des cellules dendritiques (DC) et sont situées
dans les couches basales et supra-basales de l’épiderme. Leur corps cellulaire, de forme étoilée, se prolonge par de longues dendrites qui leur permettent de capturer les corps étrangers qui auraient franchi la barrière cutanée. Leur fonction est de surveiller et d’alerter le système immunitaire lors de la pénétration de pathogènes (Dreno, 2009).
· Les cellules de Merkel
Les cellules de Merkel sont les cellules les moins nombreuses de l’épiderme. Elles se situent dans la couche la plus profonde de l’épiderme (Tortora and derrickson 2007). Elles sont particulièrement abondantes dans les régions sensibles au toucher en contact avec une terminaison nerveuse telles que les lèvres, les paumes, la pulpe des doigts et la plante des pieds (Dreno, 2009).
1.2. Le derme
Le derme est la seconde couche de la peau qui est composé principalement de tissu conjonctif. Le derme comprend des fibres collagènes et élastiques, des vaisseaux sanguins, des nerfs, des glandes et des follicules pileux. Les fibres élastiques sont synthétisées par les fibroblastes (McLafferty et al., 2012). Il est divisé en deux zones : la zone papillaire supérieure et la zone réticulaire la plus profonde. Le derme est la partie vascularisée de la peau qui lui
32
confère une fonction importante de nutrition de l’épiderme et de thermorégulation. L’association de fibres collagènes et de fibres élastiques dans le derme réticulaire confère à la peau sa résistance, son extensibilité et son élasticité (Tortora and derrickson 2007).
1.3. L’hypoderme
L’hypoderme est le compartiment le plus profond et le plus épais de la peau. Il est constitué principalement d’adipocytes séparés par du tissu conjonctif lâche, richement vascularisé et innervé. Le tissu adipeux de l’hypoderme joue un rôle de stockage des réserves énergétiques, les triglycérides. Cette couche hypodermique a essentiellement une fonction d’amortisseur des chocs contre la peau grâce à sa consistance en graisses. Elle joue également un rôle de protection contre le froid par isolation (Dreno, 2009).
2. Les cellules dendritiques
Les DC sont des cellules présentatrices d’antigènes (CPA) professionnelles jouant un rôle majeur tant dans l'immunité innée que dans l'immunité acquise ou adaptative. L’immunité innée permet de lutter de façon non spécifique contre tous les types de pathogènes et constitue la première ligne de défense (Iwasaki and Medzhitov, 2010). Quant à l’immunité acquise, elle vise à détruire spécifiquement l’agent infectieux (Iwasaki and Medzhitov, 2010). Les DC sont des cellules majeures qui assurent le lien entre l'immunité innée et l'immunité adaptative (Steinman, 2006).
Les DC sont représentées dans deux états : un état dit immature et un autre dit mature. Les DC immatures ont la capacité de capturer un antigène (Ag) induisant leur maturation tandis que les DC matures ont la capacité unique de présenter l’Ag et d’activer les LT naïfs. Ces CPA dites professionnelles sont uniques dans l’initiation d’une réponse immunitaire primaire spécifique de l'Ag (Banchereau and Steinman, 1998).
Les DC proviennent des cellules souches hématopoïétiques issues de la moelle osseuse (Shortman and Naik, 2007) (Figure 3). Elles résident principalement dans les tissus périphériques et les organes lymphoïdes, et forment un réseau de cellules sentinelles notamment au sein des épithéliums muqueux (bouche, œsophage, poumon, vessie) et dans la peau (Liu et al., 2007; Bangert et al., 2011).
33
Figure 3 : Origine des cellules dendritiques (Shortman and Naik, 2007) 2.1. La diversité des cellules dendritiques
Les DC constituent un réseau remarquable de cellules assurant un lien entre l'immunité innée et l'immunité adaptative. Ces DC sont issues d'un progéniteur commun de cellules souches hématopoïétiques. Elles peuvent être divisées en deux grandes catégories : les DC classiques ou conventionnelles (cDC) et les DC plasmacytoïdes (pDC) (Merad et al., 2013).
Les cDC comprennent les DC résidentes dans les organes lymphoïdes primaires et secondaires et les DC migratoires présentes dans les tissus périphériques. Chez la souris, les cDC résidentes dans les organes lymphoïdes comprennent deux sous-populations : les DC CD8+ et les DC CD11b+ (Merad et al., 2013).
Les DC CD8+ constituent la majorité des cDC résidentes dans le thymus tandis qu'elles
représentent 20 à 40% des cDC de la rate et des ganglions lymphatiques. Les cDC CD8+
n'expriment que le marqueur membranaire CD8a contrairement aux LT CD8+ qui expriment
le CD8ab. Les cDC CD8+ expriment fortement le FMS-like tyrosine kinase 3 (Flt3) et
prolifèrent en réponse au ligand Flt3L. Elles expriment également le CD205, récepteur de la lectine C 9A (Clec9A), et la langerine (Kiang et al.,1995, Merad 2013). Quant aux DC CD11b+,
elles n'expriment pas le marqueur CD8 et représentent les cDC prédominantes au niveau des tous organes lymphoïdes à l'exception du thymus (Merad et al., 2013). Comme pour les DC CD8+, les DC CD11b+ sont capables de proliférer en réponse au Flt3L (Waskow C 2008).
Par ailleurs, les DC migratoires constituent toutes les DC capables de migrer des tissus périphériques vers les ganglions lymphatiques. Dans cette partie, nous nous focalisons surtout sur les DC cutanées comprenant les cellules de Langerhans (LC) et les DC dermales (DDC).
34
Les LC épidermales sont caractérisées par l’expression de la Langerine (CD207) alors que les DDC retouvées dans le derme sont caractérisées par l’expression de DC-SIGN (DC-specific intercellular adhesion molecule-3 (ICAM-3)-grabbing non-integrin ou CD209) chez l’homme et par l’expression de CD11c chez la souris (Valladeau and Saeland, 2005; Guilliams et al., 2010). Ces deux principales populations de DC se trouvent dans la peau à l'état d'homéostasie. Cependant, dans les conditions inflammatoires, des populations de DC non résidentes dans l’environnement cutané normal apparaissent dans la peau. Ces DC sont dites les DC inflammatoires.
LaFigure 4montre les différentes sous-populations de DC chez la souris et leurs équivalents chez l'Homme. Figure 4: Les différentes sous-populations de DC humaines et murines (Guilliams et al., 2010)
35 Les cellules de Langerhans (LC) sont les premières DC décrites par Paul Langerhans en 1868. Ce sont les seules DC dans l’épiderme d’une peau saine (Chu et al., 2011; Igyarto and Kaplan, 2012; Kaplan et al., 2012). Elles représentent 3 à 5% des cellules épidermiques (Merad et al., 2013). A l’état basal, ces cellules se renouvellent continuellement indépendamment des progéniteurs du sang ou de la moelle osseuse (Merad et al., 2013). En effet, il a été montré par Merad et al., que les LC sont capables de s'auto-renouveler en se différenciant à partir de précurseurs localisés dans l'épiderme (Figure 5). Ainsi, il a été observé chez la souris irradiée puis transplantée par des cellules de la moelle osseuse que les LC de l'hôte d'origine persistaient dans la peau pendant 18 mois. En revanche, toutes les autres DC des différents organes ont été totalement renouvelées à partir des cellules de la moelle osseuse transplantées. Par ailleurs, il a été montré que les LC déplétées par une exposition aux UV sont renouvelées à partir des monocytes d'origine sanguine (Merad et al., 2002) (Figure 5).
Figure 5 : Le renouvellement des cellules de langerhans (Shortman and Naik, 2007) Les LC ont un phénotype caractérisé par l’expression de la langerine (CD207) et par la présence typique d’organelles cytoplasmiques appelés granules de Biberck. Ces granules sont constitués principalement de la langerine (Valladeau et al., 2000). Elles expriment également le CD1a, le CD45 et les molécules d’adhésion telles que la molécule epithellial-cell adhesion molecule (EpCAM), la β1-intégrine et l’E-cadhérine (Tableau 1) (Valladeau and Saeland, 2005; Chu et al., 2011; Gros and Novak, 2012).
36
Tableau 1 : Phénotype des LC cutanées murines et humaines [ND : non déterminé] (Merad et al., 2008; Ainscough et al., 2012)
A l’état basal, les LC sont situées dans les couches basales et suprabasales de l’épiderme où elles interagissent avec les KC via l’E-cadhérine. Borkowski et al., ont montré que les souris déficientes pour le gène codant pour le tgf-b (transforming growth factor b) ne possèdent pas de LC dans leur épiderme indiquant ainsi le rôle important du facteur de croissance TGF-β dans la différenciation des LC (Borkowski et al., 1996; Chu et al., 2011). Les LC jouent un rôle crucial dans l’induction de la réponse immunitaire adaptative (Bangert et al., 2011). Une fois activées par des allergènes, les LC sont alors capables de les capturer et d’enclencher le processus de maturation. C’est ainsi que les Ag du complexe majeur d'histocompatibilité (CMH)-I, CMH-II, les molécules de co-stimulation telles que le CD40, le CD80 et le CD86 et les récepteurs aux chimiokines tels que le CCR7 sont induits dans les DC. Ce processus est accompagné aussi d’une diminution de l’expression de l’E-cadhérine. Cette maturation permet aux LC de migrer vers les ganglions lymphatiques afin de présenter l’Ag aux LT naïfs
Peau LC Marqueurs cellulaires Souris Humain Langerine (CD207) +++ +++ Granules de Birbeck ++ ++ CD45 + + CMH class II ++ ++ CD11c + + CD205 ++ - CD11b + + ou - F4/80 + ND E-cadhérine ++ ++ EpCAM ++ + CD103 - ND CCR6 + + CCR7 - - CD1a - +++ CD1d ND -
37 D’autres études montrent que les LC participent à la tolérance cutanée. Récemment Gomez de Aguero et al., ont montré que les LC contrôlent la réponse inflammatoire d’origine allergique induite par une molécule chimique telle que le dinitrofluorobenzène (DNFB). Ainsi, les LC issues de souris ayant reçues une application cutanée d'une molécule chimique tolérogène telle que le dinitrothiocyanobenzène (DNTB) et transférées chez des souris receveuses protègent ces dernières contre l'allergie cutanée induite par le DNFB. Cette étude a permis ainsi de montrer que cette protection implique une absence de prolifération des LT CD8+ appelée anergie et une activation des LT régulateurs (Treg) en réponse au DNTB
(Gomez de Aguero et al., 2012).
2.2.2. Les cellules dendritiques dermales
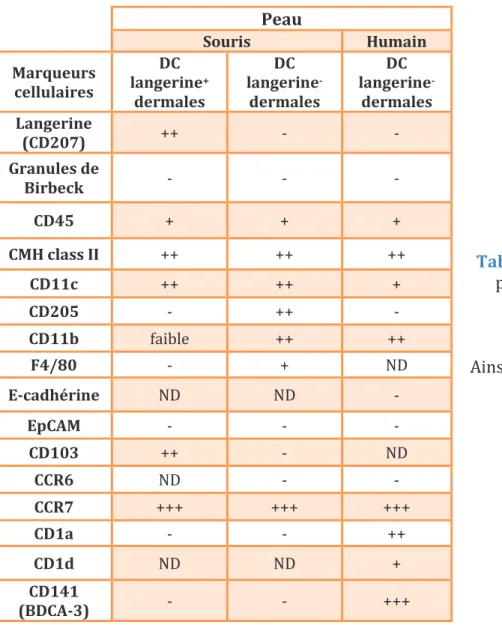
Les cellules dendritiques dermales (DDC) constituent une autre sous-population de DC résidentes dans la peau saine. Ces cellules sont capables d’activer le système immunitaire en présence d’un allergène. Les DDC se caractérisent surtout par l’expression de CD11c, CD45, CMH-II, la sous-unité A du facteur de coagulation XIII (FXIIIa). Contrairement aux LC, elles n’expriment pas de granules de Biberck (Bangert et al., 2011) (Tableau 2). Deux populations de DDC ont été identifiées : les DDC langerine+ connues aussi par les DDC CD103+ chez la
souris ou CD141high chez l’Homme (Haniffa et al., 2012) et les DDC langerine- connues par les
DDC classiques ou CD11b+ chez la souris ou CD14-/CD1a+ chez l’Homme (Tableau 2).
Les DDC proviennent des progéniteurs de la moelle osseuse et se différencient en présence du ligand FMS-like tyrosine kinase 3 (FLT3) (Ginhoux et al., 2009). Les DDC langerine+ représentent 3% de la population totale de DC, elles sont continuellement
renouvellées par recrutement à partir du sang. Par ailleurs, les DDC langerine- représentent à
peu près 80% de la population totale des DDC. Deux populations de DDC langerine- se
distinguent par l’expression CD11b (Henri et al., 2010).
Ces DDC [CD103+, Langerine+] sont capables de présenter in vivo les Ag par présentation
croisée (cross-presentation), leur permettant ainsi de présenter les Ag exogènes aux LT CD8+
via les molécules du CMH-I (Chu et al., 2011; Igyarto and Kaplan, 2012; Kaplan et al., 2012).
Bedoui et al., ont ainsi montré que les DC [CD103+, Langerine+], isolées à partir des ganglions
de souris infectées par le virus Herpes Simplex (HSV), étaient les seules cellules capables d'induire la prolifération des LT C8+ spécifiques du HSV (Bedoui et al., 2009).
38
Tableau 2 : Les marqueurs phénotypiquesdes DC cutanées murines et humaines (Merad et al., 2008; Ainscough et al., 2012), (ND : non déterminé)
Récemment, Hannifa et al., ont pu identifier une nouvelle population de DC humaines dermales exprimant fortement le CD141 [ou Blood DC antigen (BDCA)-3)] (DC CD141high). Ces
DC CD141high possèdent des homologies fonctionnelles aux DDC 103+ murines. Elles sont
capables de migrer vers les ganglions lymphatiques spontanément et suite à un stimulus inflammatoire. Elles sont capables de présenter les Ag via une présentation croisée aux LT (Haniffa et al., 2012).
2.2.3. Les cellules dendritiques inflammatoires de la peau
Les DC inflammatoires correspondent à des DC recrutées en réponse à des stimuli microbiens ou inflammatoires. Elles disparaissent lorsque l’inflammation est résolue (Merad
et al., 2013). Elles peuvent être divisées en plusieurs sous-populations : les cellules
dendritiques épidermales inflammatoires (IDEC), les DC productrices de TNF-α (tumor necrosis factor- α) et d’iNOS (inducible nitric oxide synthase) appelées Tip-DC, les 6-sulpho
Peau Souris Humain Marqueurs cellulaires DC langerine+ dermales DC langerine -dermales DC langerine- dermales Langerine (CD207) ++ - - Granules de Birbeck - - - CD45 + + + CMH class II ++ ++ ++ CD11c ++ ++ + CD205 - ++ - CD11b faible ++ ++ F4/80 - + ND E-cadhérine ND ND - EpCAM - - - CD103 ++ - ND CCR6 ND - - CCR7 +++ +++ +++ CD1a - - ++ CD1d ND ND + CD141 (BDCA-3) - - +++
39 Les IDEC, les TipDC et les slanDC proviennent des précurseurs myéloïdes et ressemblent phénotypiquement aux DC myéloïdes du sang périphérique (Bangert et al., 2011). Les IDEC se retrouvent au niveau de l’épiderme alors que les TipDC et les slanDC se retrouvent au niveau du derme d’une peau enflammée (Zaba et al., 2009). Par ailleurs, les pDC, d’origine lymphoïde, circulent du sang vers les zones T des organes lymphoïdes ou vers les tissus enflammés (Gros and Novak, 2012).
S Les cellules dendritiques inflammatoires épidermales
L’origine des cellules dendritiques inflammatoires épidermales (IDEC) n’est à ce jour pas connue. Les IDEC sont absentes dans l'épiderme d'une peau saine, elles apparaissent en réponse à un stimulus inflammatoire. Ces cellules ont été décrites pour la première fois en analysant des suspensions cellulaires des épidermes de patients atteints de dermatite atopique (Wollenberg et al., 1996). Ainsi, Wollenberg et al., ont montré que les différentes biopsies de peau issues de patients atteints de dermatite atopique, d'eczéma de contact, de psoriasis ou de lupus érythémateux présentent un nombre élevé de cellules inflammatoires cutanées telles que les IDEC et les pDC contrairement à la peau saine (Wollenberg et al., 2002).
Les IDEC représentent une population de mDC recrutées au niveau des sites inflammatoires à partir de monocytes sanguins suite à un stimulus inflammatoire (Novak 2002, Gros et Novak 2012). Le Tableau 3 montre les différents marqueurs cellulaires exprimés par les IDEC. Suite à leur activation, les IDEC induisent la production de cytokines pro-inflammatoires telles que l’interleukine (IL)-1, MIP-1α (macrophage inflammatory protein-1 α), l'IL-16 favorisant ainsi le recrutement des éosinophiles (Gros and Novak, 2012).
Tableau 3 : les marqueurs phénotypiques des différentes DC inflammatoires de la peau (Chu et al., 2011;
Gros and Novak, 2012)
Type de DC Marqueurs cellulaires
IDEC CD1a, CD1b, CD11b, CD1c, CD11c, FceRI, CD23, HLA-DR, CD206, CD36
TipDC CD11c, CD11b, CD206, CD209
slanDC CD11c, CD16 (FcgRIII), C5aR, CD45RA, Récepteurs de l’histamine (H1R, H2R, H4R) pDC
BDCA-4 (neuropilin), BDCA-2 (CD303), CD4, CD123, immunoglobulin like
40
S Les cellules dendritiques productrices de TNF-α et d’iNOS
Les DC productrices de TNF-α et d’iNOS (Tip-DC) sont des DC inflammatoires qui ont été décrites pour la première fois au cours des infections bactériennes. Elles ont ainsi été retrouvées dans la rate au cours d’un modèle d’infection à la Listeria monocytogenes (Serbina et al., 2003) et dans l'intestin au cours d’une infection à l’Escherichia Coli (E. Coli) (Engel et al., 2006).
Les Tip-DC sont aussi décrites dans le derme et l'épiderme d’une peau d’un sujet atteint de psoriasis (Lowes et al., 2005). L’inflammation psoriasique induit une augmentation de 30 fois plus le nombre de DC exprimant le CD11c+ dans le derme par rapport à une peau saine (Zaba
et al., 2009; Bangert et al., 2011). Elles produisent des cytokines pro-inflammatoires telles
que le TNF-α et l’oxyde nitrique synthase inductible (iNOS) d’où leur nom TNF-α and inducible nitric oxide synthase (iNOS) producing ou Tip-DC (Zaba et al., 2009; Bangert et al., 2011; Chu et al., 2011). Ces cellules se différencient à partir des monocytes sanguins. Ainsi, une présence remarquable de cellules CD11c+ exprimant à la fois l'iNOS et le TNF-a a été
identifiée dans le derme et l'épiderme de la peau psoriasique. L'Efalizumab (Raptiva®)
[anti-CD11a], utilisé en clinique dans le traitement du psoriasis, est montré pour diminuer le nombre de Tip-DC (Lowes et al., 2005). Guttmann et al., ont également identifié les Tip-DC comme cellules caractérisant la maladie de psoriasis. Par un marquage immunohistochimique et par une approche de PCR quantitative, ils ont ainsi pu montrer que l'expression d'iNOS est beaucoup plus faible dans les échantillons issus de donneurs ayant une dermatite atopique comparés à ceux issus de patients atteints du psoriasis (Guttman-Yassky et al., 2007). Par ailleurs, Stary et al., montrent que ces Tip-DC peuvent aussi être induites par un traitement topique d’imiquimod (Aldara®), un agoniste du récepteur toll-like (TLR) 7/8 utilisé dans le
traitement du carcinome cellulaire basal et des verrues génitales (Stary et al., 2007). En effet, les biopsies issues de patients atteints du carcinome cellulaire basal et traitées topiquement à l'imiquimod pendant 2 semaines montrent une infiltration importante de pDC et de mDC au niveau cutané (Stary et al., 2007).
Toutes les études effectuées jusqu'à présents utilisaient des TipDC issues de biopsies de patients atteints de psoriasis. Cependant, Wilsmann-Theis et al., viennent de proposer un nouveau protocole de différenciation in vitro de Tip-DC à partir des monocytes humains. Ce protocole consiste à mettre en culture les monocytes purifiés à partir du sang périphérique pendant 5 jours dans du milieu supplémenté de sérum humain et non de sérum de veau fœtal
![Figure 2 : Les différentes couches et cellules de l’épiderme [figure modifiée à partir (Tortora and Derrickson 2007)]](https://thumb-eu.123doks.com/thumbv2/123doknet/14533139.723770/31.892.219.692.124.526/figure-couches-cellules-épiderme-figure-modifiée-tortora-derrickson.webp)
![Figure 13 : Les lymphocytes T mémoires dans la peau murine [figure modifiée à partir de (Islam and Luster, 2012)]](https://thumb-eu.123doks.com/thumbv2/123doknet/14533139.723770/57.892.207.669.119.707/figure-lymphocytes-mémoires-murine-figure-modifiée-partir-luster.webp)