ŒmgÆflMŒvfÆ
C,e mémtin est une s)i'i'i;±hèse d'u:m thèse de ®oc±omi
ùtii€,,,œe :
<.Eki]Æ;e phéwménobgùw de h rikri!fta;tion i
oxyd% et de burs métimges ».
sou±i'.me h 30/05/2016 pa;r Œou6a,±a Noua;r superrisé
pa;r wtüe emadffeur Œ*. Œlguh. flMelmaaL à Vri;wers
Τmerciemems
f"Ü;:Æ'"£';:£;r";:o;;:::Jiï-",:Jef"Æm;:C,::::£gs",:,fo£-£#;:%ï
h réalïsa,tion de ce træa,i[ que nous espéro`ns être utibs.
Nos remerciemems à notre encadreuï gw. fl. Œ(guh a,u dépanemeni dÀ,,
%nœ:u[®:u:t:e:Sse:cro":e%eé%yuer[Œq::nt6:entv:c[:fl:c#wéncJ,
1
notio, tmwa,i[ . Qiu'i[ trouve ici rejq?ression de notre pro!fbnÆÂ,,
1 1
reco.,majssance.
gvïous tenons à remercier égahmem gM!. M ŒOvsfl®fl' powr son a,jde'j,
1
cons?ib et encowagerriems a,u cowrs de hréa[isation de ce trwaj,[. ''i,,
1
Nous e)q?rimons awsi, nos remercj,ements et nos gratituÆ:es a;u mem6rl,
1
de jL ry pour avoir accepté #ex£a,mimer et de juger ce tra;va;i[. 'i
Œnfin,nosmfiremmemmsàtowcewcqwiriowotri;±comri6uédep'r;J,,
ou d,9, bim pour h réalisa,±ion de ce trwa,i[. '',,
-®édüa,ces
1[ est agréa6h au momem de présenter ce tra;va,i[ dad:resser mes
déd:j,caces à :
Wi a très chère mère, que je ne poumi remercier assez„ pow son soutien
mt.ra[ et matérie[ sa compréhension, amour, tenÆresse, et ses sacrifices,
que fl[hh [ui offre h santé.
TiÆon cher père pour ses sacrifices, pour rnon 6ien être.
Mes chers fières ..
que fl[hh bur o!ffre tout ce qri est 6ea:uxi
giÆes deux:gramd mère que dieux:bs protèges
9i4es oncles, tentes tous mes cousins, cousi:riÆs et a,mj,es
9i4a promotion de master 2 et rries amis chacun à son nom
f l mes coupimes te promo f lrri:m, f lsma, Nedjh et Œ£oma,issa et 9\lïa6ih
fl i ous ce que j' ai:mÆ et qui m' aiment, et ceux.qui ont veiffé de près ou de
loim à rachèvement. de ce tra;va,i[.
I
®édcaces
1[ est agréa6b au moment de présenter ce træa,i[ dadresser rnes
dédicaces à :
m'.a très chère mère, que je ne poufrai remercier assez„ pour son soutien
m,ira[ et matérie[, sa corn;préhension, amowr, tend:resse, et ses sacrifices,
que fl[hh [ui offre h santé.
914on cher père pour ses sacrifices, pour rnDn 6ien être.
M_es chers frères :
que fl[hh bur o!ffre tout ce qri est 6ien
fl monfiancé, mes tamtes et mes oncbs
Ma promotion de master 2 et mes amis chacun à son nom
f l ï ws coupines de promo œou6a, f lsma, Nedjh, Se[wa, Mhame et atïa.
fl i ous ce que j'a;ime et qui m'aiment, et ceux.qwi ont vei[œ d:e près ou di
bim à rachèvement de ce trwai[.
Ç;ahmouriflmina
TABLE DES MATIERES
Table des matières
Liste des figures
Liste des tableaux
Symboles et abréviations
Introduction générale
Chapitre I : Oxydes et Verres
1.1. HistoriqueI.2.Introduction
1.3. Définitions du verre
1.4. Phénomène de transition vitreuse
1.5. Classification des verres
1.6. Classification des oxydes pour les verres d'oxydes
1. Oxydes fomateurs
2. Oxydes modificateurs
3. Oxydes intemédiaires
1.7. Aptitude à la vitrification des oxydes et des mélanges
1.7.1. La vitrification
[.7.2. L'aptitude à la vitrification I. 8.Conditions de vitri fication
1.8.1. Théories fondées sur les concepts cristallochimiques 1. Critère de Goldschmidt ( 1926)
2. Règles de Zachariassen (1932)
1.8.2. Théorie liée a la themodynamique
1. Critère de Sun
I
I
I
I
I
2. Critère de Rawson
I.8.3.Théories structurales de la vitrification
1. Intensité du champ de Dietzel (1942) 1.9. Conclusion
Chapitre 11 : Proposition d'un modèle d'évaluation de l'aptitude à la
vitrification des mélanges
[1.1.Introduction
[1.2. Critères de vitrification des oxydes
11.2.1. Aptitude à la vitrification relative à la thermodynamique
(ThRGFA)
22
23
23 25
11.2.2. Aptitude à la vitrification relative à la structure (StRGFA) ... 2 )
11.2.3. .Aptitude à la vitrification relative aux considérations globales
(GRGFA)
1.3. Modèles d'analyse des propriétés des mélanges
: 1.4. Loi des mélanges
] 1.5. Proposition d'un Critère de vitrification des mélanges
] I.6.Conclusion
( =hapitre 111 : Application, Résultats et Analyses
] lappel de l'objectif
] [1.1.Méthodes de travail
1 [1.2. Calculs et résultats
I [1.3 .Discussions et interprétations
I
Conclusiongénérale...jl
Bibliographie...~....j3
Liste des figures
',,J:yFi8u,.e 1.1 : Figu, e 1.2 : Figul e 1.3 : Figur e 1.4 : Figur 3 1.5 : Figur 3 1.6 : Figul., , 1.7 : Figur, , 1.8 : Figur, 11.1 : Figur, 111.1 : Fi8ur` 111.2 : Figur` 111.3 : Clichédediffiactionxd'unveneetd'unephasecristâlliüjLçgÈesponda]e ` ,`.~_1_'. -,
silice vitreuse b) cristobaliteŒ
Schématisation de l'analyse themique différentielle d'un échantill{ n vitreux et cristallin
Variation du volume spécifique V ou de l'enthalpie H avec la températu e T au cours d'un refroidissement d'un liquide
Ruptue d'un pont Si-O-Si par l'oxyde modificateu Na20 a. réseau de silice, b. fomation d'oxygène non-pontant
Domaines de stabilité des polyèdres de coordination en fonction de la tail| e respective des cations et anions
Représentationschématiqueàdeuxdimensionsd'unarrangementatomiqu( dans (a) cristal et (b) verre, selon Zachariasen
Illustration schématique de l'effet de l'addition d'oxyde alcalin (exp Na2q )
à la silice
a) Rupture d'une liaison Si-O-Si par le sodium (b) Modèle du résea|i continu désordonné de Zachariasen-Warren
schéma structure du chapitre 11
Evolution des valeurs ARvm (GRGFAm) de quelques mélanges d'oxydes 4:
Evolution des valeus du coefficient d'incertitude U en fonction des teneu ;
des oxydes fomateus
Exemple d'évaluation des vdeus ARvm (GRGFAm) de quelque mélang{
d'oxydes...„...
___________
I
Liste des Tableaux
I
Tabl3aul.1 : composition (en % de masse) de quelques verres industriels : d'a]irèsTabhau l.2 : critère de Goldschmidt
Tablt `au 1.3 : Classifications des oxydes selon Zachariasen et électronégativité du cati )n
correspondant
Tabl.aul.4: force de liaison de quelques oxydes formateus, intemédiaires et modificateus, d'après Sun
Tabl. au l.5 : classification des oxydes selon Rawson
Tabl(au l.6 : Classification des cations selon leu force de champ (Dietzel).„ ... :'4
Tabl{au ll.l : classification des oxydes selon les valeus de ThRGFA
Tabl€au ll.2 : classification des oxydes selon les valeus de stRGFA
Tabl€au ll.3 : Classification des oxydes selon les valeurs de GRGFA
Tableau ll.4 : les différentes valeurs possibles de coefficient d'incertitude u ... : 6
Tableiu lll.1 : Résumé des calculs et résultats
Tableiu lll.2 : Exemple d'évaluation des valeurs ARvm (GRGFAm) de quelque mélané e d'oxydes
11
1
Symboles & Abréviations
Ex(iy (Mxoy) Fomule générale de l'oxyde de l'élément E (M).
Longueur de la liaison M-O dans l'oxyde Mxoy.
Energie de liaison entre le métal M et l'Oxygène (Kcal).
vMx )y Üc Ed Tm, rL Cp T8 GR( ;FA StR( ;FA ThRGFA
Volume de la maille cristalline de l'oxyde Mxoy.
La valence du cation.
Energie de dissociation (Kcal).
Températue de fusion (melting point K°).
Vitesse de germination (nombre de gemes par unité de volume et de
temps).
Capacités thermique à pression constante.
Rayon atomique.
Vitesse de refroidissement critique.
Fraction volumique particulière de cristallisation.
Intensité du champ de Dietzel.
Températue de Transition vitreuse (Glass Transition Température).
Aptitude à la vitrification relative au globale (Global Glass Foming
Ability).
L'aptitude à la vitrification liée à la structure (Structural Relative
Glass Foming Ability).
L'aptitude à la vitrification liée à la thermodynamique
(Themodynamique
Relative Glass Forming Ability).
V
I
Introduction générale
I
INTl loDUCTION GENERALE
I
Introduction générali )
Les verres sont des matériaux amorphes très anciens. L'état amorphe est caractérisé pa r un orc re local à courte distance et un désordre à longue distance. C'est pourquoi le verre rest : actuel , ement imparfaitement compris.
Le verre est formé après une transition de phase qui s'appelle la transition vitreuse ; cett } demiè .e est encore mal comprise à cause de la difficulté de rendre compte tout à la fois 1'aspec [ themt idynamique et l'aspect relationnel de cette transition [ 1 ].
L'aptitude à la vitrification est le critère utilisé pour mesurer la tendance de n'import 3 quel r iatériau à se solidifier dans un état vitreux. Plusieurs critères (traitant des paramètre ; thermidynamiques et/ou structuraux eù'ou global) ont été proposés pour expliquer c ; phéno]nène pou les oxydes Exoy individualisés. Ils sont tous fondés sur des concept; cristallochimiques ou font référence à des critères liés à la nature ou [a force de la liaison
chjmi( ue de ]'oxyde.
L'analyse non-dimensionnelle est une méthode largement utilisée pou décrim quanti atïvement certains phénomènes. Nous envisageons d'utiliser cette méthode pou évalue -l'aptit`de des mélanges d'oxydes à former un verre en déteminant un coefficier]: (caraci éristique sans unité de mesure) pour chaque mélange.
En 1932, la première étape importante a été frite par W.H.Zachariasen en vue di; répon( re à deux questions fondamentales et qui ne sont pas encore complètement résolues qu'est. 3e qu'on peut djre sur la structure des verres d'oxydes et pourquoi certains composition ; d'oxy(es forment des verres bien que d'autre ne le font pas ? Ce sujet de débats initié
pa-Golds( hmidt en 1926 a été enrichi par plusieurs travaux postérieurs, mais il n'est pas encori ; compli !tement élucidé (et reste toujours un sujet d'actualité) [2].
Le but de ce travail est de proposer un modèle mathématique pou évaluer l'aptitudi ; relativ ; (sans unité de mesure) à la vitrification d'un quelconque mélange d'oxydes.
Ce travail sera basé su :
*) des considérations mathématiques lïées au principe d'additivité de la loi classique de, [
méla" ,es
1
I
Introduction génémli )
ii
**) la classification des oxydes en (02) groupes (et non 03) : oxydes vitrifiants et oxyde ;
non-v] [rifiants [3].
Ce mémoire se compose de trois chapitres :
Le premier chapitre intitulé Oxydes et Verres est consacré aux notions générales sur le ; verres et les oxydes, ]a description du phénomène de vitrification des oxydes et les différente ; appro( hes (global, themodynamique et structuales) qui décnvent ce phénomène, ainsi que le ; explic, itions et les critères déjà établis en vu de prévenir l'aptitude à la vitrification de quelque ;
mélan ;es d'oxydes.
11 a pour but de donner une vue d'ensemble sur ces matériaux, 1eurs structures et leur ;
classei nents, ainsi que quelques notions cristallochimiques nécessaires pour la compréhension di ; l'esser tïel de ce manuscrit.
Dans le second chapitre intitulé Proposition d'un Modèle d'Evaluation de l'Aptitude à 1, L Vitrifii }ation des Mélanges, nous présenterons notre expression mathématique pour modélise. l'aptiti de à la vitrification des mélanges d'oxydes, en nous inspirant de la loi des mélange i (avec ! on principe urique de 1'additivité) et en y insérant celui de la simultanéité.
Dans le troisième chapitre intitulé Applications, Résultats et Analyses, nous appliqueron , le mo lèle proposé et analyserons et comparerons les résultats obtenus avec la littératun
techm. iue.
En conclusion les résultats les plus marquants de ce travail seront soulignés.
Cha[pitre 1
Oxydes et verres
i
Chapi re I
-LL-1.1. I is.orique
Le verre a été l'un des premiers matériaux utilisés par les hommes préhistoriques pou r
réalis€ r des outils tTanchants : l'obsidienne, verre d'origine volcanique est composé à environ si )
pou c mt de silice.
La premjère fabrication de verre par l'homme date de 12000 ans avant J.-C, il s'ag]: d'éma ix décorant les céramiques, puïs vient l'élaboration de flacons par la technique du noyai [ (sorte de moulage) 1500 avant J.-C, et le soufflage au premier siècle. Enfin, la fabrication du verre i ilat par coulée sur une table métallique fut découverte en France au XVI[ème siècle. Ci ) procéc é, modemisé et automatisé (laminage, polissage ,... ), fut utilisé jusqu'à l'invention de 1: . technii iue dite « float », qui consiste à couler le verre sur un bain d'étain. Cette technique rem 1
inutile le Laminage et le polissage.
Dans le domaine scientifique, jusqu'au Xèmc siècle, la recherche a porté essentiellemen sur la composition du verre. L'inventïon d'instruments d'optique a fortement contribué i l'avan. ée des connaissances sur le verre (ajout d'oxyde de plomb pour augmenter l'indice di réfract on, diversification des compositions des verres d'optique par ajout d'oxyde de bore et d( phospl ore). L'intérêt pou la structure du verre ne date en revanche que de la seconde moitié d` Xxèm 3 siècle, fortement stimulée par l'apparition de technologies modemes mettant en œuvr{
des vei res (télécommun].cations par fibres optiques, xérographie, par exemple) [ 1 ].
1.2. 1] troduction
Le mot «verre» représente à la fois une matière à vocation artistique ou technologique, e
des ob. ets, articles ménagers ou composants pour l'industrie. Le verre faït partie de notre vi€
quotid, =-e.
Les propriétés des verres d'oxydes et, en conséquence, leurs applications ont ét€
amélio .ées au cours des siècles. Objet décoratif, le verre est devenu ensuite un obüet d'usag€
comm` n d'abord utihsé en tant que récipient étanche, puis en tant que matériau transparent. Ur intérêt majeur des verres réside dans le fait que toute propnété peut être variée de manièr€
contim e par modification de composition. Or les modifications de compositjon sont aisémem réalisal iles et quasiment infinies. De plus il est rx)ssible de prédire la valeur d'une propriété sui
la base de relations empiriques d'additivité, chacun des constituants amenant une participatior pondér ;e à la propriété recherchée. Le verre peut être inerte, mais peut aussi joueT le rôle d'u
Oxydes et verres Chapi re I
-rTT
milieu réactiomel modulable à volonté par simple variation de la température. Les verres photo .
chrom itiques réversibles et les vitro-cristallins sont deux exemples d'application d'un contrôl ;
réacti{ nnel et du contrôle transformation physique dans un verre.
Le verre, par sa transparence ou sa couleur, est un élément de l'architectue modeme Cela i pour conséquence d'orienter les verriers dans des recherches concemant la massi du ver e (transparence, couleu), mais aussi dans des recherches concernant des modifications di ' surfac( par dépôt de couches. Initialement, les couches avaient des fonctions optiques mais e les iæuvent, par effet photo catalytique, entraîner la dégradation des salissures d( nature organique. Le vitrage devient autonettoyant [2].
1.3. D éfinition du verre
Bien que les verres soient connus depuis des mïlliers d'années, ils ne disposent pas d'un€ définit on universelle. Dans le langage commun, le verre est souvent associé au matéria` transp€ rent et ffagile utilisé pour la fabrication des vitres, il a un sens beaucoup plus vaste e. moins `acile à définir dans le langage scientifique, il existe d'ajLleurs plusieus définitions :
-Sdon J. Zaiiz:icky « iin verre est un solide non -crisfallin préseniani le phénomène d€ /rc/n6.;/, c>n v!`/rez4sc ;). Dans cette définition une distinctïon claire est fàite entre les matéria"
amorpl es et les verres. En effet, seuls les verres ont la faculté de passer progressivement et d€
manièr : réversible à un état de plus en plus fluide lorsqu'on élève la température. Au cours de cette évolution, on assiste à une modification rapide des propriétés au voisinage d'unc tempér iture, c'est ce que l'on appelle la transition vitreuse.
• Doremus ne fait, par contre, aucune distinction entre les verres et les matériaux
a.morpri es dz}:"s sa. défjmi:+ion. « Un verre est un st)lide amorphe. Un matériau est amorphe quana
il n'a pw d'ordre à longue disiance„. ».
• L'ASTM (American Society for Testing Materials) définie le verre comme un produit
inorgar ique coulé à partir de l'état liquide vers un état solïde sans cristallisation, ce qui exclue
les pol! mères manifestant une transition vitreuse. D'une façon similaire, un verre peut être défini comme une substance obtenue par refroidissement continu à partir de l'état lïquide et, en
conséq\ Lence, il atteint une condïtion qui est d'un point de vue thermodynamique et structural
analogw au liquide mais avec une mobilité atomique (ou fluidité) lïmitée pour qu'il soït
considéré comme un solide. Une telle définition limite le terme «verre» exclusivement aux
matéria u non-cristallins obtenus par solïdificatïon à partir de l'état liquide en fusion.
Oxydes et verres
i
Chapi re 1
D'autre part, il existe des matériaux amorphes (non-cristamns) obtenus par réaction e ` phase solide ou par des techniques de dépôts et qui présentent des propnétés semblables à cell€ S obser\ ées dans les verres obtenus par refroidissement du liquide.
Pour ( 3tte raison, certains auteurs préfèrent définir les verres selon leus propriétés structurale ; et ther nodynamiques et non selon la technique utilisée pour les produire.
Quelque soit la définition qiie l'on adopte, le verre est un maténau homogène dont 1: structi re à l'échelle atomique est désordonnée et que l'on peut synthétiser par de nombreuse , métho. les. La plus classique consiste à chauffer un mélange de constituants chimiques de dépar jusqu'; . la fusion, puis à le refroidir suffisamment rapidement pou que la cristallisation n'ait pa
le tem] is de se produire, le matériau se fige alors dans son état amorphe [3].
D'un point de vue structural, le verre est un solïde amorphe donnant par dïffraction au rayons X des anneaux difiùs semblables à ceux des liquides alors que le spectre du crïstal donn€
des cei 3Ies de diffractïon. (Voir figure 1.1 ) [3].
Figu .e 1.1: Cliché de diffraction X d'un verre et d'une phase cristalline correspondante
a) silice vitreuse. b) cristobalitecL
1
I
I
I
I
I
I
I
I
Chapi re l Oxydes et verres
___1
1.4. 1 a transition vitreuse
Pendant de nombreuses années, on a cherché à définir le verre de manière simpl€, notam nent du point de vue de sa transparence ; cependant, cela ne suffit pas. En effet, certatn ; verres sont non transparents dans le visible alors que certains cristaux (par exemple, ]e quartz) li ) sont. ] ,orsqu'on compare les coubes d'analyse themique (ou enthalpique) différentielle d'u i
verre il'un crïstal (figure 1.2), on constate la présence de deux phénomène:
supplé nentaires su la coube du verre :
• Um transfomation endothemique : la transitïon vitreuse. • Un€ réaction exothemique : la cristallisatïon.
-__.,_- i.i- .m
Figun .1.2. Schématisation de l'analyse thermique différentielle d'un échantillon vitreux et cristallin.
Le verre est élaboré de manière classique par refroidissement rapide d'un ljquide. Lors de cette irempe, lorsqu'on atteint la température de solidificaüon Ts, deux phénomènes peuven avoir lieu.
Si le liquide cristallise, on observe une discontinuïté de certaines grandeurs physiques
(figure [.3) telles que l'enthalpie ou volume spécifique.
Si la vïtesse de reffoidissement est suffisante pour éviter le phénomène de
cristalljsation, le Liquide passe dans un état surfondu.
Oxydes et verres
Chapiire 1
r_T_
De la baisse de températue résulte un figeage progressif de la structure par accroissement di >
la visc )sité ou du temps de relaxation vers un ordre de plus basse énergie libre. Lorsque le ,
atome; ne peuvent plus se réarranger suffisamment rapidement pou que la structure sojt en
équilitre avec la température imposée (à l'échelle de temps de la durée de l'expérience
typiqu ment 60s), le système se fige dans un état désordomé métastable vis-à-vis de son énergi(
libre : ippelé l'état vïtreux.
V oll []
Figur. 1.3. Variation du volume spécifique V ou de l'enthalpie H avec la température T au cours d'un refroidissement d'un liquide.
Zarzycki dome la définition suivante d'un verre : tt /e vcm es./ ## §o//c7enon cristalln présentani le phénomène de ircmsi[ion vitreuse. L.état physique corresï c)ndant est appelé éiat vitreux ».
.a température de transition vitreuse notée Tg, est la température où interviennent des change nents assez brutaux de diverses propriétés du verre comme par exemple, la densité, l'indic€ de réfraction, le coefficient de dilatation non lïnéaire, la chaleu spécifique ou encore la
viscosiié. Elle correspond par conventjon à une viscosité du verre égale à 10]2 Pa.s, sojt
iol3 Pt ises.
a valeur de Tg dépend toutefois de l'histoire themique du verre. En effet, plus la vitesie de tremp est rapide, plus la transition vitreuse a lieu à haute température. Ainsi, i serait plus correct de parler d'un ïntervalle de température Tg dont les bomes seraient
fixées i ar les valeurs mesurées pour les vitesses de refroidissement les plus élevées et les plus
lentes_
Page 7
Oxydes et verres
Chapi re 1
rTT-L-En outre, en raison de sa nature instable, 1e verre peut vieillir, c'est-à-dire, voir varie .
dans 1: temps certaïnes de ses grandeurs d'état. Ce phénomène sera favonsé à um
tempé ature typiquement de l'ordre de 0,8-0,9 Tg [3].
Très i!n dessous de Tg, on considère souvent que la structure du verre est celle di liquid( surfondu à la températue de transition vitreuse. C'est en particulier le cas des sïljcates ei
plus j;énéralement des verres d'oxydes qui présentent des transjtions vitreuses à de,,
tempéi atures très supérieures.
La transition vitreuse a été surtout étudiée du point de vue cinétique pa
l'inteniédïaire d'une propriété physique, la chaleur spécifique ou l'indice de réfractioi par exlmple. La description relaxationnelle de la transition vitreuse conduit à admettr{
une déændance du poïnt de transition avec la durée de la mesure liée à un processu physiq ie d'étude déteminé [1 ].
1.5. C lassirication des verres
1. Verre naturel
Des substances à l'état vitreux existent rarement dans la nature ce sont essentiellement les
verres volcaniques ou la vitrification survient lorsque la lave fondue amve à la surface de 1€ croûte errestre et y subit un brusque reffoidissement. Pami ces verres on peut citer par exempl€
les obs diennes et les Pechstein [5].
2. Verre artiriciel
Bien que des substances très variées puissent foimer des verres, seul un nombre restreini de ceu -ci ont acquis une importance pratique [4].
Dans ce qui suit, nous citons les princïpaux types de verres, leurs caractéristiques prïncip Lles et leurs domaines d'utilïsatïon :
2.1. Verre d'oxyde
Les verres d'oxyde sont historiquement les plus anciens et industriellement les plus exploiti }s. La plupart des verres sont constitués par des oxydes ou des mélanges d'oxydes tel que: Sio2, E 2o3, Geo2, P2o5.
Pa8e 8
Chapi re l Oxydes et verres
2.2. Verre de silice
Les verres de silice sont les plus importants et représentent plus de 9.5% du tonnage de ,
verres produits industriellement lls sont des matériai" transparents composés des sables d..
silice Si02) fondant à une température très élevée (1500° C), constitué par un assemblagt désord )nné de tétraèdre (Si04).
Ce matériau possède une excellente transparence dans le domaine ultravïolet. De ce fait il est t -ès utilisé dans les lampes à vapeur de mercure. En revanche, dans le domaine d'IR, i
absorb } certaines bandes puis est totalement opaque à partir de 5.10< m.
Les verres de silices possèdent aussi une bonne isolation thermïque. Ainsï le coefficien
de dila ation est de l'ordre de 10-7(K-') qui lui confère une très bome tenue au choc themique.
Les qualités optiques de la silice, le rend susceptjble de réaliser des dispositifs sous fom€ de gui( es d'onde ou de constituants de cœur de fibre optique pou les télécommunïcations.
2.3. Verre sodo-calcique
C'est l'un des matériaux de base de l'industrie modeme, il se compose de 70% mol dc
Si02, 2 0% mol de Na20 et de 10 % mol de Cao. 11 possède une bonne stabilité chimique et un coeffic ent de dilatation très élevé. 11 est utilisé comme un verre plat et creux (des ampoules électric ues et en bouteillerie).
2.4. Verre de l)orate
Les verres de borates sont constitués de l'anhydride borique 8203 qui passe systém. Ltiquement à l'état vitreux au refroidissement. Son hygroscopicité (très soluble dans l'eau)
fait quc ce type de verre ne soitjamais utïlisé seul dans la pratïque mais entre la composition de nombr€ usc verre industriels Les verres de borates ont fait l'objet de nombreux travaux à cause
de leur :empérature d'élaboration moïns élevée que celle des silïcates.
-es boroaluminates du système Cao-8203-A1203 possèdent une isolation électrique élevée . iu'ils trouvent lieu dans les applications électrotechniques.
.a famille de borosilicate du système 80Si02-158203-5Na20 est la plus adoptée dans les verres tle Pyrex, Simax ou Vycor. Ces verres sont utilisés essentiellement en chimie pour la
verren€ de laboratoires à cause de leur faible coefficient de dilatation thermique
(Voisii de 3.10< K-]) et leu bome résistance chimique.
Chapi re I Oxydes et venes
2.5. Verre de phosphate
Les verres phosphatés se singularisent des silïcates par leur faible température de fiision ,
Ieur g] ande transparence dans luv et leur faible transparence dans l'IR. Les verres phosphaté ,
sont tr ±s perfomants surtout lorsqu'ils sont adoptés aux ions des terres rares tels que l'Er3+. 11
s'avèr( nt être d'excellents candidats pour les applications à gain élevé (amplïficateus optique , compa 3ts).Cependant, les verres phosphates s'accompagnent d'une faible duabilité chimiquc
Pour p ilier à cet inconvénient, il est possible de stabiliser la matrïce phosphatée en modifiant s:
compo sition. Des séries de verre phosphaté ont été développés tel que le verre boro-phosphatt quï se trouve dans des applications majeues (scellement, revêtement) ainsi que le verre silico phospl até quï a été développé pou la technologie de conducteurs optiques (photonique) [4].
2.6. Verre de germinâtes
L'oxyde de germanium Ge02 fome un verre iso-structural de la silice à base de tétraèdret Ge04. Du fait de son prix, très élevé, sa faible réfractivité et sa moindre résistance aux agents
corros] fs, il est rarement utilisé dans les compositions verrières. Cependant son importance es
surtoui d'ordre fondamental lorsqu'on l'ajoute comme dopant dans le verre de silice pou augme iter l'indice de réfraction, ce qui en fait un élément de choix pour la réalisation du cœui des fib es optiques pour la télécommunication à longue distance [4].
2.7. Verres d'oxydes lourds
Les verres d'oxydes louds se composent essentiellement des oxydes: Pbo, W03, Sb203 As203, Ge02, Te03. Ils foment des verres avec des indices de réfractions plus élevé et un€
transm ssion dans l'infrarouge plus étendue jusqu'à sHm. Ils sont utilisés dans la mise en œuvrc des ins ruments optiques de précision (lentilles objectifs), ils jouent aussi le rôle de filtre (verre de prot ?ction) ou guide d'onde pour la transmission des signaux [4].
2.8. Verre de Chalcogénures
On appelle un calogène les éléments S, Se, Te. Ils peuvent former de verre eux-mêmes à
eux to` t seul ou avec l'association d'autres éléments du groupe IV (Ge, Si, Sn) et le groupe V (Sb, A: ), [6]. Ils forment des verres binaires tel que As2S3, As2Se3, Ges2 ou temaïres tel que As2S3i \g2S, Sb2S-Ag2S, 82S3-Li2S. Dans un domaine de vitrificatïon plus étendu, la plupart des verres i ;halcogénuTes sont opaques dans le domaïne de visible et transparent dans l'ïnfrarouge Ousqu'€ 30um). Ils possèdent également une température de ramollissement entre loo-300C° et
Oxydes et verres
=
Chapi re 1
une fa ible résistance chimique. De ce fait ils sont utilisés principalement au domaine d'optiqu } infiar( uge (lentilles, capteurs infrarouge, xérographie ,... ) [7].
2.9. Verre d'lialogénures
C'est une grande famille de verre composée essentiellement des éléments halogènes tel ; que le chlore, le bromure, l.iodure ou le fluor. On connait les verres chlorés comme: Zncl;` Bic13, Cdcl` ou d'autres verres halogénés comme.. ZnBr2, Pbl2. Tous ces verres son
transp; rents dans l'infrarouge alors que leur application reste hypothétique.
2.10. Verres de Fluorures
Les fluorures comme les oxydes peuvent fomer des verres en raison de leu rayoi
ïoniqui: de l'ion F-très voisin de l'ion 0-2 (RF-= 1,285; RO-2=1,35). Les veiTes de BeF2 et le:
fluorot eryllates foment des verres iso-structuraux de silicates. Par la suite les verres dits ABI
(Alum nium Béryllium Fluor) issus du système BaF2-CaF2-AIF3-BeF2 ont été proposés.
La révolution de verres fluorés fut enclenchée depuis 1975 par la découverte de nouvelle! séries le verres fluorés par les frères Michel et Marcel Poulain. Parmi ces verres on obtien
essentï }llement les fluorozirconates, les fluoroaluminates ou les fluoroïndates ajnsï que les verres
dérivés de ThF4 UF4 MnF2 ScF3. La plupart de ces verres possèdent une bome transmission dam
le visit le jusqu`à lHm dans l'infrarouge. Ces caractéristiques placent ces verres en tête de list€
comm€ des sérieux candidats pou l'optique et la réalisation de matériaux pour les fibres optiqu s. Ils se trouvent aussi des applications dans la chimie de dérivés fluorés.
Les verres fluorés typiques les plus connus sous le nom commerciales : Le ZBLAN :
53ZrF4 + 20BaF2 + 4LaF3 + 3AIF3 + 20NaF ou le ZBLA: 57ZrF4 + 36BaF2 + 4LaF3+ 3AIF`î.
Ces ve] res se caractérisent par leur grande fenêtre optique (200-1000 nm).
2.11. Verres Organiques
1 existe des polymères vitreux comme les poly méthacrylates qui foment des verres sous
l'appel] ation commerciale "Plexiglas" "Altuglas".11 y a des nombreux composants organiques qui con luïsent à des verres tels que : le Salol et le Glycérol. Les verres organiques ont l'avantage
de prési mter un bon facteur de mérite au dessus de 2 Ltm. En revanche, ils sont à exclue pour des applica ions dans le domaine de télécommunications (],5 H m) du fait de leur absorption résidue le et de leur basse température de transition vitreuse.
______
I
Oxydes et verres
£[:=:: t l , , (ùqrdes et, vem
2.12. Verre métallique
Les premiers amages métalliques amorphes fùrent obtenus en couches minces, mais 1{ premic r verre métamque obtenu par une hypertrempe de liquide fùt décrit en 1960 et c'est ur
alliage Or-Silicium. Les verres métalliques se paftagent en deux classes principales :
a. Alliage métal-méta]loïde, où Le métal est méta] de transition
Au, Pd, Pt, Fe, Ni, Mn et le métalloïde . Si, Ge, P, 8. On trouve par exemple Pd80Si20 e Ni80P: 0 et le verre commercïal Fe40Ni40P 1486.
b. AHiage métaLméta[
On a Mg65Cu35, Au55Cu45, Sn90Culo, Zr72Co28, Zr50Cu50, Ni60Nb40. On € égaleir ent Pd40Cu30Ni30P20. Les verres métalliques ont fàit l'objet de nombreuses recherche! en rai.on de leurs propriétés mécamques remarquables. L'une de ces propriétés la plus intéres :ante est leur haute résistance à la conosion ; c'est pour quoi, ils peuvent être utihsé£ comm revêtement anticorrosion [4].
1.6. C lassification des oxydes pour les verres d'oxydes
• Composition des verres d.oxydes
Même si la silice pure dans sa configuation amorphe (la silice existe égalemeni sous f ime cristallisée dans la nature et n'est pas considérée dans ce cas comme un verre) peui être co isidérée comme un verre, les verres ont généralement une composition beaucoup plus compl€ xe. Cette capacité à inclure une grande variété d'éléments est liée à la structure amorph€ des ve.res qui favorisent 1'existence de très peu de contraintes stœchiométriques. Les él;ments entrant dans la composition des verres d'oxydes sont généralement sous fom'ie 3ationique, afin de fomer 2 oxydes avec 1'anion oxygène 0. Le chojx des constituants
et leur£ proportions est quasi-illimité. En effet, la plupart des éléments chimiques existent sous
fomie i l'oxydes à l'état naturel (roche) ou bien sont fournis par 1'industrie sous forme d'oxydes ou de ( omposés susceptibles de se transfomer en oxydes au cours de la fusion. Les constituants des veires sont classés en trois catégories selon le rôle structual qu'ils jouent lors de la vitrific,Ltion (tendance qu'aura une solution liquide à vitrifier autrement dit à former un verre € u cours du reffoidissement) : les fomateurs de réseau, les modificateus de réseau et les }onstituants secondaires. Voici m petit récapitulatif du rô[e de chacun.
Oxydes et verres
Chapiire 1
I
1. I.es oxydes formateurs
Ces oxydes à l'origine de la formation du réseau, les éléments fomateurs les plu.
courar ts Sont : Sio2, Geo2, 82o3, P2o5, AS2o5, V205.
Si02 : 3'est le vitrifiant par excellence dans l'ïndustrie verrière, trouvé dans la nature sous fom de sab e (quartz), la température de ramomssement de Littleton de Si02 pur et de 1540°C. lt verre a 96°/o de Si02, il résïste parfaitement à tous les chocs themiques qu'on peut imaginer et i
est util sé dans les lampes et les cuve u.v. en raison de sa transparence dans ce domaine.
B203 : peut jouer un rôle important pour la vitrification, car il est à la fois u oxyde fomateur es
un flui ]ifiant. Ainsi, l'introduction d'une petite quantité de 8203 dans le réseau de silice, rend 1: fonte [ lus hquide.
P20s : l'anhydride phosphorique vitreux n'a pas de résistance hygroscopique suffisante pour êtr{ utilisé seul, sa structure est à base de tétraèdre (P20) distordu, l'une des quartes liaisons étan double ceci entraine que seules 3 liaisons participent à la fomation du réseau.
Gst)2 fome un verre iso- structural de la silice, à base de tétraèdre (Ge04), son importance es
surtout d'ordre fondamental [ 14].
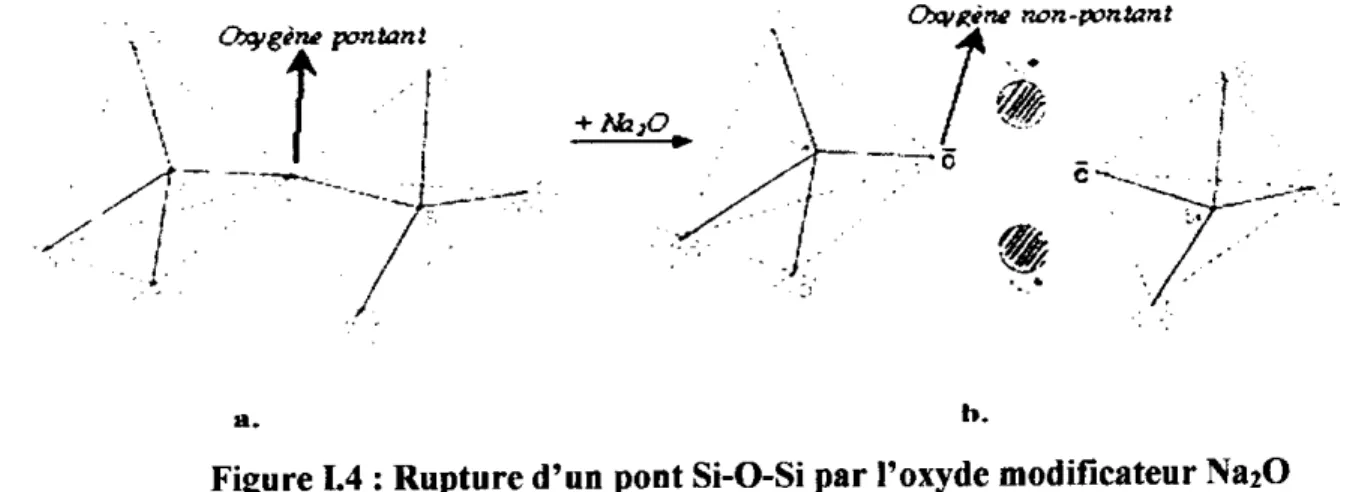
2. Les oxydes modificateurs
Les modificateus de réseau cassent les liaisons entre les polyèdres du réseau vitreu provoq Jant une dépolymérisation de ce demier, ils transfoment alors les oxygènes pontant (lié€ à deux cation formateur en oxygène non pontant, liée à un seul cation fomateu).Ceci se traduii
à l'écl-3lle macroscopique par une dïminution du point de fusion et de la vïscosité. Ce soni
essenti }llement les oxydes alcalins et alcalinoterreux tel que ; Na20, Cao, K20, Bao, Lï20.
`,\ @Ï
ponùlnt/T---
--Ô ê_ .
h.
Figure 1.4 : Rui).ure d'un pont Si-0-Si par l'oxyde modiricateur Na20 a. réseau de silice, b. formation d'oxygène non-pontant.
Oxydes et verTes
Chapiire 1
Na20 c'est l'oxyde le plus employé, son introduction abaisse la viscosité, augmente 1( coeffi(ient de dilatation et la conductivité et diminue la résistance chïmique. Les verre: (Si02- ¢a20) sont solubles dans l'eau.
Li20 : il est le flux le plus actif et augmente l'aptitude à la vitrification en dïminuant la vïscosité.
KzO : e remplacement d'un peu de Na20 par K20 diminue le point de fusion. L'ion K+ étan
bien p us gros que Na+ pemet une meilleure séparation des tétraèdres Sf04 et dlminue 1€
vïscosi é. On estime que 10% de Na20 ont le même effet su la viscosïté que 7% de K20
Par ail eurs, les bandes d'absorption de la lumière par Fe+3 sont déplacées en présence de K+ ei [e vem devient blanc.
Cao : 3'est un ingrédient essentiel des verres industriels, il améliore la résistance chimique des verres i Si02-Na20), diminue fortement leur solubilité et abaisse ]eur viscosité.
Bao : 1 agit d'une manière semblable à Cao, en outre 11 élève l'indice de réfraction du verr€
d'où s( n applicatïon dans les verres d'optique [ 14].
3. I.es oxydes intermédiaires
Certains oxydes peuvent fonctïomer suivant les compositions dans lesquelles ils entrenl soit co nme formateu, soit comme modificateur ; ils portent le nom d'oxyde intemédiaire, tel
que:
A1203 le rôle de l'alumine dans le verre est l'un des plus difficiles à cemer. Quand il est seul, cet ox} de ne vitrifie pas. Introduit dans la silice pure, Al+ adopte la coordinance 6, inapte à la
fomatim d'un réseau vitreux, il joue alors le rôle de modificateu. Mais lorsque A1203 est
introdu t dans un verre contenant des alcalins, il devient possible à A13+ da se substituer à Si4+
dans 1( réseau si à son voisinage, se trouve un Na+ qü compense la charge négative.
A1203 imélïore la résistance mécanique et chimique du verTe, augmente le coefficient de
diffusi( n des ions alcalins, diminue la tendance à la démixtion.
Pbo : i nérite une mention particulière, car il peut donner un verre même si on lui ajoute 8% en
masse ( e Sio2.
Pbo a` gmente l'indïce de réfraction (uti]ise dans le verre cristal) et la résistivité électrique à fort
teneur i 40-80°/o), il seii dans le verre protecteur contre le rayon X, il diminue Tg et favorise les
séparat ons des phases d'où son emploi comme opacifiant dans certains émaux.
1
Ë==Î] re [ , „ „ Oxydes et venLÊî. Zno : augmente la dureté du verre.
Cdo : entre dans la composition des verres protecteurs contre ]es neutrons themiques à for ,
teneu (30"%).
Ti02 : augmente l'indice de réftaction, fàvorise la séparation des phases (utilisation dans le{
vitrocé ramiques) et améliore la résistance aux acides.
Zr02 . agit comme Ti02, fàvorise la dévitrification et la séparation des phases.
Le tableau (1.1) donne à titre indicatif les proportions exprimées en % des masse! d'oxyc 3s des verres industriels courants et de quelques verres typiques spéciaux[ 14].
Tal ileau Ll : composition (en % de masse) de quelques verres industriels : d'après J. Zarzycki. [14]
Formateurs de réseau Modificateurs de réseau
Si02 820, A1203 Na20 K20 Cao Mgo P
erre plat 72,5 1,5 13 0,3 9,3 3 ! à boutellles 73 1 15 10 Pyrex » 80,6 12,6 2,2 4,2 0,1 0,05 •e de veire 54,6 8 14,8 0,6 17,4 4,5 C,istal » 55,5 11 e de lampes 73 1 16 1 5 4
On remarque que le verre plat est celui dont la composition est la plus proche des verres
que no is avons utilisé (verres sodo-calciques).
1.7. A ptitude à la vitrification des oxydes et des méLanges
1.7.1. La vitrification
La vitnfication est la transformation d'une substance en verre, habituellement, elle esi réalisé{ par un refroidissement rapide d'un liquide via sa transïtion vitreuse. Certaines réactiom chimiq ies peuvent aussi entrainer la fomation de verres.
Oxydes et verres
Chapil-e I
-F_
La vitnfication est une caractéristique des matériaux amorphes ou des système: désord)nnés et se produit lorsque la liaison entre deux objets élémentaires (atomes
moléc`]es„..) dépasse en énergie un certain seuil. Les fluctuations themiques brisent ce! liaison :, ainsi plus la température est basse plus le degré de connectivité est élevé. A cause de c(
phénoi ]ène, les matériaux amorphes ont une température-seuil caractéristique appelé€ tempéi iture de transition vitreuse (Tv) : en dessous de (T`,) les matériaux sont vitreux, au-dess"
ils so" liquïdes.
Dans u i sens plus large, l'encastrement d'un matériau dans une matrice de verre est aussi appel€ vitrific ition. Une importante apphcation dans ce sens est la vitnfication des déchets, notammeni dans li; cadre de déchets nucléaires, afin d'obtenir un composé stable et plus pratique é
stockei [8] .
I
1.7.2. L'aptitude à la vitrification
Pour bien comprendre c'est quoi l'état vitreux, il convient de revenir su ]'évolution d'm liquide lorsque sa température décroit. En effet, la vitrification des liquides n'est pas un phénor `ène inéluctable, celle-ci se produit aisément pour un liquide polymère ou bien formé
d'un n élange d'oxydes riche en Si02. Elle est par contre particulièrement difflcïle, volrc inacces sible, pour la plupart des métaux.
Certains liquides (matériaux) peuvent être refroidis au-dessous de leu point de fiision pour fc rmer des verres. On a cru que seulement quelque systèmes, comme ceux basées sur des silicate ; et des borates pou-raient être induits à la fomiation du verre. Cependant, ces demières années une large variété de systèmes a démontré que la possjbilité de formation du verre n'est pas aussi hmitée. En effet, des verres ont été même fomés d'une série de systèmes
métalliitues[13].
1.8. Ci }ndition de vitrification
)e nombreuses études ont été faïtes pour expliquer l'aptitude à la formation vitreuse. On peut lei classer en deux catégories : les unes fondées sur des concepts structuraux, qui font appel
à la dis tribution spatiale des atomes ainsi que leur force de liaisons. D'autres critères basés sur
des co isidérations cinétjques occultent complètement l'aspect structural et constituent ]a
deuxièi ie classe [9].
Oxydes et verres
Chapiire I
T-LLï=
1.8.1. Théories fondées sur les concepts cristal]ochimiques
Etant domé la grande diversité des substances formant les verres, il est difficile dH trouve des critères pouvant s'appliquer également à différents cas. A cause de leu importanci. pratiqi e, les verres d'oxydes ont retenu tout particulièrement l 'attention.
1. Critère§ de Go]dschmidt (1926)
En 1926, Goldschmidt a étudié la structure des verres d'oxydes inorganiques. 11 i
dévelo )pé sa théorie sur la fomation vitreuse pour un oxyde simple de type Mmon (M le cation)
11 a égi lement considéré que la fomation vitreuse est possible si le rapport des rayons atomique! (ra Ac) est compris entre 0.2 et 0.4, ou (ra) et (rc) sont respectivement les rayons ioniques d€ l'anior et de cation. Cette condïtion est satisfaite pour les oxydes Si02, 8203, P205 et Ge02 ; e. par la .uite pour BeF2. En cristallochimie le rapport (ra/rc) implique une structure tétraédriqu€
avec { arions aux coins. Par conséquent, Goldschmidt a affimé que cet arrangemen. tétraéd .ique est nécessaire pour la fomation vitreuse. Mais cette condiüon n'est plus applicabl€
pour c{ rtains cas, par exemple l'oxyde Beo impossible de le vitrifier [ 15].
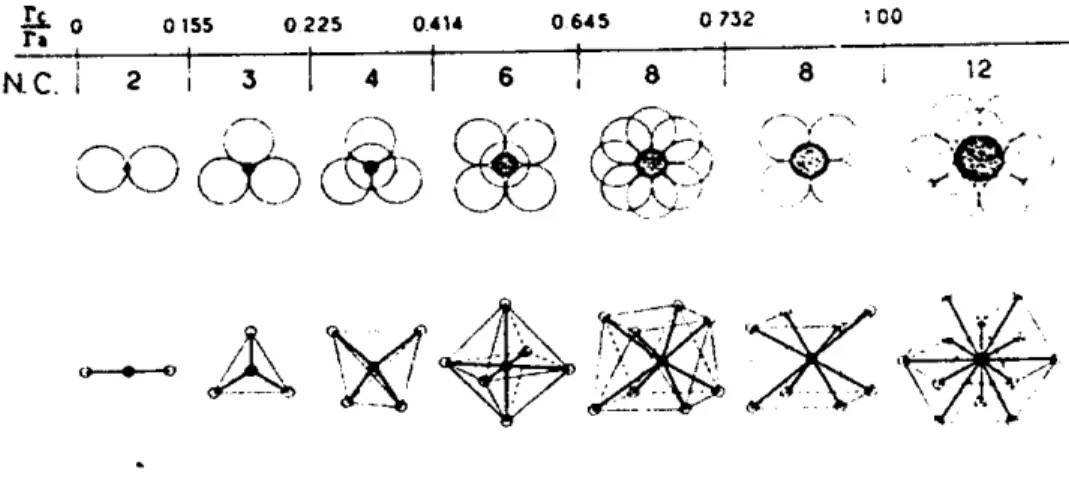
Or, d'après les considératjons classiques de cristallochimie, pour des structures ion]ques
le rapr .rt (r/ra) est en relation directe avec le nombre de coordination du cation central (voii
figure ) 5). L'intervalle proposé implique donc une coordïnation tétraédrique [16].
Ëo o,ss 0 22S 0_.`. 0 6.S 0 732 : 00 NC.121 3
cïzj cÎ, cæ
Oi8' k` ,-`_,,-```,+
^`Figu re 1.5 : Domaines de stabilité des polyèdres de coordination en fonction de la taille respectÉve des cations et anions.
tydc
rc/r,
Viïiific:~aïion
80
0.53
dimcile
io:
0.45
difflt.ile
\
JO.i
0,39
difïlcilc
t.OÎ
0.30
alsce
io:
0,1{)aiséc
!0_`
0.13^iséc
€0
0,12di'ficilc
ÎO.'
0.09
Aiséc
I
Oxydes et verres
Figu .e 1.6 : Représentation schématique à deux dimensions d'un arrangement atomique dans (a) cristal e. (1)) verre, selon Zachariasen.
Zachariasen a également proposé un ensemble de règles pour tenir compte de cett€ structu e :
1. Le r ombre d'atomes d'oxygène entourant n'importe quel cation domé doit être petit.
2. Auc in atome d'oxygène ne doit être lié à plus de deux cations.
3, Les polyèdres fomés par les oxygènes dojvent avoir en commun uniquement leurs sommets et non eurs arêtes ou leus faces.
4. Au ] ioins trois sommets de chaque polyèdre doivent être partagés avec d'autre polyèdre. Ces conditii )ns sont remplies par des oxydes de types M20i, M02 et M205 ; et pratiquement a été confim é par l'existence des verres de 8203, As203, Si02, Ge02 et P205.
=oncemant les systèmes à plusieurs constituants d'oxydes tels que le binaire M20-Si02
la situa [ion évolue d'une manière spectaculaire. A tïtre d'exemple, l'addition de Na20-Si02 a
pour ef `et séparation des motifs Si-O-Si représentés sur la figure(I.8) [ 15].
00
0\ +Na2o
Na®
Sj_
€,3f `o
Figu .e 1.7 : Illustration schématique de l.effei de l'addition d'oxyde alcalin (exi) Na20)
à la silice,
Oxydes et verres
Chapi,re 1
Le modèle de Zachariasen-Wanen représenté schématiquement à la (figure 1. 8) a domini . pendai t plusieus décennies la science du verre et constitue encore la référence habituelle.
.... `
-•sli~ 01-,>-,
Ï\-a-Figui e 1.8 : (a) Rupture d'une liaison Si-O-Si par le sodium (b) Modèle du réseau continu désordonné de Zachariasen-Warren.
Dans les verres de silice pure, tous les ions 02- qui sont liés à deux cations Sï4+ s'appel lent des oxygènes pontant. L'insertion de l'oxyde Na20 coupe la liaison, et les ions 02.
ne part igeant plus qu'une seule liaison avec Sï" s'appellent oxygène non pontant. Dans ce cas, la silict ; joue le rôle d'un formateur de i-éseau, tandis que, Na20 agit tant que modificateur d€ réseau. Certains oxydes jouent suivant le cas le rôle d'un formateur ou d'un modificateur, on les appelle oxydes intemédiaires.
Zachar asen a classé les oxydes selon leus caractères ; comme le montre le tableau (1.3) Le modèl€ de Zachanasen souffre de nombreuses exceptions, notamment les verres d'oxydes à base de coo dination octaédrique comme les verres de tïtanates, ou encore des coord]nances plus
comple {es comme les tellurates [10].
• Classification des verres d'oxydes selon zachariasen
1 existe plusieus façons de classer les verres. Zachariasen s'est particulièrement
intéressé aux oxydes. En effet,11 a montré qu'un oxyde fomant iin verre devrait satisfaire
plusieu s règles : L'échantillon contient un pourcentage suffisant de cations entourés par des tétraèdi 3s ou par des triangles d'oxygène. Ces tétraèdres (cas du Silicium... ) ou ces triangles n'ont d3 commun que les sommets. Certains atomes d'oxygène ne sont simplement liés qu'à
deux d€ ces cations et ne foment pas de nouvelles liaisons avec d'autres cations [10].
Oxydes et verres
Chapiire 1
j--Le tableau (1.3) donne la classification des principaux oxydes dans la pratique :
Tat leau L3: Classifications des oxydes selon Zacliariasen et électronégativité du cation correspondant. |10]
Ox}.de ç fomiate`u.ç Ox}-des iiiiem`édia ireç Ox}.des niodificate`u`
."bole
Electi.oné&ati`.ité` S)1llbole Electi.ciiiég<iti`.ite S)1nbole Electi`onégati`'itdu c{1'loll d\l ca'ioll d\' ca'lon
0.
1_8 AIJ03 1_5 Li'O 1.0 •03 1.9Pbo
l.S \-a=O 0.90,
2.1 Zllo 1.5 K'O 0.8 :0` l.S C'do l.J Rb'O 0.S J05 2.0 TioJ 1.5 CsJO 0.-•î03 1.6 C`ao 1 05 2.0 I-a=03 1.2[.8.2. Théorie liée à la thermodynamique L. Critère de sun (1947)
Comme les processus de réanangement atomique au cours de la cristallisation entraineni
la rupt ire des liaisons, Sun a tenté d'établir une coiTélation entre la force de ces liaisons et l'aptitu le des oxydes à vitrifier.
-a « force » de la liaison M-O dans un oxyde MO` a été calculée en divisant l'énergie de dissoci; tion Ed de l'oxyde cristallin en ses éléments à l'état de vapeur par le nombre des atomes
d'oxygi .ne entourant 1'atome M dans le cristal (ou dans le verre), c'est-à-dire, par son nombre de coordin ation. Ed a été évalué à partir des mesures spectroscopïques.
•es valeurs des « forces de liaisons » ainsi calculées sont données dans le tableau. On
peut c)nstater que les «formateus» ont des «forces» dépassant 90 Kcal/mol, les « modi] icateus » des forces inférieurs à 60 Kcal/mol, et les « intermédiaires » correspondant à
60-73 F cal/mol.
)ans l'utilisation de ce critère, il faut que toutes les liaisons soient de même type.
Si on 'appliquait au C02 par exemple, on trouverait pour la force de la liaison C-O :
120 Kc il/mol, or les molécules de C02 ne forment pas de verres. La force de liaison C-O ne
compte pas devant les faibles forces de Van der Waals intemoléculaires [9].
I
1
1
I
I
Oxydes et verres Chapiire 1ï-riT=
Tab]eau 1.4 : force de liaison de que]ques oxydes formateurs, intermédiaii.es et modiricateurs, d'après Sun. [9]
l rL`t,\. JL- \``,nt¥`. `ll.
` l dir` `I( )` \ |}ci```. di```i..ij`a ```¢üifLili`m
l,J ll\Jl ''1,!'.l ,
1 "m'~n
1'\'
\1 'h lL./,
\'odirr,i(en
\'
lJ\
\''
(,, lîl< t I __4, '= <E'` .`u, J\< 1 {rll. ùL. 1 l.JIvm t ' L \ J 1 r' * ` !\- ' 2. Critère de Rawson (1967)=n 1967, Rawson a amélioré le critère de Sun : il divise le facteur Fi par la température de fusïon i le l'oxyde, pour tenir compte du fait, qu'un oxyde vitrifiera d'autant plus facilement que ]'éncrg e themique à éliminer par la tremp sera faible, limitant ainsi les possibihtés de réarran ;ement d'atome par diffusïon.
Oxydes et verres
Chapi,re 1
jiEiiii
-D'après ce critère, on sépare mieux un fomateur tel que Si02 pour lequel la force di!
liaison de Sun est 106 Kcal/mole et Zr02 avec 81 Kcal/mole, mais qui à cause de son point di:
fusion élevé possède un paramètre de Rawson ïnférieur et ne fome pas de verre [11 ].
Malheureusement, le critère de Rawson souffre, lui aussi, de nombreuses exceptions.
Tableau 1.5 : classification des oxydes se]on Rawson. [11]
Oxyde Force de liaison BMi)
Poin( de fiision L
Paranièm de
ŒcaL,''mole) (OK)
Râ\i.sonB\io''L
8!03 119 o`i 89 723 0.164 ou 0.122
Sio` 106 1993 0.053
Geo!
108 1388 0.078P:06 88-111 843 0.104 ou O.3 l
V:O) 90-112 943 0.09! ou O. l l9
1.8.3. 1 héories structurales de ]a vitrification
1. L'intensité du chami} de Dietzel (1942)
Le pouvoir polansant des cations, c'est-à-dire l'aptitude à défomer un nuage électroriquc (celui ( e l'oxygène pour ce qui conceme les verres d'oxydes) peut être estimé grâce à la notion de forc 3 de champ. Celle-ci prend en considération la charge Z du cation ainsi que la distance moye"ie cation-oxygène, notée au sein du verre. La force de champ F s'exprime alors de la façon suivante : F=Z/a2 (a dépend de la coordinence du cation). Cette formule est issue de
l'expre ;sion de la force qu'exerce un cation sur ses premiers voisins dans le cas d'un modèle
électro! tatique de charge ponctuelle. Cette notion est importante, car elle pemet d'établir une
classifi :ation des différents cations ; par exemple, le critère de Dietzel [19], indique que les ions
modifi{ateus sont caractérisés par une faible force de champ, inférieue à 0,35 [9] (faible charge, rayon ionïque et coordjnence élevés) (tableau ,1.6). A l'inverse, les ions fomateus de réseau )résentent une force de champ élevée, située entre 1,4 et 2 (forte charge, rayon ionique et
coorditi 3nce faibles) [12].
I
I
I
I
I
Oxydes et verres Chapi,re 1r_F_
rableau 1.6 : Classification des cations selon leur force de champ (Dietzel). |12]
``, ,` \`::f.,-' 1 ``,, \' !`,,.:` ! f,,\, ',`"r{:,\.., L..,,,,.. i, F `ït,`. `\ f`-`ï,`, , (;'-' r( `\ \ i l\r`'J.``. ` ,\ .. •.\ • ' ,).
ï,'„
1', \,, „ , ' ,-,. ! `.l,t / ' '! (,J ``::*`r. :-, :. `, ,.`.<1` `.,Selon Dietzel, les cations fomateurs ont des valeurs de l'intensité du champ élevées (de
1.3 jus( u'à 2), les oxydes modificateurs ont une intensité du champ faïble (de 0.1 à 0.4), et ceux qui ont des valeurs de F entre 0.5 et 1.1 sont intemédïaires. Apparemment, les cations quï ont
une intmsité du champ forte se repoussent fortement, en même temps, leurs petites tailles exigent des polyèdres de petit nombre de coordination avec l'oxygène. Ces deux facteurs favoris( nt les arrangements désordonnés. Les cations ayant une intensité du champ faïble, dans
l'autre i ,oté, peuvent se rapprocher.
1
I
£:=LtreiiPropo3itiond'umodè]ed'ftLLütionde,l'.ptitudeà1.vitrifiœqondœmLÉ!!!Ëï
11.1. [ntroduction
L'aptitude à la vitrification (Glass Foming Ability, GFA) peut-être définie comme éta] it la ten hnce à la fomation d'un matériau amorphe (un verre), c'est-à-dire, sa capacité d'éviter ! a gemi iation et la croissance de cristaux.
GFA est caractérisé par la vitesse critique RC, mais elle est difficile à mesura.. Cepei dant, l'aptjtude à la vitrification (GFA) d'un alliage peut-être représentée souvent à part r de l'a` ialyse themique d'un verre métalhque mesué par calorimétrie différentielle à balayag 3 (DSC , il permet également de suivre l'évaluation de la structure analysée en fonction de la tempé rature.11 est possible d'extraire un certain nombre de températures caractéristiques, a i relève la température de transition vitreuse (Tg), [a températue du premier pic de cristallisatio i
(Tx), a température de liquïdus (Ti). A partir de ces températures, plusieurs critères ont éié
dévelt ippés afin de quantifier la capacité d'amorphisation du verre obtenu. Néanmoins, le calci 1 de cef indices de GFA nécessite de pouvoir mesurer les températures, et donc d'être en mesui 3 de pr( duire uri verre. Ils n'ont donc aucun caractère prédictif, mais permettent de se confront€ r avec i lus ou moins de succès aux valeus de diamètre critique(Dc) obtenues. Un de ces critères ] 3 plus u [ilisé est la température réduite de transition vitreuse (Trg = TgÆi) introduit par Turnbul , ce pai amètre est lié aux taux de geminations homogènes dans un liquide en surfusion et il ei t classit iuement admis que les verres présentant un Trg proche de 2/3 ont une grande capacité i forme -un verre (GFA). Plus Trg est grand, plus Tg est proche de Ti, et donc plus la viscosité d i
liquid } entrant en surfusion est grande.
La cristallisation est ainsi gênée et il est possible d'utï]iser des vitesses de trempe plu s
mode! tes menant à l'obtention de phase amorphe dans de plus grandes dimensions [17].
La synthèse de la recherche bibliographique nous a pemis de :
*) retenir l'existence d'un modèle mathématique global GRGFA (ARvm) défini par 13 produ t mathématique de 02 critères (TIŒRMODYNAMIQUE : ThRGFA et STRUCTURAL : StRG] 'A) pou la vitrificatïon des oxydes.
**) envisager un modèle de vitrification global pou les mélanges d'oxydes : GRGFAm.
I
Chap itre 11 Proposition d'un modèle d'évaluation de l'aptitude à la vitrification des mélai iges
11.2. Critères de vitrification des oxydes
11.2.1. Aptitude à la vitrirication relatÉve à la thermodynamique (ThRGFA)
En se basant sur l'aptitude à la vitrification des oxydes simples, 1'analyse de b littéra :ure a montré que tous les critères mentionnés précédemment semblent êtTe utiles pou : a comp éhension générale de l'aptitude à la vitrïfication. La méthode non dimensionnelle poi r ana]y§ er les données expérimentales a pemis à Rao et al. (2004) I'étude de la tendance d'u i grand nombre de matériaux à fomer un verre. L'auteur a proposé ]e critère G, lié aux facteus d 3 la liai m (force de liaison et iconicité), la structure (les contraintes et l'asymétrie de la taille) ( t
la visi ;osité (1'entropie configurationnel) et estimé « . . . G est me fonction de produit pour d€ s
matér aux simples et prévus d'être un facteu de mérite » (Rao et al 2004). Rao a classé le s
oxydes les plus utilisés ainsi : 8203 , Si02 , P205 , Ge02 , Mo03 , Te02 , V205 , W03 , Pb02 ,
Sn02 Pbo , A1203 , As205 , Li20 , Mgo , Na20 , Cao.
Dans un article publié par N. Boubata et al [18], utilisant les données de L'IUPAC € t NIST et obéissant aux règles fondamentales de l'analyse adimensïonnelle mathématique, ce ; demie rs ont suggéré de prendre en compte une caractéristique themodynamique précédemmer t
omise dans les autres modèles : la capacité calorifique isobarique(Cp) évaluée à la température d 3 fusion (cecl était l'objectif initial de Rawson (1956,1957) qui avait confondu entre li
tempé .ature et la chaleur). L'équipe a proposé d'ajouter la valeur de Cp (calculé à la températur } de fiis on) au dénominateur de la formule de Rawson, ce qui le rendre adimensionnelle.
L'analyse mathématïque non dimensionnel]e pemet de décrire n'importe qu'ellu phéno nène par une simple équation non dimensionnelle (sans unités de mesure, comme le ;
atome . et l'électronégativité) [ 19].
Le nombre des équations non dimensionnelles E est donné par la différence P-U, où P es le non bre des propriétés étudiées et U est le nombre des unités de mesure (S.U.). Dans ce cas l'aptitude à la vitrification est le phénomène étudié, tandis que P=4 (Ed,1, Tm, Cp) et U=:
(cal, n, ol, K).
Ainsi, E=P-U=4-3=], cela veut dire que l'aptitude à la vitrification peut-être décrite pa
une et 3eulement une équation (c'est en conséquence, une équation adimensiomelle). [18,19]
ThRGFAEX°y = EËaws°n |Cp= EÊun| (Tm . Cp) [11.1 ]
1
1
1
I
I
1
1
I
Chap itre 11 Proposition d'un modèle d'évaluation de l'aptitude à la vitrification des méla
Ce nouveau critère a pemis de classer les oxydes en trois groupes (fomate intern iédiaires et modificateus) selon leus valeus spécifiques (portées su le Tableau 11. 1 ) : *) Ox /des fomateus : ThRGFA 21. 709xi03,
**) 0 [ydes intemédiaires : 1.569 x 103 2 ThRGFA 2 0.8i2x i03, ***) ()xydes modificateus : ThRGFA s 0.743 x |03.
Tableau 11.1 :classification des oxydes se]on [es va]eurs de ThRGFA (18].
EI{' Ædiu/mtic} }àm CF/L]hîk-X! Suniu'müiaî Rawi`ÜiïkJj'"ür`Ki "Gi.`A -ii+` rm3Œp
14_is.aî T''.î 9fit,5 Î3f'7._%
1""
!80I.S# 113ù% 14l,fl2 177:.3= l)f'!" !S76-8! 1847.5Ô 35ü,!4 iEl_iE '1?! ÊÆ 3-".5 1%3' 104a lgw.,, -"?.3 m 1 .9! m.k EÆ !4,5 933..i Hffi 919é l.m.35"
91 1.3 lm4.% ul,IÜ"
lœ? m12 ' 10?.76 ®#.8 ".2+ _itt! 4#).7 tL¥3`" l tt._t l(`X`.`i GÙÊiï!`t,imicr rH3 l !).19 .ç.#+ï{: i"ùÉ lï..iffw! 5-3"ri7 ïL5.1T595 +.VÏIJ1183 iL51155t) +"t% Ü324¥# +œ4" ŒH,541 3.5_® 1 _% "3Ü3j§ 3, =Xfig: O.3216m }lT"3 0-1537_19 2-m" (tJW_W !.,45 3hj O..W l iü 3..f .î?811 0,24ST# 2.12W15 03"5î !.OSÂ7„ n`2¢io7Ü l -ti£r)759 0.!3293: l.719lT: o-3æ.T79 l.nmlm.1 0133fiLç* 1."241 lnœ"liaæ tLO9l ffü l..%} S4 t"rfts O,!f)lft)7 1.14551: ¢l J32st l. 'i_"J (wlfit}lçljg l.(m502 «lœï»3 wœomü (}{t5i46 ! i.ûFm Œ0"'!28 0.ilft5¢0 lw7Üé70 (L¢+l¢)SIL (l+Iætgl+ (}9tl2!7 0J()515q3 (1919=1 n. t Ë 3ü o,g3t}.w? "Hm5 0.8l ïg l lt»54#l B 0.813_%: o+w6æ6 0 743* Mtüücr OJ)7Ô3fi? (Lî.Üflo üük{wwaw: ti. 7£&ir7:
l}œ&:1)15 {Lmstr?4 «_i_"9 ('¢++X2Li "}mr!77 {i6 i 65.r6 m3?4ô.î lït-11338o (JJl.i:35E É}S 15H» iSm5.-!s4li tl..q.yp2m tü,5?]:t' 0.W.Ç?_t.,
:±ltTe11Proposltiobd.unmod_çled'évt]utbndç.|.îptitHd€ÀLwftrifiœtiondœméh:==
Dans le premier groupe ( les oxydes fomateurs), 8203 apparait alors qu'il est absent dai \s
la cla #ification de Sun et/ou Rawson. Selon les classifications précédentes, Zr02 et A1203 sŒ it
incon -`omément supposés des formateurs de réseau vu leurs températures de fùsion Tm élevées
L'htroduction de la capacité calorifique isobare Cp (comme caractéristiqie thermdïnamique indispensable) dans ce nouveau modèle a permls de les reclasser dans ]e
group3 adéquat (intemédiaires) des oxydes selon leurs valeurs respectives (1.]5 et 1.14) dJ ThRGFA. Ainsi, les ambiguités de la classification de Sun et Rawson sont definitivemei t levées[18]. La confüsion de la classification de 8203 et Zr02 est résolue : le premier est ui
forma eu pendant que le deuxiéme est un intemédiaire.
De plus, les valeurs obtenues de ThRGFA des oxydes sont confomes avec l'idée d3
Angell qui regroupe les oxydes formateurs comme « oxydes formateuLrs forts » « oxyde;
foma eurs ffagües ».
1122. Aptitude à la vitrification relative à la structure (StRGFA)
D'un point de vue d'analyse non dimensionnelle, Boubata et al ont introduit les critère ;
structi raux suivants : la valence et le rayon pour redéfinir l'aptitude à la vitrification du point di }
vue str ictural. Cette aptitude peutétre décrite par une seule équation adimensionnelle:
SCÆGFA=F#=
æTri x T#
t,c v „xoy [11.2]Ou:
F est l'intensité du champ de Dietzel ;
VM\°y est |e volume de la maille de l'oxyde ;
L#;:y est la longueur de la liaison entre les ions dans l'oxyde considéré (1.26A° est le rayon de l'an on oxygène o2-).
Le critère de Dietzel (qui tient de la valence du cation et du rayon ionique seulement) sera éendu et amélïoré par l'introduction de ces deux paramètres (comme rapport
volum€ 1ongueur pour être en accord avec les règles d'analyse adimensionnelles).
.a longueur de la liaison (longueur iomque) devrait être considérée comme un paramètre
essenti{ 1 qui distingue entre les liaisons ino - covalentes. De même, le volume de la maille du
cristal i quï dépend de la forme, du nombre total des atomes et du nombre des liaisons M-O)
__
I
=:=l_treHPTopŒitiond'unmodèJed'ft.lu.tiobde['apûtud€àhvftrtfhtiondœpç!±=
devra t être cons].déré. Ces caractéristiques structurales ont été omises par Dietzel. Les calcu s
selon 3es considérations sont portés su le tableau 11.2) [20].
Tableau 11.2 : classification des oxydes selon les valeurs de StRGFA [20].
CC •* 5 a: É: Êç!.JË,.`='=`Êgf`if:r::`f`..`ê,i.t2>Ë¥ =3ë=2Ï2r=£:82sÎ#L;€S --- r. -.i r. r. .i ri +. ri r. ~. r. ri r. ri ri ~ -i i .r` ..\ r -`r .r t C t .r ii-.t i r ~ { .r Ê É .g, Î '= Î, Ë â Ë § § :fï Ë Ë Î Î ;'{ çî Ê, :i f±: ë, É Î Ë È`: È. Ë r:, uî ,= 2 F` 5 i :: Ï~ r: Ë é ',- < X) r, - ',. & *-,-, & ,'' x t -,-, rJ -1: -r ---- J= = -...,,-.,,-, \. * £ + * * - + + * + * f f\=- .lzè'.x:'[` *ë£f,,' 'Ë 3 î=J .Ë :j` fi î! È .Ë, Ë 'É '± {: Ê Ê § Ë Ê 3`:fl:#ÊÈ'3Î*3î;Êæî,3?ÊÎ53ÊÊ3-É.Ê. :,.Î.É5É'5:É.Égç3.;'3.Î.3`:.fî3, = = 'i üf `- ..9 8 .Î Z .J ,r` [`,,., P, S }'. ir=: S` t r; ; ! Î z ; ¥ £ = tF =r j 3 ±Ï = 3 j+ € = f ; € a '5 = € à` :; ; = Ë = ri .Ïi ,t ;,. = r, = = = Ù., :j = i ~= ~. -i 5 g = € £ t3 5 + 3:t ,f = = é î
'k!!sics and Chf mu{rv q(Crlass€s EiiiopcœÊ Jo..ünu2l d C,lœ<s Scicnœ .md T€chn.`Icisy Par{ 8 \.olu"c 53 :'`.umbcT 3 )`*ne 101:
____
I
I
Chap tre H Proposition d'un modèle d'évaluatîon de l'aptitude à la vitrification des mélai gÊ=
11.23. Aptitude à la vitrification relative aux considérations globales (GRGFA)
Cette contnbution théorique considère l'aptitude à la vitrification des deux perspectives : them )dynamique et structurale. En tenant compte des paramètres omis précédemment (I i capac té thermique isobanque Cp, le volume de la maille, la distance inter ionique L de l'oxyde , N. B{ubata et al [20], ont proposé un nouveau critère NONDIMENSIONNEL et GLOBA;j appel{ GRGFA (Global Relative Glass Foming Ability) ainsi fomulé :
GRGFA = ThRGFA x StRGFA = GRGFA =
[#x:][
t,cV
[11.3]
Ce nouveau critère adimensionnel recouvre (du pojnt de vue themodynamjque ét structi `ral) mieux l'aptitude à la vitrification des oxydes. Les valeurs calculées selon ce nouvea i
modèl 3 sont portées su le tableau 11.3 [20].



![Tableau 1.5 : classification des oxydes se]on Rawson. [11]](https://thumb-eu.123doks.com/thumbv2/123doknet/14463642.713113/35.897.118.812.364.693/tableau-classification-oxydes-rawson.webp)
![Tableau 11.1 :classification des oxydes se]on [es va]eurs de ThRGFA (18].](https://thumb-eu.123doks.com/thumbv2/123doknet/14463642.713113/41.895.38.818.173.1319/tableau-classification-oxydes-eurs-thrgfa.webp)
![Tableau 11.2 : classification des oxydes selon les valeurs de StRGFA [20].](https://thumb-eu.123doks.com/thumbv2/123doknet/14463642.713113/43.897.148.724.270.1168/tableau-classification-oxydes-valeurs-strgfa.webp)
