HAL Id: tel-01889567
https://tel.archives-ouvertes.fr/tel-01889567
Submitted on 7 Oct 2018HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
cibles du récepteur des minéralocorticoïdes dans les
cellules rénales
Florian Le Billan
To cite this version:
Florian Le Billan. Identification et régulation transcriptionnelle des gènes cibles du récepteur des minéralocorticoïdes dans les cellules rénales. Biologie moléculaire. Université Paris Saclay (COmUE), 2017. Français. �NNT : 2017SACLS277�. �tel-01889567�
Identification et Régulation
Transcriptionnelle des Gènes Cibles
du Récepteur Minéralocorticoïde
dans les Cellules Rénales
Thèse de doctorat de l'Université Paris-Saclay
préparée à l’Université Paris-Sud
École doctorale n°568 Signalisation et Réseaux Intégratifs en Biologie (Biosigne) Spécialité de doctorat : Aspects Moléculaires et Cellulaires de la Biologie
Thèse présentée et soutenue à Le Kremlin-Bicêtre, le 6 Octobre 2017, par
Florian LE BILLAN
Composition du Jury :
Madame la Dr Pascale CHAVATTE-PALMER
DR INRA-ENVA, INRA Jouy-en-Josas Président Madame la Dr Morgane THOMAS-CHOLLIER
MCU, École Normale Supérieure de Paris Rapporteur Monsieur le Dr Antoine OUVRARD-PASCAUD
MCU, Université de Rouen Rapporteur
Monsieur le Dr Vincent CAVAILLÈS
DR Inserm, Université de Montpellier Examinateur Monsieur le Dr Marc LOMBÈS
DR Inserm, Université Paris-Sud Directeur de thèse Monsieur le Dr Jérôme FAGART
CR Inserm, Université Paris-Sud Co-Directeur de thèse
NNT
: 2
01
7S
ACL
S
27
7
Identification et Régulation
Transcriptionnelle des Gènes Cibles
du Récepteur Minéralocorticoïde
dans les Cellules Rénales
Thèse de doctorat de l'Université Paris-Saclay
préparée à l’Université Paris-Sud
École doctorale n°568 Signalisation et Réseaux Intégratifs en Biologie (Biosigne) Spécialité de doctorat : Aspects Moléculaires et Cellulaires de la Biologie
Thèse présentée et soutenue à Le Kremlin-Bicêtre, le 6 Octobre 2017, par
Florian LE BILLAN
Composition du Jury :
Madame la Dr Pascale CHAVATTE-PALMER
DR INRA-ENVA, INRA Jouy-en-Josas Président Madame la Dr Morgane THOMAS-CHOLLIER
MCU, École Normale Supérieure de Paris Rapporteur Monsieur le Dr Antoine OUVRARD-PASCAUD
MCU, Université de Rouen Rapporteur
Monsieur le Dr Vincent CAVAILLÈS
DR Inserm, Université de Montpellier Examinateur Monsieur le Dr Marc LOMBÈS
DR Inserm, Université Paris-Sud Directeur de thèse Monsieur le Dr Jérôme FAGART
CR Inserm, Université Paris-Sud Co-Directeur de thèse
NNT
: 2
01
7S
ACL
S
27
7
Ce travail de Thèse a été rendu possible grâce à la participation et au soutien de nombreuses personnes que je tenais à remercier ici.
Je remercie les membres du jury d’avoir accepté d’évaluer mon travail de Thèse :
Madame le Docteur Morgane Thomas-Chollier et monsieur le Docteur Antoine Ouvrard-Pascaud, je vous remercie plus particulièrement d’avoir pris le temps de lire mon manuscrit de Thèse, d’avoir évalué mon travail, et d’avoir partagé avec moi vos impressions et remarques.
Madame le Docteur Pascale Chavatte-Palmer, je vous remercie de m’avoir fait l’honneur de présider mon jury de Thèse.
Monsieur le Docteur Vincent Cavaillès, je vous remercie de m’avoir fait l’honneur d’être membre du jury en tant qu’examinateur.
Je remercie monsieur le Docteur Laurent Sachs d’avoir suivi et soutenu ce projet au cours du Master et du Doctorat, notamment en y participant en tant qu’expert, au jury du comité de mi-parcours de Thèse. Je remercie également madame le Docteur Joëlle Cohen-Tannoudji d’avoir assumé le rôle de tutrice de Thèse. Vos conseils et suggestions m’ont été précieux.
J’adresse ma plus profonde reconnaissance et mes plus sincères remerciements à mes Directeurs de Thèse, Marc et Jérôme.
Marc, je te remercie de m’avoir accueilli dans ton équipe pour un stage de 1ère année de Master, et de m’avoir depuis permis de découvrir et d’intégrer le monde de la recherche scientifique. Je te remercie de m’avoir fait confiance en me proposant ce projet de Thèse et de m’avoir permis de le défendre au cours de congrès, notamment. J’admire le passionnant projet que tu as développé et la façon dont tu le mènes en t’entourant d’une solide et joyeuse équipe, et je te suis reconnaissant de m’avoir permis d’y apporter ma contribution. Je te remercie enfin pour tes conseils justes et avisés, ton encadrement constructif et bienveillant, ton soutien infaillible, pour tout le temps que tu m’as accordé, et pour le partage de ton immense savoir scientifique, théorique et pratique.
Jérôme, je te remercie d’abord de m’avoir pris sous ton aile pour pouvoir poursuivre ce projet. Je te remercie pour ton encadrement quotidien impeccable, pour les moments inoubliables passés en L2 ou en chambre froide, pour nos conversations scientifiques très instructives et constructives, et pour tout ce que tu as fait pour ce manuscrit. Je te remercie surtout pour tes conseils et nos conversations plus personnelles qui ont contribué à construire notre belle complicité. Je ne saurais assez te remercier pour ton soutien constant et enthousiaste, et pour la confiance que tu m’as accordée.
Junaid, je te remercie de m’avoir choisi pour t’accompagner dans le développement des expériences de ChIP, et de m’avoir appris une grande partie des approches que je maitrise aujourd’hui. C’est en partie grâce à toi que je suis entré dans l’Unité, et je t’en suis grandement
Je remercie chaleureusement l’ensemble des membres de l’Unité 1185 qui participent, chacun à leur manière, à la convivialité, à l’entraide et à l’ambiance de travail exceptionnelle qui y règne au quotidien.
Say, tu es un des piliers centraux du laboratoire et ta présence a été indispensable à la bonne conduite de ce projet. Je te remercie pour ton aide quotidienne pour des conseils techniques, scientifiques, administratifs et personnels. En particulier, je te suis reconnaissant de m’avoir appris, avec rigueur, la culture cellulaire et la PCR quantitative, entre autres, mais aussi pour ta présence amicale à San Diego, ou encore ton aide pour mon ameublement. Je te remercie pour ta disponibilité et ton écoute qui m’ont été indispensables. Ton dévouement aux autres et à la science est pour moi exemplaire.
Larbi, je te remercie pour ta grande générosité et ton énergie communicative. Je te remercie de m’avoir appris la microscopie à fluorescence et fait bénéficier de ton expertise en HTM, ce qui nous aura permis de réaliser deux beaux projets. Je te remercie pour nos conversations toujours intéressantes, tes conseils, scientifiques ou non, qui m’ont beaucoup aidé, et d’avoir partagé avec moi un pêché assumé : la gourmandise.
Khadija, je te remercie pour ta gentillesse et pour le travail d’équipe que nous avons mené à bien, notamment grâce à ton énergie et à ta patience. Je repense à nos longs moments en L2 ou face à un certain sonicateur : ils ont été supportables grâce à ta bonne humeur et à nos rires.
Damien, je te remercie pour ta gentillesse, ta disponibilité et ton aide, et pour toujours savoir partager ton expérience et animer les discussions. Et oui, ramener du fromage aux pots est une très bonne idée !
Stéphanie, je te remercie pour tes nombreux conseils judicieux, de m’avoir guidé en partageant ta propre expérience et pour ta gentillesse.
Jérôme B, je te remercie de nous avoir aidés dans l’analyse bioinformatique des données de ChIP-Seq, avec Florian Nadal et Christophe Habib, et d’avoir toujours essayé de répondre aux questions que nous avions.
Françoise, je te remercie pour ta gentillesse et ton naturel. Je te remercie aussi pour tes conseils, les services que tu m’as rendus et pour m’avoir fait découvrir de très bonnes musiques ! Géraldine, Mirella, Laurence, Thi An et Mohsen, je vous remercie pour votre grande gentillesse, votre bonne humeur quotidienne, votre générosité et votre amitié ! J’ai été heureux de partager mon passage dans l’Unité avec vous, je vous souhaite le meilleur pour la suite et fin de votre Thèse, j’ai confiance en vous !
Ingrid, je te suis reconnaissant pour tous les conseils que tu m’as donnés et tous les services rendus ! Suivre ton chemin au cours du Doctorat m’a permis de moins en appréhender les différentes épreuves. Je te remercie pour ta générosité et ton intégrité.
Nadine, je te remercie pour tes nombreux conseils avisés et ta bienveillance. C’était un honneur de t’avoir comme marraine à la SFE !
Isabelle, je te remercie pour ta gentillesse, tes conseils et pour nos sympathiques covoiturages !
Justine, tu as été un exemple pour moi pour ta gentillesse, ta bienveillance, ton sens de l’organisation, ton sérieux et ta générosité ! Je te remercie de m’avoir montré toutes les astuces à connaitre pour un Western blot notamment, de m’avoir donné de bons conseils et de m’avoir aidé même une fois partie !
Valérie, je te remercie pour ta bonne humeur communicative ! C’était un plaisir de partager l’expérience du Doctorat avec toi, et le chocolat, et de pouvoir s’entraider !
Hui, 我很高兴认识你,并且和你分享这几年! 我希望你对法国的访问会让你幸福回忆,祝你未 来最好!
Charlotte, je te remercie pour ta gentillesse et je te passe un double flambeau : tu es la prochaine à aller vivre à Antony, et surtout la prochaine à soutenir ! Même si je ne me fais pas de soucis pour toi, je te souhaite beaucoup de succès !
Laura, Clémence, Geoffrey, Paul, Nelly, Sophie, Vianney, Florent, Justine VdW, Adrien et Sara, c’était un plaisir de vous rencontrer et de partager votre passage au sein de l’Unité ! Je vous remercie tous pour votre gentillesse ! Mention spéciale pour Laura, ma copine de chocolat, pour Justine VdW et Adrien et leur don incontestable pour la cuisine, pour Nelly et Sophie pour leur diaporama de départ inoubliable, et pour Sara ma souriante camarade de master !
Christophe, je te remercie pour ton aide, ta sympathie et de m’avoir fait découvrir le Coq&Co ! Leïla, je te remercie chaleureusement pour ta grande gentillesse, ta bonne humeur, ton soutien et tes conseils.
Dilek, Qiong-Yao et Alexis, je vous remercie pour votre gentillesse, votre énergie et votre aide pour le sonicateur Covartis, le Bioanalyzer, le Qubit, et les dosages en LC-MS/MS.
Pr Anne Guiochon-Mantel, je vous suis reconnaissant de m’avoir permis de suivre le master Endocrinologie et Métabolisme, et de m’avoir soutenu au concours de l’ED.
Je remercie vivement ceux qui ont contribué et contribuent encore aujourd’hui à faire vivre ce laboratoire : Laëtitia, Lavinia que je remercie d’avoir gentiment accepté de partager son bureau, Cindy, Vixra, Jérôme N, Séverine, Claudia, Ségolène, Bruno, Luc, Simon, Anaïs, Mélanie N, Esther, Meriem, Éric, Peter, Jacques et Philippe.
Claudine Delomenie, je te remercie d’avoir pris le temps de nous former, Jérôme et moi, au logiciel IPA.
Dr. Peter Kolkhof, I thank you for the collaboration you built with our lab and I was pleased to participate to this exciting project concerning the Finerenone.
Gaëlle Auguste et Jessica Sabourin, je vous remercie pour le temps passé à préparer les CVRN, pour votre aide pour les expériences de ChIP, pour votre implication dans l’avancée du projet Calsignaldo, mais aussi pour votre gentillesse.
Ly Tu, Christophe Guignabert et Alice Huertas, je vous remercie pour la préparation des CML, et je suis heureux de participer au passionnant projet Tamirah. J’espère que je pourrais encore suivre, même de loin, son avancée qui a l’air prometteuse.
Je remercie enfin François Guillonneau et la Plateforme 3P5 de l’Université Paris-Descartes pour les expériences d’APMS ; Sophie Lemoine et Juliette Pouch du Genomic Paris Centre de l’ENS Ulm pour leur collaboration fructueuse au projet ChIP-Seq sur les cellules HK-GFP-MR ; l’équipe du Dr Claude Thermes de la Plateforme I2BC de l’Université Paris-Sud pour leur collaboration et leur implication dans le projet de séquençage des CML.
Je souhaite remercier ici mes Professeurs de lycée, de prépa, de fac, qui m’ont donné envie de donner le meilleur de moi-même, de continuer dans le domaine de la biologie, de l’endocrinologie et la recherche, ou qui m’ont encouragé à adopter un raisonnement scientifique rigoureux. Tous les noms ne me reviennent pas en mémoire, mais je peux nommer et remercier Hélène Cordoliani, Stéphane Premier, Philippe Canadas, Pr Cazaubon, Christian Plas, Sophie Warin, Patrick Kohl, Anne Roux, Mohammed Taouis et Claire-Marie Vacher.
Je remercie avec une profonde affection mes amis qui m’ont soutenu avant et pendant ma Thèse et qui ont su être présents durant toutes ces années. Votre amitié m’est indispensable et je ne saurais vous dire tout ce que vous m’apportez. Sans vous nommer tous, je pense évidemment à Claire, Elodie, Elise, Vincent, Allison, Chloé, Winchy et Joffrey, Elodie R et Vincent L, Victor et Floriane, Kévin, Sandra et Philippe, Hélène et François.
Je remercie du fond du cœur ma famille pour tout le soutien et l’amour qu’elle m’apporte au quotidien. Maman et Papa, je vous dois d’en être arrivé là, et je vous dois tant d’autres choses ! Je vous suis profondément reconnaissant et j’espère vous le montrer toute notre vie, notamment au travers de ce Doctorat. Antony et Sarah, je ne saurais vous remercier assez pour votre soutien et votre affection indispensables ! Le quatuor que nous formons est formidable et magique. Linda, Marilyn, Yohan, Carletta, Padou, Naomie et Ludo, vous êtes une belle-famille merveilleuse, votre présence et votre soutien me sont nécessaires et vous les assurez très bien au quotidien ! Pépé et Mémé, ma chère tata Sylvie, tonton Alain et tata Nath, Jimy, Daniel, je vous remercie pour votre soutien et pour votre affection qui me sont essentiels !
Aurélie, ma Femme, je te dédie cet accomplissement. Même si ta participation est indirecte, il t’appartient de par ton soutien infaillible, tes encouragements quotidiens et ton envie de me pousser à donner le meilleur de moi-même ! To koné ki sans toi la vie pas serié. Mo mari contan toi mo fiancée !
Article 1
Cistrome of the aldosterone-activated mineralocorticoid receptor in human renal cells.
Florian Le Billan, Junaid A. Khan, Khadija Lamribet, Say Viengchareun, Jérôme Bouligand, Jérôme Fagart*, Marc Lombès*.
FASEB J. 2015 Sep; 29 (9): 3977-89.
*Ces auteurs ont contribué de façon équivalente.
Article 2
Finerenone impedes aldosterone-dependent nuclear import of the mineralocorticoid receptor and prevents genomic recruitment of steroid receptor coactivator-1.
Florian Le Billan*, Larbi Amazit*, Peter Kolkhof, Khadija Lamribet, Say Viengchareun, Michel R. Fay, Junaid Ali Khan, Alexander Hillisch, Marc Lombès, Marie-Edith Rafestin-Oblin, Jérôme Fagart.
J Biol Chem. 2015 Sep 4; 290 (36): 21876-89.
*Ces auteurs ont contribué de façon équivalente.
Article 3
Differential dynamic kinetics of Mineralocorticoid and Glucocorticoid Receptors genomic interaction.
Florian Le Billan, Larbi Amazit, Qiong-Yao Xue, Christophe Lhadj, Eric Pussard, Peter Kolkhof, Say Viengchareun, Jérôme Fagart*, Marc Lombès*.
Manuscrit en cours de préparation. 2017.
*Ces auteurs ont contribué de façon équivalente.
Publications présentées en Annexes
Article 4Ulipristal Acetate Inhibits Progesterone Receptor Isoform A-Mediated Human Breast Cancer Proliferation and BCl2-L1 Expression.
Nathalie Esber, Florian Le Billan, Michèle Resche-Rigon, Hugues Loosfelt, Marc Lombès, Nathalie Chabbert-Buffet.
PLoS One. 2015 Oct 16; 10 (10): e0140795. Article 5
Three Novel Heterozygous Point Mutations of NR3C1 Causing Glucocorticoid Resistance. Géraldine Vitellius, Jérôme Fagart, Brigitte Delemer, Larbi Amazit, Nelly Ramos,
Jérôme Bouligand, Florian Le Billan, Frédéric Castinetti, Anne Guiochon-Mantel, Séverine Trabado*, Marc Lombès*.
Hum Mutat. 2016 Aug; 37 (8): 794-803.
2016
Identification and Transcriptional Regulation of the Mineralocorticoid Receptor Target Genes in the Cardiorenal System.
Florian Le Billan, Junaid Ali Khan, Larbi Amazit, Khadija Lamribet, Say Viengchareun, Jérôme Fagart, Marc Lombès.
COST ADMIRE Masterclass “Co‐morbidity of Affective, Metabolic and Cardiovascular Disease: a Crucial Role of the Mineralocorticoid Receptor”, Amsterdam, Pays-Bas,7 October 2016.
2015
Identification of the Mineralocorticoid Receptor Genomic Targets (Cistrome): Implication in the Transcriptional Regulation of the Aldosterone-Regulated Genes.
Florian Le Billan, Junaid Ali Khan, Khadija Lamribet, Say Viengchareun, Jérôme Bouligand, Jérôme Fagart, Marc Lombès.
32ème Congrès de la Société Française d’Endocrinologie, Angers, France, 7-10 Octobre 2015. Award: Award SFE-Novartis 2015 pour la Meilleure Communication Orale.
First Identification of the Mineralocorticoid Receptor Cistrome in Human Renal Cells.
Florian Le Billan, Junaid Ali Khan, Khadija Lamribet, Say Viengchareun, Jérôme Bouligand, Jérôme Fagart, Marc Lombès.
5ème Journée des Récepteurs Nucléaires, Clermont-Ferrand, France, 5 Juin 2015.
Identification and Transcriptional Regulation of the Mineralocorticoid Receptor Target Genes. Florian Le Billan, Junaid Ali Khan, Khadija Lamribet, Say Viengchareun, Jérôme Fagart, Marc Lombès.
97th Endocrine Society Annual Meeting, San Diego (CA), USA, 5-8 Mars 2015.
Communications sous forme de poster
2016The New Nonsteroidal Antagonist Finerenone Impedes Three Critical Steps of the Mineralocorticoid Receptor Signaling Pathway.
Florian Le Billan, Larbi Amazit, Peter Kolkhof, Khadija Lamribet, Say Viengchareun, Junaid Ali Khan, Marc Lombès, Jérôme Fagart.
Journée de l’Ecole Doctorale Biosigne, Faculté de Médecine, Université Paris Sud, Le Kremlin-Bicêtre, France, 3 Novembre 2016.
2015
Identification and Transcriptional Regulation of the Mineralocorticoid Receptor Target Genes in Human Renal Cells.
Florian Le Billan, Junaid Ali Khan, Khadija Lamribet, Say Viengchareun, Jérôme Bouligand, Jérôme Fagart, Marc Lombès.
FEBS Advanced Lecture Courses, “Nuclear Receptor Signaling in Physiology and Disease”, Summer School, Spetses, Greece, 23-28 Août 2015.
Table des matières
Table des Illustrations 1
Liste des abréviations 2
Avant-propos 4
INTRODUCTION 7
I. Physiologie de la signalisation minéralocorticoïde 7
A. Le récepteur minéralocorticoïde 7
1. La protéine MR, interface entre ligand, ADN et partenaires transcriptionnels 7
a) Le domaine N-terminal 8
b) Le domaine de liaison à l’ADN 9
c) La région charnière 10
d) Le domaine de liaison au ligand 11
2. Le gène NR3C2 13
3. Expression du MR 14
4. Expression diphasique du MR au cours du développement chez l’Homme 17 5. Régulations post-transcriptionnelles et post-traductionnelles de l’expression du MR 19
a) Régulations post-transcriptionnelles 19
b) Régulations post-traductionnelles 21
B. Les hormones minéralocorticoïdes : lieu de synthèse, régulation et sécrétion 23
1. L’aldostérone 25
2. Autres hormones minéralocorticoïdes naturelles 27
C. Fonctions physiologiques régulées par la signalisation minéralocorticoïde 28 D. Les mécanismes d'action du MR dans la signalisation minéralocorticoïde 30
1. La voie génomique 31
a) Activation du MR lié au complexe chaperon et translocation nucléaire 32
b) Interaction avec les cibles génomiques 32
c) Les corégulateurs transcriptionnels du MR 35
(1) Les coactivateurs du MR 35
(2) Les corépresseurs du MR 40
d) Extinction du signal et adressage au protéasome 42
2. Voies non génomiques 42
II. Physiopathologie de l’Aldostérone et du MR 50
A. Invalidations et sous-expressions du MR 50
1. Modèles animaux 50
2. Pseudohypoaldostéronisme de type 1 et mutations du gène NR3C2 51 B. Suractivation de la signalisation minéralocorticoïde et pathologies 53
1. Modèles murins de surexpression du MR 53
2. Stratégies d’interférence du MR 54
3. Une mutation activatrice du MR chez l’Homme 55
4. Hyperaldostéronisme 56
5. MR et inflammation dans les fibroses cardiaques et rénales 57
6. MR et maladies métaboliques 58
C. Les antiminéralocorticoïdes 59
1. La spironolactone, première génération d’antiminéralocorticoïde 59 2. L’éplérénone, seconde génération d’antiminéralocorticoïde sélectif 61
3. La nouvelle génération de MRA est non-stéroïdienne 62
a) Le BR-4628 63
b) BAY 94-8862 ou la finérénone 64
c) CS-3150 ou l’esaxérénone 65
III. Sélectivité de la voie minéralocorticoïde et dynamique des complexes
transcriptionnels 67
A. Dualité entre les voies minéralocorticoïdes et glucocorticoïdes 67
1. Sélectivité intrinsèque du MR pour l'aldostérone 68
a) Activité de transactivation du MR en réponse à l'aldostérone et aux
corticostéroïdes 68
b) Mode de liaison de l'aldostérone et du cortisol dans le LBD du MR 69
2. Dualités de récepteurs homologues MR et GR 70
a) Données structurales 70
b) Récepteur ancestral 71
3. Sélectivité d’interactions avec les partenaires transcriptionnels et les chaperons 72
a) Corégulateurs transcriptionnels spécifiques du MR 72
b) Corégulateurs transcriptionnels sélectifs du MR ou du GR 73
c) Interactions sélectives dans le cytoplasme 75
B. Sélectivité et dynamique de la machinerie transcriptionnelle 77 1. Conformation de l’ADN, éléments de réponse et recrutement du MR 77
a) L’ADN, acteur dans le recrutement des transrégulateurs 77
b) La séquence des GRE dans la régulation gène-spécifique 78
2. Le recrutement du MR et de ses corégulateurs transcriptionnels est dynamique 79
OBJECTIFS 82
RESULTATS 86
1ère Partie : Identification et caractérisation du premier cistrome du récepteur
minéralocorticoïde dans une lignée rénale humaine 86
A. Justification du projet 86
1. Contexte de l’étude 86
2. Modèle d’étude 86
3. Hypothèses de travail 87
4. Objectifs du travail 88
Article 1 : Cistrome of the aldosterone-activated mineralocorticoid receptor in human
renal cells 88
B. Données complémentaires et autres éléments de discussion 89
2ème Partie : Etude de la signalisation minéralocorticoïde par l’utilisation d’un nouvel
antagoniste minéralocorticoïde non-stéroïdien 102
A. Justification du projet 102
1. Contexte de l’étude 102
2. Etude initiale 103
3. Hypothèses de travail 103
4. Objectifs du travail 104
Article 2 : Finerenone impedes aldosterone-dependent nuclear import of the mineralocorticoid receptor and prevents genomic recruitment of Steroid Receptor
Coactivator-1 104
3ème Partie : Etude de la contribution relative des récepteurs minéralocorticoïde et
glucocorticoïde dans la signalisation des corticostéroïdes dans des
cellules n’exprimant pas la 11βHSD2 112
A. Justification du projet 112
1. Contexte de l’étude 112
2. Hypothèses de travail 113
3. Objectifs du travail 114
Article 3 : Differential dynamic kinetics of Mineralocorticoid and Glucocorticoid
Receptors genomic interaction 115
B. Données complémentaires et autres éléments de discussion 156
DISCUSSION GENERALE 169
CONCLUSION GENERALE 180
REFERENCES BIBLIOGRAPHIQUES 183
ANNEXES 218
Article 4 : Ulipristal acetate inhibits progesterone receptor isoform A-mediated human breast cancer proliferation and BCL2-L1 expression
Article 5: Three novel heterozygous point mutations of NR3C1 causing glucocorticoid Resistance
1
Table des Illustrations
Figure 1 : Représentation de la structure modulaire du MR 8
Figure 2 : Structure du DBD du MR humain 9
Figure 3 : Structure du LBD du MR humain en liaison avec l’aldostérone 12
Figure 4 : Gène NR3C2, transcrit et protéine MR 13
Figure 5 : Sites d’expression du MR 15
Figure 6 : Représentation de l’ontogénèse du MR et du GR chez l’Homme 18
Figure 7 : Modifications post-traductionnelles du MR 21
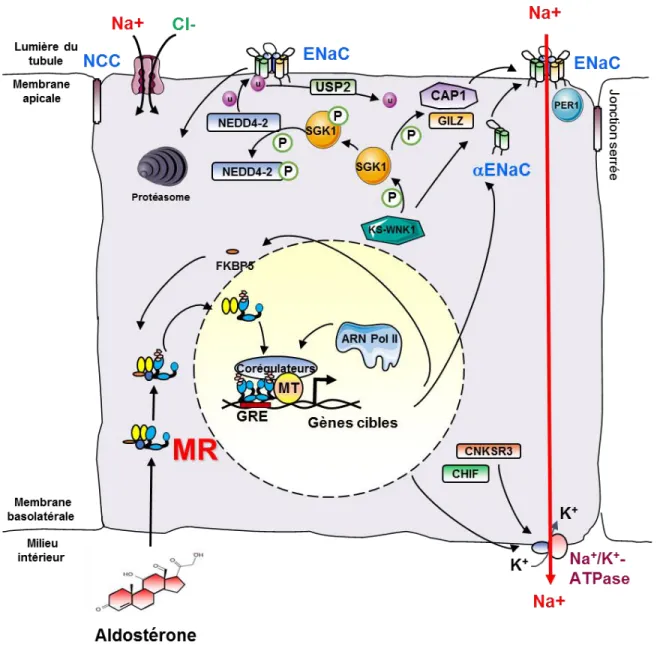
Figure 8 : Le cortex des glandes surrénales, principal responsable de la stéroïdogénèse 24 Figure 9 : Voie d’action génomique du MR dans une cellule épithéliale du tubule contourné
Distal 31
Figure 10 : Interactions entre le domaine AF-2 du MR et le RID du coactivateur SRC-1 36 Figure 11 : Le complexe aldostérone-MR régule la réabsorption de sodium dans les cellules du
tubule contourné distal 44
Figure 12 : Les antiminéralocorticoïdes de la famille des spirolactones 60
Figure 13 : Les antiminéralocorticoïdes non-stéroïdiens 63
Figure 14 : L’enzyme 11βHSD2 métabolise le cortisol de façon NAD+-dépendante 68 Figure 15 : Dynamiques de recrutement des partenaires transcriptionnels coordonnés par le
ERα activé par l’œstradiol sur le promoteur du gène pS2 80
Figure 16 : Activité transrégulatrice associée à un MBS localisé dans une région génomique
désertique 90
Figure 17 : Recrutement aldostérone-induit du MR sur le promoteur du gène SGK1 93 Figure 18 : Recrutement aldostérone-induit du MR sur le promoteur des gènes Scnn1a et Sgk1
dans les cellules KC3AC1 97
Figure 19 : Recrutement aldostérone-induit du MR sur le promoteur du gène KCNIP3 dans les
cellules HK-GFP-hMR 99
Figure 20 : Recrutement du MR sur le promoteur du gène Scnn1a dans le rein et du gène Sgk1
dans le cœur de souris 108
Figure 21 : Expression des ARNm du gène PER1 en fonction de la durée d’exposition à
l’aldostérone 158
Figure 22 : Stratégie des mutants dim du MR et du GR de rat pour l’étude des hétérodimères
MR-GR 162
Figure 23 : Modèle d’une structure quaternaire de GR en homotétramère 163 Figure 24 : Différentes hypothèses de structures quaternaires proposées pour le MR et le GR 165
Tableau 1 : Les motifs de liaison génomique du MR 33
Tableau 2 : Les coactivateurs connus pour interagir avec le MR 39
Tableau 3 : Les corépresseurs connus pour interagir avec le MR 41
Tableau 4 : Identification de transcriptomes et de cistromes du MR et de l’aldostérone 49 Tableau 5 : Sélectivité des MRA vis-à-vis des récepteurs des oxo-stéroïdes 60
2
Liste des abréviations
3’-UTR 3’-Untranslated region
11βHSD2 11β-Hydroxystéroïde déshydrogénase de type 2 AncCR Ancestral Corticosteroid Receptor
ACE Angiotensin-Converting Enzyme
ACTH Adrénocorticotropine
ADN (c) Acide désoxyribonucléique (complémentaire)
AF Activation Function
AKI Acute Kidney Injury
APMS Affinity Purification followed by Mass Spectrometry
AR Androgen Receptor
ARE AU Rich Element
ARN Acide ribonucléique
ARNhn heterogeneous nuclear RNA
ARNi ARN interférent
ARNm ARN messager
ChIA-PET Chromatin Interaction Analysis by Paired-End Tag Sequencing
ChIP-(seq) Chromatin immunoprecipitation-(followed by sequencing)
CIH Cold-Induced Hypertension
CMLV Cellules Musculaires Lisses Vasculaires CoRNR Motif d’interaction corépresseur-récepteur
DBD DNA-Binding Domain
DOC 11-Désoxycorticostérone
DOCA Deoxycorticosterone acetate
eGFP enhanced Green Fluorescent Protein
ENaC Epithelial Na+ Channel
ER Estrogen Receptor
FDR False Discovery Rate
FKBP5 FK506 Binding Protein 5
GFP Green Fluorescent Protein
GILZ Glucocorticoid-Induced Leucine Zipper
GR Glucocorticoid Receptor
GRE Glucocorticoid Responsive Element
GST Glutathione S-Transferase
HAT Histone Acetyltransferase
HDAC Histone Deacetylase
HFpEF/HFrEF Heart Failure with preserved/reduced Ejection Fraction
HK Human Kidney
hMR human Mineralocorticoid Receptor
HRE Hormone Responsive Element
Hsp Heat-shock protein
HTAP Hypertension artérielle pulmonaire
3
ID Inhibitor Domain
IGV Integrative Genomics Viewer
Kbp kilobase pairs
KCNIP3 Potassium Voltage-Gated Channel Interacting Protein 3
KO Knock-out
LBD Ligand-Binding Domain
LC-MS/MS Liquid Chromatography - tandem Mass Spectrometry
MBS Mineralocorticoid Binding Sequence
Mbp Millions de paires de bases
miR MicroRNA
mMR mouse Mineralocorticoid Receptor
MR Mineralocorticoid Receptor
MRA Mineralocorticoid Receptor Antagonist
MRE Mineralocorticoid Responsive Element
NADPH Nicotinamide Adénine Dinucléotide Phosphate
NES Nuclear Export Signal
NLS Nuclear Localization Signal
NR Nuclear Receptor
NR3C2 Nuclear Receptor subfamily 3 group C member 2
NTD N-terminal Domain
pb paires de bases
PER1 Period circadian protein homolog 1 protein
PHA1 Pseudohypoaldostéronisme de type 1 Pol II ARN Polymérase de type 2
PR Progesterone Receptor
PTM Post-Translational Modification
qPCR quantitative Polymerase Chain Reaction
RAR Retinoic Acid Receptor
RCPG Récepteur Couplé à une Protéine G RID Receptor Interacting Domain
RIP140 Receptor Interacting Protein 140
RXR Retinoid X Receptor
SCNN1A Sodium Channel epithelial 1 alpha subunit
SG Semaine de Grossesse
SGK1 Serum and Glucocorticoid-regulated Kinase 1
siRNA small interferent silencing RNA
SNC Système Nerveux Central
SRAA Système Rénine-Angiotensine-Aldostérone SUMO Small Ubiquitin-like Modifier
SV40 Virus simien 40
TR Thyroid hormone Receptor
TSS Transcription Start Site
4
AVANT-PROPOS
Mon intérêt pour la physiologie et la physiopathologie a été croissant au cours de mon cursus de second cycle universitaire, nourri par des lectures et les cours passionnants des professeurs de physiopathologie endocrinienne de l’Université Paris-Sud. Afin d'approfondir mes connaissances dans ce domaine et de m'initier à la recherche scientifique, j’ai rejoint l’unité Inserm 693 (actuellement U1185), localisée au sein de la Faculté de Médecine Paris-Sud, au Kremlin-Bicêtre, pour effectuer mon stage de première année de master. Cette unité Inserm, dirigée par le Dr. Marc Lombès, s’intéresse à la signalisation hormonale, et à la physiopathologie endocrinienne et métabolique.
Au cours de ce stage de M1, j’ai été initié à la recherche par le Dr Junaid Ali Khan sur la problématique de l’identification des cibles génomiques du MR et de la régulation transcriptionnelle par l’aldostérone des gènes associés. J’ai poursuivi ce projet au cours de mon stage de master 2, sous la direction conjointe des docteurs Jérôme Fagart et Marc Lombès. Etant tout à fait convaincu de vouloir poursuivre dans la recherche, et souhaitant approfondir ce projet, j’ai obtenu un financement du Ministère de l’Éducation Supérieure et de la Recherche me permettant de réaliser en trois ans une thèse de Sciences.
Mon projet s’inscrivait dans le cadre de collaborations de l’unité, engagées grâce à des projets de recherche soutenus financièrement par l’Agence Nationale de la Recherche (ANR), ou en collaboration avec le département de recherche cardiologique du laboratoire pharmaceutique Bayer AG. Le programme "Ephimir" (ANR 11-BSV1-028-01, 2011-2014) avait pour double objectif d’étudier les mécanismes régulant l’expression tissu-spécifique du MR, et d’identifier de nouveaux gènes cibles du MR et les protéines régulées par l’aldostérone, dans le but de préciser les implications physiopathologiques de la signalisation minéralocorticoïde. Notre collaboration avec Bayer avait pour but de caractériser les mécanismes moléculaires d’un nouvel antagoniste non-stéroïdien du MR, la finérénone. Enfin, j’ai eu l’opportunité d’apporter ma contribution aux programmes "Calsignaldo" (ANR-15-CE14-0005, 2015-2018), portant sur la signalisation calcique en lien avec le réseau minéralocorticoïde cardiaque, et "Tamirah" (ANR-16-CE17-0014, 2016-2020) portant sur l’étude des conséquences d’une activation anormale du MR dans l’hypertension artérielle pulmonaire.
Ces projets collaboratifs, par les rencontres occasionnées et les sujets étudiés, représentent des expériences particulièrement enrichissantes. Ils ont conduit à la publication d’articles originaux, dont deux dans lesquels je suis premier auteur ou co-premier auteur, et m’ont permis
5 de participer à des congrès scientifiques nationaux et internationaux. J’ai également contribué par ma maîtrise de la technique de ChIP à d’autres travaux sur d’autres récepteurs nucléaires.
Le présent mémoire de thèse est subdivisé en 3 grandes parties : une Introduction Bibliographique, une partie réunissant les résultats que j'ai obtenus, et une dernière partie de Discussion Générale et de Perspectives.
L'introduction bibliographique est structurée en trois grands chapitres. Le premier présente la physiologie de la signalisation minéralocorticoïde, en introduisant les principaux acteurs, le MR et les hormones minéralocorticoïdes, et leur participation à la régulation de grandes fonctions physiologiques. Cette partie se poursuit par la description des mécanismes moléculaires mis en jeu dans cette voie et les gènes auxquels ces mécanismes s’appliquent. La deuxième partie de l'Introduction Générale est consacrée aux aspects physiopathologiques de la signalisation minéralocorticoïde, en présentant successivement les cas d’invalidation puis de suractivation de cette voie, ainsi que les pathologies associées. Elle se termine sur la présentation des principaux antagonistes du MR développés à ce jour et leur utilisation en thérapeutique. Enfin, la troisième partie de l’Introduction Générale est axée sur la sélectivité de la signalisation minéralocorticoïde en lien avec la dynamique des complexes transcriptionnels. Cette partie introductive aura mis en évidence certaines lacunes dans nos connaissances de la signalisation minéralocorticoïde, et elle sera donc suivie par les objectifs de mes travaux de thèse qui en découlent directement.
Le corps du mémoire, présentant les principaux résultats originaux obtenus au cours du doctorat, est divisé aussi en trois chapitres correspondants aux deux articles publiés et à un article en préparation. Chaque article est précédé d’une courte introduction rappelant le contexte et les hypothèses qui ont motivé le travail effectué, et est suivi d’un prolongement de la réflexion au cours d’une discussion accompagnée de résultats complémentaires éventuels. Ainsi, dans le premier chapitre des résultats, nous décrivons l’identification et la caractérisation du premier cistrome du MR activé par l’aldostérone dans des cellules rénales humaines. Les résultats obtenus ont fait l’objet d’une publication en 2015 dans The FASEB Journal. Dans le second chapitre, nous décrivons l’impact de la finérénone, un nouvel antagoniste sélectif du MR, sur certaines étapes clés de la voie de signalisation du MR. Les résultats obtenus ont fait l’objet d’une publication en 2015 dans le Journal of Biological Chemistry. Enfin, dans le troisième chapitre, nous décrivons l’implication que peuvent avoir des dynamiques différentielles d’interaction entre les récepteurs minéralocorticoïde et glucocorticoïde et les cibles génomiques sur la contribution respective de ces deux récepteurs dans la signalisation corticostéroïde dans les cellules rénales
6 humaines. Les résultats obtenus sont présentés sous forme du manuscrit d'un article qui est en cours de préparation.
Une discussion synthétisant l’ensemble des résultats, et proposant des perspectives intéressantes pour ce travail, est présentée en troisième partie. Le manuscrit de thèse se termine par une Conclusion Générale.
Enfin, sont présentées en Annexes des travaux auxquels j’ai participé au cours de mon doctorat. Une première publication présente les travaux portant sur les effets de l’acétate d’Ulipristal sur la prolifération de cellules mammaires cancéreuses humaines et l’expression du gène BCL2L1 induites par l’isoforme A du récepteur de la progestérone. Les résultats obtenus ont fait l’objet d’une publication en 2015 dans le journal PLoS One. Une seconde publication porte sur la caractérisation de trois nouvelles mutations ponctuelles hétérozygotes dans le gène NR3C1 impliqués dans la résistance aux glucocorticoïdes. Les résultats obtenus ont fait l’objet d’une publication en 2016 dans le journal Human Mutation.
7 La signalisation minéralocorticoïde est étudiée depuis des décennies essentiellement pour son rôle dans le maintien de l’homéostasie hydro-électrolytique et de la pression artérielle. Cette signalisation est d’ailleurs impliquée dans différentes pathologies majeures chez l’Homme, notamment l’hypertension artérielle, certains dysfonctionnements cardiorénaux et le syndrome métabolique. L’effecteur principal de cette signalisation est le Récepteur Minéralocorticoïde, ou MR, qui est un facteur de transcription dont l’activité est induite par une hormone, l’aldostérone. Dans ses tissus cibles, le MR agit principalement au niveau génomique en réponse aux stimuli hormonaux. Il induit la régulation de la transcription de gènes cibles de l’aldostérone. Au cours de l’introduction, nous présenterons successivement les aspects physiologiques puis pathologiques de la signalisation minéralocorticoïde, pour finalement évoquer la sélectivité de cette voie en relation avec la dynamique des complexes transcriptionnels.
I. Physiologie de la signalisation minéralocorticoïde
A. Le récepteur minéralocorticoïde
1. La protéine MR, interface entre ligand, ADN et partenaires transcriptionnels
Le récepteur minéralocorticoïde (codé par le gène NR3C2) est une protéine composée chez l’Homme de 984 acides aminés et dont la masse moléculaire est de 107 kDa. C’est un facteur de transcription hormono-induit faisant partie de la superfamille des récepteurs nucléaires (NR) (Nuclear Receptors Nomenclature Committee, 1999). Il est classé dans la famille des récepteurs stéroïdiens (NR, sous-famille 3) et dans la sous-famille des récepteurs des oxo-stéroïdes (NR3, groupe C) avec les récepteurs des glucocorticoïdes (GR, NR3C1), de la progestérone (PR,
NR3C3) et des androgènes (AR, NR3C4). Les récepteurs nucléaires sont structurés en domaines
fonctionnels : un domaine N-terminal (NTD pour N-terminal Domain), un domaine central de liaison à l’ADN (DBD pour DNA-Binding Domain), une région charnière et un domaine C-terminal de liaison au ligand (LBD pour Ligand-Binding Domain) (Figure 1). La relation structure-fonction de chaque domaine sera décrite dans les prochains paragraphes.
8
Figure 1 : Représentation de la structure modulaire du MR.
NTD : domaine N-terminal,
DBD : domaine de liaison à l’ADN, Hinge : région charnière,
LBD : domaine de liaison au ligand, AF : fonction d’activation (1a, 1b et 2), ID : domaine central inhibiteur,
NLS : signal de localisation nucléaire (0, 1 et 2), NES : signal d’export nucléaire.
a) Le domaine N-terminal
Le domaine N-terminal (NTD) des récepteurs oxo-stéroïdiens est un domaine très peu conservé, avec seulement 15% d’homologie entre les membres de ce groupe. Néanmoins, la comparaison de la séquence du NTD du MR de différentes espèces révèle une homologie supérieure à 50%, ce qui souligne son importance fonctionnelle. Constitué de 602 acides aminés chez l’Homme, il est le plus long domaine N-terminal décrit parmi les récepteurs nucléaires. Sa structure tridimensionnelle n’est pas connue à ce jour. Cependant, plusieurs sous-domaines fonctionnels ont été décrits en son sein (Figure 1). Il s'agit des fonctions d'activation de la transcription AF-1a et AF-1b localisées aux deux extrémités du domaine (acides aminés 1 à 167 et 445 à 602). Ces dernières sont séparées par le domaine central inhibiteur ID (résidus 168 à 437) qui a des propriétés inhibitrices de la transactivation. Ce domaine porte également le signal de localisation nucléaire 0 (NLS0 pour Nuclear Localization Signal 0). Le domaine ID module l’activité transactivatrice du MR en modifiant la configuration tridimensionnelle des domaines AF-1a et AF-1b (Pascual-Le Tallec et al., 2003), ce qui participe à la sélectivité minéralocorticoïde (Edman et al., 2015), comme nous le détaillerons plus loin. Les domaines AF-1a et AF1-b ne sont pas toujours accessibles pour les corégulateurs du MR. La nature du ligand lié dans la cavité de liaison du LBD, ainsi que les modifications post-traductionnelles (PTM) présentes à un temps donné, modulent la conformation tridimensionnelle du MR. De cette modulation dépendent les interactions qui vont être favorisées entre le MR et ses corégulateurs. En effet, aucune structure tridimensionnelle complète du NTD du MR n’a été proposée à ce jour. Il en a été déduit que le
9 NTD pouvait adapter sa structure en fonction de la nature du ligand et des PTM. Cette souplesse permettrait au MR d’offrir une réponse transcriptionnelle spécifique à un contexte donné à un moment donné (Fuller, 2015). Les PTM et les partenaires du MR seront décrits en détail dans la suite du manuscrit.
b)
Le domaine de liaison à l’ADN
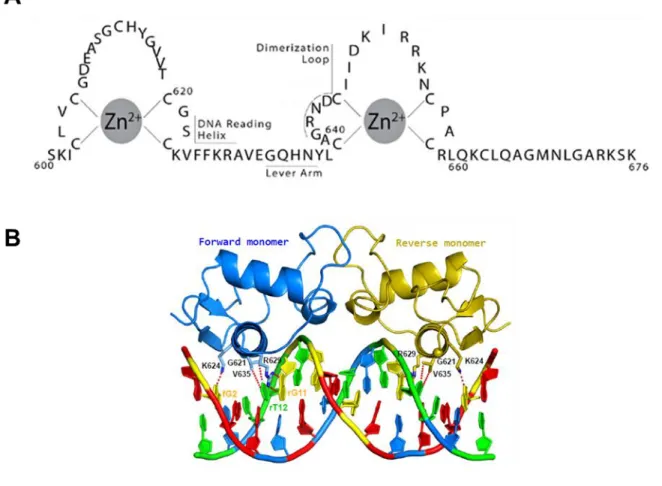
Figure 2 : Structure du DBD du MR humain.
A, Représentation linéaire du DBD du MR. Les deux atomes de zinc (Zn2+) forment avec 4 cystéines chacun les deux doigts de zinc caractéristiques du DBD des récepteurs nucléaires. DNA Reading Helix : séquence de reconnaissance des GRE, contenant la « boîte P », Dimerization Loop : boîte D permettant la dimérisation du MR, Lever Arm : séquence levier.
B, Structure tridimensionnelle de deux DBD d’un homodimère de MR liés à une séquence GRE consensus.
Les nucléotides sont représentés en rouge, bleu, jaune et vert pour l’adénine, la cytosine, la guanine et la thymine respectivement. D’après (Hudson et al., 2014).
Le domaine central du MR est le domaine de liaison à l'ADN (DBD pour DNA-Binding Domain) (Figure 1). Il est hautement conservé au sein de la superfamille des récepteurs nucléaires. Ce domaine de 66 acides aminés (résidus 603-670 pour le MR humain) est riche en cystéines. Ces
10 cystéines du DBD sont tétracoordonnées autour de deux atomes de zinc pour former deux doigts de zinc (Figure 2A). L'hélice α du premier doigt de zinc est impliquée dans la liaison au grand sillon de l’ADN, au niveau d'éléments de réponse aux hormones (HRE pour Hormone Response
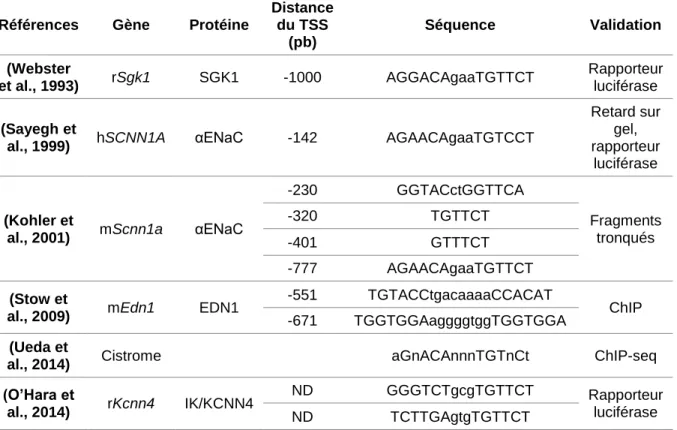
Element). Cette hélice porte une séquence peptidique spécifique appelée « boîte P ». Elle est
caractérisée par trois résidus (lysine 624, valine 625 et arginine 629) qui permettent une reconnaissance des bases nucléotidiques du HRE (Hudson et al., 2014) (Figure 2B). La séquence HRE la mieux caractérisée est le motif GRE (Glucocorticoid Response Element) qui est reconnue par tous les récepteurs des oxo-stéroïdes, de par la forte homologie entre leur DBD. Le GRE dit classique ou parfait est un palindrome composé de deux hexanucléotides séparés par trois nucléotides favorisant la symétrie axiale. Il a pour séquence consensus 5’-AGAACAnnnTGTTCT-3’ (où n désigne n’importe quel nucléotide). Le second doigt de zinc du DBD contient une boucle, appelée « boîte D » (résidus 641 à 648) impliquée dans la dimérisation du MR (Mifsud and Reul, 2016). Les études cristallographiques sur le complexe MR-GRE ont montré que le MR se fixe sous forme de dimère, chaque monomère liant un des hémi-sites du GRE (Figure 2). Entre les deux doigts de zinc, une séquence dite « levier », identique dans le GR, le PR et le MR, est essentielle à l’activité régulatrice des récepteurs nucléaires (Meijsing et al., 2009). Il a été décrit que les bases nucléotidiques de chaque GRE entraînaient un positionnement spécifique de la boîte P ayant une répercussion sur la structure du levier. Cette répercussion sur le levier se propagerait du côté C-terminal du MR, jusqu’à influencer la configuration du domaine de liaison au ligand (Watson et al., 2013). Ces connections indirectes entre le levier et le LBD permettrait d’adapter la réponse transcriptionnelle de façon GRE-spécifique.
c) La région charnière
La région charnière du MR est peu caractérisée. Néanmoins, il a été décrit qu'au niveau du cytoplasme, la liaison d'un ligand agoniste au MR induit un repliement de cette région permettant aux régions N- et C-terminales de se rapprocher et d'exposer les signaux de localisation nucléaire de la région charnière (NLS1) et du LBD (NLS2) (NLS pour Nuclear Localization Signal). Le complexe MR-aldostérone peut alors migrer dans le compartiment nucléaire de la cellule cible. Une seconde séquence importante est localisée dans la région charnière, entre le NLS1 et le DBD ; il s’agit du signal d’export nucléaire (NES pour Nuclear Export Signal), qui régule le trafic
11 du MR du compartiment nucléaire vers le cytoplasme (Pascual-Le Tallec and Lombès, 2005) (Figure 1).
d) Le domaine de liaison au ligand
La partie C-terminale du MR correspond au domaine de liaison du ligand (LBD) (Figure 1). Ce domaine possède plusieurs fonctions : l’interaction et la reconnaissance du ligand, l’interaction avec la protéine chaperonne Hsp90 (Heat shock protein 90) et les corégulateurs transcriptionnels, la localisation nucléaire ainsi que l’activité transrégulatrice ligand-dépendante du MR.
La protéine de choc thermique de 90 kDa de masse moléculaire (Hsp90) est une chaperonne cytoplasmique fortement exprimée (Binart et al., 1995). Elle établit, avec le MR et d’autres protéines, un complexe hétéro-oligomérique stable maintenant le MR dans une configuration capable de lier le ligand. Si la Hsp90 interagit directement avec le LBD du MR, il a été montré que le LBD seul (acides aminés 734 à 984) ne lie pas la Hsp90 (Couette et al., 1998). Par contre, le LBD associé aux 5 acides aminés C-terminaux de la région charnière (729 à 733) peut lier la Hsp90. Enfin, le LBD associé à la région charnière entière peut non seulement lier la Hsp90, mais possède aussi une affinité maximale pour l’aldostérone.
Il existe pour ce domaine des homologies de 50 à 60% avec les autres membres des récepteurs des oxo-stéroïdes mais très faible avec les autres membres des récepteurs nucléaires (moins de 18%). Néanmoins, grâce à un alignement de la séquence des différents LBD des récepteurs nucléaires ainsi qu'à la structure cristallographique de la forme non associée à un ligand de l’isoforme α du récepteur aux rétinoïdes (RXRα) (Bourguet et al., 1995) et à la forme associée au ligand de l’isoforme γ du récepteur de l’acide rétinoïque (RARγ) (Renaud et al., 1995), il a été proposé que l'ensemble des récepteurs nucléaires adoptaient le même repliement tridimensionnel (Wurtz et al., 1996). Un modèle tridimensionnel du LBD du MR a d'abord été construit par homologie en utilisant les données structurales du RARγ (Fagart et al., 1998), puis celles du récepteur de la progestérone (Hellal-Levy et al., 2000a). Sa structure tridimensionnelle a ensuite été résolue par cristallographie aux rayons X (Bledsoe et al., 2005; Fagart et al., 2005a; Li et al., 2005; Huyet et al., 2012). Schématiquement, le LDB est organisé en un sandwich antiparallèle de 11 hélices α (H1, H3 jusqu'à H12), et de deux petits feuillets β (Figure 3).
12
Figure 3 : Structure du LBD du MR humain en liaison avec l’aldostérone.
A, Structure tridimensionnelle du LBD de MR dans lequel est logée l’aldostérone (Numéro d’identification
dans la Protein Data Bank : 2AA2).
B, Diagramme indiquant les contacts entre l’aldostérone et les résidus de la cavité de liaison du LBD. Extrait de (Huyet et al., 2012).
La cavité de liaison du ligand du MR est délimitée par les hélices H3, H5, H6, H7, H11 et H12, le feuillet β entre les hélices H5 et H6, et la boucle entre les hélices H11 et H12 (Fagart et al., 1998, 2005a; Li et al., 2005) (Figure 3A). La cavité de liaison est bordée par 22 acides aminés formant des liaisons spécifiques avec les différents groupements de l’aldostérone (Figure 3B). Seulement cinq des 22 acides aminés sont polaires et ancrent les fonctions polaires de l'aldostérone. La glutamine 776 (Gln776, hélice H3) et l’arginine 817 (Arg817, hélice H5) forment des liaisons hydrogène avec la fonction cétone en position 3 de l'aldostérone, la thréonine 945 (Thr945, hélice H11) avec la cétone en position 20 et l'hydroxyle en position 21. Enfin, l’asparagine 770 (Asn770, hélice H3) forme une liaison hydrogène avec les groupements hydroxyles en 18 et 21 de l’aldostérone. Certains acides aminés sont indispensables à la discrimination des ligands du MR, ils seront évoqués dans le chapitre consacré à la sélectivité minéralocorticoïde.
Le LBD porte une fonction d'activation de la transcription (Activation Function 2, AF-2) qui est formée par les hélices H3, H4, H5 et H12. L’entrée et la liaison de l'aldostérone dans la cavité de liaison entraînent des changements structuraux à l’origine de l’activation du récepteur. La structure non ligandée du LBD du MR n'est pas connue. Néanmoins, par homologie avec le RXRα
13 et le RARγ, la liaison de l'aldostérone au récepteur induit un repositionnement de l’hélice H12 contre les hélices H3 et H4 fermant la cavité de liaison comme un couvercle (Renaud et al., 1995). Les hélices H3, H5, H11 et H12 forment alors un sillon hydrophobe dans lequel se loge le motif LXXLL des coactivateurs transcriptionnels. Les corégulateurs transcriptionnels du MR contiennent des domaines de liaison au récepteur (NR boxes, pour Nuclear Receptor boxes) qui présentent des motifs LXXLL (où L désigne une leucine et X un acide aminé quelconque) reconnus au niveau du domaine AF-2 du MR dans sa conformation active (Darimont et al., 1998). La nature et le rôle des corégulateurs du MR seront détaillés dans un chapitre dédié.
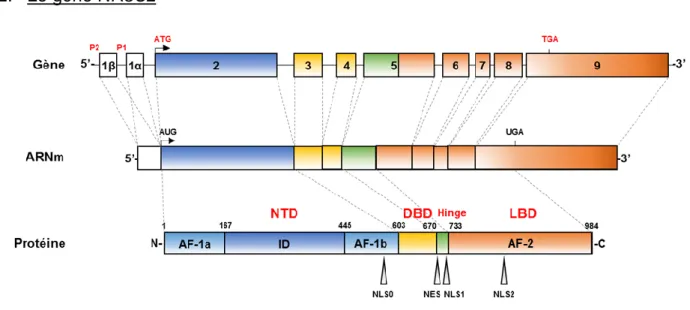
2. Le gène NR3C2
Figure 4 : Gène NR3C2, transcrit et protéine MR.
P1 et P2 : régions promotrices en amont des deux premiers exons alternatifs 1α et 1β, ATG : codon du site d’initiation de la transcription du gène NR3C2,
TGA : codon stop du gène NR3C2.
Le MR est codé chez l’Homme par le gène NR3C2 localisé sur le chromosome 4, dans la région q31.1. Ce gène NR3C2 est un gène qui s’étend sur plus de 450 kilobases et qui est composé de 10 exons et 8 introns (Figure 4). Les deux premiers exons, 1α et 1β, sont non transcrits et sont sous le contrôle en 5’ de leurs promoteurs respectifs P1 et P2. Ils sont à l’origine de deux isoformes d’ARNm du MR (Zennaro et al., 1995). Le promoteur proximal P1 initie la transcription dans l’ensemble des tissus dans lequel le MR est exprimé et tout au long de la vie adulte. L’activité du promoteur distal P2 est plus faible et semble restreinte à certains tissus et à certains stades du développement (Zennaro et al., 1996). Il a été décrit que le MR, de façon
14 aldostérone-dépendante, régulerait sa propre expression via le promoteur P2 uniquement (Le Menuet et al., 2000). Ceci est également vrai dans un contexte de cellule neuronale (Munier et al., 2012). L’absence de GRE, et la présence de plusieurs motifs correspondant à d’autres facteurs de transcription, dans les régions promotrices de NR3C2 suggèrent une liaison indirecte du MR sur d’autres facteurs de transcription. En parallèle, il semblerait que le récepteur glucocorticoïde (GR) régule de façon glucocorticoïde-dépendante l’expression du MR via P1 et, en synergie avec le MR, via P2 (Zennaro et al., 1996).
Les exons 2 à 9 du gène NR3C2 sont à l’origine, après transcription et traduction, des 984 acides aminés composant la protéine MR fonctionnelle chez l’Homme (Zennaro et al., 1995) (Figure 4). Plus précisément, le long exon 2, comprenant 1758 paires de base, code l'intégralité du NTD. Les exons 3 et 4, plus courts, codent chacun un des deux doigts de zinc du DBD, tandis que l’exon 5 code la région charnière ainsi que les hélices H1 et H3 du LBD. Enfin, les courts exons 6 à 8, et le long exon 9, composé de 2733 pb, sont à l’origine du reste du LBD. L’exon 9 est également porteur de la séquence transcrite en région 3’ non codante du transcrit du MR qui, nous le verrons plus loin, est importante pour la régulation post-transcriptionnelle de l’expression du MR (Viengchareun et al., 2014).
3. Expression du MR
Le MR a initialement été identifié dans le rein, in vivo, comme un récepteur sensible à l’aldostérone, et dont l’activité et la liaison à l’aldostérone sont inhibées par la spironolactone, qui était alors définie comme antagoniste de l’aldostérone (Marver et al., 1974). Le MR était alors caractérisé par son coefficient de sédimentation en gradient glycérol. Il a ensuite été identifié dans le rein humain avec le même coefficient de sédimentation et une affinité conservée pour l’aldostérone (Matulich et al., 1976) (Figure 5). Le développement d’anticorps anti-MR permettra par la suite d’identifier les tissus exprimant le MR ainsi que la localisation subcellulaire du MR. Par ce moyen, l’expression du MR a été précisée dans les épithélia polarisés à jonctions serrées, cibles de l’aldostérone et sièges d’un transport transépithélial de sodium. Avant le séquençage du gène NR3C2, la séquence du domaine AF-1a du MR humain avait été déduite par comparaison avec celle du GR, permettant de générer trois peptides (selon le cadre de lecture du transcrit) utilisables pour produire trois anticorps polyclonaux (Krozowski et al., 1989). L’un d’entre eux s’est révélé efficace pour la détection du MR sur des coupes de rein humain. Le récepteur a alors été localisé précisément dans les tubules contournés distaux, les anses de Henlé et les tubules
15 collecteurs du cortex rénal (Sasano et al., 1992). La génération d’un anticorps anti-idiotypique chez le Lapin a aussi permis de confirmer l’expression majeure du MR dans ces différents segments néphroniques par immunohistochimie (Lombès et al., 1990). Les deux types d’anticorps, antisérum et anti-idiotypique, ne permettaient pas alors de déterminer avec certitude la localisation subcellulaire du MR, et notamment de montrer clairement une influence de l’aldostérone sur celle-ci (Fejes-Tóth et al., 1998), comme nous le décrirons plus loin.
Figure 5 : Sites d’expression du MR.
D’après une figure originale de la thèse du Dr Say Viengchareun, Diversité des effets minéralocorticoïdes : Apport de nouveaux modèles cellulaires différenciés établis par oncogenèse ciblée chez la souris, Université Paris-Sud, 2005.
Le clonage du gène NR3C2 de l’Homme par homologie avec l’ADNc de NR3C1 (gène codant le GR) (Arriza et al., 1987), puis au séquençage du gène NR3C2 (Zennaro et al., 1995) représentent et sont à l’origine d’avancées majeures, puisqu’ils ont permis ensuite de produire plusieurs anticorps anti-MR polyclonaux, notamment par des industriels (Santa Cruz). Plusieurs anticorps ont été ainsi générés et utilisés pour des approches d’immunodétection, Western blot ou immunohistochimie. L’expression rénale du MR a été confirmé dans les parties distales du
16 néphron (Lombès et al., 1990), et élargie aux cellules mésengiales du glomérule (Nishiyama et al., 2005) et dans les podocytes (Shibata et al., 2007). Il est à noter que l’approche d’immunohistochimie, très spécifique, est une approche lourde et réservé aux expérimentateurs entraînés, notamment pour la réalisation de l’étape de démasquage des antigènes.
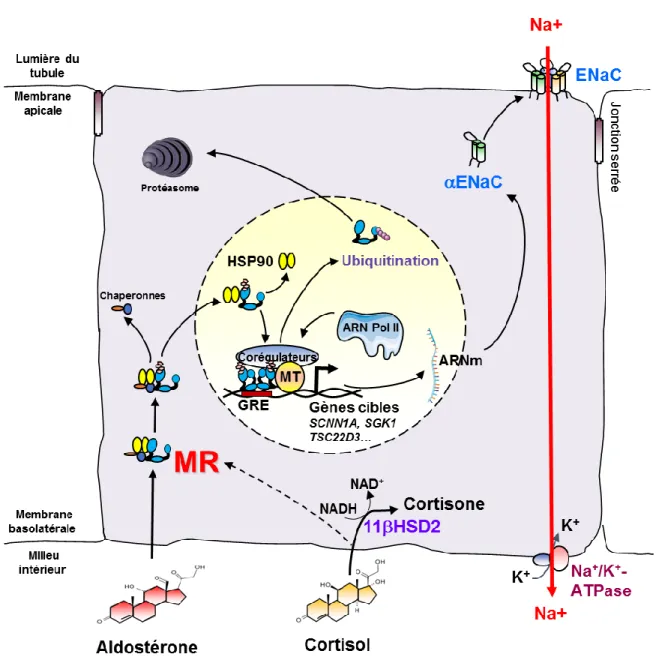
L’expression du MR a été rapidement élargie à d’autres tissus épithéliaux (Figure 5). Le récepteur est exprimé dans plusieurs segments du tube digestif. A partir des extraits de muqueuses intestinales de Rat, l’affinité de l’aldostérone a été mesurée par des tests de liaison, ce qui a indirectement montré l’expression du MR dans les différentes parties de l’intestin grêle (duodénum, jéjunum et iléon) et le colon (Pressley and Funder, 1975; Rafestin-Oblin et al., 1984). Grâce à un anticorps anti-AF-1a du MR humain, les résultats précédents ont été confirmés en immunohistochimie, et ont permis de montrer son expression dans l’épithélium œsophagien (Hirasawa et al., 1999). L’hybridation in situ, qui permet de détecter spécifiquement une séquence d’ADN ou des transcrits dans des tissus grâce à des sondes complémentaires, a permis de montrer l’expression du MR dans la peau. En effet, le MR est exprimé dans les kératinocytes, les follicules pileux, les glandes sudoripares et les glandes sébacées (Kenouch et al., 1994). Ces observations ont été confirmé par immunohistochimie (Hirasawa et al., 1999). Enfin, le MR est aussi exprimé dans le poumon (Krozowski and Funder, 1981; Suzuki et al., 2000). Dans ces tissus épithéliaux, l’expression du MR est associée à celle du canal épithélial à sodium (ENaC pour
Epithelial Na+ Channel), ce qui corrobore le rôle prépondérant du MR dans la régulation de l’homéostasie hydrosodée. L’expression du MR a aussi été montré dans l’oreille interne, où il pourrait contrôler l’équilibre hydro-électrolytique de l’endolymphe (Furuta et al., 1994).
Le MR est aussi exprimé dans des tissus non-épithéliaux. Dans le système cardio-vasculaire, les effets bénéfiques de la spironolactone, antagoniste du MR, dans le traitement de certaines pathologies cardiaques, laissaient penser que le MR était présent (Kolkhof and Bärfacker, 2017). Ce n’est qu’avec le développement de l’anticorps anti-idiotypique du MR que son expression sera confirmée dans les cardiomyocytes, ainsi que dans les cellules endothéliales des gros vaisseaux sanguins (aorte) (Lombès et al., 1992). Nous détaillerons les effets physiopathologiques de la signalisation minéralocorticoïde dans le cœur dans la seconde partie de l’introduction. Les tests de liaison avec l’aldostérone avaient montré que le foie est sensible à l’aldostérone (Duval and Funder, 1974). Le développement de l’approche d’hybridation in situ a permis de révéler l’expression du MR dans l’hippocampe, structure limbique essentielle à la mémoire, et dans l’hypothalamus, où l’appétit sodée est régulé (Van Eekelen et al., 1988, 1991). Enfin, les différentes approches d’immunologie ont permis de démontrer l’expression du MR dans la rétine
17 (Mirshahi et al., 1997), le placenta (Hirasawa et al., 1999), les macrophages (Rickard et al., 2009), et les tissus adipocytaires blanc et brun (Zennaro et al., 1998; Caprio et al., 2007). Enfin, grâce à deux modèles de souris transgéniques, l’ARNm du MR a aussi été détecté dans l’utérus, les ovaires et les testicules (Le Menuet et al., 2000).
Il est essentiel de noter que, dans les tissus non-épithéliaux, le MR n’est pas coexprimé avec l’enzyme 11β-hydroxystéroïde déshydrogénase de type 2 (11βHSD2) qui protège le MR de l’occupation illicite par les hormones glucocorticoïdes. Nous reviendrons sur l’importance de cette enzyme et sur les mécanismes de sélectivité de la signalisation minéralocorticoïde dans la troisième partie de l’introduction. Le MR est maintenant régulièrement décrit comme un récepteur ubiquitaire de par la démonstration de son expression dans un nombre important de tissus. Pourtant, son expression n’est pas constante à la vie adulte, et de plus varie considérablement au cours du développement.
4. Expression diphasique du MR au cours du développement chez l’Homme
Martinerie et al. se sont intéressés en détail à l’expression rénale du MR dans la période périnatale. Chez l’Homme, le rein n’est pas complètement mature à la naissance, ce qui conduit à une difficulté à maintenir l’homéostasie hydrosodée dans cette période critique de transition entre le milieu liquide intra-utérin et le milieu extérieur. Puisque les concentrations d’aldostérone et de rénine étaient élevées dans le sang du cordon ombilical des nouveau-nés, montrant que le système rénine-angiotensine-aldostérone (SRAA) est fonctionnel, l’équipe a cherché à évaluer l’implication du MR dans la genèse de la résistance rénale à l’aldostérone dans la période périnatale. Cette période est caractérisée par une perte de sel importante contrastant avec des concentrations plasmatiques élevées de rénine et d’aldostérone. En mesurant l’expression de l’ARNm du MR par PCR quantitative en temps réel et l’expression protéique par immunohistochimie, il a été mis en évidence une expression diphasique au cours du développement rénal chez l’Homme (Figure 6). L’immunohistochimie révèle que le MR est absent du rein avant la 15ème semaine de gestation, puis est majoritairement présent dans les noyaux des cellules du tubule contourné distal entre la 15ème et la 24ème semaine. Entre la 15ème et la 24ème semaine de gestation, il existe un pic transitoire d’expression du MR dans le rein fœtal, période qui semble contemporaine à la kératinisation cutanée du fœtus in utero, définissant ainsi les limites physiques et fonctionnelles de la barrière entre le moi (l’intérieur) et le non-moi (l’extérieur). Ensuite, le MR n’est plus détecté dans la période périnatale, à partir de la 30ème semaine de
18 gestation ainsi qu'à la naissance pour augmenter progressivement jusqu’à la maturité totale du rein, vers l’âge de un an chez l’Homme. La localisation du MR en période fœtale est nucléaire, ce qui suggère que le récepteur est activé. Il a été montré que l’aldostérone maternelle passe librement par le sang ombilical, ce qui laisse penser que le MR joue déjà un rôle dans le rein, probablement développemental, avant la naissance (Brophy and Robillard, 2004). L’aldostérone est aussi exprimée dans le cortex surrénal fœtal dès la 9ème semaine, elle peut donc agir dans le fœtus en développement. De façon intéressante, l’expression progressive du MR dans la période post-natale corrèle avec l’augmentation concomitante de l’expression de l’enzyme 11βHSD2, facteur important de sélectivité cellulaire de la signalisation minéralocorticoïde (voir chapitre III de l’introduction) et de la sous-unité α du canal ENaC, conduisant à la maturité fonctionnelle complète du rein (Martinerie et al., 2009a, 2009b). Ces résultats sont également observés chez la souris, confirmant la mise en place cyclique de l’expression rénale du MR chez les mammifères.
Figure 6 : Représentation de l’ontogénèse du MR et du GR chez l’Homme.
Au cours du développement, l’expression du MR est diphasique chez l’Homme. Celle du GR ne varie pas significativement.
Adapté de (Martinerie et al., 2012).
Dans le rein, les mécanismes régulant la mise en place de l’expression du MR, ainsi que sa localisation subcellulaire fœtale et son absence périnatale ne sont pas connus. En parallèle, si la mise en place de l’expression rénale du MR au cours du développement est maintenant mieux caractérisée, il y a peu de données sur la mise en place de la signalisation minéralocorticoïde