DEPARTEMENT DE BIOLOGIE
MéMoire de fin d’études
Présenté par
BELLAL IBTISSAM
Pour l’obtention du diplôme deMaster en biologie
Spécialité: microbiologie appliquée
thèMe
Soutenue publiquement le 01/07/2018 devant le Jury
Président M. Laissouf .Ahlem (MCB) U. Mostaganem
Examinateurs Mr. Bouzned ahcene (MCB) U. Mostaganem
Encadreur Mme Mahmoudi.Fatima (MCB) U. Mostaganem
Université Abdelhamid Ibn Badis-Mostaganem Faculté des Sciences de la
Nature et de la Vie
République Algérienne Démocratique et Populaire
ﺔﻌﻣﺎﺟ
سﯾدﺎﺑ نﺑ دﯾﻣﺣﻟا دﺑﻋ
مﻧﺎﻐﺗﺳﻣ
ﺔﯾﻠﻛ
موﻠﻋ
ةﺎﯾﺣﻟا و ﺔﻌﯾﺑطﻟا
L’activité antimicrobienne des bactéries lactiques
isolées à partir du lait de chamelle vis-à-vis les
Dédicaces Remerciements Liste des figures Liste des tableaux Liste des abréviations
Résumé………01
Summary ………....02
ﺺﺨﻠﻤﻟا………03
Analyse bibliographique Introduction générale……….04
Chapitre n° I : Généralités sur le dromadaire et le lait camelin: 1) Aperçue sur les dromadaires ………..05
2. Origine du dromadaire ………....05
3. Taxonomie et race ………05.
4. Les races algériennes du dromadaire………..06
5. Production laitière en Algérie ………...07.
6. Le lait camelin définition ………07
7. Caractéristiques du lait de chamelle……….07
7.1. Caractères physiques et organoleptiques………...07.
7.2. Propriétés nutritionnelles de lait de camelin ……….08
8. Comparaison entre le lait de différents mammifères ………09
Chapitre Π : les bactéries lactiques et les probiotiques 1. généralités sur les bactéries lactiques 1.1. Définition ……….10
1. 2. Habitat ……….10
1. 3. Taxonomie……….10
2. Les déférents groupes des BAL. 2.1. Le genre de lactobacillus 2.1.1. Définition ………...11
2.1.2. Habitat ……….12
2.1.3. Classification ………...12
2.1.4. Les caractéristiques biochimiques et physiologiques………...13
2. 2. Le genre leuconostoc 2.2.1 Définition……….14
2.2.2. Habitat. ………...14
2.2.3. Classification………..14
2.2.4. Les caractéristiques biochimiques et physiologiques 2.3. Le genre de lactococcus 2.3.1 Définition ………..15
2.3.2. Habitat………15
2.3.3. Classification ……….15
2.3.4. Les caractéristiques biochimiques et physiologiques……….15
2.4. Le genre de streptococcus 2.4.1. Définition………... 16
2.4.2. Habitat ………... 17
2.4.3. Classification………. 17
2.4.4. Les caractéristiques biochimiques et physiologiques………. Partie 02 : les bactéries probiotiques 1. l’histoire sur Les probiotiques:………. 18
2. Microorganismes probiotiques……… 18
3. Propriétés probiotiques ……….. 18
4. Les propriétés antimicrobiennes des bactéries lactiques ………..19
4.1. Peroxyde d’hydrogène………19
4.2. dioxyde de carbone ………...19
4.3. Le diacétyle ………20
4.4 Les acides organiques ……….20
4.5 Les bactériocines ………...21
5. Critères de sélection les probiotiques à application intestinal ……….21
Partie expérimentale : Π) Matériels et méthodes 1) Milieux de culture ………..22
2. Echantillonnage ………..22
3. Provenance des souches bactériennes………23
4. Paramètres organoleptiques et physique de lait cru de chamelle ……….23
5. Isolement et purification des bactéries lactiques………..23
6. Purification et ré-identification des espèces………..23
6.1. Critère morphologique………23
6.1.1. Examen macroscopique ……….23
6.2. Recherche de la catalase ……….24
6.3. Test de croissance à différentes température et de thermorésistante………24
6.4. Test de croissance à différentes concentrations de NaCl……….24
6.5. Test de croissance à différentes pH ………..24
6.6. Test hydrolyse arginine l’ADH………..24
6.7. Test de production l’acétoine……….24
6.8. Utilisation de citrate ………..25
6.9. Production de dextrane………..25
6.10. Vancomycine-Résistance ……….25
6.11. Test de fermentation ………..25
6.12.Test d’utilisation des sucres ………..25
6.13. Test de lait de Sherman………26
7. Etude des propriétés technologiques ………26
7.1.pouvoir acidifiant………..26
7.1.1.étude de la cinetique……….26
7.1.2. Mesure de pH ……….26
7.1.3. L’acidité titrable………..26
7.1.4. Étude la cinétique de croissance au milieu lait………27
7.2. Etude l’activité antimicrobienne des souches ………27
7.2.1. Méthode de double couche (méthode directe)……….27
7.2.2. Méthode de puits (méthode indirecte) ………27
7.3. Pouvoir protéolytique………28
7.4. Pouvoir lipolytique………28
7.6. Tolérance à l’acidité ………..29
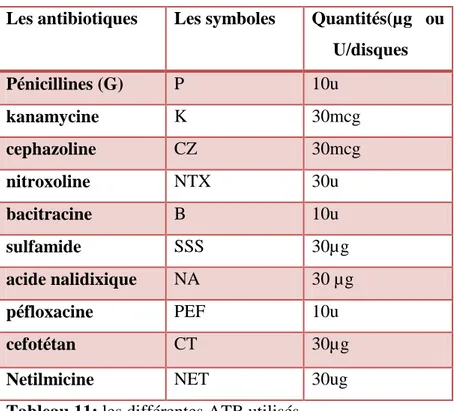
7.8. Résistance aux antibiotiques ……….29
8. Conservation de souches………30
8.1. Conservation à courte terme ………30
8.2. Conservation à long terme………30
Résultats et discussion………...31
Discussion générale………..45
Conclusion……….48
Références bibliographique ………49
Index de milieux de cultures………53
Je dédie ce travail à :
A mon père BELLAL ABDELLAH et ma
mère TOUMI MAGHNIA
A mes sœurs : Amina et son fils Abdeljalil ;
Roumaisa ; Hadja ; Malek ; Khaira
A mon frère ABDELKRIM
A mes amies
Je remercie avant tout ALLAH tout puissant ; de m’avoir guidé tout au long de ma vie ; dans toutes les années d’étude et m’avoir donné la croyance ; la volonté ; la patience et le courage pour terminer ce travail.
Je tiens à adresser ma profonde gratitude et mes vifs à toutes les personnes pour leur aide ; en particulier :
Mme .Mahmoudi. F mon encadreur ; professeur à université de Abdelhamid Ibn Badis Mostaganem ; pour son soutien ; son aide et ses conseils qu’il m’a apportés dans la réalisation de ce travail.
Un remerciement spécial et chaleureux à Mme hafidha technicienne du laboratoire de microbiologie ;pour leur soutien ;leur compréhension et leur encouragement .
*Mme. Dr. A. laissouf , maître de conférences à Université de.Mostaganem que je remercie pour m’avoir fait l’honneur de présider le jury.
* Mr. Dr. Bouzned, maître de conférences à université de Mostaganem que je tiens à remercier d’avoir accepté d’examiner ce travail.
Mes remerciements s’adressent aussi à :
*L’ensemble des membres du laboratoire de biologie Mr.Abaidi.A responsable des laboratoires Mr djéllali Mr.mohammed technicienne de laboratoire de microbiologie pour tout leur aide. J’oublie pas mon ami Saddaoui Mahammed pour leur aide et encouragement durant la période de réalisation de ce trav*Je remercie de façon particulière le père de microbiologie Mr. Djibaoui.R professeur à université de Mostaganem pour leur encouragement durant les années de mes études. Enfin ; je tiens remercier mes parents pour leurs aides et leurs encouragements durant toute la période
Liste des tableaux :
Tableau 01: La production laitière cameline par wilaya d’Algérie en 2013. Tableau 02 : les espèces incluent dans le genre leuconostoc (Hemme et al; 2004) Tableau 03 : Quelques genres de bactéries lactiques (Bekhouche., 2006)
Tableau 04 : Micro- organismes considérés comme probiotiques (Hozalpfel et al ; 1998). Tableau05 : les caractéristiques physiologiques et biochimiques des souches lactiques Tableau06: analyse physique de lait cru de chamelles prélevé dans la région d’Arar. Tableau 07 : résultats s d’antibiogramme pour les bactéries lactiques
Tableau 08: représente les Valeurs des cinétiques de croissance ; d’acidité et le ph en milieu
lait écrémé en fonction du temps de Leuconostoc
Tableau09: représente les Valeurs des cinétiques de croissance ;d’acidité et le ph en milieu
lait écrémé en fonction du temps de Lactobacillus
Tableau10: représente les Valeurs des cinétiques de croissance ;d’acidité et le ph en milieu
lait écrémé en fonction du temps de Lactococcus
Tableau11 : les caractéristiques physiologiques et biochimiques des souches lactiques
Tableau12 : représente les Valeurs des cinétiques de croissance ; d’acidité et le ph en milieu
lait écrémé en fonction du temps de Streptococcus.
Tableau13 : critères différentiels des trois groupes de lactobacilles (Sharpe ; 1981 ; Handler
et al; 1986).
Tableau14: principales caractéristiques physiologiques et biochimiques de quelques espèces
de Lactocoques (dallaglio et al ; .1994)
Tableau 15 : Caractéristiques différentielles des bactéries lactiques (Salminen et al., 2004). Tableau 16: spectre d’action les BAL sur les germes pathogènes et entre eux
Liste des figures :
Figure 01 : représente la race de dromadaire d’origine algérienne (Camelus dromedarius)
figure02 : représente la race de dromadaire d’origine Marocaine (Camelus dromedarius). Figure03 : morphologie en microscopie électronique de Streptococcus thermophilus figure05: résultat de test de production l’acétoine
Figure06 : Dendrogramme illustrant les relations phylogénétiques de l’ordre «
Lactobacillales» dans la classe des « bacilli»
Figure 07: Observation au microscope électronique du genre Lactobacillus. Une barre
représente 2µm
figure08 : résultat de test de catalase pour les BAL
Figure09 : résultat de croissance sur milieu MRS et M17 liquide Figure10: test de citratase pour les souches lactiques
Figure 11: Résultats du test de l’ADH sur milieu M16 BCP Figure12: les tests de croissance sur différentes (T ;NaCl ;pH)
Figure13 : lactococcus lactis subsp lactis sous forme de cellules ovoides par paire (A).et en
chainette (B) selon la souche
Figure14 : observation microscopique de Lactobacille (a) ;Leuconostoc
;Lactococcus (c) ;Sreptococcus (d ) .après coloration de Gram .
Figure15 : résultats de test de catalase pour les bactéries lactiques .
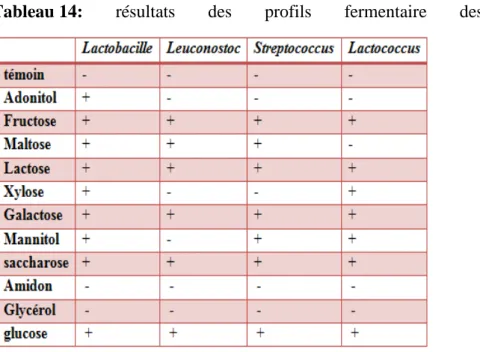
Figure 16 : type fermentaire des souches 1(lactobacille) ;2 (Leuconostoc) ;4 (Lactocoques)
sur MRS contenant la cloche de durham incubées à 30˚c/24h
Figure 17 : aspect macroscopique des BAL sur différentes milieux de culture après 48h
d’incubation
Figure18 : résultat de test de production l’acétoine
figure19 : résultat de test de Sherman à 0.1% et 0.3% de bleue de méthylène
Figure21: les résultats des types fermentaire des souches lactiquesFig02 : résultats de
croissance sur milieu (MRS +pepsine)
Figure22 : représente les interactions entre BAL-BAL
Figure23 : résultats d’antibiogramme pour les souches lactiques
Figure24 : image représente les interactions entre (BAL-souches pathogènes) après 24h
d’incubation (méthode indirecte)
Figure25: représente les interactions entre (BAL-souches pathogènes) après 24h d’incubation
méthode directe
Figure26 : résultats de croissance sur milieu MRS ou pepsine à différents pH2 Figure27 : résultat d’interaction (BAL-champignons) après 48h d’incubation Figure28 : la résistance des souches aux milieux acides.
Figure29 : résultat de l’activité protéolytique (à gauche) et l’activité lipolytique (à droit)
Liste des abréviations ADH : Arginine déshydrogénase
ATB : antibiotiques BAL: bactéries lactiques BCP : Pourpre de bromocrésol °C : Degré Celsius
CO2 : Dioxyde de carbone cm : centimètre
°D : Degrés Dornic DO : Densité Optique h: heurs
FAO : Food and Agriculture Organisation (Organisation des Nations Unies pour
l’alimentation et l’agriculture) Lb: Lactobacillus Lc : Lactococcus min : minutes pH : Potentiel hydroélectrique sp : espèce indéterminée Str : Streptococcus
sub specie :(sous espèce) trs : tours
g : gramme
H2O2 : l’eau oxygénée Ml : millilitre
mm : millimètre
MRS : de Man Rogosa Sharpe NaCl: chlorure de sodium
NaOH: Hydroxyde de sodium (soude) OMS : organisation mondiale de la santé spp: species
T° : température
UFC : unité formant colonie
Résumé
Le lait de chamelle constitue depuis des temps très lointains , la principale
ressource alimentaire pour les peuplades nomade. se lait se singularise
néanmoins par une Teneur élevée en vitamine C et en niacine et par la présence
d’un puissant système protecteur, lié à des taux relativement élevés en
Lysozyme, en Lactopéroxydase (système LP/ SCN/ H2O2), en Lactoferrine
et en Bactériocines produites par des bactéries lactiques. Dans ce travail nous
avons axé notre recherche sur le potentiel probiotique et technologique de quelques
espèces des BAL isolées à partir lait cru de chamelle du région adrar.les
défférentes techniques microbiologiques et biotechnologiques ont été permet
de identifier quatre souches(Lactococcus lactis subsp lactis ;Leuconostoc
mésentéroides sub sp mésentéroides ;Streptococcus thermophilus .Les résultats
obtenus pour l'aptitude de Str.thermophilus et lc.lactis subsp lactis à résister aux
stresses acide, basique et enzymatique qui nous montrent clairement que cette
espèce est probiotique en comparaison avec les souches les plus étudiées qui
Lb. casei et Lb. rhamnosus et Ln mésentéroides et Lc lactis sub cremoris
L'aptitude de ces souches à inhiber un large groupe de bactéries pathogènes est
confirmée par les résultats d'interactions entre les souches lactiques et les
souches pathogènes utilisées dans cette étude et qui sont Staphylococcus aureus,
Escherichia coli, Pseudomonas auroginosa ;et Condida albicans ;Aspergilus
brinsiliensis. Alternaria altarnata .L’antibiogramme des souches a permet de
Summary
For many years, camel milk has been the main food source for nomadic peoples.
However, the milk is distinguished by a high content of vitamin C and niacin and
by the presence of a powerful protective system, linked to relatively high levels of
Lysozyme, lactoperoxidase (LP / SCN / H2O2 system), Lactoferrin and
Bacteriocins produced by lactic acid bacteria. In this work, we focused our
research on the probiotic and technological potential of some BAL species
isolated from camel raw milk from the adrar region. The different microbiological
and biotechnological techniques were used to identify four strains (Lactococcus
Lactis subsp lactis; Leuconostoc mesenteroids sub sp mesenteroids;
Streptococcus thermophilus. The results obtained for the ability of
str.thermophilus and lc.lactis subsp lactis to withstand the acid, basic and
enzymatic stresses that clearly show us that this species is probiotic in
comparison with the most common strains. studied Lb. casei and Lb. Rhamnosus
and Ln mesenteroids and lc lactis sub cremoris The ability of these strains to
inhibit a large group of pathogenic bacteria is confirmed by the results of
interactions between lactic and pathogenic strains used in this study. Which are
Staphylococcus aureus, Escherichia coli, Pseudomonas auroginosa, and Condida
albicans, Aspergilus brinsiliensis. The antibiogram of the strains has led to the
conclusion that they have polyresistance to several antibiotics.
ا
ا
ﺺﺨﻠﻤﻟ
ﺔﺒﺴﻧ ﻰﻠﻋ ﮫﺋاﻮﺘﺣﺎﺑ ﺰﯿﻤﺘﯾو .ﺔﯾوﺪﺒﻟا ﻞﺋﺎﺒﻘﻠﻟ ﻲﺴﯿﺋر ءاﺬﻏ رﺪﺼﻣ اﺪﺟ ﺪﯿﻌﺑ ﺖﻗو ﻦﻣ قﻮﻨﻟا ﺐﯿﻠﺣ ﺮﺒﺘﻌﯾ
ﻦﯿﻣﺎﺘﯿﻓ ﻦﻣ ﺔﯿﻟﺎﻋ
C
،ﺔﯾﻮﻗ ﺔﯿﻣﺎﺣ ﺔﻤﻈﻧا دﻮﺟو لﻼﺧ ﻦﻣو ﻦﯾﺰﯿﻨﻟاو
ﻦﻣ ﺎﯿﺒﺴﻧ ﺔﯿﻟﺎﻋ تﺎﯾﻮﺘﺴﻤﺑ ﺔﻄﺒﺗﺮﻣ
مﺎﻈﻧ ﻲﻓ ﻢﯾزوﺰﯿﻠﻟا
Lactoperoxidase )LP
/
SCN / H2O2
و
Lactoferrine ; Bactériocines
ﺔﯿﻧﺎﻜﻣإ ﻰﻠﻋ ﺎﻨﺜﺤﺑ ﺎﻧﺰﻛر ﺪﻘﻓ ﻞﻤﻌﻟا اﺬھ ﻲﻓ .ﻚﯿﺘﻛﻼﻟا ﺾﻤﺣ ﺎﯾﺮﯿﺘﻜﺑ ﺎﮭﺠﺘﻨﺗ ﻲﺘﻟا
probiotique
ﻞﺑﻹا ﻦﻣ مﺎﺨﻟا ﺐﯿﻠﺤﻟا ﻦﻣ ﺔﻟوﺰﻌﻣ عاﻮﻧﻷا ﺾﻌﺒﻟ ﺔﯿﺟﻮﻟﻮﻨﻜﺘﻟاو
ﺎﯿﺟﻮﻟﻮﻨﻜﺘﻟا تﺎﯿﻨﻘﺘﻟاو راردا ﺔﯾﻻﻮﻟ
تﻻﻼﺳ ﻊﺑرأ ﺪﯾﺪﺤﺗ ﻦﻣ ﺎﻨﺘﻨﻜﻣ ﺔﯿﺟﻮﻟﻮﯿﺑوﺮﻜﯿﻤﻟاو ﺔﯾﻮﯿﺤﻟا
)
actococcus lactis subsp lactis;
L
cus thermophilus
Streptococ
mesenteroids sub sp mesenteroids;
Leuconostoc
ةرﺪﻗ ﻲھ ﺎﮭﯿﻠﻋ ﻞﺼﺤﺘﻤﻟا ﺞﺋﺎﺘﻨﻟاو
Str.thermophilus
و
Lc.lactis
طﻮﻐﻀﻟا ﮫﺟو ﻲﻓ دﻮﻤﺼﻟا ﻰﻠﻋ
ا
ﻢﻈﻌﻣ ﻊﻣ ﺔﻧرﺎﻘﻤﻟﺎﺑ ﻚﯿﺘﯿﺑوﺮﺑ ﻮھ عﻮﻨﻟا اﺬھ نأ حﻮﺿﻮﺑ ﺮﮭﻈﺗ ﻰﺘﻟا تﺎﻤﯾﺰﻧﻹاو ﺔﯿﺳﺎﺳﻷا ﺔﯿﻀﻤﺤﻟ
ﺔﺳورﺪﻤﻟا تﻻﻼﺴﻟا
mesenteroids and lc lactis
Ln
Lb. casei and Lb. Rhamnosus and
sub cremoriso
ﺎﯾﺮﯿﺘﻜﺒﻟا ﻦﻣ ﺔﻌﺳاو ﺔﻋﻮﻤﺠﻣ ﻮﻤﻧ ﻊﻨﻣ ﻰﻠﻋ ةرﺪﻘﻟا ﺎﮭﻟ
ضاﺮﻣﻸﻟ ﺔﺒﺒﺴﻤﻟا
Staphylococcus aureus, Escherichia coli, Pseudomonas auroginosa ;et Condida
albicans ;Aspergilus brinsiliensis.
ﺔﯿﻨﻘﺗ تدأو
Antibiogramme
نأ جﺎﺘﻨﺘﺳا ﻰﻟإ تﻻﻼﺴﻠﻟ
Introduction générale
4
Le lait de chamelle constitue depuis des temps très lointains , la principale ressource alimentaire pour les peuplades nomade qui le consomment habituellement a l’état cru ou fermente . il est considéré comme l’aliment de base pour une période annuelle prolonge ,dans la plupart de ces zone pastorales sahariennes physico-chimique relativement similaire a celle du lait bovin , se lait se singularise néanmoins par une Teneur élevée en vitamine C et en niacine et par la présence d’un puissant système protecteur, lié à des taux relativement élevés en Lysozyme, en Lactopéroxydase (système LP/ SCN/ H2O2), en Lactoferrine et en Bactériocines produites par des bactéries lactiques .se si prolonge naturellement sa conservation de quelques jours sous des température relativement élevées. (Sboui ,2009).
Les bactéries lactiques interviennent dans l’industrie laitière et dans la fermentation de nombreux autres produits alimentaires, en contribuant à la texture, à la saveur des aliments et à la production des composes aromatiques. Ils fermentent les glucides en acide lactique d’où une diminution du pH favorable à la bio conservation des denrées alimentaires .Leur pouvoir antagoniste résulte aussi de la production du H 2O2 (le peroxyde d’hydrogène) et des ,bactériocines limitant la croissance de certains germes pathogènes. Pour cela, de nouveaux produits sont développés, notamment dans le secteur laitier, Il est montré que certaines souches de bactéries lactiques, peuvent jouer un rôle bénéfique pour la santé humaine.
Les objectifs de ce travail s’articulent autour des points suivants :
Isolement et identifications les bactéries lactiques isolés à partir lait cru de chamelle Études des aptitudes technologiques de ces bactéries
Effet antagonisme des bactéries lactiques vis-à-vis les souches pathogènes (Escherichia
coli ; Staphylococcus aureus ; Condida albicans ; pseudomonas aeroginosa ; Aspergilus .sp ; Alternaria alternata ).
Les bactéries lactiques et les probiotiques
10
1. Généralités sur les bactéries lactiques : 1.1 .Définition :
Les bactéries lactiques appelées aussi bactéries de l’acide lactique constituent un groupe très hétérogène de micro-organismes partageant divers aspects morphologiques ; métaboliques et physiologiques ;et dont la caractéristique fondamentale est la production de quantités appréciable de l’acide lactique comme produit principal de leur métabolisme fermentaire
(Marshall et al . ; 1984 ;Axelsson ;1993 ) .
Les bactéries lactiques sont des cellules procaryotes ; hétérotrophes et chimio – organotrophes. elles sont gram positives ;généralement immobiles ; asporulés ; anaerobies mais aérotolérantes (microaérophiles ).elles dépourvues de nombreux activités enzymatiques comme la catalase ;nitrate réductase et la cytochrome oxydase ; aussi elles ne produisent pas d’indole ni acide sulfhydrique et certaines espèces hydrolysent la caséine .en raison de leur biosynthétique ;ces bactéries ont des exigences nutritionnelles complexes pour les acides aminés ;les peptides ;les vitamines ;les sels ;les acides gras et les glucides fermentescibles
(Dellaglio et al. ;1994) 1.2. Habitat :
d’évolution et d’adaptation ;ces bactéries ont colonisé d’autre environnements et se trouvent ainsi dans divers habitats ;tant que ceux-ci réunissent les conditions adéquats pour satisfaire leurs besoins nutritifs (Fenton ;1987 ;Kelly et al .;1998 ;Carr et al. ;2002) de manière ;le lait auquel les bactéries lactiques peuvent accéder à travers le corps de l’animal ; les excréments ou les végétaux ;est devenu un habitat caractéristique des bactéries lactiques ;et ainsi elles se trouvent associées à divers produits laitiéres fermentés (Dellaglio et al. ;1994 ).il faut signaler ; en outre que les BAL font partie de la microflore naturelle de la bouche ;du tractus intestinal et du vagin de l’espèce humaine et de nombreux animaux homéothermes. (Holzapfel et al ;1998 ;Sookkhee et al ;2001 ).
1.3. Taxonomie :
la taxonomie des bactéries lactiques repose sur l’identification phénotypique basée sur les tests morphologiques physiologiques et biochimiques .néanmois ; ces méthodes conventielles ont leurs limites ;notamment dans le cas de variations du phénotype par la présence ou l’absence d’un plasmide codant pour les fonctions métaboliques.par conséquent ;les méthodes
Généralités sur les dromadaires et lait camelin
5
1) Aperçue sur les dromadaires :
Le dromadaire occupe une place de choix dans les zones arides et semi –arides ; en raison de son excellentes adaptation aux mauvaises conditions de vie ; tels que le manque d’eau et de pâturage ; mais malgré tout cela ; il est apte à produire un lait de bonne qualité
(Mahboub et al . ; 2010). 2) Origine du dromadaire :
Le nom dromadaire » dérive du terme grec dromados qui veut dire course .il existe deux espèces : la première est camelus dromedarius : elle est donnée à l’espèce de chameau à une seule bosse ; appartenant au genre camelus de la famille des camelidae et dont le nom scientifique est camelus dromedarius ; la deuxième est camelus bactrianus (deux bosses). le dromadaire vit dans les régions chaudes ; arides et semi arides de la planète .il est le plus ancien fossile de camelidae (Dick et al . ;2011 )
3) Taxonomie et race :
La taxonomie du dromadaire selon wilson 1984 et la suivante : Règne : Animalia
Embranchement : Chordota Classe Mammalia Ordre : Artiodactyla Sous Ordres : Tylopoda Famille : Camelidae Sous Famille : Camelinae Genre : Camelus Espèce : dromedarius
4) Les races algériennes du dromadaire
Différentes races de dromadaires existent en Algérie et, d’une manière plus générale, en Afrique du Nord. (Ben Aïssa ;1989) mentionne l’existence de 9 races :
Généralités sur les dromadaires et lait camelin
6
4.1. Le chaambi : sa répartition va du Grand Erg Occidental au Grand Erg Oriental. 4.2. L’Ouled Sidi Cheikh : on le trouve dans les Hauts Plateaux du Grand Erg Occidental. 4. 3. Le Sahraoui : c’est un croisement entre Chaambi et Ouled sidi Cheikh. Présent dans le
Grand Erg occidental jusqu’au Sahara central.
4.4. L’Aït Khebbach : on le trouve dans l’aire du Sud-Ouest.
4.5. Le chameau de la steppe : présent dans les limites du Sud de la steppe.
4.6. Le Tergui ou race des Touaregs du Nord : Réparti dans le Hoggar et le Sahara central. 4.7. L’Ajjer : dans le Tassili N’Ajjer.
4.8. Le Reguibi : se trouve dans le Sahara occidental de Béchar à Tindouf.
4.9. Le chameau de l’Aftouh : comme le précédent se trouve entre Béchar et Tindouf.
(2) (1)
Figure 01 : représente la race de dromadaire d’origine algérienne (Camelus dromedarius) figure02 : représente la race de dromadaire d’origine Marocaine (Camelus dromedarius).
5) Production laitière en Algérie :
La production laitière cameline en Algérie est estimée à 43725 litres en 2013
(anonyme ; 2013) comparés à3 9668 litres en 2013 ; le tableau suivant représente en détail la
Généralités sur les dromadaires et lait camelin
7
Tableau 04: La production laitière cameline par wilaya d’Algérie en 2013
PL : production laitière.
6. Lait de chamelle 6. 1. Définition :
Le lait de chamelle constitue depuis des temps très lointains , la principale ressource alimentaire pour les peuplades nomade qui le consomment habituellement a l’état cru ou fermente. il est considéré comme l’aliment de base pour une période annuelle prolonge ,dans la plupart de ces zone pastorales sahariennes physico-chimique relativement similaire a celle du lait bovin , se lait se singularise néanmoins par une Teneur élevée en vitamine C et en niacine et par la présence d’un puissant système protecteur, lié à des taux relativement élevés en Lysozyme, en Lactopéroxydase (système LP/ SCN/ H2O2), en Lactoferrine et en Bactériocines produites par des bactéries
WILAYA P.L WILAYA P.L WILAYA P.L
ADRAR 7759 DJELFA 1035 ILLIZI 5111
CHLEF - JIJEL - B.B.ARRERIDJ -
LAGHOUAT 4212 SETIF - ELTAREF -
O, E, BOUAGHI - SAIDA - TINDOUF 11480
BATNA - SKIKDA - TISSEMSILT -
BEJAIA S,B,ABBES - ELOUED 927
BISKRA 1440 ANNABA - SOUK AHRAS -
BECHAR 5113 QUELMA - TIPAZA -
BLIDA - CONSTANTINE - MILA -
BOUIRA MEDEA - AIN DEFLA -
TEMENRASSET 14782 MOSTAGANEM - NAAMA 528
TBESSA - MSILA - A.TEMOUCHENT -
TLEMCEN - MASCARA - GARDAIA 2108
TIARET - OURAGLA 3996 RELIZANE -
TIZI OUZOU - ORAN -
Généralités sur les dromadaires et lait camelin
8 lactiques .se si prolonge naturellement sa conservation de quelques jours sous des température relativement élevées. (Sboui ,2009)
6.2. Caractéristiques du lait de chamelle
6.2.1. Caractères physiques et organoleptiques
Le lait de chamelle est de couleur blanche, en raison notamment de la structure et de la composition de sa matière grasse, relativement pauvre en β–carotène (Sawaya et al.,
1984). Il est légèrement sucré, avec un gout acide, parfois même salé (Abdel-Rahime,
1987) et / ou amère (Ramet, 2003). Cette variabilité dans le gout est lié au type de fourrage ingéré ainsi qu’à la disponibilité en eau (Yagile et al. ;1980 ; Wangoh et al. ;1998). le pH du lait camelin se situe au tour de 6,6 et l’acidité est de l’ordre de 15° Dornic. Sa densité oscille entre 0,99 et 1,034 avec une viscosité moyenne de 2,2 centipoise (Hassane et
al. ;1987) et un point de congélation variant de -0,53 à -0,61°C.
6.2.2. Propriétés nutritionnelles de lait de camelin :
Le lait de chamelle présente des teneurs importantes et équilibrées en nutriments de base. Ce lait présent des toux de protéines variant de 2.5 à 4.5% .Les teneurs en matière grasse dans ce lait sont estimés en moyenne à 3.15%. la matière grasse cameline est caractérisée par la richesse en acide gras mono –insaturé à longue chaine (acide stéarique et oléique).le lactose constitue le sucre principal dans le lait .sa concentration dans le lait camelin varie de 2.8 à 5.8% .par ailleurs ;les grandes concentration en vitamine et en minéraux font de ce lait un véritable aliment à finalité diététique .a ce propos le lait de chamelle présente de faibles teneurs en vitamine A et B2 par rapport au lait de vache et de fortes teneurs en vitamine E et B1 dans le colostrum tandis qu’il présente un apport important en vitamine C (Siboukeur ;2012).
6.2.3. Caractéristiques microbiologiques du lait camelin :
Le lait d’un animal est parfaitement saint quand il est trait aseptiquement ; il est normalement dépourvu de microorganismes .à la sortie de la mamelle le nombre de germes est très faible généralement inférieur à 5000 germes /ml (Anonyme ;1993 ).a la sortie de la mamelle ; le lait est à la temperature 370c.malgrés cette condition favorable à la multiplication de nombreux germes ;celle –ci est inexistante pendant les quelques heures qui suivent le traité ;en raison du pouvoir bactériostatique du lait frais .dans la mesure ou l’on dispose des
Généralités sur les dromadaires et lait camelin
9 moyens nécessaires ;il est houtement souhaitable de profiter de cette période pour refroidir le lait afin de relantir la prolifiration des microorganismes dés la phase bactériostatique passée
(Anonyme ;1993).pour certaines espèces microbiennes ;le lait de chamelle constitue un bon
milieu ;ce qui leur permet de s’y développer .parmi les genres appartenant qui y vive ;on cite
les Streptococcus (ou lactococcus ).les lactobacillus ;les Leuconostocs et les
bifidobactériums.
Tableau 05: composition globale de lait de différents mammifères en g.100g1-de lait
MAT : matières azotées totales ; EST : extrait sec total (d’après les données de Johnson et
al ; 1972 ; Alais ; 1984 ; Luquet ; 1985 ; Belitz et Grosch ; 1987 ; cités par Cayot et al ;
1998).
Lait EST MA
T
Protéin es
Caséines Urée MG Lactose Cendres
Femme 12.6 - 1.6-1.2 0.5-0.8 - 3.75 6 à 7 0.21 Vache 13.0 3.9 3.2 2.8 0.014 3.9 4 à 6 0.9 Brebis 18.4 5.7 5.5 4.5 0.035 7.19 4.7 0.9 Chèvre - 3.1 2.8 2.3 0.0385 3.38 4.4 à 4.7 0.5 à 0.8 Jument - - 2.0 - - - - 0.4 Chamelle 12.4 - 3.00 - - 5.38 3.3 0.7
Les bactéries lactiques et les probiotiques
11 moléculaires s’avérent indispensable car elles sont plus fiables pour une classification couvrent des niveaux d’identification allant de la famille à l’espéce .de plus ;les informations obtenues avec les méthodes moléculaire sont utiles pour le concept de phylogénie (Zakhia et
al . ;2006 )
Figure03: Dendrogramme illustrant les relations phylogénétiques de l’ordre « Lactobacillales» dans la classe des « bacilli» (De Vos et al., 2009).
2. Les déférents groupes des BAL : 2.1. Le genre de Lactobacillus :
les cellules de ce genre sont soit des bacilles longs parfois incurvés ou des coccobacilles courts isolés, comme elles peuvent former des chaines. Elles sont généralement immobiles à l’exception de quelques espèces qui possèdent des flagelles péritriches. Les souches sont acidophiles et peuvent croitre à un pH égal à 5 ou moins avec un optimum de 5.5 à 6.2. La température optimale de croissance est de 30°C à 40°C, mais peuvent croitre à un intervalle de température allant de 2°C à 53°C. Les thermophiles sont incapables de
Les bactéries lactiques et les probiotiques
12 se développer à moins de 15°C. Le genre Lactobacillus peut être divisé en trois groupes : homofermentaires stricts, hétérofermentaires facultatifs et hétérofermentaires stricts.
Figure 04: Observation au microscope électronique du genre Lactobacillus. Une barre
représente 2µm (Gagnon, 2007)
2.1.1. Habitat :
Les lactobacillus sont présents naturellement chez l’homme et l’animal et constituent la flore
autochtone dominante de la partie supérieure du tractus intestinal.les lactobacilles sont également naturellement présents dans les aliments tels que la viande et ses dérivés ainsi les produits laitiers .ils sont utilisés industriellement dans trois dommaines :
En tant que probiotiques dans l’alimentation animale ;
Dans les préparations pharmaceutiques destinées à l’homme ;
En tant que ferments lactiques pour produits fermentés (dans les domaines laitiers et carnés).
2.1.2. Classification : Leur mode de fermentation est à la base de la subdivision en trois
groupes.
groupe1 :
Forme de lactobacilles homofermentaires stricts qui ne fermentent que les hexoses par la voie d’Embden-Meyerhof en produisent presque exclusivement du lactate. Ce groupe comprend notamment Lb.acidophilus ; Lb.farciminis ;Lb.johnsonnii ; Lb.amylovorus ; Lb.paralimentarius (Cai et al. ;1999). Lb.delbrueckii subsp. delbrueckii ; Lb. delbrueckii
Les bactéries lactiques et les probiotiques
13
subsp.lactis ; delbrueckii subsp.bulgaricus (Torriani et al. :1999) ; Lb.nantensis (Valcheva
et al. ;2006).
Groupe2 :
Renferme les lactobacilles homofermentaires facultatifs qui fermentent les hexoses mais aussi les pentoses en lactate et acétate par la voie d’Embden-Meyerhof.il s’agit en particulier de :
Lb.alimentarius ;LB.casei ;LB.curvatus ;LB.plantarum ;LB.graminis ;LB.paracasei ;Lb.para plant rum ;Lb.pentosus ;Lb.sakei (Stiles et al. ;1997). Ces espèces bactériennes sont présentes
dans les végétaux fermentés comme l’ensilage et dans les produits carnés et laitiers fermentés
Groupe03 :
forme de lactobacilles hétérofermentaires stricts qui fermentent les hexoses en lactate ;acétate (ou éthanol) et co2.les pentoses aussi sont fermentés en lactate et en acétate.ces lactobacillus ont un faible pouvoir acidifiant et produisent Des substances aromatiques.il s’agit notamment de : Lb.brevis : Lb.buchneri ; Lb.fermentum ; Lb.hilgardii ;Lb.fructivorans ; Lb.panis
,Lb.reuteri ; Lb.hammeseii (valcheva et al. ;2005) ; Lb.sanfranciscensis ;Lb.spicheri ;
Lb.kimchii et Lb.frumenti (Müller et al.; 2000). Ces espèces se retrouvent dans les levains de
panification et les produits laitiers fermentés (Oheix ; 2003).
Tableau06 : critères différentiels des trois groupes de lactobacilles (Sharpe ; 1981 ; Handler et Weiss ; 1986).FDP : fructose 1-6diphosphate aldolase.
Les bactéries lactiques et les probiotiques
14
2.2. Le genre de Leuconostoc :
le genre leuconostoc a été défini en 1878 par vanthieghem.le terme leuconostoc vient du mot
leucos qui veut dire blanc ; claire ; lumière et nostoc qui est une algue bleue mucilagineuse
(cyanobactérie) ; le tout fera des algues incolores (Ogier et al. ;2007). ce genre comprend 10 espèces fastidieuses dans leurs exigences nutritionnelles, les cellules sont ellipsoïdales à sphériques généralement allongées qui s’arrangent en paires ou en chaines, non acidophiles avec un pH optimum de croissance égal à 6.5. Néanmoins, certains leuconostocs peuvent croitre même à un pH de 4,5. La température optimale est comprise entre 20°C et 30°C mais la croissance peut aussi avoir lieu même à 5°C. Les leuconostocs sont des hétérofermentaires obligatoires. Sur un milieu concentré en saccharose, certaines souches produisent des dextranes extracellulaires.
2.2.1. Historique :
les premiers souches ont été isolées à partir d’accidents apparus dans les sucreries .Or les
leuconostocs responsables de ces accidents produisent des dextranes et en milieu
saccharose ;les chaines de coccies sont entourées d’une gaine bien distincte à l’examen microscopique.les travaux d’orla –Jensen ;1919 basé sur le type de l’acide lactique produit ;l’utilisation de l’arabinose et du caractère hétéro-fermentaire par Evans ;1918 confirmés par Garvie ;1984)ont conduit à la séparation du genre Leuconostoc du
Streptococcus. 2.2.2. Habitat :
les souches de leuconostoc sont présentes dans de nombreux environnements tels que la végétation verte et les racines qui constituent leur riche écologique naturelle(Mundt ;1970).la présence des espèces ;Ln mesenteroides ;Ln lactis et Ln dextranium ;a été signalée dans le lait de chamelle (Zarour et al. ;2012 ;Chentouf et al. ;2014 ;Benmechernene et al. :2014).ils peuvent facilement se propager dans diverses autres niches ;tels que des légumes et de l’ensilage(Ennahar et al. ;2003) et dans les produits alimentaires fermentés
2.2.3. Classification :
Plusieurs changements dans la classification et la taxonomie des espèces de genre leuconostoc ont été faits dans les dix dernières années ; et de nouvelles espèces ont été décrites le genre
Les bactéries lactiques et les probiotiques
15
;dextranicum et cremoris) et 13 autres espèces
(tableau07) ;Ln.citreum ;Ln.carnosum ;Ln.durionis ;Ln.fallax ;Ln.ficulneum ;Ln.pseudoficuln eum ;Ln.gelidum ;Ln.inhae ;Ln.kimchii ;Ln.Lactis ;Ln.pseudomesenteroides (Kim et al. ;2003).
Tableau 07 : les espèces incluent dans le genre Leuconostoc (Hemme et al. ; 2004)
Les bactéries lactiques et les probiotiques
16
Tableau08 : principales caractéristiques physiologiques et biochimiques de quelques espèces
de leuconostoc (Dallaglio et al. ; 1994).
2.3. Le genre de Lactococcus :
Les cellules de ce genre sont sphériques ou ovoïdes isolées, en paires, ou en chaines. De type mésophiles, leur température optimale varie de 10 à 40°C mais sont incapables de se développer à 45°C. Celles-ci se développent généralement à 4% de NaCl et à un pH proche de la neutralité, leur croissance s’arrêtant lorsque le pH du milieu atteint 4,5. Ce genre est un habitant typique des plantes, des animaux et de leurs produits.
Figure05: Lactococcus lactis subsp lactis sous forme de cellules ovoides par paire (A).et en
Les bactéries lactiques et les probiotiques
17
2.3.1. Habitat :
Les habitats les plus importants de Lactococcus demeurent le lait ; les laits fermentés et les fromages ou on les trouve en quantité dominante ; utilisés en culture pures ou en association aves d’autres micro-organismes ; ils jouent dans les produits laitiers fermentés un rôle irremplaçable pour y assurer la structure le gout ; la conservation et la salubrité.
2.3.2. Classification :
le genre lactocccus comporte plusieurs espèces et sous espéces.les trois espéces suivantes sont utilisées dans l’industries laitiére :Lactococcus lactis subsp.lactis ;Lactococcus lactis
subsp.cremoris ;Lactococcus lactis subsp.lactis biovar .diacetylactis (Teuber et al. :1995).ces sous –espèces se différencient selon certaines caractères biochimiques ;telle la
production de diacétyle à partir du citrate ; la désamination de l’arginine ;la capacité à croitre en présence de 4.5% de sel ;à ph 9.2 et 40˚c.
actuellement ; le genre lactococcus comprend cinq espèces ;Lactococcus lactis est l’espèce la plus connue avec ses trois sous-espèces :Lc.lactis subsp.lactis ;Lc.lactis subsp.cremoris et Lc
lactis subsp .hordniae (pot ;2008).même si Lc.lactis se sous- divise en quatre sous –espèces
sous –espèces ;soit Lc.lactis subsp.cremoris ;Lc.lactis ssp.hordniae ;Lc.lactis ssp.lactis et
Lc.lactis
Tableau09 : principales caractéristiques physiologiques et biochimiques de quelques espèces
Les bactéries lactiques et les probiotiques
18
2.4. Le genre de Streptococcus :
les cellules de ce genre sont immobiles, sphériques ou ovoïdes qui ont un diamètre inférieur à 2μm avec une disposition en paires ou en chaines longues. La fermentation des carbohydrates produit principalement de l’acide lactique mais il n’y a pas de production de gaz. Le peptidoglycane est du groupe A et leur température optimale de croissance est 37°C. Elles sont incapables de se développer à 15°C et à pH: 9.6. Beaucoup d’espèces sont commensales ou parasites de l’homme et des animaux et certaines sont hautement pathogènes.
Les bactéries lactiques et les probiotiques
19
Figure06: morphologie en microscopie électronique de Streptococcus thermophilus
(Liebefeld ; 2002)
2.4.1.Habitat et taxonomie :
Le genre streptococcus comprend la majorité des espèces de Streptocoques.ces organismes ont été un contenu en G+C de 35 à 46% (Pilet et al. ;2005).ce genre est généralement divise en trois groupes :pyogène ;oral et les autres Streptocoques .le groupe pyogène contient essentiellement des espèces pathogènes ;hémolytiques (hémolyse ß) comme Streptococcus
pyogenes ; d’autres Streptocoques oraux (
ᵧ
-ou non-hémolytiques)sont associés principalement à la cavité orale de l’homme et de l’animal (Streptococcus mutans).l’espèce thermophile qui soit utilisés en technologie alimentaire est Streptococcus thermophilus.lesSp.thermophilus ont été inclus dans le groupe des autre Streptocoque par (scheilfer et
al.;1987).du fait par son habitat (lait et produits laitiers) ;et son caractère non pathogène seul
cette espèces est considéré comme appartenant aux bactéries lactiques
1) L’histoire sur Les probiotiques:
Durant plusieurs années, le terme « probiotique » a été utilisé dans différentes applications. Il a été tout d’abord utilisé pour définir des substances produites par des protozoaires pour en stimuler un autre (Lilly et al., 1965) plus tard il a été utilisé pour décrire des suppléments alimentaires destinés à l’alimentation animale ayant des effets bénéfiques sur l’animal hôte en affectant sa flore intestinale (Parker, 1974). Récemment, il a été défini comme suit « organismes ou substances qui contribue à l’établissement d’un équilibre dans la microflore intestinal ». Cette définition est insuffisante car imprécise, cela inclurait les antibiotiques. Le plus judicieux serait de le définir comme « supplément alimentaire contenant des microorganismes vivants qui affecte bénéfiquement l’animal hôte en régulant l’équilibre de la flore intestinale » (Fuller, 1989). La FAO (Food and Agriculture Organization) et l’OMS (Organisation mondiale de la santé ; WHO) ont établi récemment des lignes directrices pour l’utilisation du terme « probiotiques » dans les aliments et formulent la définition suivante : «micro-organismes vivants qui lorsqu’ils sont administrés en quantités adéquates, exercent une action bénéfique sur la santé de l’hôte qui les ingère» (FAO/OMS, 2002).
Les bactéries lactiques et les probiotiques
20
2. Microorganismes probiotiques:
La consommation de probiotiques dans des aliments comme le yaourt date depuis plusieurs années, ce n’est que dans les années 1900 que les scientifiques ont commencé à s’intéressés sur les raisons de l’effet bénéfique qu’offrent ces complément alimentaires. Plusieurs genres bactériens et de levures sont utilisés autant que probiotiques, notamment les genres de Lactobacillus, Leuconostoc, Pediococcus, Bifidobacterium,
Enterococcus et Saccharomyces. Les bactéries probiotiques ayant des propriétés désirables
et les plus documentées sont : Lactobacillus johnsonii La1, Lactobacillus rhamnosus GG (ATCC 53103), Lactobacillus casei Shirota, Lactobacillus acidophilus NCFG 1478,
Lactobacillus reuteri et Bifidobacterium animalis Bb12 (Shah, 2007). 3) Propriétés probiotiques :
Résistance aux acides (acide gastriques) Résistance aux sels biliaires
Stabilités en milieu acide.
Aptitude à adhérer aux paroirs intestinaux.
Production des substances antimicrobiennes (bactériocines) Activité immunostimulante.
Les bactéries lactiques et les probiotiques
21
Tableau 10: Micro- organismes considérés comme probiotiques (Hozalpfel et al ;1998 )
4) Les propriétés antimicrobiennes des bactéries lactiques :
Les BAL synthétisent des molécules à action bactéricide /bactériostatique comme les acides organiques ; le peroxyde d’hydrogène ; le dioxyde de carbone : le diacétyle ; la reutérine et les bactériocines (De Vuyst et al ; 1994 ; Messens et al ; 2002).ces mécanismes antimicrobiens ont été exploités pour améliorer la préservation des aliments.
4.1. Peroxyde d’hydrogène :
Les Bactéries lactiques sont dépourvues de catalases catalysant la décomposition du peroxyde d’hydrogène H2O2 en eau et en oxygène .en conséquence ; l’H2O2 produit s’accumule dans l’environnement et peut inhiber certains microorganismes présents
(Condon ; 1987).l’action inhibitrice du peroxyde d’hydrogène est principalement due à son
fort effet oxydant sur les lipides membranaires et les protéines cellulaires (Caplice et al. ;
1999)
Les bactéries lactiques et les probiotiques
22 les bactéries lactiques hétérofermentaires synthétisent du dioxyde de carbone (CO2)comme métabolite secondaire .son accumulation dans le milieu extérieur crée une anaérobiose qui peut étre toxique pour les microorganismes aérobie présents dans l’aliment .toutefois ;le dioxyde de carbone peut aussi ;à faible concentration ;stimuler la croissance de certaines bactéries (Lindgren et al ;1990)
4.3. Le diacétyle :
le diacétyle est un produit du métabolisme du citrate qui est responsable de l’arome beurre des produits laitiérs.les bactéries à gram négatif ;les levures et les moisissures sont plus sensibles au diacétyle que les bactéries gram positif .le diacétyle inhibe la croissance bactérienne en interférant probablement avec les mécanismes gouvernant l’utilisation de l’arginine (Motlagh
et al. ;1991).toutefois ;le diacétyle est rarement présents dans l’aliment en quantité suffisante
pour y exercer une activité antimicrobienne importante (Caplice et al .;1999)
4.4. Les acides organiques :
Les acides organiques comme l’acide lactique ; l’acide acétique ou l’acide propionique ; sont produits par les BAL ou cours de processus de fermentation alimentaire. leurs effets antimicrobiens sont bien connus à l’heure actuelle (Davison ;1997 ;Tou et al. ;2006 ;Djé et
al . ;2008).ces acides ;sous leur formes dissociée ou non dissociée ;agissent au niveau de la
membrane cytoplasmique en perturbant le maintien du potentiel de membrane et en inhibant les systèmes membranaires de transport actif(Alakomi et al . ;2000 ;Menasah et
al .;1991 ;Annan et al ;1997).l’activité antimicrobienne d’un acide organique dépend de sa
nature (acide fort ;acide faible).l’acide acétique ;par exemple ;est plus inhibiteur que l’acide lactique ;il inhibe les levures ;les moisissures et les bactéries(Blom et al. ;1991).
4.5. Les bactériocines :
La détection de la première bactériocine remonte à 1925 par André Gratia qui a observé que la croissance de certaines souches d’E.coli a été inhibée en présence d’un composé antibactérien ; dont il a donné le nom de colicinv.la découverte d’une bactériocine chez les
lactocoques remonte à 1933.à cette époque Whitehead ; 1933 avait observé dans un lot de
lait spécifique que la présence de deux souches de lactocoques inhibait la croissance d’un ferment de culture fromagère. en 1953 ; Jacob et al. proposèrent le terme général bactériocine .les bactériocines différent de la plupart des antibiotiques thérapeutiques par leur composition protéique et possèdent généralement une spécificité d’action étroite contre les mêmes espèces
Les bactéries lactiques et les probiotiques
23
(Tagg et al. ; 1976).Différentes définitions des bactériocines ont été données au cours du
temps. Cependant ;la définition qui reste la plus largement acceptée est celle de
klaenhammer ;1988 qui définit les bactériocines comme des protéines ;ou complexes de
protéines ;aves une activité bactéricide contre des espèces proches de la souche productrice .les bactériocines représentent une large classe de substances antagonistes qui varient considérablement du point de vue de leur poids moléculaire ;de leur propriétés biochimiques ;leur spectre d’action et de leur mode d’action klaenhammer ;1988.Toutes les bactériocines produites par des bactéries lactiques décrites jusqu’à présent ont une activité dirigée contre les bactéries gram-positive. Aucune bactériocine produite par des bactéries lactiques avec une activité contre des bactéries gram-négatif n’a été décrite .en effet ; la membrane externe des bactéries gram-négatif ne permet pas aux bactériocines d’atteindre la membrane interne ; siège de leur activité.
5. Critères de sélection les probiotiques à application intestinal : 5.1. Critères de sécurité :
Souche pour l’usage humain ‘isolée du tractus intestinal d’un homme sain) ou alimentaire (utilisée dans les produits laitiers).
Souche déposée dans une collection de culture reconnue mondialement. Souche caractérisée par des techniques phénotypiques et génotypiques. Histoire de non pathogénicité.
Pas de dé conjugaison excessive des sels biliaires au risque d’induire des lyses cellulaires.
Pas de transmission possible de gène de résistance aux antibiotiques. Pas de dégradation excessive du tractus
5.2. Critères fonctionnels :
Tolérance à l’acidité et aux enzymes gastriques. Tolérance à la bile et aux enzymes digestives.
Adhésion aux cellules intestinales et persistance dans le tractus gastro-intestinal. Immun stimulation.
Production des substances antimicrobiennes et antagonismes vis-à-vis des pathogènes. Effet sur la santé documenté
Les bactéries lactiques et les probiotiques
24
5.3. Critères technologiques :
Stabilité au cours des procédés de production et dans le produit fini.
Conservation des propriétés probiotiques après production (Mattila et al. ; 1999 ;
Matériel et méthodes
35 L'ensemble de ce travail a été réalisé au laboratoire de microbiologie (faculté
des sciences de la nature et de la vie , département de biologie) de l’Université Abdelhamid Ibn Badis Mostaganem. Durant la période (janvier– Mai).
1. Milieux de culture :
Plusieurs milieux de culture ont été utilisés au cours de cette étude expérimentale ; il s’agit des milieux suivants :
MRS à pH9 ; MRS à pH 4.5; MRS à pH6.5; MRS à pH 6.8; MRS à pH5.4; MRS +6.5% NaCl;MRS+4.5%NaCl ; MRS+18%NaCl ; MRS +30µg vancomycine (MRSV); MRS +10% lait écrémé (MRSL); MRS +1% tween80 ; M17 à ph 6.8; M17 à ph6.2 ; MRS a base de jus de tomate ; MSE ; MRSBCP ; M16BCP ; KMK ;; MH; MRS a base de jus de tomate MRS liquide +; M17 liquide ; bouillon nutritive ; Clark et Lubs .
2. Echantillonnage :
Le lait de chamelle testé dans cette étude provient de région Ouled Ahmed Timmi de Adrar ou mois de février Après collecte des échantillons, 3flacons de lait ont été met en glacier à 4°C jusqu'à leur utilisation (nous avons travaillés dans des conditions aseptique)
3. Provenance des souches bactériennes:
Les bactéries pathogènes (Staphylococcus aureus ATCC 25923, Escherichia coli ATCC
25921, Pseudomonas aeroginosa , condida albicans ATCC10231 proviennent de la
collection du laboratoire de microbiologie du centre hospitalier universitaire d’Oran.
Pseudomonas aeroginosa provient de laboratoire de microbiologie de l’université de
Mostaganem.La flore fongique (Alternaria alternata et Aspergillus brinsiliensis) proviennent de laboratoire de l’université de Mostaganem.
4. Paramètres organoleptiques et physique de lait cru de chamelle :
La mesure du pH a été réalisée par un pH-mètre. L’acidité totale a été déterminée en titrant 10 ml de lait cru de chamelle avec la solution basique NaOH N/9 en utilisant l’indicateur de pH la phénolphtaléine.
Matériel et méthodes
36
5. Isolement et purification des bactéries lactiques
Les échantillons de lait dilué (10-1 à 10-4) dans l’eau physiologique (9%о NaCl ) ont été ensemencés par étalement sur gélose MRS acidifiée (ph5.4) pour les lactobacilles et M17 ph 6.5 (lactocoques) ;et ensuite incubés à 30°C pendant 24H à 48H. Des colonies de couleur blanchâtre ou laiteuse ont été récupérées au hasard sur lesquelles ont été appliqués un test préliminaire comprenant la coloration de Gram et le test de catalase. Seules les souches à Gram positif et catalase négative ont été prises en considération puis purifiées par ensemencements successifs en stries .Pour l’isolement de lactobacilles nous avons utilisées MRS modifié (sans KH2PO4) se qui nous permet d’obtenir des forme de bacille sans passé par les étapes de purification contrairement aux autres souches.
6. Purification et ré-identification des espèces :
6.1.Examen macroscopique : La morphologie des colonies et leur dimension sont
étudiées à partir des cultures obtenues sur les milieux suivants : la gélose MRS et la gélose M17 ;MSE ;MRSV
6.2.Examen microscopique : Il a été effectué sur un frottis bactérien, préparé à partir
des colonies suspectes en cultures pures, puis fixé et coloré par la méthode de
Gram (voir l’annexe).
6.3..Recherche de la catalase :
La catalase (Ferro porphyrine de poids moléculaire élevé) à la propriété de décomposer l’eau oxygénée avec dégagement d’oxygène .C’est l’action directe de l’enzyme qui est mise en évidence dans la masse bactérienne. On prend une goutte d’eau oxygénée (H2O2) à 10 volumes qu’on dépose sur une lame avec une colonie bien distincte de culture jeune de 24 h, le dégagement immédiat de bulles d’oxygène exprime la présence d’une catalase(Garnier et Denis, 2007)
H2O2 H2O +1/2 O2
6.4Test de croissance à différentes température et de thermorésistante:
Ces tests nous permettent d’évaluer l’aptitude d’une espèce bactérienne à croitre dans une large gamme de températures. En ensemence de la suspension bactérienne dans un milieu MRS à pH6.8 et on incube les tubes à 20°C, 30°C ; 37°C ; 40°C et 45°C. La
Matériel et méthodes
37 lecture des résultats ce fait après 24h pour les deux derniers et pendant une semaine pour le test de 20°C. Pour la thermorésistance, on fait chauffer la suspension bactérienne pendant 30 min à 63,5°C puis en incube à 30°C et à 53.5pendant 15mn (Bottazzi,
1988 ; De Roissart et al., 1994
6.5. Test de croissance à différentes concentrations de NaCl:
On utilise pour ce test des milieux MRS hypersalé à 4.5% ;6.5% ;18% ; de NaCl dans lesquels on ensemence la souche bactérienne. Il nous permet de déterminer la résistance de la dite souche au stresse halin (Larpent et al., 1990 et Samelis et al., 1994). On apprécie la croissance par l’apparition d’un trouble.
6.6. Test de croissance à différentes pH :
On utilise pour ce test des milieux MRS à différentes pH (4.5 ; 5.4 ; 6.5 ; 6.8 ; 7 ; 9.6 ), on apprécie la croissance par apparition d’un trouble
6.7. Test hydrolyse arginine l’ADH:
Le test consiste en un ensemencement de la souche sur un milieu M16 BCP solide à pH 7. Les réactions observées sont un virement de couleur du milieu vers la couleur jaune après 18h qui s’explique par l’acidification de ce dernier, puis après 48h d’incubation, le milieu réalcalinisé par l’hydrolyse de l’arginine retrouvera sa couleur originelle si l’espèce possède l’enzyme sinon il restera jaune dans le cas contraire
(Thomas, 1973).
6.8. Test de production l’acétoine
la mise en évidence de la production d'acétoïne au cours de la fermentation par la voie du butane-diol en présence de réactif VP (en ajoutant quelques gouttes du réactif VP1 et le même volume du réactif VP2), l'acétoïne donne une coloration rouge en milieu très oxygéné. La lecture s’effectue après quelques minutes.
6.9. Utilisation de citrate :
Utilisation du citrate est détectée sur le milieu kempler et MC Kay 1980.aprés l’incubation à 30˚c pendant 24h à 48h ; les colonies qui fermentent le citrate sont des colonies bleues ou ayant un centre bleu (citr+).les colonies incapables de fermenter le citrate restent blanches (citr-).
Matériel et méthodes
38
6.10. Production de dextrane.
La production du dextrane à partir du saccharose est mise en évidence sur milieu solide MSE (Mayeux et al., 1962). Les souches productrices de dextrane sont caractérisées par la formation de colonies larges, visqueuses et gluantes. Ce test est aussi considéré comme clé d’indentification permetant aussi de différencier entre les leuconostoques productrices et non productrice de dextrane.
6.11. Vancomycine-résistance :
Seuls les isolats de genre leuconostoc ont été testés pour la résistance à la vancomycine. elle est mise en évidence par la culture sur milieu MSE (Mayaux et
al. ;1962) gélosé à une concentration de vancomycine égale 30µg. l’ensemencement est
réalisé à la surface et les boites sont incubées à 30˚c pendant 48h.
6.12. Test de type fermentaire :
Les souches sont ensemencés dans un bouillon M17 ou MRS contenant les cloches du Durham, puis incubés à 30°C/24h. L’absence de gaz dans les cloches montre qu’il s’agit d’un métabolisme homofermentaire alors que la présence de gaz indique qu’il s’agit d’un métabolisme hétérofermentaire.
6.13. Test d’utilisation des sucres :
Les cultures bactériennes revivifiés sur MRS subissent une 1ére centrifugation à 4000 t/min pendant 10 min après élimination de surnageant,5ml d’eau physiologique stérile ajouté au culot puis une 2éme centrifugation suivie de l’ajout de 5ml d’eau physiologique stérile au culot bien agité au vortex pour obtenir une suspension homogène. Bouillon MRS ou M17 sans sucre + le pourpre de bromocrésol (0,025g/l) reparti dans des tubes à raison de 10 ml par tube. Dans chaque tube en met quelque goutte de suspension bactérienne +quelque goutte de sucre testée. On crée l’anaérobiose par l’addition de l’huile de paraffine stérile à la surface puis incubés 30°C/24h à 72h. L’utilisation des sucres se traduit par un virage de l’indicateur colorée (virage au jaune). Les sucres étudiés sont : Glucose, D(-) fructose, D(-) arabinose, D(+) galactose, lactose, maltose, cellubiose, mannitol, amidon, saccharose(
BOUMEDIENE Karima ;2012). Les solutions sucres sont préparées à 3% et stérilisées
Matériel et méthodes
39
6.14. Test de lait de Sherman :
ce test indique l’aptitude des bactéries à pousser en présence de bleue de méthylène à différents concentration .chaque culture à tester a été ensemencée dans écrémé au bleue de méthylène à 0.1% et 0.3%.après une incubation à 30˚C pendant 24h à48h ;on note les observations relatives à la réduction de bleue de méthylène et la coagulation du lait la réaction positive se traduit par la réduction de bleue de méthylène qui vire du bleue (forme oxydé) vers le transparent :forme réduite (Maghnia ;2011).
7.caracterisation technologiques :
7.1.povoir acidifiant ; 7.1.1.étude de la cinetique :
la mesure de l’activité acidifiante consister à suivre d’une part l’évolution du ph des différentes cultures en fonction du temps et d’autre part à doser simultanément l’acidité totale par NAOH .
Chaque souche a été ensemencée d’abord sur milieu MRS liquide et incubée à 30pendant 18h ; ensuite 100µl de la culture jeunes a été inoculé dans un tube contenant 10ml de lait écrémé et incubée à 30˚C. En retirant les deux tubes de t0 .les 24 tubes restant vont être incubée à 30˚C .chaque deux heures deux tubes vont être sortis pour suivre l’évaluation de l’acidité et de pH (kihal et al 2007)
7.1. 2.Mesure de pH :
L’acidité développée dans le lait est suivi aussi par une mesure de pH à l’aide d’un pH mètre type CRISON
7.1.3. L’acidité titrable :
le dosage de l’acidité au cours de la croissance des souches dans le lait est effectué selon la méthode décrit par (acools et al. ; 1977)en utilisant un statif avec noix et pince ;une solution de NaOH/9 ;une burette de 25ml ;une pipette de 10ml et une solution de phénolphtaléine à 1% dans l’éthanol. On remplit la burette de la solution de NaOH ; on la fixe au statif et on réglé le niveau du liquide à zéro.les tubes incubés contenant les cultures de lait ; sont versé dans un bécher dans lequel sont ajoutées 5 gouttes de phénolphtaléine .le titrage s’effectue sous agitation .on considéré que le virage atteint ;
Matériel et méthodes
40 quand la couleur blanche du lai vire au rose pale et persiste pendant une dizaine secondes.les résultats sont exprimés en degrés dornic selon la formule suivante :
Acidité (˚d)=VNaOH ×10 VNaOH : volume de NAOH utilisé pour titrer l’acide lactique contenu dans les 10ml de lait .1degré Dornic =1˚D=0.1g d’acide lactique dans un 1l de lait.
7.1.4. Etude de la cinétique de croissance en milieu lait:
Nous avons respecté la même comparaison concernant les milieux lait pour l’étude de la cinétique de croissance ainsi que la même méthodologie d’ensemencement, la seul différence est que toutes les 2h on effectue des dilutions de l’ordre de 10-7, 10-8 et 10-9 que l’on ensemence en profondeur sur milieu MRS. On ensemence deux boites par dilution pour être conforme à la méthode de dénombrement en milieu solide (Kihal et
al., 1996).
7.2. Etude l’activité antimicrobienne des souches :
Les bactéries lactiques isolées sont testées pour leur activité antagoniste selon deux méthodes :
7.2.1. Méthode de double couche (méthode directe):
Pour mettre en évidence les zones d’inhibition ;les souches lactiques ont été ensemencées en touches à la surface d’un milieu MRS ou m17 solide à partir d’une culture de 24h ;les boites sont séchées sous la température ambiante pendant 2h.après 24h incubation chaque spot est recouvert aves une goutte de gélose nutritive cela permet de fixer les colonies et éviter leur dispensions (Larpent –Gourgaud et al. :1997), une couche de gélose MH semi solide contenant 0.1mld’une culture en milieu liquide de 18h d’une couche indicatrice (pathogène)est coulée au dessus de la première couche de gélose.la lecture des boites s’effectue après 24h d’incubation à37˚c en aérobiose ;les souches présentant une zones transparente sont considérées comme productrices de substances antimicrobiennes .la taille des zones d’inhibition produites a été mesurée en mm la méthode a été expliqué dans le tableau05.
7.2.2. Méthode de puits (méthode indirecte)
afin de déterminer la nature de la substance inhibitrice produite par nos bactéries lactiques ;il est impératif de réaliser une série de tests on utilisant la méthode indirecte