RÉGÉNÉRATION ET DYNAMIQUE DES POPULATIONS MARGINALES DE THUJA OCCIDENTALIS L. EN FORÊT BORÉALE
MÉMOIRE
PRÉSENTÉ
COMME EXIGENCE PARTIELLE
DE LA MAÎTRISE EN BIOLOGIE
EXTENSIONNÉE DE
L'UNIVERSITÉ DU QUÉBEC A MONTRÉAL
PAR
ISABELLE VISNADI
Avertissement
La diffusion de ce mémoire se fait dans le respect des droits de son auteur, qui a signé le formulaire Autorisation de reproduire et de diffuser un travail de recherche de cycles supérieurs (SDU-522 - Rév.01-2006). Cette autorisation stipule que «conformément à l'article 11 du Règlement no 8 des études de cycles supérieurs, [l'auteur] concède à l'Université du Québec à Montréal une licence non exclusive d'utilisation et de publication de la totalité ou d'une partie importante de [son] travail de recherche pour des fins pédagogiques et non commerciales. Plus précisément, [l'auteur] autorise l'Université du Québec à Montréal à reproduire, diffuser, prêter, distribuer ou vendre des copies de [son] travail de recherche à des fins non commerciales sur quelque support que ce soit, y compris l'Internet. Cette licence et cette autorisation n'entraînent pas une renonciation de [la] part [de l'auteur] à [ses] droits moraux ni à [ses] droits de propriété intellectuelle. Sauf entente contraire, [l'auteur] conserve la liberté de diffuser et de commercialiser ou non ce travail dont [il] possède un exemplaire.»
Mes remerciements vont tout d'abord à mon directeur Yves Bergeron pour ses judicieux conseils et sa confiance tout au long du projet. Il a su me guider et me remettre dans le droit chemin quand je m'en égarais ! Mes remerciements vont également à mon codirecteur Christopher Carcaillet pour la pertinence des suggestions et conseils qu'il a su me donner lors de la rédaction du présent mémoire.
Je tiens à remercier très sincèrement Marc Mazerolle pour son aide précieuse en statistiques et sans qui les analyses m'auraient causé bien de la misère !
Je remercie également le personnel de la Chaire en aménagement forestier durable pour leur support, notamment Marie-Hélène Longpré et Danielle Charron pour leur disponibilité, leur dévouement dans tous aspects logistiques du projet.
Mes remerciements vont également aux membres de mon comité d'encadrement, Hugo Asselin et Francine Tremblay, ainsi qu'à Igor Drobyshev, Osvaldo Valeria, Marie-Josée Fortin et Christelle Hély pour leurs précieux conseils et suggestions en analyses statistiques, dendrochronologie et interprétation des résultats. Ils ont ainsi contribué de près ou de loin à l'amélioration de ce mémoire.
Je remercie aussi Raynald Julien pour les divers aspects logistiques de terrain, David Paré et son équipe du Centre de foresterie des Laurentides qui ont effectué les analyses biochimiques des échantillons de sol ainsi que Mélanie Desrochers pour la confection des cartes ArcGis directement appliquées
à
mon territoire d'étude, soit quelques heures de travail qui m'ont été épargnées !Mes remerciements s'adressent aussi
à
Johann Housset, Aurore Lucas et Huaitong Xu pour les divers échanges (discussions, données, ... ) que l'on a pu avoir sur l'espèce qui a fait (pour certains) ou fait encore (pour d'autres) l'objet de notre étude ... le cèdre n'aura bientôt plus de secrets pour nous autres!Un grand Merci
à
mes aides de terrain, Edith, Marc-Olivier, Lucas,--Clément et Raphaëlle qui m'ont énormément aidée ... et supportée aussi !
Mes pensées et remerciements vont également
à
tous mes proches qui ont su m'écouter, me soutenir et me guider dans des choix pas toujours faciles ...Ce projet a été réalisé dans le cadre du Laboratoire International Associé MONTABOR (partenariat France - Canada). Le financement nécessaire pour sa réalisation a été apporté par le Conseil national de recherche en sciences naturelles et en génie du Canada ainsi que le Ministère du développement économique, de l'innovation et de l'exportation du Québec.
REMERCIEMENTS ... II TABLES DES MATIE RES ... IV LISTE DES FIGURES ... VII LISTE DES TABLEAUX ... IX RÉSUMÉ ... X
CHAPITRE I ... 1
INTRODUCTION GÉNÉRALE ... ! 1.1 Les populations marginales ... 1
1.1.1 La limite d'aire de répartition d'une espèce ... .4
1.2 Vulnérabilité des populations marginales ... 5
1.2.1 Paysage fragmenté ... 5
1.2.2 Limite de répartition ... -... 6
1.3 Réponse des populations marginales face aux changements environnementaux ... 8
1.4 Facteurs limitant le succès de recrutement ... 11
1.5 Facteurs influençant la dynamique et la structure des populations marginales : le cas du cèdre blanc (Thuja accidenta lis L.) ... 12
1. 5.1 Rôle important de la ca nopée ... 14
1.5.2 Facteurs abiotiques : luminosité et humidité ... 14
1.5.3 Substrat favorable
à
la germination et à la croissance des plantules ... 151.6 Modèle biologique : le cèdre blanc (Thuja occidentalis) ... 18
1.6.1 Mode de reproduction du cèdre ... 21 1.6.2 Le cèdre
à
sa limite de répartition ... 221.6.3 Enjeux de conservation du cèdre blanc : aspects sociaux et économiques ... 23
1. 7 Objectifs et hypothèses ... 24
1. 7.1 Objectifs ... 24
CHAPITRE II ... 28
2 MATÉRIELS ET MÉTHODES ... 28
2.1 Zone d'étude ... 28
2.2 Echantillonnage ... 29
2.2.1 Sélection des sites ... 29
2.2.2 Structure spatiale ... 30
2.2.3 Structure d'âge ... 34
2.3 Analyses statistiques ... 36
CHAPITRE III ... 42
3 RÉSULTATS ... 42
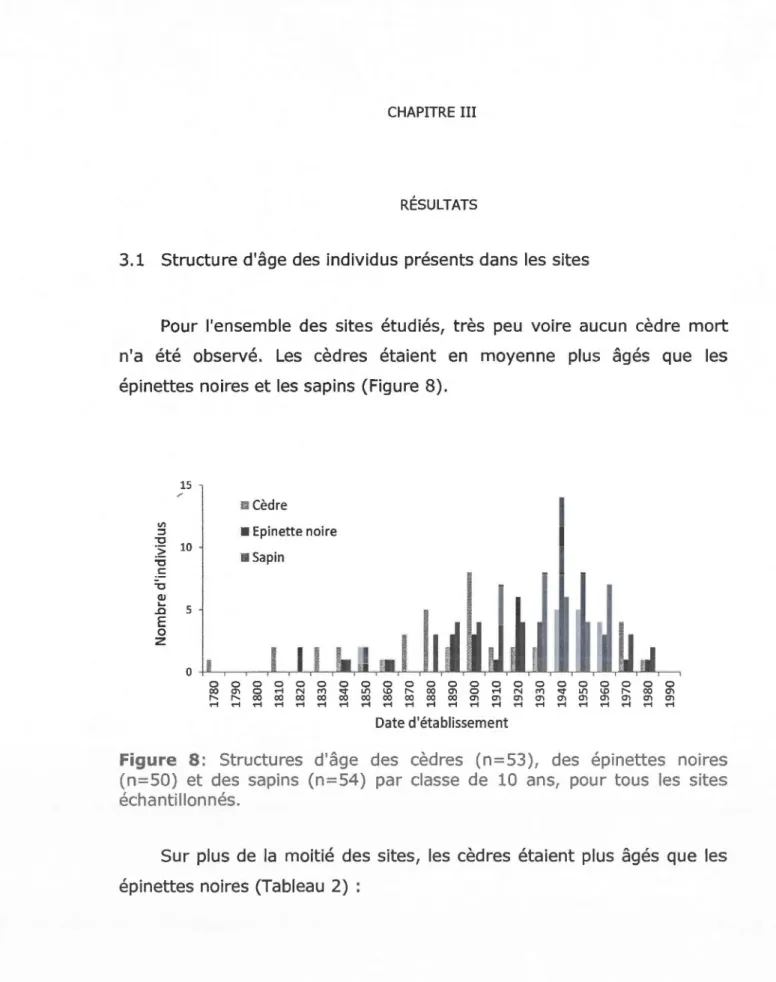
3.1 Structure d'âge des individus présents dans les sites ... 42
3.2 Structure d'âge de la régénération des cèdres ... 44
3.2.1 Description de la structure d'âge ... 44
3.2.2 Nature du recrutement ... 45
3.2.3 Influence des variations climatiques .... _, ... 46
3.3 Structure spatiale de la régénération ... 49
3.3.1 Taux d'expansion des populations marginales ... 54
3.3.2 Caractérisation du substrat le long du transect ... 55
3.3.3 Facteurs expliquant la densité de cèdres ... 56
3.3.4 Facteurs expliquant l'occurrence des semis de cèdre ... 57
3.4 Analyses pédolog iques ... 60
3.4 .1 Matières organiques ... 60
3.4.2 Matières minérales ... 62
CHAPITRE IV ... 65
4 DISCUSSION ... 65
4.1 Maintien des populations de cèdre ... 66
4.1.1 Un maintien de la dynamique grâce au marcottage ... 66
4.1.2 Un habitat favorable au cèdre ... 69
4.1.3 Une densification des populations possible dans le futur .... 71
4.2.1 Expansion et déclin du cèdre au cours de l'Holocène ... 73
4.2. 2 Reproduction sexuée effective mais inefficace ... 75
4.2. 3 Un faible potentiel de dispersion ... 77
4.3 Projections et perspectives ... 79
4.3.1 Climat ... 79
4.3.2 Feux ... ; ... 80
4.4 Implications pour l'aménagement forestier ... 81
CHAPITRE V ... 82
5 CONCLUSION ... 82
6 APPENDICE A ... 83
CARACTERISTIQUES BIOLOGIQUES ET ECOLOGIQUE DU CEDRE BLANC (THUJA OCCIDENTALIS L.) ... 83
7 APPENDICE B ... 86
AGE MOYEN DES CEDRES PAR CLASSE DE HAUTEUR ... 86
8 APPENDICE C ... 87
ANALYSES GRANULOMETRIQUES DES ECHANTILLONS DE MATIERES MINERALES ... 87
9 APPENDICE D ... 89
DETERMINATION DU PH DANS LES ECHANTILLONS DE MATIERES MINERALE ET ORGANIQUE ... 89
10 APPENDICE E ... 91
DETERMINATION DE LA CAPACITE D'ECHANGE CATIONIQUE (CEC) DES ECHANTILLONS DE MATIERES MINERALE ET ORGANIQUE ... 91
11 APPENDICE F ... 98
DETERMINATION DES TAUX DE CARBONE, D'AZOTE ET DE SOUFFRE DANS LES ECHANTILLONS DE MATIERES MINERALE ET ORGANIQUE .... 98
12 APPENDICE G ... 100
TABLES D'ANALYSE DE LA VARIANCE ... 100
Figure Page
1.1 Facteurs influençant la structure et la dynamique spatio-temporelle de la régénération... 13 1.2 a) Carte de répartition du cèdre au Québec. Le point vert indique
la zone d'étude. b) Localisation des sites échantillonnés autour des lacs de kettle sur la moraine de la rivière Harricana... 19 2.3 a) Localisation des transects en bordure de site. b) Disposition
des quadrats sur le transect ... 31 2.4 Plan d'échantillonnage... 32 2.5 Localisation des échantillons de matières minérales et
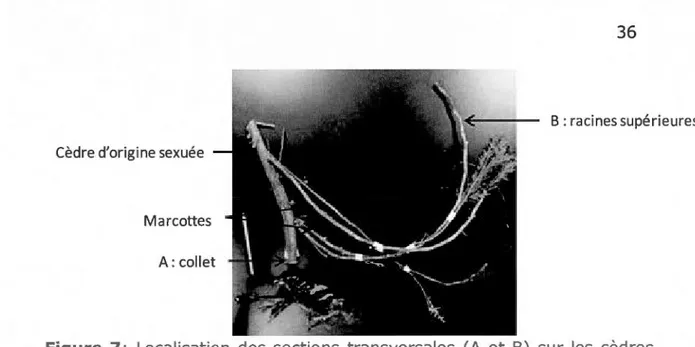
organiques et des prélèvements de cèdres de DHP < 5 cm 33 2.6 Distinction des couches pédologiques ... ~... 33 2.7 Localisation des sections transversales (A et B) sur les cèdres
issus de reproduction sexuée (graine) et asexuée (marcotte)... 35 3.8 Structures d'âge des cèdres (n=53), des épinettes noires (n=50)
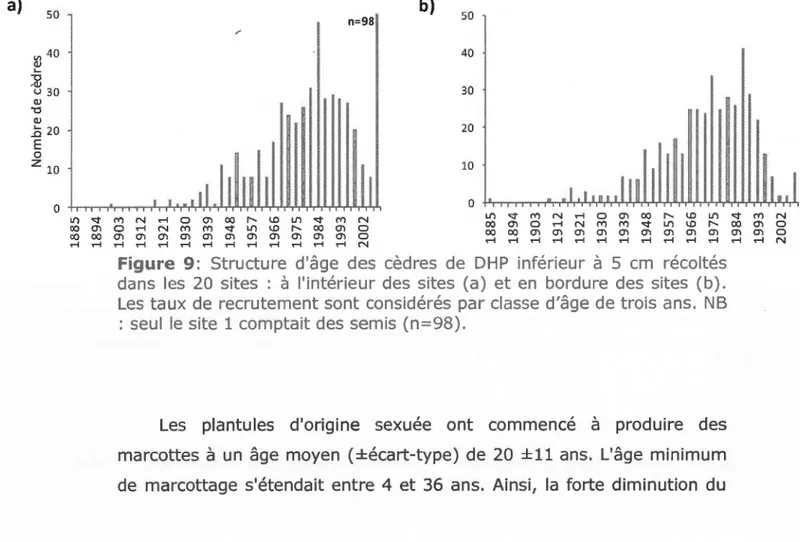
et des sapins (n=54) par classe de 10 ans, pour tous les sites échantillonnés... 41 3.9 Structure d'âge des cèdres de DHP inférieur à 5 cm
à
l'intérieurdes sites et en bordure des sites... 43 3.10 Application de la fonction Puissance (a) et de la fonction
Exponentielle négative (b)
à
la structure d'âge des cèdres récoltés en bordure des sites... 44 3.11 a) Disposition des quadrats le long du transect et délimitationdes trois zones (intérieur, bordure et extérieur). b) Proportions relatives du nombre de cèdres, sapins et épinettes noires le long du transect. Relation entre la densité de cèdres et la distance au site... 49 3.12 Relation entre la densité de cèdres et la distance au site : a)
toutes les classes de hauteur confondues (portions extérieure du transect uniquement) ; b) classes de hauteur distinctes (portions
extérieure du transect uniquement) ; c) petites classes de hauteur (intérieur et extérieur)... 50 3.13 Proportions relatives de cèdres, sapins et épinettes noires dans
chacune des zones en fonction des classes de hauteur : a) intérieur du site, b) bordure du site, c) extérieur du site... 52 3.14 Age moyen des cèdres en fonction de la distance au site... 54 3.15 Proportions des types de substrat le long du transect,
à
l'intérieur et
à
l'extérieur des sites... 55 3.16 Variation des prédictions de la probabilité [0-1] de présenced'une plantule en fonction de la distance au semencier le plus proche, pour un substrat donné... 56
Tableau Page
1.1 Moyennes climatiques annuelles des zones de répartition continue (47,5°N) et marginale (49,5°N) du cèdre au cours des 30 dernières années... 29 3.2 Age estimé de l'individu le plus vieux (cèdre, épinettes noires,
sapins) sur chacun des sites échantillonnés... 42 3.3 Estimations des paramètres et valeurs de p des modèles GLS...... 45 3.4 Estimations des paramètres et valeurs de
p des modèles GLS
... 46 3.5 Estimations et écart-types des variables des trois modèlesprésentant le plus faible critère d'information Akaike sur un total de six modèles ... -:-... 56 3.6 AICc des régressions logistiques... 57 3. 7 Inférence multi-modèle et estimation du paramètre de la
variable 01... 59 3.8 Moyennes et erreur-types de l'épaisseur (cm) de la couche
organique à l'extérieur et à l'intérieur des sites et valeurs de p des ANOVA... 59 3.9 Valeurs moyennes et erreurs standard des variables
biochimiques de la matière organique prélevée
à
l'extérieur et à l'intérieur des sites et valeurs de p des ANOVA... 61 3.10 Valeurs moyennes et écarts-type des variables biochimiques dela matière minérale (MM 1) prélevée à l'extérieur et à l'intérieur des sites et valeurs de p des ANOVA... 62 3.11 Valeurs moyennes et écarts-type des variables biochimiques de
la matière minérale (MM2) prélevée à l'extérieur et
à
l'intérieur des sites et valeurs de p des ANOVA... 63Dans la forêt boréale, la répartition du cèdre blanc (Thuja occidentalis L.) se caractérise par un gradient latitudinal de fragmentation du sud au nord. Les populations marginales situées au nord représentent des refuges biologiques potentiels car elles sont susceptibles de s'étendre. En limite d'aire de répartition, les espèces sont généralement plus vulnérables aux fluctuations environnementales et leur capacité de réponse est déterminante pour le devenir de l'espèce en termes d'adaptation, d'expansion ou d'extinction.
L'objectif de cette étude est de caractériser la dynamique spatio-temporelle de régénération de ces populations en relation avec les variables édaphiques et climatiques locales, afin d'évaluer leur capacité d'expansion. Des populations marginales ont été cartographiées dans la pessière
à
mousses au niveau du 49ème parallèle nord. La structure spatiale a été caractérisée en quantifiant la régénérationà
l'aide de transects en bordure des populations. La distance aux arbres semenciers et le type de substrat ont été considérés afin d'identifier les facteurs limitant l'expansion locale. La structure d'âge a été déterminée en prélevant et datant 967 cèdres de diamètre inférieurà
5 cm en bordure età
l'intérieur des populations.Au cours du dernier siècle, le bilan net du recrutement apparaît constant et indépendant des conditions climatiques, indiquant une stabilité du recrutement des cèdres. Les structures d'âge en bordure et
à
l'intérieur des populations sont similaires, suggérant l'absence d'expansion spatiale récente. Le patron spatial des populations est groupé du fait d'une reproduction végétative continue par marcottage favorisant le recrutement près des arbres producteurs, et d'années semencières intermittentes. L'expansion du cèdre semble limitée par la distance de dispersion des graines et de son mode de recrutement dominant par voie végétative, et non par la disponibilité en substrat favorableà
la germination. Cette vulnérabilité de l'espèce en limite de son aire de répartition devra être prise en compte dans les pratiques d'aménagement . durable.MOTS CLÉS : Thuja occidentalis L., cèdre blanc, populations marginales, régénération, reproduction, forêt boréale
INTRODUCTION GÉNÉRALE
1.1 Les populations marginales
Les populations marginales ou fragmentées sont des fragments de végétation originelle, isolés ou peu connectés les uns aux autres. Situées au sein d'une matrice de végétation différente (Wilcove et al. 1986), elles sont souvent le résultat d'une fragmentation naturelle ou anthropique des habitats (Franklin et al. 2002, Didham 2010). Elles se rencontrent également en limite d'aire de répartition des espèces, au-niveau d~s latitudes ou altitudes plus élevées que l'aire de répartition continue (Thuiller et al. 2008)
1. La fragmentation des habitats
La fragmentation des habitats est au cœur des préoccupations dans le domaine de la biologie de la conservation (Meffe et Carroll 1997). Elle est souvent associée à la perte et l'isolement des habitats (Holt et al. 1995, Collinge 1996, Fahrig 1997). Aujourd'hui, ce processus représente une menace importante pour la biodiversité et est considéré comme l'une des premières causes de la crise d'extinction actuelle (Wilcox et Murphy 1985, Reid et Miller 1989, Fahrig 1997).
La fragmentation des habitats peut être définie comme une transformation du paysage résultant en un ensemble de fragments ou d'îlots de végétation originellement connectés, en des parties isolés ou peu connectés et enfermés dans une matrice de végétation distincte (Wilcove et al. 1986). Il peut s'agir d'une conversion d'un type d'habitat continu en un autre (Faaborg et al. 1993) ou d'une rupture ou destruction de la configuration spatiale d'un habitat large et continu en plus petits fragments (Wiens 1989, Fahrig 1997, Forman 1997, Franklin et al. 2002, Fahrig 2003). Dans les deux cas, seuls des fragments de l'habitat originel demeurent dans le paysage. La fragmentation aboutit généralement
à
l'individualisation de fragments réduits en taille et déconnectés les uns des autres. Le temps écoulé depuis l'isolement d'un fragment, la distance ainsi que le degré de connectivité entre ces derniers sont des déterminants importants de la réponse biotique au processus de fragmentation. Un paysage fragmenté est soumisà
de nombreux "" changements biologiques, biogéographiques et physiques (Saunders et al. 1991).La fragmentation présente deux composantes, toutes deux causes d'extinction (Wilcove et al. 1986) :
la réduction de l'aire totale de l'habitat d'origine, qui affecte avant tout la taille de la population végétale et donc son taux d'extinction ;
la redistribution de l'aire d'habitat restant en fragments disjoints, qui affecte les taux de dispersion et donc d'immigration.
De manière générale, ce processus compromet l'intégrité des écosystèmes, en contribuant
à
la perte de la biodiversité initiale (ex :richesse spécifique, abondance, diversité génétique), à l'invasion d'espèces exotiques, à l'altération de la structure des communautés (ex : interactions interspécifiques au sein de la chaîne trophique) et du fonctionnement des écosystèmes (ex : érosion des sols, diminution de la qualité des eaux) (Forman et Godron 1981, Wilcove et al. 1986, Bierregaard et al. 1992, Collinge 1996, Fahrig 2003, Didham 2010). L'intensité et l'étendu de ces altérations sont influencées par la taille, la connectivité, l'arrangement spatial et l'hétérogénéité des fragments restants (Collinge 1996).
Par le passé, des perturbations naturelles comme les feux, les inondations ou les tempêtes ont fréquemment détruit des habitats, se traduisant en l'isolement et la réduction des populations animales ou végétales. Les organismes ont été capables de s'adapter à cette fragmentation naturelle au cours du temps, notamment via la pression sélective exercée sur les individus les moins tolérants aux conditions locales (fitness de la population). La croissance et la reproduction favorisent l'apparition de caractères physiologiques. La nouvelle cohorte d'individus, en quelque sorte déjà adaptée aux nouvelles conditions (ex : individus issus de graines en provenance de populations situées plus au sud durant des périodes plus chaudes), contribue ensuite à l'adaptation de l'espèce en favorisant l'apparition de nouvelles combinaisons génétiques et en les maintenant via la sélection naturelle (Davis et Shaw 2001, Didham 2010).
Cependant, à l'heure actuelle, en plus des perturbations naturelles, s'exercent aussi des perturbations anthropiques comme les coupes forestières ou la conversion des terres (ex : conversion de forêts ou prairies naturelles pour les cultures agricoles). Celles-ci sont à l'origine
des modifications paysagères qui se produisent
à
des taux sans précédent (Skole et Tucker 1993, Collinge 1996, Franklin et al. 2002) et qui excèdent souvent la capacité d'adaptation et de réponse de la plupart des espèces (Myers et Knoll 2001).Par exemple, dans la forêt boréale d'Amérique du Nord, alors que la coupe forestière est reconnue comme la perturbation anthropique prépondérante (Burton et al. 1999), les feux sont la perturbation naturelle majeure (Payette 1992). Dans les deux cas, la perte et la fragmentation de forêts matures ont une influence négative sur l'abondance des espèces animales (St-Laurent et al. 2009) et végétales (Hanski 1998).
1.1.1 La limite d'aire de répartition d'une espèce
En se rapprochant de la limite d'aire de répartition des espèces, que ce soit en limite altitudinale ou latitudinale, celles-ci forment des populations de plus en plus fragmentées et plus vulnérables aux conditions environnementales. Dans le contexte actuel de changement climatique, il est important de prendre en compte les espèces situées
à
leur limite d'aire de répartition et en particulier leur dynamique spatio-temporelle (Thuiller et al. 2008). Il est en effet communément accepté, d'après la théorie de la niche, que l'aire d'expansion d'une espèce dépend principalement des populations situées au niveau du front de colonisation (Thuiller et al. 2008). A ce niveau, la colonisation est contrôlée par des événements de dispersion sur de longues distances, suivis d'une croissance exponentielle de la population (Hampe et Petit 2005). Par exemple, en forêt boréale, de nombreuses espèces atteignent leur limite de répartitionà
la transition entre la forêt mixte et la forêt coniférienne. Cette transition entre les deux écozones du biome boréal estpartiellement contrôlée par le climat et le régime des feux actuel (Bergeron et al. 2004) ou passé (Carcaillet et al. 2010) même si d'autres facteurs, comme l'existence de micro-habitats favorables, jouent aussi un rôle important (Hofgaard 1993).
1.2 Vulnérabilité des populations marginales
Dans le contexte actuel de changements climatiques, un des défis auxquels font face les écosystèmes réside dans la capacité de régénération des espèces, et notamment au sein des populations marginales, situées dans un paysage fragmenté ou en limite d'aire de répartition (Payette et Lavoie 1994, Holtmeier et Broll 2005).
1.2.1 Paysage fragmenté
La fragmentation augmente la vulnérabilité des espèces aux perturbations naturelles telles les feux ou les tempêtes. L'impact de ces perturbations varie avec la nature (ex : structure, composition spécifique) et la disposition géographique des fragments dans le paysage (Lord et Norton 1990). Dès qu'un habitat est isolé, celui-ci connaît une diminution du nombre d'espèces capables de maintenir une population viable à long terme (Brooks et al. 1999). Cette réduction de la richesse spécifique est causée par la diminution des ressources, l'hétérogénéité de l'habitat, la sévérité des perturbations et l'altération de la dynamique des taux de colonisation et d'émigration (Ewers et Didham 2006). Il en résulte une augmentation de la probabilité d'extinction des espèces (Saunders et al. 1991, Didham 2010). L'extinction d'une espèce indigène peut cependant être retardée si celle-ci est longévive et résistante aux perturbations, comme le cèdre blanc, Thuja occidentalis L. (Saunders et al. 1991).
De nombreuses études se sont intéressées à la taille minimale des fragments nécessaire pour permettre la viabilité d'une population mais il n'y a actuellement pas de réelle concordance des auteurs sur les caractéristiques définissant une population viable (ex: Lovejoy et Oren 1981, Noss et Harris 1986). La réduction de la superficie d'un fragment limite la disponibilité des ressources, réduit les taux de colonisation, altère le succès reproducteur et impose une contrainte intrinsèque sur la taille maximale de la population (capacité de charge). Ces conditions peuvent exposer la population à un risque élevé d'extinction locale (Hanski et Ovaskainen 2000).
La perte d'habitat associée à la diminution de la taille des fragments augmente la proportion de bordure entre les habitats, exposant l'intérieur des fragments
à
l'influence de l'environnement alentour (Didham 2010). L'effet bordure correspond à la transition des conditions biotiques et abiotiques au niveau de l'interface entre deux habitats adjacents (Cadenassa et al. 2003). Ainsi, la dynamique des petits fragments est plutôt influencée par les conditions environnementales environnantes. Au contraire, les fragments de grande taille présentent un noyau qui est peu affecté par les changements biotiques et abiotiques associés à cet effet bordure (Harris 1988).1.2.2 Limite de répartition
Aux marges de leurs aires de répartition, les espèces sont, par principe, situées aux limites de leurs tolérances écologiques et présentent une forte sensibilité aux fluctuations de l'environnement. De ce fait, c'est souvent à cet endroit que se manifestent les premiers signes de
changement suite à une perturbation (Payette et Lavoie 1994, Holtmeier et Broll 2005).
De manière générale, ces populations sont plus vulnérables et souvent soumises à des risques accrus d'extinction (Thuiller et al. 2008) par rapport à celles situées dans une aire de répartition continue. En effet, elles présenteraient une diversité spécifique et une densité moindres, des capacités de colonisation limitées et souvent, elles sont situées dans des habitats peu favorables (Collingham et al. 1996, Vucetich et Waite 2003). Par exemple, lorsque l'aire de répartition devient de plus en plus fragmentée (ex : le long d'un gradient latitudinal ou altitudinal), les taux de croissance et d'établissement diminuent, alors que le taux de mortalité augmente. Les espèces sont non seulement contraintes par leur limites physiologiques absolues de survie mais aussi par la compétition avec les espèces environnantes pouvant mieux se développer
à
l'endroit donné (Thuiller et al. 2008).A ce niveau, les espèces peuvent répondre de plusieurs manières aux fluctuations climatiques : une modification de croissance et des capacités reproductives, un changement de densité des populations, une migration (MacDonald et al. 1998). Néanmoins, le climat n'est pas l'unique facteur qui intervient dans la dynamique de ces populations. L'interaction complexe avec les perturbations, les conditions édaphiques, les changements d'usage des terres, ou encore la biologie des espèces (ex : exigences écologiques, capacité de reproduction) sont des facteurs importants qui agissent au niveau de la structure et de la dynamique spatio-temporelle de ces populations. La limite de répartition d'une espèce n'est pas fixe du point de vue spatio-temporel (Holtmeier et Broll 2005, Messaoud et al. 2007a, Harsch et al. 2009, Chauchard et al. 2010).
En effet, la structure et la position actuelles ne sont pas en équilibre avec le climat actuel du fait de l'inertie de la réponse de la végétation face aux variations climatiques mais aussi de l'influence d'autres perturbations (ex : épidémies, feux). Par exemple, la limite nordique du cèdre blanc pourrait atteindre des latitudes plus élevés en l'absence de feux (Paul 2011). Le climat a souvent un effet régulateur sur les perturbations et, dans une moindre mesure, un effet direct sur la biologie des espèces (Paul 2011). Il existe en effet une forte inertie des arbres établis depuis des centaines d'années alors que les conditions étaient a priori plus favorables (Payette et Morneau 1993, Kullman 2000).
1.3 Réponse des populations marginales face aux changements environnementaux
Les projections de changement climatique impliquent une modification dans l'abondance et les aires de répartition des espèces (Payette 2007, Morin et al. 2008) : celles-ci seraient susceptibles de migrer vers de plus hautes altitudes ou latitudes (Lenoir et al. 2008). Au cours de l'Holocène, des restructurations dans la répartition des espèces se sont déjà produites (ex : Kullman 1997, Kullman 2000). Ces modifications sont particulièrement visibles en limite d'aire de répartition. Fortement sensibles à ce niveau, les populations répondent rapidement aux variations de l'environnement (Holtmeier et Broll 2005, Caccianiga et Payette 2006, Parmesan 2006).
Dans le cas de la forêt boréale du Québec, le changement climatique (ex hausse des températures et des précipitations) pourrait considérablement accroître les capacités reproductives des espèces, se traduisant à terme par une augmentation de leurs proportions à l'échelle
du paysage et une colonisation du territoire. Dans le futur, la dynamique (ex : potentiel reproducteur) et la structure (ex : composition spécifique) des populations marginales subiront inéluctablement de fortes modifications (Caccianiga et Payette 2006, Messaoud et al. 2007b).
Aussi, malgré un changement climatique planétaire, la dynamique des espèces diffère d'une région à l'autre (Dalen et Hofgaard 2005, Payette 2007). Par conséquent, la structure et le rythme des changements dépendent aussi des facteurs locaux et régionaux ainsi que des traits biologiques des différentes espèces (Danby et Hik 2007, Batllori et Gutierrez 2008).
A court terme, la réponse des populations végétales aux perturbations et aux changements environnementaux dépend en partie de l'histoire de vie de l'espèce. En effet, les processus adaptatifs se développent au cours des générations et la longueur du cycle de vie est un facteur important qui affecte le potentiel adaptatif d'une espèce (Rosenheim et Tabashnik 1991). Alors que le maintien et la persistance d'une population sont favorisés par la longévité des individus, c'est-à-dire un cycle de vie long (ex : herbacées pérennes, buissons, arbres), l'adaptation est plutôt favorisée par des taux élevés de reproduction, c'est-à-dire un temps de génération court et donc un renouvellement rapide des individus (Ghalambor et al. 2007, Thuiller et al. 2008). Ces derniers sont en effet plus aptes à répondre à une nouvelle pression sélective (Rosenheim et Tabashnik 1991). A long terme, les populations ne se maintiendront que si la rapidité d'adaptation au fil des générations correspond au moins à la rapidité des changements environnementaux (Burger et Lynch 1995).
Du fait de leur vulnérabilité, les populations marginales, du fait de leur position en limite d'aire de répartition, constituent de bons indicateurs des variations biotiques et abiotiques et sont souvent utilisées pour analyser les modifications de la répartition des espèces au cours du temps. Par exemple, une hausse (resp. baisse) des températures peut se traduire par une augmentation (resp. diminution) du taux de recrutement et une avancée (resp. retrait) de la limite de répartition (Payette et Lavoie 1994, Kullman 1997, Kjallgren et Kullman 1998, Camarero et Gutierrez 2004, Holtmeier et Broll 2005). C'est via le recrutement, phase critique dans le cycle de vie des espèces, que celles-ci répondent aux variations biotiques et abiotiques. Fortement dépendantes des variations climatiques lors de leur reproduction, les espèces connaissent fréquemment un échec de recrutement (Caspersen et Saprunoff 2005). Ainsi, à leur limite de répartition, la réponse des espèces face au réchauffement climatique, dépendrait plutôt du succès de régénération (sexuée et asexuée) que de la réponse physiologique des arbres matures (Lescop-Sinclair et Payette 1995, Holtmeier et al. 2003). Par exemple, la reproduction sexuée est rare au-delà de la limite de répartition d'une espèce et la limite géographique de la production de graines viables est souvent située plus loin au sud (Payette et al. 2001, Holtmeier et al. 2003). Plus particulièrement, la déficience des températures le long du gradient latitudinal est l'ultime cause affectant les processus biologiques des arbres. La régénération et la survie s'en trouvent directement et indirectement affectés (Holtmeier et Broll 2007).
Ainsi, la reproduction sexuée serait probablement le meilleur indicateur de la sensibilité des espèces au changement climatique dans le cas des populations marginales situées en limite d'aire de répartition. A ce niveau, ce processus peut même être considéré comme un facteur
limitant la régénération et l'expansion spatiale. Cependant, même si le changement climatique favorise la production de graines viables, cela n'aboutira pas forcément à un taux de régénération plus élevé et une meilleure survie des plantules au-delà de la limite de répartition. En effet, d'autres facteurs peuvent avoir un effet opposé. A cet égard, la variabilité interannuelle du climat joue un rôle important (Holtmeier et Broll 2005).
1.4 Facteurs limitant le succès de recrutement
En plus des conditions climatiques, de nombreux facteurs biologiques et écologiques peuvent limiter le recrutement d'une espèce (Cornett et al. 1997, Clark et al. 1998, Hanski 1998, Simard et al. 1998) :
l'abondance et la distribution des arbres semenciers, la production de graines fertiles,
la présence et la disponibilité d'un substrat favorable1 à la germination,
la capacité à disperser les graines sur ces sites potentiels (distance de dispersion).
1 Un substrat favorable est spécifique à chaque espèce et doit répondre aux exigences écologiques de cette dernière. Il est déterminé par des conditions abiotiques comme la disponibilité en nutriments et en eau mais aussi par les conditions microclimatiques comme la luminosité et la température du substrat (Kunstler et al. 2007).
1.5 Facteurs influençant la dynamique et la structure des populations marginales : le cas du cèdre blanc (Thuja occidentalis L.)
De la dispersion des graines à l'établissement des plantules, de nombreux facteurs déterminent le patron spatial de recrutement (Houle 1995). La distribution des plantules de conifères, et notamment celle du cèdre blanc, est souvent reliée à l'abondance et la distribution des arbres semenciers, des substrats et de la microtopographie (Cornett et al. 1997, Simard et al. 1998, Cremer et al. 2012). En revanche, de nombreuses études ont exploré l'importance de la disponibilité en substrats favorables exigés par les espèces de fin de succession pour leur germination (St Hilaire et Leopold 1995, Simard et al. 1998, Cornett et al. 2000, Cornett et al. 2001, Simard et al. 2003, Caspersen et Saprunoff 2005, Gengarelly et Lee 2005). D'autres ont insisté sur l'importance de la canopée dominante sur les processus de régénération et de succession (ex: Frelich et Reich 1995). Dans la plupart des écosystèmes forestiers, les sites favorables résultent de la combinaison unique entre la dominance de la ca nopée et les conditions des lits de germination (Cornett et al. 2001). Ces éléments sont synthétisés et schématisés dans la figure 1. Celle-ci montre l'ensemble des facteurs biologiques et écologiques susceptibles d'influencer la structure et la dynamique des populations marginales.
VÉGÉTATION • Composition spécifique • Structure spatiale des arbres semenciers • Stade de succession • Capacité compétitive P ERT URBATIONS NATURELLES ET ANTHROPIQUES CONDITIONS ÉDAPHIQUES • Substrat superfi ci e l • M ati è re s org ani que et minéra le RÉGÉNÉRATION • Mode de reproduction : sexuée /asexuée • Fréquence de production de graines • Abondance et viabilité des graines • Distance de dispersion • Survie et croissance des plantules • Exigences écologiques des espèces HISTOIRE DE LA VÉGÉTATION CONDITIONS STRUCTURE ET DYNAMIQUE SPATIO-TEMPORELLE DES POPULATIONS MARGINALES Figure 1: Fà cteur s in fluençant la structure et la dynamique spatio-temporelle de la régénérat ion. Figure librement inspir ée de Holtmeier et Broll (2007).
1. 5.1 Rôle important de la ca nopée
L'approvisionnent adéquat en graines, la présence d'un substrat favorable et, la qualité et la quantité de luminosité sont des attributs critiques influencés par les conditions de la ca nopée (Cornett et al. 2001). Les plantules de cèdre blanc sont généralement plus rares sous couvert décidu que sous couvert résineux (Kneeshaw et Bergeron 1996, Simard et al. 1998) et ce, même à proximité des arbres semenciers (Bergeron et Charron 1994). Dans ce cas, le facteur limitant la germination du cèdre sous une canopée de feuillus, en l'occurrence des bouleaux, demeure l'approvisionnement en graines, c'est-à-dire l'abondance de graines ou de semenciers (Cornett et al. 1997, Cornett et al. 2001) ; la distance de dispersion relativement faible entrave aussi sa colonisation (Kneeshaw et Bergeron 1996, Cornett et al. 1997).
1.5.2 Facteurs abiotiques : luminosité et humidité
Les plantules de conifères de fin de succession se développent généralement sur des substrats présentant une forte luminosité (Simard et al. 1998). Toujours dans le cas du cèdre blanc, malgré une meilleure disponibilité des lits de germination sous une canopée de cèdre, les taux de mortalité y sont généralement plus élevés par rapport à une canopée décidue (en l'occurrence des bouleaux) et ce, indépendamment du lit de germination. La mortalité des plantules de cèdre sous une canopée de cèdre est liée à la plus faible luminosité du fait de l'interception par le feuillage (Scott et Murphy 1987, Simard et al. 1998, Cornett et al. 2001).
1.5.3 Substrat favorable
à
la germination età
la croissance des plantules1.5.3.1 Germination
La germination du cèdre est généralement associée aux substrats caractérisés par une humidité abondante et composés de bois en décomposition (ex : souches, bois couchés) éventuellement recouvert de mousses. Mais sa germination peut également être bonne sur sol minéral (Simard et al. 1998, 2003). La disponibilité en eau joue un rôle plus important que le type de substrat, dans le développement et la survie du cèdre. Par exemple, en présence d'une litière, l'apport en eau doit être suffisant car celle-ci en absorbe une partie (Cornett et al. 2000).
Alors que la litière feuillue présente des effets inhibiteurs sur la régénération des conifères (Simard et al. 1998, Parent et al. 2006), le bois en décomposition, la matière organique et la mousse sont reconnus comme étant de bons lits de germination pour le cèdre blanc (Simard et al. 2003). En effet, les petites graines germent préférentiellement sur des substrats sans litière comme un sol nul ou du bois décomposé (Caspersen et Saprunoff 2005). D'une part, la litière feuillue serait une barrière
à
la germination en bloquant l'accèsà
l'humidité du sol (Place 1950, Cornett et al. 1998) ; d'autre part, les radicules sont incapables de pénétrer des couches épaisses de litière feuillue pour accéder au sol minéral (McGee 2001).Le bois mort décomposé est souvent indiqué comme le substrat le plus favorable pour la germination et l'établissement des conifères (ex : Motta et al. 2006) et notamment du cèdre (ex : Scott et Murphy 1987,
Cornett et al. 1997, Simard et al. 1998, Rooney et al. 2002). La rugosité de ce substrat permet de retenir les petites graines (Cornett et al. 1997) et surtout, il fournit d'excellentes conditions de germination pour les plantules de cèdre. Cela serait lié à une température plus élevée, une meilleure rétention de l'humidité et une faible épaisseur de litière, en comparaison à d'autres lits de germination (Cornett et al. 1997, Cornett et al. 2000). De manière générale, par rapport à d'autres substrats, le bois mort présente plusieurs caractéristiques favorables à l'émergence des plantules de conifère :
Température relativement élevée et réchauffement plus précoce (Nelson 1951),
Bonne rétention d'eau (Place 1950),
Bonne luminosité (Kuuluvainen et Juntunen 1998),
Présence de micro-organismes fixateurs d'azote (Sharp et Millbank 1973, Harvey et al. 1979),
Absence de litière (Cornett et al. 1997),
Abondance d'associations mycorhiziennes (Maser et Trappe 1984 ).
Cornett et al. (2001) ont montré que la présence de bois mort décomposé est très bénéfique pour la régénération du cèdre, quel que soit le type de canopée (cèdre ou feuillue). Cependant, le type de bois décomposé, c'est-à-dire le type d'espèce, a une influence sur la régénération du cèdre. Le bois de fin de succession (ex : cèdre) pourrait être meilleur que celui de début de succession comme les feuillus (Simard et al. 1998), peut-être en raison de la composition chimique des matériaux en décomposition et de la spéciation des métabolites secondaires qui en résulte.
Un fin tapis de matière organique, souvent présent sur le bois décomposé, a un effet positif sur l'établissement des conifères (St Hilaire et Leopold 1995, Simard et al. 1998). Quant aux bryophytes, elles forment un fin tapis qui facilite la pénétration des petites racines dans la couche d'humus humide. De plus, les fluctuations d'eau estivales sont atténuées par le contenu en eau au sein du substrat sous-jacent (bois mort notamment) (Nakamura 1992, Cornett et al. 1997). La présence de bryophytes permet aussi de conserver une température relativement plus élevée que le milieu environnant, ce qui stimule la croissance racinaire (Eckstein 2000).
1.5.3.2 Croissance et survie
Tout comme la germination, la croissance et la survie des jeunes plantules sont également dépendantes de la bonne qualité du substrat. Il arrive que celui-ci soit favorable lors de la germination mais au cours de leur croissance, les plantules peuvent exiger des conditions différentes. Par exemple, alors que le taux de survie du cèdre au cours de la première saison de croissance est plus élevé sur le bois en décomposition et le sol minéral que sur la litière (Simard et al. 2003), il diminue lorsque les plantules grandissent. Cela serait dû
à
la colonisation du bois par un fin tapis de mousses qui entrent en compétition pour les ressources (ex : Nakamura 1992). Aussi, au cours de la période hivernale, que ce soit dans les peuplements feuillus (ex : tremble) ou résineux (ex : cèdre), la litière a un effet négatif sur la survie des plantules. Celles-ci semblent mal adaptéesà
la chute de débris automnale (Metcalfe et Grubb 1997). De plus, la litière de cèdre est composée de petites branches et non d'aiguilles, pouvant affecter négativement la survie des jeunes plantules (Clark et Clark 1989). Ainsi, durant ses premières années de croissance,le cèdre demeure exigent et très sensible et sa survie reste sous la dépendance étroite du substrat et donc des conditions abiotiques environnantes.
1.6 Modèle biologique : le cèdre blanc (Thuja occidentalis)
Le cèdre blanc est un gymnosperme originaire du nord-est de l'Amérique du Nord, de la famille des Cupressaceae. Abondant dans le sud de la forêt boréale de l'est du Canada, le cèdre présente des populations plus discontinues en remontant vers le nord. Au-delà du 49ème parallèle, dans le domaine de la pessière à mousses dominée par l'épinette noire (Picea mariana Mill.) et le pin gris (Pinus banksiana Lamb.), il ne persiste que sous forme de populations marginales (Johnston 1990, Miller 1990) (Figure 2a). Reconnu comme une espèce calciphile (Blanchet 1982), le cèdre est cependant bien adapté
à
une large variété de sols organiques et minéraux présentant une légère acidité, avec des valeurs de pH allant de 5,5à
7,2 (USDA 2013). Il est souvent associé aux sols humides et riches en nutriments, et plus particulièrement aux sols organiques où le taux de décomposition est relativement rapide. Il est notamment présentà
proximité des cours d'eau, des lacs ou encore au sein des tourbièresà
sphaignes (Curtis 1946, Nelson 1951, Del Degan 1998, USDA 2013).a) 5o·o'N 48.0'N 46.0'N b) so·o·o 49•52'N 00 00 00 0 Lac Hébert 75·o·o 0 0 78.37'0 Lac Paré 0 0 0
Rivière Harricana 7o·o·o
•
0 0 0 0 65·o·o Présence Faible - Modérée - ElevéeSuperficie des sites (m') 0 0-50 0 50-100 0 100-200 0 200-400 0 400-3 000
•
> 3 000•
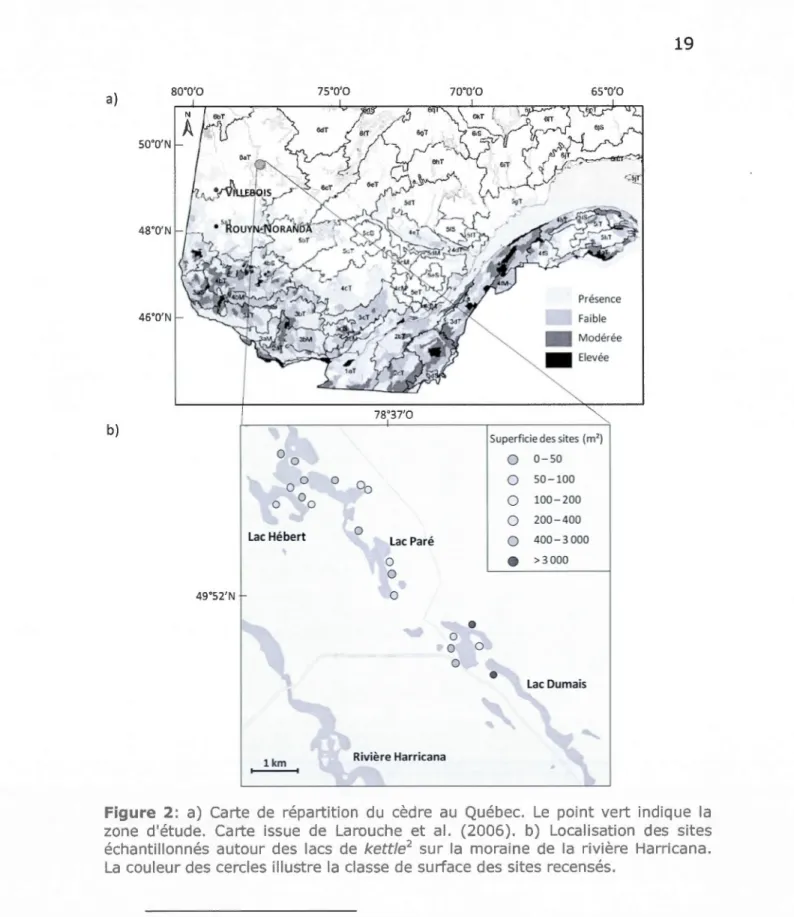
Lac Du maisFigure 2: a) Carte de répartition du cèdre au Québec Le point vert indique la zone d'étude. Carte issue de Larouche et al. (2006). b) Localisation des sites échantillonnés autour des lacs de kettle2 sur la moraine de la rivière Harricana. La couleur des cercles illustre la classe de surface des sites recensés.
2 Les kettles, ou dolines glaciaires, sont des dépressions d'origine glaciaire, souvent issus de culot de glace morte emprisonnée dans du till ou de la moraine de retrait. Les lacs de kettle sont de forme plus ou moins circulaire et parfois remplis d'eau.
Rarement en peuplements purs, le cèdre se rencontre fréquemment avec d'autres espèces. A la limite nordique de son aire de répartition, il est souvent associé
à
l'épinette blanche (Picea g!auca (Moench) Voss), l'épinette noire (Picea mariana Mill.), le sapin baumier (Abies balsamea L.) et le peuplier faux-tremble (Populus tremuloides Michx) (Miller 1990, USDA 2013). Le cèdre est une espèce de fin de succession caractérisée par une croissance lente, une grande longévité et une bonne toléranceà
l'ombre (Bergeron 2000, USDA 2013). A l'état de plantules, un ombrage partiel est nécessaire pour réduire les pertes causées par la sécheresse et la compétition des herbacées environnantes, notamment lors de périodes chaudes et sèches (Johnston 1990). A la différence d'autres conifères de la forêt boréale canadienne comme le pin gris (Pinus banksiana Lamb.) ou l'épinette noire, il ne possède pas de cônes sérotineux et n'est donc pas adapté aux feux. Aussi, ses racines superficielles sont facilement endommagées par les feux peu intenses et de surface (USDA 2013). Sa capacité de régénérationà
la suite d'un feu est donc limitée et dépend essentiellement de la présence d'arbres matures survivants (Asselin et al. 2001) et de la multiplication végétative par marcottage. Ce mécanisme est relativement fréquentà
la limite nordique de son aire de répartition (Fayle et Scott 1995, Krause 2006). En l'absence de feu, le cèdre est une espèce stable du fait de sa longévité. Il est peu sensible aux maladies, aux champignons et aux insectes. Cependant, la sécheresse et la rudesse de l'hiver (ex : faibles températures, longueur de l'hiver) peuventprovoquer un brunissement du feuillage, conduisant
à
la sénescence des individus (Curtis 1946, USDA 2013). L'annexe A répertorie les caractéristiques biologiques et écologiques du cèdre.1.6.1 Mode de reproduction du cèdre
Outre la reproduction sexuée, le cèdre a la capacité de s'établir par multiplication végétative, ce qui est relativement fréquent dans les milieux humides, pauvres en nutriments et présentant une abondance de mousses (Curtis 1946, Bergeron 2000). Dans certaines zones du Maine, au sein de milieux très humides et pauvres en nutriments, près de la moitié des cèdres sont d'origine végétative (Curtis 1946, Johnston 1990). Le marcottage est particulièrement répandu
à
la limite nordique de son aire de répartition (Fayle et Scott 1995, Krause 2006, USDA 2013). Dans ces milieux, la prévalence de marcottes sur les plants d'origine sexuée s'explique par une meilleure toléranceà
l'ombre et un système racinaire plus étendu et préétabli (Curtis 1946).En forêt boréale, le taux d'individus issus de marcottage est estimé :
entre 57 et 97 % selon la zone de répartition (continue, discontinue ou marginale) (Paul et al. 2014 ),
à
60 % au sein de populations situées dans les plaines humides du Michigan (Nelson 1951, USDA 2013).De manière générale, les taux de reproduction sexuée et asexuée sont fortement variables entre les sites mais aussi au sein même de l'espèce (Prati et Schmid 2000). Xu et al. (2013) ont observé une augmentation des taux de marcottage (variant de 23
à
31 %) avec le temps écoulé depuis le dernier feu.1.6.2 Le cèdre à sa limite de répartition
La fragmentation actuelle des populations de cèdre résulterait des changements passés de climat et de régime des feux (Liu 1990, Carcaillet et al. 2001). Les variations d'abondance du cèdre au cours des derniers millénaires coïncideraient avec une période d'accroissement suivi d'une diminution de la fréquence des feux (Ali et al. 2009) ou de leurs sévérités (Hely et al. 2010). D'un point de vue spatial, le régime des feux de la pessière (partie nord de l'aire de répartition du cèdre), caractérisé par des feux plus grands et plus sévères que dans la forêt mixte, favorise plutôt les espèces possédant une banque de graines aériennes et des cônes sérotineux comme l'épinette noire et le pin gris (Sirois 1997, Bergeron et al. 2004). Aussi, les peuplement de cèdre sont souvent associés aux lacs (Figure 2 b), probablement en raison de leur rôle naturel de pare-feux (Denneler et al. 2008) tel qu'il a été montré plus au nord pour le sapin baumier (Sirois 1997). Sa capacité
à
résister aux dommages mécaniques causés par la glace peut également lui conférer un avantage, notamment en termes de maintien et de colonisation,à
la différence d'autres espèces plus sensibles (Bergeron et al. 2004, Denneler et al. 2008). En pessière, les populations marginales représentent aujourd'hui des refuges biologiques potentiels. En effet, elles se comportent comme des populations sources susceptibles de s'étendre dans le futur, notamment sous l'effet de conditions climatiques propicesà
la régénération del'espèce telle une augmentation des températures ou un allongement de la durée de la saison de croissance. Les modifications que pourraient subir ces populations sont
à
la fois spatiales (ex : abondance d'individus, tailledes populations) et temporelles (ex : taux annuel de régénération).
-1.6.3 Enjeux de conservation du cèdre blanc aspects sociaux et économiques
Du fait de sa diminution sur l'ensemble de son aire de répartition, le cèdre revêt aujourd'hui de nombreux enjeux pour la conservation de la biodiversité et la durabilité de son exploitation. Sa raréfaction est devenue un sujet préoccupant dans plusieurs régions du Québec (ex : Bas-Saint-Laurent, Capitale-Nationale, Outaouais, Abitibi-Témiscamingue, Nord-du-Québec). Dans les régions du sud, l'exploitation inadaptée du fait d'un manque de connaissances ou encore l'accroissement et le déplacement vers le nord des populations de cervidés pourraient être
à
l'origine de sa diminution. De ce fait, le maintien du cèdre constitue un élément reconnu comme prioritaire par le Ministère des Ressources Naturelles (Larouche 2006).Du point de vue écologique, le cèdre fournit un habitat de choix pour de nombreuses espèces, en tant qu'abri hivernal pour le cerf de Virginie, l'orignal ou encore le lièvre d'Amérique et demeure un habitat de reproduction pour plus d'une vingtaine d'espèces d'oiseaux (Boulfroy et al. 2012). Du point de vue économique, le cèdre est une essence très recherchée et présente une forte valeur industrielle. Ses propriétés isolantes, sa durabilité, sa légèreté et sa résistance au pourrissement en font une espèce utilisée dans de nombreuses applications. L'utilisation commerciale principale est la confection de clôtures et poteaux rustiques. Il est souvent utilisé dans la construction en tant que bois ronds, bois d'œuvre et bardeaux. Une moindre quantité est utilisée pour la fabrication de lambris, d'isolant, de tonneaux, etc. (Boulfroy et al. 2012, USDA 2013).
1. 7 Objectifs et hypothèses
1. 7.1 Objectifs
Dans le cadre de l'évaluation des effets des changements climatiques sur la limite d'aire de distribution des espèces, la connaissance du patron spatio-temporel de recrutement et de la niche écologique des espèces composant ces écosystèmes est indispensable (Guisan et Thuiller 2007, Holtmeier et Broll 2007). Par exemple, le modèle PHENOFIT appliqué
à
deux espèces d'Amérique du Nord (érable à sucre (Acer saccharum Marsh.) et peuplier faux-tremble (Populus tremuloides Michx.)) montre que la répartition d'une espèce peut être modélisée à partir de processus biologiques tels la survie et le succès reproducteur et plus spécifiquement de processus phénologiques. La correspondance existant entre la phénologie d'une espèce et les variations climatiques saisonnières serait un déterminant majeur de sa répartition (Chuine et Beaubien 2001). Dans le cas des populations marginales de cèdre, la prise en compte du succès reproducteur permet d'avoir une idée sur leur expansion potentielle.À ce jour, peu de travaux se sont penchés sur l'étude du fonctionnement et de la dynamique des espèces situées dans les zones de
transition forestière, telle la zone de transition boréale entre la forêt mixte et la forêt coniférienne. Aussi, les études sur la limite de répartition d'une espèce sont souvent menées à grande échelle spatiale (ex : Kullman 1997, Camarero et Gutierrez 2004, Batllori et Gutierrez 2008). Or, le niveau local (ex : placette) est le plus pertinent pour comprendre les processus de recrutement (Veblen 1992). A ce niveau, les variables écologiques telles que la microtopographie, le microclimat ou le substrat influencent directement le succès reproducteur des espèces.
Plus spécifiquement, dans le cas du cèdre blanc, la reproduction sexuée est effective dans la partie nordique de son aire de répartition. Bien que la production de graines viables, les taux de germination et de survie soient plus faibles que dans la zone continue (Paul et al. 2014 ), la physiologie de l'espèce ne semble pas être le facteur limitant la régénération ni l'expansion des populations marginales.
C'est dans ce contexte que la présente étude s'intéresse à la dynamique spatio-temporelle de recrutement des populations marginales septentrionales de cèdre blanc, en tenant compte des variables édaphiques et climatiques locales comme variables explicatives. L'étude portera sur l'aire de répartition fragmentée du cèdre située dans la pessière noire de l'ouest du Québec.
Il s'agit d'évaluer :
1) la capacité de maintien des populations en décrivant la dynamique récente de régénération en relation avec les conditions climatiques passées ;
2) la capacité d'expansion spatiale locale des populations en lien avec les conditions édaphiques (substrat superficiel et sol sous-jacent).
1. 7. 2 Hypothèses
Au sein des populations marginales, le recrutement et la mortalité
des individus peuvent être étroitement reliés aux variations climatiques.
de recrutement et les variations saisonnières du climat, où les périodes de fort recrutement correspondent aux conditions climatiques favorables (Payette et Filion 1985, Agren et Zackrisson 1990). Dans le cas des populations marginales de cèdre, la structure d'âge reflèterait l'influence des changements climatiques passés. Les variations de températures et de précipitations joueraient un rôle clé sur le succès reproducteur (Agren et Zackrisson 1990, Chuine et Beaubien 2001).
Hypothèse 1 : La structure démographique s'explique par les variations temporelles des températures et des précipitations.
Si la structure temporelle du recrutement est sous la dépendance des variations climatiques, la structure spatiale, en l'occurrence l'expansion des populations marginales, serait déterminée par des facteurs édaphiques. La disponibilité en substrat favorable
à
la germination serait responsable du succès ou de l'échec de recrutement d'origine sexuée.Hypothèse 2 : Le déficit en substrat favorable limite l'établissement des plantules.
Enfin, de nombreuses études ont montré que la distance de dispersion des graines est souvent le facteur qui limite le plus l'établissement d'une espèce (Turner et al. 2003, Dullinger et al. 2005, Kunstler et al. 2007). Cette hypothèse sera testée en mesurant la distance de recrutement des plantules par rapport aux cèdres semenciers.
Hypothèse 3 : La distance de dispersion des graines limite l'expansion des populations.
MATÉRIELS ET MÉTHODES
2.1 Zone d'étude
La zone d'étude est située dans le nord du Québec, au sein du domaine bioclimatique de la forêt boréale dite de la pessière
à
mousses, aux environs du 49e parallèle nord. Les sites se situentà
proximité des lacs disposés le long de la moraine Harricana (Figure 2a). Ce territoire appartientà
la région écologique 6a définie par le Ministère des Ressources Naturelles (Plaine du Lac Matagami).Le couvert forestier de fin de succession est dominé par l'épinette noire, associée
à
des espèces compagnes comme le sapin baumier. En début de succession, le pin gris, le bouleauà
papier (Betu!a papyrifera Marsh.) et le peuplier faux-tremble sont les espèces dominantes au coursdes premières décennies. Des éricacées (ex Rhododendron
groenlandicum Oeder) et des sphaignes caractérisent le sous-bois. La dynamique naturelle de ces peuplements est davantage influencée par les feux que par d'autres perturbations de la canopée comme les chablis ou les épidémies d'insectes. La nature des dépôts est organique ou minérale de texture fine ou grossière. Le climat est de type subpolaire continental, caractérisé par une courte saison de croissance avec seulement 2075 degrés-jour de croissance (DJC)
à
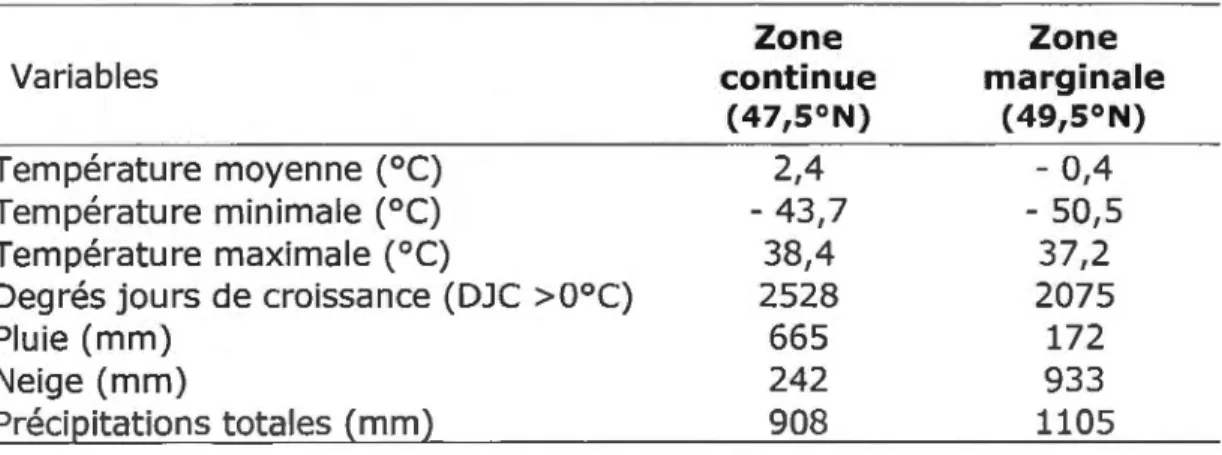
la différence de la zone de répartition continueà
200 km au sud qui présente 2528 DJC. La température annuelle moyenne est de -0,35°( (Tableau 1) et figure parmi les plusbasses du Québec méridional (Biouin et Berger 2005). Les précipitations neigeuses sont près de quatre fois plus élevées en zone marginale qu'en zone continue (Tableau 1).
Tableau 1: Moyennes climatiques annuelles des zones de répartition continue (47,5°N) et marginale (49,5°N) du cèdre au cours des 30 dernières années (Environnement Canada).
Variables
Température moyenne (0
C) Température minimale (°C) Température maximale (0C)
Degrés jours de croissance (DJC >0°C) Pluie (mm)
Neige (mm)
Précipitations totales (mm)
2.2 Echantillonnage
2.2.1 Sélection des sites
Zone continue (47,5°N) 2,4 - 43,7 38,4 2528 665 242 908 Zone marginale ( 49,5°N) - 0,4 - 50,5 37,2 2075 172 933 1105
La recherche des sites comportant des cèdres a été réalisée
à
partir des lacs accessibles en canot, soit un total de six lacs. Tous les cèdres situés en bordure de lacs ont été localisésà
l'aide d'un GPS. Parmi eux, vingt sites ont été sélectionnés sur la base des deux critères suivants :1) présence d'au moins deux cèdres matures déterminés par la présence de cônes,
2) présence de régénération : cèdres au DHP3 inférieur
à
5 cm.La superficie des sites était de taille variable, s'étendant de 6
à
14 000 m2 (Figure 2b).2.2.2 Structure spatiale
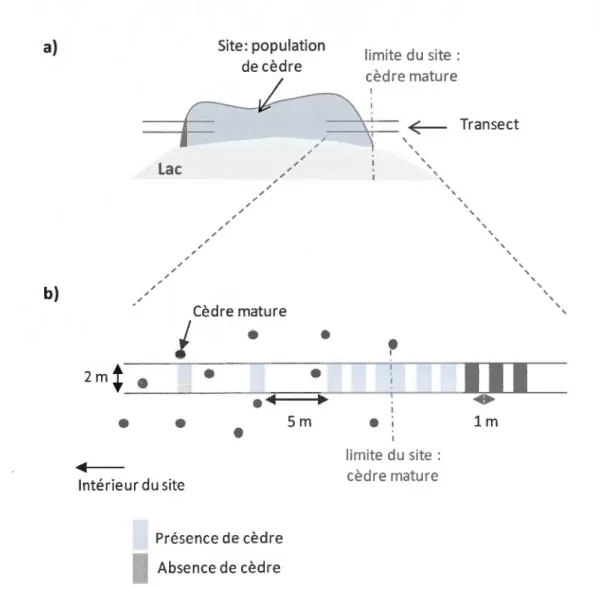
Les bordures de chacun des sites ont été définies par le cèdre mature le plus excentré et présentant des cônes et ce, de part et d'autre du site (Figure 3a). A partir de ce cèdre, un transect de 2 mètres de large et parallèle au lac a été mis en place. Sur ces transects, la régénération a été quantifiée sur des quadrats de 2 m2 (2 m x 1 m) où tous les individus (cèdres, sapins, épinettes noires) ont été comptés et assignés à l'une des classes suivantes combinant hauteur et âge :
0-5 cm (semis de l'année) 0-5 cm (semis de 1 an)
0-5 cm (semis de 2 ans et plus) 5-10 cm 10-25 cm 25-50 cm 50-75 cm 75-100 cm 100-150 cm 150 cm et DHP < 5 cm
Vers l'extérieur du site, les quadrats étaient répartis tous les 2 mètres jusqu'à l'obtention de trois quadrats successifs en l'absence de cèdres. Vers l'intérieur, trois quadrats similaires ont été délimités suivis de 2 quadrats espacés de 5 mètres (Figure 3b). Dans chaque quadrat, le substrat majoritaire couvrant le sol minéral a été défini et attribué à l'une des classes suivantes :
matière organique mousse
bois mort plus ou moins décomposé bois mort recouvert ou non de mousse
L'état de décomposition du bois mort a été déterminé à partir de la clé de description de Hunter (1990).
a) b)
2m+
•
...
/ / /•
Lac / / / /•
/ / / / Site: population de cèdre Cèdre mature•
•
•
.
...
•
...
Sm•
Intérieur du site Présence de cèdre1
Absence de cèdre limite du site : cèdre mature '•
1•
1 ' ' ' ' ' ' limite du site: cèdre mature ' ' ' ' ' ' ' ' ' lm ' ' ' ' ' ' ' ' ' ' 'Figure 3: a) Localisation des transects en bordure de site. b) Disposition des quadrats sur le transect.
Afin d'évaluer le lien entre la présence de plantules d'origine sexuée
(semis) et le type de substrat, 120 semis de cèdre de taille inférieure
à
5cm et 120 points en l'absence de semis ont été sélectionnés de manière
aléatoire
à
l'extérieur des sites. Pour chaque point et semis, le substrat aété caractérisé. En outre, les distances aux trois arbres semenciers les plus proches, Dl, D2 et D3 par ordre croissant, ont été mesurées afin de
déterminer la variable, substrat ou distance, expliquant le mieux
Site: population de cèdre Transe ct
8
Cèdre semencier•
Détermination•
Relevé d'un semis de cèdre }
Relevé d'un point aléatoire en du substrat
l'absence de cèdre
Di: distances mesurées entre un Relevé et les 3 cèdres semenciers les plus proches (i = {1; 2; 3})
Figure 4: Plan d'échantillonnage.
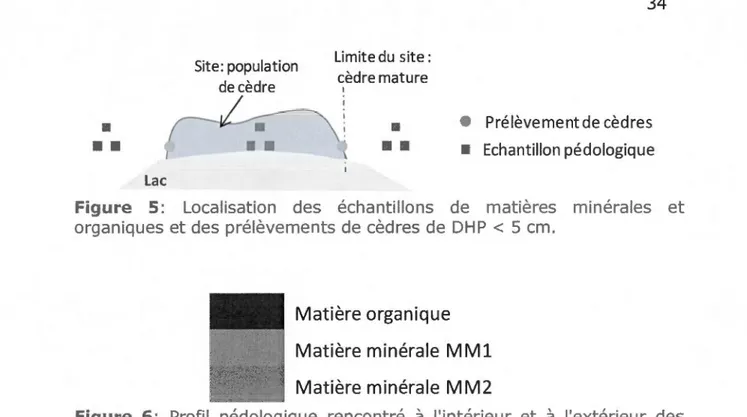
Afin de comparer les caractéristiques pédologiques, des échantillons de matières minérale et organique ont été prélevés de la manière suivante : trois échantillons à l'intérieur des sites et trois de part et d'autre des sites (Figure 5). Lorsque deux couches de matière minérale de couleurs distinctes étaient présentes, elles étaient traitées séparément (MMl et MM2) (Figure 6). Pour chaque échantillon, l'épaisseur de la couche organique a été mesurée. Les taux de sables, de limons et d'argiles (granulométrie) ont été évalués sur les échantillons de matière minérale (protocole en annexe C). Les analyses biochimiques, réalisées au Centre de Foresterie des Laurentides du Service Canadien des Forêts, ont permis de déterminer le pH, la capacité d'échange cationique (CEC) et les quantités de cations disponibles (protocoles en annexes D et E). Le ratio carbone/azote (C/N) a également été calculé (protocole en annexe
F). Un faible ratio indique une richesse en nutriments azotés et un taux élevé de minéralisation (Campbell 1978), témoignant une bonne activité microbienne.
•
••
lac Site: population de cèdre Limite du site: cèdre mature 1 1 1•
•
•
• • EchantPrélèvement de cèdres illon pédologiqueFigure 5: Localisation des échantillons de matières minérales et organiques et des prélèvements de cèdres de DHP < 5 cm.
Matière organique Matière minérale MMl Matière minérale MM2
Figure 6: Profil pédologique rencontré
à
l'intérieur età
l'extérieur des sites et distinction des 3 trois couches échantillonnées. MMl et MM2 étant les couches de matière minérale supérieure et inférieure respectivement.2.2.3 Structure d'âge
L'âge minimal des cèdres de chaque site a été déterminé en dénombrant le nombre de cernes annuels de croissance
à
l'aide de carottes de bois (biopsie) prélevéesà
la base du tronc, sur les 2 ou 3 plus gros cèdresà
hauteur de poitrine (DHP), soit un total de 53 individus. Cinquante épinettes noires et 54 sapins ont également été carottés etdatés au sein de chaque site contenant des cèdres. Les carottes ont été
polies