REPUBLIQUE ALGERIENNE DEMOCRATIQUE ET POPULAIRE MINISTERE DE L’ENSEIGNEMENT SUPERIEUR ET DE LA RECHERCHE
SCIENTIFIQUE
UNIVERSITE AKLI MOHAND OULHADJ-BOUIRA
Faculté des Sciences et des Sciences Appliquées Département de Génie des Procédés
Mémoire de fin d’étude
Présenté par :DAHMANI Khalida ZADI Khadra
En vue de l’obtention du diplôme de
Master
en : Filière : Génie des ProcédésOption : Génie Chimique
Thème :
Synthèse, caractérisation et modification du chitosane. Application dans
l’élimination du bleu de méthylène par adsorption.
Soutenu le 07/12/2019 devant le jury composé de :
Pr LOUNICI Hakim M.C.A. Université de Bouira président Mme BELALIA Fatiha M.C.B. Université de Bouira Examinatrice Mr AOUDJIT Farid M.C.B. Université de Bouira Examinateur Mme MERAKCHI Akila M.C.B. Université de Bouira Promotrice
REMERCIEMENT
Après avoir rendu grâce à Dieu le tout Puissant et le Miséricordieux nous tenons à remercier vivement tous ceux qui, de près ou de loin ont participé à ce travail. Il s’agit plus particulièrement de :
Notre promotrice Madame MERAKCHI Akila que nous exprimons notre profonde gratitude pour son suivi et pour son énorme soutien, qu’elle n’a cessé de nous prodiguer tout au long de la période du projet.
Monsieur KENNOUCHE Salim et Monsieur MOUSSI Yacine
Madame HADIOUCHE Dalila, Madame ZIANI Salima et Monsieur HADJENE Tahar. Monsieur BESTANI Ammar, Monsieur SPERGOUD Kamel et Mr HAOUASSAINE Hamza. Que nous ne remercions jamais assez, vous serez toujours en mémoire, un symbole de sagesse
et de bravoure.
On tient à remercier également Monsieur LOUNICI Hakim ; pour le temps qu’il a consacré et pour les précieuses informations qu’il nous a prodigué avec intérêt et compréhension.
On adresse aussi nos vifs remerciements aux membres des jurys Mr AOUDJIT Farid et Mme BELALIA Fatiha pour avoir bien voulu examiner et juger ce travail.
La partie pratique a été réalisée au niveau du laboratoire N°2 de Département SM dirigé par Madame HAMANI Sihem qui trouve ici nos vifs remerciements et reconnaissance ; de nous avoir donné les moyens nécessaires pour aboutir au terme de notre étude. Nous la remercions aussi pour son caractère humain et ses précieux conseils.
Un grand amour et respect est dédié aux ingénieurs de labo Madame MAAMAR Naima et KERFOUF Naima.
Tout le corps professionnel des trois pyramides (ST, IT et SNV) géré par nos ingénieures de labo, les plus serviables et sympa qui nous ont fait bénéficier d’une formation de très haut niveau et très adaptée aux réalités de la chimie, et à toutes les ingénieures de l’hygiène.
Nous ne laisserons pas cette occasion passer, sans remercier tous nos enseignants de primaire, C.E.M, Lycée, INIM et INH(Boumerdes) et nos enseignants en GP-UAMOB, que Dieu protège leurs familles.
Merci à toute personne qui a participé, de près ou de loin, à réaliser ce travail.
Dédicaces
Au Nom de Dieu Clément est Miséricordieux
Je dédie ce modeste travail
A mes très chers parents qui m’ont guidé durant les moments les plus
pénibles de ce long chemin,
Mon père Abdelkader qui a sacrifié toute sa vie afin de me voir devenir ce
que je suis, et ma mère Hadda qui a été à mes côtés
et ma soutenu durant toute ma vie,
merci mes parents.
Mes frères : Hakim, Amine et leurs femmes,
Mes sœurs : Hassiba, Faten,
Mon beau frère : Abboud Meziane,
À toute ma famille,
A toutes mes amies adorables
A mon binôme Dahmani Khalida, qui a partagé avec moi les bons
moments de ce travail.
Je tiens à remercier Madame Merakchi Akila de sa disponibilité, ses
conseils et sa passion.
Mes camarades de promotion Génie des Procédés.
Enfin à tous ceux que j’aime et qui m’aiment.
Dédicaces
Mon soleil
Ma lune
Mes cinq planètes
Mes étoiles
Mes anges gardiens
A partir de ce trésor,
J’ai été proche de recréer l’Univers entier,
Qui contient tout !
.
SOMMAIRE
Liste des figures Liste des tableaux Liste des abréviations
Introduction générale ………... 01
CHAPITRE I : Généralités sur le chitosane I.1. Historique ………..……….………..………… 03
I.2. Source de la chitine et du chitosane ………...………... 04
I.3. Structure du chitosane ………...………... 04
I.4. Préparation du chitosane à partir de la chitine ………..…...……….…… 05
I.4.1. Extraction de la chitine ………..…… 05
I.4.2. Production de chitosane ……….……… 06
I.5. Propriétés du chitosane ………...………. 08
I.5.1. Degré de Désacétylation (DD) ………...…… 08
I.5.2. Cristallinité ……… 08
I.5.3. Solubilité ………...………. 08
I.5.4. Polyélectrolytes en milieu acide ………...……… 08
I.5.5.Viscosité ……… 09
I.5.6. Autres propriétés physico-chimiques ……….……..…………..… 09
I.5.7. Propriétés biologiques ………... 10
I.6. Modification du chitosane ……….………...……… 10
I.6.1. Modifications physiques ………..………….. 10
I.6.2. Modifications chimiques ………...………... 11
I.7. Principales applications du chitosane ………..…… 11
CHAPITRE II : Phénomène d’adsorption
II.1. Définition ………..……….………..…… 14
II.2.Types d’adsorption ………...………..…….. 14
II.2.1. Adsorption chimique (ou chimisorption) …….……… 14
II.2.2. Adsorption physique (ou physisorption) ………...……….………….. 14
II.3. Facteurs influençant l’adsorption ……...……….…... 15
II.3.1. Conditions opératoires ………..………... 16
II.3.1.1.Température ……….………16
II.3.1.2. pH de la solution ………..………….. 16
II.3.1.3. Concentration des substances à adsorber …...……….. 16
II.3.1.4. Temps de contact ………..……… 16
II.3.1.5. Présence d’espèces compétitives ……….……….. 16
II.3.2. Nature de l’adsorbât ………. 16
II.4. Mécanisme d'adsorption ……….………. 17
II.5. Modélisation des cinétiques d’adsorption ……...………... 18
II.5.1. Modèle de pseudo-premier ordre ……….……… 18
II.5.2. Modèle de pseudo-second ordre ……….………….……… 19
II.5.3. Modèle de Diffusion intra-particulaire ………. 20
II.6. Matériaux adsorbants ……….……….………... 20
II.6.1. Charbon actif ……….….……….. 20
II.6.2. Autres adsorbants ……….………..……….. 20
II.6.2.1. Zéolithes ……… 20
II.6.2.2. Adsorbants minéraux ………...………. 21
II.6.2.3. Adsorbants organiques ………. 21
CHAPITRE III : Matériel et méthodes III.1. Matériel……...……….……….……..……… 22
III.1.1. Produits chimiques ……….……….……… 22
III.1.2. Verrerie de laboratoire ……….………... 22
III.1.3. Appareillage ……… 22
III.2. Méthodes……….……….…….. 23
III.2.1.1. Procédé d’extraction de la chitine à partir des carapaces de crevettes ………..…... 23
III.2.1.2. Synthèse du chitosane par la désacétylation de la chitine ……….……...… 26
III.2.1.3. Caractérisation du chitosane synthétisé ……….……….. 27
III.2.2. Modification du chitosane et élaboration des billes composites (chitosane/épluchures de pomme de terre) ………...……….…………...…….. 29
III.2.2.1. Etapes d’élaboration des billes composites (chitosane/EPT) ……...………..…….. 29
III.2.2.2. Caractérisation des billes du chitosane ……...………. 31
III.2.3. Etude de l’adsorption du bleu de méthylène en système batch par les billes composites (chitosane/EPT) ………...…… 34
III.2.3.1. Caractéristiques du colorant étudié (BM) ………..………….. 34
III.2.3.2. Préparation de l’adsorbat «bleu de méthylène » ...……….………..…… 35
III.2.3.3. Procédure expérimentale du processus d’adsorption ……….….. 36
III.2.3.3.1. Etude paramétrique ………..………. 37
III.2.3.3.2. Modélisation de la cinétique d’adsorption ……… 39
CHAPITRE IV : Résultats et discussions IV.1. Synthèse et caractérisation du chitosane………...………...40
IV.1.1. Extraction de la chitine et sa transformation par voie chimique en chitosane………..40
IV.1.2. Test de solubilité………...41
IV.1.3. Détermination du DDA du chitosane par dosage conductimétrique………42
IV.1.4. Caractérisation par la spectroscopie IRTF………43
IV.2. Elaboration et caractérisation des billes composites (chitosane/EPT)……….44
IV.2.1. Formation et réticulation des billes composite (chitosane / EPT) …...………44
IV.2.2. Caractérisation des billes composites (chitosane/EPT)………46
IV.2.2.1.Test de solubilité……….46
IV.2.2.2.Taux d’humidité des billes………….……….47
IV.2.2.3. Densité des billes………...47
IV.2.2.4. Diamètre moyen des billes………47
IV.2.2.5. Point de charge nulle des billes………...………...48
IV.2.2.6. Caractérisation des billes par IRTF………...49
IV.3. Adsorption du bleu de méthylène par les billes composites (chitosane/EPT)…….……51
IV.3.1. Courbe d’étalonnage du bleu de méthylène………..51
IV.3.2. Etude paramétrique………...51
Liste des figures
Figure I.1: Structure chimique du chitosane ..………..….5
Figure I.2 : Structure chimique de la chitine et du chitosane. R = H ou COCH3 ……….……5
Figure I.3: Méthode de production de la chitine et du chitosane ………..7
Figure I.4: Etat d’ionisation du chitosane. ………9
Figure I.5 : Différentes formes du chitosane ………. 11
Figure II.1: Schéma de l’adsorption physique ………...15
Figure II.2: Mécanisme de diffusion de l’adsorbat vers l’adsorbant .……….17
Figure III.1: Prétraitement des carapaces de crevettes .………...24
Figure III.2: Déminéralisation des carapaces de crevettes par HCl 2N ..……..…..…..…...25
Figure III.3: Déprotéinisation des carapaces de crevette par NaOH 1N …….…………..….25
Figure III.4: Blanchiment des carapaces de crevette par l’eau oxygénée ...26
Figure III.5: Désacétylation de la chitine et obtention du chitosane .….………... 26
Figure III.6 : Dosage conductimétrique de chitosane .………28
Figure III.7: Préparation de la poudre des épulchures de pomme de terre. Epluchures de pomme de terre : (a) : à l’état brut, (b) : séchées, (c) : broyées .……….……...29
Figure III.8 : Gel du chitosane. ……….….…...30
Figure III.9: Préparation du mélange : gel du chitosane/épluchures de pomme de terre ...29
Figure III.10: Formation des billes à base du chitosane/épulchures de pomme de terre ...30
Figure III.11: Méthode de détermination de la densité des billes par gravimétrie…………..32
Figure III.12: Mesure du diamètre des bille à l’aide d’un pied à coulisse .………...33
Figure III.13: Structure chimique du bleu de méthylène .…………...…………...………... 34
Figure IV. 1 : Réaction de désacétylation de la chitine, obtention du chitosane……….40
Figure IV.2 : Dosage conductimétrique basique du chitosane………...……….43
Figure IV.3 : Spectre IRTF du chitosane……….43
Figure IV.4 : Réticulation du chitosane par l’épichlorohydrine………..45
Figure IV.5 : Photographie numérique d’une bille composite (chitosane/EPT) réticulée par l’épichlorohydrine……….46
Figure IV.6 : Histogrammes de taille pour des billes composite (chitosane/EPT) modélisés
par une gaussienne (lignes continues)………...48
Figure IV.7 : Point de charge nulle des billes composites (chitosane/EPT)………48
Figure IV.8 : Spectre IRTF des épluchures de la pomme de terre………...49
Figure IV.9 : Spectre IRTF des billes composites (chitosane/EPT)………50
Figure IV.10 : Courbe d’étalonnage du BM………51
Figure IV.11 : Effet du temps de contact et de la concentration initiale sur l’adsorption du BM par les billes du chitosane : Evolution des rendements d’élimination ; (a) : 10 mg/L, (b) : 40 mg/L, (c) : 70 mg/L……….52
Figure IV.12: Effet du temps de contact et de la concentration initiale sur l’adsorption du BM par les billes composites (chitosane/EPT) : Evolution de la capacité d’adsorption…………..53
Figure IV.13 : Influence de la masse des billes composites (chitosane/EPT) sur l’adsorption du BM………...54
Figure IV.14 : Effet du pH de la solution sur l’adsorption du BM………..55
Figure IV.15 : Evolution de la charge des billes composites (chitosane/EPT) en fonction du pH………..55
Figure IV.16 : Effet de la vitesse d’agitation su l’adsorption du VM………..56
Figure IV.17 : Représentation du modèle cinétique (a) premier ordre, (b) pseudo-deuxième ordre : Pour l’adsorption du bleu de méthylène par les billes composites (chitosane/EPT)……….57
Liste des tableaux
Tableau I.1: Principales applications du chitosane ………..……..12
Tableau II.1: Principales différences entre l’adsorption physique et l’adsorption chimique..15
Tableau III.1: Caractéristiques physico-chimiques du bleu de méthylène .…….…... 35
Tableau IV.1: Rendements des différentes étapes d’extraction et de transformation de la chitine en chitosane………...41 Tableau IV. 2 : Test de solubilité du chitosane………...41 Tableau IV.3: Principales bandes d’absorption IR du chitosane synthétisé et leurs groupements attribués………...44 Tableau IV.4 : Tests de solubilité des billes à base du chitosane………46 Tableau IV.5 : Valeurs des taux d’humidité obtenues………...……….47 Tableau IV.6: Paramètres cinétiques de l’adsorption du BM par les billes composites du chitosane pour les modèles pseudo-premier et pseudo-deuxième ordre………...58
Liste des abréviations
BM : Bleu de méthylène DA : Degré d’acétylation DD : Degré de désacétylation
EPT : Epluchures de Pommes de Terre IRTF : Infra rouge à Transformée de Fourrier MES : Matière En Suspension
UV : Ultravisible Aq : Aqueuse
1
L’eau est le point central de l’inquiétude des opinions publiques et des dirigeants, mais à long terme il est clair pour tous que tout rejet polluant, en particulier peu biodégradable ou toxique, est une menace et/ou une complication pour l’eau. Il convient donc de réduire au maximum les émissions polluantes au niveau des effluents.
La pollution des eaux par les matières organiques constitue une source de dégradation de l’environnement et suscite à l’heure actuelle un intérêt particulier à l’échelle internationale. L’importance attachée à la protection des milieux naturels et à l’amélioration de la qualité des eaux, ne cesse de croître. Les colorants synthétiques sont une source de pollution de l’eau. Parmi les colorants textiles, 15% sont azoïques. La production totale mondiale de colorants est estimée à 1000000 T/an [1]. Les rejets d’eau fortement chargés en colorants dans l’écosystème génère des problèmes de pollution esthétique, sachant qu’ils sont clairement apparents pour des concentrations inférieures à 1 mg/L et que leur concentration dans les eaux usées de textiles varie de 10 à 200 mg/L. Ils sont peu ou pas biodégradables [2]. En outre leur présence dans les systèmes aquatiques, même à faible concentration, réduit la pénétration de la lumière et a donc un effet néfaste sur la photosynthèse [3]. Par conséquent, la dépollution des eaux contaminées par ces substances chimiques, s’avère nécessaire aussi bien pour la protection de l’environnement que pour une éventuelle réutilisation de ces eaux non conventionnelles.
De ce fait, plusieurs procédés biologiques, physiques et chimiques sont utilisés pour le traitement des effluents industriels textiles dont la biodégradation [4], la filtration sur membranes [5] et l’oxydation. Cependant, beaucoup de ces technologies sont coûteuses, surtout lorsqu’elles sont appliquées pour les effluents à haut débit.
Dans une optique de traitement des eaux industrielles, l’adsorption s’est révélé une méthode très efficace pour la réduction de la couleur, en milieu aqueux. Ceci est dû à la facilité d’emploi de ce procédé et au faible coût comparé à d’autres applications dans le processus de dépollution particulièrement si l’adsorbant est à bas prix, et aisément disponible. A cet effet, la recherche des hôtes matrices solides qui peuvent piéger les polluants (molécules organiques, métaux lourds et pesticides…) s’avère nécessaire, voir indispensable, afin de minimiser l’impact nocif de ces derniers sur l’environnement.
2
Les charbons actifs, historiquement parlant sont massivement utilisés pour leurs propriétés sorptives très performantes aussi bien dans l’activité domestique que dans l’activité industrielle. Néanmoins ce matériau constitue une source potentielle d’émission de gaz à effet de serre. Ceci a conduit de nombreux laboratoires de différents horizons à s’intéresser à la recherche de nouveaux solides adsorbants à base de matériaux naturels plus respectueux de l’environnement tels que les argiles [6], la zéolithe [7], les grignons d’olive [8], le son de blé [9], la sciure de bois [10].
Dans le cadre de cette étude, nous nous sommes intéressés à l’élimination d’un colorant (le bleu de méthylène) par des billes à base de chitosane et des épluchures de pomme de terre. L’utilisation de ce matériau comme adsorbant pour l’élimination du BM, contribuera, à réduire l’impact environnemental causé par les quantités importantes des eaux rejetées par les diverses industries.
L’objectif principal de cette étude, est d’élaborer d’un nouveau adsorbant à base d’un biopolymère d’origine marine, le chitosane, et d’un déchet agricole, les épluchures de pommes de terre ;et d’optimiser les principaux paramètres expérimentaux du processus d’adsorption du bleu de méthylène. un colorant cationique choisi comme modèle de polluant organique par les billes composites ainsi élaborées (concentration de la solution de bleu de méthylène et des billes à base de chitosane/Epluchures des pommes de terre, vitesse d’agitation, la masse des billes et pH de la solution), de façon à définir le schéma de traitement le plus approprié. La réalisation de cette étude a nécessité l’utilisation de plusieurs techniques : La spectroscopie Infra rouge à Transformée de Fourrier (IRTF), la spectrophotométrie UV-visible et les analyses physicochimiques.
En conséquence, le présent manuscrit est composé de deux parties. Une partie théorique subdivisée en deux chapitres dont le premier est consacré à une description générale du chitosane et le deuxième chapitre décrit le phénomène d’adsorption. La partie expérimentale comporte le chapitre III qui présente les différents matériel et méthodes expérimentales utilisés pour la synthèse et la caractérisation du chitosane, l’élaboration et la caractérisation des billes composites chitosane /épluchures de pommes de terre ainsi que l’étude de l’adsorption du bleu de méthylène par les billes ainsi élaborées. Le chapitre IV est consacré à la présentation et la discussion des différents résultats expérimentaux obtenus. Enfin, ce manuscrit se terminera par une conclusion générale qui résumera les principaux résultats obtenus lors de ce travail.
3
« Biopolymères » est un terme couramment utilisé pour les polymères qui sont synthétisés par des organismes vivants. Les biopolymères proviennent de sources naturelles comme l’amidon, la cellulose et les alginates, sont biologiquement renouvelables, biodégradables et biocompatibles.
La chitine et son principal dérivé chitosane ont reçu une attention considérable, en tant que biopolymères, en raison de leurs nombreuses applications potentielles dans l’agriculture, l'industrie alimentaire, la médecine, la fabrication du papier, l'industrie textile et les traitements des eaux. Cet intérêt est dû à leurs nombreuses propriétés physico-chimiques et biologiques [11-13].
I.1. Historique
La découverte de la chitine a été faite par le professeur Français H. Braconnot, spécialisé en Histoire de la nature, date du 18ème siècle [14]. Une décennie plus tard, en 1823, la même substance a été trouvée dans certains insectes (coléoptère) et a été ensuite nommée chitine (provient du mot grec "kitos" qui signifie l'enveloppe). En 1859, le Pr. C. Rouget a soumis la chitine à un traitement alcalin et a observé les différentes solubilités de la chitine. La substance, résultat du traitement alcalin, a pu être dissoute dans les acides. Cependant, ce n’est qu’en 1894 que cette substance a été nommée chitosane par Hoppe-Seyler [15].
Entre 1930 et 1940, ces biopolymères (la chitine et le chitosane) ont trouvé beaucoup d'intérêt dans le monde oriental, principalement pour l'application dans le domaine médical et la purification de l'eau. A partir des années 1970, la chitine et le chitosane ont commencé à susciter un réel intérêt en raison notamment des grandes quantités de déchets que produisaient les conserveries de crustacés. Les gouvernements, notamment américain et japonais, ont alors cherché à valoriser ces déchets et ont lancé les premiers programmes de recherches. De nombreux brevets sur les procédés d’obtention, de modification et d’utilisation de la chitine et du chitosane [16-18]. Actuellement, ces biopolymères font l’objet de nombreuses recherches.
Actuellement, il est connu que la chitine et le chitosane (collectivement appelés les substances chitineuses), sont des sources renouvelables que l’on peut trouver en abondance dans la nature. Ce fait a attiré plus d’intérêt pour le développement durable. Du fait que la chitine et le chitosane sont deux biopolymères produits par certains animaux. Ils sont donc
4
biodégradables et biorésorbables. Ces deux propriétés sont primordiales à notre époque où la protection de l’environnement joue un rôle important.
I.2. Source de la chitine et du chitosane
La chitine est le polysaccharide le plus abondant après la cellulose [19]. Elle est présente principalement dans les coquilles de mollusques, dans les cuticules des insectes et dans les carapaces des crustacés. Associée à des protéines, la chitine contribue à la cohésion des différentes couches qui constituent la coquille des mollusques ou la carapace des arthropodes. Ce polymère se trouve également dans la paroi de la plupart des champignons et dans certaines algues chlorophycées, levures et bactéries. En plus de son rôle dans le maintien de la rigidité de la cellule, elle contribue au contrôle de la pression osmotique.
Chez les insectes la chitine constitue aux environs de 1,5 % du poids frais de l’animal. Chez les micro-organismes le rendement d’extraction peut atteindre plus de 20% du poids sec de la cellule. Les quantités les plus abondantes sont observables chez les crustacés où les carapaces contiennent en moyenne de 5 à 20% de chitine avec des teneurs supérieure à 30, voire 35% dans certaine partie du corps.
En outre, le chitosane est une substance peu répandue dans la nature. Il est présent dans la paroi cellulaire de certains micro-organismes fongiques (champignons zygomycètes) et dans le mycélium de Mucor rouxii, Rhizopus oryzae et Absidia coerulea, et n’est signalé que dans les exosquelettes de certains insectes (par exemple la paroi abdominale des reines de termites). Il n’y a donc pas de source primaire de chitosane exploitable, la production étant assurée par transformation des déchets issus de la pêche et source majeure du chitosane vendu commercialement provient, en effet, de la désacétylation de la chitine [20].
I.3. Structure du chitosane
Le chitosane est un polysaccharide de structure linéaire, dérivé désacétylé de la chitine. Il est composé d’unités monomériques de glucosamine et de N-acétyl- D-glucosamine liées en β (1→4) (figure I.1).
La chitine et le chitosane peuvent être représentés par une structure chimique unique (Figure I.1) qui correspond à des séries de copolymères liés par des liaisons β (1, 4) où l'un ou
5
unité glycosidique. Ces deux biopolymères se distinguent par le degré d’acétylation (DA). En général le terme chitosane est donné à tout copolymère dont le DA est inférieur à 50 % [21].
Figure I. 1 : Structure chimique du chitosane.
Figure I. 2 : Structure chimique de la chitine et du chitosane. R = H ou COCH3. I.4. Préparation du chitosane à partir de la chitine
Il se trouve plus rarement dans la nature : il n’est présent que dans la paroi d’une classe particulière de champignons et chez quelques insectes. La chitine est ainsi la source la plus intéressante du chitosane. Le chitosane commercialisé provient essentiellement de la désacétylation alcaline de la chitine.
I.4.1. Extraction de la chitine
Les déchets de l’industrie des crustacés sont une source très importante de chitine. De nombreuses méthodes ont été développées afin de préparer la chitine à partir des exosquelettes. De manière générale, ces méthodes consistent à éliminer les protéines (déprotéinisation), les éléments minéraux (déminéralisation), la couleur (blanchiment) [22].
Déminéralisation
La déminéralisation est généralement réalisée par un traitement acide sous agitation pour solubiliser le carbonate de calcium et le chlorure de calcium [23]. Les acides les plus fréquemment utilisés sont l'acide chlorhydrique et l'acide formique. La durée du traitement
6
acide est de l'ordre de 1 à 48 heures à la température ambiante [24].
Déprotéinisation
A l'état naturel, la chitine se présente en association avec les protéines (chitinoprotéine). Ces protéines sont éliminées par un traitement basique en utilisant, en général, des solutions à base de NaOH, Na2CO3, NaHCO3, KOH, K2CO3, Ca(OH)2 , Na2SO3, CaSO3, ou Na3PO4 . La solution d'hydroxyde de sodium est la plus souvent utilisée pour dissoudre les protéines [25].
Blanchiment
Et enfin un blanchiment (décoloration) par la présence d’un agent oxydant [26] (KMnO4, NaOCl, SO2, NaHSO3, Na2S2O4 ou H2O2). Ce traitement peut éliminer des traces de pigments résiduels, comme les caroténoïdes [23]. Entre ces différentes étapes, des opérations de lavage sont nécessaires [26].
I.4.2. Production de chitosane
L’étape la plus délicate reste la désacétylation qui nécessite de substituer suffisamment les groupements acétylé pour aboutir au chitosane, ce qui peut entrainer une réduction excessive de la longueur de chaine du polymère. En jouant sur la durée du traitement alcalin et sur l’élévation de la température, il est donc possible d’obtenir différents chitosane à partir d’une même chitine. Un degré d’acétylation (DA) inférieur à 10% est rarement atteint par un procédé simple [26]. Le rendement de désacétylation et la qualité du chitosane varient selon l’origine de la matière première utilisée (crevettes, crabes, calamars,…) et de la procédure d’extraction (la température, la durée, la concentration d'alcalin, les traitements préalables pour l'obtention de la chitine, l'atmosphère (air ou azote), la quantité de chitine par rapport à la solution alcaline, la densité de la chitine et la taille des particules). Des conditions trop drastiques conduisent à une dégradation physique du biopolymères (avec une chute importante de la masse moléculaire et/ou une oxydation des extrémités réductrices des chaînes macromoléculaires), alors que des conditions trop douces ne permettent pas une désacétylation suffisante. Ceci permet d’expliquer parfois la difficulté d’obtenir de manière reproductible des produits de composition prédéterminée.
7
La procédure générale pour l’obtention du chitosane à partir de la chitine est résumée dans la figure suivante.
Carapaces de crustacés et de mollusques
Etape 1 : Extraction de protéines
Etape 2 : Déminéralisation Etape 4 : Désacétylation Etape 3 : Décoloration CHITINE CHITOSANE Collecte et entreposage Broyage Rinçage Rinçage Séchage Rinçage Séchage Broyage NaOH HCl Oxydant NaOH
8 I.5.Propriétés du chitosane
I.5.1. Degré de Désacétylation (DD)
Le degré de désacétylation (DD) est l’une des propriétés les plus importantes du chitosane. Il influe, non seulement sur les caractéristiques chimiques et physiques, mais aussi sur la biodégradation et l’activité immunologique du chitosane [27].
Au cours des trente dernières années, beaucoup de méthodes ont été développées pour la détermination du DD, y compris la spectroscopie infrarouge [28], la spectroscopie U-V, la résonance magnétique nucléaire, la titration colloïdale et la titration potentiométrique [29]. Cependant, la méthode la plus simple reste la spectroscopie IR proposée par Khan et al. [30]. I.5.2. Cristallinité
Le Chitosane est une substance semi-cristalline. Il cristallise dans le système orthorhombique ; deux types de structures sont connus : le chitosane I (sous forme de sel) correspondant à un faible degré de désacétylation DD (60 %). Il est plus désordonné que le chitosane II (forme amine libre) qui possède un fort degré de désacétylation DD (90 %) [31-33].
I.5.3.Solubilité
Le chitosane est insoluble dans l’eau et dans les solutions alcalines concentrées ou diluées, par contre, soluble dans la plupart des solutions organiques acides [16, 31, 34, 35]. L’acide le plus couramment utilisé pour préparer une solution de chitosane est l’acide acétique dilué. En générale, le chitosane est parfaitement soluble à pH 3-4, les groupes aminés du chitosane sont protonés et le polymère chargé positivement devient soluble. En revanche il est relativement stable en milieu acide concentré, même s’il se dégrade après une longue exposition.
La solubilité du chitosane est un paramètre très difficile à contrôler [36] car la valeur de degré de désacétylation DD influence fortement sa solubilité. La distribution des groupes N- acétyle sur la chaîne polymérique peut contrôler aussi la solubilité des solutions données. I.5.4.Polyélectrolytes en milieu acide
9
acide, il se comporte comme un polycation, a forte densité de charge et dont l’état d’ionisation est décrit par l’équilibre suivant :
Figure I.4 : Etat d’ionisation du chitosane.
Le chitosane est une base faible de pKa compris entre de 6,3-6,7, En général, la valeur du pKa augmente quand le DD diminue [32, 37-39].
I.5.5. Viscosité
La viscosité du chitosane dépend du degré de désacétylation de ce polymère. Plus il est désacétylé, plus il y a de groupements amines libres, le chitosane est donc plus soluble et par voie de conséquence sa viscosité est plus importante [40]. La viscosité dépend également : de la concentration du polymère (elle augmente avec la concentration), de la température (elle chute lorsque la température augmente) [41], du poids moléculaire (la viscosité intrinsèque augmente en fonction de l’augmentation du poids moléculaire) [42] et enfin du pH (plus il est bas plus la viscosité est élevée). Ce paramètre est déterminé par viscosimètre.
I.5.6. Autres propriétés physico-chimiques
Le chitosane est un matériau versatile qui prend des formes physiques modifiables [17, 43]. C’est un matériau très stable en phase solide (sèche) et il a une conservation quasi-infinie en solution. Il possède un degré élevé de réactivité chimique dû à ses groupes amines primaires libres. Il possède ainsi des propriétés de rétention d’eau, de chélation d’ions, de complexation et d’adsorption de molécules ou des polymères.
Le chitosane est un agent de floculation dans le traitement des eaux polluées grâce à son association sélective avec les espèces anioniques, il peut aussi former des complexes polyanion- polycation menant à la préparation de membranes.
10 I.5.7. Propriétés biologiques
Le chitosane est biodégradable et biocompatible. Il ne présente aucun comportement antigénique, mais possède un caractère antithrombogénique et hémostatique. Il montre des propriétés cicatrisantes remarquables. Le chitosane a également des propriétés inhibitrices sur la croissance de nombreux parasites et infections. Il a de plus des propriétés immunologiques, antitumorales, antibactériennes et antifongiques.
I.6. Modification du chitosane
Le chitosane est un matériau qui peut être modifié de manière relativement facile par voie physique ou par voie chimique (greffage de groupements fonctionnels spécifiques). Ces modifications ont pour but d’augmenter les performances de fixation (augmenter les sites fonctionnels), d’améliorer la sélectivité (en apportant des groupements spécifiques qui conduisent éventuellement à changer le mécanisme de fixation), d’accélérer le mécanisme de transfert (en minimisant la résistance aux mécanisme de transfert), de stabiliser le matériau (en limitant la dégradation ou la solubilisation du polymère), ou encore d’étendre le champ d’application du bioadsorbant (en modifiant en particulier la plage de pH ).
I.6.1.Modifications physiques
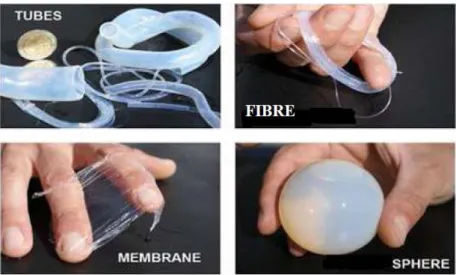
La solubilité du chitosane en milieu acide permet de décliner le chitosane sous différentes formes. Le principe des procédés de transformation physique comprend une phase initiale identique pour tous les conditionnements développés [16, 18] : le chitosane est d’abord mis en solution en milieu acide, souvent en milieu acide acétique. Il est ensuite extrudé dans un fluide (air, gaz, solution…) au travers d’une aiguille à débit relativement lent pour préparer des billes de gel ou au travers d’une filière à débit plus élevé pour préparer des fibres. Dans le cas de la préparation de membranes, la solution visqueuse de chitosane est étendue sur une surface lisse. L’étape de neutralisation est une étape commune à tous les conditionnements. Dans le cas des billes du chitosane, les dimensions obtenues vont généralement de quelques centaines de microns à quelques millimètres.
11
Figure I.5 : Différentes formes du chitosane. I.6.2.Modifications chimiques
La modification chimique du chitosane peut répondre à différents objectifs : 1) Renforcement de la stabilité du chitosane.
2) Augmentation des capacités de fixation 3) Amélioration de la sélectivité de fixation.
Le chitosane étant soluble dans la majorité des solutions acides, il est nécessaire de renforcer sa stabilité chimique. Ceci peut être réalisé par une réticulation du polymère. Ce procédé consiste à créer de nouvelles liaisons entre les chaînes du biopolymère pour diminuer sa sensibilité à l’hydrolyse des liaisons β (1, 4). Divers agents réticulants ont été expérimentés, tels que l’épichlorohydrine (EPI), l’éthylène di-glycidyl-éther, l’hexaméthylène diisocyanate ou les cyclodextrines, mais la majorité des travaux publiés sur la réticulation du chitosane utilisent le glutaraldéhyde (GLU) comme agent réticulant. Dans ce type de réaction l’aldéhyde réagit avec les groupements aminés portés par le chitosane pour former une liaison imine. La réaction de l’aldéhyde avec la fonction aminée réduit la réactivité de l’azote pour les mécanismes de complexation [44].
I.7. Principales applications du chitosane
Le tableau I.1 présente quelques applications du chitosane dans différents domaines d'exploitation.
12
Tableau I.1 : principales applications du chitosane [36].
Domaine d’exploitation Applications
Potentiel biomédical
Sutures chirurgicales Implants dentaires
Peaux artificielles Reconstructions osseuses Agriculture Mécanisme défensive
Stimule la croissance des plantes Enrobage (protection)
Libération de fertilisants et nutriments
Traitement des eaux
Polymère écologique
Pouvoir séquestrant (métaux lourds colorants etc.)
Diminution de la turbidité Diminution des odeurs
Bactéricides
Alimentaire Non digestible (diète aux fibres) Hypocholestérolémiant
Agent de conservation Stabilisateur Antimicrobien Enrobage protecteur (fruits)
Cosmétique Crèmes Traitement de l'acné Produits hydratants Formulation de dentifrices Formulation de shampoings Biopharmaceutique Lmmunostimulants Antitumoraux Anticoagulants Bactériostatiques
Libérations contrôlées (matrices)
13
I.8. Applications du chitosane dans le traitement des eaux
Des réductions de 70 à 98 % de la teneur en MES (matière en suspension, responsable de la turbidité) et de 55 à 80 % la demande chimique en oxygène (DCO) ont été observées pour le traitement des eaux usées en utilisant du chitosane comme floculant. Du fait de leur forte densité de charge, les dérivés de chitine sont capables d’interagir avec les MES, les microorganismes et les ions métalliques. Cette propriété est utilisée pour piéger les composés dangereux, pour les éliminer ou les doser.
Le chitosane est également employé pour recycler les effluents de l’industrie textile en retenant des pigments. Le chitosane peut être utilisé de plusieurs façons, la principale étant comme floculant. Les colloïdes en suspension, les métaux lourds, les colorants des eaux de teintureries ou encore les molécules aromatiques et phénoliques s’agglomèrent avec le chitosane et les flocs sont retenus par filtration. Les flocs de chitosane réduisent de 50 % les MES. Un autre mode d’action consiste à intégrer le chitosane directement dans la composition des membranes de filtration. Actuellement, les techniques d'adsorption utilisant le chitosane et ces dérivés, comme un traitement conventionnel développé pour adsorber les colorants anioniques en solution aqueuse. L'adsorption des ions métalliques par le chitosane a été intensivement étudiée parce que le chitosane exerce les propriétés bioadhesive pour former les nanoparticules stables avec différents métaux en solution [44].
Conclusion
La chitine et le chitosane sont des biopolymères d’une importance croissante pour l’industrie et qui ont des impacts significatifs sur la recherche et le développement dans des domaines aussi variés que la chimie, la biologie, la santé ou encore la protection de l’environnement. Leurs propriétés exceptionnelles l’engouement pour ces macromolécules naturelles, extraites de carapaces de crustacés, considérées il y a encore peu de temps comme des déchets. Il s’est avéré que ces coproduits d’origine marine, très bon marché, peuvent participer à l’élaboration de nombreux produits commerciaux à haute valeur ajoutée. De nombreux secteurs industriels sont concernés, allant des cosmétiques à l’industrie agroalimentaire, en passant par la pharmacie et l’ingénierie biomédicale. Les perspectives sont variées et nombreuses. Des travaux s’orientent actuellement vers les nouveaux conditionnements que sont les membranes. De nouveaux marchés prometteurs sont également susceptibles de s’ouvrir, comme par exemple dans le domaine des biotechnologies [19].
14
Le terme « adsorption » a été proposé pour la première fois par Kayser en 1881 pour différencier entre une condensation de gaz à la surface et une adsorption de gaz (processus dans lequel les molécules de gaz pénètrent dans la masse de l’adsorbant), un phénomène déjà constaté par Fontana et Scheele en 1777 [45]. Le terme large de sorption a été proposé en 1909 par MC. Bain [46], il désigne aussi bien le phénomène d’adsorption que celui de désorption.
II.1. Définition
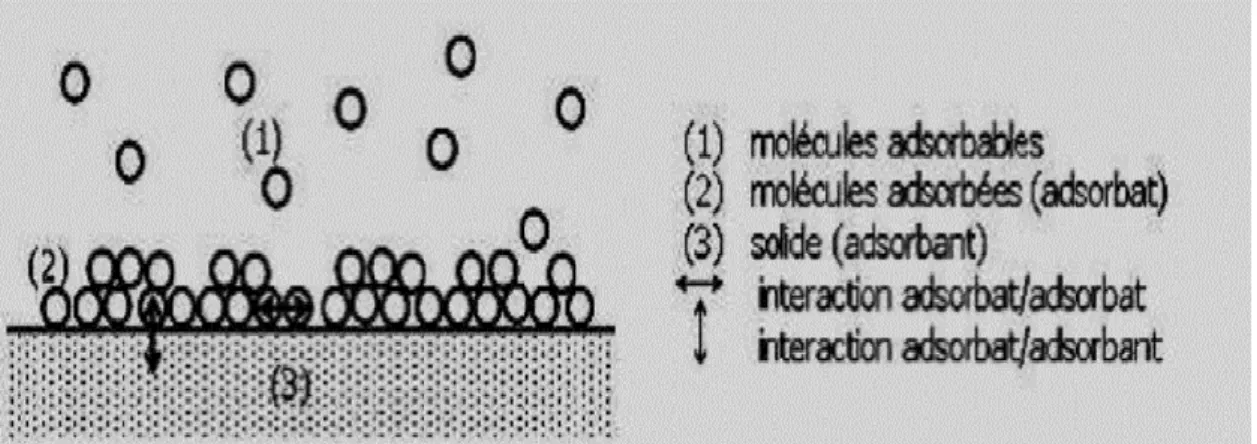
L’adsorption est le processus au cours duquel des molécules contenues dans un fluide (gaz ou liquide) appelées adsorbats, se fixent à la surface d’un solide appelé adsorbant. Les sites où se fixent les molécules d’adsorbat sont appelés sites actifs. L’adsorption est dite chimique ou physique selon la nature des interactions qui lient l’adsorbat à la surface de l’adsorbant [7].
II.2.Types d’adsorption
Suivant l’importance des énergies mises en jeu entre l'adsorbant et l'adsorbat, les forces responsables du phénomène d’adsorption peuvent être de nature physique ou chimique, conduisant ainsi à deux types d’adsorption : l’adsorption physique "physisorption" et l’adsorption chimique "chimisorption".
II.2.1. Adsorption chimique (ou chimisorption)
La chimisorption est un phénomène d’adsorption qui met en jeu une ou plusieurs liaisons chimiques covalentes ou ioniques entre l’adsorbat et l’adsorbant. La chimisorption est généralement irréversible, produisant une modification des molécules adsorbées. Ces dernières ne peuvent pas être accumulées sur plus d’une monocouche. Par ce type d’adsorption, les molécules sont directement liées au solide [47]. La chaleur d’adsorption, relativement élevée est comprise entre 20 et 200 Kcal/mol [48].
II.2.2. Adsorption physique (ou physisorption)
L’adsorption physique se produit à des températures basses. Les molécules s’adsorbent sur plusieurs couches (multicouches) avec des chaleurs d’adsorption souvent inférieures à 20 kcal/mol [47].
15
Les interactions entre les molécules du soluté (adsorbat) et la surface du solide (adsorbant) sont assurées par des forces électrostatiques type dipôles, liaison hydrogène ou Van der Waals (La liaison physique est plus faible) [49]. Elle est réversible et peu spécifique, L’adsorption physique est rapide et généralement limité par les phénomènes de diffusion [50].
Figure II. 1 : Schéma de l’adsorption physique [51].
Le tableau suivant présente les différences entre les deux types d’adsorption. Tableau II.1 : Principales différences entre l'adsorption physique et l'adsorption chimique.
Propriétés Adsorption physique Adsorption chimique
-Température du processus -Relativement basse -Plus élevé
-Chaleur d’adsorption -5Kcal/mol environ -10Kcal/mol environ
-Liaison -Physique : Vander W aals -Chimique
-Cinétique -Rapide, réversible -Lente irréversible
-Spécificité -Processus non spécifique -Processus très spécifique
-Désorption -Facile -Difficile
-Couche formée -Mono ou multicouches Uniquement monocouches
II.3.Facteurs influençant l’adsorption
Dans le cas de l’adsorption en phase liquide, le processus dépend de plusieurs facteurs :
16 II.3.1. Conditions opératoires
II.3.1.1.Température
L’adsorption physique s’effectue à des basses températures (phénomène exothermique), alors que l’adsorption chimique demande des températures plus élevées (phénomènes endothermique). Ce qui nécessite de fixer la température du processus dès le départ [52].
II.3.1.2. pH de la solution
Le pH est un facteur important dans toute étude d’adsorption du fait qu’il peut influencer à la fois la structure de l’adsorbant et de l’adsorbât ainsi que le mécanisme d’adsorption. Ce facteur dépend de l’origine des eaux à traiter et du procédé de leurs traitements (coagulation, floculation, oxydation…). Donc, il est judicieux de connaitre l’efficacité de l’adsorption à différents pH [53].
II.3.1.3.Concentration des substances à adsorber
L'équilibre d'adsorption qui s'établit entre la concentration dans la phase solide et la phase liquide dépend en premier lieu de la concentration initiale des substances adsorbables [54].
II.3.1.4. Temps de contact
La durée de contact entre l’adsorbât et l’adsorbant détermine le taux d’élément adsorbé. Ainsi, la longue durée de contact favorise la sorption et renforce la liaison entre l’adsorbat et la surface de l’adsorbant.
II.3.1.5. Présence d’espèces compétitives
En général, la présence de la compétition diminue la capacité de chaque espèce à s’adsorber sur l’adsorbant [53].
II.3.2. Nature de l’adsorbât
• Solubilité : La solubilité d’un adsorbât ou son affinité pour un solvant, joue un rôle important lors de son adsorption. Plus la solubilité est grande, plus les forces reliant le soluté au solvant sont fortes et plus faible sera l’adsorption.
17
• Polarité : Un soluté polaire aura plus d’affinité pour un solvant ou pour l’adsorbant polaire. Il faut que l’adsorbant et l’adsorbât soient de polarité voisine [55].
• Structure moléculaire de l’adsorbât : Plus la structure moléculaire des particules à fixer est grande, plus le remplissage des pores s’effectue rapidement et la saturation est atteinte avec des rendements faibles. Chose qui fait diminuer le nombre des sites libres pour les autres molécules [56].
II.4. Mécanisme d'adsorption
La cinétique d’adsorption présente un intérêt pratique considérable pour la mise en œuvre d’un adsorbant optimal dans un procédé d’adsorption. Elle permet de mettre en évidence les interactions physicochimiques entre le soluté et l’adsorbant, d’obtenir la vitesse initiale d’adsorption, le calcul du coefficient de transfert de matière et le coefficient de diffusion [57].
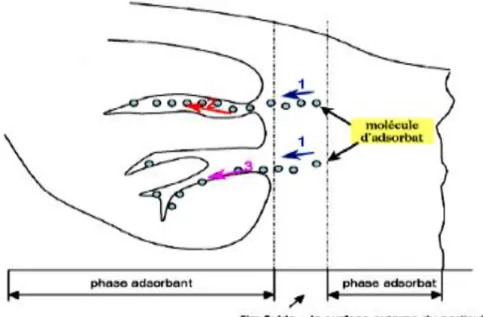
La figure II.2 représente un matériau (adsorbant) avec les différents domaines dans lesquels peuvent se trouver les molécules organiques ou inorganiques qui sont susceptibles de rentrer en interaction avec le solide.
Figure II.2 : Mécanisme de diffusion de l’adsorbat vers l’adsorbant. (1-diffusion externe ; 2-diffusion interne (dans les pores); 3-migration en surface).
18
Au cours de l’adsorption d’une espèce sur un solide, le transfert de matière a lieu de la phase fluide vers les sites actifs de l’adsorbant fait intervenir les étapes suivantes [58] :
1ére étape (Diffusion externe) : l’adsorbat diffuse à travers la couche limite située
autour des particules de l’adsorbant.
2ème étape diffusion interne (dans les pores) : c’est le transfert de la matière dans la
structure poreuse de la surface extérieure des graines vers les sites actifs.
3ème étape diffusion de surface : c’est la fixation de l’adsorbat sur les sites actifs de
l’adsorbant.
II.5. Modélisation des cinétiques d’adsorption
Plusieurs modèles de cinétique ont été utilisés afin d’interpréter les données expérimentales [59]. Les trois modèles cinétiques les plus couramment utilisés sont : le modèle de pseudo-premier-ordre (PPO), le modèle de pseudo-second-ordre (PSO), et la diffusion intra particule.
II.5.1. Modèle de pseudo-premier ordre :
Ce modèle suppose que la vitesse d’adsorption à l’instant t est proportionnelle à la différence entre la quantité adsorbée à l'équilibre, Qe, et la quantité Qt adsorbée à cet instant et que l'adsorption est réversible [60]. Autrement dit, l’adsorption est d'autant plus rapide que le système est loin de l'équilibre.
Lagergren (1898) a proposé un modèle cinétique de pseudo premier ordre exprimé par la relation suivante : La loi de vitesse s'écrit :
𝑑𝑄𝑡
𝑑𝑡 = 𝑘1(𝑄𝑒− 𝑄𝑡 ) Eq. II.1 k1 : est un paramètre de vitesse qui a la dimension de l'inverse du temps (t).
L'intégration de l'équation II.1 donne : log ( 𝑄𝑒− 𝑄𝑡) = log 𝑄𝑒−
𝑘1
19 II.5.2. Modèle de pseudo-second ordre
Une expression également très souvent utilisée est celle du pseudo-deuxième ordre. Ce modèle suggère l’existence d’une chimisorption, un échange d’électrons par exemple entre molécule d’adsorbat et l’adsorbant solide. Il est représenté par la formule suivante [61] : dQt
dt = k2(Qe− Qt )
2 Eq.II.3 L’intégration de l’équation IV.7 donne la forme linéaire suivante :
t Qt= 1 k2 Qe2+ 1 Qet Eq.II.4 Avec :
Qt (mg/g) : quantité adsorbée en adsorbât par gramme d’adsorbant à un temps t. Qe (mg/g) : quantité adsorbée de l’adsorbât par gramme d’adsorbant à l’équilibre. t (min) : temps de contact.
k2 (g/min.mg) : constante de vitesse.
II.5.3. Modèle de Diffusion intraparticulaire
La diffusion intraparticulaire est fréquemment l’étape limitante dans beaucoup de processus d’adsorption, particulièrement dans un réacteur agité fermé. La possibilité de la diffusion intraparticulaire peut être explorée en utilisant le modèle de diffusion intraparticulaire proposé par Weber et Morris (1963) [62].
Ce modèle est représenté par l'équation suivant :
Qt = kdt1/2+ L Eq.II.5
Avec :
kd : Constante de diffusion intra particule (mg/g.min0,5).
La constante kd est déduite de la pente de la partie linéaire de l’équation représentant ce m odèle.
20 II.6. Matériaux adsorbants
Les adsorbants sont des solides microporeux présentant des surfaces par unité de masse importantes (de 100 m2 /g et jusqu’à plus de 2000 m2 /g) afin de maximiser la capacité d’adsorption. Il existe de nombreuses variétés d’adsorbants. Le choix se fera en fonction de l’adsorbat et/ou du type d’opération désirée. Généralement, tous les matériaux sont des adsorbants mais seuls ceux possédant d’importantes capacités d’adsorption sont intéressants pour des applications industrielles. Cette capacité d’adsorption est en partie liée à la structure interne du matériau et les adsorbants intéressants possèdent un réseau poreux très développé et une grande surface spécifique. Dans l’industrie, les adsorbants les plus utilisés sont les charbons actifs, les zéolithes, les gels de silice et les alumines activées.
II.6.1. Charbon actif
Le charbon actif est historiquement parlant, le premier adsorbant utilisé. De par ses propriétés médicinales, il était déjà employé en Egypte antique. C’est un composé obtenu par calcination de bois, noix de coco, charbon, lignite, tourbe, et en général tout composé organique. Il est souvent caractérisé par une surface quasi non polaire, qui lui permet d’adsorber préférentiellement les composés organiques ou non polaires par rapport aux composés polaires tels que l’eau. Il peut ainsi être utilisé pour des opérations de séparation, purification de gaz sans déshumidification préalable contrairement à la plupart des autres adsorbants. L’énergie de liaison adsorbat/adsorbant est généralement plus faible pour le charbon actif que pour les autres adsorbants, ce qui diminue la quantité d’énergie nécessaire pour la phase de régénération.
II.6.2. Autres adsorbants
En plus des adsorbants naturels déjà mentionnés, de nouveaux adsorbants sont développés.
II.6.2.1. Zéolithes
Ce sont des silico-aluminates hydratés à l'état cristallin. Ces composés possèdent la propriété de perdre lentement leur eau de cristallisation par chauffage modéré, sans changer de structure cristalline. Ils deviennent spongieux et très adsorbants. Il existe des zéolithes artificielles, avec des pouvoirs adsorbants très importants. Ils possèdent la propriété de fixer les sels de métaux lourds qui se trouvent dans les eaux.
21 II.6.2.2. Adsorbants minéraux
Les alumines et oxydes métalliques divers ; bien que présentant, pour certains, des surfaces spécifiques importantes (300 à 400 m2 .g-1). Ces solides adsorbent plus sélectivement que les charbons. Leur capacité dépend étroitement du pH et de leur mésoporosité. En dessous du point isoélectrique, seules les molécules chargées négativement sont adsorbées sur les sites positifs. Dans l'état actuel de leur développement, ils ne peuvent être compétitifs vis-à-vis du charbon actif. Cependant, certains de ces solides, comme les alumines ou les oxy-hydroxydes ferriques, présentent un réel intérêt pour l'élimination du fluor, des phosphates des nitrates etc. II.6.2.3. Adsorbants organiques
Résines macromoléculaires à surfaces spécifiques comprises entre 300 et 750 m2 .g1 ; leurs capacités sont très médiocres par rapport à celles des charbons actifs. Cependant, ces résines ont une meilleure cinétique d'adsorption et sont souvent plus faciles à régénérer (énergie de liaison faible).
Conclusion
Il existe plusieurs méthodes physique, chimique et biologique pour traiter et décolorer des effluents pollué tel que la coagulation et la floculation, la biodégradation, la filtration membranaire, l’oxydation chimique, l’ozonation, échange d’ions, les méthodes électrochimiques et l’adsorption. La technique de l’adsorption est la méthode la plus favorable pour l’élimination des colorants ; elle est devenue une méthode analytique de choix, très efficace et simple dans son utilisation. Le principe du traitement par adsorption est de piéger les colorants par un matériau solide appelé adsorbant. Il existe, dans la littérature, plusieurs matériaux solides (argiles, zéolites, alumines activées, boue, biomasses, résidus agricoles, sous-produits industriels et charbon actif…) pouvant être utilisés dans des procédés de décoloration des eaux. Les recherches sont axées sur l’utilisation des adsorbants de faible coût, disponible localement, adsorbant biodégradable, fabriqué à partir des sources naturelles ou de déchets industriels ou agricoles comme la peau d’orange, les cendres volantes qui ont été utilisés pour éliminer des polluants organiques [63, 64]. Les polymères naturels (cellulose, carraghénane, amidon, cyclodextrine, alginate, chitosane) présentent de nombreux avantages par rapport au charbon actif comme leur faible coût, leur biocompatibilité et leur biodégradabilité ; ils ont un pouvoir coagulant/floculant et chélatant, et surtout ils peuvent être modifiés chimiquement afin d’acquérir de nouvelles propriétés [65]. Leurs propriétés d’adsorption ont été largement mises en évidence [63, 66-69].
22
Dans ce chapitre, nous décrivons tous le matériel et les méthodes utilisés pour réaliser les différentes parties expérimentales de ce travail à savoir l’extraction de la chitine à partir des carapaces de crevettes, sa transformation chimique par désacétylation en chitosane et la modification du chitosane ainsi synthétisé par réticulation pour élaborer un nouveau matériau (billes composites chitosane/épluchures de pomme de terre) pour une application environnementale.
III.1.Matériel
III.1.1. Produits chimiques
Tous les produits sont de la marque BIOCHEM CHEMOPHARMA. L’hydroxyde de sodium NaOH.
Une solution d’acide chlorhydrique HCl à 37%. Une solution de l’eau oxygénée H₂O₂ à 30%.
L’acide acétique CH3COOH à 99.8% en masse et de densité 1,05. Le colorant : bleu de méthylène.
L’épichlorohydrine
III.1.2. Verrerie de laboratoire
Fioles jaugées, agitateurs en verre, entonnoirs, béchers, pipettes, éprouvettes, flacons, erlenmeyers, entonnoir Büchner, capsules, boites de pétrie, burettes, tubes à essais.
Papier filtre, Papier aluminium, barreaux magnétiques, spatules et micropipette. III.1.3. Appareillage
Balance de précision de marque Nahita (séries 5033), Pmax =200g.
Agitateur à plaque chauffante, de marque (Stuart type heat-stir/CB162)
pH mètre, de marque inoLab instrument (type 7310).
Agitateur magnétique, de marque Nahita (code 691-31).
Agitateur magnétique à 8 postes de marque WiseStir MS-MP8.
Etuve de marque MEMMERT.
23
Spectrophotomètre Infra rouge à transformées de Fourier FT-IR de marque JASCO FT-IR-4200, ATR PRO450-S.
Pompe de filtration sous vide de marque Kif lab. (labo port) type N820.3AN.18 𝑃𝑚𝑎𝑥=100Kpa (1.03 bar).
Bain marie de marque MEMMERT.
Spectrophotomètre UV de marque SHAMIDZU de type 1280.
Pied à coulisse à lecture digitale.
Conductimètre de marque WTW type (1970I). III.2. Méthodes
Partie A : Synthèse et caractérisation du chitosane
Cette première partie expérimentale comporte deux sous-parties : l’extraction de la chitine à partir des carapaces de crevettes et sa conversion en chitosane par désacétylation. Le chitosane synthétisé sera caractérisé principalement par un dosage conductimétrique pour déterminer son degré de désacétylation et par la spectroscopie IRTF.
III.2.1.Synthèse et caractérisation du chitosane
III.2.1.1. Procédé d’extraction de la chitine à partir des carapaces de crevettes
Les carapaces de crevettes utilisées dans cette étude pour synthétiser le chitosane sont ramenées d’un restaurant situé à la cité 140 à Bouira (les crevettes sont pêchées de la mer méditerranéenne).
Prétraitement des carapaces
Une quantité des crevettes rouges ont été soigneusement décortiquées, lavées plusieurs fois avec l’eau de robinet afin d’éliminer toutes les impuretés possibles (sels, sables, coquilles, etc.), ensuite à l’eau distillée puis séchées sur des plateaux dans l’étuve à 40 ⁰C pendant 48h, et enfin broyées en fine poudre[70.71].
24
Figure III.1 : Prétraitement des carapaces de crevettes.
Chez les crustacés, la chitine est présente sous forme de mucopolysaccharides intimement associés au calcaire de la coquille, et liés par des liaisons covalentes aux protéines, aux caroténoïdes, aux lipides et aux pigments. Par conséquent, après le prétraitement, les carapaces de crevettes doivent subir une autre série de traitements qui se déroule en trois étapes essentielles : une déminéralisation, une déprotéinisation et une étape de blanchiment. Le protocole expérimental adopté dans cette étude pour l’extraction de la chitine est inspiré de l’étude de Kadouche S. et al. [70] et Michael Odote P et al. [71].
Déminéralisation
Les carapaces, une fois prétraitées (lavage, séchage et broyage), ont été soigneusement immergées dans une solution aqueuse d’acide chlorhydrique HCl 2N avec un rapport de masse du solide / volume du liquide 1 :10 (w/v) et l’ensemble a été soumis à une agitation modérée pendant 2 jours à température ambiante afin de dissoudre les minéraux qui accompagnent les carapaces. Le carbonate de calcium (CaCO3), principal composé minéral de la carapace, réagit avec HC1 pour former du chlorure de calcium, de l'eau et du gaz carbonique comme décrit dans la réaction suivante :
25
Après la déminéralisation, la solution a été filtrée et la matière obtenue a été lavée plusieurs fois à l’eau distillée jusqu’à la neutralité puis séchée à l’étuve pendant une nuit à une température de 50 °C.
Figure III.2 : Déminéralisation des carapaces de crevettes par HCl 2N.
Déprotéinisation
Dans cette, les carapaces déminéralisées ont été soumises à un traitement alcalin par la soude 1N à 80 °C dans un bain marie pendant 6 heures avec des proportions solide/liquide 1:20 (w/v). Une filtration sous vide suivie d’un lavage à l’eau distillée ont été nécessaires jusqu’à neutralité, afin d’éliminer toutes les protéines qui ont été séparées de la chitine. La matière récupérée a été étuvée pendant une nuit à 40°C.
26
Blanchiment
Le produit obtenu après déprotéinisation a été traités par le peroxyde de l’hydrogène H2O2 (0,315%) avec un rapport du solide au solvant 1:10 (w/v), sous agitation magnétique qui a été maintenue durant 4 heures. Après ces trois étapes, la chitine obtenue a été rincée plusieurs fois à l’eau distillée puis séchée.
Figure III.4 : Blanchiment des carapaces de crevette par l’eau oxygénée.
III.2.1.2. Synthèse du chitosane par la désacétylation de la chitine
C’est l’étape la plus délicate qui met en œuvre la substitution d’un nombre maximal et suffisant de groupements acétyles, pour aboutir au chitosane. La désacétylation a été effectuée par un traitement avec l'hydroxyde de sodium (NaOH) à 45% et à température ambiante, pendant 35 jours avec un rapport solide au solvant 1:50 (w/v) [71]. Le produit ainsi obtenu a été filtré et lavé à l’eau distillée jusqu’à stabilisation du pH des eaux de lavage, puis étuvé à 50 °C jusqu’à séchage.
27 III.2.1.3. Caractérisation du chitosane synthétisé
Test de solubilité
Pour tester la solubilité du chitosane synthétisé dans quelques solvants tels que l’eau distillée, l’acide acétique, l’acide chlorhydrique, la soude, l’éthanol et l’acétone ; 10 mg d’échantillon ont été introduits séparément et sous agitation magnétique pendant 24h dans un volume de 10 ml.
Caractérisation par le dosage conductimétrique basique
Le dosage conductimétrique a été effectué dans le but de déterminer le degré de désacétylation du chitosane synthétisé. Ce dosage se fait selon les étapes suivantes [72] :
- Solubilisation totale de 150 mg de chitosane dans 10 ml d’HCl 0,1N ;
- Après solubilisation, ajustement du volume de la solution à 200ml avec de l’eau distillée ;
- Titrage de la solution de chitosane, tout en l’agitant, avec une solution de NaOH de 0,1N ;
- Mesure de la conductivité de la solution après chaque ajout de NaOH.
Le degré de désacétylation (DDA) se calcule par la formule suivante :
𝐷𝐷𝐴 = 203 .(𝑉2−𝑉1).𝑁
𝑚+42.(𝑉2−𝑉1).𝑁 .100 Eq. III.2
Où :
N : représente la normalité de la solution de NaOH (N). V1 et V2 : sont les volumes équivalents de NaOH (L). m : est la masse du chitosane (g).
203 (g/mol) est la masse moléculaire du monomère acétylé.
42 g/mol est la différence entre la masse moléculaire du monomère acétylé et la masse moléculaire du monomère désacétylé.
28
Figure III.6 : Dosage conductimétrique de chitosane.
Caractérisation du chitosane synthétisé par la spectroscopie IRTF
La spectroscopie IRTF a été utilisée pour étudier la composition et la structure du chitosane synthétisé. Cette analyse a été effectuée à l’aide d’un spectrophotomètre de marque « JASCO FT/IR-4200, ATR PRO450-S » au niveau de la faculté des Sciences et des Sciences Appliquées de l’université de Bouira. La plage balayée est de 400 à 4000 cm-1.
Partie B : Elaboration et caractérisation des billes à base du chitosane synthétisé
Cette partie est dédiée à la description des différentes étapes expérimentales suivies pour élaborer un nouveau matériau aux propriétés améliorées à base du chitosane synthétisé, les billes composites chitosane/épluchures de pomme de terre. L’élaboration de ces billes a été faite par la technique d’extrusion en utilisant le chitosane synthétisé et la poudre des épluchures de pomme de terre comme matières premières. L’utilisation des épluchures de pomme de terre a pour objectif de minimiser le maximum la quantité du biopolymère utilisé (le chitosane) qui est jugé cher et de le remplacer par un déchet plus disponible et moins cher et d’élaborer par la suite un nouveau matériau aux propriétés améliorées tout en exploitant les propriétés gélifiantes du chitosane. Les billes ainsi élaborées seront ensuite réticulées chimiquement par un agent réticulant qui est l’épichlorohydrine afin d’améliorer davantage leurs propriétés notamment leur solubilité.
29
III.2.2. Modification du chitosane et élaboration des billes composites (chitosane/épluchures de pomme de terre)
III.2.2.1.Etapes d’élaboration des billes composites (chitosane/EPT)
a) Préparation de la poudre des épluchures de pomme de terre
Les épluchures de pomme de terre utilisées dans cette étude sont collectées à partir d’un magasin de Fast-food situé à la wilaya de Bouira. Ce déchet a été lavé plusieurs fois avec de l’eau de robinet jusqu’à l’élimination totale de la poussière et de la terre, puis lavé avec de l’eau distillée. Après lavage, les épluchures ont été séchées dans l’étuve à 40°C puis broyées et tamisées afin d’obtenir une fine poudre.
Figure III.7 : Préparation de la poudre des épulchures de pomme de terre. Epluchures de pomme de terre : (a) : à l’état brut, (b) : séchées, (c) : broyées.
b) Préparation de la solution (gel) du chitosane
Une quantité de 1 g du chitosane est dissoute dans 30 ml d’une solution d’acide acétique 2%. Le mélange est agité avec un agitateur magnétique jusqu’à dissolution complète du solide. La solution du chitosane ainsi préparée est laissée reposer jusqu’à élimination totale des bulles d’air formées lors de l’agitation. La solution du chitosane obtenue est translucide et visqueuse.
Figure III.8 : Gel du chitosane.