Publisher’s version / Version de l'éditeur:
Vous avez des questions? Nous pouvons vous aider. Pour communiquer directement avec un auteur, consultez la première page de la revue dans laquelle son article a été publié afin de trouver ses coordonnées. Si vous n’arrivez pas à les repérer, communiquez avec nous à PublicationsArchive-ArchivesPublications@nrc-cnrc.gc.ca.
Questions? Contact the NRC Publications Archive team at
PublicationsArchive-ArchivesPublications@nrc-cnrc.gc.ca. If you wish to email the authors directly, please see the first page of the publication for their contact information.
https://publications-cnrc.canada.ca/fra/droits
L’accès à ce site Web et l’utilisation de son contenu sont assujettis aux conditions présentées dans le site
LISEZ CES CONDITIONS ATTENTIVEMENT AVANT D’UTILISER CE SITE WEB.
Digeste de la construction au Canada, 1978-01
READ THESE TERMS AND CONDITIONS CAREFULLY BEFORE USING THIS WEBSITE. https://nrc-publications.canada.ca/eng/copyright
NRC Publications Archive Record / Notice des Archives des publications du CNRC :
https://nrc-publications.canada.ca/eng/view/object/?id=f35149ab-11a3-4bc1-a85a-fe48b6d2d6f0
https://publications-cnrc.canada.ca/fra/voir/objet/?id=f35149ab-11a3-4bc1-a85a-fe48b6d2d6f0
NRC Publications Archive
Archives des publications du CNRC
For the publisher’s version, please access the DOI link below./ Pour consulter la version de l’éditeur, utilisez le lien DOI ci-dessous.
https://doi.org/10.4224/40001103
Access and use of this website and the material on it are subject to the Terms and Conditions set forth at
Produits chimiques pour la fonte de la neige et de la glace autour des
bâtiments
Digeste de la Construction au Canada
Division des recherches en construction, Conseil national de
recherches Canada
CBD 191F
Produits chimiques pour la fonte de
la neige et de la glace autour des
bâtiments
Publié à l'origine en janvier 1978 G. P. Williams
Veuillez noter
Cette publication fait partie d'une série qui a cessé de paraître et qui est archivée en tant que référence historique. Pour savoir si l'information contenue est toujours applicable aux pratiques de construction actuelles, les lecteurs doivent prendre conseil auprès d'experts techniques et juridiques.
Malgré l'usage très répandu de produits chimiques pour faire fondre la neige et la glace sur les trottoirs et les chaussées, à l'entrée des magasins et dans les parcs de stationnement, il y a encore beaucoup de confusion quant à l'application correcte de ces produits. Le présent bulletin a pour objet d'exposer sommairement les principes généraux et la technique de contrôle par action chimique à l'intention des concierges d'immeubles, des ingénieurs d'entretien ou des paysagistes qui peuvent ne pas être au courant de l'information technique qui existe sur ce sujet.
Principes
Le sel et les autres produits chimiques utilisés font fondre la glace en abaissant le point de congélation de l'eau. Le montant de glace qui est fondue avec une quantité donnée de produit chimique décroît avec l'abaissement de la température du mélange. A une certaine température limite, dite eutectique, il ne peut plus se former de solution de sel et la fonte cesse.
La quantité de produit chimique nécessaire pour abaisser le point de congélation à la température eutectique s'appelle concentration eutectique. A cette température, la fonte est très lente. Si on ajoute trop de sel (c'est-à-dire, si la concentration est supérieure à la concentration eutectique), les cristaux de sel sont précipités sans abaisser davantage le point de congélation. Ainsi, l'usage de trop de sel constitue un gaspillage car il diminue l'efficacité de la fonte de la glace par action chimique.
La chaleur nécessaire pour fondre la glace provient de l'air et de la chaussée, sous la couverture de glace ou de neige. Lorsqu'un produit chimique est d'abord ajouté à la glace,
l'élimination de la chaleur nécessaire pour la fonte de la glace abaisse la température du mélange de glace et d'eau jusqu'à ce qu'elle soit égale à celle de la concentration de solution saline. Toutefois, à mesure que la glace fond, la concentration de sel diminue et la température d'équilibre augmente (c'est-à-dire que le point de congélation est supérieur). Il s'ensuit donc que la fonte de la glace par l'addition de produits chimiques entraîne un abaissement initial de la température, suivi de l'accroissement graduel de la température au fur et à mesure que la glace fond.
L'action des produits chimiques est compliquée par le fait que certaines solutions salines produisent de la chaleur au cours de la dissolution tandis que d'autres nécessitent de la chaleur aux fins de la dissolution. Cette chaleur de dissolution peut modifier sensiblement la vitesse de fonte ou l'efficacité du produit chimique. Le processus est encore compliqué par l'accroissement ou l'abaissement de la température de l'air au moment de l'application du produit. Bref, les implications pratiques du processus fondamental de fonte de la glace par action chimique sont les suivantes:
1. Les produits chimiques ne sont efficaces que jusqu'à certaines limites inférieures de température précises qui peuvent varier d'un produit à l'autre.
2. Plus la température de l'air est élevée, plus l'action de fonte est efficace.
3. Pour un maximum d'efficacité, une solution bien déterminée (eutectique) est nécessaire; les concentrations supérieures gaspillent le sel.
4. La température de l'air et de la chaussée et le type de sel utilisé influent sur la vitesse de fonte. Le choix de produit chimique ne dépend pas seulement de l'efficacité des produits à une température donnée mais également de facteurs tels que le coût, le matériel de répandage disponible, le stockage et la possibilité de dommages (effet corrosif). Il a été constaté que le chlorure de sodium et le chlorure de calcium sont les composés chimiques les plus satisfaisants, étant donné surtout qu'ils sont disponibles en grandes quantités à un coût relativement faible. Leur plus grand désavantage réside dans leur effet corrosif et les dommages qu'ils peuvent causer; toutefois, s'ils sont utilisés correctement les problèmes peuvent être réduits au minimum. Ces produits chimiques, qui sont couramment utilisés, font l'objet du présent bulletin.
Comparaison du chlorure de sodium et du chlorure de calcium
Le chlorure de sodium (NaCl) peut être fourni sous forme de sel gemme grossier ou sous forme de sel fin évaporé. Le sel fin a tendance à agir plus vite mais il a également tendance à s'agglutiner plus facilement que le sel gemme. Le chlorure de calcium (CaCl2) peut être fourni
sous forme de boulettes ou de flocons. Les boulettes sont plus concentrées et ont tendance à faire fondre la glace plus rapidement que les flocons. Ces deux produits chimiques peuvent être utilisés en solution mais, en règle générale, cette technique ne s'est pas avérée économique ni avantageuse.
Les principales différences entre ces deux sels résident dans leur température d'efficacité et leur chaleur de dissolution. En pratique, le NaCl n'est efficace qu'à des températures supérieures à 15°F (-10°C) environ, et il devient de plus en plus efficace en s'approchant du point de fonte. Le CaCl2, par contre est efficace à de très faibles températures (-20°F, -29°C)
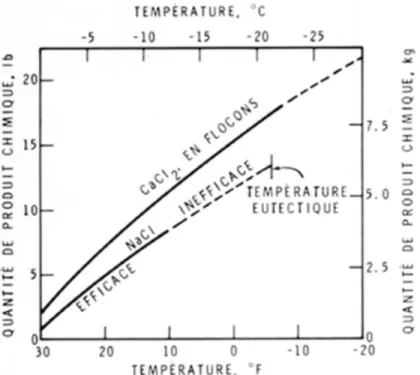
et a tendance à agir plus rapidement que le NaCl étant donné qu'il dégage de la chaleur lorsqu'il est en solution; le NaCl, au contraire, nécessite de la chaleur. Toutefois, le chlorure de calcium est hygroscopique, c'est-à dire qu'il absorbe l'humidité de l'air. De ce fait, une fois que la chaussée est mise à nu, il continue d'absorber l'humidité de l'air, laissant la surface humide et glissante. Par contre, le chlorure de sodium laisse une chaussée sèche et recouverte de sel. La figure 1 illustre la quantité théorique de chlorure de sodium et de calcium nécessaire pour faire fondre une verge carrée de glace d'une épaisseur de un pouce (environ un mètre carré de glace d'une épaisseur de 2 cm). A des températures approchant le point de congélation (32°F, 0°C), les deux produits chimiques peuvent fondre plusieurs fois leur poids en glace. Bien qu'il faille plus de CaCl2que de NaCl à des températures approchant le point de congélation, le CaCl2
peut faire fondre la glace efficacement à des températures beaucoup plus basses. Les quantités nécessaires pour la fonte totale de la neige et de la glace sont excessivement grandes lorsque les températures se situent bien au-dessous du point de congélation de l'eau.
Figure 1. Quantité de produit chimique nécessaire pour faire fondre 1 verge carrée de glace d'une épaisseur de 1 pouce (1 m², 2 cm). [Quantité de glace 42.5 lb (19.2 kg)]
Mélanges de NaCl et de CaCl2
Le chlorure de sodium et le chlorure de calcium sont parfois utilisés ensemble pour combiner les avantages des deux produits. Le chlorure de calcium assure une fusion plus efficace par temps très froid; le chlorure de sodium coûte moins cher et réduit la quantité de produit nécessaire à des températures plus élevées. Les mélanges nécessitent une certaine préparation. Ils doivent être bien mélangés et séchés au moment du malaxage afin de prévenir toute agglutination et tout problème en cours de stockage. Certains organismes d'entretien recommandent un mélange composé d'une partie de chlorure de calcium pour trois parties de chlorure de sodium. Pour accélérer la fonte à des températures plus basses, on peut augmenter la quantité de chlorure de calcium et produire un mélange de 1 pour 2 ou de 1 pour 1.
CaCl2et NaCl avec abrasifs
Les abrasifs sont parfois utilisés seuls pour améliorer la traction, surtout à des températures très basses auxquelles les produits chimiques ne sont pas très efficaces. La taille maximale des particules d'abrasifs est d'environ 0.5 po (12.0 mm) et la taille minimale de 0.1 po (2.5 mm), On peut améliorer l'efficacité de l'abrasif en ajoutant du CaCl2 ou du NaCl car ces produits ont
tendance à s'imprégner dans la surface en fondant, ce qui empêche les particules d'être emportés par le vent ou la circulation. Le mélange de produits chimiques et d'abrasifs a également l'avantage de prévenir le gel des particules en mottes en cours de stockage à l'extérieur sous un abri quelconque. Les mélanges coûtent moins cher qu'un produit chimique tout seul et sont plus faciles à répandre car ils sont plus visibles. Malheureusement, l'usage d'abrasifs entraîne beaucoup plus de problèmes lors du nettoyage au printemps.
Le mélange des abrasifs avec les produits chimiques doit être effectué avec soin, surtout lorsqu'il s'agit de quantités assez importantes. Environ 100 lb (45 kg) de chlorure de sodium ou 50 lb (22.5 kg) de chlorure de calcium doivent être ajoutés pour chaque verge Cube (environ 0.75 m³) de sable ou de gravier. On peut ajouter plus de produit chimique au moment de l'épandage pour accroître l'efficacité du mélange.
Application de NaCl ou de CaCl2ou des deux
Il est très difficile d'établir des règles précises sur l'application de ces produits étant donné que beaucoup de facteurs influent sur le processus de fonte; toutefois, quelques lignes directrices peuvent s'avérer utiles:
1. Il faut des quantités assez importantes de produit chimique pour faire fondre complètement les couches épaisses de neige ou de glace (figure 1). L'usage d'un produit chimique n'est pratique qu'à des températures approchant le point de fonte.
2. Il faut des quantités relativement petites de produit chimique pour faire fondre des couches minces de neige ou de glace ou pour améliorer la traction en surface. Il existe une gamme assez large de quantités recommandées, allant de 1/10 lb/verge2(50 gm/m²) pour les couches minces
de glace, jusqu'à 1/2 lb/verge2 (250 gm/m²) pour les couches épaisses de glace et pour les
croûtes de neige.
3. En général, il est préférable d'utiliser trop peu de sel plutôt que d'en utiliser trop. Des quantités moins grandes de sel ne font pas fondre la glace complètement mais elles affaiblissent son adhérence à la chaussée, la rendant plus facile à briser en morceaux. La glace brisée et partiellement fondue s'enlève facilement par grattage et pelletage.
4. Des quantités plus importantes de produits de déglaçage sont nécessaires pour les sections de chaussées qui se trouvent à l'ombre étant donné que la température de ces sections est habituellement plus basse que celle des sections exposées au soleil.
5. Le temps est le facteur le plus important contribuant au succès du produit de déglaçage. Le produit doit être appliqué avant ou au début de la formation de la glace ou d'une nouvelle chute de neige pour prévenir l'adhérence des couches de glace à la surface de la chaussée ou pour faciliter l'enlèvement mécanique de la glace. Le produit doit être appliqué à raison de 1/10 lb/verge2(50 gm/m²) ou moins.
6. Les produits chimiques ne facilitent pas nécessairement le déblaiement de la neige et de la glace sur les sections de chaussée sujettes au balayage de la neige. Étant donné la surface humide qui en résulte, la neige fondue peut coller à la surface et accélérer l'accumulation de neige. Une surface non traitée peut être maintenue exempte de neige par l'action du vent.
7. L'usage de CaCl, à des températures inférieures à 0°F .(-18°C) environ n'est pas toujours avantageux car la surface a tendance à rester humide et glissante. Une légère application d'abrasif ou d'un produit chimique mélangé avec un abrasif peut s'avérer plus satisfaisante.
8. L'usage à grande échelle des produits de déglaçage exige une bonne planification, y compris en termes de précautions à prendre au cours du stockage et de matériel particulier à utiliser pour le répandage. Il est très important de bien former le personnel d'entretien afin d'assurer une application correcte en termes de vitesse et de temps.
9. Les produits de déglaçage doivent être stockés dans des conteneurs étanches placés dans un endroit sec. Les produits stockés en vrac à l'extérieur doivent être placés dans des trémies spéciales ou protégés par des bâches.
Effets nuisibles du NaCl et du CaCl2
On peut réduire les effets secondaires nuisibles des produits chimiques en restreignant leur usage au minimum et en prenant certaines précautions, dont les suivantes:
Détérioration du béton
La majorité des autorités admettent que le chlorure de sodium et le chlorure de calcium peuvent entraîner la détérioration du béton. Si les bonnes techniques de bétonnage sont appliquées, les dommages peuvent être réduits au minimum. Ces techniques comprennent l'usage de béton à air occlus et le colmatage de toutes les fissures. Il faut assurer une bonne évacuation en surface et enlever la neige et les débris des caniveaux au cours de l'hiver. Les produits chimiques ne doivent pas être utilisés sur les surfaces en béton réalisées depuis moins de trois mois.
La plupart du temps, la végétation est endommagée lorsque les produits chimiques sont employés en grandes quantités et que les véhicules projettent la saumure sur les bords de la route ou lorsque les eaux de fonte s'écoulent sur les pelouses. Les dommages peuvent être réduits en limitant la quantité de produit dans les endroits où il y a des risques pour la végétation, en plantant des essences résistant au sel (pâturin du Kentucky n° 31, peupliers, trembles, ormes, chênes) et en évitant de repousser sur les pelouses la neige contaminée par un produit chimique. Les haies de cèdre ou d'autres essences sensibles au sel doivent être plantées aussi loin que possible des routes et ne doivent pas être plantées dans des endroits où les eaux de ruissellement contaminées peuvent s'accumuler. Les nouvelles pelouses doivent être ensemencées au printemps lorsqu'elles risquent de subir des dommages afin qu'elles puissent se développer suffisamment.
Les sources d'eau potable peuvent être contaminées par les produits de déglaçage lorsque des quantités excessives de sel sont utilisées ou que le sel a été stocké selon une mauvaise technique.
Corrosion des métaux
L'application de bonnes techniques d'entretien peut réduire la corrosion causée par les éclaboussures clé solutions salines sur les parties métalliques des bâtiments, clôtures ou garde-corps. Parmi ces techniques il y a le rinçage du métal exposé et l'application d'une couche protectrice de peinture ou d'émail. Il faut prendre des précautions particulières lorsqu'il s'agit de stocker des produits de déglaçage à proximité d'objets métalliques, surtout à l'intérieur de bâtiments, étant donné que le processus de corrosion est accéléré à des températures élevées. Bitume
On n'a constaté aucun effet significatif attribuable aux produits de déglaçage mêmes sur les revêtements bitumineux. Il est à noter toutefois que l'enlèvement de la neige et de la glace sur les chaussées, quel que ce soit le moyen y compris l'usage de produits chimiques, entraîne des contraintes thermiques plus grandes, une pénétration plus profonde du gel et une plus grande susceptibilité aux dommages. Il est de bonne pratique de colmater les fissures dans les revêtements bitumineux pour empêcher l'humidité de pénétrer dans la sous-couche. Il n'est pas conseillé d'utiliser des produits chimiques pour faire fondre la neige sur les toits bitumineux, surtout lorsque les solins et les débords de toit sont en métal.
Autres dommages
Les produits traînés dans les bâtiments laissent des taches sur certains matériaux de revêtement des planchers et certains tissus. Le cuir peut également être endommagé. Pour réduire les dommages au minimum, la quantité de produit utilisé dans les endroits très fréquentés doit être limitée. Nettoyer et laver souvent les matériaux salis pour enlever le sel et prévenir tout dommage permanent.
Produits chimiques non corrosifs
Des produits chimiques non corrosifs peuvent être utilisés lorsqu'aucun effet corrosif ne il peut être toléré. Ils sont toutefois beaucoup plus coûteux que le chlorure de calcium et le chlorure de sodium et sont habituellement moins efficaces que les agents de déglaçage. L'urée (NH2CO.NH2) est un tel produit qui est relativement efficace-et qui, en plus, peut être utilisé
comme engrais. Cependant, elle n'est pas efficace à des températures inférieures à 20-25°F environ (température eutectique = 12°F) et son prix est supérieur à celui des sels. Par contre, il faut utiliser beaucoup plus de sel pour obtenir le même résultat.
Références
1. Schneider, T.R. Snowdrifts and Winter Ice on Roads, Conseil national de recherches Canada, TT 1038, 1962.
2. Manuel de déneigement dans les régions urbaines. Conseil national de recherches Canada, Comité associé sur la recherche géotechnique, Sous-comité de la neige et de la glace, TM 93, novembre 1967.
3. National Cooperative Highway Research Program. Effects of De-icing Salts on Plant Biota and Soil. National Research Council, Washington, D.C., Transportation Research Board, Report 170, 88 p. 1976.